Enzymwirkungsweise
Werbung

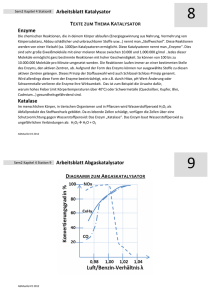
Enzymwirkungsweise Theoretische Wichtigkeit der Enzyme Berühmte Enzymforscher - sie beschleunigen die biologisch-wichtigen Reaktionen Praktische Wichtigkeit ihrer Forschung - ihr Defekt oder Fehlen verursacht Krankheiten ihr Hyperaktivität löst Krankheiten aus ihre Aktivitätsbestimmung hilft in der Diagnose Ihr Zusammenspiel mit Medikamenten hilft in der Therapie ihre industrielle Rolle (Landwirtschaft, Lebensmittelverarbeitung) Anfänge der Enzymforschung Bucnher (1987): Die Gärung von Zucker kann nicht nur von lebenden Hefezellen beschleunigt werden, wie früher die Vitalisten behaupteten, sondern auch von einer aus ihnen isolierten Substanz. Sumner (1926): Alle Enzyme sind Proteine Haldane (193?): Die Essenz der enzymatischen Katalyse ist eine gewisse Verzerrung des Substrats durch schwache Bindungswechselwirkungen zwischen dem Enzym und seinem Substrat. Bezeichnungen bezüglich der Enzyme Cofaktor: zur Aktivierung eines Enzyms benötigter chemischer Stoff Coenzym: ein organischer oder metallorganischer Cofaktor Prosthetische Gruppe: an ein Enzym fest gebundener Cofaktor Holoenzym: ein Enzym mit seinen gebundenen Cofaktoren Apoenzym: ein Enzym ohne Cofaktoren Einige Coenzyme können von Lebewesen nicht synthetisiert werden; daher müssen sie mit der Nahrung aufgenommen werden. Solche Coenzyme heissen Vitamine. Benennung und Klassifizierung der Enzyme ATP + D-Glucose ↔ ADP + D-Glucose-6-phosphat Klassifizierungsnummer: 2711 erste Ziffer (2) ~ Enzymklasse (Transferase) zweite Ziffer (7) ~ Subklasse (Phosphotransferase) dritte Ziffer(1) ~ Akzeptorgruppe (Hydroxylgruppe) vierte Ziffer (1) ~ Akzeptor-Molekül (D-Glucose) Enzyme beschleunigen die chemischen Reaktionen durch Erniedrigung ihrer freien Aktivierungsenthalpie Aktivierungs Energetische Verhältnisse der unkatalysierten Reaktionen (Energiebarriere) ⇓ S↔P unkatalysierte monomolekulare Reaktion E + S ↔ ES ↔ EP ↔ E + P E ~ Enzym (Isomerase) S ~ Substrat (Glucose-6-phosphat) P ~ Produkt (Fructose-6-phosphat) V = k[S] k = KTh-1e-∆G/RT ∆G ~ freie Aktivierungsenhalpie k~ Geschwindigkeit-Konstante [S] ~ Konzentration des Substrats K, h, R ~ unterschiedliche Konstanten T~ absolute Temperatur Enzyme haben keine Wirkung auf die Richtung und Gleichgewicht der Reaktion. Wie erniedrigen Enzyme die freie Aktivierungsenthalpie chemischer Reaktionen (Komplementarität) aktives Zentrum Die nicht-kovalenten Wechselwirkungen zwischen der - von der Substrat-Bindung veränderten - Struktur des aktiven Zentrums und der – von der veränderten aktiven Zentrum deformierten - Struktur des Substrats lockern diejenige kovalente Bindung des Substrats auf, und dadurch erniedrigen die Enthalpie derjenigen Bindung, die in der nächsten Fase der enzymatischen Reaktion gespaltet werden soll. Das ist der strukturelle Grund für die Erniedrigung der zur Spaltung dieser kovalenten Bindung benötigten freien Aktivierungsenthalpie. ⇐ Coenzyme, die hier eine gelbe Farbe haben, tragen zur Maximierung der Komplementarität des Enzyms zu seinem Substrat bei. Säure-Base-Katalyse bimolekularer enzymatischer Reaktionen Alkohol-Molekül ⇒ Häufige Protonendonator Protonenakzeptor Paare ⇓ Ester-Molekül ⇒ Amid-Molekül ⇒ ⇐ Carbonsäureanhydrid-Molekül Kovalente Katalyse bimolekularer enzymatischer Reaktionen Hydrolyse von Peptidbindungen: R2-NH-CO-R1 + H2O ↔ R2-NH2 + R1-COOH nukleophile Reaktion ⇒ + OH+ R1--COOH Die Wirkung der Entropie auf die Energieverhältnisse und die Geschwindigkeit enzymatischer Reaktionen Ester Carbonsäureanhydrid Carbonsäure Ester Carbonsäureanhydrid Carbonsäure Ester Carbonsäure Carbonsäureanhydrid