Sauerstofftransport im Blut (Hamid Sebbaq + Hamdi Ramzi)
Werbung

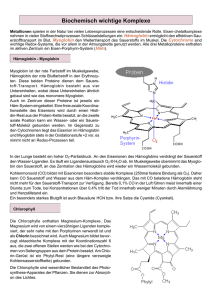
Sauerstofftransport p im Blut Von Hamid Sebbaq q und Hamdi Ramzi Gliederung des Vortrags • • • • • • • • G hi h li h Geschichtliches Das Blut: Funktionen Das Blut: Bestandteile Der Sauerstofftransporter Die Chemie des Hämoglobins Myoglobin Blutgifte Quellen Geschichtliches • 1928 beschrieb William Harvey den Blutkreislauf und legt g damit den Grundstein der modernen Physiologie • 1958 Jan Swammerdam endeckt unter dem gerade entwickelten Mikroskop die roten Blutzellen • 1901 90 Endeckung dec u g der de Blutgruppen u g uppe A,, B,, O durch Karl Landsteiner, 1902 noch AB Das Blut: Funktionen • • • • • • • • • Funktionen S SauerstoffSauerstoff ff- und d CO2-Transport T Nährstoff-- und Wasserversorgung Nährstoff Entsorgung von Stoffwechselprodukten Transport von Wirkstoffen, z.B. Hormonen Pufferung Abwehr Blutstillung und -gerinnung Wärmeregulation Das Blut: Bestandteile • Blutplasma, bzw. Blutflüssigkeit (ca. Blutplasma, 55%) davon d 10% ffeste S Stoffe ff Bluteiweiße (Albumine, Globuline, Fibrogen ) + Proteine restliche 90% Wasser • Weitere feste Bestandteile: Rote Blutkörperchen ( Erythrozyten Erythrozyten), ), weiße Blutkörperchen Bl kö h (L ((Leukozyten L k Leukozyten), ) ), Blutblättchen (Thrombozyten (Thrombozyten)) und der Blutfarbstoff Hämoglobin • Hormone und gelöste Gase • Sowie: Nährstoffe (Zucker, Lipide, Vitamine) • Hämoglobin leicht zerfallende Verbindung mit Sauerstoff Oxyhämoglobin Sauerstofftransport Der Sauerstofftransporter • Die Erythrozyten: y y Die roten Blutkörperchen sind die häufigsten Zellen im Blut von Wirbeltieren • Zellen ohne Zellkern • Lebensdauer etwa 120 Tage • Beinhalten Trägerstoff g für Sauerstoff und Kohlendioxid: das Hämoglobin Die Chemie des Hämoglobins 1 1. Häm-gruppe ist ein ChelatHämChelat2+ komplex des Fe 2 2. Das Ligand ist vier zahnig 3. Das Eisenatom im Hämoglobin ist oktaedrisch koordiniert. bzw. low– low–spin konfiguriert 4. Der fünfte Ligand ist das Proteinmolekül 5. In der sechsten Position kann ein Sauerstoffmolekül gebunden sein (Oxyhämoglobin) Chemie des Hämoglobin - Durch Diffusion (gezwungen durch hoche O2-Partialdruck in der Lunge) g ) gelangt der Sauerstoff ins Blut - Der D aufgenommene f S Sauerstoff ff diffundiert sofort in die roten Blutkörperchen (Erythrozyten) und lagert sich an das Eisen des roten Blutfarbstoffs (Hämoglobin) an : Hämoglobin + Sauerstoff = Oxyhämoglobin Kohlendioxid Abtransport • Ca. 80% des Kohlendioxids wird nach seiner Aufnahme ins Blut nach einer chemischen Umwandlungsreaktion: in Form von Bikarbonat ((HCO3) transportiert: p (CO2 + H2O ó HCO3- + H+) • Ein Teil des gebildeten Bikarbonats befindet sich im Plasma und 10% sind physikalisch gelöst • In der Lunge unter Aufnahme von Protonen in CO2 ungew. und abgeatmet: (HCO3- + H+ ó H2CO3 ó CO2 +H2O) • Ca. 20 % des Kohlendioxids (Hämoglobin gebunden ) Myoglobin • R Roter t Farbstoff F b t ff in i der d Skelettmuskulatur: Myoglobin ist ein einkettiges Hämoprotein p mit Sauerstoffspeicherfunktion • Im Vergleich zum Hämoglobin hat Myoglobin eine höhere Sauerstoffbindungsaffinität • Besonders reich an Myoglobin ist der Herzmuskel von tauchenden Seesäugern wie W l D Wale, Delphine l hi und dR Robben bb (Pinnipedia) Blutgifte • K Kohlenmonoxid hl id und dC Cyanidionen idi sind i d starke k Liganden • Hämoglobin reagiert mit CO und CN• Stabilere Komplexe als Oxyhämoglobin (200 - 300 mal) • Bindungsstellen für Sauerstoff werden blockiert • Aus diesem Grund wirken beide toxisch Quellen www.wissenschaft-online.de/sixcms/media.php/3 h //chem.ch.huji.ac.il http: h h h ji il Wikipedia Wiki di http://www.latein.at/med/Atmungssystemh // l i / d/A Skriptum.pdf Chemie Charles Mortimer