9 Atomaufbau und Periodensystem
Werbung

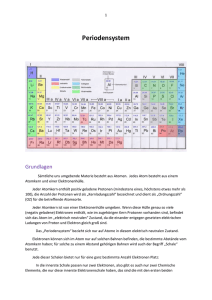
5. Atomaufbau und Periodensystem der Elemente 5.1 Historie: 1869 Meyer&Mendeleev: Konstruktion des Periodensystems aus der Periodizität chemischer und physikalischer Eigenschaften Wertigkeit der Ionen formale Wertigkeit von Atomen in Verbindungen Reaktives Verhalten Atomvolumen Ionisierungsenergien Anordnung der Elektronen in Schalen Besondere Stabilität der Edelgase Sehr niedrige Ionisierungsenergien der Alkalimetalle 5. Atomaufbau und Periodensystem der Elemente Ionisierungsenergien: • Besondere Stabilität der Edelgase • sehr niedrige 1. Ionisierungsenergien der Alkalimetalle • 2 Ionisierungsenergie: maximal für Alkalimetalle minimal für Erdalkalimetalle • Alkalimetalle – einwertig; Erdalkalimetalle - zweiwertig Aufbau neuer Schalen mit Alkalimetallen Ab 1920: Erklärung des Atomaufbaus und des Periodensystems aus der Quantenmechanik Spektren Aufbau von Mehrelektronen-Atomen Optische Spektren locker gebundene Elektronen (Valenzelektronen) Röntgen-Spektren fest gebundene Elektronen (Rumpfelektronen) 5. Atomaufbau und Periodensystem der Elemente 5.2 Wasserstoffähnliche Atome Einelektronen-Atome Alkali-Metalle 2 3 5.2.1 Einelektronen-Atome: H, He , Li , Be , Einführung der Kernladung in E pot Ze 2 V(r) 4 0 r 1 Lösen der SGL analog zu H-Atom e e 4 Z2 1 E n (Z) 2 2 2 8 0 h n Einführung von Z in Wellenfunktion, z.B. Grundzustand 1s: s const e Z 5. Atomaufbau und Periodensystem der Elemente Elektronenwolke näher am Kern lokalisiert, da stärkere Anziehung durch höhere Kernladung rH rHe rLi2 Spektrallinien zu höheren Wellenzahlen verschoben, aber Spektren qualitativ analog zum Spektrum des H-Atoms 5.2.2 Alkali-Metalle: Optische Spektren durch äußeres Elektron (s-Elektron) bestimmt „Leuchtelektron“ Innere Elektronen schirmen Kernladung ab Z Zeff Innere Elektronen + Atomkern = Atomrumpf Z Komplikation: Zeff kann nicht als Punktladung am Ort des Kerns beschrieben werden 5. Atomaufbau und Periodensystem der Elemente Kugelsymmetrie der potentiellen Energie geht verloren E n f () n2-fache Entartung der Energieniveaus wird aufgehoben 5.3 Mehrelektronen-Atome – generelle QM-Beschreibung Einfachstes Beispiel: Helium - Z 2, 2e 2 r12 1 r2 + r1 Hamilton-Operator: 2 2 2 2 1 2e 1 2e 1 e 2 2 ˆ 1 2 H 2 e 4 0 r12 4 0 r1 4 0 r2 Anziehung Kern – Elektron 1 2 2 2 2 2 2 ; i 1, 2 x i yi z i 2 i Anziehung Kern – Elektron 2 Elektron-ElektronAbstoßung 5. Atomaufbau und Periodensystem der Elemente 2 e ˆ H ˆ H ˆ H ; 1 2 4 0 r12 1 2 2 1 2e ˆ H i2 i 2 e 4 0 ri Ohne Elektron-Elektron-WW: Hamiltonoperator = Summe von 1e Hamiltonoperatoren ˆ H ˆ H ˆ H 1 2 (x1 , y1 , z1 ) (x 2 , y 2 , z 2 ) Lösung der SGL Lösung des H-Atoms Wasserstoff-Wellenfunktionen Elektron-Elektron-Abstoßung Ĥ nicht separierbar keine analytische Lösung der SGL möglich Näherungsverfahren erforderlich 5.4 Näherungsverfahren – Das Variationsprinzip 5.4 Näherungsverfahren 5.4.1 Das Variationsprinzip Berechnung der Erwartungswerte der Energien des Atoms: E n Ĥ n d n n d ˆ d n H n wenn n normiert ist d dx dy dz dx 1 1 1 2 dx N dy N dz N für N-Elektronen-System n = Eigenfunktion von Ĥ E E n Berechnung von E mit Testfunktion E Man kann zeigen: wenn n E En Ĥ d d Variationsprinzip 5.4 Näherungsverfahren – Das Variationsprinzip Anschaulich: das in der Natur realisierte System hat immer die niedrigste Energie. Falsche Wellenfunktion höhere Energie ist daher eine umso bessere Näherung für n, je niedriger E ist. wenn E E n n ; wird aber in der Regel nicht erreicht Beste Näherung wird durch Energiemininierung ermittelt: E Ĥ d ! Minimum d Energieminimierung durch Parametervariation: E c i c ji 0 mit (c1 , c2 , , ck ) Näherungsverfahren zur Lösung der SGL 1. Variationsmethode Berechnung des ErwartungsWerts der Energie mit Testfunktion ( c1 , c2, , ck ) Hˆ d d * E * En Energieminimierung durch Koeffizientenvariation E ci 0 C j i E Minimum beste Approximation von n 5.4.2 Hartree-Fock-Methode des selbstkonsistenten Feldes Ansatz: Gesamtwellenfunktion = Produkt aus wasserstoffähnlichen 1-Elektronen-Wellenfunktionen g1 (r1 , 1 , 1 ) g 2 (r2 , 2 , 2 ) g N (rN , N , N ) i wobei g i (ri , i , i ) h i (ri , Zeff ,i ) Y ,m (i , i ) Beschreibt Abschirmung des Elektrons i durch „Feld“ der anderen Elektronen Winkelanteil wird von Elektron-Elektron-WW nicht beeinflusst Möglicher Ansatz: h i (ri , Zeff ,i ) R n , (ri , Zeff ,i ) Iteratives Verfahren zur Bestimmung der Zeff ,i via Variationsprinzip: 1. Schritt: Variation von h1 E Zeff ,1 Zeff , j1 0 g1 (r1 ,1 , 1 ) g 2 (r2 ,2 , 2 ) g N (rN ,N , N ) 5.4.2 Hartree-Fock-Methode des selbstkonsistenten Feldes 2. Schritt: Variation von h2 E Zeff ,2 Zeff , j2 0 g1 (r1 ,1 , 1 ) g2 (r2 ,2 , 2 ) g N (rN ,N , N ) Iterative Energieminimierung durch sukkzessive Optimierung aller Zeff ,i Abbruch wenn E * Ĥ d d * konstant , d.h. wenn E n ' 1 E n ' ; sehr kleine Zahl, z.B. 104 Zeff ,i Z i 5.4.2 Hartree-Fock-Methode des selbstkonsistenten Feldes Zeff ,i Z i Zeff ,i = effektive Kernladung für Elektron i Z = Kernladung i = Slater-Abschirmkostante des Elektrons i Bsp. Ermittlung von für ein Außenelektron (4s) von Ca: Energietermschema von Mehrelektronenatomen Zahl und Art der Orbitale wie bei H-Atom; Aber: Aufhebung der Entartung Ursache: unterschiedliche Abschirmung von s-, p- und d-Orbitalen 2s größere AufenthaltsWahrscheinlichkeit am Kernort geringere Abschirmung niedrigere Energie 2pz Knotenebene am Kernort stärkere Abschirmung höhere Energie Aufbau des Periodensystems Aufbauprinzip: 1) Energieniveau-Schema 2) Pauli-Verbot 3) Hundsche Regel Nomenklatur: H 1s1 He 1s2 Ne 1s22s22p6 Na [Ne]3s1