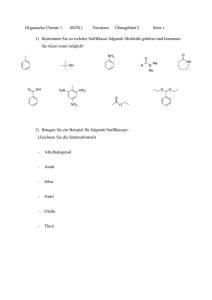
2 Die kinetische Gastheorie: Lernziele 2. Die kinetische Gastheorie
Werbung

2 Die kinetische Gastheorie: Lernziele 2. o Einführung in das zugrundeliegende Modell des perfekten Gases o Der Druck eines perfekten Gases nach den kinetischen Gastheorie o Die Mittelwerte diskreter und kontinuierlicher Verteilungen o g der Die Maxwell-Boltzmannsche und Maxwellsche Verteilung Molekülgeschwindigkeiten o Berechnung der mittleren Geschwindigkeit, der quadratisch gemittelten Geschwindigkeit und der wahrscheinlichsten Geschwindigkeit der Teilchen eines Geschwindigkeit, Gases o Stossquerschnitt, Stosszahl und mittlere freie Weglänge der Teilchen eines Gases P. Atkins, P Atkins J. J de Paula, Paula “Physikalische Physikalische Chemie Chemie”, Wiley WileyVCH Verlag GmbH& Co, 2010, 21.1 Die kinetische Gastheorie: Einleitung o Die Energie eines Gases = kinetische Energie seiner Moleküle. o Die Gastheorie = mikroskopisches Modell zur Berechnung makroskopischer Eigenschaften o Die Di Gastheorie G th i beruht b ht auff drei d i Annahmen: A h 1. Das Gas besteht aus Molekülen in kontinuierlicher, zufälliger Bewegung 2. Die Grösse der Moleküle : Strecke zwischen 2 Zusammenstössen 3. Es gibt keine Wechselwirkungen zwischen den Molekülen ausser gelegentlichen kurzen, elastischen Stössen. Kinetische Energie und Temperatur o Die kinetische Gasteilchens ist: Energie (für Translationsbewegung) 1 2 ε trans = m v 2 oDer Druck des Gases ist: pVm = 2 pVm = N Aε trans 3 1 N Am v 2 3 o Gasgesetz (ideale Gase): pVm = RT N Aε trans = eines 3 RT 2 3 2 ε trans = kT Di Wä Die Wärme iistt eine i A Artt von B Bewegung ! Wärme und mechanische Energie sind verwandt Die quadratisch gemittelte Geschwindigkeit o Die quadratisch gemittelte Geschwindigkeit der Gasmoleküle ist proportional zur Wurzel aus der Temperatur und umgekehrt proportional zur Wurzel aus der Molmasse: v 2 3RT = M c= v 2 ⎛ 3RT ⎞ =⎜ ⎝ M ⎠ 1 2 M = molare Masse der Moleküle An Tafel... o Die einzelnen Geschwindigkeitswerte g sind über einen weiten Bereich verteilt o Die einzelnen Geschwindigkeitswerte werden zusätzlich durch ständige Stossereignisse umverteilt: vor einer Stoss kann sich ein Teilchen schnell bewegen durch Stosseinwirkung kann das Teilchen auf seht hohe Geschwindigkeit beschleunigt sein. durch den nächsten Stoss kann das Teilchen wieder abgebremst werden. M Maxwell‘schen ll‘ h Geschwindigkeitsverteilung G h i di k it t il o Wir brauchen die Verteilung der Komponenten der TeilchenGeschwindigkeiten zur Berechnung von Reaktionsgeschwindigkeiten und zur Beschreibung der Eigenschaften von Molekularstrahlen. o Der Anteil der Moleküle mit einer Geschwindigkeit zwischen v und v + d ist dv i t zur Grösse Gö d betrachteten des b t ht t B i h proportional Bereiches ti l und d wird i d mit it F(v)dv bezeichnet. o Wenn das gegebene Geschwindigkeits- Intervall so breit ist (v1 v2), dann: N = ∫ F (v )dv v2 v1 o F(v) ist die Geschwindigkeitsverteilung, die für die Moleküle eines Gases bei der Temperatur T ist die Maxwell‘schen Geschwindigkeitsverteilung: 3 2 M 2 ⎛ M ⎞ 2 − Mv 2 RT F (v ) = 4 π ⎜ ⎟ v e ⎝ 2 π RT ⎠ Maxwell‘schen Geschwindigkeitsverteilung g g o Der Anteil der Moleküle mit einer Geschwindigkeit zwischen v1 und v2 ist das Fläche unter der Kurve zwischen v1 und v2. N = ∫ F (v )dv d v2 v1 o Die Fläche unter der Graphen von F(v) muss numerisch ausgerechnet werden. Re elative Anza ahl der Mole eküle Mittlere Geschwindigkeit Moleküle Moleküle Moleküle Geschwindigkeit v1 v2 Maxwell‘schen Maxwell schen Geschwindigkeitsverteilung Herleitung: o Um die Wahrscheinlichkeit dass ein Molekül eine Geschwindigkeit im Bereich von v bis v+dv besitzt, zu ermitteln, berechnen wir die Wahrscheinlichkeit dafür, dass der Geschwindigkeitsvektor irgendwo auf eine Kugel Fläche mit dem Radius v zeigt. 2 2 2 2 o Die Wahrscheinlichkeit dass ein Molekül eine Geschwindigkeit mit Komponenten p zwischen vx und vx+dvx; vx und vy+dvy; vz und vz+dvz hat, ist: v = vx + v y + vz Oberfläche 4πv2 Dicke dv v F (v x , v y , v z )dv x dv y dv z o Die Geschwindigkeitsverteilung ist raumsymmetrisch: vz vx F (v x , v y , v z )dv x dv y dv z = f (v x ) f (v y ) f (v y )dv x dv y dv z vy Maxwell‘schen Geschwindigkeitsverteilung Herleitung: o Boltzmann Verteilung = Der Anteil der Moleküle Geschwindigkeitskomponenten vx, vy, vz, ist proportional Exponentialfunktion ihrer kinetischen Energie E. E= 1 1 1 mv x2 + mv y2 + mv z2 2 2 2 F (v x , v y , v z ) = Ae F (vx , v y , vz ) = Ae A −E kT − mvx2 2 kT mit den zu einer − mv2y e 2kT e − mvz2 2 kT o Der Anteil der Moleküle mit den Geschwindigkeitskomponenten im Geschwindigkeitsbereich vx und vx+dvx; vy und vy+dvy; vz und vz+dvz, ist: −mvx2 −mv2y −mvz2 F(vx , vy , vz )dv d xdv d y dv d z = Ae A 2kT e 2kT e 2kT dv d xdv d y dv dz F (v x , v y , v z )dv x dv y dv z = f (v x ) f (v y ) f (v y )dv x dv y dv z f (v x ) = A 3 e 1 − mv x2 2 kT − mv 2y f (v y ) = A 3 e 2 kT 1 f (v z ) = A 3 e 1 − mv z2 2 kT Maxwell‘schen Geschwindigkeitsverteilung g g Herleitung: o Zur Bestimmung von A überlegen wir, dass die Geschwindigkeit jedes − ∞ < vx < + ∞ Moleküls irgendwo im Bereich liegen muss: ∞ ∞ ∫ f (v )dv x x −∞ =1 ⎛ m ⎞ A=⎜ ⎟ 2 π kT ⎠ ⎝ 3 2 ⎛ M ⎞ =⎜ ⎟ 2 π RT ⎠ ⎝ 3 als 2 ∫e −∞ − ax 2 ⎛π ⎞ dx = ⎜ ⎟ ⎝a⎠ 1 1 2 ⎛ M ⎞ f (vx ) = ⎜ ⎟ e ⎝ 2πRT ⎠ An Tafel... 2 −mvx2 2 kT o Die Wahrscheinlichkeit dass ein Molekül eine Geschwindigkeit mit Komponenten zwischen vx und vx+dvx; vx und vy+dvy; vz und vz+dvz hat, ist: 2 3 − Mv ⎛ M ⎞ 2 2 RT F (v x , v y , v z )dv x dv y dv z = ⎜ dv x dv y dv z ⎟ e ⎝ 2πRT ⎠ mit v 2 = v x2 + v y2 + v z2 Maxwell‘schen Maxwell schen Geschwindigkeitsverteilung Herleitung: o Das Volumen der betreffenden Kugelschale= g die Summe aller Volumenelemente: dvx dv y dvz = 4πv 2 dv Oberfläche 4πv2 vz o Die Wahrscheinlichkeit, dass die Geschwindigkeit unabhängig von ihrer Richtung zwischen v und v+dv +d liegt: 3 ⎛ M ⎞ 2 −Mv F (v )dv = 4π ⎜ ⎟ ve ⎝ 2πRT ⎠ 2 Dicke dv v vx 2 2RT dv 3 ⎛ M ⎞ 2 2 − Mv 2 2 RT F (v ) = 4π ⎜ v e ⎝ 2πRT ⎠ Maxwell‘schen Geschwindigkeitsverteilung vy Eigenschaften der Verteilung o Der Anteil der Moleküle mit sehr hoher Geschwindigkeit wird sehr gering sein. o Schwerere Moleküle bewegen wahrscheinlich nicht seht schnell. 100K 300K sich 800K o Bei höheren T bewegt be egt sich ein grosser Teil der Moleküle schneller als bei niedrigen T. o Der Anteil von Molekülen mit sehr geringer Geschwindigkeit ist klein Mittlere Geschwindigkeit Relative Anzahll der Moleküle o Die Verteilung g wird breiter bei höheren T Moleküle Moleküle Geschwindigkeit Moleküle Geschwindigkeiten g der Moleküle o Die mittlere Geschwindigkeit, v kann man aus der Maxwell-Verteilung berechnen: ∞ v = v = ∫ vF (v )dv −∞ ⎛ 8 RT ⎞ v = v = ⎜ ⎟ π M ⎝ ⎠ 1 2 ⎛ 8 kT ⎞ = ⎜ ⎟ π m ⎝ ⎠ 1 2 o Die wahrscheinlichste Geschwindigkeit, g , v* ergibt g sich aus der Lage g des Maximus der Verteilung: dF (v ) =0 dv ⎛ 2 RT ⎞ v∗ = ⎜ ⎟ ⎝ M ⎠ 1 2 ⎛ 2 kT ⎞ =⎜ ⎟ ⎝ m ⎠ 1 2 o Die mittlere Relativgeschwindigkeit, vrel ist die mittlere Geschwindigkeit, mit der ein Molekül sich einem anderen nähert: vrel = 2v Geschwindigkeiten der Moleküle o Zusammenfassung der Schlussfolgerungen, die sich aus der Maxwell-Verteilung für Moleküle mit der Molmasse m und der Temperatur T ergeben: • die wahrscheinlichste Geschwindigkeit, v∗ = c ∗ • die mittlere Geschwindigkeit, v = v = c • die quadratisch gemittelte Geschwindigkeit, c= v2 o Die mittlere Relativgeschwindigkeit zweier verschiedener Moleküle: mm µ= 1 2 m1 + m2 vrel ⎛ 8kT ⎞ = ⎜⎜ ⎟ ⎝ πµ ⎠ Die Stosshäufigkeit o Wir betrachten die Moleküle als harte K Kugeln l (Durchmesser (D h d) d). o Die Moleküle „treffen“ sich, wenn der Abstand der Mittelpunkte beider Teilchen ≤ St Stossdurchmesser d h d d. o Die Positionen aller Moleküle, mit Ausnahme von einem, sollen eingefroren sein. o Um ein Teilchen (dies fliegt eine Zeit ∆t lang mit vrel) herum einsteht ein Stosszylinder mit: o Treffzahl der Moleküle = die Anzahl Querschnitt σ = πd 2 ortsfester Moleküle deren Mittelpunkte sich L = vrel ∆t Länge innerhalb des Stosszylinder befinden: V = σvrel ∆t Volumen N N ∗ = σ v rel ∆ t V Teilchendichte Di Stosshäufigkeit Die St hä fi k it o Die Stosshäufigkeit Z = der Anzahl der Stösse eines Moleküls pro Z it i h it mit Zeiteinheit it N Molekülen M l kül in i Volumen V l V V,: Z = N σ v rel V o Bei konstanten Volumen, Z nimmt mit der Temperatur zu. o Bei konstanter Temperatur, Z ist proportional zum Druck t. o Für ideale Gase: Z = σ v rel p kT o z. B. N2 Moleküle, p = 105 Pa, T = 25 °C > Z = 5x109 s-1 σ (nm2 ) 0.88 0.21 0.43 Moleküle Benzol Helium Stickstoff Die mittlere freie Weglänge o Die mittlere Weglänge, λ = die mittlere Wegstrecke, die ein Molekül zwischen zwei Stössen zurücklegt. o Ein Molekül verbringt zwischen Stössen eine freie Flugzeit 1/Z bewegt sich um eine Strecke, l : l =λ und v λ= Z o Die mittlere freie Weglänge: kT λ= 2σ p Querschnitt σ = πd 2 o z.B. Stickstoff, p = 105 Pa (das bedeutet 103 Moleküldurchmessern) > λ = 70nm. o In einem geschlossenem Behälter, T/p = konst. > λ ≠ f (T ) 2 Die kinetische Gastheorie: Lernziele 2. 9 Einführung in das zugrundeliegende Modell des perfekten Gases 9 Der Druck eines perfekten Gases nach den kinetischen Gastheorie 9 Die Mittelwerte diskreter und kontinuierlicher Verteilungen 9 Die Di Maxwellsche M ll h Verteilung V t il d Molekülgeschwindigkeiten der M l kül h i di k it 9 Berechnung der mittleren Geschwindigkeit, der quadratisch gemittelten Geschwindigkeit, und der wahrscheinlichsten Geschwindigkeit der Teilchen eines Gases 9 Stossquerschnitt, Stosszahl und mittlere freie Weglänge der Teilchen eines Gases P. Atkins, P Atkins J. J de Paula, Paula “Physikalische Physikalische Chemie Chemie”, Wiley WileyVCH Verlag GmbH& Co, 2010, 21.1 Thermodynamik (TD) Fundamentale Theorie der makroskopischen Eigenschaften der Materie: - Spontane Prozesse - Konzept der “Temperatur” -Phasenübergänge -Energetik Energetik makroskopischer Phasen und chemischer Reaktionen P. Atkins, P Atkins J. J de Paula, Paula “Physikalische Physikalische Chemie Chemie”, Wiley WileyVCH Verlag GmbH& Co, 2010. Der erste Hauptsatz der TD- Lernziele o Einleitung o Zustandgrössen und –funktionen o Wärme, Arbeit und Energie o Innere Energie o Der erste Hauptsatz der Thermodynamik o Volumenarbeit o Wärmeübergänge o Die Enthalpie o Adiabatiche Anderung o Anderungen der Inneren Energie o Der Joule-Thomson-Effeckt ff oThermochemie P. Atkins, P Atkins J. J de Paula, Paula “Physikalische Physikalische Chemie Chemie”, Wiley WileyVCH Verlag GmbH& Co, 2010, 2. Einleitung o Die Thermodynamik ist die Lehre von den Umwandlungen der Energie. Energie o Beispiele für Anwendungsgebiete: - Verbrennungsenergie wird in mechanische Arbeit umgewandelt (Motoren) - Elektrische Arbeit wird durch den chemischen Transfer von Elektronen erzeugt (Batterien) - Energetische Analyse chemischer Prozesse (kann eine bestimmte Reaktion überhaupt ablaufen ?) - Bereitstellung von Energie zur Synthese komplexer Biomoleküle ü in Organismen O Bevor wir uns der Theorie hinter diesen Fragen widmen, benötigen wir jedoch einige mathematische Hilfsmittel, die im Folgenden diskutiert werden. Zustandgrössen und - funktionen o Zustandsvariabeln (Zustandsgrössen) sind physikalische Grössen, mit denen man den Zustand eines makroskopischen Systems beschreibt, z.B. -Temperatur T - Druck p - Volumen V - Stoffmenge n - innere Energie U und andere mehr (s. später) 1. Intensive Zustandsvariablen (Zustandsgrössen) sind Eigenschaften, die von der Masse des Systems unabhängig sind. z.B. Druck p, Temperatur T, Molvolumen Vm=V/n, Viskosität. 2. Extensive Zustandsvariablen (Zustandsgrössen) sind Eigenschaften, die von der Masse von System abhängig sind. sind z. B. Volumen V, Stoffmenge n, innere Energie U Zustandgrössen und - funktionen o Spezifische Grösse = Dividiert man eine extensive Grösse durch die Masse m: v= V m o Molare Grösse = Dividiert man eine extensive Grösse durch die Stoffmenge n: Stoffmenge, V - molares Volumen n H - molare Enthalpie n o Der Erfahrung nach werden für eine reine Substanz zwei intensive und eine extensive Zustandsvariable benötigt, um ein System zu beschreiben. Alle anderen Zustandsgrössen sind dann Zustandsfunktionen, die von den gewählten Zustandsvariablen abhängen. abhängen Vm = Hm = o Extensive Grössen werden in intensive Grössen überführt. o Prinzipiell hat keine der intensiven Grössen einen Vorrang vor der anderen. o Oft verwendet man die Temperatur und den Druck als unabhängige Variable das molare Volumen ist eine Funktion von p und T ! Z t d ö Zustandgrössen und d - funktionen f kti o Der Wert einer Zustandsvariable ist eine Funktion der anderen Z t d Zustandsvariablen, i bl eine i Zustandsfunktion. Z t d f kti z. B. die innere Energie U kann als eine Funktion der unabhängigen Zustandsgrössen usta dsg össe p, T u und d n ausged ausgedrückt üc t werden: e de U = f(T,p,n) ( ,p, ) o Zustandsgleichung = die Gleichung, die eine Beziehung zwischen den Zustandsgrössen herstellt. o Zustandfunktionen = Grössen eines Systems, gegenwärtigem Zustand des Systems abhängen die nur von o Wegfunktionen = Grössen eines Systems, die weganhängig sind. o Eine Zustandfunktion ist unabhängig davon, wie dieser Zustand erreicht wurde Partielle Ableitungen Partielle Ableitung = Steigung der Funktion entlang einer Koordinate, wobei alle anderen Koordinaten konstant gehalten werden. werden Beispiel: f = Funktion zweier unabhängiger Variabeln x, y f(x,y) - partielle Ableitung nach x bei konstantem y: Schnitte parallel zur (x,f) Ebene = Funktionen von x und y können abgeleitet werden. Partielle Ableitungen/ Totales Differential f - partielle Ableitung nach y bei konstantem x: x= 0 ⎛ δf ⎞ ⎜⎜ ⎟⎟ ⎝ δy ⎠ x ⎛ δf ⎞ ⎜⎜ ⎟⎟ ⎝ δy ⎠ x x= l x y Schnitte parallel zur (y,f) Ebene y y = Funktionen von x und y können abgeleitet werden. Das totale Differential df gibt die totale, infinitesimale Änderung einer Funktion f(x,y) bei einer infinitesimalen Variation dx und dy der unabhängigen Variablen x und y an. Totales Differential von f(x,y): ⎛ ∂f ⎞ ⎛ ∂f ⎞ df = ⎜ ⎟ dx + ⎜⎜ ⎟⎟ dy ⎝ ∂x ⎠ y ⎝ ∂y ⎠ x Gesamte Änderung des Funktionswerts > Integral über df ist unabhängig vom Weg : x1 , y1 ∫ df x2 , y 2 = f ( x1 , y1 ) − f ( x0 , y0 ) Grundbegriffe o Das System = derjenige Teil der Welt, dem unser spezielles Interesse gilt. Eine Region im Raum, die von der Umgebung durch die S t Systemgrenzen abgegrenzt b t wird. i d Die Di Systemgrenzen S t sind i d frei f i wählbar, ählb aber nach der Wahl für die weitere Diskussion fixiert. o Die Umgebung g g = Rest des Universums ((kann aber häufig g auf einen kleineren Teil des Labors beschränkt werden!) o Das Weltall = System + Umgebung o Systeme: Offene Systeme Systeme, Geschlossene Abgeschlossene (Isolierte) Systeme: Umgebung System Offen Sy. Stoffe Energie Umgebung System Stoffe Energie Geschlossen Sy. Systeme Umgebung System und Stoffe Energie Abgeschlossen Sy. Arbeit Wärme, Arbeit, Wärme Energie o Arbeit wird geleistet, wenn man einen Prozess dazu verwendend kann, irgendwo in der Umgebung die Höhe eines Gewichtes zu verändern. o Die Arbeit > wird von dem System geleistet, wenn das Gewicht angehoben wird > wird an dem System geleistet, wenn das Gewicht abgesenkt wird. o Energie ist die Fähigkeit, Arbeit zu leisten • wenn die Arbeit an dem System geleistet wird , nimmt seine Energie zu • wenn das System Arbeit leistet > nimmt die Energie ab o Wärmefluss = erfolgt die Änderung der Energie eines Systems aufgrund einer i T Temperaturdifferenz t diff o Behälter: Wärme diathermisch Wärme adiabatisch Arbeit, Wärme, Energie Vorgänge: Wärme 1 1. exoterme 2. endotherme exotherm Wärme endotherm Molekularer Bild: o Wärme: Energieübertragung durch eine ungeordnete Bewegung von Molekülen (thermische Bewegung) o Arbeit: Energieübertragung ü durch eine ordnete Bewegung von Molekülen (mechanische Bewegung) Energie Wärme Energie Arbeit Der erste Hauptsatz der TD o Thermodynamik basiert auf vier grundlegenden Gesetzen (die Hauptsätze), aus denen sich die gesamte Theorie entwickeln lässt. o D Der erste t Hauptsatz H t t der d TD = Wärme Wä und d Arbeit A b it sind i d equivalent, i l t wenn es darum geht die Energie eines Systems zu ändern. o Was für eine Energie g eines Systems? y o Innere Energie (U) = die Gesamtenergie eines Systems (die Summe der kinetischen und potentiellen Energie seiner Moleküle). o Z. B. Die Innere Energie einatomiger Gase, die nur kinetische Energie haben, ist: Um = Um (0) + 3/2 RT Wobei Um (0) ist die molare Innere Energie bei T = 0K. o Die Aenderung der Inneren Energie , wenn ein System von Anfangszustand A (UA) in einen Endzustand E (UE) überführt wird, wird ist: ∆ U = UE - UA Der erste Hauptsatz der TD o Eigenschaften der Inneren Energie: - U ist eine Zustandsfunktion - Jede Änderung einer der Zustandgrössen (z.B. Druck) bewirkt eine Änderung der Inneren Energie. - U ist eine extensive Eigenschaft (hängt von der Stoffmenge ab). o 1. Hauptsatz der TD (andere Formulierung) = In einem abgeschlossenen b hl S t System k kann k i keine Aenderung A d d IInneren E der Energie i auftreten (U ist konstant) Es ist noch nie gelungen g g ein Perpetuum Mobile zu bauen ! Einheit für Innere Energie, Arbeit und Wärme: Joule (J) 1J = 1kg m2 s-2 Der erste Hauptsatz der TD o 1. Hauptsatz der TD = Verändert sich ein System von einem Zustand A in einen anderen Zustand E auf einem beliebigen, adiabatichen Weg, so ist die geleistete Arbeit immer die gleiche. wad = Arbeitsmenge, die geleistet wird in einem adiabatischen Prozess (das System kann nicht Wärme austauschen) wad = ∆U = U E − U A ∆U hat die gleiche Änderung auf nicht-adiabatischen Weg, aber die geleistete Arbeit, w muss nicht dieselbe wie zuvor sein. o Die aufgenommene Wärme, Q = den Unterschied zwischen der geleisteten Arbeit und die Änderung der Inneren Energie: Q = ∆U − w w = Arbeitsmenge, A b it di geleistet die l i t t wird i d in i einem i nicht-adiabatischen i ht di b ti h Prozess P (das System kann Wärme austauschen) Der erste Hauptsatz der TD o Wärme und Arbeit sind die Möglichkeiten die Energie eines Systems zu beeinflussen. o Mathematische Formulierung des erstes Hauptsatz der TD: ∆U = Q + w Q = Wärme die dem System zugeführte Energie w = Arbeit die an einem System verrichtet ist o Für infinitesimale Änderung des Systems: dU U = dQ Q + dw oMakroskopisch messbare Änderungen thermodynamischer Grössen werden durch Integration über alle infinitesimalen Änderungsschritte erhalten. o Ein griechisches “ ∆” bezeichnet eine messbare makroskopische Änderung der relevanten thermodynamischen Grösse, die nach der Integration über alle infinitesimal kleinen Änderungen erhalten wird; wir lassen das “ ∆ ∆” für Q und w weg, weil der Transfer von Wärme und Arbeit immer bereits eine Veränderung impliziert. Wegfunktionen ow > 0, Q > 0 wenn dem Systems Energie zugeführt wird. o w < 0, Q < 0 wenn dem Systems Energie entnommen wird. o w und Q sind Wegfunktionen (sind nicht totale Differentiale). o Weggrössen (auch Transfergrössen) sind thermodynamische Grössen deren Wert vom Weg abhängt, in dem das System in den gegenwärtigen Zustand gelangt ist. ist o Möglichkeiten, einen thermodynamischen Prozess zu führen (“Wege”): • isotherm: die Temperatur bleibt konstant • isobar: der Druck bleibt konstant • isochor: das Volumen bleibt konstant • adiabatisch: kein Wärmefluss δq=0 Volumenarbeit o Volumenarbeit = der Form von Arbeit, die mit einer Volumenänderung verbunden ist. o Die allgemeine Formulierung der Volumenarbeit = die Arbeit, die erforderlich ist, um ein Objekt um eine Strecke dz gegen den Widerstand einer i G Gegenkraft k ft F zu bewegen. b dw = − Fdz o Das System hat eine Wand, die bildet ein masseloser, reibungsfrei, starrer, perfekt eingepasster p g p Kolben der Fläche A. o Die entgegen der Ausdehnung wirkende Kraft ist: F = pex A pex A dz A pex V l Volumenarbeit b it o Wenn das System um die Strecke dz expandiert (gegen den äusseren D k pex), Druck ) ist i t die di Arbeit: A b it dw = − pex Adz d = Adz dV Ad dw = − pex dV o Die Arbeit die insgesamt g bei der Volumenänderung von VA auf VE verrichtet ist: VE w = − ∫ p ex dV VA o Für andere Formen der Arbeit, die wir nicht mechanische oder zusätzliche Arbeit nennen wollen, gelten analoge Beziehungen, jeder Arbeit, w ist: w = (eine intensive Grösse) x (eine extensive Grösse) A d Andere F Formen d der A Arbeit b it o Oberflächenarbeit (bei Emulsionen): γ dA o Längenausdehnung (Spannung eines Gummis): fdl γ = die Oberflächenspannung dA = die Oberflächenänderung f = die Spannung dl = die Längeänderung o Elektrische Arbeit: φdφ φ= das elektrische Potenzial dφ = die Ladungsänderung