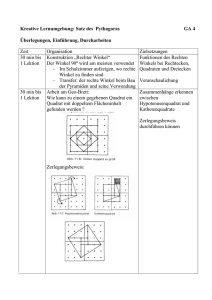
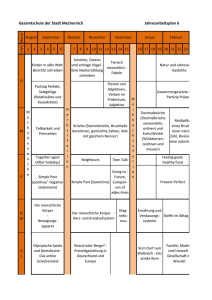
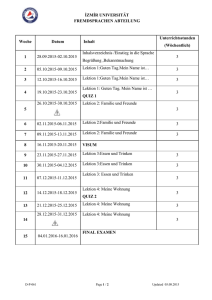
Pathobiologie/Pathobiochemie Teil 1
Werbung

Pathobiologie/Pathobiochemie Teil 1 Lektion 1 20.09.10 Einführung und Grundlagen Lektion 2 27.09.10 Gedächtnisstörungen Pathobiologie der Sucht Lektion 3 4.10.10 Lektion 4 11.10.10 Pathobiologie der Sinnesorgane Augenkrankheiten [ Lektion 5 18.10.10 Herz-Kreislaufkrankheiten ] Lektion 6 25.10.10 Pathobiologie des Schmerzes Lektion 7 1.11.10 Neurodegenerative Erkrankungen und andere Krankheiten des Nervensystems (Selbststudium) Hautkrankheiten 1 04/10/10 Pathobiologie - HS 2010 - Lektion 3 1 Stoff aus dem Lehrbuch zu Lektion 3 G. Thews, E. Mutschler, P. Vaupel Anatomie, Physiologie, Pathophysiologie des Menschen (6. Auflage) Wissenschaftliche Verlagsgesellschaft mbH Stuttgart, 2007. Grundlagen aus der Anatomie/Physiologie: Kapitel 19: Seiten 677-697, 702-720, 771-788, 796-813, 814-818, 823-831 (gilt auch für Lektion 12) Neurologische Störungen: Kapitel 19: Seiten 832-850 Psychiatrische Störungen: Kapitel 19: Seiten 851-858 Schlafstörungen: Kapitel 19: Seiten 818-822 2 04/10/10 Pathobiologie - HS 2010 - Lektion 3 2 Erkrankungen des Nervensystems Inhalt von Lektion 3: Beispiele: • Neurodegenerative Erkrankungen Alzheimer-, Parkinson-, Prion-Krankheit* • Infektionen Akute/chronische Meningitis, (Meningo-) Enzephalitis, Toxoplasmose, Prion-Krankheit* • Ödem, Druck, Malformationen, Traumen Cerebrales Ödem, intrakranialer Druckanstieg, Hernien, Hydrocephalus, Anomalien, Verletzungen • Cerebrovaskuläre Erkrankungen Hypoxie, Ischämie, Infarkt, Hämorrhagie • Vegetatives Nervensystem (nur Übersicht) Vegetative Fehlregulationen, Ausfall von vegetativen Neuronen, vegetative Querschnittssyndrome, sympathisches Nervensystem und Schmerz (s. Lektion 13) • Zentrale und periphere motorische Störungen (s. auch Lektion 10) Periphere Nervenläsionen, spinaler Schock, Spastik, • Demyelinisierende Erkrankungen Mulitple Sklerose • Hirntumoren Gliome, Medulloblastom, Meningiom, Schwannom • Anfallserkrankungen Epileptische Anfälle, Epilepsien, epileptische Syndrome • Vertigo (Schwindel) • Schlafstörungen (s. Lektion 4) Basalganglienerkrankungen, Kleinhirnerkrankungen Akuter Labyrinthausfall, langsame Schädigung des Labyrinths, zentralvestibuläre Störungen Störungen des zirkadianen Rhythmus, Insomnie, Narkolepsie, Schlaf-Apnoe-Syndrom 3 04/10/10 Pathobiologie - HS 2010 - Lektion 3 3 * Neurodegenerative Erkrankungen − Einführung Neurodegenerative Erkrankungen sind sporadische, seltener erblich auftretende Prozesse, vorwiegend des Zentralnervensystems (ZNS), die ein oder mehrere Neuronensysteme oder das gesamte ZNS betreffen. Sie gehen mit langsam fortschreitendem Funktionsverlust und Ausfall spezifischer Neuronenpopulationen und ihrer Verbindungen einher. Damit häufig verbunden sind − durch Störungen des intrazellulären Ubiquitin-Proteasomensystems bedingte − Veränderungen der Zytoskelettproteine mit Ablagerung unlöslicher Eiweissbruchstücke oder Einschlusskörper in Zellzytoplasma oder Zellkern wie Amyloidablagerungen, Neurofibrillendegeneration, Lewy-Körper u.a. Die Erkrankungen zeigen einen progressiven Verlauf mit charakteristischen klinischen, morphologischen und biochemischen Veränderungen. Typisch ist ein schleichender Beginn (50. bis 75. Lebensjahr) und langsame Krankheitsprogredienz bis zu schwerster Behinderung und Pflegebedürftigkeit. Der Tod erfolgt meist durch Sekundärkomplikationen (Pneumonie, Harnwegs- und andere Infekte, Lungenembolie), kardiovaskuläre Prozesse oder Ausfall lebenswichtiger zerebraler Funktionen. 4 04/10/10 Jellinger, J Neurol Neurochir Psychiatr 6(1):9-18, 2005 Pathobiologie - HS 2010 - Lektion 3 4 * Klassifikation (1) Neurodegenerative Erkrankungen wurden traditionell nach klinisch-pathologischen Kriterien gegliedert, d.h. nach den schwerpunktmässig betroffenen Neuronensystemen und ihren klinischen Phänotypen, wobei häufig Kombinationen und Überlappungen auftreten. 1. Physiologische und pathologische Alternsprozesse des Gehirns − senile und präsenile Demenzen, je nach Erkrankungsalter, Schweregrad und Verlauf der Hirnschäden. 2. Neurodegenerative Prozesse (Systematrophien) mit Vorzugsbefall der Stammganglien: Parkinson-Syndrom, Chorea Huntington; der Motoneuronen: Amytrophe Lateralsklerose; der Kleinhirn-, Hirnstamm- und Rückenmarkssysteme: spinozerebrale Ataxien. 3. Prion-Erkrankungen Jakob-Krankheit. 5 04/10/10 (übertragbare spongiforme Enzephalopathien): Creutzfeld- Jellinger, J Neurol Neurochir Psychiatr 6(1):9-18, 2005 Pathobiologie - HS 2010 - Lektion 3 5 (*) Klassifikation (2) Nach molekularbiologischen Merkmalen (Fehlfaltung von Zellproteinen = molekularer Grundmechanismus → “Proteinopathien”) 6 04/10/10 Jellinger, J Neurol Neurochir Psychiatr 6(1):9-18, 2005 Pathobiologie - HS 2010 - Lektion 3 6 (*) Klassifikation (3) Nach molekularbiologischen Merkmalen (Fehlfaltung von Zellproteinen = molekularer Grundmechanismus → “Proteinopathien”) 7 04/10/10 Jellinger, J Neurol Neurochir Psychiatr 6(1):9-18, 2005 Pathobiologie - HS 2010 - Lektion 3 7 * Klassifikation (Zusammenfassung) Tauopathien mit und ohne Amyloidablagerung - Alzheimer Krankheit (“sekundäre Tauopathie”) - Frontotemporale Demenz + Parkinsonismus - Pick-Krankheit - Progressive supranukleare Parese - Kortikobasele Degeneration Synucleinopathien - Morbus Parkinson - Demenz mit Lewy-Körpern - Multisystematrophie Polyglutamin-Erkrankungen - Chorea Huntington - Spinozerebelläre Ataxien - Friedreich-Ataxie Motorische Systemdegeneration - Amyotrophe Lateralsklerose Prionen-Erkrankungen - Creutzfeldt-Jakob-Krankheit Jellinger, J Neurol Neurochir Psychiatr 6(1):9-18, 2005 8 04/10/10 Pathobiologie - HS 2010 - Lektion 3 8 * Alzheimer-Krankheit (Alzheimer-Demenz) Als Demenz (Verstandesverlust) bezeichnet man erworbene Störungen mehrerer kognitiver Funktionen mit Abnahme von Gedächtnis, Denkvermögen oder anderen höheren Hirnleistungen (Sprache, Urteilskraft, Orientierung, Affektkontrolle, Persönlichkeit) bei bewusstseinsklaren Personen, die zur Beeinträchtigung sozialer, beruflicher und anderer Alltagsaktivitäten führen. Die Alzheimer-Krankheit (AK) ist die häufigste Ursache einer Demenz (50-70%). Das Demenzrisiko steigt mit zunehmendem Lebensalter drastisch an. Das lebensalterliches Risiko für Demenzen im Alter zwischen 65 und 100 Jahren beträgt 33% für ♂ und 45% für ♀. Riskikofaktoren - Alter - familiäre Belastung - Apolipoprotein Eε4 - Hypertonie - Diabetes - Nikotinabusus - Atherosklerose - Hypercholesterinämie - weibliches Geschlecht (Hormonmangel) - Schädelhirntrauma. 9 04/10/10 Pathobiologie - HS 2010 - Lektion 3 9 * Klinischer Verlauf und Diagnose der AK Klinischer Verlauf Anfangs bestehen leichte, vom Patienten und seiner Umgebung wenig bemerkte Störungen von Gedächtnis, Merkfähigkeit, Aufmerksamkeit und Informationsverarbeitung. Diese geringen Veränderungen (mild cognitive impairment - MCI) ohne Hinweis auf Demenz bedingen noch keine Beeinträchtigung im Alltagsleben, jedoch zeigen spezifische neuropsychologische Tests bereits einen Leistungsabfall vom früheren Niveau. In bis zu 80% geht MCI in Demenz über. Frühstadien der AK (Dauer 1−2 Jahre) mit Störungen von Kurzzeitgedächtnis und Konzentration bleiben bei guter “Fassade” oft verborgen. Später schreiten Störungen von Gedächtnis, Denken und Orientierung, Sprache und Handlungsabläufen, oft verbunden mit Aggressivität, motorischer Unruhe, Apathie, Aphasie und Agnosie bis zu Desorientiertheit, Psychosen, Sprachzerfall, Gangstörungen, Harn- und Stuhlinkontinenz, Wahnbildung bis zur völligen Pflegebedürftigkeit fort. Diagnose - Sorgfältige Anamneseerhebung - Klinische und psychologische Untersuchungen - Laboruntersuchungen (Blutchemie, Harn, Apolipoprotein E (ApoE)-Bestimmung im Serum, HIV, Amyloid- und Tau-Protein im Liquor) - Bildgebende Verfahren (CT, MRT, PET) Die Verdachtsdiagnose sollte bereits im Stadium der MCI erfolgen. Eine eindeutige Diagnose ist nur durch die histologische Hirnuntersuchung möglich (meist Autopsie, selten Biopsie). 10 04/10/10 Jellinger, J Neurol Neurochir Psychiatr 6(1):9-18, 2005 Pathobiologie - HS 2010 - Lektion 3 10 (*) Stadien der Alzheimer-Krankheit leichte Form milde Form schwere Form Diagnostik des Alzheimer-Gehirns mit Magnetresonanz (MR; links) und Positronen-Emissionstomographie (PET; rechts). Das MR-Bild zeigt Atrophie und ventrikuläre Vergrösserung. Das PET-Bild weist einen reduzierten Glukose-Metabolismus nach, und zwar bilateral in den Parietallappen (blaugrün) verglichen mit dem normalen Metabolismus in anderen kortikalen Bereichen (gelb, rot). 11 04/10/10 Reference: Cummings JL, NEJM 351:56-67, 2004 Pathobiologie - HS 2010 - Lektion 3 11 (*) Neuropathologie der Alzheimer-Krankheit Morphologische Diagnosekriterien Ablagerung von Amyloid im Gewebe als Plaques und in Hirngefässen (zerebrale Amyloidangiopathie) durch Abbaustörungen des im ZNS ubiquitär vorhandenen Amyloid-Vorläufer-Proteins (APP) Ablagerung von hyperphosphoryliertem Tau-Protein in Nervenzellen (Neurofibrillendegeneration), ihren Fortsätzen (Neuropilfäden) und um Amyloiddeposits (neuritische Plaques) Neuropathologie Während das Beta-Amyloidpetid neurotoxisch wirkt, bindet sich das fibrilläre TauProtein an die Mikrotubuli in den Nervenzellen und führt durch synchrone Wechselwirkung zu Gewebsschädigung (Verlust von Synapsen und Nervenzellen). Durch Unterbrechung wichtiger Nervenverbindungen kommt es zur Demenz. Jellinger, J Neurol Neurochir Psychiatr 6(1):9-18, 2005 12 04/10/10 Pathobiologie - HS 2010 - Lektion 3 12 * Mechanismus der Amyloidbildung A: Das Amyloid-Präkursorprotein (APP) ist ein Transmembranprotein mit Spaltstellen für drei bestimmte Enzyme (α-, β- und γSekretase). Die Aβ-Domäne (42 AS) reicht vom Extrazellulärteil bis in den Transmembranteil. B: Wenn APP durch die α-Sekretase gespalten wird, kann durch weitere Spaltung mit γ-Sekretase kein Aβ42 gebildet werden. Wenn APP hingegen konsekutiv durch die β- und γ-Sekretase gespalten wird, bildet sich das neurotoxische Aβ42, das dann zu Fibrillen aggregiert. Die Spaltung durch γ-Sekretase folgt immer nach jener durch α- bzw. β-Sekretase. Die Aktivierung der (membrangebundenen) γ-Sekretase erfolgt durch quarternäre Komplexbildung mit Presinilin und drei weiteren Komponenten. C: Aggregatbildung von β-Amyloid mit Tau, ApoE u.a. 13 04/10/10 Pathobiologie - HS 2010 - Lektion 3 Martin JB, NEJM 340:1970-1980, 1999 13 (*) Auswirkungen der β-Amyloidbildung Die Hypothese der Amyloid-Kaskade basiert auf der Bildung des β-Amyloids (Aβ) aus dem APP-Präkursor und schliesst verschiedene sekundäre Stufen (Oxidation, Excitotoxizität, Aggregation, Entzündung, Tau-Hyperphosphorylierung) ein, bis hin zur Plaque-Bildung, was schliesslich zum Untergang zahlreicher Neuronen führt. Das Verständnis der einzelnen Schritte dieser Kaskade eröffnet Ansatzpunkte für die Behandlung der Alzheimer-Krankheit. Reference: Cummings JL, NEJM 351:56-67, 2004 14 04/10/10 Pathobiologie - HS 2010 - Lektion 3 14 (*) Gehirn von Alzheimer-Patienten Das Gehirn von Alzheimer-Patienten zeigt Atrophien in variablem Ausmass und stark erweitere Furchen (Sulci), die besonders in den Frontal-, Temporal- und Parietallappen sichtbar sind. A Ausschnitt aus dem zerebralen Cortex eines Alzheimer-Patienten mit neuritischer Plaque. B Extrazelluläre Amyloid-Plaque mit AβPeptid (Pfeil) und Amyolid-Ablagerung in einem Blutgefäss (darunter). Die Alzheimer-Krankheit tritt kaum je bei Personen unter 50 Jahren auf. Bei der Gruppe der 60-64-Jährigen ist etwa 1% davon betroffen, bei den 8589-Jährigen sind es bereits 40%. Die Krankheit scheint nur bei 5-10% der Fälle einen genetischen (d.h. familiären) Hintergrund zu haben. Bei Patienten mit Trisomie 21 sind ab dem Alter von 45 Jahren fast alle von den bei Alzheimer beobachteten pathologischen Veränderungen betroffen. 15 04/10/10 Pathobiologie - HS 2010 - Lektion 3 15 Wichtige Gene für Erkrankungen des ZNS Reference: Kennedy et al, Science 2003; 302: 822-826 Beispiele von Genen, die involviert sind in der Pathogenese von neurodegenerativen und psychischen Krankheiten. 16 04/10/10 Pathobiologie - HS 2010 - Lektion 3 16 Epigenetische Veränderungen bei neurodeg. Krankh. Reference: Urdinguio et al, Lancet Neurol 2009; 8: 1056-72 Neurodegenerative Krankheiten werden neben genetischen auch durch epigenetische Veränderungen bestimmt; Beispiele finden sich in dieser Tabelle. 17 04/10/10 Pathobiologie - HS 2010 - Lektion 3 17 * Syncleinopathien − Parkinson-Krankheit Eine komplexe Gruppe neurodegenerativer Proteinopathien ist gekennzeichnet durch pathologische Ablagerungen des veränderten und fehlgefalteten Hirnproteins α-Synuclein (AS) als Lewy-Körper in Nervenzellen und Neuriten bzw. als Zytoplasmaeinschlüsse in Oligodendoglia und Neuronen (Synucleinopathien). Die Parkinson-Krankheit ist die häufigste Form extrapyramidaler Erkrankungen im höheren Lebensalter. Sie ist bedingt durch fortschreitende Degeneration der striato-nigralen und extranigralen Neuronensysteme (Substantia nigra) sowie durch das Auftreten vorwiegend subkortikaler Lewy-Körper. Prävalenz nimmt exponentiell mit dem Alter zu (<10/100’000 der 50jährigen, 150-200/100’000 der über 80jährigen), wobei sie bei Männern doppelt so hoch wie bei gleichaltrigen Frauen ist. Der Erkrankungsbeginn liegt zwischen 55 und 65 Jahren. A Normale Substantia nigra B Depigmentierte Substantia nigra (= Verlust von dopaminergen Neuronen) bei idiopathischem Parkinson-Syndrom. C Lewy-Körperchen, typisch für depigmentierte Substantia nigra. 18 04/10/10 Pathobiologie - HS 2010 - Lektion 3 18 * Parkinson-Krankheit Klinik Initialsymptome sind einseitiger Ruhetremor und Rigor (Steifigkeit), gefolgt von Gang- und Haltungsstörungen, Bradykinese (Verlangsamung der Bewegungen), Maskengesicht und Mikrographie (verlangsamtes Schreiben), vegetative Dysfunktionen bis zur Akinese (Bewegungslosigkleit) und Pflegebedürftigkeit. Kognitive Störungen treten in 30−70% mit 6fachem Risiko gegenüber der Normalpopulation auf und führen zu starker Verkürzung der Überlebenszeit von etwa 10 bis über 25 Jahren. Psychiatrische Komplikationen und Depression bei rund 50% der Patienten beeinträchtigen neben motorischer Behinderung wesentlich die Lebensqualität. Eine eindeutige Diagnose ist nur durch neuropathologische Untersuchung möglich. Sir W.R. Gowers, 1886 A Manual of Diseases of the Nervous System Typische Haltung eines Patienten, der unter einem Rigor (Muskelstarre) leidet. 19 04/10/10 Pathobiologie - HS 2010 - Lektion 3 19 * Neuropathologie der Parkinson-Krankheit Die Parkinson-Krankheit ist eine degenerative Erkrankung des Extrapyramidalmotorischen Systems bzw. der Basalganglien. Dabei kommt es zu einem Absterben von Nervenzellen in der Substantia nigra, die Dopamin herstellen (Dopaminmangel). Der Dopaminmangel führt zu einem Ungleichgewicht in der Funktion der Basalganglien. A Lewy-Körperchen gefärbt mit Antikörper gegen Ubiquitin; B Lewy-Körperchen gefärbt mit Antikörper gegen α-Synuclein; C Übereinanderlagerung von A und B; D-E Substantia nigra, α-Synuclein schwarz gefärbt Dopaminerge Bahnen beim gesunden Menschen (links) und beim Morbus Parkinson (rechts). Rote Pfeile stehen für Hemmung und blaue für Stimulation der Zielstruktur. Nussbaum & Ellis, NEJM 348:1356-1364, 2003 20 04/10/10 Pathobiologie - HS 2010 - Lektion 3 20 Genmutationen bei der Parkinson-Krankheit Nussbaum & Ellis, NEJM 348:1356-1364, 2003 21 04/10/10 Pathobiologie - HS 2010 - Lektion 3 21 Molekulare Grundlagen der Parkinson-Krankheit 22 04/10/10 Missense mutations and genomic multiplications of SNCA (the gene that encodes α-synuclein) lead to an increase in the cytoplasmic accumulation of the αsynuclein monomer. This promotes oligomerization of α-synuclein, which is toxic to the cell. The neuron can respond either by rapidly degrading monomeric αsynuclein through the ubiquitin–proteasome system (UPS) and/or endosomal–lysosomal pathways, or by driving the formation and aggregation of higher molecular weight fibrils. Altered α-synuclein function that is due to mutation results in its impaired vesicular binding, which abrogates the inhibition of phospholipase D2. Soluble α-synuclein is also a competitive inhibitor of tyrosine hydroxylase, the key enzyme of DOPA biosynthesis. The equilibrium between lipidassociated and cytoplasmic α-synuclein seems to provide a mechanistic link between dopamine production, packaging and vesicle dynamics. Impaired neurotransmitter release and its accumulation in the cytosol might lead to the formation of reactive oxygen species, which triggers neuronal death. Parkin and DJ1 interact and are involved in normal UPS function. In late-onset Parkinson disease α-synuclein aggregates accumulate within neurites and axons are ultimately sequestered within a central Lewy body in surviving neurons. Ubiquitin carboxyl-terminal esterase L1 (UCHL1) has ubiquitin hydrolase and ligase activities and provides a link between the UPS, endosomal–lysosomal pathways and Lewy bodies in late-onset Parkinson disease. It maintains a pool of monoubiquitin for E3 ligase and UPS function while preventing degradation of free ubiquitin in the endosomal–lysosomal pathway. UPS function and aggregate clearance requires ATP synthesis by mitochondria, and normal mitochondrial function is notably compromised by loss of PTEN-induced kinase 1 (PINK1), DJ1 and parkin activities, resulting in earlyonset parkinsonism. Reference: Farrer MJ, Nat Rev Genet 2006; 7: 306-318 Pathobiologie - HS 2010 - Lektion 3 22 * Polyglutamin-Erkrankungen − Chorea Huntington Einige neurodegenerative Erkrankungen werden durch Verlängerung der Trinukleotidexpansion für Polyglutamine verursacht. Gemeinsames Merkmal ist die Anhäufung von Polyglutamin enthaltenden Proteinen als intranukleäre Neuroneneinschlüsse. Chorea Huntington Spinozerebelläre Ataxien Chorea Huntington (CH) - autosomal-dominant vererbt - Prävalenz: 5−10/100’000 - Beginn zwischen dem 5. und 80. Lebensjahr, meist in der 4. oder 5. Dekade - verlängerte Anzahl von Wiederholungen der Trinukleotidsequenz CAG im Huntingtin-Gen (Anzahl von CAG-Wiederholungen bei Gesunden 11−35, bei CH-Patienten über 40) - Je höher die Kopienzahl, desto früher beginnt die Erkrankung. - Die mutierte Form des Proteins Huntingtin ist neurotoxisch und bildet gemeinsam mit Ubiquitin neuronale Kerneinschlüsse, deren Rolle bislang unklar ist. 23 04/10/10 Pathobiologie - HS 2010 - Lektion 3 23 Trinukleotide-Repeat-Krankheiten Robbins Zu den Trinukleotide-Repeat-Krankheiten zählen heute mindestens 20 verschiedene Krankheiten, und es kommen immer weitere hinzu. Dabei können entweder nicht-kodierende Regionen der DNA betroffen sein (z.B. FMRP) oder kodierende Regionen (z.B. Huntingtin bei der Huntington-Krankheit oder der Androgenrezeptor, das Atrophin-1, die Ataxine 1, 2, 3 und 7, sowie die α1AUntereinheit des VDCC (voltage-dependent calcium channels). Lokalisation von Trinukleotid-Repeats und betroffene Sequenzen bei ausgewählten Trinukleotid-Repeat-Krankheiten. Modell der molekularen Wirkungsweise des FMRP (familiäres mentales Retardationsprotein) in Neuronen. 24 04/10/10 Pathobiologie - HS 2010 - Lektion 3 24 * Klinik der Chorea Huntington Klinische Symptome - anfängliche Verhaltensstörungen - choreiforme Hyperkinesen (unwillkürliche Bewegungen grösserer Muskelgruppen) - Gangstörungen - gehäufte Stürze - früh einsetzende fortschreitende Demenz - Depression - Rigor (Muskelstarre) - Akinese (Bewegungsarmut) - Dystonien - Athetose (unwillkürliche Bewegungen von Händen und Füssen) - Ataxie (Störungen der Bewegungskoordination) - Sprach- und Schluckstörungen Manifestation häufig im 4.−5. Lebensjahrzehnt. Die Krankheit führt nach 15−25 Jahren zum Tode. Links: Hemisphäre eines normalen Gehirns Pathogenese Teile des Gehirns − v.a. der Nucleus caudatus, ferner oft auch der Frontallappen und selten der ganze Cortex − sind stark atrophiert und der laterale und dritte Ventrikel sind dilatiert. Trinukleotid-Repeat-Krankheit - Erhöhte Zahl von CAG-Repeats im Hintingtin-Gen (Chrom. 4) - Exzitotoxizität und Mitochondrienschäden durch Interaktionen des mutierten Huntingtin mit anderen Proteinen - Schädigung des Proteasomen-Ubiquitinsystems zur Entgiftung schädlicher Eiweissstoffe Rechts: Hemisphäre eines Patienten mit Chorea Huntington Auf zellulärer Ebene beobachtet man einen starken Verlust von striatalen Neuronen. 25 04/10/10 Pathobiologie - HS 2010 - Lektion 3 25 Molekulare Pathogenese der Chorea Huntington Dysregulation of cAMP-response-element (CRE) and NRSE-mediated transcription Two mechanisms that contribute to the early molecular pathogenesis 1. Transcriptional dysregulation and protein misfolding and degradation. Reference: Landles & Bates, EMBO Rep 5:958-963, 2004 2. Impairment in intracellular transport, mitochondrial function and synaptic transmission. 26 04/10/10 Pathobiologie - HS 2010 - Lektion 3 26 Spinozerebelläre Ataxien Die Spinozerebellären Ataxien bilden eine Gruppe meist autosomal-dominant vererbter, genetisch klassifizierter Krankheiten (bereits 26 Typen bekannt: SCA1-SCA26) mit progressiver Ataxie bei variablen Degenerationen von Kleinhirnrinde, Brücke, unteren Oliven und spinalen Bahnen (Prävalenz 1-2/100’000). Erste Symptome zeigen sich in der regel im mittleren Lebensalter durch Bewegungsstörungen, ungewöhnliche Augenbewegungen, abnehmenden Orientierungssinn und abnehmende Wahrnehmungsfähigkeit. Im weiteren Verlauf verstärken sich die Symptome und führen schlisslich zum Tod. Pathogenese Verlust der Purkinje-Zellen, der grössten Neuronen des Kleinhirns. 27 04/10/10 Pathobiologie - HS 2010 - Lektion 3 27 Molekulare Pathogenese der Spinozerebellären Ataxie Neurodegeneration 1. 2. 3. 4. 5. 6. 7. 8. 9. 10. 11. 12. 13. Aggregation Apoptose Autophagie Veränderungen in der Ca2+-Homöostase Unterbrechung des axonalen Transports der Vesikel Exzitotoxizität Interferenz mit Gen-Expression Schädigung der Mitochondrien Oxidativer Stress Veränderung der Proteasomen-Degradation Synaptische Dysfunktion unfolded protein response (UPR) Dysfunktion der Kalium-Kanäle Reference: Duenas, Brain 129:1357-1370, 2006 28 04/10/10 Pathobiologie - HS 2010 - Lektion 3 28 * Prionenkrankheiten Prionenkrankheiten sind seit langem bekannte tödliche Erkrankungen des zentralen Nervensystems. Sie werden auch transmissible spongiforme Enzephalopathien (TSE) genannt und kommen sowohl im Tierreich als auch beim Menschen vor. Die Prionenkrankheiten des Menschen kommen als sporadisch auftretende (Creutzfeldt-Jakob-Krankheit - CJD), als vererbte (erbliche Form der CJD, Gerstmann-Sträussler-Scheinker-Syndrom, letale familiäre Insomnie) und als erworbene, übertragene (neue Variante der CJD - vCJD, iatrogene CJD, Kuru) Erkrankungen vor. Mitte: A Möglicher Mechanismus der Transformation von PrPc (neuronales 30 kDa Protein) von seiner normalen α-Helixform zum PrPsc mit einer β-Faltblattstruktur. Das PrPsc ist Protease-resistent, korrumpiert die normale Zellfunktion und führt zu Aggregaten. B Mutationen in der PrP-Sequenz können den Prozess beschleunigen. C Schwammartige Veränderung des Cerebellums, D Plaque-Bildung. 29 Links: Modell der PrPc- und PrPsc-Struktur; rechts: PrPc-Präkursor (a), PrPc-Verankerung in der Membran (b) und Spezies-Variationen (c). 04/10/10 Pathobiologie - HS 2010 - Lektion 3 29 Konformationsänderung vom PrPc- zum PrPsc-Protein B.J. Bennion, V. Daggett, Clin. Chem. 2002; 48:2105-2114 Schnappschüsse aus einer Molecular dynamics simulation des Hamster-, Rind- und Human-Prions in zwei Modelldarstellungen, vor dem Start der dynamischen Simulationen (PrPc) und nach 10 ns bei tiefem pH, was zur PrPsc-Konformation führt. 30 04/10/10 Pathobiologie - HS 2010 - Lektion 3 30 Konversion des PrPc- zum PrPsc-Protein S.J. Collins et al, Lancet 2004;363:51-61 Normale Synthese von PrPc-Protein und Zellmetabolismus mit möglicher Konversion von PrPc zum PrPres (PrPsc). 31 04/10/10 Pathobiologie - HS 2010 - Lektion 3 31 (*) Nomenklatur der Prionkrankheiten Vorkommen bei Krankheitsformen Mensch Creutzfeldt-JakobKrankheit (4 Varianten) Tier Internationale Bezeichnung Creutzfeldt-Jakob Diasease Abkürzung Erstbeschreibung CJD (sCJD) (iCJD) (fCJD) (nvCJD) 1920 1921 1996 Gerstmann-SträusslerScheinker-Syndrom Gerstmann-SträusslerScheinker-Syndrom GSS 1913 Kuru Kuru Kuru 1957 Letale familiäre Schlaflosigkeit Fatal Familiar Insomnia FFI 1986 Traberkrankheit bei Schafen und Ziegen Scrapie Scrapie 1732 Übertragbare HirnDegeneration der Nerze (in Pelzfarmen) Transmissible Mink Encepahlopathy TME 1965 Chronisch zehrende Krankheit der Hirsche Chronic Wasting Disease CWD 1980 Schwammartige HirndeGeneration der RinderUnd rinderartigen Wiederkäuer (im Zoo) Bovine Spongiform Encephalopathy BSE 1987 Schwammartige HirndeGeneration der Katzen Feline Spongiform Encephalopathy FSE 1990 32 04/10/10 Pathobiologie - HS 2010 - Lektion 3 32 * Formen der Creutzfeldt-Jakob-Krankheit (1) Sporadische Creutzfeldt-Jakob-Krankheit (sCJD) Die sporadische CJD ist eine Erkrankung des Menschen in höherem Lebensalter (>60 Jahre). Die durch das Prion (PrPsc) ausgelösten Veränderungen im Gehirn führen zunächst zu psychischen Auffälligkeiten. Wesensänderung mit Gereiztheit, Gleichgültigkeit, bald fortschreitender Demenz, mit Gedächtnis- und Merkfähigkeitsausfällen, Kritiklosigkeit und Orientierungsstörungen sind feststellbar. Hinzu kommen neurologische Zeichen wie Gangunsicherheiten, Muskelzuckungen, erhöhte Muskelspannung, Lähmungen und Sehstörung. Die Krankheit schreitet schnell fort und endet unaufhaltsam tötdlich. Familiäre CJD (fCJD) Seltene autosomal-dominante Formen durch verschiedene Punktmutationen am Prionprotein- (PRHP-) Gen am Chr. 20 sind klinisch gekennzeichnet durch Lähmung, Kleinhirnsyndrome, Demenz und selten Muskelzuckungen. 33 04/10/10 Pathobiologie - HS 2010 - Lektion 3 33 * Formen der Creutzfeldt-Jakob-Krankheit (2) Iatrogen übertragene CJD (iCJD) Die CJD wird akzidentell übertragen durch kontaminierte menschliche Hornhaut, Duratransplantate, intrazerebrale Elektroden oder Stereotaxienadeln, Injektionen von aus Hypophysen gewonnenen Wachstumshormonen, fraglich auch Bluttransfusionen von CJD-Patienten. Sie hat Inkubationszeiten von 1.3 - 20 Jahren und geht mit progredienten Kleinhirnsymptomen und einer Krankheitsdauer bis zu 30 Jahren einher. Neue Variante der CJD (vCJD) Im Jahr 1996 wurden in England die ersten Fälle einer neuen Variante der CJD (vCJD) beschrieben. Sie tritt bei relativ jungen Menschen (Ø 29 Jahre) und zeigt einen ungewöhnlichen Krankheitsverlauf. Die Patienten werden zu Beginn der Erkrankung psychiatrisch auffällig, sind depressiv und ziehen sich zurück. Sie haben häufig Sensibilitätsstörungen. Die für die sCJD typischen Symptome Muskelzuckungen und Demenz entwickeln sich später, der klinische Verlauf ist insgesamt verlängert. Bei den vCJD-Patienten kann man das PrPsc in den lymphatischen Organen nachweisen. 34 04/10/10 Pathobiologie - HS 2010 - Lektion 3 34 (*) Zusammenhang zwischen BSE und vCJD Die räumliche und zeitliche Korrelation von BSE und vCJD in Grossbritannien liessen den Verdacht aufkommen, dass die vCJD durch Übertragung von BSE-Prionen hervorgerufen sein könnte. Inzwischen bestehen keine vernünftigen Zweifel mehr an der Übertragbarkeit von BSE auf den Menschen. Collins SJ et al., Lancet, 363:51-61, 2004 Zeitlicher Zusammenhang zwischen dem Auftreten von BSE und der vCJD, insbesondere mit Blick auf das Erscheinen von BSE-Tieren in der menschlichen Nahrungskette 35 04/10/10 Pathobiologie - HS 2010 - Lektion 3 35 * Klinik der Creutzfeldt-Jakob-Krankheit Der Weg der Prionen nach oraler Aufnahme vom MagenDarm-Trakt zum ZNS ist noch nicht restlos geklärt. Möglicherweise gibt es unterschiedliche Wege. Im Tierversuch vermehren sich die Prionen nach der Aufnahme aus dem Darm zunächst im lymphoretikulären System (Lymphknoten und Milz). Der weitere Weg in das Gehirn läuft vermutlich über die peripheren Nerven des Verdauungstraktes, ein weiterer Weg über das Blut ist jedoch nicht ausgeschlossen. Im Gehirn setzen die Prionen einen Prozess in Gang, der zu einer massiven Vermehrung von PrPsc und dessen Ablagerung im Gewebe führt. In der Folge gehen Nervenzellen zugrunde. Die CJD hat eine lange Inkubationszeit, d.h. es vergehen Jahre bis Jahrzehnte von der Infektion bis zum Auftreten der ersten Krankheitserscheinungen. Bei der Empfänglichkeit für die vCJD scheint auch eine genetische Veranlagung eine Rolle zu spielen. Menschen, die an einer bestimmten Stelle des Prionproteins bestimmte Aminosäuren tragen, scheinen für die Infektion empfänglicher zu sein oder früher zu erkranken. Replikation und Transport von Prionen 36 04/10/10 Pathobiologie - HS 2010 - Lektion 3 36 Diagnostische Kriterien für die CJD Jellinger, J Neurol Neurochir Psychiatr 6(1):9-18, 2005 37 04/10/10 Pathobiologie - HS 2010 - Lektion 3 37 Rekapitulation Echinokokkose s. Lektion 1 Beispiel eines Echinokokkose-Falles Ein 65-jähriger Bauer aus Ostanatolien, dem zwei Jahre zuvor eine Hydatidenzyste aus der Leber operativ entfernt worden war, wurde erneut ins Spital eingewiesen, da er an epileptischen Anfällen und einem rechtsseitigen Schwächegefühl litt. Die MRIUntersuchung ergab 3 zystische Läsionen mit 0.5-2 cm Durchmesser. Die Serodiagnose war positiv für Echinokokkose (Titer 1/320). Der Patient hat einen chirurgischen Eingriff abgelehnt, weshalb er mit Albendazol behandelt worden ist, mit positivem Ergebnis (siehe Bild). Aydin MD et al. Turk J Med Sci 2003; 33: 293-295 Ein anderer Fall mit fatalem Verlauf: Hakan T, Aker FV. Ann Neurosurg 2001; 1: 14-19 Links: Axiales MRI des Gehirns zeigt drei zystische Läsionen. Rechts: 18 Monate nach Behandlungsbeginn mit Albendazol (6 Zyklen à 4 Wochen mit 2x 400 mg/Tag) sind die Läsionen komplett verschwunden. Albendazol (Methyl-5-propylthio-2-benzimidazolcarbamat) Albenza®, Zentel® (GlaxoSmithKline) 38 04/10/10 Pathobiologie - HS 2010 - Lektion 3 38 * Hirn-Infektionen Eintrittspforten und Verbreitung von Mikroorganismen in verschiedene Organe Robbins Eintrittspforten ins ZNS: - Hämatogene Infektion (meist über Arterien, jedoch seltener auch über einen retrograden Weg, z.B. bei anastomotischen Verbindungen zwischen Venen des Gesichts und der zerebralen Zirkulation. - Direktes Eindringen von Mikroorganismen bei Traumen (z.B. Schädel-/Hirnverletzungen; jedoch selten). - Iatrogene Infektionen (z.B. bei Lumbalpunktion). - Lokale Ausbreitung von nahe gelegenen Infektionsherden (z.B. infizierter Zahn, infizierter Nasensinus, nach einem chirurgischen Eingriff u.a.). - Verbreitung über das periphere Nervensystem ins ZNS (bei bestimmten Viren wie z.B. Tollwut, Herpes zoster). 39 04/10/10 Pathobiologie - HS 2010 - Lektion 3 39 * Meningitis Robbins Entzündung der Hirn- bzw. Rückenmarkhäute (Meninges) Bakterielle Meningitis Virale Meningitis wird durch verschiedene Bakterien ausgelöst, und zwar überwiegen je nach Alter: Meist weniger fulminanter Verlauf der Infektion als bei bakterieller Meningitis. In 70% der Fälle kann ein Pathogen identifiziert werden, z.B. häufig Echoviren, Coxsackieviren, nicht-lähmungsauslösende Poliomyelitis-Viren. - bei Neugeborenen diverse E. coliStämme und B-Streptokokken - bei Kleinkindern Streptococcus pneumoniae - bei jungen Erwachsenen Neisseria meningitidis - im hohen Alter Streptococcus pneumoniae und Lysteria monocytogenes Dank Impfung ist die Infektionsrate durch Haemophilus influenzae stark zurückgegangen. Klinik: Kopfschmerzen, Photophobie, Reizbarkeit, Bewusstseinsstörungen, Nackensteifigkeit Bakterielle Meningitis: ein eitriges Exudat bedeckt den Hirnstamm und das Cerebellum; die weichen Hirnhäute sind verdickt. Antibakterielle Therapie 40 04/10/10 Pathobiologie - HS 2010 - Lektion 3 40 * (Meningo-)Enzephalitis Robbins Meningoenzephalitis: auf das Gehirn übergreifende Meningitis (Hirn-/Hirnhaut-Entzündung) Enzephalitis: Entzündung des Gehirns Chronische bakterielle Meningoenzephalitis Virale (Meningo-)Enzephalitis - Tuberkulose Die virale Enzephalitis ist eine Entzündung des Gehirnparenchyms und geht meist einher mit einer Entzündung der Hirnhäute. Einwanderung von Lymphozyten und Makrophagen, Bildung von Mikrogliaknoten. Folgende Viren können die Ursache sein: - Neurosyphilis - Neuroborreliose (Lyme-Krankheit) (Details siehe vorhergehende Kapitel) - Arboviren (z.B. Nil-Virus, Japan-B-Virus u.a.) werden durch Insekten übertragen - Herpes simplex Virus Typ-1, -2 (HSV-1 / HSV2) und Herpes zoster - Cytomegalovirus, Poliomyelitis-Virus, TollwutVirus - HIV A Herpes-simplex-Enzephalitis (HSV-1) mit ausgedehnter Zerstörung der unteren Frontallappen und der vorderen Temporallappen. B Nekrotisierende Entzündungsherde charakterisieren die Herpes-simplex-Enzephalitis. 41 04/10/10 Pathobiologie - HS 2010 - Lektion 3 41 (*) Pilz-Meningoenzephalitis Robbins Meningoenzephalitis, welche durch Pilzinfektionen ausgelöst wird, tritt meist als Spätfolge einer systemischen Pilzkrankheit bei immundefizienten Patienten auf (z.B. in Zusammenhang mit AIDS) Pilze, die eine Meningoenzephalitis auslösen können - Candida albicans (führt zu Invasion des Gehirnparenchyms) - Cryptococcus neoformans ( “ “ “; siehe Abbildung) - Aspergillus fumigatus (führt zu Vaskulitis) Das klinische Bild einer Invasion des Gehirnparenchyms durch Pilze zeigt besonders bei Candida multiple Mikroabszesse mit oder ohne Bildung von Granulom. A Kryptokokken-Infektion löst bei deren Ausbreitung im perivaskulären Gebiet zahlreiche Gewebeschädigungen aus. B In den Läsionen können bei entsprechender Vergrösserung die Kryptokokken nachgewiesen werden. 42 04/10/10 Pathobiologie - HS 2010 - Lektion 3 42 * Zerebrale Toxoplasmose Robbins Die zerebrale Toxoplasmose hat ebenfalls in Zusammenhang mit AIDS an Bedeutung zugenommen. Toxoplasma ist eine Protozoen-Gattung (Coccidia, Toxoplasmidia) mit der einzelligen Art Toxoplasma gondii. Zyklische Entwicklung in der Hauskatze (Schizo-, Gamo- und Sporogonie) und fakultativem Wirtewechsel (Trophozoit, Pseudo- und Terminalzysten mit bis zu 14’000 kleinen Toxoplasmen). Viszerale Toxoplasmose: ungünstige Prognose Zerebrale Toxoplasmose: lang dauernde Meningoenzephalitis mit Dauerschäden 43 04/10/10 B Freie T. gondii Trophozoiten im Thalamus (Immunfärbung) C T. gondii Pseudozyste Toxoplasma gondii ist ein obligat intrazellulärer Parasit, dessen Lebenszyklus aus sexueller Vermehrung (in Enterozyten von Katzen) und asexueller Vermehrung in Zwischenwirten besteht. Infektion des Zwischenwirts (z.B. Nager oder auch Menschen) durch Katzenkot (Oozysten) oder rohes Fleisch (Zysten). Weltweit verbreitet; oft asymptomatischer Verlauf der Infektion. Bei immungeschwächten Individuen kann sich eine viszerale oder zerebrale Toxoplasmose einstellen. Föten sind ebenfalls betroffen (bei massivem Befall Frühoder Totgeburt). Pathobiologie - HS 2010 - Lektion 3 43 Rekapitulation Anatomie des Gehirns Mutschler Liquor cerebrospinalis Der Liquor (Gesamtvolumen ca. 140 ml), der die Ventrikel und Zisternen sowie die Subarachnoidalund Spinalräume füllt, dient dem Schutz von Gehirn und Rückenmark vor mechanischen Einwirkungen und ermöglicht einen Druckausgleich im ZNS. Er zirkuliert im ventrikulären System und wird im Hirnstamm in den sog. Arachnoidalzotten resorbiert. Frontalschnitt des Gehirns Innere Liquorräume (dunkelblau) und äussere Liquorräume (hellblau) im Längsschnitt 44 04/10/10 Pathobiologie - HS 2010 - Lektion 3 44 (*) Cerebrales Ödem, Hernien, Hydrocephalus Cerebrales Ödem Hydrocephalus Vasogenes Ödem: bei defekter Blut-Hirnschranke entweicht vaskuläre Flüssigkeit in den Interzellulärraum des Gehirns. Bei Hydrocephalus wird Liquor im ventrikulären System exzessiv akkumuliert, und zwar meist wegen zu geringer Resorption, seltener wegen Überproduktion von Liquor. Tritt der Hydrocephalus vor dem Verschluss der Fontanella auf, resultiert eine Schädelvergrösserung, nach dem Verschluss der Fontanella hingegen ein erhöhter Hirndruck. Zytotoxisches Ödem: bei gen. Hypoxie/Ischämie nimmt das intrazelluläre Zell-Volumen zu. Robbins Erhöhter Hirndruck, Hernien Erhöhter Hirndruck ist charakterisiert durch einen Druckanstieg auf >200 mm. Ausgelöst wird dieser Zustand durch Zunahme des intracranialen Volumens (Tumore, Ödeme, Abszesse, Blutungen), was zu einer Kompression der Venen und einer druckbedingten Verlagerung von CSF-Flüssigkeit führt. Die Folge ist die Bildung von Hernien. 45 04/10/10 Pathobiologie - HS 2010 - Lektion 3 45 (*) Traumen Robbins Die anatomische Lokalisation und die geringe Regenerationsfähigkeit des Gehirns sind Grund für die massiven Auswirkungen eines Hirntraumas. Nekrose von mehreren cm3 Hirnparenchym kann ohne klinisch sichtbare Folgen bleiben, zu sehr starken Einschränkungen führen (Rückenmark) oder letal sein (Hirnstamm). Es gibt drei Arten von Schädigungen nach einer traumatischen Einwirkung im Kopfbereich: - Schädelfrakturen - Schädigungen des Gehirns - vaskuläre Schädigungen (z.B. Hirnblutungen) B Akute Kontusionen an beiden Temporallappen (mit Blutungen) nach Schädelhirntrauma. C Entferntere Prellungen im unteren Teil des Gehirns. Die gelbe Farbe wird auch als Plaque jeaune bezeichnet. A Multiple Kontusionen (Prellungen) im Hirnparenchym des Frontallappens, Cerebellums und innerer Oberflächen nach einem Schädelhirntrauma. 46 04/10/10 Pathobiologie - HS 2010 - Lektion 3 46 (*) Intrakranielle Blutungen Robbins Epidurales Hämatom (links) wird ausgelöst durch die Ruptur einer HirnhautArterie, meist im Zusammenhang mit einer Schädelfraktur: Ansammlung von arteriellem Blut zwischen der Dura mater und dem Schädel. Subdurales Hämatom (rechts) wird verursacht durch eine Schädigung von verbindenden Venen (bridging veins), welche über den Subarachnoidalraum mit dem oberen sagittalen Sinus verbunden sind: bei starken Traumen (besonders bei älteren Personen) kann es bei den relativ starr verankerten Venen zu einer Ruptur kommen, was zu einer Ansammlung von venösem Blut zwischen der Hirnhaut und der Dura mater führt. A Grosses subdurales Hämatom B Im Schnitt zeigt sich die starke Kompression der betroffenen Hirnregion 47 04/10/10 Epidurales Hämatom (zwischen Dura mater und Schädelknochen) Pathobiologie - HS 2010 - Lektion 3 47 (*) Cerebrovaskuläre Krankheiten Robbins Cerebrovaskuläre Krankheiten gliedern sich in: - Hypoxien, Ischämien und Infarkte (gestörte Blutzufuhr bzw. Oxygenierung des ZNS) - Hämorrhagien (Blutungen nach Ruptur von Blutgefässen im Gehirn) Hypoxie und Ischämie Die Ischämie kann das ganze Gehirn betreffen (z.B. aufgrund einer Hypotonie nach Herzstillstand oder Schock) und heisst dann globale cerebrale Ischämie. Ist nur ein bestimmter Teil des Gehirns betroffen (wegen regional unterbrochener Blutzufuhr z.B. durch Embolie oder thrombotischem Arterienverschluss oder aufgrund einer Vaskulitis), spricht man von einer fokalen cerebralen Ischämie. Infarkt Es wird unterschieden zwischen - hämorrhagischen (“roten”) Infarkten (typisch für Embolien) (Bild A: die Blutungen in den Infarktregionen sind deutlich zu sehen) und - nicht-hämorrhagischen (“bleichen”) Infarkten (typisch für Thrombosen) (Bild C: es sind keine Blutungen um die punktierten Infarktzonen zu sehen). 48 04/10/10 Pathobiologie - HS 2010 - Lektion 3 48 (*) Cerebrovaskuläre Krankheiten Robbins Hämorrhagien (Blutungen) - Intracerebrale Hämorrhagien treten gehäuft in der späteren Lebensphase auf (Peak: um 60 Jahre). Verursacht werden sie meist durch Ruptur eines kleinen Gefässes im Hirnparenchym, oft aufgrund einer Hypertonie (welche die Ausbildung von Mikroaneurysmen fördert). Das Bild zeigt eine massive Blutung wegen Hypertonie, die sich in den lateralen Ventrikel ergossen hat. - Subarachnoidale Hämorragien und ruptierte Aneurysmen (Gefässausweitung) Subarachnoidale Blutungen werden oft durch eine Aneurysmen-Ruptur verursacht. Im Circulus arteriosus cerebri (circle of Willis), einer kreisförmigen Gefässverbindung an der Hirnbasis, können sich gehäuft Aneurysmen bilden, die aufbrechen können. 49 04/10/10 Aneurysma der vorderen cerebralen Arterie Pathobiologie - HS 2010 - Lektion 3 49 Rekapitulation Vegetatives Nervensystem 1. Parasympathikus 2. Sympathikus Mutschler Ursprünge der präganglionären Neuronen Lage der vegetativen Ganglien Neurotransmitter Steuerung der Zielorgane 3. Darmnervensystem 50 04/10/10 Pathobiologie - HS 2010 - Lektion 3 50 Vegetative Fehlregulationen I. Krankheiten oder Läsionen des zentralen Nervensystems A. Primäres Versagen vegetativer Regulationen Fölsch III. Änderungen der Aktivität in vegetativen Neuronen durch Pharmaka A. Abnahme der Aktivität in sympathischen Neuronen B. Sekundäres Versagen vegetative Regulationen 1. Zentrale Wirkungen 1. Zentrale Hirnläsionen (Clonidin, Methyl-Dopa, Reserpin, Barbiturate, Anästhetika) 2. Rückenmarkläsionen 2. Periphere Wirkungen 3. Infektionen des zentralen Nervensystems (α-, β-Adrenozeptor-Blocker) B. Zunahme der Aktivität in sympathischen Neuronen II. Erkrankungen des peripheren vegetativen Nervensystems (Amphetamine, Aufnahmeblocker für Noradrenalin (z.B. Imipramin), MAO-Hemmer) A. Erkrankungen ohne sensorische Neuropathie C. Åbnahme der Aktivität in parasympathischen Neuronen 1. Akute und subakute autonome Neuropathie (Antidepressiva, Tranquillizer (Phenothiazine), Antiarrhythmica, Anticholinergica) 2. Botulismus B. Erkrankungen kombiniert mit sensorischen Neuropathien 1. Metabolische Neuropathien D. Zunahme der Aktivität in parasympathischen Neuronen (Cholinomimetica, Anticholinesterasen) 2. Ernährungsbedingte Neuropathien 3. Toxische Neuropathien IV. Altersabhängige Veränderungen vegetativer Regulationen 4. Neuropathien bei Autoimmunerkr. und Entzündungen 5. Paraneoplastische Neuropathien 6. Hereditäre sensorische und autonome Neuropathien 51 04/10/10 Pathobiologie - HS 2010 - Lektion 3 51 (*) Motorische Störungen Fölsch Akute Läsionen deszendierender Bahnen führen zu Paresen, die initial mit schlaffem, im weiteren Verlauf mit spastisch erhöhtem Muskeltonus einhergehen. Während nach Unterbrechung peripherer Nerven eine axonale Regeneration mit funktioneller Restitution die Regel ist, findet im ZNS keine funktionell relevante Regeneration durchtrennter Axone statt. Oberes Bild: Zelluläre Reaktionen nach Axotomie peripherer Nerven Unteres Bild: Zelluläre Reaktionen nach Axotomie im ZNS. Es kommt zum Zelltod zahlreicher Neuronen. Die überlebenden chromatolytischen Nervenzellen können eine axonale Regeneration induzieren. Diese bleibt jedoch abortiv, da sich das von Mikrogliazellen, Astrozyten und Oligodendrozyten erzeugte Milieu distal der Läsion wachstumshemmend auswirkt. Die Wachstumsfortsätze der Neuronen können deshalb nur wenige mm aussprossen, sodass die Zielregion nicht erreicht wird und eine Restitution ausbleibt. 52 04/10/10 Für weitere Aspekte von motorischen Störungen siehe auch Lektion 5. Pathobiologie - HS 2010 - Lektion 3 52 (*) Amyotrophe Lateralsklerose (ALS) Amyotrophe Lateralsklerose (Motor Neuron Disease; Lou-Gehrig-Syndrom, früher auch Charcot-Krankheit, kurz: ALS) Die Amyotrophe Lateralsklerose ist eine degenerative Krankheit des motorischen Nervensystems, bei der es im Verlauf zu einer zunehmenden Degeneration des ersten und zweiten Motoneurons (welche die Willkürmotorik steuern) in variablen Ausmass kommt. Der Begriff “Amyotrophe Lateralsklerose” wurde 1969 von Charcot und Joffroy geprägt. Die Amyotrophe Lateralsklerose hat eine Inzidenz von 1−3 Fällen/100’000, tritt mehrheitlich als sporadische Form (90−95%) und seltener als vererbte Form (5−10%) auf und ist charakterisiert durch eine fortschreitende muskuläre Schwäche der Skelettmuskulatur, die sich meist ohne sensible Symptome und ohne Beteiligung der Sinnesorgane (Auge, Gehör, Geschmack, Geruch) bemerkbar macht. Das heisst, dass in der Regel eine Beteiligung glatter Muskeln, wie Eingeweidemuskulatur, Schliessmuskeln oder eine Beeinträchtigung der Blasenfunktion nicht zum Krankheitsbild gehören. Es kommt mit der Zeit zu einer irreversiblen Muskellähmung am ganzen Körper und schliesslich auch der Atemmuskulatur. Ausserdem sind Lungenentzündungen häufig, da die Lungen aufgrund der Lähmung der Atemmuskulatur nicht mehr gut belüftet werden, die Erkrankten nicht mehr richtig schlucken können und so Speisen in die Atemwege gelangen können. Die Überlebenszeiten sind je nach Unterform verschieden, meist sterben die Patienten jedoch innerhalb weniger Monate bis Jahre. Subtypen der ALS Progressive Bulbärparalye: Die selektive Beteiligung von Sprech-, Schluck- und Kaumuskulatur ist initiales Symptom bei ca. 20% der ALS-Patienten. Typischerweise schreitet die Erkrankung im weiteren Verlauf über die obere zur unteren Extremität fort. Selten bleibt die Extremitätenmuskulatur ausgespart. Primäre Lateralsklerose: 2−4% der ALS-Patienten zeigen initial und im Verlauf nur Zeichen des ersten Motoneurons. Das Manifestationsalter liegt zwischen 50 und 55 Jahren, der Verlauf kann langsam sein. Einige ALS-Patienten entwickeln im Verlauf jedoch auch Zeichen des zweiten Motoneurons. Flail-arm Syndrom: Das Flügelarm-Syndrom zeigt sich als relative symmetrische Beteiligung des Schultergürtels und von Oberarm- und Handmuskulatur mit positiven Pyramidenbahnzeichen. Männer sind deutlich häufiger betroffen (9:1). 53 04/10/10 Hemiplegische Mills-Variante: Die initialen Symptome zeigen sich auf nur einer bzw. betont auf einer Körperhälfte. Pathobiologie - HS 2010 - Lektion 3 53 (*) Amyotrophe Lateralsklerose (ALS) Pathobiologie und Pathogenese der ALS Die Ursche des fortschreitenden Verlustes von Motoneuron-Zellen in Grosshirn, Hirnstamm und Rückenmark mit einer Degeneration der sog. Pyramidenbahn bei der Amyotrophen Lateralsklerose ist noch kaum verstanden; eine Beziehung zu verschiedenen Proteinen (z.B. Neurofilamente, Peripherine) und zur Superoxid-Dismutase (SOD1) wird derzeit intensiv untersucht. Die Kenntnisse zur Pathophysiologie die Erkrankung basieren vor allem auf Untersuchungen eines Maus-Tiermodells, das Mutationen im SOD1-Gen trägt. Diese Mäuse entwickeln eine Muskelschwäche und sterben an einer fortschreitenden Lungenfunktionsstörung. In der Pathogenese der Erkrankung könnten immunologische und entzündliche Faktoren, oxidativer Stress über freie Radikale, Glutamat-vermittelte Exzitotoxizität und andere Gründe eine Rolle bei der Entwicklung der ALS spielen. Veränderungen der Motoneuronen bei ALS und involvierte Proteine Die ALS ist charakterisiert durch zahlreiche Einschlüsse (inclusions) in den Motoneuronen, die durch verschiedene Färbungen nachgewiesen werden (A-C). Die Hämatoxylin-Färbung zeigt Bunina-Körperchen (D), Peripherin-Färbung axonale Spheroide (E) und diffuse Perikarya (F). Mit der kombinierten Hämatoxylin-Luxol-Eosin-Färbung werden Hyalin-Konglomerate nachgewiesen (G), und die Neurofilament-Färbung zeigt zeigt ebenfalls HyalinKonglomerate (H). In neuronalen Perkarya finden sich hyperphosphorylierte Neurofilamente (I). S. Xiao et al, Biochim. Biophys. Acta 2006, 1762: 1001-1012 Veränderungen im Rückenmark Die Wurzelfortsätze aus dem Rückenmark sind bezüglich motorischen Fasern reduziert (oben), verglichen mit den sensorischen Fortsätzen, welche normal ausgeprägt sind (unten). Involvierte Proteine: - Neurofilamente (intermediäre Filamente) - Peripherine (intermediäre Filamente) - Superoxid-Dismutase (SOD1) 54 04/10/10 Pathobiologie - HS 2010 - Lektion 3 54 (*) Superoxid-Dismutase und ALS Die Ätiologie / Pathobiochemie der meisten Formen und Fälle der ALS ist unbekannt. In ca. 2% der Fälle wird die ALS in Zusammenhang mit Mutationen der Zn/Cu Superoxid-Dismutase 1 (SOD1) gebracht. Ein Maus-Tiermodell mit mutierter SOD1 liefert Einblicke in mögliche pathobiochemische Mechanismen der ALS. Dabei ist die durch die Mutation ausgelöste Toxizität der SOD1 jedoch noch nicht in allen Details geklärt, weshalb es verschiedene Pathogenese-Modelle gibt: 55 04/10/10 SOD1-Proteinaggregate, die wegen Mutationen und dadurch veränderter Faltung entstehen, führen zur Ko-Aggregation weiterer zytoplasmatischer Proteine, wodurch die Proteasomen teilweise inhibiert und in der Folge auch Chaperone negativ beeinflusst werden. Schliesslich kommt es zu einer Dysfunktion von Mitochondrien und anderen Organellen. S. Boillée et al, Neuron 2006, 52: 39-59 SOD1-Proteinaggregate werden präferentiell in Mitochondrien von betroffenen Zellen importiert. Dabei wird der Elektronentransport in Mitochondrien gestört und die ATP-Bildung unterbrochen. Ferner wird der Mitochondrien-kontrollierte CalciumHaushalt beeinflusst sowie die Apoptose-Prozesse z.T. blockiert. Pathobiologie - HS 2010 - Lektion 3 55 Superoxid-Dismutase und ALS Stadien der Motoneuron-Degeneration and Glia-Aktivierung in der durch SOD1-Mutanten verursachten ALS S. Boillée et al, Neuron 2006, 52: 39-59 Vier Stadien werden unterschieden (Normalzustand, frühe Phase, symptomatische Phase und Endzustand). Die Toxizität wird durch eine Kombination von Schadenereignissen ausgelöst, welche direkt am Motoneuron stattfinden. Ein sich auf nicht-neuronale Nachbarzellen (z.B. Astrozyten, Microglia) ausbreitender Schaden amplifiziert den initialen Schaden am Motoneuron, indem sich die Krankheit auf andere Motoneuronen ausbreitet. Die spezielle Empfindlichkeit von Motoneuronen auf mutierte SOD1 basiert auf den speziellen funktionellen Eigenschaften dieser Zellen (grosse Zellen mit grosser Biosynthese-Fracht, hoher Feuerrate und Reaktion auf GlutamatInputsignale) und auf Schäden an den sie umgebenden Unterstützungszellen. 56 04/10/10 Pathobiologie - HS 2010 - Lektion 3 56 Mögliche Therapien für ALS S. Boillée et al, Neuron 2006, 52: 39-59 1. Therapien mit Wachstumsfaktoren Allgemeine Therapie mit verschiedenen Wachstumsfaktoren (z.B. IGF-1, BDNF) hat keine Erfolge gezeitigt. In Tiermodellen waren viral-mediierte Applikation von Wachstumsfaktor-Genen in Motoneuronen bzw. Infusion von Wachstumsfaktoren direkt ins Gehirn oder Rückenmark erfolgreicher. Besonders intensiv wird vaskulärer endothelialer Wachstumsfaktor (VEGF) untersucht, weil Mutanten des VEGF-Gens mit ALS assoziiert sein können. 2. Gentherapie mit siRNA Das RNA Silencing mittels siRNA wird intensiv erforscht, um SOD1-Genmutanten damit auszuschalten. Wiederum im Tiermodell haben sich drei Vorgehensweisen als erfolgreich erwiesen: • Lentivirus mit siRNA (gegen das mutierte SOD1-Gen) wurden in verschiedene Muskeln eines Versuchstiers appliziert. Durch retrograden Transport des Lentivirus in die Motoneuronen kam es zu einer Reduktion der Synthese von mutiertem SOD1 und gleichzeitig zu einer erheblichen Verzögerung des Krankheitsausbruchs. • Analoges Konstrukt wird ins Rückenmark appliziert. • Direkte Icv-Applikation von synthetischen AntisenseOligonukleotiden. Damit kann der SOD1-Gehalt um 50% gesenkt und die Progression der Krankheit wesentlich verlangsamt werden. 57 04/10/10 Pathobiologie - HS 2010 - Lektion 3 57 * Demyelinisierende Krankheiten Robbins Demyelinisierende Krankheiten des ZNS sind erworbene Schädigungen des Myelins, wobei die Axone erhalten bleiben. Klinisch manifestiert sich der Myelinverlust mit einer beeinträchtigten Leitung der elektrischen Impulse entlang der Axone. Da das ZNS das Myelin in nur geringem Umfang regenerieren kann, treten Sekundärschäden an Axonen ein und der Krankheitsverlauf ist progredient. Multiple Sklerose (MS) Ätiologie und Pathogenese von MS sind noch unklar, obwohl eine Reihe von genetischen, immunologischen und Umweltfaktoren identifiziert werden konnten. Betroffen von MS ist etwa 1:1000 Personen, meist in der Altersgruppe 20-50 Jahre. Klinisch zeigen sich zeitlich getrennte Episoden von neurologischen Defiziten, die mit räumlich getrennten Läsionen in den Nervenscheiden in Zusammenhang gebracht werden können. Der Verlauf der Krankheit ist abwechselnd progredient und stillstehend oder mit partieller Remission. Andere Krankheiten mit Demyelinisierung: z.B. akute nekrotisierende hämorrhagische Enzephalomyelitis u.a. Multiple Sklerose Braune Plaques im occipitalen Horn des lateralen Ventrikels Luxol fast blue-Färbung für Myelin zeigt Làsionen (A, B). Die Axone (C) hingegen sind relativ gut erhalten. 58 04/10/10 Pathobiologie - HS 2010 - Lektion 3 58 Genetisch bedingte ZNS-Defekte Robbins Beispiele: - Prader-Willi-Syndrom - Angelmann-Syndrom Imprinting: Funktionelle Stilllegung des einen von den beiden Allelen. In diesem Fall: Auf dem mütterlichen Chromosom werden jene Gene, deren Defekt das Prader-Will-Syndrom auslösen würden, stillgelegt. Auf dem väterlichen Chromosom sind es jene, die das AngelmannSyndrom auslösen würden. Bei defektem väterlichen Chromosom führt dies zum Prader-Willi-Syndrom, bei defektem mütterlichen Chromosom zum Angelmann-Syndrom. Chromosom 15 Prader-Willi-Syndrom: Mentale Retardation, kurze Statur, Hypotonie, Adipositas, kleine Hände und Füsse, Hypogonadismus. Angelmann-Syndrom: ähnlich wie Prader-Willi-Syndrom, jedoch zusätzlich Gangunsicherheit, Krämpfe, unwillkürliches Gelächter. 59 04/10/10 Pathobiologie - HS 2010 - Lektion 3 59 (*) Hirntumoren Robbins Hirntumoren treten bei 10-17 Personen pro 100’000 auf (intracranial) und bei 1-2 pro 100’000 (intraspinal). ZNS-Tumoren betreffen 20% der Tumorerkrankungen im Kindesalter. Allgemeines Astrozytome und Glioblastome Der Unterschied zwischen benignen und malignen Tumoren im Gehirn ist klinisch weniger klar als in anderen Organen, da auch benigne Tumoren das Gehirn infiltrieren und Schäden verursachen können. Diese betreffen etwa 80% der Hirntumoren im Erwachsenenalter. Klinische Symptome sind Krämpfe, Kopfweh und verschiedene neurologische Defizite. Bei kombinierter Chemo- und Radiotherapie ergibt sich eine Überlebenszeit von 8-10 Monaten. Hirntumoren können chirurgisch oft nicht entfernt werden, ohne andere wichtige Strukturen zu zerstören. Die durch Hirntumoren verursachten (lethalen) Schäden stehen oft auch nicht in Zusammenhang mit der histologischen Klassifikation des Tumors. Auf der anderen Seite metastasieren Hirntumoren äusserst selten ausserhalb des Gehirns. Ausdifferenziertes Astrozytom (Gliom) A. Der rechte frontale Tumor weist ausgedehnte Gyri (Windungen) auf, die zu einer Verflachung geführt haben (Pfeile). B. Ausgedehnte weisse Substanz (linke Hemisphäre) und verdicktes Corpus callosum. 60 04/10/10 Pathobiologie - HS 2010 - Lektion 3 60 (*) Hirntumoren Robbins Typen von Hirntumoren 1. Neuroepitheliale Tumoren: - Gliome (80%) - Neuronale Tumoren (Gangliozytom, Gangliogliom) - Astrozytome - Oligodendrogliom - Ependymom - Medulloblastom (Kinder) - anaplastisches Astrozytom - fibrilläres (differenziertes) Astrozytom - Mischformen; andere - Glioblastom 2. Tumoren der kranialen und spinalen Nerven: - Neurinom - Neurofibrom (Schwannom) 3. Tumoren der Meningen: - Meningeome - Hämangioblastom - Meningeale Sarkome 4. Andere Tumoren (Hämatopoetische Tumoren, Keimzelltumoren, Zysten, Hypophysentumoren, Kraniopharyngeome) 5. Metastasen 61 04/10/10 Neurinome (Schwannome). A: Bilaterales Schwannom des XIII. Nervs (N. vestibulocochlearis). B: Histopathologisches Bild. Pathobiologie - HS 2010 - Lektion 3 61 Hirntumoren: Gliome Robbins Beispiele verschiedener Gliome Glioblastom (Glioblastoma multiformis). Aggressiver Tumor mit vielen hoch malignen Tumorzellen (Pseudopalisadenbildung) Pilozytisches Astrozytom im Cerebellum, langsam wachsend, wenig aggressiv (tritt im Kindes- und Jugendalter auf). A: Grosse Tumorläsion, sichtbar gemacht mit CT 62 04/10/10 B: Glioblastom (nekrotische, hämorrhagische, infiltrierende Masse) Pathobiologie - HS 2010 - Lektion 3 Ependymom. A: Tumor wächst im vierten Ventrikel und infiltriert und drückt auf umgebendes Gewebe. B: Histopathologisches Bild. Die klinische Prognose ist normalerweise schlecht. 62 Hirntumoren: Medulloblastome Robbins Medulloblastom Dieser Tumor tritt vor allem bei Kindern auf, und zwar ausschliesslich im Cerebellum. Der Tumor ist häufig undifferenziert und sehr malign. Unbehandelt sterben die Patienten rasch. Der Tumor ist jedoch sehr empfindlich auf Radiotherapie, besonders als Folgetherapie nach einer möglichst totalen Tumorexzision. Genetisch lässt sich dieser Tumor mit einer Deletion auf dem kurzen Arm des Chromosoms 17 korrelieren. Medulloblastom A: CT mit Kontrastmittel: Tumorläsion in der hinteren Fossa. B: Sagittaler Schnitt mit Medulloblastom, welches die obere Hälfte des Cerebellums zerstört. C: Mikroskopisches Bild eines Medulloblastoms. 63 04/10/10 Pathobiologie - HS 2010 - Lektion 3 63 Hirntumoren: Meningeome Robbins Meningeom Meningeom Meningeome sind vorwiegend benigne Tumoren des Erwachsenen, die im allgemeinen an die Dura angeheftet sind und aus Meningothelialzellen der Arachnoidea (Spinnengewebshaut des Gehirns und Rückenmarks) entstehen. A. Parasagittales multilobuläres Meningeom, das an die Dura mater angeheftet ist und eine Kompression der darunter liegenden Hirnstrukturen zur Folge hat. Meningeome wachsen im Allgemeinen langsam. Klinisch sind die Symptome oft diffus oder resultieren aus der Kompression der darunter liegenden Hirnstruktur. B. Meningeom mit gequirltem Muster von Zellwachstum und Psammomakörpern (hyalinisierte, zwiebelschalenartige Zellanordnung mit sekundären Kalkinkrustationen). Metastasen anderer Tumoren Metastasen im Gehirn, die von anderen primären Tumoren stammen, betreffen etwa 50% von hospitalisierten HirntumorPatienten. Etwa 80% der Metastasen entstammen Primärtumoren der Lungen, Brust, Haut (Melanom), Nieren und des Gastrointestinaltraktes. Gewisse seltene Tumoren, wie z.B. das Choriocarcinom, metastasieren im Gehirn, während häufigere Tumoren, wie z.B. das Prostatakarzinom, keine Hirnmetastasen bildet. 64 04/10/10 Pathobiologie - HS 2010 - Lektion 3 64 Epilepsie Neben dieser links dargestellten generalisierten Epilepsie gibt es auch patielle (= fokale) Epilepsien, die durch eine Funktionsstörung an einem bestimmten Punkt im Gehirn entstehen (= epileptischer Fokus). In vielen Fällen können solche Patienten mit Antiepileptikas erfolgreich behandelt werden, indem dank diesen die Entstehung eines Anfalles verhindert wird. Bei einer gesteigerten P-Glykoprotein-Medikamenten-EffluxPumpe (in einem Teil der Patienten) sprechen die Medikamente jedoch nur ungenügend oder nicht an. Was ist eine Epilepsie? Die Epilepsie gehört zu den am häufigsten auftretenden neurologischen Erkrankungen. Bei den Symptomen einer Epilepsie handelt es sich um eine vorübergehende Hirnfunktionsstörung, d.h. eine Störung des Gleichgewichts zwischen Erregungs- und Bremsvorgängen größerer Nervenzellenverbände des Gehirns. Derzeit sind in Deutschland zwischen 600’000 und 800’000 Menschen an Epilepsie erkrankt, jährlich kommen ca. 30’000 neue Fälle dazu. Epilepsie kann jeden in jedem Lebensalter treffen. Der epileptische Anfall: Nicht immer kommt es zu plötzlichem Bewusstseinsverlust, unkontrollierten Stürzen, rhythmische Körperzuckungen, sondern oft zu differenzierter auftretenden Reaktionen. 65 04/10/10 Pathobiologie - HS 2010 - Lektion 3 65 Epilepsie Neben dieser links dargestellten generalisierten Epilepsie gibt es auch patielle (= fokale) Epilepsien, die durch eine Funktionsstörung an einem bestimmten Punkt im Gehirn entstehen (= epileptischer Fokus). In vielen Fällen können solche Patienten mit Antiepileptikas erfolgreich behandelt werden, indem dank diesen die Entstehung eines Anfalles verhindert wird. Bei einer gesteigerten P-Glykoprotein-Medikamenten-EffluxPumpe (in einem Teil der Patienten) sprechen die Medikamente jedoch nur ungenügend oder nicht an. 66 04/10/10 Zusätzliche Details: Die Symptome der Epilepsie - die epileptischen Anfälle - sind sehr vielfältig. Sie können von Bruchteilen von Sekunden bis zu einigen Minuten dauern. Das Bewusstsein kann während eines Anfalls erhalten bleiben oder gestört sein. Manche Anfälle werden von Laien gar nicht als solche erkannt. Bei anderen kommt es zu heftigen Zuckungen, unter Umständen auch zum Sturz. Manche Anfälle treten nur aus dem Schlaf, andere nur nach dem Aufwachen auf. Es werden mehr als 30 Arten epileptischer Anfälle und ebenso viele Arten epileptischer Syndrome (Kombination bestimmter Formen epileptischer Anfälle in Verbindung mit anderen Merkmalen, z.B. einem Auftreten der Anfälle in der frühen Kindheit, charakteristischen EEG-Veränderungen etc.) unterschieden. Die Ursachen der Epilepsie sind vielfältig. Häufig spielen Schädigungen des Hirngewebes eine Rolle, bedingt durch z.B. Sauerstoffmangel während der Geburt oder Durchblutungsstörungen. Auch Tumore oder Unfälle, bei denen das Gehirn verletzt wird, können eine Epilepsie verursachen. Epilepsie ist keine Erbkrankheit - man weiß jedoch, dass eine erhöhte Neigung des Gehirns, mit Anfällen zu reagieren, vererbt werden kann. Nicht jeder, der diese Neigung hat, bekommt aber tatsächlich Anfälle. In der Regel kommen zusätzliche Faktoren, wie z.B. eine strukturelle Schädigung des Hirngewebes hinzu, die aber so minimal sein kann, dass sie mit den gängigen Untersuchungsmethoden nicht nachweisbar ist. Dies ist ein Grund, warum bei fast 50% der Betroffenen die genaue Ursache der Epilepsie im Dunkeln bleibt. Aber auch in Fällen, wo die Ursache einer Epilepsie im Prinzip bekannt ist, ist letztlich nicht geklärt, wie und wann es zu der für einen epileptischen Anfall charakteristischen abnormen Entladung von Hirnzellenpopulationen kommt. Pathobiologie - HS 2010 - Lektion 3 66 Einzelne epileptische Anfälle & Epilepsien Fölsch Gelegenheitsanfälle Einzelne epileptische Anfälle oder Gelegenheitskrämpfe sind von den Epilepsien und vom epileptischen Syndrom abzugrenzen. Der epileptische Anfall stellt eine zunächst unspezifische Reaktion auf eine Reizung des zentralen Nervensystems dar. Diese kann so mild aussehen wie ein akkumulierter Schlafentzug oder eine Narkoseausleitung. Anfälle können aber auch eine beginnende Hirnhautentzündung (Enzephalitis) begleiten. Derartige Gelegenheitsanfälle sistieren beim Verschwinden der Ursache. Sie treten bei einer Lebensspanne von 80 Jahren mit 10% Wahrscheinlichkeit einmal auf. Epilepsien Epileptische Anfälle treten wiederholt auf, ohne dass eine akute Ursache vorliegt. Epilepsie ist eine der häufigsten neurologischen Erkrankungen (0.6-0.8% der Bevölkerung ist davon betroffen). Generalisierte Anfälle erfassen den grössten Teil der Hirnrinde, während fokale Anfälle eine begrenzte Ausdehnung haben. Bei diesen hängen die Auffälligkeiten entscheidend vom Entstehungsort der Anfälle ab. Bewusstseinsstörungen können mit den Anfällen einher gehen. Absence-Epilepsien (Petit Mal) gehören zu den generalisierten Formen, ebenso tonisch-klonische Anfälle (tonische Muskelverkrampfungen mit klonischen Zuckungen; Grand Mal). Epileptische Syndrome Sind bestimmte Epilepsieformen, die entweder charakteristische EEG-Befunde aufweisen und/oder eine bstimmte Altersabhängigkeit der Krankheitsmanifestation oder aber auch eine bestimmte Prognose zeigen. Die Absence-Epilepsie des Schulalters zählt dazu. 67 04/10/10 Pathobiologie - HS 2010 - Lektion 3 67 Epileptischer Anfall Charakteristiken einer Abszenz beim epileptischen Syndrom: das EEG zeigt einen klassischen 3/s Spikewave-Verlauf. Verharr-Reaktion mit Bulbusdeviation nach oben. Fölsch Charakteristiken eines komplex-partiellen Anfalls: starke Hippocampus-Aktivität. Der Patient zeigt orale Automatismen mit Schmatzen und Lecken, einem starren Blick und häufig VerharrReaktionen. Die MRI-Aufnahme weist auf eine AmmonshornSklerose (AHS) links hin. 68 04/10/10 Pathobiologie - HS 2010 - Lektion 3 68 Ammonshornsklerose Fölsch Verschaltungsschema des Hippocampus (oben). Die Histologie (unten) zeigt einen segmentalen Nervenzellverlust im CA1-Sektor (Pfeil) bei Ammonshornsklerose (AHS). SC Schaffer-Kollateralen. CA1 und CA3 Felder des Ammonshorns, Hi Hilus der Area dentata, DG Gyrus dentatus, Sub Subikulum, mf Moosfasern, pp Tractus perforans. Epilepsien mit temporo-mesialem Fokus zeigen häufig eine Ammonshornsklerose mit segmentalem Zellverlust, Gliose und axonaler Reorganisation. Epilepsien mit neokortikalem Fokus haben häufig eine strukturelle Störung als Grundlage, z.B. Tumor, Entwicklungsschädigung oder Trauma. 69 04/10/10 Pathobiologie - HS 2010 - Lektion 3 69 Neurotransmittersysteme und Epilepsie Fölsch Veränderungen des neuronalen Netzwerks entstehen durch neuronalen Zelltod, Neubildung von Nervenzellen und axonale Reorganisation. Funktionell führt sowohl die axonale Reorganisation als auch der Verlust bzw. die Neubildung bestimmter Nervenzelltypen zu einer tiefgreifenden Umorganisation der Verknüpfung überlebende Nervenzellen. Das Bild zeigt schematisch verschiedene Veränderungen im Hippocampus bei AHS. Links: Normalzustand. Rechts: chronische Temporallappenepilepsie. Neue (pathologische) Axonkollateralen sind rot dargestellt. Hemmende GABAerge Synapsen sind mit einem (-), erregende glutaminerge mit einem (+) gekennzeichnet. Oberer Teil: Körnerzellen bilden bei AHS rekurrente, erregende Verbindungen von Axonkollateralen zu apikalen Körnerzelldendriten aus (Moosfaserrouting). Mittlerer Teil: Sprouting betrifft auch die Axone von hemmenden GABAergen Interneuronen. Unterer Teil: Möglicherweise erhalten Interneurone bei chronischer Epilepsie weniger erregende Eingänge durch Zellverlust von afferenten Neuronen. 70 04/10/10 Pathobiologie - HS 2010 - Lektion 3 70 (*) Anti-Epileptika ▪ Generalisierte tonisch-klonische Anfälle (Grand-mal-Anfälle, GM) und einfach und komplexe fokale Epilepsien werden mit derselben Medikamentengruppe behandelt. Aus mehreren mit grossem Patientengut durchgeführten Untersuchungen geht hervor, dass folgende etwa gleich wirksam sind (führen in ca. 80% zur Anfallsfreiheit): ▪ Carbamazepin (alterantiv: Oxcarbacepin) ▪ Valproat ▪ Phenytoin (neu: Fosphenytoin) ▪ neu: Topiramat ▪ bei fokalen Anfällen etwas weniger wirksam: ▪ Primidon und ▪ Phenobarbital ▪ bei primär generalisierten Epilepsien: ▪ Valproat ▪ Ethosuximid ▪ Lamotrigin ▪ bei BNS-Krämpfen (Blitz-Nick-Salaam-Anfälle; Entwicklungsstörung des Gehirns, Säuglingsalter): ▪ ACTH ▪ Clobazam ▪ neuere Antiepileptika ▪ Topiramat (breites Einsatzgebiet, auch Monotherapie) ▪ Gabapentin (breites Einsatzgebiet, Mono- oder Zusatztherapie) ▪ Spezialgebiet: Schmerztherapie ▪ Fosphenytoin (besseres Profil als Phenytoin) 71 04/10/10 Pathobiologie - HS 2010 - Lektion 3 71 Anti-Epileptika Hauptsächliche Wirkungsorte/Angriffspunkte für Antiepileptika Reference: Duncan JS et al, Lancet 2006; 367: 1087-1100 72 04/10/10 Pathobiologie - HS 2010 - Lektion 3 72 * Schlafregulation Fölsch / Mutschler Schlafstadien Nach EEG gibt es 4-5 verschiedene Schlafstadien: die Frequenz der EEGWellen nehmen bei zunehmender Schlaftiefe ab (Tiefschlaf: langsame δWellen). Die 4-5 Schlafstadien werden während einer Nacht mehrfach durchlaufen (3-5x). REM (rapid eye movement) Schlaf sind Perioden von desynchronisiertem Schlaf und durch starke hirnelektrische Aktivität charakterisiert (s. auch Traumphasen). In den REM-Phasen scheinen cholinerge Neurone spinale Motoneurone zu hemmen und dabei die REM-typische Muskelerschlaffung herbeizuführen. Noradrenerge Neuronen aus dem Locus coeruleus beendigen die REM-Phasen. Kontrolle der Schlaf-Wach-Periodik Es sind mehrere Zentren involviert, insbesondere der Nucleus suprachiasmaticus (SCN) im Hypothalamus, der den Belichtungszustand der Retina wahrnimmt und mit der Epiphyse (Zirbeldrüse) verbunden ist. Diese setzt das Melatonin frei, das auf den SCN zurückwirkt. Bei genügender Lichtintensität (>2500 Lux) wird die Melatoninausschüttung supprimiert. Der Rhythmusgeber im SCN steuert die Area praeoptica im Hypothalamus und Zentren im Hirnstamm und in der Hirnrinde. Involvierte Transmitter sind u.a. die serotonergen und GABAergen Systeme (siehe Tranquilizer). 73 04/10/10 Die Einleitung des NREM (Non-REM)-Schlafs scheint von Neuronen des Nucleus tractus solitarius (NTS) herbeigeführt zu werden. Diverse Faktoren beeinflussen den Einschlafvorgang (endogene Schlafregulatoren). Pathobiologie - HS 2010 - Lektion 3 73 * Schlafstörungen Mutschler Dyssomnien Beeinträchtigungen des Schlafs hinsichtlich Dauer, Qualität und zirkadianer Periodik. Insomnien sind durch einen Mangel an Schlafqualität gekennzeichnet (Einschlaf-, Durchschlafstörungen). Bei Hypersomnien besteht eine exzessive Einschlafneigung während des Tages (z.B. Schlafattacken). Parasomnien Störende und krankhafte Begleitsymptome des Schlafs, z.B. Schlafwandeln, Alpträume oder nächtliches Zähneknirschen (Bruxismus). Organisch und psychiatrisch bedingte Schlafstörungen Neurologische Erkrankungen (z.B. degenerative Hirnerkrankungen, Demenz-Syndromen, Polyneuropathien, Epilepsien), psychiatrische Erkrankungen (z.B. Psychosen, depressive Syndrome, Angstkrankheiten) sowie internistische Erkrankungen (z.B. Schmerzzustände, Krankheiten des Bewegungsapparats, Atmungsstörungen) können zu Schlafstörungen führen. Schlafstörungen unterschiedlicher Genese z.B. während und nach der Schwangerschaft 74 04/10/10 Pathobiologie - HS 2010 - Lektion 3 74 (*) Insomnie Fölsch Auf der Basis eines primär leicht störbaren Schlaf-Wach-Systems entwickelt sich durch einen äusseren Auslöser eine Insomnie, die durch verhaltensbedingte und psychoreaktive Faktoren aufrechterhalten und chronifiziert wird. 75 04/10/10 Pathobiologie - HS 2010 - Lektion 3 75 Narkolepsie Fölsch Die Narkolepsie stellt eine Störung der Schlaf-Wach-Regulation dar, die durch Tagesmüdigkeit, Schlafattacken und Symptome des disinhibierenden REM-Schlafes (Kataplexien und Schlaflähmungen) gekennzeichnet ist. Das Schlafprofil einer 27jährigen Narkolepsiepatientin zeigt, dass die erste REM-Phase unmittelbar nach dem Einschlafen einsetzt (Sleep-Onset-REM, SOREM). Non-REM-Symptomatik: Tagesschläfrigkeit mit unkontrollierten Einschlafattacken. REM-Symptomatik: Kataplexie (affektiver Muskeltonusverlust), ausgeglöst durch emotionale Reize wie Freude, Ärger oder Überraschung; Schlaflähmungen sind ein Erwachen mit völliger Bewegungsunfähigkeit. 76 04/10/10 Pathobiologie - HS 2010 - Lektion 3 76 (*) Obstruktive Schlaf-Apnoe Fölsch Schlaf-Apnoe-Syndrom Die häufigste Ursache von Tagesschläfrigkeit stellt das Schlaf-ApnoeSyndrom dar: meistens sind übergewichtige Männer >50 J. betroffen. Das linke Bild zeigt verschiedene Atemmuster im Schlaf, polygraphisch gemessen (Atemfluss an Nase- und Mundeingang). Brust- und Bauchdehnung werden mit Dehnungssensoren an Thorax und Abdomen gemessen. Obstruktive Schlaf-Apnoe Grundlage der obstruktiven SchlafApnoe ist ein rezidivierender Verschluss (Obstruktion) des Oropharynx durch einen Kollaps der umgebenden Weichteilstrukturen aufgrund von Muskelerschlaffung im Schlaf: Abfall des pO2, Anstieg des pCO2, Weckreaktion, Öffnung der Luftwege mit einem lauten Schnarchgeräusch. Vorstufe: obstruktives Schnarchen. Anwendung eines nCPAP (nasal continuous positive airway pressure) - Geräts reduziert bzw. eliminiert die obstruktiven Apnoen und führt zu einer verbesserten Sauerstoffsättigung. 77 04/10/10 Pathobiologie - HS 2010 - Lektion 3 77