Methoden - Sterne und Weltraum
Werbung
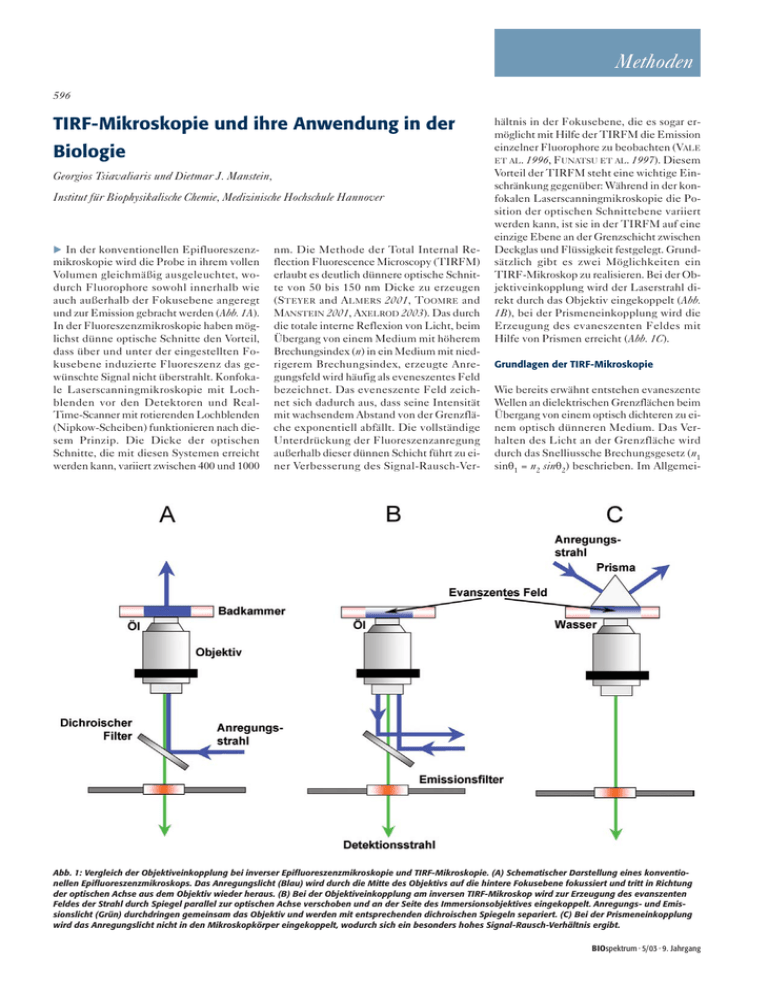
Methoden 596 TIRF-Mikroskopie und ihre Anwendung in der Biologie Georgios Tsiavaliaris und Dietmar J. Manstein, Institut für Biophysikalische Chemie, Medizinische Hochschule Hannover In der konventionellen Epifluoreszenzmikroskopie wird die Probe in ihrem vollen Volumen gleichmäßig ausgeleuchtet, wodurch Fluorophore sowohl innerhalb wie auch außerhalb der Fokusebene angeregt und zur Emission gebracht werden (Abb. 1A). In der Fluoreszenzmikroskopie haben möglichst dünne optische Schnitte den Vorteil, dass über und unter der eingestellten Fokusebene induzierte Fluoreszenz das gewünschte Signal nicht überstrahlt. Konfokale Laserscanningmikroskopie mit Lochblenden vor den Detektoren und RealTime-Scanner mit rotierenden Lochblenden (Nipkow-Scheiben) funktionieren nach diesem Prinzip. Die Dicke der optischen Schnitte, die mit diesen Systemen erreicht werden kann, variiert zwischen 400 und 1000 nm. Die Methode der Total Internal Reflection Fluorescence Microscopy (TIRFM) erlaubt es deutlich dünnere optische Schnitte von 50 bis 150 nm Dicke zu erzeugen (STEYER and ALMERS 2001, TOOMRE and MANSTEIN 2001, AXELROD 2003). Das durch die totale interne Reflexion von Licht, beim Übergang von einem Medium mit höherem Brechungsindex (n) in ein Medium mit niedrigerem Brechungsindex, erzeugte Anregungsfeld wird häufig als eveneszentes Feld bezeichnet. Das eveneszente Feld zeichnet sich dadurch aus, dass seine Intensität mit wachsendem Abstand von der Grenzfläche exponentiell abfällt. Die vollständige Unterdrückung der Fluoreszenzanregung außerhalb dieser dünnen Schicht führt zu einer Verbesserung des Signal-Rausch-Ver- hältnis in der Fokusebene, die es sogar ermöglicht mit Hilfe der TIRFM die Emission einzelner Fluorophore zu beobachten (VALE ET AL. 1996, FUNATSU ET AL. 1997). Diesem Vorteil der TIRFM steht eine wichtige Einschränkung gegenüber: Während in der konfokalen Laserscanningmikroskopie die Position der optischen Schnittebene variiert werden kann, ist sie in der TIRFM auf eine einzige Ebene an der Grenzschicht zwischen Deckglas und Flüssigkeit festgelegt. Grundsätzlich gibt es zwei Möglichkeiten ein TIRF-Mikroskop zu realisieren. Bei der Objektiveinkopplung wird der Laserstrahl direkt durch das Objektiv eingekoppelt (Abb. 1B), bei der Prismeneinkopplung wird die Erzeugung des evaneszenten Feldes mit Hilfe von Prismen erreicht (Abb. 1C). Grundlagen der TIRF-Mikroskopie Wie bereits erwähnt entstehen evaneszente Wellen an dielektrischen Grenzflächen beim Übergang von einem optisch dichteren zu einem optisch dünneren Medium. Das Verhalten des Licht an der Grenzfläche wird durch das Snelliussche Brechungsgesetz (n1 sinθ1 = n2 sinθ2) beschrieben. Im Allgemei- Abb. 1: Vergleich der Objektiveinkopplung bei inverser Epifluoreszenzmikroskopie und TIRF-Mikroskopie. (A) Schematischer Darstellung eines konventionellen Epifluoreszenzmikroskops. Das Anregungslicht (Blau) wird durch die Mitte des Objektivs auf die hintere Fokusebene fokussiert und tritt in Richtung der optischen Achse aus dem Objektiv wieder heraus. (B) Bei der Objektiveinkopplung am inversen TIRF-Mikroskop wird zur Erzeugung des evanszenten Feldes der Strahl durch Spiegel parallel zur optischen Achse verschoben und an der Seite des Immersionsobjektives eingekoppelt. Anregungs- und Emissionslicht (Grün) durchdringen gemeinsam das Objektiv und werden mit entsprechenden dichroischen Spiegeln separiert. (C) Bei der Prismeneinkopplung wird das Anregungslicht nicht in den Mikroskopkörper eingekoppelt, wodurch sich ein besonders hohes Signal-Rausch-Verhältnis ergibt. BIOspektrum · 5/03 · 9. Jahrgang Methoden nen wird, in Abhängigkeit vom Einfallswinkels θ und von der Polarisation der einfallenden Lichtwelle, ein Teil des Anregungslichts unter einem bestimmten Winkel θ2 gebrochen und der Rest reflektiert (Abb. 2A). Bei einem Brechungswinkel von θ2 = 90° ergibt sich für den Einfallswinkel θ1: θC = arcsin (n2/n1) Wenn man für n1 und n2 typische Werte für die Brechungsindices von Zytosol (1,36) und Glas (1,515) einsetzt, dann erhält man für den kritischen Winkel θC einen Wert von 63,85°. Für θ1 > θC propagiert die Welle entlang der Grenzfläche. Sie dringt außerdem in das dünnere Medium ein. Dabei lässt sich das Intensitätsprofil der evaneszenten Welle vereinfacht durch folgende Gleichung beschreiben: I(z) = I(0) e-z/d Wobei für die Eindringtiefe d der evaneszenten Welle gilt: d= λ 4π n 12 sin2 θ1 – n 22 Abbildung 2B verdeutlicht die Abhängigkeit der Intensität der evaneszenten Welle vom Einfallswinkel θ und dem Abstand z zur Grenzschicht. Aufbau eines TIRF-Mikroskops Beim Bau eines TIRF-Mikroskops sind folgende praktische Punkte zu beachten. Die Erzeugung eines evaneszenten Felds mittels Objektiveinkopplung ist nur möglich wenn die numerische Apertur (NA) des Objektivs größer als 1,38 ist. Heute stellen fast alle Mikroskophersteller geeignete Objektive mit einer NA im Bereich zwischen 1,40 und 1,65 her. Dabei sind zwei Dinge zu beachten. Zum einen schwankt der Toleranzbereich von Objektiven, die vor 1998 gebaut wurden und die Aufschrift NA=1,40 tragen, zwischen 1.36 und 1,41. Dies bedeutet, dass mit einigen dieser älteren Objektive keine Totalreflexion erzeugt werden kann. Zum anderen können ObBIOspektrum · 5/03 · 9. Jahrgang jektive mit NA größer als 1,48 nur in Kombination mit Deckgläsern und Immersionsmedien mit entsprechend hohem Brechungsindex benutzt werden. Für Objektive mit einer NA von 1,65, wie sie von Olympus hergestellt werden, verwendet man Deckgläser und Immersionsöl mit einem Brechungsindex von 1,780. Die Deckgläser werden meist aus SF11oder LAFN21 von Schott bzw. PBH11 oder SLAH64 von Ohara hergestellt und dürfen nicht dicker als 150 µm sein. Wir verwenden Deckgläser mit einem Durchmesser von 20 und 32 mm in Kombination mit speziellen Badkammern, die sich passgenau in den x-y-Tisch unseres Mikroskops einfügen lassen. Entsprechende Deckgläser werden als so genannte Planscheiben oder Rundscheiben von den Firmen Vision GmbH (Rodenberg) und PlanOptik GmbH (Elsoff) hergestellt. Ein geeignetes Immersionsöl wird unter der Bezeichnung LRIM 165 von der Firma Cargille Laboratories (Cedar Grove, NJ, USA) hergestellt. Die Prismeneinkopplung, wie in Abbildung 1C schematisch dargestellt, ist einfacher in Aufbau und Handhabung. Sie hat den großen Vorteil, dass das Anregungslicht nie in den Mikroskopkörper eingekoppelt wird. Dadurch ergibt sich im Vergleich zur Objektiveinkopplung ein deutlich besseres Signal-RauschVerhältnis. Außerdem ist die Justage des Lasers auf das Prisma in der Regel nicht durch räumlich begrenzte Verhältnisse erschwert. Verwendet man einen Halbzylinder statt eines klassischen Prismas, dann lässt sich der Einfallswinkel des ankommenden Laserstrahls und somit auch die Eindringtiefe des evaneszenten Feldes verändern. Wir verwenden als Prisma einen 15 mm langen Halbstab mit einem Radius von 7,5 mm, dessen Basis um 1 mm gekürzt wurde. Dieses Prisma ist aus dem Schwerflint SF11 hergestellt und mit einer Antireflexionsbeschichtung für den sichtbaren Bereich versehen (Vision GmbH, Rodenberg). Es wird in Kombination mit Deckgläsern Methoden 598 Abb. 2: Das Verhalten einer elektromagnetischen Welle beim Übergang von einem optisch dichteren zu einem optisch dünneren Medium. (A) In Abhängigkeit vom Einfallswickel, der Polarisation der einfallenden Lichtwelle und den Brechungsindizes findet an der Grenzfläche der beiden Medien Brechung bzw. Reflexion statt. Bei Überschreitung eines bestimmten kritischen Winkel θc baut sich entlang der Grenzschicht eine evanszente Feld auf. (B) Abhängigkeit der Intensität der evaneszenten Welle vom Einfallswinkel θ und dem Abstand z zur Grenzschicht. aus SF11 und dem Immersionsöl LRIM 165 der Firma Cargille Laboratories verwendet. Ein Nachteil bei der Prismeneinkopplung ist, dass die Probe nicht mehr frei zugänglich ist, da sich das Prisma und das zur Beobachtung verwendete Objektiv auf den jeweils gegenüberliegenden Seiten der Deckgläser befinden (Abb. 1C). Außerdem stellt die Geometrie des Aufbaus besondere Anforderungen an das zur Sammlung des Fluoreszenzlichts verwendete Objektiv. Dieses sollte einen großen Arbeitsabstand erlauben und sich durch geringe sphärische und chromatische Abberation auszeichnen. Aus diesem Grund verwenden wir ein 63x Wasser-Achroplan Objektiv mit einer numerischen Aper- tur von 0,90 und einem Arbeitsabstand von 2 mm (Zeiss, Oberkochen). Spezielle Entwicklungen für zellbiologische Anwendungen Zusätzlich zu den beiden oben beschriebenen Methoden ein TIRFM zu bauen, gibt es eine Vielzahl von Variationsmöglichkeiten, die abhängig von der biologischen Anwendung, erwünscht oder essentiell notwendig sind. Für zellbiologische Anwendungen ist es oft wichtig verschiedene Fluorophore anregen zu können, was die Verfügbarkeit verschiedener Laserlinien voraussetzt (TOOMRE ET AL. 2000, KRYLYSHKI- NA ET AL. 2003). Im Prinzip lässt sich dies durch die Kombination mehrerer kompakter Diodenlaser mit einer Ausgangsleistung von mehr als 20 mW erreichen. Wir verwenden für diesen Zweck wassergekühlte Argon/Krypton-Ionenlaser mit einer Ausgangsleistung von 5–10 W. Diese Lösung mag zunächst als übertrieben erscheinen, sie hat allerdings einige entscheidende Vorteile. Setzt man diese Argon/Krypton-Ionenlaser in Verbindung mit polychromatischen akusto-optischen Modulatoren (AOM) ein, dann kann man aus dem Strahl eines im „Multi-Line“ Modus betriebenen Lasers einzelne Laserlinien auswählen und jede Linie in ihrer Intensität modulieren. Der AOM nutzt die Tatsache, dass der Ablenkwinkel zwischen der 0. und 1. Ordnung sowohl eine Funktion der optischen Wellenlänge als auch der akustischen Frequenz ist. Durch Abstimmen dieser Parameter erreicht man, dass der Ablenkwinkel für die gewünschten Laserlinien in der 1. Ordnung stets gleich bleibt und angewählte Laserlinien unter dem gleichen Winkel aus dem AOM austreten. Abhängig von der verwendeten Treiberelektronik kann man vier oder mehr Linien direkt aus dem Aufnahmeprogramm kontrollieren. Die Umschaltung von einer Laserlinie auf eine andere erfolgt dabei innerhalb weniger Mikrosekunden. Ein weiterer Vorteil ist, dass der AOM auch als sehr schneller Shutter wirkt. In unseren Mikroskopen wird das Laserlicht über eine Einkopplungsoptik in ein „Singlemode“ Glasfaserkabel (PointSource, Southampton, UK) eingekoppelt, welches das Licht zur Einkopplungsoptik des Mikroskops führt. Für die polychromatische Einkopplung geeignete Glasfasern werden bis zu einer Länge von 10 m gefertigt. Ihre Verwendung ermöglicht es einen Laser und AOM ohne größere Umbauten an mehreren Mikroskopstativen zu benutzen. Der Einsatz mehrerer Laserlinien ist bei der Prismeneinkopplung einfacher zu realisieren, bei der Objektiveinkopplung allerdings auch möglich. Bei der Einkopplung über das Objektiv haben wir den in Abbildung 3 gezeigten Aufbau gewählt, der statt eines dichroitischen Spiegels ein Prismenpaar verwendet. Bei dieser Anordnung erfolgt die Einkopplung unabhängig von der Wellenlänge des anregenden Lichts, ansonsten müsste jeweils ein geeigneter dichroitischer Spiegel eingesetzt werden, und das total reflektierte Licht wird effizient aus dem Mikroskopkörper herausgeleitet. Das Austreten des total reflektierten Lichts aus dem Mikroskop ist dabei auch eine nützliche Hilfe bei der Justierung. Natürlich setzen alle Arten der TIRFM den Einsatz von Filtern voraus, die das Anregungslicht auf der Detektorseite wirkungsvoll blocken. Hier hat BIOspektrum · 5/03 · 9. Jahrgang Methoden sich der Einsatz holografischer Notchfilter bewährt. Für Zellbiologische Anwendungen ist es meist erforderlich auch Information über Prozesse zu erhalten, die tiefer im inneren der Zelle ablaufen (OHEIM and STUHMER 2000, TOOMRE et al. 2000). Dabei ist es wichtig zu berücksichtigen, dass man schnell zwischen TIRF- und Epifluoreszenzanregung umschalten kann. Bei der Prismeneinkopplung kann dies leicht realisiert werden da die Strahlengänge des Anregungslichts vollständig getrennt sind. Für die Objektiveinkopplung gibt es einige kommerzielle Lösungen, die allerdings entweder kein schnelles Umschalten zwischen den Anregungsquellen erlauben oder starke Unterschiede in der Eindringtiefe über den abgebildeten Bereich zeigen. Einzelmolekül Anwendungen Kinetische Untersuchungen an Einzelmolekülen sind ein weiterer wichtiger Bereich in dem TIRF-Mikroskope eingesetzt werden (OIWA et al. 2000, SEITZ et al. 2002, KAYA et al. 2003). Bei dieser Anwendung sind die physikalischen Eigenschaften des Lichts von größerer Bedeutung und dies erfordert entsprechende Anpassungen. Fluorophore werden nur angeregt wenn ihre Absorptionsdipole in der Polarisationsrichtung des Lichts ausgerichtet sind. Da Laserlicht linear polarisiert ist und die beobachteten Fluorophore rotieren, ändert sich die Anregungsintensität der die einzelnen fluoreszierenden Moleküle ausgesetzt sind fortwährend. Wenn der Fluorophor an ein langsam rotierendes Molekül wie ein Protein gebunden ist, kann es durch die anisotrope Anregung zu Variationen der Emissionsintensität kommen, die das gewünschte Signale überlagern. Deshalb ist es bei der Durchführung von Einzelmolekülmessungen notwendig entsprechende Vorkehrungen zu treffen. Die isotrope Anregung von Einzelmolekülen kann unter anderem mit Hilfe eines speziellen Prismas erreicht werden (WAKELIN and BAGSHAW 2003). Die hier aufgeführten Beispiele sollen verdeutlichen, dass die TIRFM ein weites Spektrum von Anwendungsmöglichkeiten hat und auf unterschiedliche Weisen realisiert werden kann. Darüber hinaus können andere Fluoreszenztechniken wie FRET, FLIM und FCS leicht mit der TIRFM kombiniert werden, um dieses Anwendungsspektrum noch weiter zu vergrößern. Danksagung Die Arbeiten wurden von der Max-PlanckGesellschaft und der Volkswagen-Stiftung gefördert. BIOspektrum · 5/03 · 9. Jahrgang Methoden 600 Literatur Axelrod, D. (2003): Total internal reflection fluorescence microscopy in cell biology. Methods Enzymol 361: 1–33 Funatsu, T., Harada, Y., Higuchi, H., Tokunaga, M., Saito, K., Ishii, Y., Vale, R. D. and Yanagida, T. (1997): Imaging and nano-manipulation of single bio- molecules. Biophys Chem 68: 63–72 Kaya, S., Abe, K., Taniguchi, K., Yazawa, M., Katoh, T., Kikumoto, M., Oiwa, K. and Hayashi, Y. (2003): Oligomeric structure of P-type ATPases observed by single molecule detection technique. Ann N Y Acad Sci 986: 278–80 Krylyshkina, O., Anderson, K. I., Kaverina, I., Upmann, I., Manstein, D. J., Small, J. V. and Toomre, D. K. (2003): Nanometer targeting of microtubules to focal adhesions. J Cell Biol 161: 853–859 Oheim, M., and Stuhmer, W. (2000): Tracking chro- maffin granules on their way through the actin cortex. Eur Biophys J 29: 67–89 Oiwa, K., Eccleston, J. F., Anson, M., Kikumoto, M., Davis, C. T., Reid, G. P., Ferenczi, M. A., Corrie, J. E., Yamada, A., Nakayama, H. and Trentham, D. R. (2000): Comparative single-molecule and ensemble myosin enzymology: sulfoindocyanine ATP and ADP derivatives. Biophys J 78: 3048–71 Seitz, A., Kojima, H., Oiwa, K., Mandelkow, E. M., Song, Y. H. and Mandelkow, E. (2002): Single-mole- cule investigation of the interference between kinesin, tau and MAP2c. EMBO J 21: 4896–905 Steyer, J. A., and Almers, W. (2001): A real-time view of life within 100 nm of the plasma membrane. Nat Rev Mol Cell Biol 2: 268–75 Toomre, D., and Manstein, D. J. (2001): Lighting up the cell surface with evanescent wave microscopy. Trends Cell Biol 11: 298–303 Toomre, D., Steyer, J. A., Keller, P., Almers, W. and Simons K. (2000): Fusion of constitutive mem- brane traffic with the cell surface observed by evanescent wave microscopy. J Cell Biol 149: 33–40 Vale, R. D., Funatsu, T., Pierce, D. W., Romberg, L., Harada, Y. and Yanagida, T. (1996): Direct ob- servation of single kinesin molecules moving along microtubules. Nature 380: 451–3 Wakelin, S., and Bagshaw, C. R. (2003): A prism Abb. 3: Schematischer Aufbau eines TIRF-Mikroskops mit Objektiveinkopplung. Ein neu entwickelter Prismen-Filterblock ermöglicht eine effiziente Feinjustierung des evanszenten Feldes. Hierbei wird der Anregungsstrahl über ein aluminiumbeschichtetes Prisma (5 x 5 x 5 mm) aus BK7 Glas (Opto-Sigma, Santa Ana, CA, USA) in den seitlichen Rand der Objektivöffnung des Objektivs eingekoppelt. Der Anregungsstrahl verlässt bei Totalreflexion das Objektiv und wird durch ein identisches Prisma auf der gegenüberliegenden Seite herausgeleitet. Die beiden Prismen befinden sich auf einem Miniaturverschiebetisch (Linos, Göttingen) und sind individuell verstellbar. Hierdurch wird eine exakte Ein- und Auskopplung an den seitlichen Öffnungsrändern des Objektivs gewährleistet. combination for near isotropic fluorescence excitation by total internal reflection. J Microsc 209: 143–8 Korrespondenzadresse: Prof. Dr. Georgios Tsiavaliaris und Prof. Dr. Dietmar J. Manstein Institut für Biophysikalische Chemie, OE4350 Medizinische Hochschule Hannover, Carl-Neuberg-Str. 1 D-30623 Hannover Tel.: 0511 532 3700 Fax: 0511 532 5966 [email protected] [email protected] BIOspektrum · 5/03 · 9. Jahrgang