Thermodynamik - deutsch (PDF 4.72 MB)
Werbung

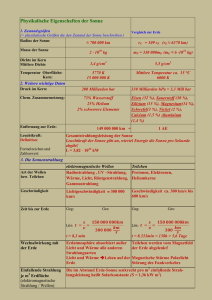
Thermodynamik PROJEKT WISSENSCHAFT UND TECHNIK MACHEN UNS SPASS! WURDE FINANZIELL UNTERSTÜTZT: Das Projektziel ist es mittels bildender (Bildungsprogramme, Materialien) und lancierender („wissenschaftliche“ Road-Show) Instrumente und dem grenzüberschreitenden motivierenden Wettbewerb das Interesse der Schüler und Studenten für Technik und Wissenschaft zu steigern sowie zu einer wechselseitigen Kommunikation der Bildungseinrichtungen in diesem Gebiet beizutragen, d.h. die Beziehungen zwischen den einzelnen Schulstufen und weiterer Bildungssubjekte innerhalb der Region Ziel 3 zu stärken. PROJEKT ARBEITSBL ÄT TER WISSENSCHAFT UND TECHNIK MACHEN UNS SPASS! THERMODYNAMIK FINANZIERT AUS PROGRAM 2 Inhalt 3 Die Theorie 3 Thermodynamik - Grundlagen 3 Stoffstruktur, Energie 5 Thermodynamische Prozesse 7 Erstes thermodynamisches Gesetz 7 Zweites thermodynamisches Gesetz 7 Temperaturausdehnung 7 Zustandsgleichung 7 Prozesse, die im idealen Gas stattfinden: 8 Abkürzungenverzeichnis 8 Literaturverzeichnis 9 Versuch Nr. 1: Sieden in Papier 9 Versuch Nr. 2: Regelation von Eis 10 Versuch Nr. 3: Unterkühlung von Wasser 11 Versuch Nr. 4: Kochen von Wasser – energetischer Aufwand 12 Versuch Nr. 5: Gekühlte Getränke 13 Versuch Nr. 6: Genauigkeit von Wärme im Wasser 14 Test 1 16 Test 2 18 Test 3 Test 1: 1a), 2d), 3b), 4d), 5c), 6d), 7c), 8b), 9b), 10a), 11a), 12d) Test 2: 1a), 2b), 3d), 4d), 5a), 6b), 7b), 8d), 9a), 10c), 11a), 12b) Test 3: 1c), 2b), 3d), 4b), 5d), 6d) Kuvert: Boiling Water, Scott Akerman, licence CC BY 2.0, www.flickr.com, geändert die Temperatur 0K (der absolute Nullpunkt). Dieser Zustand kann niemals auftreten, bei der Temperatur Die Theorie 0K kommt die Wärmebewegung der Partikel zum Stehen. Die Celsiustemperatur t geht aus der Temperatur des Tauens von Eis unter einem normalen Druck von 1013,25 hPa (0°C) hervor. Die Temperatur 100°C entspricht kochendem Wasser unter normalem Druck. Im Gegensatz zur thermodynamischen Skala hat die Celsiusskala auch negative Werte. Die Temperatur ist in beiden Skalen gleich – der Temperaturanstieg um 1°C = Temperaturanstieg um 1K. Die Messung der Temperatur wird mit einem Thermometer durchgeführt. THERMODYNAMIK - GRUNDLAGEN iche aufteilen: Die Thermodynamik ist ein Zweig der Physik, der • Die Thermodynamik lässt sich auf mehrere Bere- sung von Temperatur und den verwendeten sich mit Stoffen und deren Eigenschaften in Abhän- Messmethoden. gigkeit von Temperatur befasst; mit der Messung von • Temperatur, Wärme und Wärmeprozessen. Kalorimetrie – befasst sich mit dem Wärmeinhalt von Stoffen. Wärme (Q) ist ein Teil der inneren Energie, die bei einem Wärmeaustausch übergeben wird – das Sys- Thermometrie – befasst sich mit der Mes- • Kinetische Theorie der Stoffe – befasst sich tem nimmt sie an oder gibt sie beim Antreffen eines mit der Beziehung zwischen der Molekularstruk- anderen Systems mit einer anderen Temperatur wie- tur von Stoffen und deren Wärmeverhalten. Sie der ab. Diese Energie hat weder den Charakter von knüpft an die Molekularphysik an und nutzt die Arbeit noch von chemischer Arbeit. Es handelt sich Wahrscheinlichkeitsmethode und Statistik. um eine physikalische Prozessgröße – sie beschreibt einen thermodynamischen Prozess (Abfolge der Zustände des Systems). Die Einheit von Wärme ist Joules. • tung von Wärme durch die Umgebung. • andere Arten). sgröße, sie charakterisiert den Wärmezustand von Nebeneinheit sind Grad Celsius. Die thermodynamische Temperatur T ist eine der Grundgrößen des Systems SI. Die Kelvinskala ist durch den Tripelpunkt des Wassers 273,16 K (0,01 °C) definiert. Ein Kelvin ist die Temperatur, die /273,16 der thermodynamischen Temperatur des Trippelpunktes des Wassers entspricht. Der Trippelpunkt ist ein Zustand während einer bestimmten Temperatur und eines bestimmten Druckes, wobei alle drei Aggregatzustände in Gleichgewicht sind – der feste Stoff, die Flüssigkeit und das Gas. Die thermodynamische Skala verzeichnet keine negativen Werte. Der Beginn der Skala ist Thermodynamik – befasst sich mit den Gesetzen der Energieumwandlung (Wärmeenergie in Die Wärme (T, t) ist eine physikalische ZustandMasse. Die Einheit von Temperatur sind Kelvin, eine Thermokinetik– befasst sich mit der Verbrei- STOFFSTRUKTUR, ENERGIE Stoffe aller Aggregatzustände werden durch Teilchen gebildet – Atome, Moleküle und Ionen. Die Struktur der Stoffe ist nicht kontinuierlich, sondern diskret. Diese Teilchen sind in ständiger Bewegung. Ist der Körper im Ruhezustand, so überwiegt im jeweiligen Augenblick keine Bewegungsrichtung. Ist der Körper in Bewegung, so überwiegt die Bewegung in Richtung des gesamten Körpers. Die ständige Bewegung der Teilchen ist eine Wärmebewegung. Der Beweis dafür ist zum Beispiel die Brownsche Bewegung (winzige Teilchen wie zum Beispiel Pollenkör- PROJEKT ARBEITSBL ÄT TER WISSENSCHAFT UND TECHNIK MACHEN UNS SPASS! THERMODYNAMIK FINANZIERT AUS PROGRAM 4 ner, die ins Wasser geschüttet werden, bewegen sich. Aufgrund der Existenz der oben angeführ- Diese Bewegung ist unter dem Mikroskop sichtbar; ten Kräfte, schwingen die Teilchen um die gleich- die Bewegung wird durch den Aufprall von Wasser- gewichtige Position herum. Bei einer Annäherung molekülen auf die Teilchen verursacht; die Bewegu- stoßen sich die Atome ab, wenn sie sich entfernen, ngsintensität erhöht sich mit der Temperatur, beim ziehen sie sich an. Jedes Teilchen wird stärkemäßig absoluten Nullpunkt würde diese Bewegung zum nur von den Teilchen in seiner Umgebung beeinflusst Stehen kommen) und Diffusion (spontanes Durch- (bei Flüssigkeiten handelt es sich um ein Umfeld, das dringen der Teilchen eines Stoffes zu den Teilchen in etwa dreimal so groß ist wie der Radius des Teil- eines anderen Stoffes im Falle, dass die Körper dieser chens). Stoffe in gegenseitige Berührung gebracht werden – Die Energie, die das Teilchen wegen seiner Posi- zum Beispiel das Auflösen von Zucker in Wasser oder tion gegenüber den benachbarten Teilchen hat, ist die Verbreitung eines Duftes). Die Teilchen haben potentielle Energie. Die Summe der potentiellen also kinetische Energie. Gesamtenergie und der kinetischen Energie aller sich Zwischen den Teilchen wirken anziehende und bewegender Teilchen nennt man innere Energie des abstoßende Kräfte, deren Größe von der Entfernung Körpers oder des Systems mit der Abkürzung U und zwischen den Teilchen abhängt. Bei kleinen Entfer- der Einheit Joules. Die innere Energie beeinflusst die nungen ist die Kraft abstoßend, bei größeren Entfer- Eigenschaften und den Zustand des Stoffes. nungen ist sie anziehend. Diese Kraft entsteht durch Die kinetische Energie der Teilchen steht mit der die Wechselwirkung positiv aufgeladener Kerne und Temperatur des Körpers in Zusammenhang. Je höher negativ aufgeladener Hüllen und gleichzeitig auf- die Temperatur des Körpers ist, desto größer ist die grund der Existenz von Gravitationskräften. Geschwindigkeit, mit der sich die Teilchen bewegen. Es existiert eine gleichgewichtige Position bei Die Lageenergie beeinflusst die Festigkeit des Kör- einer bestimmten Entfernung zwischen den Teilchen. pers. Je höher die Lageenergie der Teilchen, desto In dieser ist die Größe der Kraft, mit welcher die Teil- fester der Körper. Die innere Energie kann auf zwei chen auf sich wirken, gleich Null. Die Teilchen bewe- Arten verändert werden: gen sich um diese gleichgewichtige Position herum. a) durch die Verrichtung von Arbeit – bei der Ist die Entfernung zwischen den Teilchen größer als Verrichtung von Arbeit wirken äußere Kräfte auf die Entfernung der gleichgewichtigen Position, so das System und dank deren Wirkung kommt es wirkt eine anziehende Kraft auf die Teilchen. Diese zur Veränderung des Volumens oder des Drucks Kraft wächst anfangs, erreicht aber schon bald ihr des Systems. Diese Veränderung führt zu einer Maximum und beginnt dann, sich zu verkleinern. Veränderung der kinetischen Energie der Ele- Bei größeren Entfernungen sind die Teilchen so weit mente. voneinander entfernt, dass sie aufeinander nicht abstoßend wirken. Das Atom erscheint in seiner Wirkung als neutral und die Teilchen ziehen sich durch die Gravitationskraft an. Bei kleineren Entfernungen, als es die gleichgewichtige Position ist, wirkt eine abstoßende Kraft auf die Teilchen. Diese Kraft steigt bereits bei einer geringen Annäherung steil an. Deshalb können sich Teilchen unter normalen Bedingungen einander annähern, sich jedoch nicht gegenseitig berühren. b) durch Wärmeaustausch – ändert sich die Temperatur des Systems, kommt es zu einer Änderung der kinetischen Energie der Teilchen. Feste Stoffe – die Teilchen in festen Stoffen haben eine geringe kinetische Energie, sie bewegen sich nur geringfügig um den gleichgewichtigen Punkt. Bereits bei einem geringen Ausschlag von der gleichgewichtigen Position weg, erhalten die Teilchen eine große potentielle Energie. Bei festen Stoffen überwiegt also die potenzielle Energie deutlich gegenüber der kinetischen. PROJEKT ARBEITSBL ÄT TER WISSENSCHAFT UND TECHNIK MACHEN UNS SPASS! THERMODYNAMIK FINANZIERT AUS PROGRAM 5 Flüssigkeiten – im Vergleich zu festen Stoffen Wärmeaustausch verändern. Wenn der Körper die schwingen die Flüssigkeitsteilchen und bewegen Arbeit verrichtet, der auf das System wirkt, so wird sich auch in andere gleichgewichtige Positionen. Sie die Arbeit dem System hinzugefügt und sein Wert ist können sich aber nicht sehr weit von diesen Positio- positiv. Wenn das System die Arbeit verrichtet, wird nen entfernen. Deshalb ist die Lageenergie bei Flüssi- dem System Arbeit weggenommen und sein Wert ist gkeiten höher als die kinetische Energie. negativ. Der Wärmeaustausch ist die Übergabe inne- Gase – die Teilchen in Gasen sind sehr weit rer Energie ohne die Verrichtung von Arbeit. Stets gilt, von einander entfernt und bewegen sich mit großer dass der wärmere Körper Energie an den Körper mit Geschwindigkeit. Wir müssen uns also nicht mit der der niedrigeren Temperatur abgibt. Beim Wärmeau- gleichwichtigen Position befassen. Die kinetische stausch übergeben die Körper oder Systeme einander Energie der Teilchen bei Gasen überwiegt deutlich Wärme. Wenn der Körper die Wärme annimmt, gilt gegenüber der Lageenergie. Die Gesamtenergie des dessen Wert als positiv. Im Falle der Wärmeabgabe Körpers (des Systems) ist gleich der Summe ihrer gilt dieser Wert als negativ. Die Menge der übergebe- mechanischen und ihrer inneren Energie. Diese nen Wärme ist proportional zum Gewicht des Kör- Gesamtenergie des Systems ändert sich nicht. pers und zur Temperaturveränderung des Körpers THERMODYNAMISCHE PROZESSE (Im Falle, dass sich der Aggregatzustand des Stoffes nicht verändert). Die Wärmemenge, die dem Körper Die Körper und Systeme befinden sich in unterschied- hinzugefügt werden muss, damit sich die Tempera- lichen Zuständen – sie haben einen unterschiedlichen tur des Körpers um 1°C erhöht (oder 1K), nennt man Aggregatzustand, Druck, ein unterschiedliches Volu- Wärmekapazität. Sie wird mit C gekennzeichnet und men oder eine andere Temperatur. Diese Zustände ihre Einheit ist J/K (Joule pro Kelvin). werden durch Zustandsgrößen beschrieben. Bei der Interaktion mit dem Umfeld (Energieaustausch, Krafteinwirkung) kommt es zu einer Prozess- oder Zustandsänderung. Die Wärmemenge, die wir dem Körper mit einem Wenn es zu einem Energie- oder Teilchenaustausch kommt, so nennt man das System isoliert. Gewicht von einem Kilogramm hinzufügen müssen, damit sich dessen Temperatur um 1°C erhöht (oder Wenn sich die Werte der Zustandsgrößen nicht 1K) erhöht, nennt sich gemessene Wärmekapazität. ändern, so befindet sich das System in einem so Sie wird mit c gekennzeichnet und hat die Einheit j genannten gleichgewichtigen Zustand. In diesen (Joule pro Kilogramm Kelvin). Zustand gelangt es in dem Falle, in dem die äußeren Bedingungen über einen ausreichend langen Zeitraum hinweg unverändert bleiben. Der Übergang in den gleichgewichtigen Zustand ist spontan. In der folgenden Tabelle sind Beispiele für gemessene Wärmekapazität für unterschiedliche Materialien Jede Veränderung des Systemzustandes, also der angeführt. Prozess, bei dem sich die Zustandsgrößen verändern, nennt man einen thermodynamischen Prozess. Im Verlauf eines thermodynamischen Prozesses gemessene Wärmekapazität j Stoff ( Zu Beginn des Prozesses hat das System die innere Wasser 4 180 Energie U1, beim finalen Zustand die innere Energie Luft (0˚C) 1 003 U2. Wie oben erwähnt, kann sich die innere Energie Eis 2 090 kommt es zu einer Veränderung der inneren Energie. ) durch die Verrichtung von Arbeit oder durch einen PROJEKT ARBEITSBL ÄT TER WISSENSCHAFT UND TECHNIK MACHEN UNS SPASS! THERMODYNAMIK FINANZIERT AUS PROGRAM 6 Öl Der Wärmeaustausch kann auf folgende Weisen ver- 2 000 laufen: Trockenes Holz (0˚C) 1 450 a) Wärmeleitung (Konduktion) – diese Wär- Eisen 450 Kupfer 383 Aluminium 896 Flüssigkeiten kommt es zur Wärmeübertragung Gold 129 durch die Wärmeleitung, aber es überwiegen hier Silber 235 andere Weisen. Das Prinzip der Wärmeleitung – meübertragungsweise wird überwiegend bei festen Stoffen angewandt. Auch bei Gasen und Die Stoffteilchen im Bereich mit einer höheren Damit sich ein Köper vom Gewicht m, das aus dem Stoff z mit einer gemessenen Wärmekapazität c hergestellt ist um die Temperatur ∆t erwärmt, müssen wir diesem die Wärme Q beigeben. Es gilt folgende Beziehung. Energie übergeben einen Teil ihrer Bewegungsenergie mittels gegenseitiger Zusammenstöße an Teilchen im Bereich niedrigerer Energie. Während des Austauschs kommt es zu keiner Verlagerung der Teilchen, diese schwingen lediglich um die gleichgewichtigen Positionen herum. Q = m ∙ c ∙ ∆t Die Schnelligkeit der Wärmeleitung wird durch Für den Wärmeaustausch zwischen Körpern gilt die dieser Größe teilen wir die Stoffe in Wärmeleiter kalorimetrische Grundgleichung. Beide Körper werden am Ende des Wärmeaustauschs die gleiche Temperatur t haben und sie werden sich in gleichgewichtigem Zustand befinden. Körper 1 nimmt Wärme an, Körper 2 gibt Wärme ab. Die kalorimetrische Grundgleichung hat dann (bei der Vernachlässigung von Verlusten) folgendes Aussehen: (hohe Geschwindigkeit der Wärmeleitung und ein großer Koeffizient der Leitfähigkeit von Wärme) und Wärmeisolatoren (niedrige Geschwindigkeit der Wärmeleitung und ein niedriger Koeffizient der Leitfähigkeit von Wärme). b) Wärmeströmung (Konvektion) – diese Art der Wärmeübertragung wird insbesondere bei Flüssi- Q1 angenommen = Q2 abgegeben gkeiten und Gasen angewandt, nicht jedoch bei m1 ∙ c1 ∙ (t - t1) = m2 ∙ c2 ∙ (t2 – t) gung kommt es zur Bewegung von Masse unter- festen Stoffen. Bei dieser Art der Wärmeübertra- Eine kompliziertere Situation entsteht in dem Falle, dass es im Verlauf des Wärmeaustauschs zu einer Veränderung des Aggregatzustands kommt. In dem Fall müssen wir in der kalorimetrischen Grundgleichung auch die Schmelz- oder Kondensationstemperatur L berücksichtigen. Für Eis, das wir in warmes Wasser geben, gilt dieses Aussehen der kalorimetrischen Grundgleichung Qangenommen = Qabgegeben schiedlicher Temperatur. Durch die Bewegung der Masse kommt es zu einer Wechselbewegung der einzelnen Teile, die eine unterschiedliche Temperatur und somit eine unterschiedliche Dichte der inneren Energie haben, und dadurch wird Wärme übertragen. Bei flüssigen Systemen kommt es zu einer spontanen Strömung – die wärmeren Teile steigen auf, da die Dichte von Flüssigkeiten und Gasen in der Regel mit der Temperatur sinkt. c) Wärmestrahlung – diese Art von Wärmeü- QErwärmung von Eis auf O°C +LTauen + QErwärmung von Wasser auf die Temperatur T die Leitfähigkeit von Wärme festgelegt. Gemäß bertragung braucht kein stoffliches Umfeld, die Wärme kann sich mithilfe von Wärmestrahlung = QAbkühlung von warmem Wasser m1 ∙ cEis∙ (0-t1) + m1∙lt + m1∙ cWasser∙ (t-0) = m2∙cWasser∙(t2-t) auch durch ein Vakuum übertragen (dies ist im Falle von Leitung und Strömung nicht möglich). Die Wärmeübertragung durch Wärmestrahlung PROJEKT ARBEITSBL ÄT TER WISSENSCHAFT UND TECHNIK MACHEN UNS SPASS! THERMODYNAMIK FINANZIERT AUS PROGRAM 7 funktioniert nach dem Prinzip der Ener- gieausstrahlung von der Oberfläche eines Körpers in Form von elektromagnetischer Strahlung. Die ausgestrahlte Energie hängt von mehreren Faktoren ab - der Wärme des Körpers, der Farbe (Wärme wird am meisten von schwarzen Oberflächen, am wenigsten von glänzenden silbernen Oberflächen ausgestrahlt) sowie der Oberfläche des Körpers ab. ERSTES THERMODYNAMISCHES GESETZ Formulierung des Gesetzes der Energieerhaltung Die Gesamtveränderung der inneren Energie des TEMPERATURAUSDEHNUNG Die Temperaturausdehnung (oder auch Wärmeausdehnung) ist ein Phänomen, bei welchem sich die Längenmaße oder der Umfang des Körpers in Abhängigkeit von der Wärmezulieferung (Aufwärmung) oder der Wärmeentnahme (Abkühlung) des Körpers verändern. Beim Großteil der Stoffe kommt es bei der Aufwärmung zu einer Ausdehnung. Die Stoffmoleküle bewegen sich also schneller und ihre gleichgewichtigen Flächen sind weiter von einander entfernt. Die Wärmeausdehnung gibt die lineare Abhängigkeit der Umfangsänderung des Körpers von der Temperaturveränderung an. Systems ΔU ist gleich der Summe der Arbeit W, die Δx = x0 · γ · Δt durch die Körper im Umfeld oder das System durch Bei dieser Formel ist x0 der Ausgangswert der Größe x vor der Temperaturveränderung, γ ist der Wärmekoeffizient der Dehnbarkeit, der in den Einheiten K-1 angegeben wird. In der Physik befassen wir uns mit zwei Fällen – Krafteinwirkung und Wärme Q ausgeübt wird, die aus dem Umfeld der Körper oder die an die Körper im Umfeld abgegeben wird. ΔU = W + Q der Umfangs- und der Längendehnbarkeit. Dieses Gesetz besagt, dass die Gesamtenergie des isolierten Systems zeitlich unveränderbar ist. Die Energie kann im isolierten System weder entstehen oder vergehen. Es kann sich allerdings die Energieart ändern (zum Beispiel verändert sich mechanische Energie in Wärmeenergie). ZWEITES THERMODYNAMISCHES GESETZ ZUSTANDSGLEICHUNG Die Zustandsgleichung legt die Beziehung zwischen den einzelnen Zustandsgrößen fest, die das jeweilige thermodynamische System beschreibt. Die Zustandsgleichung idealer Gase beschreibt die gegenseitige Abhängigkeit von Zustandsgrößen bei thermodynamischen Prozessen im idealen Gas. p·V=n·R·T Es ist nicht möglich, eine periodisch arbeitende Wärmemaschine zu konstruieren, welche nur Wärme von einem bestimmten Körper (Heizkörper) annehmen und die gleiche Arbeit verrichten würde (es lässt sich also kein Perpetuum Mobile der zweiten Art – ein thermodynamisches also – konstruieren). Eine andere Formulierung dieses Gesetzes lautet: Wärme kann beim Kontakt zweier Körper unterschiedlicher Temperaturen spontan vom kälteren Körper auf den wärmeren übergehen. In dieser Gleichung ist P der Gasdruck, V der Gasumfang, n die Stoffmenge, R die molare Gaskonstante und T die thermodynamische Temperatur. Die oben angeführte Gleichung kann nur in einer relativ engen Spanne von Temperatur und Druck genutzt werden. Für andere Bedingungen (zum Beispiel hohen Druck) existieren weitere Formen der Zustandsgleichung, deren Lösung ist jedoch weitaus komplizierter. Die Zustandsgleichung idealer Gase ist lediglich bei niedrigem Druck und höherer Temperatur anwendbar. Diese Situation entspricht verdünntem Gas. In diesem Falle kann die Zustandsgleichung idealer Gase mit ausreichender Genauigkeit angewandt werden. PROJEKT ARBEITSBL ÄT TER WISSENSCHAFT UND TECHNIK MACHEN UNS SPASS! THERMODYNAMIK FINANZIERT AUS PROGRAM 8 PROZESSE, DIE IM IDEALEN GAS STATTFINDEN: a) Isothermischer Prozess – Prozess im idealen Gas unter konstanter Temperatur Für diesen Prozess gilt das Boyll-Mariottsche Gesetz, welches besagt, dass das Produkt von Druck und Umfang konstant ist. p · V = konst. b) Isochorischer Prozess – Prozess im idealen Gas, der Umfang des Systems ist konstant. Für diesen Prozess gilt das Gesetz von Char- n – Stoffmenge [mol] p – Druck [Pa] Q – Wärme [J] R – Gaskonstante [JK-1mol-1] S –Entropie [JK-1] T –Thermodynamische Temperatur [K] t – Temperatur [°C] U – Innere Energie [J] V – Volumen [m3] W – Arbeit [J] X – Länge (Körpermaß) [m] X0 – Anfangskörpermaß [m] LITERATURVERZEICHNIS 1) DROZD, Zdeněk a Jitka BROCKMEYEROVÁ. les, welches besagt, dass der Anteil von Druck und Pokusy z volné ruky. 1. vyd. Praha: Prometheus, Temperatur konstant ist. 2003, 148 s. ISBN 80-7196-268-6. 2) Dílny Heuréky 2005: sborník konference projektu = konst. Heuréka : [Náchod, 23.-25.9.2005. 1. vyd. Editor c) Isobarischer Prozess – Prozess im idealen Leoš Dvořák. Praha: Prometheus, 2006, 148 s. ISBN 80-7196-334-8. Gas bei konstantem Druck. Für diesen Prozess gilt das Gesetz von Gay 3) KEPKOVÁ, Jaroslava, Josef VESELÝ a Jitka SOU- Lussac, welches besagt, dass der Anteil des KUPOVÁ. Enviroexperiment - fyzika pro 2. stu- Umfangs und der Temperatur konstant ist. peň ZŠ. 1. vyd. V Plzni: Západočeská univerzita, 2012, 75 s. ISBN 978-80-261-0180-2. = konst. 4) Fyzikální praktikum – elektronická podpora d)Der adiabatische Prozess ist ein Prozess, bei welchem es zu keinem Wärmeaustausch mit dem Umfeld kommt. Das System nimmt Wärme weder výuky [cit 15.1.2015] Dostupné z http://home.pf.jcu.cz/~kriz/ 5) Radek Jandora / Maturitní otázky do fyziky [cit. auf, noch gibt es sie ab. Für den adiabatischen 15.1.2015] Erreichbar unter: Prozess gilt das Poisson-Gesetz. http://radek.jandora.sweb.cz/fyzika.htm 6) Fyzika – priklady.eu – Zbierka úloh z matematiky, p · V κ = konst. fyziky a chémie pro stredné školy [cit. 20.1.2015] κ ist die Poissonsche Konstante. Erreichbar unter: http://www.priklady.eu/sk/Fyzika.alej ABKÜRZUNGENVERZEICHNIS a – Temperaturleitfähigkeit [m2s-1] c – Spezifische Wärmekapazität [Jkg-1K-1] C –Wärmekapazität [JK-1] γ – Ausdehnungskoeffizient [K-1] Δ – Wertenunsterschied der physikalischen Größe κ – Isentropenexponent [-] l – Verdampfungswärme [Jkg-1] L – Latente Wärme [J] m – Gewicht [kg] PROJEKT ARBEITSBL ÄT TER WISSENSCHAFT UND TECHNIK MACHEN UNS SPASS! THERMODYNAMIK 7) O škole – testy- fyzika [cit. 20.1.2015] Erreichbar unter: http://www.oskole.sk/?skola=zakladna-skola&id_cat=35 8) Techmania – edutorium [cit. 15.1.2015] Erreichbar unter: http://www.techmania.cz/edutorium/ FINANZIERT AUS PROGRAM 9 VERSUCH NR. 1: VERSUCH NR. 2: Sieden in Papier Regelation von Eis Hilfsmittel: Papiergefäß (Tüte, Schachtel), Spiritusbrenner, Ständer, Zündhölzer Hilfsmittel: PET-Flasche, Saite, Eimer, zwei Ständer Das Papiergefäß füllen wir mit Wasser und befesti- Unter dem Begriff Regelation verstehen wir das gen es am Ständer über dem Spiritusbrenner. Wir abwechselnde Auftauen und Einfrieren. Dieser Ver- zünden den Brenner an und beobachten den Behälter such ist für den Beginn der Schulstunde geeignet, mit Wasser. da mit einem längeren zeitlichen Verlauf zu rechnen Wenn das Papiergefäß kein Wasser beinhalten ist. Wenn wir Eis im Gefrierschrank mit einer Tem- würde, würde es fast sofort anfangen zu brennen. peratur von unter -15°C vorbereiten, ist es gut, die Luft ist ein schlechter Wärmeleiter und reicht für Flasche mit dem Eis etwa 20 Minuten vor Beginn der die Ableitung von Wärme aus dem Gefäß nicht. Das Schulstunde herauszunehmen. Die PET-Flasche mit einem Umfang von 1,5l füllen Papier erwärmt sich also schnell und seine Tempera- wir mit Wasser und geben sie in den Gefrierschrank. tur übersteigt schon bald die Zündtemperatur. Wasser ist ein etwa 30x besserer Wärmeleiter als Nach dem Gefrieren befreien wir das Eis von der Luft. Wenn wir Wasser in das Gefäß geben, wird es Flasche (wir schneiden diese auf und entfernen sie). dem Gefäß Wärme entnehmen und erreicht erst nach Das Eis befestigen wir anschließend an den beiden einer bestimmten Zeit die Siedetemperatur. Die Tem- Ständern. Anstelle von Ständern können zwei Stühle peratur des Siedens ist geringer als der Brennpunkt oder zwei Tische verwendet werden, die sich in der von Papier (185°C). Nach Erreichen der Siedetem- Nähe von einander befinden. In den Eimer füllen wir peratur erhöht sich die Temperatur nicht weiter, die entweder rund sieben Liter Wasser oder ein Gewicht, angenommene Wärme wird für das Verdampfen des das etwa 7kg wiegt. Den Eimer binden wir an einem Wassers verwendet. Im Falle, dass jegliches Wasser Draht oder einer e-Gitarrensaite (der dünnsten) fest verdampft, erhöht sich die Temperatur des Papiers und führen den Draht so um das Eis herum, das er sehr schnell und die Schachtel beginnt zu brennen. eine Schlinge bildet. Der Eimer muss über dem Boden Wasser ist ein viel besserer Wärmeleiter als Luft, in einer größeren Höhe hängen, als es der Durschnitt doch im Gegensatz zu Metallen ist seine gemessene des Eises ist. Es wird nicht empfohlen, den Eimer in Wärmeleitfähigkeit deutlich geringer. Die Wärme- eine zu große Höhe zu hängen, das Wasser könnte leitfähigkeit von Kupfer ist zum Beispiel in etwa 700x verschüttet oder der Eimer beschädigt werden. Nach so hoch als die von Wasser. Die Wärmeableitung einer gewissen Zeit beginnt sich der Draht (die Saite) durch Wasser wird jedoch durch dessen Strömung ins Eis zu schneiden. Diese Zeit ist von der Eistempe- unterstützt. ratur abhängig. Die Saite durchschneidet allmählich den ganzen Eisblock, das Eis ist jedoch nicht in zwei Hälften geschnitten. Der Draht hat das Eis durchschnitten, das Eis blieb jedoch im Umfeld des Drahtes unversehrt. PROJEKT ARBEITSBL ÄT TER WISSENSCHAFT UND TECHNIK MACHEN UNS SPASS! THERMODYNAMIK FINANZIERT AUS PROGRAM 10 VERSUCH NR. 3: Unterkühlung von Wasser Hilfsmittel: Flasche mit Sodawasser, Gefrierschrank Unter dem Draht (der Saite) herrscht ein höherer Druck, der eine geringere Temperatur des Eisschmelzens verursacht. Laut der Clausius-ClapeyronGleichung liegt die Temperatur des Eisschmelzens unter dem Draht bei etwa -0,75°C. Sobald die Temperatur unter dem Draht oder der Saite diesen Wert erreicht, so schmilzt das Eis unter der Saite, das Wasser über ihr gefriert bei dieser Temperatur jedoch wieder. Der Draht (die Saite) ist ein guter Wärmeleiter, deshalb kommt es zur Eiserwärmung unter ihm – erneut taut das Eis und das Wasser über dem Draht schmilzt. Wenn wir den Versuch draußen bei einer Temperatur durchführen würden, die niedriger ist als die verringerte Schmelztemperatur unter der Saite, so würde der Draht nicht ins Eis schneiden. Wenn wir anstelle des Drahts Kevlar-Garn verwenden würden, würde der gesamte Prozess weitaus länger dauern. Das Garn würde sich durch die Wärmeleitfähigkeit nicht erwärmen und das Eis würde erst dann auftauen, wenn die Eistemperatur den Wert des Eisschmelzens unter höherem Druck unter dem Kevlar-Garn erreichen würde . PROJEKT ARBEITSBL ÄT TER WISSENSCHAFT UND TECHNIK MACHEN UNS SPASS! THERMODYNAMIK Für mehrere Stunden geben wir die Flasche mit dem Sodawasser in den Gefrierschrank. Die Flasche darf jedoch nicht allzu lange im Gefrierschrank bleiben, damit kein Eis in der Flasche entsteht. Auf diese Weise kann Wasser auf -7°C unterkühlt werden. Was passiert, wenn wir diese Flasche aus dem Gefrierschrank holen und sie sogleich öffnen? Welche Temperatur zeigt das Thermometer, das wir gleich nach dem Öffnen in die Flasche stecken? Die Unterkühlung ist ein Prozess, bei welchem die Flüssigkeit unter den Gefrierpunkt abgekühlt wird, es jedoch nicht zu ihrer Erstarrung kommt. Flüssigkeit kristallisiert bei einer Temperatur, die niedriger ist als der Gefrierpunkt. Es muss darin ein Kristallisationspunkt anwesend sein, in dessen Umgebung eine Kristallstruktur entsteht. Wenn sich dieses Zentrum nicht in der Flüssigkeit befindet, so überdauert der flüssige Aggregatzustand bis zu der Temperatur, bei der es zur so genannten homogenen Nukleation kommt. Wasser hat einen Gefrierpunkt von 0°C (273,15 K). Bei normalem Druck kann es auf fast -42°C (231 K) unterkühlt werden. Tropfen unterkühlten Wassers befinden sich zum Beispiel in Wolken; wenn es zum Kontakt mit Flugzeugflügeln kommt, wandeln sich diese Tropfen augenblicklich in Eis um. Ein sehr ähnliches Phänomen stellt die übersättigte Lösung dar, die auch als unterkühlte Flüssigkeit angesehen werden kann. Sie kann durch vorsichtiges Unterkühlen einer gesättigten Lösung eines Stoffes vorbereitet werden, bei welcher eine große Abhängigkeit der Löslichkeit von der Temperatur vorherrscht (Natriumacetat, Calciumnitrat). FINANZIERT AUS PROGRAM 11 lassen), die gleiche Wassermenge, die gleiche VERSUCH NR.4: Anfangstemperatur. Diesmal bedecken wir den Top allerdings mit dem Deckel. Wir messen und Kochen von Wasser – energetischer Aufwand berechnen die gleichen Größen wie im vorangehenden Fall. 3) Wir gießen einen Liter kaltes Wasser in den Wasserkocher und bringen das Wasser zum Kochen. Wir messen erneut die Zeit und berechnen die oben angeführten physikalischen Größen Wir vergleichen die gemessenen Werte und leiten davon Schlussfolgerungen ab. Hilfsmittel: Topf, Topfdeckel, Elektrokocher, Wasserschnellkocher, Messbecher (Wattmeter) a) Durch das Kochen mit Topfdeckel sparen wir einen Teil der Energie und somit auch der Finanzen ein. Wir messen die Temperatur von kaltem Wasser, die aus dem Wasserhahn fließt. Mithilfe des Messbe- b) Der Wasserschnellkocher hat eine deutlich höhere Leistung (rund 90%) als der Kocher (rund 50%), chers messen wir ein Liter Wasser ab. Im Falle, dass auch die Aufwärmzeit ist deutlich kürzer. Wir uns kein Wattmeter zur Verfügung steht, stellen wir aus der Gebrauchsanweisung den Leistungsbedarf des Elektrokochers fest, auf welchem wir das Wasser kochen werden. Gleichzeitig muss in Betracht gezogen werden, für welche Stufe des Kochers der Leistungsbedarf angeführt ist (meist gilt dies für die höchste Stufe, dem ist aber nicht immer so). Im Falle, dass uns ein Wattmeter zur Verfügung steht, schalten wir den Kocher über diesen an. Desweiteren stellen wir den Leistungsaufwand des Wasserkochers fest. 1) Wir schütten einen Liter kaltes Wasser in den Topf, den Topf decken wir nicht mit dem Topfdeckel ab und bringen das Wasser zum Kochen. Wir messen die Zeit, die das Wasser zum Erreichen des Siedepunktes gebraucht hat und bestimmen den Verbrauch elektrischer Energie. Gleichzeitig berechnen wir die Wärmemenge, die das Wasser angenommen hat (wir kennen die Menge, die Anfangs- und die Endtemperatur und die gemessene Wärmekapazität des Wassers). Desweiteren sparen weitere Energie und zugleich Zeit. Wenn wir Wasser in einem Topf ohne Deckel erwärmen, gelangt der Wasserdampf in die Umgebung und dadurch kommt es zu einem deutlichen Verdunsten des Wassers an der Oberfläche des Topfes. Dadurch kommt es zu großen Verlusten der inneren Energie. Wenn wir einen Topfdeckel verwenden, entsteht zwischen dem Deckel und dem Wasserspiegel satter Dampf. Dieser entweicht nirgendwohin und deshalb wird die Energie für das Erwärmen des Wassers und weniger für die Herstellung von Dampf verwendet. Deshalb beschleunigt sich die Erwärmung. Beim Wasserschnellkocher ist die Heizspirale unter dem Wasser am Boden angebracht. Deshalb wird nahezu die gesamte Energie für die Wassererwärmung verwendet. Im Falle eines Kochers wird ein Teil der Energie für die Erwärmung der Luft in der Umgebung des Topfes und für die Erwärmung des Kochers selbst verwendet. bestimmen wir die ungefähre Wirksamkeit des Kochers bei der Wassererwärmung. 2) Den oben angeführten Versuch wiederholen wir. Wir verwenden den gleichen Topf (wir sollten ihn auf die Temperatur des Umfeldes abkühlen PROJEKT ARBEITSBL ÄT TER WISSENSCHAFT UND TECHNIK MACHEN UNS SPASS! THERMODYNAMIK FINANZIERT AUS PROGRAM 12 VERSUCH NR. 5: Gekühlte Getränke Hilfsmittel: 2 Plastikbecher, Thermometer, Wagen, Geschirrtuch, Hammer, Eiswürfel, Getränk mit Zimmertemperatur Warum wird zum Kühlen von Getränken im Sommer Eis und nicht kaltes Wasser verwendet? Wenn wir zum Abkühlen Eis verwenden, entnehmen wir dem warmen Getränk neben der oben In zwei Plastikbecher geben wir die gleiche Menge angeführten Wärme auch die Aggregatwärme des Mineralwasser, zum Beispiel 100g. In den ersten Tauens. Dies ist Wärme, welche das Eis beim Tauen Becher geben wir einen Eiswürfel oder bestenfalls annimmt. Wenn der Eiswürfel zu kleinen Stücken zerstoßenes Eis (wir wickeln den Eiswürfel in ein zerstoßen ist, erhöht die größere Oberfläche die Tau- Geschirrtuch und zerstoßen es mit dem Hammer). geschwindigkeit. In den zweiten Becher geben wir kaltes Wasser mit Die Endtemperatur unterscheidet sich mit der einer Temperatur von 0°C. Das Gewicht dieses kalten Sorte der verwendeten Flüssigkeit. Wenn wir anstelle Wassers muss identisch sein mit dem Gewicht des von Limo ein alkoholisches Getränk verwenden, so Eiswürfels im ersten Becher. Das Wasser mit dem kühlt dieses mehr ab, weil es eine niedrigere Messka- zerstoßenen Eis rühren wir langsam mit dem Ther- pazität hat. mometer und warten, bis das Eis aufgetaut ist. Die Mischung im zweiten Becher verrühren wir ebenfalls und warten, bis sich die Temperatur stabilisiert hat. Wir vergleichen die Endtemperaturen beider Getränke. Im Falle der Verwendung von zerstoßenem Eis kommt es zu einer deutlichen Abkühlung des Getränks (bei 100g Mineralwasser mit 20°C und 20g Eis mit 0°C wird sich die Endtemperatur ungefähr auf 4,5°C belaufen), im Falle der Verwendung von kaltem Wasser wird sich die Temperatur nicht sonderlich senken (wenn wir 20g Wasser mit 0°C verwenden, wird sich die Endtemperatur auf 17°C belaufen). Im Falle, dass wir zum Abkühlen kaltes Wasser verwenden, entnehmen wir dem warmen Getränk Wärme, welche laut der kalorimetrischen Gleichung gleich der Wärme ist, die wir dem Wasser beifügen müssen, damit es sich von 0°C auf die Endtemperatur erwärmt. PROJEKT ARBEITSBL ÄT TER WISSENSCHAFT UND TECHNIK MACHEN UNS SPASS! THERMODYNAMIK FINANZIERT AUS PROGRAM 13 VERSUCH NR. 6: Genauigkeit von Wärme im Wasser Hilfsmittel: zwei gleiche Becher, Thermometer, Metalllöffel Wir bereiten zwei gleiche Becher vor. Wir schütten die gleiche Mengen heißes Wasser mit derselben Temperatur hinein und legen einen Löffel in einen der beiden Becher. Nach einer Weile messen wir die Wassertemperatur in beiden Bechern. Das Wasser im Becher mit dem Löffel wird kälter sein. Auch bei der Wiederholung des Versuchs kommen wir zu dem Schluss, dass das Wasser im Becher mit dem Löffel schneller abkühlt. Wärme verbreitet sich im Wasser überwiegend durch Strömung, Leitung wird hier kaum angewandt. Aus diesem Grund dauert es lange, bis das Wasser abgekühlt ist, soweit wir nicht rühren. Das Wasser kühlt durch den Wärmeaustausch mit der Luft an der Oberfläche aus. Das kältere Wasser sinkt nach unten, an seine Stelle steigt wärmeres Wasser auf (dies gilt für den Fall, dass die Wassertemperatur höher ist als 4°C). Wenn wir einen Metalllöffel in den Becher geben (ein guter Wärmeleiter), kommt es dadurch zum Wärmeaustausch zwischen Wasser am Boden und Wasser an der Oberfläche. Dies beschleunigt die Abkühlung von Wasser. Gleichzeitig kommt es zum Wärmeaustausch zwischen dem Ende des Löffels, das aus dem Wasser herausragt und der umgebenden Luft. Dieser Einfluss ist jedoch nicht allzu bedeutend. PROJEKT ARBEITSBL ÄT TER WISSENSCHAFT UND TECHNIK MACHEN UNS SPASS! THERMODYNAMIK FINANZIERT AUS PROGRAM 14 5. Ein Schnellball mit einem Gewicht von 0,2 kg Test 1 prallt mit einer Geschwindigkeit von 30 m.s-1 an eine Hauswand und kommt zum Stehen. Um welchen Wert steigt die innere Energie des Schneeballs und der Wand? 1. Wie drücken wir die Wärme t = 300°C in Kelvin a) 6 J aus? b) 30 J a) T = 573 K c) 90 J b) T = 300 K d) 180 J c) T = 273 K d) T = 27 K Auf dem Bild sind Graphen aufgezeichnet, die die Temperaturänderung dreier Körper als Wär- 2. Wie drücken wir die Wärme T = 300 K in Grad Celsius aus? mefunktion veranschaulichen, die diese Körper angenommen haben. a) t = 573 °C b) t = 300 °C t[°C] c) t = 273 °C d) t = 27 °C 3. Der Temperaturunterschied zweier Körper ist Δt = 300 °C. Wie drücken wir diesen Temperaturunterschied in Kelvin aus? a) ΔT = 573 K 80 1 60 2 40 3 20 b) ΔT = 300 K c) ΔT = 273 K 0 d) ΔT = 27 K 4. . Ein Stein mit einem Gewicht von 2 kg fällt 10 20 30 40 50 Q[kJ] 6. Welcher der drei Körper hat die meiste Wärme im freien Fall von 30 m Höhe in den Sand. Um angenommen? welchen Wert steigt die innere Energie des Steins a) Körper 1 und des Sandes? b) Körper 2 a) 30 J c) Körper 3 b) 60 J d) alle gleich c) 300 J d) 600 J 7. Welcher dieser drei Körper hat die größte Wärmekapazität? a) Körper 1 b) Körper 2 c) Körper 3 d) alle gleich PROJEKT ARBEITSBL ÄT TER WISSENSCHAFT UND TECHNIK MACHEN UNS SPASS! THERMODYNAMIK FINANZIERT AUS PROGRAM 15 Auf dem Bild ist ein Graph aufgezeichnet, der die Das thermodynamische System, auf welches Temperaturveränderung des Körpers mit einem äußere Kräfte einwirken, nimmt von der Umge- Gewicht von 4kg als Wärmefunktion verans- bung Wärme im Wert von 20 kJ an. chaulicht, die vom Körper angenommen wurde. 11.Welche Arbeit verrichtet das System, wenn seine innere Energie um 15kJ steigt? t[°C] a) 5 kJ 40 b) 15 kJ c) 20 kJ 30 d) 35 kJ 20 12.Wie verändert sich die innere Energie des Systems, wenn es Arbeit von 25kJ verrichtet? 10 a) sie wächst um 25 kJ 0 10 20 30 40 50 60 Q[kJ] b) sie wächst um 5 kJ c) sie sinkt um 25 kJ d) sie sinkt um 5 kJ 8. Welche Wärme nimmt ein Körper bei der Erwärmung von 20°C auf 40°C an? a) 20 kJ b) 40 kJ c) 60 kJ d) 80 kJ 9. Welche Wärmekapazität hat der Körper? a) 0,5 kJ · K-1 b) 2 kJ · K-1 c) 10 kJ · K-1 d) 40 kJ · K-1 10.Welche gemessene Wärmekapazität hat der Körper? a) 0,5 b)2 c)8 d) 10 PROJEKT ARBEITSBL ÄT TER WISSENSCHAFT UND TECHNIK MACHEN UNS SPASS! THERMODYNAMIK FINANZIERT AUS PROGRAM 16 Auf dem nächsten Bild sind vier Graphen ABCD, die den Druck P als Umfangsfunktion V verdeut- Test 2 lichen. A p 1. Bei welchem Prozess beleibt die innere Energie von Gas konstant? a) beim isometrischen b) beim isochorischen 0 c) beim isobarischen d) beim adiabatischen B p V 2. Bei welchem Prozess verrichtet Gas keine Arbeit? a) beim isometrischen b) beim isochorischen c) beim isobarischen 0 d) beim adiabatischen 3. Bei welchem Prozess verrichtet Gas Arbeit auf C p V Kosten der inneren Energie? a) beim isometrischen b) beim isochorischen c) beim isobarischen 0 d) beim adiabatischen Auf dem Grafen, der den Umfang V idealer Gase V D p als Wärmefunktion T verdeutlicht, werden drei Prozesse veranschaulicht, bei welchen Gas vom Zustand 1 in einen der Zustände 2, 3 und 4 übergeht. 0 V 2 3 V 4. Welcher der Graphen A, B, C, D entspricht dem Prozess 1-2, d.h. dem Übergang idealer Gase aus Zustand 1 in Zustand 2? a) Graph A b) Graph B 4 1 c) Graph C d) Graph D 0 T PROJEKT ARBEITSBL ÄT TER WISSENSCHAFT UND TECHNIK MACHEN UNS SPASS! THERMODYNAMIK FINANZIERT AUS PROGRAM 17 5. Welcher der Graphen A, B, C, D entspricht dem Auf dem Bild ist der Graph eines reversiblen Prozess 1-3? Kreisprozesses mit idealen Gasen im Diagramm a) Graph A p-V abgebildet. Die Reihenfolge der Gaszustände b) Graph B ist ABCA. c) Graph C d) Graph D p [MPa] 4 6. Welcher der Graphen A, B, C, D entspricht dem Prozess 1-4? A B 3 a) Graph A b) Graph B 2 c) Graph C 1 d) Graph D IIdeale Gase mit einem Gewicht von 0,2 kg haben 0 bei einer Temperatur von 27°C einen Umfang von C 2 4 6 8 10 V [1 litr] 0,4 m3 und einen Druck von 2.105 Pa. Die gemessene Wärmekapazität des Gases bei konstantem Umfang liegt bei 0,6 10. Welche Arbeit verrichtet das Gas beim Prozess, der auf Strecke AB veranschaulicht ist? . a) 0 kJ b) 18 kJ konstanter Temperatur der Druck auf 4.105 Pa c) 24 kJ erhöht? d) 32 kJ 7. Welches ist der Gasumfang, wenn sich bei a) 0,1 m 3 b) 0,2 m3 11. Welche Arbeit verrichtet das Gas beim Prozess, c) 0,8 m der auf der Strecke CA veranschaulicht ist? d) 1,6 m 3 3 8. Welches ist der Gasdruck bei einem Umfang von 0,1 m3 und einer Temperatur von 327 °C? a) 0 kJ b) 2 kJ c) 6 kJ d) 8 kJ a) 1,105 Pa b) 4,105 Pa 12. Welche Arbeit verrichtet das Gas beim Kreispro- c) 8,105 Pa zess ABCA? d) 16,105 Pa a) 3 kJ b) 9 kJ c) 18 kJ d) 24 kJ 9. Welche Wärme fügen wir dem Gas bei, wenn sich seine Temperatur bei konstantem Umfang von 27 °C auf 327 °C erhöht? a) 36 kJ b) 60 kJ c) 69 kJ d) 180 kJ PROJEKT ARBEITSBL ÄT TER WISSENSCHAFT UND TECHNIK MACHEN UNS SPASS! THERMODYNAMIK FINANZIERT AUS PROGRAM 18 Auf dem Bild ist das Phasendiagramm eines bestimmten Stoffes abgebildet. Test 3 p K B C Flüssigkeit mit einem Gewicht von 2 kg wird auf T Siedetemperatur aufgewärmt. Bei dieser Temperatur verdampft sie gänzlich. Auf dem Bild ist ein Graf A abgebildet, der die Temperaturänderung als Funktion angenommener Wärme veranschaulicht. Ihr solltet voraussetzen, dass die Flüssigkeit erst während des Kochens zu verdampfen beginnt. 0 T 3. In welchem Aggregatzustand befindet sich ein Stoff, wenn sein Zustand durch Punkt B verans- t[°C] chaulicht wird? 100 a) im festen Aggregatzustand 80 b) im flüssigen Aggregatzustand 60 c) im gasförmigen Aggregatzustand 40 d) im flüssigen und im gasförmigen Aggregatzustand 20 0 200 400 4. In welchem Aggregatzustand befindet sich ein 600 800 Q[kJ] Stoff, wenn sein Zustand durch Punkt C veranschaulicht wird? 1. Welches ist die Aggregatwärme des Kochens bei a) im festen Aggregatzustand der gegebenen Flüssigkeitsmenge? b) im flüssigen Aggregatzustand a) 200 kJ c) im gasförmigen Aggregatzustand b) 400 kJ d) im flüssigen und im gasförmigen Aggregat- c) 600 kJ zustand d) 800 kJ 5. Jakou změnu představuje přechod kapaliny ze 2. Welches ist die gemessene Aggregatwärme des stavu zobrazeného bodem D do stavu zobraze- Kochens der jeweiligen Flüssigkeit? ného bodem C? a) 80 kJ · K a)Tauen -1 b) 300 kJ · K b)Gefrieren c) 400 kJ · K c)Verdampfen d) 600 kJ · K d) Kondensation -1 -1 -1 PROJEKT ARBEITSBL ÄT TER WISSENSCHAFT UND TECHNIK MACHEN UNS SPASS! THERMODYNAMIK FINANZIERT AUS PROGRAM 19 6. Wie verändert sich die Tau- und die Siedetemperatur eines Stoffes bei einer Senkung des äußeren Drucks? a) Die Tautemperatur sinkt, die Siedetemperatur steigt b) Die Tautemperatur steigt, die Siedetemperatur sinkt c) Die Tautemperatur und die Siedetemperatur steigen d) Die Tautemperatur und die Siedetemperatur sinken PROJEKT ARBEITSBL ÄT TER WISSENSCHAFT UND TECHNIK MACHEN UNS SPASS! THERMODYNAMIK FINANZIERT AUS PROGRAM 20