Lösungsblatt 10 ausgegeben am 18. 06. 2007
Werbung

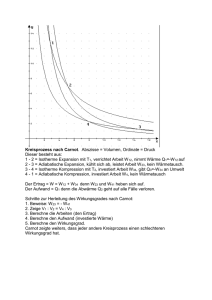
3 Lösungen Lösung zu 65. (a) Siehe Abbildung 1. (b) Schritt I: freie adiabatische Expansion, also ist δW = 0, δQ = 0 und damit T2 = T1 . Folglich ist nach 1. Hauptsatz auch ∆U = 0. Schritt II: isobare Kompression, also ist δQ = cp ∆T = cp (T1 − T3 ) und ∆W = −nR(T1 − T3 ). Zur Vervollständigung noch ∆U = δQ + δW = cp (T1 − T3 ) − nR(T1 − T3 ) Schritt III: isochore Erwärmung, heisst Volumen konstant, also dV = 0 und damit keine verrichtete ArbeitδW = 0. Dann ist δQ = ∆U = cV (T1 − T3 ). Die verrichtete Arbeit ergibt sich also nur aus Schritt II. (c) Bei einem irreversiblen Prozess muss I δQ <0 T Abbildung 1: Der Mayersche Kreisprozess. 4 gelten. Also jetzt einfach Einsetzen: I Z Z Z δQ δQ δQ δQ = + + T T T T I II ZT3 = 0+ ncp III dT + T T1 ZT1 ncV dT T T3 T1 T3 + ncV ln T1 T3 T1 = (cV − cp ) · n · ln <0 T3 = ncp ln Das Ergebnis ist kleiner Null, da T1 > T3 und cV < cp ist. Lösung zu 66. Zunächst eine Nebenrechnung zur Bestimmung der Anzahl der Mole 3 · 105 mN2 · 0.5m3 p1 V1 n= = = 42.65mol J RT 8.314 mol·K · 423K kJ kJ cp = 1.005 kg·K und damit Cp = 29.1 kmol·K . dQ = nCV dT + pdV und ∆S = nCV ln T2 T1 + nR ln V2 V1 Man beachte auch noch Cp − CV = R V2 T2 p1 = V1 T1 p2 Dann folgt ∆S = S2 − S1 = nCV ln p2 V2 T2 p2 + nCp ln = nCp ln − nR ln p1 V1 T1 p1 Jetzt die bekannten Größen einsetzen: ∆S = 42.65mol·29.1 kJ 293 J 0.8 J ·ln −42.65mol·8.314 ·ln = 12.97 kmol · K 423 mol · K 3 K Das Endvolumen ergibt sich dann zu V −2= 42.65 · 8.314 · 293 3 nRT2 = m = 1.299m3 5 p2 0.8 · 10 5 Abbildung 2: Zu Aufgabe 68: Die Fläche unter der Kurve ist die zugeführte Wärme, was der Entropieänderung entspricht Lösung zu 67. Die Längenänderung des Bandes beträgt ∆l = l0 · α · ∆T . Sei ε die relative Längenänderung ε = ∆l = l0 α∆T und F = A · E · ε. l0 l0 F = 2 · 10−4 m2 · 206 · 109 N 1 · 1.2 · 10−5 · 280K = 138.4kN 2 m K Lösung zu 68. Gegeben sind m = 100g. Das sind 3.453mol Luft. p = 2bar, T1 = 293K, T2 = J J 383K, cp = 29.1 mol·K und cV = cp − R = 20.79 mol·K . Die Entropiedifferenz ist ∆S21 = S2 − S1 V2 = ncp ln V1 weil isobar (p1 = p2 ) erwärmt wird. ∆S21 = ncp ln T2 T1 = 34.53 · 29.1J · K −1 ln 383 = 269.2J · K −1 293 ∆Q = ncp (T2 − T1 ) 383 kJ cdot ln = 0.710 K 293 = 90.45kJ 6 Abbildung 3: Zu Aufgabe 68: Die Fläche 1-2-b-d entspricht der gesamten zugeführten Wärme. Die Fläche a-2-b-c entspricht der Wärme, die zur Erhöhung der inneren Energie ∆U erforderlich ist. Die Fläche d-1-2-a-c entspricht der in Arbeit umgewandeltem Wärme. Teilweise wird die Wärme in Volumenarbeit umgewandelt W12 = nR(T2 − T1 ) = 0.287 kJ (383 − 293)K = 25.83kJ K Die Entropiedifferenz bei konstantem Volumen, also der Anteil der Entropiedifferenz, der sich für die Änderung der inneren Energie ergibt, ist ∆S = S2 − S1 = ncV ln T −2 383 = 0.719kJ · K −1 · ln = 0.193kJ · K −1 T1 293 Lösung zu 69. Der Carnot-Prozess wurde schon mehrmals behandelt und daher als bekannt angenommen. Es gilt T2 − T1 = −m · cV dW = dQ · T2 µ ¶ T2 − 1 dT T1 Die Temperaturen bestimmen dabei den Wirkungsgrad der Carnot-Maschine. Die Dichte von Wasser sei hier mit 1kg pro Liter angenommen. Also haben 5 7 Liter die Masse 5kg. Die Arbeit findet man dann durch Integration: ZT0 W = −mcV T2 dT + mcV T dT T2 T2 = mcV T2 ln ZT0 T2 − mcV (T2 − T0 ) T0 = 5kg · 4.18kJ kg −1 K −1 · 298K · ln 298 − 5kg · 4.18kJ kg −1 K −1 · 25K = 23.2kJ 273 der Wirkungsgrad η bestimmt sich aus den angegebenen Temperaturen η= T2 − T1 = 0.0839 T2 Nun muss man noch beachten, dass die Kristallisations- bzw. Schmelzwärme aufgebracht werden muss. ΛS = 5kg · 333.1 kJ = 1.67M J kg Für die Überführung dieser Wärme ist die Arbeit W = QS · η = 1.67M J · 0.0839 = 140.8kJ erforderlich. Die Gesamtarbeit ist also Wges = 175.6kJ. Lösung zu 70. Zunächst allgemeines zur Entropie. Die Entropie ist eine Zustandsfunktion. Sie ist für eine reversible infinitesimale Zustandsänderung eines Stoffsystems bei der Temperatur T durch die Aufnahme der Wärmemenge δQ definiert. dS = δQ T Die Änderung zwischen zwei Zuständen 1 und 2 ist gegeben durch Z2 ∆S = S2 − S1 = δQ T 1 Allgemeines zur Entropie: 1. Bei einem reversiblen Prozess bleibt die Entropie konstant. 2. Für ein ideales Gas ergibt sich für eine reversible Zustandsänderung dS = dU + pdV dV δQrev = +R T T V 8 Für eine Isobare: ∆Sisobar = CV ln T2 V2 + R ln T1 V1 ∆Sisochor = Cp ln T2 p2 − R ln T1 p1 Für eine Isochore: Für den Kreisprozess nach Carnot: (a) isotherme Kompression (1 nach 2) Z Z Z δQ pdV dV V2 S2 − S1 = = = nR = nR ln T T V V1 (b) adiabatische Expansion (2 nach 3): Z S3 − S2 = δQ =0 T (c) isotherme Expansion (3 nach 4): Z Z Z δQ pdV dV V4 S4 − S3 = = = nR = nR ln T T V V3 (d) adiabatische Kompression (4 nach 1): Z δQ S1 − S4 = =0 T Als Summe über alle Änderungen der Entropie ergibt sich: ∆S = nR ln V2 V4 + 0 + nR ln +0 V1 V3 Für adiabatische Prozesse gilt T2 · V1κ−1 = T1 · V2κ−1 und T1 · V3κ−1 = T2 · V4κ−1 Division der beiden Gleichungen ergibt: V2 V1 = V4 V3 umgeformt auch V2 V3 = V4 V1 und noch logarithmiert − ln V2 V4 = ln V3 V1 9 Also folgt jetzt ∆S = nR ln V2 V4 + 0 + nR ln +0=0 V1 V3 Lösung zu 71. Es erfolgt keine Wärmeaustausch, also handelt es sich um eine adiabatische Zustandsänderung. Volumina: V1 = A · l1 = πr2 · l1 = 0.0157m3 V2 = πr2 · l2 = 0.00942m3 Die Temperatur ist 293K, p1 = 105 mN2 , κ = 1.4. Mit dem 1. Hauptsatz findet sich Q12 = mcV (T2 − T1 ) − W12 = 0 Also W12 = mcV (T2 − T1 ) Für Adiabaten gilt pV κ = const µ ¶κ−1 V2 T1 = T2 V1 µ ¶κ V2 p1 = p2 V1 µ ¶ κ−1 T1 p1 κ = T2 p2 mit κ = cp cV und cp − cV = R. Dann weiter W12 = ncV (T2 − T1 ) = n R (T2 − T1 ) κ−1 1 (p2 V2 − p1 V1 ) κ − 1 µµ ¶ ¶ p1 V1 T2 = −1 κ−1 T1 õ ¶ κ−1 ! p1 V1 p2 κ = −1 κ−1 p1 ! õ ¶ κ−1 p1 V1 V1 − 1 = 890N m = κ−1 V2 = 10 Die Endtempertaur nach der Verdichtung ist T2 = T1 µ V1 V2 ¶κ−1 = 1.227 Also T2 = 359.5K = 86.5◦ C. Der Endruck beträgt µ ¶κ p2 V1 = = 2.04 p1 V2 Also ist der Enddruck p2 = 2.04bar. Lösung zu 72. Zunächst nutzen wir den 1. und 2. Hauptsatz und finden: dS = δQ 1 p = dU + dV T T T Die Zustandsgleichungen umgeformt ergeben 1 mcV = T U p nR T V Das wir oben eingesetzt µ R dV dU + dS = m cV U mm V ¶ Integration vom Ausgangszustand bis zum aktuellen, also von z0 (U0 , V0 , m) bis z(U, V, m) ergibt µ ¶ U R V S(U, V, m) = S0 + m cV ln + ln U0 m m V 0