TM-Begleitung der Stammzellentransplantation
Werbung

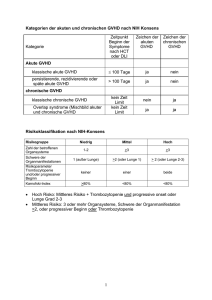
Transfusionmedizinische Begleitung der Stammzelltransplantation Nina Worel Univ. Klinik f. Blutgruppenserologie and Transfusionsmedizin AKH Wien Medizinische Universität Wien Transfusionsmedizin und Transplantation Transplantation Versorgung mit Blutkomponenten Prä-, peri- und post-transplant Bearbeitung von Transplantaten Plasma-, Erythrozytendepletion Therapeutische Apheresen Erythrozytenaustausch Plasmaaustausch, Immunadsorption Extrakorporale Photopherese Transplantation Altersverteilung allogene SZT 1995 bis 2005 (n=1362) myeloablativ dosisreduziert >70y 60-69y 60-69y 50-59y 50-59y 40-49y 40-49y 30-39y 30-39y 20-29y 20-29y <20y 300 <20y 250 200 150 100 50 Quelle: ASCTR 0 50 100 150 Allogene Transplantationen in A 2006 verwandt unverwandt Summe KM PBSZ KM PBSZ KM+PBSZ Kinder 8 (67%) 4 (33%) 7 (50%) 7 (50%) 26 Erwachsene 3 (5%) 53 (95%) 3 (5%) 61 (95%) 120 11 57 10 68 146 Summe Quelle: ASCTR Stammzellquelle Knochenmark späteres Engraftment Î mehr Blutprodukte nötig geringere Inzidenz an GvHD bei Verwandtenspendern Periphere Blutstammzellen rascheres Engraftment Î weniger Blutprodukte nötig höhere Inzidenz an chronischer GvHD Plazentarestblut verzögertes Engraftment Î mehr Blutprodukte nötig geringere Inzidenz an GvHD Transfusionsmedizin und Transplantation Prä-transplant Periode Planen, Ressourcen aufbauen Peri-transplant Periode Ressourcen nützen, Komplikationen beachten Post-transplant Periode Komplikationen bewältigen !! Kommunikation wichtig !! Prä-transplant Periode Transfusionsanamnese? Irreguläre Antikörper (Spender/Empfänger)? Refraktär auf PLT-Transfusionen? vor TX: Familienspenden vermeiden Leukozyten-reduzierte Blutkomponenten verwenden (HLA Immunisierung ↓) zelluläre Blutkomponenten bestrahlen (25-30 Gy) Peri-transplant Periode Stammzellquelle? Autologe oder allogene Transplantation? Verwandtenspender oder URD? Manipulation der Stammzellen? Konditionierung (myeloablative, dosisreduziert)? AB0-match? Infektionen (bakt., fungal, viral) und Antibiotika? beeinflussen Engraftment und Bedarf an Blutprodukten Blutgruppenungleiche SZT Major AB0-mm (25%) Isoaggl. gegen Spender RBC Minor AB0-mm (25%) Isoaggl. gegen Empfänger RBC Bidirektional AB0-mm (3-5%) Isoaggl. gegen Spender + Empfänger RBC Versorgung mit Erythrozyten BG Empfänger BG Spender Inkompatibilität 0 A B AB major major major 0 0 0 A B AB A 0 B AB minor biditektional major 0 0 0 B AB B 0 A AB minor bidirektional major 0 0 0 A AB AB 0 A B minor minor minor 0 A B - Empfehlungen AKH ab Konditionierung ab Verschwinden der Empfänger-Isoaggl.* *Nur relevant bei major AB0-mm CMV: spezifischer Riskofaktor in der SZT Prävalenz je nach Alter 40-90% intrazellulär Monozyten/Makrophagen TT-CMV Infektion nach KM-/ PBSZT nach Organtransplantation immungeschwächte Patienten nach CHT/Strahlentherapie CMV Infektion/Reaktivierung, CMV Disease CMV: spezifischer Riskofaktor in der SZT Prävention: CMV seronegative Spender Leukozytenfiltration (Reduktion von 3-log) Leukozytendepletion vergleichbar mit Filtration CMV seroneg. Spender > Leukozytenfiltraton Garret Blood 2003 Alternative: Pathogeninaktivierung Versorgung mit Thrombozyten Blutungsprophylaxe: 20 G/l Apherese-TK > Pool-TK Leukozyten-depletierte TK Bestrahlung mit 25-30 Gy CMV negative Produkte oder Pathogeninaktivierung Gurkan BMT 2007 Thrombozyten Refraktärzustand Wenn Transfusion von 2 unabhängigen (AB0-kompatiblen) TK mit mindestens 2 x1011 Plt. zu keinem oder nur marginalem Anstieg der Thrombozyten im preripheren Blut (CCI < 5-7 G/l) führt. Inzidenze bei prophylaktischen Transfusionen bei 25% fehlender Anstieg der Thrombozytenwerte Thrombozyten Refraktärzustand Immunologische Ursachen HLA- (40%); HPA-Antikörper (15%) Major, minor ABO-Inkompatibilität Nicht-Immunologische Ursachen (50%) Splenomegalie Fieber, Infektionen Antibiotika, Amphotericin B, ATG Disseminierte intravasale Gerinnung VOD, GvHD Thrombozyten Refraktärzustand: Logistik AK-Suche (PRA, HPA) HLA typisierte Spender HPA typisierte Spender SZ-Spender als TK-Spender? Crossmatch neg. Spender (LCT)? Frische AB0-idente TK, ev. HLA- bzw. HPA gematched (LCT) Stammzellmanipulation Volumenreduktion (kleiner Empfänger) Erythrozytendepletion (major AB0-Inkompatibilität) Plasmadepletion (minor AB0-Inkompatibilität) CD34- Selektion, B- oder T-Zelldepletion Kryopreservation und Lagerung (meist autolog) Verlust an Stammzellen, verzögertes Engraftment möglich AB0-mismatch : eine klinische Herausforderung Hämolyse während TX: Isoagglutinine des Empfängers (major) Isoagglutinine im Transplantat (minor) Verspätet: rasche Isoagglutinin-Produktion der Spenderlymphozyten (minor) AB0-mismatch : eine klinische Herausforderung Hämolyse während TX: Isoagglutinine des Empfängers (major) Isoagglutinine im Transplantat (minor) Verspätet: rasche Isoagglutinin-Produktion der Spenderlymphozyten (minor) verzögertes RBC Engraftment / Pure Red Cell Aplasie persistierende Isoagglutinine des Empfängers (major) Manipulation bei major AB0-mm Knochenmark: 20-30% Hkt (ca 500ml RBC) PBSZ: 2-15% Hkt (10-30ml RBC) CAVE: Hämolyse während Transplantation Prophylaxe: 1. kontrollierte „Fehltransfusion“ mit RBC der Spenderblutgruppe (um Isoagglutinine zu adsorbieren) 2. Plasmaaustausch um Isoagglutinine vor TX zu entfernen 3. Erythrozytendepletion aus den KM Erythrozytendepletion mit der Cobe Spectra vor nach Rec. % med. range med. range median Volumen (ml) 1403 770 - 1598 82 62 - 128 5.9 Hkt % 24.5 17.5 – 34.4 6.6 3.4 – 23.4 -- RBC mL 344 19.5 – 530 5.4 2.6 – 18.7 1.6 WBC x 109 13.3 3.5 – 31.2 4.2 1.4 – 12.7 32.3 CD34 % 0.51 0.18 – 1.67 1.5 0.45 – 5.8 74.5 CD34 x 106 70.5 8.15 – 244.4 62.2 8.47 – 219.5 76.7 Transplant-assozierte Komplikationen Hämolyse nach minor AB0-Inkompatibilität TA-Thrombotische Mikroangiopathie (TAM) Pure Red Cell Aplasie (PRCA) Graft-versus-host Erkrankung (GvHD) ESFH 2005 Hämolyse bei minor AB0-Inkompatibilität 35 † day 35 (MOF) 25 15 1800 Patient 2 1400 Patient 3 1000 600 200 0 10 20 Tage nach allogener RIC-SZT Worel et al. Transfusion 2002 30 LDH U/L Hämatokrit % Red Cell Exchange (RE) Hämolyse nach minor AB0-inkomp. SZT Risiko: Dosisreduzierte SZT ohne MTX Myeloablative SZT ohne MTX Labor: Hb Abfall >2 g/dL, LDH Anstieg >50%, Bilirubin >100% in 24 Std. Gleichzeitig Empfänger-RBC und Spender-Isoagglutinine vorhanden Erythrozytenaustausch: therapeutisch / prophylaktisch Prophylaktischer Erythrozytenaustausch Months after RIC-SCT 100 Alter EK / Austausch Patienten mit NW Zitratreaktion Hypotonie / Übelkeit n=20 54 (34-63)* 8 (5-10)* 4 (20%) 2 2/2 Probability of TRM % Patienten (11 M / 9 F) p=0.023 80 60 No prophylactic RBC exchange (n=13) 40 20 prophylactic RBC exchange (n=20) * Median (range) 0 24 48 72 Schlussfolgerung Sicher durchführbar, Nebenwirkungen tolerabel Keine klinisch relevanten Hämolysen nach RIC und minor AB0-mm SZT Thrombotische Mikroangiopathie (TAM) Inzidenz: 0.5-76% nach allogeneic SZT Pathophysiologie Endothelzellschädigung Definition Fragmentozyten erhöhte LDH L Niere u/o neurol. Beeinträchtigung ohne andere Ursachen Negativer direkter und indirekter Coombs Test Therapie Plasmaaustausch, Absetzten der Calcineurininhibitoren Schlussfolgerung TAM Patienten (7 M/4 F) Spender Onset TAM (Tag) Outcome n=11 8 MUD / 3 Sib 62 (9-906)* 8 / 11 alive (72%) # PE bei Survivors 16 (10-27)* # PE bei † 10 (4-30)* * Median (range) PE ist die einzige Therapieoption neben Absetzen der Calcineurininhibitoren 72% Ansprechen in unserem Patientenkollektiv ESFH 2005 Pure Red Cell Aplasie (PRCA) Inzidenz: ca 20% nach major AB0-mm SZT Verwandtenspender > MUD Persistenz der Isoagglutinine des Empfängers Fehlen der BFU-E im KM Ausschluss von: Rezidiv RBC allo-Antikörper, Hämolyse Virusinfektion ESFH 2005 ? Behandlung PRCA Elimination der Isoagglutinine Plasmaaustausch, Immunadsorption Rituximab (CD20-AK) Induktion einer GvHD Absetzten der Immunusuppression, DLI Spontane Remissionen beschrieben ESFH 2005 Schlussfolgerung PRCA PE und IA sind sichere und effiziente Möglichkeiten zur Elimination residueller Isoagglutinine und haben bei allen unseren Patienten zum RBC Engraftment geführt. IA effizienter aber teurer Æ daher vorher Versuch mit PE Auch wenn Spontanremissionen beschrieben sind ist eine frühe Behandlung (ab Tag 60) nötig um eine Transfusions-assoziierte Hämochromatose zu vermeiden. ESFH 2005 Graft-versus-Host Erkrankung 10% bis 90% akute GvHD nach SZT von einem Geschwisteroder unverwandten Spender wenig therapeutische Optionen für Patienten mit steroidrefraktärer akuter GvHD 10% bis 80% chronische GvHD, tödlich in 20-40% ESFH 2005 Photochemotherapie GvHD irradiated nucleated cells and plasma red cells & plasma whole blood UVA + 8 MOP nucleated cells & plasma ECP vorher nach 1 bzw. 6 Zyklen Haut III Haut IV Patienten mit akuter GvHD Overall Survival Transplant Related Mortality p<0.0001 p<0.0001 100 100 no CR to ECP (n=16) Probability % 80 80 CR to ECP (n=28) 60 60 All (n=44) 40 40 20 20 CR to ECP (n=28) 0 24 48 Months after SCT 72 96 no CR to ECP (n=16) 0 24 48 Months after SCT 72 96 Schlussfolgerung: ECP bei GvHD Effektiv bei Patienten mit steroid-refraktärer akuter GvHD. Hohe Responsraten bei Haut- und Leberbeteiligung bei akuter und chronischer GvHD. Frühzeitiger Einsatz kann Responsraten erhöhen und spart Steroide ein. Langzeitergebnisse zeigen dauerhafte Resolution der GvHD. ESFH 2005 Zusammenfassung Für eine optimal transfusionmedizinische Begeitung der SZT bedarf es einer engen Kooperation und guten Kommunikation zwischen der Transplantationseinheit, der und dem Transfusionsteam. ! ?