1 Konstanten
Werbung

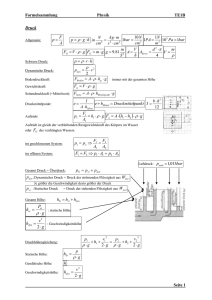
Formelsammlung 1 Konstanten c = 2, 998 · 108 ms−1 kB = 1, 38 · 10−23 = R JK −1 NA h = 6, 63 · 10−34 Js me = 9, 109 · 10−31 kg 1eV = 1, 602 · 10−19 J F = 96485 NA = 6, 0223 · 1023 Physikalische Chemie II 1 Bomze Daniel 0726183 Formelsammlung 2 Formeln 2.1 Reale und ideale Gase n2 a nRT − 2 V − nb V Vm pVm z = ideal = RT Vm a TB = Rb p= ∫p f = γ(p, T ) · p = p · e ( 0 ) z−1 ′ p dp 2.2 Thermodynamik ∆G = ∆H − T ∆S ∆G = −RT lnk ( ) 1 ∆Hr0 1 − ln(KT1 ) = ln(KT2 ) − R T1 T2 nRT Π= V ( )νi pi p0 Kp = ( )νj pj p0 ( ) pges −∆ν Kp = Kx · p0 pi = xi · pges 2.3 Elektrochemie 0 0 E 0 = EKathode − EAnode ( 0) ∂E ∆S 0 = zF ∂T p ∆G0 = −zF E Physikalische Chemie II 2 Bomze Daniel 0726183 Formelsammlung 2.3.1 Nernst-Gleichung RT E=E − · ln zF 0 2.3.2 Konzentrationszelle RT E= · ln zF ( ( aνP rodukte aνEdukte aνP rodukte aνEdukte ) ) 2.4 Photochemie 2.4.1 Quantenausbeute ϕ= NumgesetzteM olekuele NabsorbierteP hotonen 2.4.2 Energie eines Elektrons abzüglich der Austrittsarbeit E =h·ν−ϕ Ekin = m · v2 2 2.5 Ideale und reale Lösungen ai = xi · γ + − pLoesungsmittel aLoesungsmittel = ∗ pLoesungsmittel ) m∑ ( 2 2 I= i νi+ zi+ + νi− zi− 2 √ logγ + = −0.5092|z+ z− | I − 2.5.1 Henry-Gesetz Gilt für sehr kleine Konzentrationen i pi = xi · kH 2.5.2 Raoult-Gesetz pi = xi · p∗i Physikalische Chemie II 3 Bomze Daniel 0726183 Formelsammlung 2.5.3 Gefrierpunktserniedrigung und Siedepunktserhöhung ∆Tf = −Kf · mgeloesterStof f ∆Tb = Kb · mgeloesterStof f 2.6 Quantenmechanik h p p=m·v λ= E =h·ν 2.6.1 1-Dimensionaler Potentialtopf En = h2 · n2 8 · m · a2 2.6.2 3-Dimensionaler Potentialtopf h2 En = 8·m ( n2x n2y n2z + + a2 b2 c2 ) 2.6.3 harmonischer Oszillator 1 Ev = (v + ) · h · ν 2 √ 1 k ν= · 2π µ 2.6.4 starrer Rotator Ej = (j + 1)jhcB B= h 8π 2 cI I = r2 · µ m1 · m2 µ= m1 + m2 Physikalische Chemie II 4 Bomze Daniel 0726183 Formelsammlung 2.6.5 Schrödingergleichung Eindimensionale, Zeitunabhängige SG −h̄2 d2 Ψ(x) + V (x)Ψ(x) = EΨ(x) 2m dx2 Dreidimensionale, Zeitunabhängige SG ( ) d2 d2 −h̄2 d2 + + Ψ(x, y, z) + V (x, y, z)Ψ(x, y, z) = EΨ(x, y, z) 2m dx2 dz 2 dz 2 Eindimensionale, Zeitababhängige SG −h̄2 d2 ∂Ψ(x, t) Ψ(x, t) + V (x, t)Ψ(x, t) = ih̄ 2m dx2 ∂t 2.6.6 Operatoren p̂x = −ih̄ Êkin = − ∂ ∂x h̄2 ∂ 2 1 (p̂x ) p̂x = 2 2m ∂x 2m x̂ = x Êpot = V (x) h̄2 ∂ 2 + V (x) 2m ∂x2 ( ) ∂z ∂y − Îx = −ih̄ ∂z ∂y Ĥ = − 2.7 Heisenbergsche Unschärferelation ∆x > h̄ h = 2∆p 4π∆p 2.8 Statistische Thermodynamik 2.8.1 Boltzmann-Verteilung gj ∆ε nj = e− kT ni gi S = kB · ln(W ) Physikalische Chemie II 5 Bomze Daniel 0726183 Formelsammlung 2.8.2 Zustandssummen V Λ3 h Λ= √ 2πmkT 1 qV = ∆E 1 − e− kT qT = 2.8.3 molare Wärmekapazität Cv = (Cv )T + (Cv )R + (Cv )V ib (Cv )Rot 3 (Cv )T rans = R 2 lineare M olekuele : (Cv )R = R 3 (Cv )Rot gewinkelte M olekuele : (Cv )R = R 2 ( ) ∂U cv = ∂T V R e− kT 2 = ∆E ( ) ∆E 2 (kT )2 1 − e− kt ∆E (Cv )V ib Cp = Cv + R Physikalische Chemie II 6 Bomze Daniel 0726183