Die Reizleitung des Herzens
Werbung

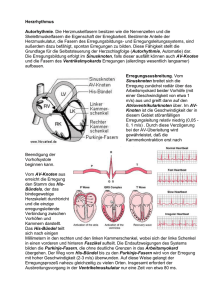
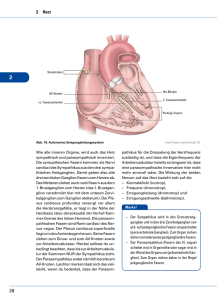
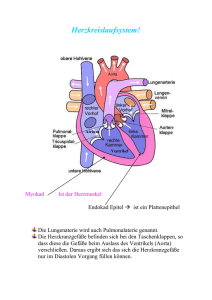
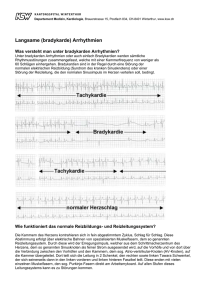
Die Reizleitung des Herzens - Eine Einleitung Wolfgang Herzberg 18.7.2014 In der Beschäftigung mit der Reizleitung des Herzens, die eigentlich nur eine Einfügung der noch fehlenden magnetischen Selbstinduktion in alle dafür vorgesehenen Leerstellen der Membranerregung werden sollte, ist sehr schnell ein Projekt geworden, in welchem die interpretatorischen Versäumnisse der letzten 75 Jahre aufgearbeitet werden müssen. Irgendwie hat eine unvollständige Membranerregungstheorie der 40er Jahre des letzten Jahrhunderts derart einschüchternde Wirkungen in den Köpfen der Forscher erzeugt, dass sie zwecks Harmonisierung mit einem Dogma, das nur Membranwiderstände, Kapazitäten und elektrische Ströme kennt, das Suchen nach einer daraus abgeleiteten, zwingend Zellgrenzen überschreitenden elektrischen Leitfähigkeit über alle anderen Fragen gestellt haben. Nachdem für diese Leitfähigkeit auch in der aufkommenden elektronenoptischen Technik histologisch kein Korrelat gefunden wurde, blieb irgendwie alles andere, was bereits „evidence based“ war, am Rande des Weges liegen, wo es bald vergessen wurde. In der Literatur können diese Schätze jedoch wieder gehoben werden: 1. Die erhellenden Tuscheversuche, die das gesamte Reizleitungssystem der Kammern als ein in sich geschlossenes Netzwerk aus quasi lymphartigen Schlauchstrukturen visualisiert haben. 2. Die eher beiläufige Feststellung im Rahmen der frustranen Suche nach den synzytialen Verbindungen innerhalb des Reizleitungssystems, dass dieses keine vasale Versorgung besitzt – übrigens eine Entdeckung, die sich schon allein aus dem fehlenden intravasalen Druckgefälle ergibt. 3. Die Durchschneidungsversuche des Reizleitungssystems, die einmal mehr den scheinbar unverwüstlichen Netzcharakter des Reizleitungssystems belegen. 4. Die „P“ Negativierung bei retrograder Vorhofstimulation liefert heute den Beweis, dass der Sinusknoten orthograd die Gegenseite jener Zellmembranen depolarisiert, die bei retrograder Stimulation erregt werden. 5. Der „Pumpstempel“ der Klappenebene, dessen Amplitude das bei weitem größte Bewegungsausmaß jeglicher Herzbewegung darstellt und via Vorhofwand an den Pulmonalabgängen zerrt. Hier liegt die Ursache für die durch lebenslange Dehnungszyklen entstehenden Myokardmanschetten der Pulmonalvenenabgänge und damit auch des Vorhofflimmerns. 6. Die Aufzeichnungen der Mitralklappenbewegungen, die sowohl auf eine vorhofseitige als auch kammerseitige Erregung schließen lassen. Allein dadurch, dass die Signalübertragung des Reizleitungssystems durch die bisher ausgeblendeten magnetischen Induktionsfelder schlüssig erklärt werden kann, können auch viele bisher für inkompatibel erachtete Bausteine logisch ineinander gefügt werden, so dass zwanglos eine Modellvorstellung entsteht, aus welcher sich eine Fülle weiterer Beobachtungen (und auch Vorhersagen) ableiten lässt. Bevor das funktionelle System der Reizleitung des Herzens in allen Details Schritt für Schritt anhand der in 100 Jahren angesammelten Untersuchungsergebnisse entwickelt werden kann, soll zunächst das gesamte in sich schlüssige Modell vorgestellt werden, damit der Leser rasch einen Gesamteindruck gewinnen kann, um später die Detaildarstellungen besser in das Ganze einordnen zu können. Die Erregungsleitung vom Sinusknoten zum av-Knoten erfolgt über das Vorhofmyokard. Der vorhofseitige Abschnitt des av-Knotens erhält seine pezifischen Fasern aus verschiedenen Richtungen der Vorhöfe, vornehmlich aber aus dem Sinus coronarius. Die Fasern entstehen in kontinuierlicher Umwandlung aus Fasern des Vorhof-Arbeitsmyokards. Sie sind wie auch das gesamte folgende System der Reizleitung von einer Bindegewebsscheide mit Basalmembran umgeben. Diese hat sich kontinuierlich aus dem Perimyseum der Vorhofmyokardfasern auf die Reizleitungsfasern fortgesetzt. Wenn die sternförmig auf den av-Knoten einstrahlenden Fasern vom Vorhofmyokard depolarisiert werden, dann erfolgt kurz darauf eine Kontraktion ihrer Myofibrillen. Der inzwischen depolarisierte vorhofseitige av-Knoten Abschnitt wird von den einstrahlenden Fasern unter Zug gesetzt. Erreicht die Erregung den mittleren av-Knoten Abschnitt, der vom vorhofseitigen Abschnitt durch den Anulus fibrosus abgegrenzt ist, erzeugt die weiter fortschreitende muskuläre Erregungsphase eine gegen den Anulus fibrosus gerichtete Verpressung der sich kontrahierenden av-Abschnitte oberhalb und unterhalb des Anulus. Die zwischen den Fasern innerhalb der Bindegewebsscheide vorhofwärts strömende Substratlösung wird im Niveau des Anulus fibrosus abgeklemmt. Dadurch ist ein hermetisch geschlossener extrazellulärer Raum geschaffen, der lediglich am Übergang der terminalen Purkinjefasern in die Myokardfasern der Kammern in Form des Perimyseums offen ist. Mit dem Fortschreiten der Depolarisationswelle im av-Knoten erzeugt der fortgesetzte Na+ Ionen Einstrom in die Reizleitungszellen aufgrund der sehr beengten extrazellulären Räume in Kombination mit großen erregbaren Membranoberflächen ein wachsendes extrazelluläres negatives Potential. Dieses Potential wird zusätzlich noch dadurch gesteigert als die Reizleitungszellen aufgrund ihrer Schrittmachereigenschaften stetige Na+ Ionen Leckströme produzieren. Schließlich erreicht die schleichende Membrandepolarisation die Membranschwelle und löst in Form einer Kettenreaktion eine kollektive Depolarisation der gesamten im av-Knoten befindlichen Membranoberflächen aus. Alle den av-Knoten und später das Hiss´sche Bündel verlassenden Fasern transportieren somit synchrone Depolarisations-Signale. Da seit dem Beginn der av-Knoten Depolarisation erst etwa 50 ms vergangen sind, ist die muskuläre Erregungsphase weiterhin aktiv, der hermetische Verschluß im Anulus fibrosus dauert fort und die wachsende extrazelluläre Negativität besteht weiterhin und umfaßt elektrostatisch das gesamte orthograde Reizleitungssystem. Bei fortschreitender Depolarisation der Kammerschenkel folgen zwei weitere kollektive Depolarisationen: zuerst depolarisieren die Purkinjenetze der Papillarmuskeln und erhöhen mit ihrer kollektiven Membrandepolarisation die extazelluläre Negativität sprunghaft weiter, so dass die etwas höhere Membranschwelle der Purkinjenetze der beiden Kammern unmittelbar danach auch kollektiv depolarisieren. In der endsystolischen Phase der Kammern preßt der in den Kammerwänden maximale Wandinnendruck die sauerstoff- und substratreiche extrazelluläre Flüssigkeit des Myokards gegen den systolischen Kammerinnendruck über die Scheiden der Purkinjefasern in av-wärtiger Richtung. Wenn dieser Vorgang einsetzt, hat die Repolarisationswelle vom Sinusknoten aus bereits begonnen und erzeugt die diastolische Ruhephase, in welcher der Anulus-Verschluß den Substratfluss wieder freigibt und die Na+/K+ Pumpen der Membranen die transmembranöse Ionen-Bilanz wieder restaurieren können.