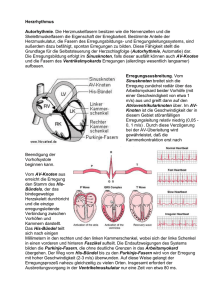
Der AV Knoten
Werbung

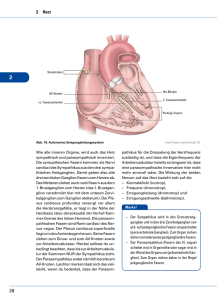
1 Der AV Knoten Wolfgang Herzberg 29.10.2014 Grundsätzliche Fakten: 1. Morphologisch ist der av Knoten ein Knäuel eines Faserbündels der spezifischen kardialen Reizleitung. Es gibt eine Anzahl Fasern, die noch innenseitig im rechten Vorhof (sinus coronarius, linker Vorhof, rechter Vorhof und Aorta, nach Kung aus Schütz)(1) in den AVKnoten einstrahlen. In welcher Anzahl sie den AV-Knoten wieder verlassen, ob innerhalb des Knotens Vernetzungen bestehen oder nicht und ob es Unterbrechungen im Faserverlauf gibt, ist ungeklärt. 2. Die vorhofseitige Etage der einstrahlenden Fasern zeichnet sich durch sehr dünne Fasern mit sehr geringer Reizleitungsgeschwindigkeit (wenige cm/s) und niedrigem MRP, geringer Amplitude und geringerer Anstiegssteilheit aus. 3. Die kammerseitige Etage enthält zunehmend dicke Fasern mit höherer Reizleitungsgeschwindigkeit, größerer Amplitude und Steilheit. 4. Die experimentelle retrograde Reizleitung scheitert häufig.(2) 5. Wenn die Sinusfrequenz sehr hoch ist, kann es zu Aussetzern der Überleitung kommen.(2) 6. Wenn es zum Abbruch einer Überleitung kommt, ist immer das gesamte Faserbündel betroffen: alles oder nichts ! 7. Wird das Herz experimentell nur mit Ringerlösung oder Blut-Ringer perfundiert, zeigt sich eine isolierte Funktionsschwäche des av-Knotens. (Rothberger im Schütz)(1) 8. Die Versuche von Ganter und Zahn (bestätigt von Meek und Eyster) (1) haben gezeigt, dass nach Zerstörung des Sinusknotens das „P“ negativ wird und die PQ-Zeit je nach der Etage, in welcher der AV-Knoten thermisch stimuliert wird, positiv, null oder negativ wird (Abb.1). Theoretische Ansätze auf der Grundlage der bekannten Evidenzen: 1. Aufgrund der kleinen Faserquerschnitte der vorhofseitigen Etage ist die für den AV-Knoten typische Leitungsverzögerung hinreichend erklärt. Hinzu kommt noch die durch Faltung sowohl der ganzen Faser als auch der Membran verlängerte Wegstrecke, die das einzelne Signal überwinden muss. 2. Muss man aus harmonisierenden Gründen auch davon ausgehen, dass ALLE Fasern in ihrer Abfolge demselben Modifikationszyklus – vorhofseitig „dünn“ und kammerseitig „dick“ unterliegen? Ja, denn für jede einzelne Faser muss der erste Abschnitt kleinkalibrig und der letzte Abschnitt großkalibrig sein. Dieses bestätigen auch die Thermostimulations-Versuche von Ganter und Zahn (s.o.); denn da eine obere Stimulation den Vorhof retrograd zeitlich vor der Kammer depolarisiert und die tiefe Stimulation umgekehrt die Kammern vor dem Vorhof depolarisiert, dürfen die Fasern bestenfalls nur horizontal gefaltet sein. Eine dominierend vertikale oder gar völlig multidirektionale Fältelung hätte in diesem Versuchsaufbau für alle stimulierten Etagen dasselbe Ergebnis produzieren müssen. 28.10.2014 Revision 0 Wolfgang Herzberg 2 Abb.1 Reizung des AV-Knotens mit der Thermosonde nach Ausschaltung des Sinusknotens. Reizung des vorhofnahen Abschnittes (links), des mittleren Abschnittes (Mitte), des kammernahen Abschnittes (rechts); unterer Block: die zugehörigen EKG-Ableitungen. (aus Schütz, Physiologie des Herzens, 1958 Springer Verlag) 3. Bedeutet das auch, dass alle Fasern gleich lang sein müssen? Nein, denn entscheidend ist nur die Synchronizität der Abläufe im av-Knoten. Und nur diese sorgt dafür, dass am Ende der avKnoten-Passage trotz unterschiedlich langer Enden alle Fasern synchrone Signale transportieren. 4. Wäre das Geschehen im av-Knoten allein dadurch zu erklären, dass eine Anzahl (n) Fasern mit jeweils identisch modifizierten Geschwindigkeiten (v) ein Signal über die Faserlänge (s) transportieren, dann wären die „alles oder nichts“ Phänomene nicht zu erklären. Vielmehr müßten dann auch asynchrone Signale zu beobachten sein. 5. Das „alles oder nichts“ Phänomen des av-Knotens ist also auf der Ebene der faserbezogenen Erregungsleitung allein nicht zu erklären. Es muss noch eine übergeordnete Funktionsebene geben, die den Signaltransport synchronisiert und auch kollektiv abschalten kann. 6. Diese Ebene muss allerdings im Rahmen des membranösen Erregungsgeschehens gesucht werden. Mit dem Beginn des Aktionspotentials der vorhofseitigen Fasern beginnt ein komplexer und zugleich kollektiver Depolarisations-Prozess, der eine „innere Uhr“ hat; denn nach einem (∆t) von etwa 200 ms nach der ersten Depolaristion des av-Reizleitungssystems setzt die Repolarisationsphase ein und damit das Ende der Erregung. Da wir von einem avBlock sprechen, wenn die Überleitungszeit größer als 200 ms wird, liegt es nahe, hier einen kausalen Zusammenhang zu suchen. 7. Mit der Depolarisation strömen Na+ Ionen in das Innere der Zellen der Reizleitungsfaser. Da die räumlichen Verhältnisse im av-Knoten extrem eng sind und somit die extrazellulären Spalten zwischen den benachbarten Fasern klein sind, erzeugt der kollektive Na+ Ionen Import elektrostatische Veränderungen, die nicht nur das Zellinnere betreffen sondern auch den Extrazellulärraum: Wenn an der äußeren Faser-Membran Kationenbewegungen stattfinden, dann verändert jede importierte Ladung (∆Q) nicht nur das intrazelluläre Potential sondern auch das extrazelluläre Potential - intrazellulär wird es positiver, extrazellulär negativer. 8. Die Effizienz dieser extrazellulären Negativierung hängt nicht nur von der Minimierung des extrazellulären Raumes ab sondern auch von dem Ausmaß der hermetischen Abgeschlossenheit der Einscheidung des av-Knotens gegenüber der Umgebung und den verbliebenen Möglichkeiten zur Äquilibrierung durch Diffusion. An diesem Punkt kommt auch die Kontraktilität der Fasern zum Tragen; denn da die Fasern gefaltet sind, führt eine 28.10.2014 Revision 0 Wolfgang Herzberg 3 9. 10. 11. 12. kollektive Kontraktion erregter Etagen zu Verengungen und Konstriktionen. Somit ist es denkbar, dass der AV-Knoten sich selbst während der Erregungsphase „abdichtet“ und so die Möglichkeiten zur Diffusion auf ein Minimum reduziert. Zudem ist es möglich, dass der avKnoten in seiner Tonisierung die bindegewebige Einscheidung im Niveau des Anulus fibrosus abdichtet und so einen nach retrograd geschlossenen Raum schafft. Da innerhalb der Depolarisationszeit (∆t) die Fläche depolarisierter Membranen stetig zunimmt, wächst auch das positive extrazelluläre Ladungsdefizit. Dabei ist einerseits zu bedenken, dass die langsamen dünnen Fasern (Durchmesser D) die größeren Oberflächenanteile (F) pro Volumen (Vo) besitzen: es gilt etwa (F/Vo ~ 1/D). Und andererseits nimmt die Signalgeschwindigkeit (v) bei größerem Faser-Durchmesser zu, so dass bei insgesamt gleicher Na+ Ionen Kanaldichte die Funktion F(t) des depolarisierten Flächen-Wachstums sowohl vom Verhältnis Ddünn : Ddick. als auch vom Verhältnis vdünn : vdick abhängig ist. Zudem ist zu bemerken, dass das MRP der zunehmend dicker werdenden Faseranteile (2) stetig wieder zunimmt. Dieser Trend erzeugt zum einen über die größere Potentialdifferenz höhere Quanten importierter Na+ Ionen pro Kanal in der Depolarisation und zum anderen gleichzeitig einen wachsenden Schutz gegen die extrazellulär wachsende elektrostatische Negativität als spontaner Auslöser einer Depolarisation noch ruhender Membranen. Unabhängig von dem fortschreitenden Depolarisationsgeschehen beginnt nach der Repolarisation jeder einzelnen Zelle des Reizleitungssystems eine langsame diastolische Selbst-Depolarisation, was diese Zellen ja als Schrittmacher ausweist. Die Zeit ∆t, die eine Zelle zur kritischen Selbstdepolarisation benötigt, ist im kardialen Reizleitungssystem streng hierarchisch organisiert. Sie ist im Sinusknoten am kürzesten, in den terminalen Endaufzweigungen der Purkinjefasern am längsten. Prinzipiell hängt dieses ∆t von drei Parametern ab: Gesamt-Kationentransfer aller Leckkanäle einer Zelle pro Zeit; MRP und Membranschwelle. Es laufen also zwei voneinder unabhängige gleichgerichtete Prozesse über das Reizleitungssystem hinweg, die bezüglich der Membrandepolarisation synergistisch sind. Während die Leckströme durch keine vorhandenen Mechanismen kompensierbar sind, wird die wachsende extrazelluläre Negativität durch gegenläufige Ionen-Diffusionsvorgänge des sicherlich nicht vollständig hermetisch geschlossenen „Einscheidungssystems“ gebremst. Somit kann das Gesamtgeschehen nur dynamisch begriffen werden (Abb.2). Abb.2 Funktion q(t) der extrazellulären Ladungsbilanz des Reizleitungssystems des Herzens; q = elektrische Ladung, t = Zeit, 1 = AP-abhängiger transmembranöser Kationentransfer, 2 = transmembranöser Kationen-Leckstrom, 3 = Ionen-Diffusion der Wandung des „Einscheidungssystems“ 28.10.2014 Revision 0 Wolfgang Herzberg 4 13. Vor Ablauf der Depolarisationszeit wird unter normalen Bedingungen aber irgendwann ein Zustand erreicht, der trotz höherem MRP der kammerseitigen Faserzellen die erforderliche Membranschwelle (MPM) überschreitet: die gesamte noch nicht depolarisierte Membranoberfläche aller Faser-Restabschnitte des AV-Knotens depolarisiert in Form einer sich selbst beschleunigenden Kettenreaktion, die physikalisch in ihrer Dynamik Ähnlichkeiten mit einer Explosion hat. Die Folge: ALLE Fasern transportieren ein synchrones Depolarisationssignal aus dem AV-Knoten heraus. 14. Dass diese Kettenreaktion nicht auch gleich auf das Hiss´sche Bündel übergreift, wird dadurch verhindert, dass in der aufsteigenden Kaskade der MRP des Reizleitungssystem am Austritt des AV-Knotens eine Stufe eingebaut ist. 15. Eine wichtige Voraussetzung für den Mechanismus der kollektiven Depolarisation ist ein ausreichender Längenvorrat aller Fasern; denn die Erregungswelle darf unter normalen Bedingungen das Ende aller Fasern nicht erreichen, bevor die kollektive Depolarisation eingesetzt hat. Würde es dennoch geschehen können, bricht der Signaltransport ab. 16. Bewegt sich eine Membranstörung noch innerhalb gewisser Grenzen, dann kommt die kollektive Depolarisation gerade noch vor Erreichen der Faserenden mit einer maximierten PQ-Zeit zustande. Sind die restaurativen Vorgänge (Na+/K+ Pumpen) innerhalb der diastolischen Pause aber zunehmend unzureichend, dann erreicht das Folgesignal durch seine weiter verlangsamte Depolarisationsausbreitung die Faserenden vor der Auslösung der kollektiven Depolarisation: „Wenckebach Periode“. 17. Die möglichen Aussetzer während einer Sinus-Tachykardie werden von zwei unterschiedlichen Umständen begünstigt: zum einen kann ein Sinus-Signal in die Refraktärphase der AV-Fasern fallen und zum anderen nimmt die Dauer des AP mit der Tachykardie ab. Die Repolarisation kommt dann früher. Zwar wird auch die Depolarisationswelle zunächst schneller weil auch das MRP ansteigt aber die restaurativen Prozesse müssen unter wachsendem Energieeinsatz in kürzerer Zeit höhere Gradienten wieder aufbauen. Somit kann ein ermüdendes oder vorgeschädigtes System von der früher einsetzenden Repolarisation gestoppt werden bevor die kollektive Depolarisationsschwelle erreicht werden konnte. Dabei wirkt sich auch die Situation des Arbeitsmyokards auf die Leistungsfähigkeit des av-Knotens aus ! (siehe „nutritive Aspekte“) 18. Nimmt die Leistung der verschiedenen Kationenpumpen und Austauscher allmählich ab, so wird das AV-System unter einer Tachykardie störanfälliger. Es folgen drei histologische Bilder des AV-Knotens (Ratte) unbestimmter Zuordnung innerhalb des Knotens mit aufsteigender Vergrößerung. In Abbildung 3 sind die interzellulären Räume max 1,5 μm breit. In Abbildung 4 ist der größte extrazelluläre Spalt 2μm breit und in Abbildung 5 ist er 0,5μm breit. 28.10.2014 Revision 0 Wolfgang Herzberg 5 Abb. 3 Sinusknoten (Ratte), Maßstab rechts unten im Bild. Copyright H.Jastrow Abb. 4 Sinusknoten (Ratte), Maßstab rechts unten im Bild. Copyright H.Jastrow Abb. 5 Sinusknoten (Ratte), Maßstab rechts unten im Bild. Copyright H.Jastrow 28.10.2014 Revision 0 Wolfgang Herzberg 6 Somit bewegt sich die Spaltbreite in einem Breich, der für eine induktiv-magnetisch verursachte Erregungsauslöschung gegenüber liegender Membranen zu groß ist (siehe „Reizleitungssystem“) und andererseits für den durchgehenden Erhalt eines extrazellulären 0 mV Niveaus bei wachsendem Kationendefizit zu klein ist. Literatur 1. Schütz: Physiologie des Herzens, Springer Verlag Berlin 1958 2. Reichel, H, Bleichert, A, Leitfaden der Physiologie des Menschen, Ferdinand Enke Verlag Stuttgart (D) 1970 28.10.2014 Revision 0 Wolfgang Herzberg