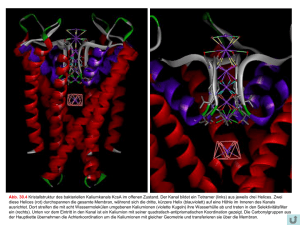
Fragen 1.Wie findet ein Membranprotein seinen Weg vom
Werbung

Fragen 1.Wie findet ein Membranprotein seinen Weg vom Zytoplasma in die Zellmembran? Welche konkreten Strukturen sind dabei beteiligt? - Lateral gate (Öffnung zwischen zwei TM-Helices der Sec61α-Untereinheit, ermöglicht Kontakt mit Lipid-Bilayer) 2.Was ist ein möglicher experimenteller Aufbau, um die Wahrscheinlichkeit eines hydrophoben Segments, in die Membrane integriert zu werden, zu ermitteln? - Glycolisierungs-Stellen vor und nach H-Segment ermöglichen Verhältnis-Bestimmung der H-Segmente in der Membran und im ER-Lumen 3.Was sind (experimentelle) Hinweise auf die wichtige Rolle von Protein-Lipid-Wechselwirkungen? - Biologische Hydrophobizitätsskala (AS in Mitte des H-Segments) zeigt gute Korrelation mit Wimley-White-Skala 4.Wie variiert die Wahrscheinlichkeit zur Membranintegration mit der Position im H-Segment für eine polare Aminosäure? (Relevant für S4-Spannungssensor von KvAP) - Höhere Wahrscheinlichkeit am Rand, niedrige in der Mitte (Grund: hydrophober Ring) 5.Was sind Hinweise darauf, dass man die Membranintegration als thermodynamischen Gleichgewichtsprozess auffassen kann? - Wahrscheinlichkeit der Membranintegration aufgetragen gegen Anzahl der speziellen AS im H-Segment zeigt Boltzmann-Verteilung 6. Wie bestimmt die apolare Oberfläche der Seitenketten die Effizienz des translokonvermittelten Aminosäuretransfers in die Membran? Wie kann man den Energiebedarf quantitativ abschätzen? Fragen zu Vorlesung 3 vom 4.4.2017: 1. Warum ist der Ausschluss von Ionen lebensnotwendig für Eukaryonten? - Calciumspeicher ER Warum ist der Ausschluss von Ionen lebensnotwendig für Prokaryonten? 2. - Protonengradient Periplasma/Cytoplasma Wodurch wird laut Modell 1 die Membranbarriere aufrecht erhalten? Durch welche Experimente wird es gestützt? 3. - nicht durch Kanal selbst, sondern bindende Translokationspartner Fluoreszenz-Quenching Experimente 4. - Wodurch wird laut Modell 2 die Membranbarriere aufrecht erhalten? Durch welche Experimente wird es gestützt? o durch Kanal selbst (Porenring und „Stöpsel“) Messung der Kristallstruktur (Röntgen, Elektronenmikroskopie); Biotinylierung und Osmotische Schwellung (Mutationen Stöpsel/Porenring; Modellsubstrate; aktiver/ruhender Kanal) ; Elektrophysiologie (Mutationen Stöpsel/Porenring; Einzelkanalmessungen; Ionensensitive Mikroelektrode) 5. Welche zentrale Frage bleibt unbeantwortet? - Wie werden große Substrate unter Ausschluss von Ionen geleitet?