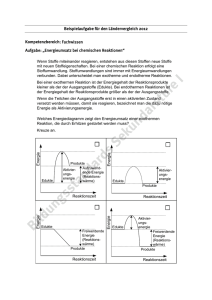
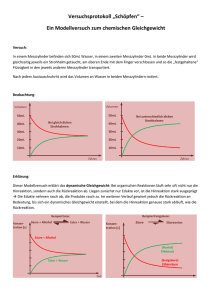
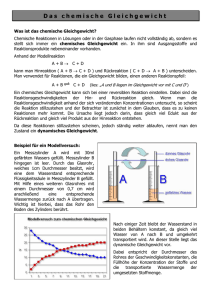
25 3.1.2 Gleichgewichtskonstante/Massenwirkungsgesetz
Werbung

3.1.2 Gleichgewichtskonstante/Massenwirkungsgesetz Beispiel: H 3C C O δ– H H – δ C H C OH H Abb. 12:Gleichgewichtslage medi-learn.de/ch1-12­ Bei dieser Reaktion werden im Gleichgewicht mehr Edukte als Produkte vorliegen. Grund: Die Edukte sind untereinander stärker durch intermolekulare Wasserstoffbrücken (s. S. 17) stabilisiert als die Produkte, da der Edukt-Sauerstoff stärker negativ geladen ist. Übrigens ... Stabile Substanzen werden allgemein bevorzugt gebildet und kommen daher in der Natur auch häufiger vor. 3.1.2 Gleichgewichtskonstante/ Massenwirkungsgesetz Da im Gleichgewicht die Konzentrationen von Edukten und Produkten konstant sind, lässt sich eine Gleichgewichtskonstante (K) formulieren: c (Produkte) K= mit c = Konzentration c (Edukte) K ist auch der Quotient aus den Geschwindigkeitskonstanten k der Hin- und Rückreaktion, weil im Gleichgewicht Hin- und Rückreaktion ja gleich schnell ablaufen (mehr dazu s. S. 70): k (hin) K= k (rück) Für das Beispiel: A + B ← →C+D c (C) ∙ c (D) K= c (A) ∙ c (B) oder falls mal stöchiometrische Faktoren auftauchen wie hier: 2A + 3B ← → C + 4D K= c (C) ∙ c (D)4 c (A)2 ∙ c (B)3 www.medi-learn.de Bei gekoppelten Reaktionen, wie ← B → ← C A → ist die Gleichgewichtskonstante des Gesamtprozesses das Produkt der Gleichgewichtskonstanten der Einzelschritte. Also: B C K1 = , K 2 = , A B B C ∙ Kgesamt = K1 ∙ K2 = A B und das ergibt nach dem Kürzen von B: Kgesamt = C A 3 Ist K = 1, liegen Produkte und Edukte in gleichen Konzentrationen vor. Bei K > 1 ist die Konzentration der Produkte höher als die der Edukte oder anders, ausgedrückt, die Reaktion ist freiwillig abgelaufen und daher exergon (∆G < 0, s. S. 49). Bei K < 1 ist die Konzentration der Edukte höher als die der Produkte, die Reaktion ist nicht freiwillig abgelaufen und daher endergon (∆G > 0, s. S. 59). Die Beziehung zwischen der Gleichgewichtskonstanten K und der freien Reaktionsenthalpie ∆G ist logarithmisch (mehr dazu im Kapitel 4 Energetik). Beispiel Das Enzym Adenylat-Kinase katalysiert die Reaktion AMP + ATP ← → 2 ADP. Die Gleichgewichtskonstante der Reaktion ist 1,0. Die (freien) Konzentrationen im Gleichgewicht betragen 0,1 μmol/l für AMP und 30 μmol/l für ADP. Wie groß ist die der Gleichgewichtslage entsprechende ATP-Konzentration? Antwortmöglichkeiten: 15 μmol/l, 60 μmol/l, 300 μmol/l, 3 mmol/l, 9 mmol/ l. Da bei K = 1 Produkte und Edukte in gleichen Konzentrationen vorliegen, kannst du folgende Gleichung aufstellen: [AMP] ∙ [ATP] = [ADP] ∙ [ADP] 25