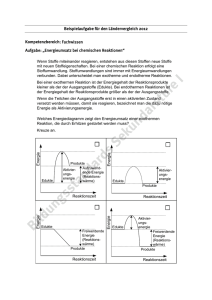
Illumina-Chemieformelsammlung
Werbung

Illumina-Chemieformelsammlung Verwendete Symbole A = Aktivität a = Kohäsionsdruck a = Aktivität des betreffenden Redoxpaares b = Molalität b = Kovolumen C = Wärmekapazität c = Lichtgeschwindigkeit (Vakuum; 2,99792458 · 108 m s-1 bzw. 1,0792528488 · 109 km h-1) c = spezifische Wärmekapazität cx = Konzentration ceq = Gleichgewichtskonzentration E = Energie E = Elektrodenpotential E0 = Standardelektrodenpotential Ēkin = mittlere kinetische Energie Eλ = Extinktion ε = Extinktionskoeffizient F = Faraday-Konstante (9,648534 · 104 C mol−1) G = Gibbs-Energie (Freie Enthalpie) H = Enthalpie h = Planck-Konstante (6,62606885 · 10−34 J s bzw. 4.1356673310 · 10−15 eV s) I = Stromstärke i = van’t Hoff-Faktor KL = Löslichkeitsprodukt KN = Nernstscher Verteilungskoeffizient Kb = Basenkonstante Ks = Säurekonstante kB = Boltzmann-Konstante (1,380650424 · 10−23 J K-1 bzw. 8,61734315 · 10−5 eV K-1) L = Löslichkeit M = Molare Masse m = Masse n = Stoffmenge NA = Avogadro-Konstante (6,0221417930 · 1023 mol−1) p = Druck pc = kritischer Druck Q = Wärme q = elektrische Ladung R = Universelle Gaskonstante (8,314472 J mol-1 K-1) S = Entropie T = absolute Temperatur Tc = kritische Temperatur Tf = Gefrierpunkt t = Elektrolysezeit t0,5 = Halbwertszeit U = Innere Energie http://www.illumina-chemie.de/illumina-formelsammlung-t1702.html V = Volumen v = Frequenz Vm = molares Volumen ze = Zahl der übertragenen Elektronen pro Mol Λ = Zerfallskonstante λ = Wellenlänge Angenäherte Zustandsgleichung für reale Gase RT = (Van-der-Waals-Gleichung) Tc = pc = Ēkin = 1,5 kBT Chemische Gleichgewichte Keq = Elektrochemie E0Zelle = E0Reduktion + E0Oxidation E = E0 + (Nernst-Gleichung) q = nzeF t= Elektromagnetische Strahlung E = hv (Plancksches Strahlungsgesetz) v= λv = c Ideale Gasgesetze pV = nRT (Ideale Gasgleichung) http://www.illumina-chemie.de/illumina-formelsammlung-t1702.html p1V1 = p2V2 = = R = kBNA Lösungen und Löslichkeit Für Salze AmBn KL = ceq(A+)mceq(B-)n L= Eλ = εdcx (d = Durchmesser der Küvette bzw. Länge der Strecke des Lichtstrahls durch die Lösung) (Lambert-Beersches Gesetz) ΔTf = bikf KN = (Nernstsches Verteilungsgesetz) Radioaktivität und Halbwertszeit t0,5 = n= Säuren und Basen pH = -log[cx(H+)] pOH = -log[cx(OH-)] pH + pOH = 14 Für starke Säuren/Basen: pH ~ -log[cx(HxX)x] http://www.illumina-chemie.de/illumina-formelsammlung-t1702.html pOH ~ -log[cx(B(OH)x)x] Für schwache Säuren/Basen: pH = -log pOH = -log Ks = pKs = -log(Ks) Kb = pKb = -log(Kb) pKs + pKb = pKW = 14 Thermodynamik G = H - TS G = U + pV - TS H = U + pV ΔH = ∑H(Produkte) - ∑H(Edukte) ΔS = ∑S(Produkte) - ∑S(Edukte) ΔS0 = ∑S0(Produkte) - ∑S0(Edukte) ΔH0 = ∑Δ (Produkte) - ∑Δ (Edukte) ΔG0 = ∑Δ (Produkte) - ∑Δ (Edukte) C= Q = mcΔT c= http://www.illumina-chemie.de/illumina-formelsammlung-t1702.html