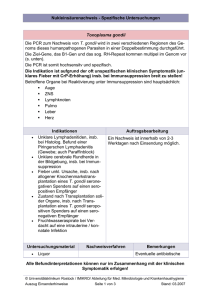
Dissertation fertig2 - TiHo Bibliothek elib
Werbung

Aus dem Institut für Parasitologie der Tierärztlichen Hochschule Hannover Serologische Untersuchungen zur Toxoplasmose nicht humaner Primaten INAUGURAL-DISSERTATION Zur Erlangung des Grades einer Doktorin der Veterinärmedizin (Dr. med. vet.) durch die Tierärztliche Hochschule Hannover Vorgelegt von Anna Katharina Brandt aus Cuxhaven Hannover 2006 Wissenschaftliche Betreuung: Apl.-Prof. Dr. Astrid M. Tenter 1. Gutachterin: Apl.-Prof. Dr. Astrid M. Tenter 2. Gutachter: Prof. Dr. F.-J. Kaup Tag der mündlichen Prüfung: 7. Juni 2006 meiner Familie INHALTSVERZEICHNIS 1. EINLEITUNG 11 2. LITERATURÜBERSICHT 12 3. 2.1. Der Parasit Toxoplasma gondii 12 2.2. Historischer Überblick 13 2.3. Biologie von T. gondii 2.3.1. Entwicklungszyklus 2.3.2. Wirtsspektrum 2.3.3. Übertragungswege von T. gondii und Epidemiologie der Toxoplasmose 14 14 18 18 2.4. 21 21 23 Risikogruppen 2.4.1. Risikogruppen innerhalb der Humanmedizin 2.4.2. Risikogruppen innerhalb der Veterinärmedizin 2.5. Infektionen mit T. gondii bei nicht humanen Primaten 2.5.1. Dokumentierte T.-gondii-Infektionen bei verschiedenen Primatenspezies 2.5.2. Seropositivität 2.5.2.1. Serologische Untersuchungen an Altweltaffen im natürlichen Habitat 2.5.2.2. Serologische Untersuchungen an Neuweltaffen im natürlichen Habitat 2.5.2.3. Serologische Untersuchungen an nicht humanen Primaten in Gefangenschaft 2.5.3. Übertragungswege und Epidemiologie bei nicht humanen Primaten 2.5.4. Fallberichte 2.5.4.1. Klinische Toxoplasmosen bei Altweltaffen 2.5.5. Klinische Symptome und Verlauf der Erkrankung 2.5.6. Pathologie und Pathogenese 2.5.7. Therapie 25 25 31 31 34 35 40 43 45 51 55 59 2.6. Diagnostik von T.-gondii-Infektionen bei nicht humanen Primaten 2.6.1. Indirekte Nachweismethoden 2.6.1.1. SFT 2.6.1.2. IFAT 2.6.1.3. Agglutinationstests 2.6.1.4. KBR 2.6.1.5. ELISA 2.6.1.6. Immunoblot 2.6.2. Sonstige Nachweismethoden 2.6.2.1. Mikroskopischer und immunhistologischer Nachweis im Gewebe 2.6.2.2. PCR 2.6.2.3. Biologische Verfahren 62 63 63 64 65 66 67 68 68 68 69 70 MATERIAL UND METHODEN 71 4. 3.1. Material 3.1.1. Geräte und Verbrauchsmaterialien 3.1.2. Reagenzien und Lösungen 3.1.3. Seren von nicht humanen Primaten 3.1.4. Toxoplasma gondii 3.1.5. Mäuse 71 71 71 71 74 75 3.2. Methoden 3.2.1. Serumgewinnung und -lagerung 3.2.2. SFT 3.2.2.1. Untersuchungsgut 3.2.2.2. Antigengewinnung für den SFT 3.2.2.3. Aktivatorserum 3.2.2.4. Testdurchführung 3.2.2.4.1. Vorversuch 3.2.2.4.2. Hauptversuch 3.2.2.4.3. Auswertung 3.2.2.5. Ergebnisse aus dem SFT 3.2.3. ELISA 3.2.3.1. Kontrollseren zur Optimierung der ELISAs 3.2.3.2. Antigengewinnung für den ELISA 3.2.3.3. Bestimmung der Proteinkonzentration des Tachyzoitenantigens 3.2.3.4. Konjugate 3.2.3.5. IgG-ELISA 3.2.3.5.1. Testdurchführung 3.2.3.5.2. Festlegung der Grenzwerte für den IgG-ELISA 3.2.3.5.3. Festlegung der Titer und Auswertung des IgG-ELISAs 3.2.3.6. IgG-Aviditäts-ELISA 3.2.3.7. IgM-ELISA 3.2.3.8. Optimierung der ELISA-Formate 3.2.4. Mausinokulation 3.2.4.1. Aufbereitung des Gehirns 3.2.4.2. Infektion der Mäuse 3.2.4.3. Untersuchung des Mäuseserums im SFT 3.2.5. IFAT 3.2.5.1. Untersuchungsgut 3.2.5.2. Antigengewinnung für den IFAT 3.2.5.3. Konjugat 3.2.5.4. Kontrollseren 3.2.5.5. Testdurchführung 3.2.6. Histologische Untersuchung von Gewebeproben 75 75 76 76 76 77 77 77 78 78 79 81 81 82 83 84 84 85 87 88 89 89 89 93 93 93 94 94 94 94 95 95 96 98 ERGEBNISSE 99 4.1. Untersuchung von Serumproben nicht humaner Primaten im IgM-ELISA auf Antikörper gegen T. gondii 99 4.2. Untersuchung von Serumproben nicht humaner Primaten im IgG-ELISA auf Antikörper gegen T. gondii und Vergleich mit den im SFT ermittelten Ergebnissen 99 4.2.1. Weißkopfmakis 100 4.2.2. Kattas 106 4.2.3. Totenkopfaffen 107 4.2.4. Andere Neuweltaffen 110 4.2.5. Rhesusaffen 111 4.3. Untersuchung von Serumproben nicht humaner Primaten im IgG-Aviditäts-ELISA zur Bestimmung des Infektionsstadiums der T.-gondii-Infektionen 112 4.3.1. Weißkopfmakis 113 4.3.2. Kattas 114 4.3.3. Totenkopfaffen 114 4.3.4. Andere Neuweltaffen 115 4.3.5. Rhesusaffen 115 5. 4.4. Untersuchung der Serumprobe der Maus im SFT auf Antikörper gegen T. gondii 4.5. Untersuchung von Serumproben der Mäuse im IFAT auf Antikörper gegen T. gondii 116 4.6. Histologische Untersuchung von Gewebeproben eines verstorbenen Kattas 117 4.7. Reproduzierbarkeit des IgG-ELISAs 118 DISKUSSION DER ERGEBNISSE 116 119 5.1. Problematik von T.-gondii-Infektionen bei nicht humanen Primaten und Zielsetzung dieser Dissertation 119 5.2. Untersuchung von Serumproben nicht humaner Primaten im SFT auf Antikörper gegen T. gondii 122 5.3. Untersuchung von Serumproben nicht humaner Primaten im ELISA auf Antikörper gegen T. gondii 123 5.3.1. IgM-ELISA 123 5.3.2. IgG-ELISA 124 5.3.2.1. Weißkopfmakis 125 5.3.2.2. Kattas 126 5.3.2.3. Totenkopfaffen sowie weitere Neuweltaffen 126 5.3.2.4. Rhesusaffen 127 5.3.2.5. Prädispositionen im Zusammenhang mit T.-gondii-Infektionen 128 5.3.2.6. Festlegung der Grenzwerte für den IgG-ELISA 128 5.3.2.7. Reproduzierbarkeit des IgG-ELISAs 129 5.3.2.8. Abschließende Bewertung des IgG-ELISAs 129 5.3.3. IgG-Aviditäts-ELISA 130 5.4. Untersuchung von Serumproben der Mäuse im IFAT und SFT auf Antikörper gegen T. gondii 132 5.5. Histologische Untersuchung von Gewebeproben des Kattas und der Maus 132 5.6. Ausblick 133 6. ZUSAMMENFASSUNG 135 7. SUMMARY 136 8. LITERATURVERZEICHNIS 137 9. ANHANG 157 9.1. Chemikalien und andere Reagenzien 157 9.2. Lösungen 158 9.3. Ergebnisse aus dem IgG-Aviditäts-ELISA 9.3.1. Weißkopfmakis 9.3.2. Kattas 9.3.3. Totenkopfaffen 9.3.4. Andere Neuweltaffen 9.3.5. Rhesusaffen 161 161 164 164 166 166 Abkürzungsverzeichnis Abb. BSA °C CITES DAT DEAE DNA ELISA Fc γ g H.&E. H+L IFAT IgG IgM i. p. IU KBR Kgw LAT mind. ml nm µg µl O. D. o. g. PBS PCR p. i. s. c. SD SFT Abbildung bovines Serumalbumin Grad Celsius Convention on International Trade in Endangered Species on Wild Fauna and Flora (Washingtoner Artenschutzabkommen) Direktagglutinationstest Diethylaminoethyl Desoxyribonukleinsäure Enzyme-linked Immunosorbent Assay Fc-Fragment eines Immunglobulins Gamma Gravidationskonstante Hämatoxylin und Eosin schwere und leichte Ketten eines Immunglobulins indirekter Immunfluoreszenzantikörpertest Immunglobulin G Immunglobulin M intraperitoneal international unit (internationale Einheit, I.E.) Komplementbindungsreaktion Körpergewicht Latexagglutinationstest mindestens Milliliter Nanometer Mikrogramm Mikroliter optische Dichte oben genannt phosphate buffered saline (phophatgepufferte Kochsalzlösung) polymerase chain reaction (Polymerasekettenreaktion) post infectionem subcutan Standardabweichung Sabin-Feldman-Test 1. Einleitung 11 1. EINLEITUNG Die Toxoplasmose ist eine parasitäre Zoonose und wird durch den Erreger Toxoplasma gondii hervorgerufen. T. gondii gehört zu den so genannten zystenbildenden Kokzidien und besitzt einen fakultativ heteroxenen Lebenszyklus. Während als Endwirte ausschließlich Angehörige der Feliden dienen, zählen zu den Zwischenwirten des Parasiten vermutlich alle warmblütigen Lebewesen. Eine Infektion mit T. gondii verläuft bei immunkompetenten Individuen in der Regel latent. Es gibt jedoch Risikogruppen, bei denen es zu schwerwiegenden Erkrankungen durch T.-gondiiInfektionen kommen kann. Dazu zählen in der Humanmedizin schwangere Frauen sowie immundefiziente Patienten und in der Veterinärmedizin einige hochempfängliche Spezies. Zu letzteren gehören auch die nicht humanen Primaten, bei denen akute disseminierte Toxoplasmosen beobachtet werden, die meistens mit dem Tod der Tiere enden. In Zoologischen Gärten verursacht der Erreger immer wieder Tierverluste und Störungen innerhalb der Zuchtprogramme bei den artgeschützten Tieren. Ziel der vorliegenden Arbeit war es, einen serologischen Test zu etablieren, mit dem ein breites Spektrum von Seren verschiedener Arten nicht humaner Primaten auf Antikörper gegen T. gondii untersucht werden kann. Dieser Test soll es möglich machen, T.-gondii-Infektionen bei diesen Spezies schnell und kostengünstig auch an lebenden Tieren zu diagnostizieren, da die Diagnose bisher häufig erst bei der Sektion gestellt wird. Zudem soll durch diesen Test ermöglicht werden, epidemiologische Untersuchungen in zoologischen Gärten durchzuführen und dadurch frühzeitig festzustellen, ob der Parasit in den entsprechenden Beständen vorkommt. So können präventive Maßnahmen ergriffen werden, um das Risiko eines seuchenhaften Ausbruchs der Toxoplasmose zu minimieren. 12 2. Literaturübersicht 2. LITERATURÜBERSICHT 2.1. Der Parasit Toxoplasma gondii Die Toxoplasmose ist eine parasitäre Zoonose mit einer weltweiten Verbreitung. Der Erreger, Toxoplasma gondii (T. gondii), weist eine zum Teil hohe Prävalenz sowohl in der menschlichen Bevölkerung als auch im Tierreich auf. Eine Infektion mit T. gondii verläuft bei immunkompetenten Individuen in der Regel latent oder mit unspezifischen klinischen Symptomen (EVANS 1992). Es gibt jedoch Risikogruppen (siehe Kap. 2.4.), bei denen der Parasit schwere Erkrankungen hervorrufen kann, die nicht selten einen letalen Verlauf nehmen. Sowohl veterinärals auch humanmedizinisch ist der Parasit insbesondere bei der vertikalen Übertragung auf den ungeborenen Fetus bedeutsam. Hier spielt T. gondii z. B. als Aborterreger bei Schafen oder als Ursache von geistigen und körperlichen Behinderungen bei Menschen eine wichtige Rolle. T. gondii gehört zu den so genannten zystenbildenden Kokzidien. Die Coccidea zählen zu den Protozoen und stellen die artenreichste Klasse innerhalb des Unterstammes der Apicomplexa dar (LEVINE 1988; LEE et al. 2000). Charakteristisch für diesen Unterstamm ist das Vorhandensein eines apikalen Komplexes am Vorderende der invasiven Stadien (LEVINE 1985). Der Apikalkomplex wird durch eine Reihe von Organellen gebildet, die am Eindringen des Parasiten in die Wirtszelle beteiligt sind. Dazu zählen Polringe, Rhoptrien, Mikronemen, Konoid, subpellikuläre Mikrotubuli sowie ein oder mehrere Mikroporen (LEVINE 1988). Weitere Charakteristika der Apicomplexa sind ein Generationswechsel mit geschlechtlicher (Gamogonie) und ungeschlechtlicher Vielfachteilung (Merogonie) sowie die ausschließlich parasitäre Lebensweise aller Arten (LEVINE 1985). Die Kokzidien zeichnen sich darüber hinaus durch die intrazelluläre Lokalisation ihrer Entwicklungsstadien sowie durch einen Lebenszyklus aus, der in Sporogonie, Merogonie und Gamogonie gegliedert ist und mit der Bildung von Oozysten endet (LEVINE 1988). Der Entwicklungszyklus von T. gondii ist fakultativ heteroxen. Endwirte sind ausschließlich Feliden, in denen die geschlechtliche Entwicklung des Parasiten mit der Bildung von Oozysten erfolgt. Wie bei anderen Gattungen der Sarcocystidae, zu denen neben Toxoplasma auch Isospora, Sarcocystis, Hammondia, Neospora und Besnoitia gehören (LEVINE 1988; LEE et al. 2000), sind die sporulierten Oozysten vom so genannten Isospora-Typ und enthalten zwei Sporozysten mit je 2. Literaturübersicht 13 vier Sporozoiten. Zwischenwirte von T. gondii sind vermutlich alle warmblütigen Lebewesen einschließlich des Menschen (DUBEY u. BEATTIE 1988). In den Zwischenwirten vollzieht der Parasit die ungeschlechtliche Entwicklung, wobei eine große Vielfalt an kernhaltigen Wirtszelltypen befallen wird und es zur Bildung von Gewebezysten kommt. 2.2. Historischer Überblick Die erste umfassende Beschreibung von T.-gondii-Merozoiten erfolgte 1908 von NICOLLE u. MANCEAUX (1908). Sie konnten den Erreger in Milz, Leber und Blut eines nordafrikanischen Nagetiers, dem Gondi (Ctenodactylus gondi), nachweisen und bezeichneten ihn zunächst als Leishmania gondii. Da sich diese Einordnung jedoch als falsch erwies, führten sie ein Jahr später die Gattung Toxoplasma (nach dem griechischen Wort toxon = Bogen) ein und nannten die Art T. gondii (NICOLLE u. MANCEAUX 1909). Während der ersten Hälfte des 20. Jahrhunderts wurden mehrere Arten von T. gondii in der Regel nach den Wirtsspezies, in denen sie entdeckt wurden, benannt. Erst 1939 wurde von SABIN (1939) durch biologische und immunologische Vergleiche der Beweis erbracht, dass die zahlreichen Isolate tierischen und menschlichen Ursprungs alle zur Art T. gondii gehörten. Die Übertragungswege des Parasiten blieben lange ungeklärt. LEVADITI et al. (1928) beschrieben erstmals eine Gewebezyste als Dauerstadium von T. gondii in den Zwischenwirten Kaninchen und Maus. Mitte der 1950er Jahre wurden Gewebezysten in Schweinen nachgewiesen, woraufhin erstmals ein möglicher Zusammenhang zwischen dem Auftreten einer Toxoplasmose beim Menschen und der Aufnahme von zystenhaltigem Fleisch gesehen wurde. In nachfolgenden Experimenten erwiesen sich die Gewebezysten im Vergleich mit Tachyzoiten als widerstandsfähiger gegenüber Temperatureinflüssen und proteolytischen Enzymen. Dies führte zu der Hypothese, dass die Gewebezysten in der Epidemiologie der Toxoplasmose eine wichtige Rolle spielen. Der Beweis für diese Hypothese wurde schließlich 1965 erbracht, als die horizontale Übertragung von T. gondii auf den Menschen durch unvollständig gekochtes Fleisch nachgewiesen wurde (referiert in ASHBURN 1992). 14 2. Literaturübersicht Durch elektronenmikroskopische Untersuchungen von T. gondii wurde Mitte der 1960er Jahre der Beweis für die Zugehörigkeit des Parasiten zu den Kokzidien erbracht (SCHOLTYSECK u. PIEKARSKI 1965). T. gondii wurde daraufhin dem Isospora-bigemina-Komplex zugeordnet. Der heteroxene Lebenszyklus von T. gondii wurde erst Ende der 1960er Jahre aufgeklärt, nachdem man infektiöse Stadien des Parasiten in Katzenkot fand. Diese konnten bei Ingestion eine T.-gondiiInfektion in Zwischenwirten hervorrufen. Die Erkenntnisse über den Lebenszyklus von T. gondii wurden 1970 dadurch vervollständigt, dass sexuelle Entwicklungsformen des Parasiten im Dünndarm von Katzen nachgewiesen wurden (referiert in TENTER et al. 2000). Generell wurde T. gondii in den vergangenen drei Jahrzehnten trotz seines breiten Wirtsspektrums als die einzige Art der Gattung Toxoplasma angesehen (referiert in TENTER et al. 2000). Es gibt jedoch zahlreiche verschiedene Stämme von T. gondii, die durch den Grad ihrer Virulenz charakterisiert werden (EVANS 1992). In neuerer Zeit wurde zudem der Beweis erbracht, dass es mehrere klonale Linien von T. gondii gibt (JOHNSON 1997,1999). 2.3. Biologie von T. gondii 2.3.1. Entwicklungszyklus Abb. 1: Entwicklungszyklus von T. gondii 2. Literaturübersicht 15 Eine infizierte Katze scheidet während der Patenz mit ihrem Kot unsporulierte Oozysten von T. gondii aus, welche anschließend in der Umwelt sporulieren und dadurch infektiös werden. Während der Sporulation (syn. Sporogonie) entstehen aus dem in der Oozyste enthaltenen Sporonten zwei Sporoblasten, aus denen sich zwei Sporozysten entwickeln. In jeder dieser beiden Sporozysten entstehen vier Sporozoiten. Kommt es zur oralen Aufnahme der sporulierten Oozysten durch einen Zwischenwirt, werden die Oozystenwand und die Sporozystenhülle durch proteolytische Verdauungssäfte aufgelöst und die Sporozoiten freigesetzt. Diese durchdringen daraufhin das Darmepithel und werden hämatogen und lymphogen im gesamten Körper verteilt (JACKSON u. HUTCHISON 1989). Anschließend durchläuft T. gondii im Zwischenwirt eine zweiphasige ungeschlechtliche Vielfachteilung. In der ersten Phase teilt sich der Parasit sehr rasch in verschiedenen Wirtszellen durch wiederholte Endodyogenien. Die Endodyogenie stellt die einfachste Form der Merogonie dar, bei der aus einer Mutterzelle durch Zweiteilung jeweils zwei Tochterzellen entstehen. Die im Verlauf dieser ersten Entwicklungsphase entstehenden Merozoiten werden als Tachyzoiten (syn. Endozoiten) bezeichnet. Eine Wirtszelle füllt sich durch wiederholte Teilungsvorgänge mit maximal 32 Tachyzoiten an (FRENKEL 2000). Anschließend geht sie zugrunde, die Tachyzoiten werden freigesetzt und befallen neue Wirtszellen. Dabei kommt es regelmäßig zu einer Parasitämie. Die mit Tachyzoiten angefüllten Wirtszellen werden auch als Pseudozysten bezeichnet, bei denen sich der Parasit im Gegensatz zu echten Zysten innerhalb einer parasitophoren Vakuole befindet. Diese ist flüssigkeitsgefüllt und wird durch eine Membran, die aus der ehemaligen strukturell stark veränderten Wirtszellmembran besteht, zum Zytoplasma hin abgeschlossen. Dadurch wird der Parasit vor einer Zerstörung durch die Lysosomen der Wirtszelle geschützt (ASHBURN 1992). Mit dem Einsetzen der Antikörperbildung sowie der Ausbildung einer zellvermittelten Immunität durch den Zwischenwirt vollzieht T. gondii einen Wechsel des Entwicklungsstadiums (FRENKEL 2000). Anstelle von Tachyzoiten entstehen in der zweiten Entwicklungsphase durch fortgesetzte Endodyogenien, die jetzt jedoch langsamer ablaufen, innerhalb von Gewebezysten die Bradyzoiten (syn. Zystozoiten). Die Gewebezysten weisen eine hohe Affinität zu neuralen und muskulären Geweben wie Gehirn, Auge, Skelett- und Herzmuskulatur auf, können jedoch auch in viszeralen Organen wie Lunge, Leber und Niere beobachtet werden (DUBEY 1993, 1998c; DUBEY et al. 16 2. Literaturübersicht 1998a). Sie liegen dabei meist reaktionslos im Wirtsgewebe und der Parasit kann auf diese Weise in einigen Wirtsspezies ein Leben lang persistieren (TENTER et al. 2000). Unter bestimmten Bedingungen können diese latenten T.-gondii-Infektionen jedoch reaktiviert werden, z. B. durch eine Immunsuppression. Kommt es zu einer oralen Aufnahme von zystenhaltigem Fleisch durch einen Endwirt, so findet in dessen Darmepithel die sexuelle Entwicklung von T. gondii statt, die mit der Bildung von Oozysten endet (FRENKEL et al. 1970). Durch proteolytische Verdauungssäfte wird zuerst die Wand der T.gondii-Zysten aufgelöst. Die dadurch freigesetzten Bradyzoiten dringen in Epithelzellen der Dünndarmzotten ein und vermehren sich zunächst ungeschlechtlich durch eine initiale Endodyogenie und anschließend durch wiederholte Endopolygenien. Die Endopolygenie stellt eine Form der Merogonie dar, bei der aus einer Mutterzelle mehrere Tochterindividuen entstehen. In der Mutterzelle, dem Meronten, entwickelt sich ein polyploider, gelappter Zellkern, um dessen Ausstülpungen die Merozoitenanlagen angeordnet sind. Diese inkorporieren während ihrer Entwicklung den Inhalt der Mutterzelle, von der lediglich die Pellikula und ein Restkörper übrig bleiben. Durch Ruptur der Mutterzellwand werden die Merozoiten frei und befallen weitere Epithelzellen (KRAHENBUHL u. REMINGTON 1982). Nach Bildung mehrerer Merontengenerationen entwickeln sich schließlich ab dem 3. Tag p. i. einige Merozoiten zu Makround Mikrogamonten. Die Gamonten (syn. Gametozyten) reifen in den Dünndarmepithelien zu weiblichen Makro- oder männlichen Mikrogameten heran. Dieser Vorgang wird als Gamogonie bezeichnet und stellt die geschlechtliche Entwicklungsphase von T. gondii dar. Die Mikrogameten sind begeißelt und bewegen sich aktiv zu den sessilen Makrogameten, um diese zu befruchten. Die dabei entstehenden Zygoten werden von einer festen, mehrschichtigen Wand umschlossen und entwickeln sich so zu Oozysten. Durch Ruptur der Epithelzellen werden die Oozysten ins Darmlumen abgegeben und mit dem Kot ausgeschieden. Neben der geschlechtlichen Entwicklung im Darmepithel der Katze penetrieren in der Regel auch einige Parasiten die Lamina propria des Dünndarms und vermehren sich in extraintestinalen Organen. Dabei kommt es wie bei den Zwischenwirten zu einer zweiphasigen ungeschlechtlichen Vermehrung mit der Bildung von Tachyzoiten und Gewebezysten (KRAHENBUHL u. REMINGTON 1982). 2. Literaturübersicht 17 Die Dauer von Präpatenz und Patenz ist abhängig von der Art des aufgenommenen infektiösen Stadiums. Bei fast allen Katzen, die sich bei einer Primärinfektion mit Gewebezysten infizieren, kommt es nach einer Präpatenz von 3 bis 10 Tagen zu einer Ausscheidung von Oozysten mit dem Kot. Die Patenz hält dann bis zu 20 Tage an (referiert in TENTER et al. 2000). Hingegen scheiden etwa ein Drittel der Katzen, die sich bei einer Primärinfektion mit Oozysten infizieren, erst nach 18 bis 49 Tagen und nur bis zu 10 Tage lang Oozysten aus (FREYRE et al. 1989; DUBEY 1996). Bei dem überwiegenden Teil der auf diese Weise infizierten Katzen unterbleibt die Patenz sogar ganz. Die gegenüber einer Infektion mit Gewebezysten verlängerte Präpatenz ist dadurch zu erklären, dass die Sporozoiten zunächst in extraintestinale Organe eindringen. Die Katze dient T. gondii hierbei zunächst als Zwischenwirt und es erfolgt dementsprechend zunächst die ungeschlechtliche Entwicklung. Die Gamogonie im Darm findet erst im Anschluss daran statt. Die Anzahl der dabei ausgeschiedenen Oozysten ist deutlich niedriger als nach einer Infektion durch Gewebezysten (DUBEY u. FRENKEL 1976). Experimentell konnten T.-gondii-Infektionen bei Katzen auch durch die orale Verabreichung einer großen Anzahl an Tachyzoiten (≥1000) induziert werden. Dabei kam es nach 15-19 Tagen zu einer Oozystenausscheidung, die bis zu 7 Tage anhielt (DUBEY 1998b). Die Katzen dienten T. gondii hier ebenfalls erst als Zwischen- und anschließend als Endwirt. Zu einer Ausscheidung von Oozysten kommt es normalerweise nur nach einer Primärinfektion. Eine zweite Patenz konnte jedoch experimentell bei Katzen erzeugt werden, die nach der Erstinfektion 6 Jahre lang isoliert gehalten und anschließend erneut infiziert wurden (DUBEY 1995; DUBEY et al. 1995). Dies lässt sich damit erklären, dass die Immunität, die durch eine T.-gondiiInfektion induziert wird, nicht das ganze Leben der Katze lang anhält, wenn eine Boosterung des Antikörpertiters durch erneuten Kontakt mit dem Parasiten unterbleibt. Eine zweite Ausscheidung konnte auch durch die Reaktivierung einer chronischen Infektion erzeugt werden. Dies gelang sowohl durch eine Superinfektion mit Isospora sp. als auch durch die Applikation von immunsupprimierenden Medikamenten (referiert in JACKSON u. HUTCHISON 1989). Ob und unter welchen Umständen es unter natürlichen Bedingungen zum so genannten reshedding von Oozysten kommt, ist bislang unbekannt (TENTER et al. 2000). 18 2. Literaturübersicht 2.3.2. Wirtsspektrum T. gondii besitzt ein sehr breites Zwischenwirtsspektrum, das vermutlich alle warmblütigen Lebewesen, also Vögel und Säugetiere einschließlich des Menschen, umfasst (DUBEY u. BEATTIE 1988). Endwirte sind in Mitteleuropa im Wesentlichen nur Hauskatzen. Die Ausscheidung von Oozysten wurde jedoch auch bei wenigstens 17 verschiedenen wilden Feliden beschrieben. Dazu zählen laut LUKESOVA u. LITERAK (1998) die Europäische Wildkatze (Felis silvestris), die Falbkatze (F. lybica), der Manul (F. manul), die Pampaskatze (F. colocolo), der Rotluchs (F. rufus), die Amurkatze (F. euptilurus) die Bengalkatze (F. bengalensis), die Iriomotekatze (F. iriomotensis), der Jaguarundi (F. yagouaroundi), der Ozelot (Leopardus pardalis), die Salzkatze (Oncifelis geoffroyi), der Puma (Puma concolor), der Tiger (Panthera tigris), der Leopard (P. pardus), der Jaguar (P. onca), der Löwe (P. leo) und der Gepard (Acinonyx jubatus). 2.3.3. Übertragungswege von T. gondii und Epidemiologie der Toxoplasmose Im Entwicklungszyklus von T. gondii gibt es drei infektiöse Stadien: die Tachyzoiten, die in den Gewebezysten enthaltenen Bradyzoiten und die in den sporulierten Oozysten enthaltenden Sporozoiten. Alle drei Stadien sind sowohl für die Zwischen- als auch für die Endwirte infektiös. Eine horizontale Infektion mit T. gondii kann entweder durch die Ingestion von Gewebezysten beim Verzehr von rohem Fleisch oder Innereien oder durch die orale Aufnahme von sporulierten Oozysten erfolgen. Eine weitere Übertragungsmöglichkeit besteht in der vertikalen Infektion. Dabei werden Tachyzoiten transplazentar und bei einigen Wirtsspezies auch über die Milch von der Mutter auf die Nachkommen übertragen (referiert in TENTER et al 2000). Die mit dem Katzenkot ausgeschiedenen Oozysten sind die Hauptansteckungsquelle für herbivore Zwischenwirte. Unter geeigneten Umweltbedingungen sporulieren sie innerhalb von 1 bis 5 Tagen und werden dadurch infektiös (DUBEY 1977). Zwar werden sie in der Regel nur nach einer Primärinfektion ausgeschieden, eine einzige Katze kann jedoch während der Patenz über 100 Millionen Oozysten ausscheiden (referiert in TENTER et al. 2000). In Abhängigkeit von dem jeweiligen T.-gondii-Stamm kann bereits die Ingestion von 10 sporulierten Oozysten eine Infektion 2. Literaturübersicht 19 bei Zwischenwirten (z. B. Schweinen) hervorrufen (DUBEY et al. 1996). Bei Feliden kann die orale Aufnahme von 100 sporulierten Oozysten eine patente Infektion induzieren (DUBEY 1996). Die Oozysten sind im sporulierten Zustand sehr widerstandsfähig. Bei günstigen Umweltbedingungen können sie über einen langen Zeitraum infektiös bleiben, wobei auch kurze Trockenzeiten oder Kälteperioden überstanden werden. Unter experimentellen Bedingungen überleben sporulierte Oozysten eine Lagerung bei 4 °C für 54 Monate sowie bei –10 °C für 106 Tage, während sie bei einem Erhitzen auf 55 und 60 °C nach 1 bis 2 Minuten absterben (DUBEY 1998a). Sporulierte Oozysten weisen eine hohe Impermeabilität auf und sind dadurch sehr resistent gegenüber Desinfektionsmitteln (referiert in TENTER et al. 2000). Eine Verbreitung der Oozysten in der Umwelt kann auf vielfältige Weise, z. B. durch Wind, Regen oder mechanischen Transport geschehen. Bei Regen können die Oozysten aus dem Katzenkot ausgeschwemmt und durch Transportwirte wie Regenwürmer und koprophage Insekten aufgenommen und verbreitet werden (DUBEY u. BEATTIE 1988). Im Darm von Küchenschaben bleiben Oozysten bis zu 19 Tage lang infektiös (CHINCHILLA et al. 1994). Oozysten können aus Bodenproben in vielen unterschiedlichen Regionen der Welt isoliert werden (referiert in TENTER et al. 2000). In den meisten Böden überleben sporulierte Oozysten über ein Jahr lang. In einer in Kansas durchgeführten Studie waren sie sogar nach 18 Monaten noch infektiös, wobei zwei Winter überstanden wurden (referiert in JACKSON u. HUTCHISON 1989). Sowohl bei Menschen als auch bei Tieren kann es zu einer Aufnahme der Oozysten mit der Nahrung kommen. So steigt das Risiko einer T.-gondii-Infektion z. B. durch den Verzehr von rohem ungewaschenem Obst oder Gemüse (KAPPERUD et al. 1996). Bei Wiederkäuern (z. B. Schafen) stellen mit Katzenkot verunreinigtes Heu und Kraftfutter sowie kontaminierte Weideflächen eine Infektionsquelle dar (BUXTON 1998). In einigen Gebieten tritt der Parasit endemisch auf, so dass Schafe sich bis zum Eintritt der Geschlechtsreife infizieren und anschließend immun gegen T. gondii sind, d. h. nach einer Infektion nicht mehr erkranken. Werden dann Schafe in die Herde integriert, die toxoplasmenfrei aufgewachsen sind, kann es während der Trächtigkeit dieser Tiere zu Aborten kommen (BUXTON 1998). Bei Menschen wurden T.-gondiiInfektionen auch nach der Aufnahme von Trinkwasser nachgewiesen, das mit Oozysten kontaminiert war (BENESON et al. 1982). 20 2. Literaturübersicht Die Gewebezysten von T. gondii sind gegenüber äußeren Einflüssen weniger resistent als sporulierte Oozysten. Temperaturänderungen gegenüber sind sie jedoch recht widerstandsfähig und überleben eine Lagerung zwischen –1 °C und –8 °C über eine Woche. Bei –12 °C sterben die meisten Zysten ab (KOTULA et al. 1991; KUTICIC u. WIKERHAUSER 1996), einige können jedoch sogar ein Tiefgefrieren (–20 °C) überleben (DUBEY 2000). Es wird vermutet, dass bestimmte Stämme von T. gondii gegenüber dem Tiefgefrieren resistent sind (KUTICIC u. WIKERHAUSER 1996). Nach dem Erhitzen von Fleisch für 3 Minuten bei 67 °C sind die Gewebezysten hingegen nicht mehr infektiös (DUBEY 2000). Carnivore Zwischenwirte können sich durch den Verzehr von rohem oder nicht ausreichend gekochtem zystenhaltigen Fleisch mit T. gondii infizieren. Die in den Gewebezysten enthaltenen Bradyzoiten sind gegenüber Verdauungsenzymen relativ unempfindlich. Sie können bei einer Inkubation in Verdauungsflüssigkeit bis zu 3 Stunden lang infektiös bleiben. Die orale Aufnahme von Gewebezysten durch einen nicht immunen Wirt führt daher meistens auch zu einer Infektion (referiert in TENTER et al. 2000). Eine weitere Möglichkeit, sich über Gewebezysten mit T. gondii zu infizieren, besteht in der Transplantation von zystenhaltigen Organen (siehe Kap. 3.2.). Die Anzahl der Gewebezysten, die in den Zwischenwirten gebildet wird, variiert mit der Wirtsspezies. Am häufigsten werden Gewebezysten bei T.-gondii-infizierten Schweinen, Schafen und Ziegen beobachtet, weniger häufig bei freilaufendem Geflügel, Hunden, Tauben, Kaninchen sowie wildlebenden Hasen und Vögeln. Bei infizierten Pferden und kommerziell gehaltenem Geflügel ist die Anzahl der Gewebezysten noch geringer. Bei Rindern und Büffeln werden sie am seltensten beobachtet, obwohl die Seroprävalenz von T. gondii bei Rindern bis zu 92 % betragen kann (referiert in TENTER et al. 2000). Schadnager wie Ratten und Mäuse können ebenfalls Träger von Gewebezysten sein. Jagende Katzen sind daher häufiger infiziert als nicht jagende (SIMON 1995). Tachyzoiten sind gegenüber Umweltbedingungen sehr empfindlich und sterben normalerweise außerhalb des Wirtes schnell ab. Sie spielen die größte Rolle bei der vertikalen Übertragung von T. gondii. Eine horizontale Übertragung von T. gondii durch Tachyzoiten kann in seltenen Fällen vorkommen, ist epidemiologisch aber vermutlich unbedeutend (TENTER et al. 2000). So besteht 2. Literaturübersicht 21 u. a. die Möglichkeit einer Übertragung von Tachyzoiten während einer Transplantation oder durch eine Bluttransfusion, wenn bei dem Spender eine Parasitämie besteht. Da diese jedoch nur für kurze Zeit anhält, ist das Risiko, sich auf diese Weise zu infizieren, sehr gering (referiert in TENTER et al. 2000). Der genaue Mechanismus der vertikalen Übertragung von T. gondii ist noch nicht geklärt. Vermutlich kommt es bei einer erstmaligen Infektion während einer Schwangerschaft oder einer Trächtigkeit zu einer vorübergehenden Parasitämie und einer Invasion von Tachyzoiten in die Zellen der Plazenta sowie zu einer dortigen Vermehrung des Parasiten. Einige der Tachyzoiten passieren daraufhin die Plazentaschranke und dringen in den fetalen Blutkreislauf ein (referiert in TENTER et al. 2000). Während einer akuten Infektion kann es bei einigen Zwischenwirten (z. B. Ziegen) zu einer Ausscheidung von Tachyzoiten über die Milch kommen. Bei Menschen konnte eine akute Toxoplasmose nach dem Konsum von unpasteurisierter Ziegenmilch beobachtet werden (referiert in EVANS 1992). Tachyzoiten sind gegenüber proteolytischen Enzymen empfindlich, so dass sie im Magensaft normalerweise schnell zerstört werden. In einer Studie wurde jedoch ein Überleben der Tachyzoiten nach einer Inkubation von bis zu 2 Stunden in einer sauren Pepsinlösung nachgewiesen. Außerdem konnte experimentell die orale Applikation hoher Dosen an Tachyzoiten Infektionen bei Mäusen und Katzen hervorrufen (DUBEY 1998b). Außer in Blut und Milch wurden Tachyzoiten auch in anderen Körperflüssigkeiten wie Speichel, Urin, Tränen- und Samenflüssigkeit nachgewiesen, wobei es beim Menschen bisher keinen Hinweis auf eine Übertragung durch einen dieser Wege gibt (referiert in TENTER et al. 2000). Bei nicht humanen Primaten konnte dagegen unter experimentellen Bedingungen eine horizontale Übertragung der Tachyzoiten nachgewiesen werden (siehe Kap. 2.5.3.). 2.4. Risikogruppen 2.4.1. Risikogruppen innerhalb der Humanmedizin 22 2. Literaturübersicht Die meisten Fälle von T.-gondii-Infektionen nehmen bei immunkompetenten Menschen einen latenten Verlauf. Klinische Erkrankungen beschränken sich größtenteils auf bestimmte Risikogruppen, zu denen nicht immune schwangere Frauen und immundefiziente Personen zählen (TENTER et al. 2000). Frauen, die sich 4 bis 6 Monate vor einer Schwangerschaft oder zu einem früheren Zeitpunkt mit T. gondii infizieren, bilden eine protektive Immunität aus, die im allgemeinen die vertikale Übertragung auf den Fetus verhindert, falls die Frau während der Gravidität dem Parasiten erneut ausgesetzt ist (TENTER et al. 2000). Infiziert sich eine Frau jedoch kurz vor oder während einer Schwangerschaft zum ersten Mal mit T. gondii, so kann dies eine konnatale Toxoplasmose zur Folge haben. Das Risiko einer intrauterinen Infektion des Kindes steigt dabei mit zunehmender Graviditätsdauer an. Die Effekte auf den Fetus sind hingegen um so gravierender, je früher sich die Mutter infiziert (CHATTERTON 1992). Etwa 10 % der pränatalen T.-gondii-Infektionen führen zu Aborten oder neonatalem Tod. Weitere 10-23 % der pränatal infizierten Neugeborenen zeigen klinische Symptome einer Toxoplasmose bei der Geburt, wobei bis zu 10 % dieser Neugeborenen Leitsymptome einer konnatalen Toxoplasmose (so genannte klassische Triade bestehend aus Retinochoroiditis, Hydrozephalus und Enzephalitis gefolgt von zerebraler Verkalkung) aufweisen (referiert in TENTER et al. 2000). Eine Infektion im letzten Schwangerschaftsdrittel verläuft dagegen in der Regel subklinisch (DESMONTS u. COUVREUR 1974a, b). Auch wenn infizierte Säuglinge bei der Geburt gesund erscheinen, können sich im Kleinkindalter Augenleiden, neurologische Störungen und Hörschäden entwickeln (referiert in TENTER et al. 2000). Bei immundefizienten Personen kann es bei einer Erstinfektion mit T. gondii zu einer akuten disseminierten Toxoplasmose und im Falle einer bereits vorhandenen latenten Infektion zu einer reaktivierten Toxoplasmose mit Enzephalitis kommen. Solche T.-gondii-bedingten Enzephalitiden und disseminierten Toxoplasmosen können bei AIDS-Patienten und immunsuppressiv behandelten Personen wie Hodgkin- oder anderen Krebspatienten beobachtet werden. Bei AIDS-Patienten spielt T. gondii als opportunistischer Krankheitserreger eine bedeutende Rolle. Der Parasit verursacht weltweit bei bis zu 40 % der AIDS-Patienten hochgradige Enzephalitiden, an deren Folgen 10 bis 30 % der mit T. gondii infizierten Patienten sterben (LUFT u. REMINGTON 1992). Auch bei der Transplantation von Organen oder Knochenmark kann es zu Komplikationen durch disseminierte Toxoplasmosen kommen. Diese können entweder das Resultat eines mit dem Parasiten infizierten 2. Literaturübersicht 23 Transplantatspenders und eines nicht gegen T. gondii immunen Empfängers oder aber das Ergebnis der Reaktivierung einer latenten T.-gondii-Infektion des Transplantatempfängers in Folge der immunsuppressiven Behandlung sein (referiert in TENTER et al. 2000). 2.4.2. Risikogruppen innerhalb der Veterinärmedizin Zu den Risikogruppen innerhalb des Tierreichs gehören nicht immune trächtige Schafe und Ziegen sowie einige andere Spezies, die hochempfänglich für eine T.-gondii-Infektion sind und unter dem Bild einer akuten disseminierten Toxoplasmose erkranken. Dazu zählen neben Känguruhs, Seeottern, Koalas und Pinguinen auch die Neuweltaffen und Lemuren (referiert in INNES 1996; JUNGE 2003). Bei Schafen und Ziegen, die vor einer Trächtigkeit keine Immunität gegen T. gondii entwickelt haben, kann es zu einer vertikalen Übertragung des Parasiten auf die Lämmer kommen. Dabei können beträchtliche Verluste unter den Lämmern entstehen. Infizieren sich nicht immune Muttertiere während der Frühträchtigkeit, so führt dies oft zum fetalen Tod und zu einer Resorption der Frucht. Typische klinische Symptome bei einer Infektion während der mittleren Trächtigkeit sind Aborte sowie die Geburt toter, mumifizierter oder lebensschwacher Lämmer. Findet eine Infektion erst in einem späten Trächtigkeitsstadium statt, wenn das Immunsystem des Fetus schon relativ weit entwickelt ist, können die Lämmer bei der Geburt klinisch normal sein. Die Jungtiere sind dann latent infiziert und gegen durch T. gondii hervorgerufene Erkrankungen immun (referiert in BUXTON 1998). Das Muttertier ist in der Regel klinisch gesund, vereinzelt können jedoch eine Lymphadenopathie sowie mildes Fieber beobachtet werden (BUXTON 1990). Die akuten Toxoplasmosen bei hochempfänglichen Spezies wie den Neuweltaffen und Lemuren enden meistens letal (siehe Kap. 2.5.4.). Die Gründe dafür, warum gerade diese Spezies so empfindlich auf eine T.-gondii-Infektion reagieren, sind bislang nicht bekannt (BRACK et al. 1995b; INNES 1997; EPIPHANIO et al. 2003). Eine Hypothese ist der fehlende Kontakt zu Feliden und deren Parasiten während der evolutionären Entwicklung (CUNNINGHAM et al. 1992; BRACK et al. 1995b; INNES 1997). So lebten z. B. die Lemuren Madagaskars sowie die Beuteltiere Australiens lange Zeit geographisch isoliert. Da es in beiden Gebieten keine wilden Feliden gab und 24 2. Literaturübersicht Hauskatzen erst vor wenigen Jahrhunderten mit den ersten Siedlern in diese Länder gebracht wurden, sind diese Tiere evolutions-immunologisch naiv für T. gondii (referiert in BRACK et al. 1995b). Obwohl es im südamerikanischen Regenwald u. a. mit dem Ozelot und dem Jaguar durchaus Tiere gibt, die als Endwirte für T. gondii fungieren, trifft laut INNES (1997) ein fehlender Kontakt zu Feliden und deren Parasiten während der evolutionären Entwicklung auch auf die Neuweltaffen zu. Da sich die Neuweltaffen in ihrem natürlichen Habitat in den Baumwipfeln aufhalten, kommen sie nicht mit dem Boden und somit auch nicht mit oozystenhaltigem Kot in Kontakt (FRENKEL u. ESCAJADILLO 1987). BRACK et al. (1995b) teilen diese Ansicht nicht, da es in dem Gebiet einige Kleinkatzenarten gibt, die Baumkletterer sind (z. B. Baumozelot) und in nicht geringem Maße T.-gondii-Oozysten ausscheiden. Zudem kommt es vor, dass z. B. Totenkopfaffen auch in ihrem natürlichen Habitat in Bodennähe kommen (THORINGTON 1968), so dass die Aufnahme von sporulierten Oozysten mit dem Futter oder Wasser durchaus denkbar ist. Bekräftigt wird diese Hypothese durch epidemiologische Studien, in denen T.-gondii-Infektionen bei Neuweltaffen in ihrem natürlichen Habitat serologisch nachgewiesen werden konnten (siehe Kap. 2.5.2.2.). Eine weitere Erklärung für die besondere Empfänglichkeit der Neuweltaffen könnte ein generell weniger leistungsfähiges Immunsystem sein (BRACK et al.1995b; INNES 1997). So besteht eine Ähnlichkeit zwischen dem pathologischen Bild der akuten Toxoplasmose dieser Tiere mit dem von immunsuppremierten Patienten mit einer gestörten T-Zell-Funktion und einer verminderten Interferon-γ (INF-γ)-Produktion (INNES 1997). Die humorale Immunantwort in Form von Antikörpern sowie das Komplementsystem wirken synergistisch, um extrazelluläre Parasiten zu zerstören. Da die meisten Tachyzoiten jedoch intrazellulär liegen, kommt der zellvermittelten Immunität bei der Bekämpfung einer T.-gondii-Infektion eine größere Bedeutung zu (INNES 1997). Das Tachyzoitenstadium von T. gondii ist sehr immunogen und induziert neben einer Serokonversion eine zellvermittelte Immunantwort mit der Produktion von INF-γ und Tumornekrosefaktor-α (TNF-α). In-vitro-Versuche zeigten, dass diese Cytokine u. a. eine bedeutende Rolle bei dem Wechsel von Tachyzoiten zu Bradyzoiten zu spielen scheinen (GROSS et al. 2004). Da klinische Symptome in der Regel nur während der Vermehrung der Tachyzoiten beobachtet werden, kommt dem Stadienwechsel somit eine große Bedeutung zu. Das INF-γ wird zu einem sehr frühen Zeitpunkt der Infektion von Natürlichen Killerzellen gebildet und induziert neben 2. Literaturübersicht 25 einer Aktivierung von Makrophagen zusammen mit Interleukin-12 (IL-12) eine vermehrte Produktion von sogenannten TH1-Zellen. Diese wiederum induzieren durch die Produktion von Interleukin-2 (IL-2) die Bildung von cytotoxischen T-Zellen (ALEXANDER et al. 2000), welche die Haupteffektorzellen gegen T. gondii darstellen. Daher spielt es möglicherweise eine Rolle, wie schnell das Immunsystem der verschiedenen Spezies IFN-γ produzieren kann (INNES 1997). Das Immunsystem der Neuweltaffen wird eventuell auch durch den bei allen Platyrrhini (Neuweltaffen) sehr hohen Serumkortikosteroid-Spiegel negativ beeinflusst. Krallenaffen werden wegen ihrer Ontogenese als dizygote hämatopoetische Chimären zusätzlich als vermindert immunkompetent angesehen. Insbesondere Lisztaffen haben einen eingeschränkten MHC-IPolymorphismus und weisen ein im Vergleich zum Menschen verschobenes CD4+ : CD8+ Lymphozytenverhältnis auf. Weniger ausgeprägt, jedoch auch weniger eingehend untersucht, sind Änderungen immunologischer Parameter bei Braunrückentamarinen, Weißbüscheläffchen und Totenkopfaffen (referiert in BRACK et al. 1995b). Disseminierte Toxoplasmosen konnten bei nicht humanen Primaten bislang nur in Gefangenschaft und nicht im natürlichen Habitat beobachtet werden. Es ist möglich, dass chronische Stresssituationen, denen die Tiere während der Gefangenschaft ausgesetzt sind, sich prädisponierend auf die Ausbildung einer klinischen Toxoplasmose auswirken (WONG u. KOZEK 1974). 2.5. Infektionen mit T. gondii bei nicht humanen Primaten 2.5.1. Dokumentierte T.-gondii-Infektionen bei verschiedenen Primatenspezies Der erste Fall einer Toxoplasmose bei einem nicht humanen Primaten wurde 1916 von THEZE (1916) bei einem Brüllaffen (Alouatta seniculus) beschrieben. Eine Infektion mit T. gondii konnte seitdem bei vielen nicht humanen Primaten nachgewiesen werden. Am häufigsten sind Neuweltaffen betroffen, aber auch bei Altweltaffen einschließlich der Menschenaffen und bei Halbaffen tritt der Erreger auf (BRACK et al. 1995a). Die Tab. 1 zeigt eine Übersicht über die verschiedenen Affenspezies, bei denen in epidemiologischen Studien oder in Fallberichten eine T.- 26 2. Literaturübersicht gondii-Infektion nachgewiesen wurde. In der Tabelle sind nur die Berichte zitiert, bei denen es sich um eine natürliche und nicht um eine experimentell hervorgerufene Infektion handelte. Die Speziesbezeichnungen richten sich dabei nach GEISSMANN (2003) und nicht nach dem Kenntnisstand zum Zeitpunkt der jeweiligen Veröffentlichung. Gleichzeitig zeigt die Tabelle eine systematische Einordnung dieser Arten, wobei die Systematik von GEISSMANN (2003) verwendet wurde. Die Ordnung der Primaten gliedert sich dabei in die Unterordnung der Strepsirrhini, die verschiedene Halbaffenspezies umfasst, und in die der Haplorrhini. In letzterer finden sich die Neuwelt- und Altweltaffen einschließlich der Menschenaffen. Die Systematik ist nicht vollständig, sondern beinhaltet nur diejenigen Infraordnungen und Familien, in denen bislang das Auftreten von T.-gondii-Infektionen beobachtet werden konnte. Referenzen Strepsirrhini (Feuchtnasenprimaten) -- Lemuriformes (Lemuriforme) Lemuroidea (madagassische Lemuren) HARING u. DAVIS (1998) -- Lemuridae Hapalemur (Kleine Bambus(„echte“ Lemuren) -- H. griseus lemuren) -- Indridae (Indriartige) -- Loriformes (Loriforme) Loroidea (Loroiden) -- Loridae (Loris) Lemur (Kattas) -- L. catta SUREAU et al. (1962); UILENBERG u. RIBOT (1965); ITAKURA u. NIGI (1968); NIGI u. ITAKURA (1968); ISENBÜGEL (1983); BORST u. VAN KNAPEN (1984); DUBEY et al. (1985a); BRACK et al. (1995b, 1998); WOHLSEIN et al. (1999); ZHANG et al. (2000); SPENCER et al. (2004) Varecia (Varis) -- V. variegata UILENBERG u. RIBOT (1965); BRITT et al. (2004) Propithecus (Sifakas) -- P. verreauxi CHANG et al. (1980) Nycticebus (Plumploris) -- N. coucang ZAMAN u. GOH (1968); ZAMAN u. KRISHNAMURTI (1969) Aotus (Nachtaffen) -- A. lemurinus -- A. trivirgatus SEIBOLD u. WOLF (1971); BORST u. VAN KNAPEN (1984); PERRI et al. (1992); EPIPHANIO et al. (2003) 2. Literaturübersicht Tab. 1: Vorkommen von T.-gondii-Infektionen bei nicht humanen Primaten Unterordnung Überfamilie Gattung -- Infraordnung -- Familie -- Art — Namenloser Rang Haplorrhini (Trockennasenprimaten) 27 -- Anthropoidea (eigentliche Affen) — Platyrrhini Ceboidea (Neuweltaffen) (Neuweltaffen) -- Aotidae (Nachtaffen) -- Callitrichidae (Krallenäffchen) RATCLIFFE u. WORTH (1951); RATCLIFFE (1967) zit. von SEIBOLD u. WOLF (1971); RIEMANN et al. (1974); CHOI et al. (1987) Lagothrix (Wollaffen) -- L. lagotricha STOLZ (1962); BENIRSCHKE u. LOW (1970); HESSLER et al. (1971); BOUER et al. (1999); EPIPHANIO et al. (2003) Callithrix (Büscheläffchen) -- C. jacchus -- C. penicillata -- C. pygmaea HILGENFELD (1965a, b, 1966); DIETZ et al (1997); JENSEN et al. (1998); BAULU et al. (2002); EPIPHANIO et al. (2003) Leontopithecus (Löwenäffchen) -- L. chrysomelas -- L. chrysopygus -- L. rosalia HILGENFELD (1966); RATCLIFFE (1967) zit. von SEIBOLD u. WOLF (1971); MONTALI et al. (1995); DIETZ et al. (1997); JUAN-SALLES et al. (1997, 1998); PERTZ et al. (1997); EPIPHANIO et al. (1999b, 2000, 2001, 2003) Saguinus (Tamarine) -- S. fuscicollis -- S. geoffroyi -- S. imperator -- S. labiatus -- S. midas -- S. oedipus BENIRSCHKE u. RICHART (1960); RATCLIFFE (1967) zit. von SEIBOLD u. WOLF (1971); FRENKEL u. SOUSA (1983); GRINER (1983); BRACK et al. (1995b); DIETZ et al. (1997); WOHLSEIN et al. (1999); EPIPHANIO et al. (1999a, b, 2000, 2003); LEONG et al. (2004) Cebus (Kapuzineraffen) -- C. albifrons DE RODANICHE (1954a); NERY-GUIMARAES et al. (1971); NERY-GUIMARAES u. FRANKEN 2. Literaturübersicht -- Cebidae (Kapuzinerartige) Ateles (Klammeraffen) -- A. geoffroyi -- A. paniscus 28 Tab. 1: Vorkommen von T.-gondii-Infektionen bei nicht humanen Primaten (Fortsetzung) Unterordnung Überfamilie Gattung Referenzen -- Infraordnung -- Familie -- Art — Namenloser Rang -- Atelidae Alouatta (Brüllaffen) THEZE (1916); CARME et al. (2002); DE THOISY (Greifschwanzaffen) -- A. guariba et al. (2001, 2003); EPIPHANIO et al. (2003) -- A. seniculus Saimiri (Totenkopfaffen) -- S. boliviensis -- S. sciureus -- Pitheciidae (Sakiartige) 2. Literaturübersicht Tab. 1: Vorkommen von T.-gondii-Infektionen bei nicht humanen Primaten (Fortsetzung) Unterordnung Überfamilie Gattung Referenzen -- Infraordnung -- Familie -- Art — Namenloser Rang -- C. apella (1971); CADAVID et al. (1991) -- C. capucinus -- C. libidinosus RATCLIFFE u. WORTH (1951); RATCLIFFE (1954); DÖBEREINER (1955); McKISSICK et al. (1968); NERY-GUIMARAES u. FRANKEN (1971); FERRARONI et al. (1980); ANDERSON u. McCLURE (1982); WOOLF u. ANTHONEY (1982); DICKSON et al. (1983); BORST u. VAN KNAPEN (1984); ZWART et al. (1989); TUDGE (1991); CUNNINGHAM et al. (1992); BRACK et al. (1995b, 1998); INOUE (1997); WOHLSEIN et al. (1999); BACCIARINI et al. (2001a, b); BAULU et al. (2002); EPIPHANIO et al. (2003); ANDRADE et al. (2004) Cacajao (Uakaris) -- C. calvus RATCLIFFE (1954, 1961) Callicebus (Springaffen) -- C. moloch SEIBOLD u. WOLF (1971) Pithecia (Sakis) -- P. pithecia -- P. monachus RATCLIFFE (1954); ZWART et al. (1989) — Catarrhini Cercopithecoidea (Altweltaffen) (geschwänzte Altweltaffen) -- Cercopithecidae Chlorocebus (Grünmeerkatzen) KASCHULA et al. (1978); BAULU et al. (2002) (rezente geschwänzte -- C. pygerythrus Altweltaffen) ZHANG et al. (2000) 29 Erythrocebus (Husarenaffen) -- E. patas 30 Tab. 1: Vorkommen von T.-gondii-Infektionen bei nicht humanen Primaten (Fortsetzung) Unterordnung Überfamilie Gattung Referenzen -- Infraordnung -- Familie -- Art — Namenloser Rang Macaca (Makaken) FELDMAN u. MILLER (1956); SERY et al. (1959); -- M. arctoides VAN DEN AKKER et al. (1959); UMINSKY u. -- M. fascicularis PIETRZYK (1961); POKORNY et al. (1961); -- M. fuscata REMINGTON et al. (1965); NERY-GUIMARAES et -- M. mulatta al. (1971); ARAUJO et al. (1973); WONG u. KOZEK -- M. nemestrina (1974); CHHABRA et al. (1976); DURFEE et al. -- M. sinica (1976); RAO BHAU et al. (1987); SULAIMAN et al. -- M. sylvanus (1989); ASAI et al. (1991); SASSEVILLE et al. (1995); ZHANG et al. (2000); BAULU et al. (2002); EKANAYAKE et al. (2004) Papio (Paviane) -- P. cynocephalus -- P. ursinus LEVADITI u. SCHOEN (1933); KUNTZ u. MYERS (1967); DE ROEVER-BONNET (1972); McCONNELL et al. (1973, 1974); MICHAELS et al. (1994); BAULU et al. (2002) Trachypithecus (Haubenlanguren) SULAIMAN et al. (1989) -- T. cristatus Hominoidea (Menschenaffen & Mensch) -- Hylobatidae (Gibbons) ZHANG et al. (2000) Hylobates (Zwerggibbons) -- H. lar MURATA (1989) -- Hominidae Gorilla (Gorillas) (Große Menschenaffen & Mensch) -- G. gorilla Pan (Schimpansen) -- P. troglodytes PROWTEN et al. (1985); MURATA (1989); FURLEY (1996) KOPCIOWSKA u. NICOLAU (1938); SCHOBERT (1970) zit. von McCLURE u. GUILLOUD (1971); DRAPER et al. (1971); MURATA (1989) 2. Literaturübersicht Bunopithecus (Hulocks) -- B. hoolock 2. Literaturübersicht 31 2.5.2. Seropositivität T.-gondii-Infektionen führen auch bei nicht humanen Primaten nicht grundsätzlich zu einer Erkrankung. Insbesondere Altweltaffen sind häufig nur latent infiziert, wobei sich die Infektion in der Regel serologisch nachweisen lässt (BRACK et al. 1995b). Auch bei Neuwelt- und Halbaffenspezies konnten Antikörper gegen T. gondii nachgewiesen werden. Dabei wurden sowohl epidemiologische Studien an wildlebenden Primaten durchgeführt, als auch an Tieren, die sich zum Zeitpunkt der Untersuchung in Gefangenschaft befanden. 2.5.2.1. Serologische Untersuchungen an Altweltaffen im natürlichen Habitat Durch Studien an wildlebenden Primaten konnten Infektionen mit T. gondii im natürlichen Habitat eindeutig belegt werden. In der Tab. 2 sind diese Fälle zusammengestellt. Eine Aussage über die tatsächliche Prävalenz des Parasiten in den Wildpopulationen der verschiedenen Affenarten lässt sich anhand dieser wenigen Daten jedoch nicht treffen. Der überwiegende Teil der Studien wurde an Altweltaffen, insbesondere an Makaken durchgeführt. Die von ZAMAN u. GOH (1968) und McCONNELL et al. (1973) beschriebenen Fälle, in denen T. gondii auch histologisch nachgewiesen wurde, sind in Kap. 2.5.4. dargestellt. UMINSKI u. PIETRZYK (1961) untersuchten 155 aus Indien stammende Rhesusaffen und 16 Javaneraffen aus Malaysia in der KBR auf Antikörper gegen T. gondii. Die Tiere waren klinisch gesund und sollten anschließend bei der Herstellung einer Polio-Vakzine eingesetzt werden. Bei 13 der Rhesusaffen wurde ein Titer von 1:2 und bei neun ein Titer von 1:4 festgestellt. Unter den Javaneraffen hatten vier Tiere einen Titer von 1:2. Bei 28 Rhesus- und bei sechs Javaneraffen wurden unspezifische Reaktionen festgestellt. Diese wurden insbesondere bei Tieren beobachtet, denen zuvor Kortison verabreicht wurde. Alle Affen wurden zu einem späteren Zeitpunkt in einer Sektion untersucht, die jedoch in keinem Fall charakteristische Befunde einer Toxoplasmose ergab. Von den serologisch positiven Tieren wurde Organmaterial in Mäuse inokuliert, um den Parasiten zu isolieren. Positive Ergebnisse wurden dabei nicht erzielt. 32 2. Literaturübersicht REMINGTON et al. (1965) führten eine Studie an 164 Makaken durch. Dabei wurden 64 Rhesusaffen aus Nordindien, 50 Schweinsaffen aus Thailand und 50 Javaneraffen von den Philippinen im SFT auf Antikörper gegen T. gondii untersucht. Alle Seren der Rhesusaffen hatten einen Titer unter 1:2 und wurden damit als negativ beurteilt. Bei den Javaneraffen hatten zehn Tiere einen Titer von 1:2 und eines einen Titer von 1:8. Bei den Schweinsaffen hatten 35 Tiere einen Titer von 1:2 und sechs von 1:8. Nach Ansicht der Autoren lieferten damit 22 % der Javaner- und 82 % der Schweinsaffen ein positives Ergebnis. Auf Grund der niedrigen Titer war jedoch nicht eindeutig klar, ob es sich um chronische T.-gondii-Infektionen handelte oder nur um unspezifische Reaktionen, die bei einer Verdünnung von 1:32 nicht mehr auftraten. Alle Seren, die im SFT positiv reagierten, wurden daher mit hitzeinaktiviertem Aktivatorserum getestet und waren bei dieser Untersuchung negativ. Dies sprach für eine spezifische Antikörperreaktion. Im Gegensatz dazu verlief eine anschließend durchgeführte Untersuchung in der Elektrophorese negativ. Dabei wurden alle Seren, die einen Titer von 1:8 im SFT aufwiesen, im Vergleich mit einem positiven Humanserum getestet. Es konnten keine Antikörper gegen T. gondii in den Affenseren nachgewiesen werden. Eine histologische Untersuchung von Organmaterial, die bei positivem Befund den Beweis für eine T.-gondii-Infektion hätte liefern können, war auf Grund des Wertes der Tiere ausgeschlossen. CHHABRA et al. (1976) führten eine Studie an Rhesusaffen in Nordindien durch. Es wurden 94 Tiere aus der Region unterhalb des Himalaya gefangen und ihnen unmittelbar danach eine Blutprobe entnommen. Die Seren wurden mit dem IHAT auf Antikörper gegen T. gondii untersucht, wobei 41 der Seren eine negative Reaktion zeigten. Bei 26 Tieren wurde ein Titer von 1:8 festgestellt, 11 Tiere hatten einen Titer von 1:32, zehn von 1:128, drei von 1:512 und drei von 1:2048 oder höher. Die Autoren beurteilten damit 53 (56,4 %) der Tiere als positiv. Als Infektionsursache wurde eine Infektion mit dem Kot wilder Feliden vermutet. In die von DE ROEVER-BONNET (1972) durchgeführte Studie zur Prävalenz von Infektionen mit T. gondii in der Bevölkerung verschiedener afrikanischer Länder wurden auch einige wildlebende Tiere einbezogen. Dabei wurden die Seren von 20 Pavianen im SFT ab einer Verdünnung von 1:16 untersucht. Bei drei Tieren wurde ein Titer von 1:16 festgestellt, die übrigen Seren zeigten keine Reaktion. 2. Literaturübersicht 33 KASCHULA et al. (1978) untersuchten Grünmeerkatzen, die für eine Impfstoffproduktion und zur Verwendung der Nieren in Zellkulturen in Südafrika gefangen wurden. Die Tiere wurden neben zahlreichen anderen Krankheiten auch auf T. gondii untersucht. Dabei war von 47 Tieren eines im IFAT und zwei von 55 in der KBR positiv. Im SFT waren 48 untersuchte Tiere negativ. RAO BHAU et al. (1987) untersuchten 211 Rhesusaffen im IHAT auf Antikörper gegen T. gondii. Die Tiere wurden in Nordindien gefangen, waren 1 bis 5 Jahre alt, 1,5 bis 3 kg schwer und zeigten ein ungestörtes Allgemeinbefinden. Unmittelbar nach dem Fang wurde eine Blutprobe entnommen. Bei 62 Tieren wurde ein Titer von 1:8 nachgewiesen, bei 41 ein Titer von 1:32 und bei acht Tieren ein Titer von 1:128 oder höher. Von den Autoren wurden 111 Seren als positiv beurteilt. Als Infektionsursache wurde der Kontakt zu Hauskatzen vermutet, da die Tiere in einer von Menschen bewohnten Gegend gefangen wurden. SULAIMAN et al. (1989) untersuchten die Seren von 33 Haubenlanguren, 30 Javaneraffen und 14 Schweinsaffen, die in Malaysia gefangen wurden, im IFAT und im ELISA. Im IFAT wurden Seren mit einem Titer ≥ 1:64 als positiv beurteilt. Einer der Languren (3 %), fünf Javaner- (17 %) und acht Schweinsaffen (57 %) lieferten hier positive Ergebnisse. Im ELISA wurden die optischen Dichten bei einer Wellenlänge von 492 nm bestimmt und die Seren bei einem Wert ≥ 0,48 als positiv angesehen. Dabei lieferten einer der Languren (3 %), drei Javaner- (10 %) und 10 Schweinsaffen (71 %) positive Ergebnisse. Bei einem Vergleich der Testergebnisse konnte eine signifikante positive Korrelation zwischen dem IFAT und dem ELISA festgestellt werden. Die unterschiedlich hohen Infektionsraten zwischen den drei untersuchten Spezies wurden damit erklärt, dass die Schweinsaffen im Gegensatz zu den anderen beiden Arten bei der Futtersuche mehr Zeit auf dem Boden verbringen und sich deshalb leichter mit Oozysten infizieren könnten. EKANAYAKE et al. (2004) führten eine Studie an Ceylon-Hutaffen auf Sri Lanka durch. Es wurden Blutproben von 170 Makaken unterschiedlichen Alters und Geschlechts gewonnen, die sich auf acht verschiedene soziale Gruppen verteilten. Die Seren wurden im MAT auf Antikörper gegen T. gondii getestet. Neun Tiere wiesen dabei einen Titer von 1:16, neun einen Titer von 1:32 und drei von 1:256 auf. Da der MAT-Titer, der für Affen als spezifisch angesehen werden kann, nicht bekannt war, werteten die Autoren alle in der Studie festgestellten Titer als positive Ergebnisse und 34 2. Literaturübersicht beurteilten somit 21 Seren (12 %) als positiv. Keines der 21 infizierten Tiere starb im darauf folgenden Jahr an einer Toxoplasmose. Zwischen den einzelnen Gruppen ergaben sich Unterschiede in der Häufigkeit der T.-gondii-Infektionen. Je größer die Überschneidungen der Reviere mit menschlichen Siedlungen waren, desto öfter wurden bei den Tieren Antikörper gegen T. gondii gefunden. Dabei wurde eine Prävalenz von 19 % (21 von 112 Tieren) bei denjenigen Gruppen festgestellt, die sich regelmäßig in menschlicher Umgebung aufhielten und somit auch Kontakt zu Hauskatzen hatten. Bei den Gruppen, deren Revier sich ausschließlich auf den Urwald beschränkte, war keines von 58 Tieren serologisch positiv. Um festzustellen, ob es zu einer signifikanten konnatalen Übertragung des Parasiten kommt, wurden die Antikörpertiter von zehn Muttertieren und ihren Nachkommen verglichen. Zwei positive Muttertiere hatten positive Nachkommen, bei vier positiven Muttertieren wiesen die Jungtiere keine Antikörper gegen T. gondii auf. Auf Grund des Befundes, dass vier Nachkommen nicht infizierter Muttertiere positiv waren, wurde die Hypothese aufgestellt, dass eine Infektion mit T. gondii in den meisten Fällen postnatal stattfindet. Es wurde vermutet, dass sich die Makaken bei ihrer Nahrungssuche in den von Menschen besiedelten Gebieten infiziert hatten, indem sie mit Oozysten kontaminiertes Futter vom Boden aufnahmen. Der Umstand, dass keines der Tiere in Folge der Infektion gestorben war, lässt laut den Autoren darauf schließen, dass die Makaken während ihrer evolutionären Entwicklung lange dem Parasiten ausgesetzt waren und dadurch eine immunologische Anpassung stattfand. 2.5.2.2. Serologische Untersuchungen an Neuweltaffen im natürlichen Habitat Die bei Neuweltaffen im natürlichen Habitat festgestellte Prävalenz von T. gondii war sehr unterschiedlich. FERRARONI et al. (1980) führten eine epidemiologische Studie im Amazonasgebiet durch. Dabei untersuchten sie neben Menschen und verschiedenen Haustieren auch einige wildlebende Spezies im IHAT auf Antikörper gegen T. gondii. Die Seren wurden als positiv beurteilt, wenn eine Agglutination bei einer Verdünnung von ≥1:128 stattfand. Die niedrigsten Infektionsraten wurden bei Rindern (12 %) und bei Geflügel (22 %) gefunden, die höchsten bei Hauskatzen. Hier lieferten 26 von 32 Tieren (81 %) ein positives Ergebnis. Unter den untersuchten Wildtieren waren vier Ozelots, von denen zwei positiv waren. Von 49 Totenkopfaffen waren 24 positiv. Die Affen hatten 2. Literaturübersicht 35 somit eine relativ hohe Prävalenz (49 %), obwohl sie auf Bäumen leben und sich überwiegend von Früchten ernähren. Daraus wurde geschlossen, dass die Totenkopfaffen regelmäßig Kontakt zu sporulierten Oozysten hatten. FRENKEL u. SOUSA (1983) untersuchten bei einer in Panama durchgeführten Studie 22 verschiedene wildlebende Säugetierspezies auf Antikörper gegen T. gondii. Bei 11 Spezies wurden im SFT ab einer Verdünnung von 1:2 positive Reaktionen nachgewiesen. Unter den untersuchten Tierarten waren auch drei Primatenspezies: einer von 21 Tamarinen war positiv, 23 Nachtaffen und acht Brüllaffen waren negativ. Bei einer in Französisch Guayana durchgeführten Studie wurden verschiedene wildlebende Säugetiere im MAT auf Antikörper gegen T. gondii untersucht (CARME et al. 2002; DE THOISY 2001, 2003). Seren, die bei einer Verdünnung von >1:40 eine Agglutination auslösten, wurden dabei als positiv gewertet, die übrigen als negativ. Die Prävalenz von T. gondii bei den untersuchten Spezies wurde unter Berücksichtigung der unterschiedlichen Lebensweisen der Tiere verglichen. Dabei wiesen terrestrisch lebende und fleischfressende Spezies, wie Pakas, Gürteltiere und Pekaris eine signifikant höhere Infektionsrate auf als baumbewohnende sowie vegetarisch lebende Tiere. So waren von 50 untersuchten Roten Brüllaffen nur zwei Tiere positiv, von 50 Gelbhand-Tamarinen und 50 Faultieren waren alle negativ. Bei den vegetarisch lebenden Tieren wurde eine Infektion mit sporulierten Oozysten vermutet. Da Hauskatzen in der Gegend nicht vorkamen, gingen die Autoren von einer Übertragung durch wildlebende Feliden aus. 2.5.2.3. Serologische Untersuchungen an nicht humanen Primaten in Gefangenschaft Es gibt auch zahlreiche epidemiologische Studien an nicht humanen Primaten, die auf Antikörper gegen T. gondii untersucht wurden und sich zum Zeitpunkt der Probennahmen in Gefangenschaft befanden. In Tab. 3 sind diese Fälle zusammengestellt. Die Seren wurden dabei in der Regel in Zoologischen Gärten gewonnen. Die Fälle, in denen Antikörper gegen T. gondii im Zusammenhang mit einer klinischen Toxoplasmose nachgewiesen wurden, sind in Kap. 2.5.4. ausführlich dargestellt. 36 2. Literaturübersicht FELDMAN u. MILLER (1956) untersuchten in einer Studie die Seren von 21 Javaneraffen von den Philippinen und von 15 Rhesusaffen aus Indien im SFT auf Antikörper gegen T. gondii. Dabei wiesen 16 der zu Versuchszwecken gehaltenen Javaneraffen und einer der Rhesusaffen einen Titer von 1:4 auf. Die Ergebnisse wurden aber auf Grund der niedrigen Verdünnungsstufe als nicht signifikant angesehen und daher alle Seren als negativ beurteilt. KUNTZ u. MYERS (1967) untersuchten 25 aus einem Zoo in San Antonio (Texas, USA) stammende Paviane im SFT auf Antikörper gegen T. gondii. Bei 18 Tieren wurde ein Titer von 1:4 und bei zwei ein Titer von 1:16 nachgewiesen. Die Autoren beurteilten diese Ergebnisse als positiv. Die übrigen fünf Paviane lieferten negative Reaktionen. YAMAMOTO et al. (1970) führten mit acht aus einem Zoo in Indonesien stammenden OrangUtans einen IHAT zum Nachweis von Antikörpern gegen T. gondii durch. Dabei wiesen drei Seren einen Titer ≥1:1024 auf, die übrigen waren negativ. NERY-GUIMARAES u. FRANKEN (1971) untersuchten die Seren von 54 Neuweltaffen, die aus einem Institut und aus einem Zoo in Brasilien stammten, im SFT. Dabei wiesen von 17 Totenkopfaffen zwei einen Titer von 1:4 und einer einen Titer von 1:16 auf. Von 22 Gehaubten Kapuzinern hatten vier einen Titer von 1:4. Alle übrigen Tiere zeigten negative Reaktionen. Die Autoren bewerteten nur Titer von ≥ 1:16 als positiv. In einer Studie von MURATA (1989) wurden insgesamt 360 Tiere aus einem Zoo in Kobe untersucht. Die Blutproben wurden während tierärztlicher Behandlungen oder bei Sektionen über einen Zeitraum von 8 Jahren gewonnen und im LAT auf Antikörper gegen T. gondii untersucht. Bei den 189 von Säugetieren stammenden Proben waren 5 % positiv. Zu den untersuchten Spezies zählten auch 56 Primaten. Von 13 Menschenaffen wurden drei Tiere als positiv beurteilt. Dabei wiesen ein Gorilla und ein Gibbon einen Titer von 1:128 auf, bei einem Schimpansen wurde ein Titer von 1:1024 festgestellt. Die übrigen Affen waren negativ. ASAI et al. (1991) untersuchten die Seren von 443 Makaken im LAT auf Antikörper gegen T. gondii. Die Seren wurden ab einem Titer >1:10 als positiv beurteilt. Die Tiere waren auf zwei Institute verteilt. Eines diente dabei als Quarantänestation für Affen, die von den Philippinen neu importiert wurden. Hier wurden 147 Javaneraffen untersucht, von denen vier Tiere positiv waren. In 2. Literaturübersicht 37 dem anderen Institut wurden die Tiere für experimentelle Zwecke und zur Abgabe an Zoologische Gärten gehalten. Hier waren zehn von 234 Rotgesichts-Makaken, zwei von 54 Rhesusaffen, keiner der fünf Hutaffen und keiner der drei Javaneraffen positiv. Damit ergab sich laut der Autoren insgesamt eine Infektionsrate von 3,6 %. CADAVID et al. (1991) untersuchten 47 aus einem Zoo in Medellin (Kolumbien) stammende Kapuzineraffen im IFAT auf Antikörper gegen T. gondii. Die Seren wurden ab einer Verdünnung von 1:64 als positiv beurteilt. Beim Nachweis von IgG-Antikörpern gegen T. gondii waren von 22 Weißstirn-Kapuzinern neun Tiere (41 %) und von 15 Weißschulter-Kapuzinern zwei Tiere (13 %) positiv. Die zehn untersuchten Gehaubten Kapuziner waren alle negativ. Der IgM-Nachweis verlief für alle 47 Tiere negativ. Es wurde daher eine chronische Infektion vermutet. MONTALI et al. (1995) berichteten über ein Auswilderungsprojekt für Löwenäffchen in Brasilien. Alle Tiere, die in das Programm integriert wurden, mussten zuvor zwei Quarantäneperioden durchlaufen, in denen Impfungen der Tiere (z. B. gegen Tetanus und Tollwut) sowie zahlreiche Routineuntersuchungen vorgenommen wurden. Diese beinhalteten auch serologische Untersuchungen auf Hepatitis-Virus-, Herpes-Virus- und T.-gondii-Infektionen. Mehrere der Tiere mussten aus dem Projekt ausgeschlossen werden, weil sie einen Antikörpertiter gegen T. gondii aufwiesen. ZHANG et al. (2000) untersuchten die Seren von 117 Tieren aus einem Zoo in China im MAT und ELISA auf Antikörper gegen T. gondii. Der MAT wurde ab einem Titer von 1:20 als positiv beurteilt. Von 16 untersuchten Primaten lieferten ein Katta, ein Hulock, ein Husarenaffe und ein Bärenmakak in beiden Tests positive Ergebnisse. Die übrigen Affen waren negativ. BRITT et al. (2004) berichteten von einem Projekt, in dem 13 Schwarzweiße Varis in Madagaskar ausgewildert wurden. Diese durchliefen zuvor strenge Gesundheitskontrollen und es wurde neben zahlreichen anderen Laboruntersuchungen auch ein ELISA zum Nachweis von Antikörpern gegen T. gondii durchgeführt. Zwei Tiere wurden auf Grund hoher IgG-Antikörpertiter nicht ausgewildert. Begründet wurde diese Entscheidung damit, dass eine Reaktivierung von latenten Infektionen nicht ausgeschlossen werden konnte. 38 2. Literaturübersicht Tab. 2: Untersuchungen auf Antikörper gegen T. gondii bei nicht humanen Primaten im natürlichen Habitat Gattung Anzahl Anzahl Land Testa Referenz unter- seroposuchter sitiver Tiere Tiere n x (%) Halbaffen Nycticebus sp. 4 1 (25) Malaysia IHAT ZAMAN u. GOH (1968) Alouatta sp. 50 2 (4) Frz. Guayana MAT CARME et al. (2002); DE THOISY (2001, 2003) Saimiri sp. 49 24 (49) Brasilien IHAT FERRARONI et al. (1980) Saguinus sp. 21 1 (5) Panama SFT FRENKEL u. SOUSA (1983) Südafrika ? 2 (55) 1 (47) 15 (?) KBR IFAT ? KASCHULA et al. (1978) KASCHULA et al. (1978) BAULU et al. (2002) 5 171 3 (60) Vietnam ? 26 (15) Indien, Malaysia KBR 164 94 211 44 170 52 (32) Philippinen, SFT Indien, Thailand 53 (56) Indien IHAT 111 (53) Indien IHAT 13 (30) Malaysia IFAT, ELISA 21 (12) Sri Lanka MAT 20 3 (15) 94 11 (12) Südafrika 7 (7) IFAT, SFT KBR 33 1 (3) IFAT, ELISA SULAIMAN et al. (1989) Neuweltaffen Altweltaffen Chlorocebus sp. ? Macaca sp. Papio sp. Trachypithecus sp. a Barbados Afrika Malaysia SFT SERY et al. (1959) UMINSKI u. PIETRZYK (1961) REMINGTON et al. (1965) CHHABRA et al. (1976) RAO BHAU et al. (1987) SULAIMAN et al. (1989) EKANAYAKE et al. (2004) DE ROEVER-BONNET (1972) McCONNELL et al. (1973) McCONNELL et al. (1973) ELISA, Enzyme-linked Immunosorbent Assay; IFAT, indirekter Fluoreszenzantikörpertest; IHAT, indirekter Hämagglutinationstest; KBR, Komplementbindungsreaktion; MAT, modifizierter Agglutinationstest; SFT, Sabin-Feldman-Test; ?, unbekannt 2. Literaturübersicht 39 Tab. 3: Untersuchungen auf Antikörper gegen T. gondii bei nicht humanen Primaten nach natürlicher Infektion in Gefangenschaft Gattung Anzahl Anzahl Testa Referenz unter- seroposuchter sitiver Tiere Tiere n x (%) Halbaffen Lemur sp. 3 2 1 1 (33) 1 (50) 1 (100) LAT BORST u. VAN KNAPEN (1984) ELISA, MAT ZHANG et al. (2000) LAT, MAT SPENCER et al. (2004) Varecia sp. ? 2 (?) ELISA BRITT et al. (2004) Aotus sp. 40 3 (8) ? PERRI et al. (1992) Ateles sp. 1 1 1 (100) 1 (100) IHAT LAT RIEMANN et al. (1974) CHOI et al. (1987) Cebus sp. 2 47 2 (100) 11 (23) SFT IFAT NERY-GUIMARAES et al. (1971) CADAVID et al. (1991) Leontopithecus sp. ? ? ? MONTALI et al. (1995) Saimiri sp. 17 17 15 (88) 1 (6) IFAT SFT CUNNINGHAM et al. (1992) NERY-GUIMARAES u. FRANKEN (1971) Erythrocebus sp. 2 1 (50) ELISA, MAT ZHANG et al. (2000) Macaca sp. 36 1 48 443 2 17 (47) 1 (100) 9 (19) 16 (4) 1 (50) SFT SFT, KBR SFT LAT ELISA, MAT FELDMAN u. MILLER (1956) VAN DEN AKKER et al. (1959) ARAUJO et al. (1973) ASAI et al. (1991) ZHANG et al. (2000) Papio sp. 25 20 (80) SFT KUNTZ u. MYERS (1967) Bunopithecus sp. 2 1 (50) ELISA, MAT ZHANG et al. (2000) Hylobates sp. 7 1 (14) LAT MURATA (1989) Gorilla sp. 1 ? 1 (50) 1 (?) ? LAT PROWTEN et al. (1985) MURATA (1989) Pan sp. 2 ? 1 (50) 1 (?) SFT LAT DRAPER et al. (1971) MURATA (1989) Pongo sp. 8 3 (38) IHAT YAMAMOTO et al. (1970) Neuweltaffen Altweltaffen Menschenaffen a ELISA, Enzyme-linked Immunosorbent Assay; IFAT, indirekter Fluoreszenzantikörpertest; IHAT, indirekter Hämagglutinationstest; KBR, Komplementbindungsreaktion; LAT, Latexagglutinationstest; MAT, modifizierter Agglutinationstest; SFT, Sabin-Feldman-Test; ?, unbekannt 40 2. Literaturübersicht 2.5.3. Übertragungswege und Epidemiologie bei nicht humanen Primaten Die Übertragungswege der bislang beobachteten spontanen T.-gondii-Infektionen bei nicht humanen Primaten konnten meistens nicht geklärt werden (CHANG et al. 1980; WOOLF u. ANTHONEY 1982; TUDGE 1991; DIETZ et al. 1997; INOUE 1997; EPIPHANIO et al. 1999a, b; BACCIARINI et al. 2001a, b). Vermutlich stellen wie bei anderen herbivoren Zwischenwirten sporulierte Oozysten die Hauptansteckungsquelle dar. Sowohl in Zoologischen Gärten als auch im natürlichen Habitat kommen für die Ausscheidung von Oozysten nicht nur streunende Hauskatzen, sondern auch zahlreiche wilde Feliden in Betracht (siehe Kap. 2.3.2.). Welche Rolle die wilden Feliden in der Epidemiologie der Toxoplasmose spielen, ist jedoch unbekannt (LABELLE et al. 2001). In einer in Französisch Guayana durchgeführten Studie wurden T.-gondii-Infektionen bei freilebenden Brüllaffen serologisch nachgewiesen. Bei den folivoren Tieren wurde eine Infektion mit sporulierten Oozysten vermutet. Da Hauskatzen in der Gegend nicht vorkamen, nahm man an, dass die Ooyzsten von wilden Feliden ausgeschieden wurden (CARME et al. 2002; DE THOISY 2001, 2003). In Zoologischen Gärten wurden bei Kattas und Neuweltaffen T.-gondii-Infektionen beobachtet, nachdem sie engen Kontakt zu wilden Feliden hatten. Diese wurden entweder dauerhaft in angrenzenden Käfigen gehalten oder konnten bei der Pflege kranker Tiere räumlich nicht von den Affen getrennt werden (DUBEY et al. 1985a; CADAVID et al. 1991). Eine Infektion mit T. gondii setzt allerdings keinen direkten Kontakt zu Katzen voraus, da die Oozysten durch zahlreiche Vektoren verbreitet werden können (siehe auch Kap. 2.3.3.). Eine Übertragung kann dabei durch kontaminiertes Trinkwasser oder mangelhaft gereinigtes Futter erfolgen. Selbst durch das Waschen von Obst werden Oozysten unter Umständen nicht vollständig entfernt (DUBEY et al. 1998b). Ein mit Oozysten verschmutzter Gehegeboden stellt ebenfalls eine Infektionsquelle dar. Sägespäne, Blätter oder Sand, die als Einstreu nachträglich in die Käfige verbracht werden, können bei unzureichender Lagerung als Katzentoilette dienen und auf diese Weise kontaminiert werden (DIETZ et al. 1997). Dies wurde als Ursache für das massenhafte Verenden von Kattas und Totenkopfaffen in einem Safaripark angesehen (BRACK et al. 1995b). Bei freilebenden Primaten sind Tiere, die das Futter direkt vom Boden aufnehmen besonders gefährdet, sich mit dem Parasiten zu infizieren (DE THOISY 2001, 2003). Eine Infektion kann vermutlich auch durch die orale Aufnahme von Transportwirten wie Käfer und Schaben erfolgen 2. Literaturübersicht 41 (DIETZ et al. 1997; INOUE 1997). Im Falle eines infizierten Kattas vermuteten SPENCER et al. (2004) den mechanischen Transport von Oozysten durch Stärlinge (Icteridae), die frei zwischen den verschiedenen Gehegen hin und her fliegen konnten und daher als Vektor in Frage kamen. Die Kattas wurden auf einer Insel isoliert von anderen Tieren gehalten, wodurch andere Übertragungswege weitgehend ausgeschlossen werden konnten. Als Vektoren kommen nicht zuletzt auch die Zoobesucher oder die Tierpfleger in Betracht, die Oozysten von der eigenen Hauskatze oder von wilden Feliden in Affengehege transportieren können (CATAO-DIAS 2001). BOUER et al. (1999) schilderten den Fall einer akuten Toxoplasmose bei Wollaffen, deren Pfleger gleichzeitig für wilde Feliden zuständig war. Für gewöhnlich wurde das Katzengehege vor dem Affengehege gereinigt und dabei dieselben Geräte und dieselbe Kleidung benutzt. Beinhaltet die Ernährung der Affen eine Fleischkomponente, so kommt auch die Übertragung von T. gondii durch die orale Aufnahme von Gewebezysten in Betracht. Es gibt einige Fallberichte, bei denen die Quelle der T.-gondii-Infektionen in der Verfütterung von rohem oder nicht ausreichend gekochtem Schaf-, Rind- oder Pferdefleisch gesehen wurde (McKISSICK et al. 1968; BENIRSCHKE u. LOW 1970; HESSLER et al. 1971; DICKSON et al. 1983; BORST u. VAN KNAPEN 1984; CUNNINGHAM et al. 1992). Durch den Verzehr von Schadnagern oder kleinen Vögeln kann es bei nicht humanen Primaten ebenfalls zu einer Aufnahme der infektiösen Gewebezysten kommen (HESSLER et al. 1971; GRINER 1983; CUNNINGHAM et al. 1992; MONTALI u. BUSH 1999; BACCIARINI et al. 2001a, b). PERTZ et al. (1997) beschrieben das Auftreten einer T.-gondii-Infektion bei vier Löwenäffchen, die zuvor dabei beobachtet wurden, wie sie eine Maus gefangen und diese anschließend unter sich geteilt und gefressen haben. Ein Tier wurde von dieser Futterteilung ausgeschlossen und war später das einzige, welches nicht erkrankte. Eine Übertragung von T. gondii durch Tachyzoiten wurde bei nicht humanen Primaten bislang nur experimentell nachgewiesen. SCHOONDERMARK-VAN DE VEN et al. (1993) erzeugten in einer Studie an trächtigen Rhesusaffen eine vertikale Infektion mit T. gondii. Die Muttertiere wurden am 90. oder 130. Tag der Trächtigkeit intravenös mit Tachyzoiten infiziert. Zehn Tage nach der Infektion wurde fetales Blut sowie Amnionflüssigkeit gewonnen und in Mäuse inokuliert sowie eine PCR durchgeführt. Stimmten die Ergebnisse aus beiden Verfahren nicht überein, wurden zusätzlich die Organe der Neonaten mikroskopisch auf T. gondii untersucht. Eine transplazentare Übertragung wurde auf diese Weise bei vier von neun Feten nachgewiesen. 42 2. Literaturübersicht Experimentell wurde auch eine horizontale Infektion mit T. gondii durch die Übertragung von Tachyzoiten nachgewiesen. In einer Studie von ESCAJADILLO u. FRENKEL (1991) wurden Nachtaffen zunächst subcutan mit Tachyzoiten und nach einigen Wochen oral oder subcutan mit Gewebezysten infiziert. Zwei nicht experimentell infizierte Kontrolltiere starben daraufhin an einer akuten Toxoplasmose. Es wurde vermutet, dass Tachyzoiten über Milch, Speichel, Urin oder Kot von den experimentell infizierten Nachtaffen ausgeschieden und von den nicht experimentell infizierten Tieren aufgenommen wurden. In einer Studie von FURUTA et al. (2001) wurden oral mit T.-gondii-Gewebezysten infizierte Totenkopfaffen mit nicht infizierten in einem Käfig gehalten. Bei den nicht experimentell infizierten Tieren kam es zu einer Serokonversion, die durch einen Immunoblot festgestellt wurde, und mittels PCR konnte DNA von T. gondii in Leber und Lunge der Tiere nachgewiesen werden. Im Gegensatz zu den oral infizierten Affen waren jedoch weder klinische Symptome noch histopathologische Veränderungen oder Tachyzoiten in den Geweben auszumachen. Da in der bronchoalveolären Lavage der oral infizierten Totenkopfaffen eine große Menge an Tachyzoiten nachgewiesen werden konnte, wurde eine Übertragung durch Aerosol vermutet. Vereinzelt kann es sich bei den beobachteten Krankheitsfällen auch um reaktivierte latente Infektionen handeln. Eine Reaktivierung kann z. B. durch Stresssituationen ausgelöst werden. Bei Wildfängen kann die Übertragung von T. gondii dabei schon im natürlichen Habitat stattgefunden haben (JUAN-SALLES et al. 1997). Je nach Ansteckungsquelle kann sich eine Übertragung von T. gondii als Einzeltier- oder als Gruppenerkrankung auswirken, sowie endemisch oder epidemisch in Erscheinung treten (ANDERSON u. McCLURE 1993). Handelt es sich um sporadische Infektionen einzelner Tiere, so ist als Übertragungsweg z. B. das Verzehren eines infizierten Schadnagers oder die Verbreitung von Oozysten durch Vektoren wie Insekten denkbar. Ist in einem Bestand die Möglichkeit eines derartigen Übertragungsweges gegeben, so können Infektionen zeitlich unbegrenzt stattfinden. Kommt es daraufhin über einen längeren Zeitraum hinweg wiederholt zu Erkrankungen, kann man von einem endemischen Auftreten der Infektion sprechen (JUAN-SALLES et al. 1997). 2. Literaturübersicht 43 Bei einem seuchenhaften Ausbruch der Erkrankung kann man hingegen davon ausgehen, dass die Übertragung des Erregers zu einem bestimmten Zeitpunkt stattfand (CUNNINGHAM et al. 1992). Gleichzeitig muss die Ansteckungsquelle eine ausreichende Anzahl von Parasiten enthalten, mit der sich eine ganze Tiergruppe infizieren kann (Punktquelle). Denkbar wäre in einem solchen Fall die Kontamination des Futters mit Oozysten oder die Verfütterung von rohem, zystenhaltigem Fleisch. Ist ein solcher Ausbruch auf einen bestimmten Zeitraum begrenzt, kann von einem epidemischen Auftreten gesprochen werden. T.-gondii-Epidemien sind bei Neuweltaffen in Gefangenschaft durch eine hohe Mortalitätsrate von über 50 % charakterisiert (DIETZ et al. 1997). 2.5.4. Fallberichte In der Tab. 4 sind Fallberichte über klinische Toxoplasmosen bei nicht humanen Primaten zusammengestellt. Es sind dabei nur diejenigen klinischen Toxoplasmosen aufgeführt, die nicht experimentell hervorgerufen wurden. Die Berichte beziehen sich auf Tiere, die zum Zeitpunkt der Erkrankung in zoologischen Gärten, in Forschungseinrichtungen oder von Privatpersonen gehalten wurden. Berichte über klinische Toxoplasmosen im natürlichen Habitat gibt es bisher keine. In einer Studie von McCONNELL et al. (1973) konnte der Parasit zwar bei wildlebenden Pavianen nachgewiesen werden, klinische Symptome einer Toxoplasmose wurden aber bei keinem der Affen beobachtet. Die Tiere wurden in freier Wildbahn gefangen und anschließend euthanasiert, um sie auf verschiedene Krankheitserreger hin zu untersuchen. Dabei wurden bei vier von 94 Pavianen T.gondii-Zysten im Gehirn sowie in der Herz- und Skelettmuskulatur gefunden. Von diesen vier Pavianen zeigten alle ein positives Ergebnis im SFT, im IFAT und in der KBR. Sieben weitere der 94 untersuchten Tiere waren ebenfalls serologisch positiv. Ein ähnlicher Fall wird von ZAMAN u. GOH (1968) beschrieben. Hier wurde bei vier Plumploris, die in Malaysia gefangen wurden, eine serologische Untersuchung auf T. gondii im IHAT durchgeführt, woraufhin das einzige positive Tier euthanasiert wurde. Bei der anschließenden Sektion konnten Zysten im Gehirn des Halbaffen gefunden werden. Es handelte sich in diesem Fall ebenfalls um eine latente Infektion. 44 2. Literaturübersicht Bei den in der Tab. 4 aufgeführten Fallberichten mit unbekannter Gruppengröße und unbekannter Anzahl erkrankter Tiere handelt es sich um die Schilderung von Sektionsbefunden, ohne dass die jeweiligen Vorberichte erwähnt werden. Es gibt jedoch auch sehr detaillierte Fallberichte, in denen neben den beobachteten klinischen Symptomen die genaue Anzahl der erkrankten und verendeten Tiere angegeben wird. Dabei wird deutlich, dass sich eine Toxoplasmose bei nicht humanen Primaten sowohl als Einzeltiererkrankung auswirken, aber auch eine ganze Gruppe von Tieren betreffen kann. So trat laut ANDERSON u. McCLURE (1982) bei einer Gruppe von 15 Totenkopfaffen bei einem einzelnen Tier eine Toxoplasmose auf, während bei den von TUDGE (1991) und CUNNINGHAM et al. (1992) geschilderten Berichten von 17 Totenkopfaffen sämtliche Tiere betroffen waren. In den meisten Fallberichten endeten die beschriebenen Toxoplasmosen letal. In Einzelfällen konnte jedoch eine Rekonvaleszenz erkrankter Tiere beobachtet werden. Laut ISENBÜGEL (1983) erkrankten in einem Bestand von 16 Kattas mehrere Tiere verschiedenen Alters und Geschlechts. Die Tiere verweigerten die Nahrungsaufnahme und entwickelten neurologische Störungen. Innerhalb eines Zeitraums von 3 Wochen verstarben sechs der Tiere und gelangten nacheinander zur Sektion. Hier wurde bei jedem der Tiere eine disseminierte Toxoplasmose diagnostiziert. Beim ersten Hinweis auf eine T.-gondii-Infektion wurde bei allen erkrankten Tieren eine spezifische Therapie mit Sulfadiazin und Pyrimethamin eingeleitet. Zwei der erkrankten Tiere haben unter dieser Therapie die Toxoplasmose überlebt. CUNNINGHAM et al. (1992) beschrieben das Auftreten einer akuten disseminierten Toxoplasmose in einer Gruppe von 17 Totenkopfaffen. Jedes der Tiere zeigte sich lethargisch, die meisten waren inappetent und hatten Diarrhö. Innerhalb weniger Tage verstarben fünf Tiere. Anschließend konnte bei den übrigen Affen eine Besserung der klinischen Symptome beobachtet werden, und eine Woche nach dem ersten Todesfall schien sich das Allgemeinbefinden der Kolonie zu normalisieren. Drei Wochen später starb ein weiteres Tier, erneute Erkrankungen wurden nicht beobachtet. Vier der sechs gestorbenen Tiere wurden im IFAT auf Antikörper gegen T. gondii untersucht. Alle vier wiesen einen IgG-Titer und drei einen IgM-Titer gegen T. gondii auf. Auch von den überlebenden Totenkopfaffen wurden 47 Tage nach dem ersten Todesfall Blutproben entnommen und diese serologisch untersucht. Bei allen Tieren konnten IgG- und bei sechs Tieren IgM-Antikörper gegen T. gondii nachgewiesen werden. 2. Literaturübersicht 45 In einem von TUDGE (1991) beschriebenen Fall erkrankten 17 Totenkopfaffen an einer Toxoplasmose. Fünf der Tiere starben innerhalb von 3 Tagen, das dominante Männchen 3 Wochen später. Bei der anschließenden Sektion konnte T. gondii immunhistochemisch nachgewiesen werden. Aus den 11 überlebenden Tieren und einem neu integrierten dominanten Männchen wurde eine neue Zuchtgruppe aufgebaut, doch nach einem Jahr brach die Krankheit erneut aus und es verstarben weitere fünf Tiere. Die Infektionsquelle konnte nicht ermittelt werden. T. gondii kann je nach Übertragungsweg (siehe Kap. 2.5.3.) zur gleichen Zeit in verschiedenen Affenkolonien Erkrankungen hervorrufen. BORST u. VAN KNAPEN (1984) beschrieben einen Fall, in dem innerhalb eines Zeitraumes von 4 Wochen sechs von 19 Kattas, sechs von 31 Totenkopfaffen und zwei von vier Nachtaffen an einer Toxoplasmose starben. Alle betroffenen Tiere zeigten 2 bis 12 Tage lang unspezifische Krankheitssymptome. Als Infektionsquelle wurde die Verfütterung von rohen Schafherzen etwa 2 Wochen vor dem Auftreten der ersten Erkrankungen vermutet. Direkt nach dem Auftreten der ersten klinischen Symptome wurden insgesamt 14 Tieren der verschiedenen Affenspezies Blutproben entnommen und im LAT auf Antikörper gegen T. gondii untersucht. Diese waren alle negativ, wodurch ein früherer Kontakt zu T. gondii ausgeschlossen wurde, mit der Schlussfolgerung, dass es sich um eine frische Infektion handeln musste. Drei der erkrankten und später verstorbenen Kattas wurden ebenfalls serologisch untersucht, wobei nur eines dieser Tiere einen Antikörpertiter gegen T. gondii aufwies. Dieser Befund wurde mit dem akuten Verlauf der Erkrankung erklärt. Die überlebenden Tiere des KattaBestandes blieben auch 2 Monate nach den ersten Todesfällen serologisch negativ. Daraus wurde der Schluss gezogen, dass sich innerhalb eines engen Zeitraums nur eine begrenzte Anzahl der Tiere infizieren konnte. 2.5.4.1. Klinische Toxoplasmosen bei Altweltaffen Aus der Tab. 4 wird deutlich, dass der überwiegende Teil der klinischen Toxoplasmosen bei Neuweltaffen und Lemuren beobachtet wurde. Bei Altweltaffen einschließlich der Menschenaffen lässt sich eine Infektion mit T. gondii zwar häufig serologisch nachweisen (BRACK et al. 1995a), diese verläuft bei diesen Tieren aber in der Regel latent. Es gibt jedoch auch einzelne Berichte über klinische Toxoplasmosen bei Altweltaffen. 46 2. Literaturübersicht In einer Studie von WONG u. KOZEK (1974) wurden 1400 Sektionsberichte von Makaken ausgewertet, die in einem kalifornischen Forschungszentrum starben. Dabei wurde in vier Fällen eine Toxoplasmose diagnostiziert. Vor ihrem Verenden konnten bei den vier Makaken Konvulsionen, Gewichtsverluste, vergrößerte Lymphknoten, Nasenausfluss und intermittierende Diarrhö beobachtet werden. Die Tiere waren chronischen Stresssituationen in Form von Bestrahlungen, chirurgischen Eingriffen, experimentellen Malaria-Infektionen, Bisswunden sowie konkurrierenden Bakterien- und Parasiteninfektionen ausgesetzt. Es wurde daher diskutiert, dass sich diese Einflüsse prädisponierend auf die Ausbildung der Toxoplasmose ausgewirkt haben könnten. VAN DEN AKKER et al. (1959) beobachteten bei einem Makaken chronische Diarrhö. Im SFT hatte das Tier einen Titer von 1:512 und in der KBR von 1:32. Nach der Euthanasie konnten aus dem Gehirn Bradyzoiten isoliert werden, die pathologisch-anatomische Untersuchung verlief negativ. Ein weiterer Fall einer klinischen Toxoplasmose konnte bei einem jungen Rhesusaffen beobachtet werden. Dieser war zusammen mit anderen Tieren untergebracht, die experimentell mit T. gondii infiziert wurden. Das Tier verstarb nach kurzer Krankheitsdauer (NERY-GUIMARÃES et al. 1971). Ein 3 Jahre alter Schimpanse starb nachdem er zentralnervöse Störungen entwickelt hatte. Das Gehirn des Tieres wurde daraufhin auf eine eventuelle Tollwut-Infektion hin untersucht, dabei wurden Gewebezysten von T. gondii entdeckt (SCHOBERT 1970 zit. von McCLURE u. GUILLOUD 1971). Bei den von LEVADITI u. SCHOEN (1933) sowie von KOPCIOWSKA u. NICOLAU (1938) geschilderten Fällen ist zweifelhaft, ob die Übertragung von T. gondii auf natürlichem Weg stattfand oder experimentell verursacht wurde (REMINGTON et al. 1965). LEVADITI u. SCHOEN (1933) berichteten Lymphknotengewebe von von einer Toxoplasmose einem bei Meerschweinchen einem Pavian. verabreicht, Dem Tier wurde welches mit einem primatenpathogenen Virus infiziert war. Fünf Tage nach der Inokulation starb der Pavian an einer Meningoenzephalitis. Im Gehirn des Tieres wurden T.-gondii-Zysten gefunden, die eine große Anzahl an Parasiten enthielten. Obwohl bei einer anschließenden histologischen Untersuchung der Lymphknoten des Meerschweinchens keine Gewebezysten gefunden wurden, wurde die Spontanität 2. Literaturübersicht 47 der Toxoplasmose angezweifelt, da nicht sicher ausgeschlossen werden konnte, dass T. gondii auf diesem Weg übertragen wurde. KOPCIOWSKA u. NICOLAU (1938) beschrieben eine spontane Toxoplasmose bei einem Schimpansen. Dieser wurde euthanasiert, nachdem er 15 Tage zuvor intrazerebral mit dem Gehirn eines Kaninchens inokuliert wurde, das mit dem Aujeszky-Virus infiziert war. Im Gehirn des Schimpansen wurde neben virusinduzierten Läsionen eine einzige T.-gondii-Zyste gefunden. In der Abb. 2 ist dargestellt, wie sich die in der Tab. 4 aufgelisteten 238 Todesfälle prozentual auf die unterschiedlichen Spezies verteilen. Dabei wird deutlich, dass der Anteil der Altweltaffen, die in Folge einer Toxoplasmose gestorben sind, nur sehr gering ist (3 %), während die Neuweltaffen mit insgesamt 184 Todesfällen (77 %) den mit Abstand größten Anteil ausmachen. Dabei entfallen über die Hälfte der Todesfälle unter den Neuweltaffen auf die Totenkopfaffen. Bei den Halbaffen sind die Kattas mit 42 Todesfällen (18 %) die am häufigsten betroffene Spezies. Ein objektiv belegbarer Grund dafür, warum Neuweltaffen und Lemuren so signifikant häufiger mit letalen Erkrankungen auf eine T.-gondii-Infektion reagieren als Altweltaffen, konnte bislang nicht gefunden werden (BRACK et al. 1995b). Die Zahl der hier aufgeführten in den vergangenen Jahrzehnten durch eine Toxoplasmose verursachten Todesfälle scheint in Bezug auf die Gesamtpopulationen der weltweit von Menschen gehaltenen nicht humanen Primaten gering. Beispielsweise wurden in einer Studie von LEONG et al. (2004) retrospektiv die Todesursachen von 276 Lisztaffen untersucht, die innerhalb eines Zeitraumes von 4 Jahren in verschiedenen Institutionen in den USA starben. Dabei wurde nur in einem einzigen Fall eine disseminierte Toxoplasmose diagnostiziert. Es muss aber berücksichtigt werden, dass, wenn in den Tierbeständen eine Toxoplasmose auftritt, es innerhalb weniger Tage zu großen Verlusten unter den teilweise sehr wertvollen und artgeschützten Tieren kommen kann. Die Toxoplasmose kann daher bei seuchenhaften Ausbrüchen sowie in Problembeständen, in denen der Erreger endemische Infektionen hervorruft, von großer Bedeutung sein. So kam es in einem norddeutschen Safaripark innerhalb weniger Jahre zu massiven Verlusten innerhalb des Bestandes an Kattas und Totenkopfaffen. Der zweimalige Versuch, eine Zuchtgruppe unter den Kattas aufzubauen, scheiterte daran, dass 15 von 17 und sechs von 17 Tieren an einer Toxoplasmose starben (BRACK et al. 1995b, 1998; WOHLSEIN et al. 1999). 48 2. Literaturübersicht Tab. 4: Klinische Toxoplasmosen bei nicht humanen Primaten nach natürlicher Infektion Gattung Anzahl der Tiere Anzahl Referenz mit klinischen verenSymptomen deter x/n Tiere Halbaffen Hapalemur sp. 3/? 3 HARING u. DAVIS (1998) Lemur sp. 1/? 1/? 2/2 1 1 2 8/16 6/19 4/6 15/17 6/17 1/? 6 6 4 15 6 1 SUREAU et al. (1962) UILENBERG u. RIBOT (1965) ITAKURA u. NIGI (1968); NIGI u. ITAKURA (1968) ISENBÜGEL (1983) BORST u. VAN KNAPEN (1984) DUBEY et al. (1985a) BRACK et al. (1995b); WOHLSEIN et al. (1999) BRACK et al. (1998) SPENCER et al. (2004) Nycticebus sp. 1a /4 1b ZAMAN u. GOH (1968) Propithecus sp. 1/1 1 CHANG et al. (1980) Varecia sp. 1/? 1 UILENBERG u. RIBOT (1965) Alouatta sp. 1/1 ? 1 6 THEZE (1916) EPIPHANIO et al. (2003) Aotus sp. 2/? 2/4 ? 2 2 1 SEIBOLD u. WOLF (1971) BORST u. VAN KNAPEN (1984) EPIPHANIO et al. (2003) Ateles sp. 1/? 1 RATCLIFFE u. WORTH (1951) Cacajao sp. 1/? ? 1 1 RATCLIFFE (1954) RATCLIFFE (1961) Callicebus sp. 1/1 1 SEIBOLD u. WOLF (1971) Callithrix sp. ? 3/16 ? ? 6 3 1 3 HILGENFELD (1965a, b, 1966) DIETZ et al. (1997) JENSEN et al. (1998) EPIPHANIO et al. (2003) Cebus sp. 1/? 1/? 1b 1 DE RODANICHE (1954a) NERY-GUIMARÃES et al. (1971) Lagothrix sp. 1/3 ? 1 1 STOLZ (1962) BENIRSCHKE u. LOW (1970) Neuweltaffen ?, unbekannt; a T. gondii nur histologisch nachgewiesen, Tiere ohne klinische Symptome; b Euthanasie 2. Literaturübersicht 49 Tab. 4: Klinische Toxoplasmosen bei nicht humanen Primaten nach natürlicher Infektion (Fortsetzung) Gattung Anzahl der Tiere Anzahl Referenz mit klinischen verenSymptomen deter x/n Tiere Lagothrix sp. 1 3 5 HESSLER et al. (1971) BOUER et al. (1999) EPIPHANIO et al. (2003) Leontopithecus sp. ? ? ? 2/? 4/5 3/3 ? 2 3 3 2 4 3 10 RATCLIFFE (1961) HILGENFELD (1966) GRINER (1983) DIETZ et al. (1997) PERTZ et al. (1997) JUAN-SALLES et al. (1998) EPIPHANIO et al. (2003) Pithecia sp. ? ? 1 2 RATCLIFFE (1954) ZWART et al. (1989) Saimiri sp. 2/? 1/? 1/? ? 2 1 1 1 9/17 1/15 3/5 17/21 6/31 ? 17/17 17/17 ?/14 9/28 5/? 8/14 ? 3/? 9 1 3 17 6 7 11 6 2 9 5 8 3 3 RATCLIFFE u. WORTH (1951) RATCLIFFE (1954) DÖBEREINER (1955) ZUCKERMAN (1956) zit. von HILGENFELD (1966) McKISSICK et al. (1968) ANDERSON u. McCLURE (1982) WOOLF u. ANTHONEY (1982) DICKSON et al. (1983) BORST u. VAN KNAPEN (1984) ZWART et al. (1989) TUDGE (1991) CUNNINGHAM et al. (1992) BRACK et al. (1995b); WOHLSEIN et al. (1999) BACCIARINI et al. (2001a, b) INOUE (1997) BRACK et al. (1998) EPIPHANIO et al. (2003) ANDRADE et al. (2004) 1/2 ? 4/7 3/? 3/3 1 1 4 3 3 BENIRSCHKE u. RICHART (1960) GRINER (1983) BRACK et al. (1995b) DIETZ et al. (1997) WOHLSEIN et al. (1999) Saguinus sp. 1/? 3/? ? ?, unbekannt; a T. gondii nur histologisch nachgewiesen, Tiere ohne klinische Symptome; b Euthanasie 50 2. Literaturübersicht Tab. 4: Klinische Toxoplasmosen bei nicht humanen Primaten nach natürlicher Infektion (Fortsetzung) Gattung Anzahl der Tiere Anzahl Referenz mit klinischen verenSymptomen deter x/n Tiere Saguinus sp. ? 1/276 5 1 EPIPHANIO et al. (2003) LEONG et al. (2004) Macaca sp. 1/? 1/? 4/1400 1b 1 4 VAN DEN AKKER et al. (1959) NERY-GUIMARÃES et al. (1971) WONG u. KOZEK (1974) Pan sp. 1a /? 1/? 1b 1 Papio sp. 1/? 4/94a 1 94b KOPCIOWSKA u. NICOLAU (1938) SCHOBERT (1970) zit. von McCLURE u. GUILLOUD (1971) LEVADITI u. SCHOEN (1933) McCONNELL et al. (1973) Altweltaffen ?, unbekannt; a T. gondii nur histologisch nachgewiesen, Tiere ohne klinische Symptome; b Euthanasie 3% 2% 18% 40% 37% Altweltaffen Halbaffen außer Kattas Kattas Neuweltaffen außer Totenkopfaffen Totenkopfaffen Abb. 2: Todesfälle durch T.-gondii-Infektionen bei nicht humanen Primaten (n = 238) 2. Literaturübersicht 51 2.5.5. Klinische Symptome und Verlauf der Erkrankung Das Krankheitsbild einer Toxoplasmose bei nicht humanen Primaten ist variabel und unspezifisch (McKISSICK et al. 1968). Klinische Symptome lassen sich insbesondere bei Lemuren und Neuweltaffen beobachten. Altweltaffen einschließlich der Menschenaffen erkranken hingegen selten klinisch, obwohl laut BRACK et al. (1995a) auch bei ihnen häufig eine Infektion mit T. gondii serologisch nachweisbar ist (siehe Kap. 2.5.2.). Die in 35 Fallberichten am häufigsten genannten klinischen Symptome sind in Tab. 5 zusammengestellt. Die Beobachtungen beziehen sich dabei alle auf Tiere, die sich zum Zeitpunkt der Erkrankung in Gefangenschaft befanden. Berichte über klinische Toxoplasmosen im natürlichen Habitat gibt es bislang keine. Bei Neuweltaffen und Lemuren lassen sich akute disseminierte Toxoplasmosen beobachten, wie sie auch in der Humanmedizin von immundefizienten Patienten bekannt sind (referiert in CUNNINGHAM et al. 1992). Häufig kommt es bei diesen Tieren zu plötzlichen Todesfällen, denen ein kurzes Krankheitsgeschehen von 1 bis 11 Tagen vorausgegangen ist (POTKAY 1992). Es gibt jedoch auch zahlreiche Berichte über ein Verenden der Tiere, ohne dass zuvor klinische Symptome beobachtet werden konnten. In einer Studie von EPIPHANIO et al. (2003) geschah dies mit einer Häufigkeit von 44 %. Oft sind die Tiere zum Zeitpunkt des Todes in einer guten körperlichen Verfassung, was den akuten Verlauf der Erkrankung deutlich macht (HESSLER et al. 1971; CUNNINGHAM et al. 1992; BOUER et al. 1999; EPIPHANIO et al. 2000, 2001, 2003). Es können Tiere jeder Altersstufe erkranken, wobei es sich je nach Infektionsquelle um Einzeltiererkrankungen oder um die Infektion einer gesamten Gruppe handelt (siehe Kap. 2.5.3.). Zu den beobachteten unspezifischen klinischen Symptomen gehören Fieber oder Hypothermie sowie blasse Schleimhäute und Gewichtsverluste. Im Differentialblutbild kann die Ausbildung einer Leukozytose oder einer Leukopenie festgestellt werden. Die Tiere sind im Allgemeinen durch Schwäche, Depression und Bewegungsunlust gekennzeichnet oder befinden sich in einem somnolenten, lethargischen oder apathischen Zustand. Die Bewusstseinsstörungen können sich bis hin zum Koma verstärken. Die erkrankten Tiere zeigen eine zusammengekauerte Körperhaltung, isolieren sich vom Rest der Gruppe oder sitzen dicht aneinandergedrängt im Gehege. Verdauungsstörungen äußern sich durch verminderten Appetit bis hin zu Anorexie. Von McKISSICK et al. (1968) wurden auch übermäßige Nahrungs- und Wasseraufnahme beobachtet. 52 2. Literaturübersicht Häufig beobachtete Symptome sind Erbrechen sowie das Auftreten von ungeformtem Kot oder Diarrhö. Im Zusammenhang mit einer durch T. gondii verursachten Pankreatitis wurde bei einem Tier Hyperglykämie in Verbindung mit Polydipsie und Polyurie festgestellt (CHANG et al. 1980). Bei Beteiligung des Respirationstraktes wurden Dyspnoe, Tachypnoe und Husten beobachtet, bei dem es auch vereinzelt zur Haemoptyse kam. Auch Reibungsgeräusche bei Auskultation der Lunge wurden festgestellt (NIGI u. ITAKURA 1968). Einzelne Tiere entwickelten einen Augen- und Nasenausfluss, wobei auch Epistaxis beobachtet wurde (McKISSICK et al. 1968; EPIPHANIO et al. 2001, 2003). Beim Auftreten von neurologischen Symptomen kann es zu Kreisbewegungen, ataktischen Bewegungsstörungen oder zur Ausbildung von Paresen kommen, die ein- oder beidseitig in Erscheinung treten können. Erkrankte Tiere haben teilweise stark verlangsamte Reflexe oder entwickeln einen Strabismus. Auch das Auftreten von Konvulsionen wurde beschrieben. Ein Totenkopfäffchen wurde dabei beobachtet, wie es wiederholt seinen Kopf gegen die Käfigwände schlug (McKISSICK et al. 1968). Bei trächtigen Weibchen wurden Aborte sowie Früh- oder Totgeburten beobachtet (BRACK et al. 1998; WOHLSEIN et al. 1999). Fälle von chronischer Toxoplasmose sind bei Neuweltaffen und Lemuren selten. McKISSICK et al. (1968) beschrieben jedoch bei einem Totenkopfaffen das Auftreten von protrahierter Diarrhö, die bereits 43 Tage vor dem Tod des Tieres auftrat. Ein anderer Totenkopfaffe wurde erst zwei Monate nach Ausbruch der Krankheit auf Grund von neurologischen Symptomen eingeschläfert (BACCIARINI et al. 2001a). Laut DUBEY (1986) ist das Überleben von erkrankten Tieren selten. In Einzelfällen konnte jedoch eine Rekonvaleszenz beobachtet werden (ISENBÜGEL 1983; TUDGE 1991; CUNNINGHAM et al. 1992). Diese Fälle sind in Kap. 2.5.4. ausführlich dargestellt. Bei Altwelt- und Menschenaffen verläuft eine Infektion mit T. gondii meistens latent. Treten klinische Symptome auf, so sind sie im Allgemeinen weniger schwer wiegend als bei Neuweltaffen (WONG et al. 1974; BRACK et al. 1995b). Es wurden Lustlosigkeit, Anorexie, eine Schwellung der oberflächlichen Lymphknoten, Fieber, Gewichtsverluste, Nasenausfluss und Diarrhö beobachtet, welche intermittierend oder protrahiert in Erscheinung trat (MOHR et al. 1955; VAN 2. Literaturübersicht 53 DEN AKKER et al. 1959; DRAPER et al. 1971; WONG et al. 1974; WONG u. KOZEK 1974). MOHR et al. (1955) berichteten zudem von Schwäche, Leukopenie und dem Auftreten von Konvulsionen. Experimentell konnte bei Makaken und Meerkatzen eine okuläre Toxoplasmose durch die Injektion von Tachyzoiten in die Retina erzeugt werden (CULBERTSON et al. 1982; HOLLAND et al. 1988). Die dadurch entstandene Retinochorioiditis äußerte sich in gelb-weißen Läsionen der Retina, die nach Abheilung eine Narbe hinterließen. Zudem konnten HOLLAND et al. (1988) Gewichtsverluste und Diarrhö bei den Tieren beobachten. Die wenigen in der Literatur beschriebenen Fälle von klinischen Toxoplasmosen bei Altweltaffen beziehen sich jedoch auf experimentell infizierte oder unter chronischen Stresssituationen leidende Tiere, bei denen es auch vereinzelt zu Todesfällen kam (COWEN u. WOLF 1945; MOHR et al. 1955; NERY-GUIMARAES et al. 1971; WONG u. KOZEK 1974). 54 2. Literaturübersicht Tab. 5: Häufigkeit beobachteter klinischer Symptome bei Toxoplasmosen bei nicht humanen Primaten Klinisches Auftreten in Referenz Symptom 35 Fallberichten Abs. H. Rel. H. (n)a (%)b Anorexie 19 54 MOHR et al. (1955); BENIRSCHKE u. RICHART (1960); STOLZ (1962); HILGENFELD (1966); McKISSICK et al. (1968); NIGI u. ITAKURA (1968); WERNER et al. (1969); DRAPER et al. (1971); NERY-GUIMARAES et al. (1971); HESSLER et al. (1971); ISENBÜGEL (1983); BORST u. VAN KNAPEN (1984); CUNNINGHAM et al. (1992); BRACK et al. (1998); JUAN-SALLES et al. (1998); WOHLSEIN et al. (1999); EPIPHANIO et al. (2001, 2003); SPENCER et al. (2004) Dyspnoe 12 34 BENIRSCHKE u. RICHART (1960); HILGENFELD (1966); McKISSICK et al. (1968); WOOLF u. ANTHONEY (1982); DICKSON et al. (1983); DIETZ et al. (1997); JUAN- SALLES et al. (1998); BACCIARINI et al. (2001a); EPIPHANIO et al. (1999b, 2001, 2003); SPENCER et al. (2004) Apathie/Lethargie 11 31 HILGENFELD (1966); McKISSICK et al. (1968); CUNNINGHAM et al. (1992); WERNER et al. (1969); HESSLER et al. (1971); BOUER et al. (1999); EPIPHANIO et al. (1999b, 2001); WOHLSEIN et al.(1999); BACCIARINI et al. (2001a); SPENCER et al. (2004) Diarrhoe 10 29 MOHR et al. (1955); VAN DEN AKKER et al. (1959); STOLZ (1962); UILENBERG u. RIBOT (1965); McKISSICK et al. (1968); HESSLER et al. (1971); WONG u. KOZEK (1974); CUNNINGHAM et al. (1992); BOUER et al. (1999); BACCIARINI et al. (2001a) Erbrechen 6 17 BENIRSCHKE u. RICHART (1960); STOLZ (1962); McKISSICK et al. (1968); BOUER et al. (1999); BACCIARINI et al. (2001a, b); EPIPHANIO et al. (2003) Fieber 5 14 DE RODANICHE (1954b); MOHR et al. (1955); STOLZ (1962); NERY-GUIMARAES et al. (1971); WONG et al. (1974) Hypothermie 5 14 UILENBERG u. RIBOT (1965); HILGENFELD (1966); CHANG et al. (1980); EPIPHANIO et al. (2001, 2003) Ataxie 4 11 McKISSICK et al. (1968); DICKSON et al. (1983); ISENBÜGEL (1983); EPIPHANIO et al. (2001) Konvulsionen 3 9 MOHR et al. (1955); CHANG et al. (1980); DICKSON et al. (1983) Paresen 2 6 CHANG et al. (1980); ISENBÜGEL (1983) Aborte 2 6 BRACK et al. (1998); WOHLSEIN et al. (1999) keine (plötzlicher Tod) 11 31 ANDERSON u. McCLURE (1982); WOOLF u. ANTHONEY (1982); DICKSON et al. (1983); DIETZ et al. (1997); PERTZ et al. (1997); BRACK et al. (1998); BACCIARINI (2001a); FURUTA et al. (2001); EPIPHANIO et al. (1999a, b, 2003) a , absolute Häufigkeit; b, relative Häufigkeit 2. Literaturübersicht 55 2.5.6. Pathologie und Pathogenese Während der ungeschlechtlichen Vermehrung des Parasiten im Zwischenwirt kommt es zu einem massenhaften Befall der Parenchymzellen. Tachyzoiten dringen aktiv in die Wirtszellen ein und vermehren sich explosionsartig. Eine Wirtszelle füllt sich nach mehreren Teilungsvorgängen an, kann aber nur maximal 32 Tachyzoiten aufnehmen (FRENKEL 2000). Danach geht sie zugrunde und die Tachyzoiten werden frei, um in benachbarte Zellen einzudringen. Das Absterben parasitenbefallener Wirtszellen verursacht Gewebenekrosen, die sich durch den Tod vieler benachbarter Zellen herdförmig ausbreiten. Auf die Zerstörung der Zellen folgt in der Regel eine Infiltration mit Entzündungszellen (GARDINER et al. 1998). Wird durch den Parasiten eine starke, unkontrollierte Immunantwort induziert, stellt dies möglicherweise die Hauptursache für die Organschäden und damit auch für die Letalität der Toxoplasmose dar (referiert in EPIPHANIO et al. 2003). Vermutlich spielt bei der Pathogenese der akuten Toxoplasmose auch das Auftreten von Immunkomplexen eine Rolle, die während des Auftretens der klinischen Symptome serologisch nachweisbar sind. Das pathologische Bild einer akuten disseminierten Toxoplasmose bei nicht humanen Primaten wird durch das Auftreten multipler Nekroseherde in den verschiedenen Organen mit oder ohne entzündliche zelluläre Infiltration charakterisiert (McKISSICK et al. 1968). Die in 33 Fallberichten am häufigsten genannten makroskopischen und mikroskopischen pathologischen Befunde sind in der Tab. 6 zusammengestellt. Die makroskopisch sichtbaren Veränderungen sind wie die klinischen Symptome variabel und unspezifisch (McKISSICK et al. 1968). Zu den häufigsten Sektionsbefunden zählen schlecht retrahierte, emphysematöse und ödematisierte Lungen mit einer ausgeprägten Hyperämie. In einigen Fällen kann auch eine Atelektase festgestellt werden. Leber und Milz sind häufig vergrößert und hyperämisch. In einigen Fällen können in Leber, Niere und Milz miliare, grauweiße Herde nachgewiesen werden. Im Thorax, im Perikard und in der Bauchhöhle befinden sich oft vermehrte Ansammlungen von Transsudat. Die Mesenteriallymphknoten stellen sich häufig geschwollen und ödematisiert dar, vereinzelt sind sie hämorrhagisch. In Nieren, Herz und Lunge können petechiale Blutungen beobachtet werden. Bei einigen Tieren wird ein Ikterus festgestellt. Vereinzelt werden 56 2. Literaturübersicht am Dünndarm unterhalb der Serosa umschriebene, 1 bis 2 mm breite, rote Banden beobachtet (DICKSON et al. 1983; PERTZ et al. 1997; BACCIARINI et al. 2001a, b). Mikroskopisch werden bei fast allen nicht humanen Primaten mit einer generalisierten Toxoplasmose multifokale Organnekrosen nachgewiesen. Am häufigsten sind dabei Leber, Lymphknoten, Darm, Herz, Milz, Niere und Nebennieren betroffen, vereinzelt werden auch Nekrosen in Lunge, Pankreas, mesenterialem Fettgewebe, Skelettmuskulatur, Peyerschen Platten, Auge und Gehirn festgestellt. Beim überwiegenden Teil der Tiere wird eine interstitielle Pneumonie diagnostiziert. Entzündliche Veränderungen der Organe werden zudem oft in Darm, Leber, Myokard, Milz, Lymphknoten, Niere, Nebennieren und Gehirn nachgewiesen, vereinzelt sind Rückenmark, Hirnhäute, Pankreas, mesenteriales Fettgewebe, Skelettmuskulatur und Gebärmutter betroffen. Der Nachweis der Parasiten kann mikroskopisch oder immunhistologisch erfolgen. Dabei können Tachyzoiten im Bereich der Nekroseherde innerhalb der verschiedenen Organe frei sowie im Zytoplasma von Makrophagen oder diversen anderen Wirtszellen wie Pneumozyten, Alveolarmakrophagen, Gefäßendothelien, Hepatozyten, Kupfferschen Sternzellen, Histiozyten, Monozyten, Darmepithelzellen und Skelettmuskelzellen nachgewiesen werden (ISENBÜGEL 1983; INOUE 1997; BRACK et al. 1998; WOHLSEIN et al. 1999; FURUTA et al. 2001). EPIPHANIO et al. (2003) konnten den Parasiten zudem in Erythrozyten beobachten, die Tachyzoiten lagen dabei frei im Zytoplasma und nicht in einer parasitophoren Vakuole. Gewebezysten können in Gehirn, Myocard, Niere, Milz, Schilddrüse, Nebennieren, Pankreas und in der Skelettmuskulatur vorhanden sein (McKISSICK et al. 1968; ZAMAN u. KRISHNAMURTI 1969; HESSLER et al. 1971; McCONNELL et al. 1973, 1974; CHANG et al. 1980; WOHLSEIN et al. 1999). Die Zysten liegen dabei in der Regel ohne eine Entzündungsreaktion im Gewebe (BACCIARINI et al. 2001a, b). 2. Literaturübersicht 57 Tab. 6: Häufigkeit von makroskopischen und mikroskopischen pathologischen Befunden bei akuten disseminierten Toxoplasmosen bei nicht humanen Primaten Befund Auftreten in Referenz 33 Fallberichten Abs. H.a Rel. H.b (n) (%) multifokale 29 88 BENIRSCHKE u. RICHART (1960); UILENBERG u. RIBOT Nekrosen (1965); HILGENFELD (1966); ITAKURA u. NIGI (1968); McKISSICK et al. (1968); WERNER et al. (1969); HESSLER et al. (1971); WONG u. KOZEK (1974); CHANG et al. (1980); ANDERSON u. McCLURE (1982); ISENBÜGEL (1983); BORST u. VAN KNAPEN (1984); DUBEY et al. (1985a); HARPER et al. (1985); CUNNINGHAM et al. (1992); DIETZ et al. (1997); INOUE (1997); PERTZ et al. (1997); BRACK et al. (1998); JUAN-SALLES et al. (1998); BOUER et al. (1999); EPIPHANIO et al. (1999a, 2000, 2001, 2003); WOHLSEIN et al. (1999); BACCIARINI et al. (2001b); FURUTA et al. (2001); SPENCER et al. (2004) Pneumonie 24 73 COWEN u. WOLF (1945); DE RODANICHE (1954b); BENIRSCHKE u. RICHART (1960); STOLZ (1962); UILENBERG u. RIBOT (1965); HILGENFELD (1966); ITAKURA u. NIGI (1968); McKISSICK et al. (1968); UILENBERG (1970); ANDERSON u. McCLURE (1982); BORST u. VAN KNAPEN (1984); DIETZ et al. (1997); INOUE (1997); PERTZ et al. (1997); BRACK et al. (1998); JUAN-SALLES et al. (1998); EPIPHANIO et al. (1999a, 2000, 2001, 2003); WOHLSEIN et al. (1999); BACCIARINI et al. (2001b); FURUTA et al. (2001); SPENCER et al. (2004) Lungenödem 21 64 DE RODANICHE (1954b); BENIRSCHKE u. RICHART (1960); HILGENFELD (1966); ITAKURA u. NIGI (1968); McKISSICK et al. (1968); WERNER et al. (1969); CHANG et al. (1980); ANDERSON u. McCLURE (1982); HARPER et al. (1985); CUNNINGHAM et al. (1992); DIETZ et al. (1997); INOUE (1997); BRACK et al. (1998); JUAN-SALLES et al. (1998); BOUER et al. (1999); EPIPHANIO et al. (1999a, 2000, 2001, 2003); WOHLSEIN et al. (1999); FURUTA et al. (2001) Lymphadenopathie 18 55 BENIRSCHKE u. RICHART (1960); ITAKURA u. NIGI (1968); McKISSICK et al. (1968); WERNER et al. (1969); ANDERSON u. McCLURE (1982); ISENBÜGEL (1983); DUBEY et al. (1985a); HARPER et al. (1985); CUNNINGHAM et al. (1992); BRACK et al. (1998); JUAN-SALLES et al. (1998); EPIPHANIO et al. (1999a, 2000, 2001, 2003); WOHLSEIN et al. (1999); BACCIARINI et al. (2001b); FURUTA et al. (2001) Enteritis 17 52 HILGENFELD (1966); UILENBERG u. RIBOT (1965); McKISSICK et al. (1968); WERNER et al. (1969); UILENBERG (1970); ISENBÜGEL (1983); HARPER et al. (1985); CUNNINGHAM et al. (1992); DIETZ et al. (1997); INOUE (1997); PERTZ et al. (1997); BRACK et al. (1998); JUAN-SALLES et al. (1998); EPIPHANIO et al. (1999a); BACCIARINI et al. (2001b); FURUTA et al. (2001); a , absolute Häufigkeit; b, relative Häufigkeit 58 2. Literaturübersicht Tab. 6: Häufigkeit von makroskopischen und mikroskopischen pathologischen Befunden bei akuten disseminierten Toxoplasmosen bei nicht humanen Primaten (Fortsetzung) Befund Auftreten in Referenz 33 Fallberichten Abs. H.a Rel. H.b (n) (%) Enteritis 17 52 SPENCER et al. (2004) Hepatitis 16 49 BENIRSCHKE u. RICHART (1960); STOLZ (1962); UILENBERG u. RIBOT (1965); HILGENFELD (1966); McKISSICK et al. (1968); CHANG et al. (1980); CUNNINGHAM et al. (1992); DIETZ et al. (1997); PERTZ et al. (1997); JUAN-SALLES et al. (1998); BOUER et al. (1999); EPIPHANIO et al. (1999a, 2000, 2001, 2003); BACCIARINI et al. (2001b) Splenomegalie 15 46 DE RODANICHE (1954b); McKISSICK et al. (1968); WERNER et al. (1969); UILENBERG (1970); WONG u. KOZEK (1974); ANDERSON u. McCLURE (1982); BORST u. VAN KNAPEN (1984); HARPER et al. (1985); DIETZ et al. (1997); BRACK et al. (1998); BOUER et al. (1999); WOHLSEIN et al. (1999); BACCIARINI et al. (2001b); FURUTA et al. (2001); EPIPHANIO et al. (2003) Myocarditis 14 42 COWEN u. WOLF (1945); STOLZ (1962); McKISSICK et al. (1968); HESSLER et al. (1971); WONG u. KOZEK (1974); ISENBÜGEL (1983); CUNNINGHAM et al. (1992); PERTZ et al. (1997); BRACK et al. (1998); JUAN-SALLES et al. (1998); WOHLSEIN et al. (1999); EPIPHANIO et al. (2000, 2003); BACCIARINI et al. (2001b) Splenitis 10 30 BENIRSCHKE u. RICHART (1960); STOLZ (1962); McKISSICK et al. (1968); CUNNINGHAM et al. (1992); PERTZ et al. (1997); EPIPHANIO et al. (1999a, 2000, 2001, 2003); SPENCER et al. (2004) Hydrothorax 9 27 DE RODANICHE (1954b); ITAKURA u. NIGI (1968); McKISSICK et al. (1968); WONG u. KOZEK (1974); HARPER (1985); BRACK et al. (1998); EPIPHANIO et al. (1999a, 2000, 2003) Nephritis 8 24 STOLZ (1962); McKISSICK et al. (1968); WONG u. KOZEK (1974); PERTZ et al. (1997); BOUER et al. (1999); EPIPHANIO et al. (2000, 2001, 2003) Ascites 7 21 ITAKURA u. NIGI (1968); WERNER et al. (1969); WONG u. KOZEK (1974); HARPER et al. (1985); BOUER et al. (1999); EPIPHANIO et al. (2000, 2003) Gastrointestinale Ulcerationen 7 21 HILGENFELD (1966); McKISSICK et al. (1968); CUNNINGHAM et al. (1992); JUAN-SALLES et al. (1998); EPIPHANIO et al. (2000, 2001, 2003) Enzephalitis 6 18 COWEN u. WOLF (1945); STOLZ (1962); BRACK et al. (1998); WOHLSEIN et al. (1999); BACCIARINI et al. (2001b); EPIPHANIO et al. (2003) a , absolute Häufigkeit; b, relative Häufigkeit 2. Literaturübersicht 59 Tab. 6: Häufigkeit von makroskopischen und mikroskopischen pathologischen Befunden bei akuten disseminierten Toxoplasmosen bei nicht humanen Primaten (Fortsetzung) Befund Auftreten in Referenz 33 Fallberichten Abs. H.a Rel. H.b (n) (%) Hepatomegalie 6 18 BORST u. VAN KNAPEN (1984); CUNNINGHAM et al. (1992); DIETZ et al. (1997); EPIPHANIO et al. (1999a, 2001, 2003) Ikterus 4 12 STOLZ (1962); UILENBERG (1970); BRACK et al. (1998); WOHLSEIN et al. (1999) Hydropericard 4 12 ITAKURA u. NIGI (1968); UILENBERG (1970); WONG u. KOZEK (1974); EPIPHANIO et al. 2003 Adrenalitis 3 9 JUAN-SALLES et al. (1998); EPIPHANIO et al. (2000, 2001) Pankreatitis 2 6 CHANG et al. (1980); EPIPHANIO et al. (2003) a b , absolute Häufigkeit; , relative Häufigkeit 2.5.7. Therapie Die meisten nicht humanen Primaten, die unter einer akuten Toxoplasmose litten, wurden zunächst unspezifisch entsprechend der gezeigten klinischen Symptome behandelt. Hierbei wurde häufig eine antibiotische Behandlung durchgeführt, wobei in der Regel Antibiotika mit einem breiten Wirkungsspektrum, z. B. Ampicillin, Tetracyclin oder Chloramphenicol verwendet wurden (DE RODANICHE 1954a; BENIRSCHKE u. RICHART 1960; STOLZ 1962; HESSLER et al. 1971; CHANG et al. 1980; ISENBÜGEL 1983; CUNNINGHAM et al. 1992; PERTZ et al. 1997; BACCIARINI et al. 2001a, b). Diese Therapie wurde durch die Gabe von Corticosteroiden oder Vitamin-B-Komplex-Präparaten ergänzt (STOLZ 1962; CHANG et al. 1980; ISENBÜGEL 1983; BACCIARINI et al. 2001a, b). Im Zusammenhang mit einem erhöhten Blutzuckerspiegel, hervorgerufen durch eine akute Pankreatitis, wurde von CHANG et al. (1980) der Einsatz von Insulin beschrieben. Einige der erkrankten Tiere wurden zudem subcutan oder intravenös mit Natriumchlorid- und Glucose- oder mit Ringer-Lösung infundiert (CUNNINGHAM et al. 1992; PERTZ et al. 1997; BACCIARINI et al. 2001a, b). Diese Behandlungsversuche führten jedoch nicht zu einer Genesung der Tiere. 60 2. Literaturübersicht Eine spezifische Therapie der Toxoplasmose bei nicht humanen Primaten wurde aus Ergebnissen von In-vitro-Studien mit Chemotherapeutika an Tachyzoiten und von Tierversuchen sowie aus Erfahrungen in der Humanmedizin abgeleitet (LEHNER 1984; HARPER et al. 1985; SWENSON 1993; referiert in SCHOONDERMARK-VAN DE VEN et al. 1995; CATAO-DIAS 2001). Die in der Literatur bevorzugt angegebenen Medikamente zur Therapie einer Toxoplasmose bei nicht humanen Primaten mit den entsprechenden Dosierungen sind in Tab. 7 aufgeführt. Von vielen Autoren wird eine Kombinationsbehandlung aus Pyrimethamin mit einem Sulfonamid, bevorzugt Sulfadiazin empfohlen (LEHNER 1984; BRACK 1987; WOLFF 1990, 1993; SWENSON 1993; HUBBARD 1995; BRACK et al. 1995a; GOZALO u. TANTALEAN 1996; JOHNSONDELANEY 1996; PARROTT 1997; CARPENTER et al. 2001; CATAO-DIAS 2001). Diese Behandlungsstrategie erwies sich auch experimentell bei der Therapie von infizierten Totenkopfäffchen als effektiv (HARPER et al. 1985). Zudem gelang es SCHOONDERMARKVAN DE VEN et al. (1995) auf diese Weise eine konnatale Toxoplasmose bei trächtigen Rhesusaffen zu verhindern. Die Muttertiere wurden zunächst intravenös mit Tachyzoiten infiziert. Unmittelbar nachdem der Parasit mit der PCR in der Amnionflüssigkeit nachgewiesen wurde, begann die Behandlung. Zehn bis dreizehn Tage nach Beginn der Therapie konnten keine Erreger mehr in der Amnionflüssigkeit nachgewiesen werden und auch die Gewebe der Jungtiere wiesen bei der Geburt keine Toxoplasmen auf. Obwohl in der Humanmedizin der Einsatz von Pyrimethamin und Sulfadiazin während einer Schwangerschaft auf Grund möglicher Missbildungen des Kindes als kontraindiziert gilt (SCHOONDERMARK-VAN DE VEN et al. 1995), wurden in dieser Studie keine toxischen Effekte der Substanzen festgestellt. Pyrimethamin und Sulfadiazin wirken synergistisch gegen das Tachyzoitenstadium von T. gondii, nicht jedoch gegen die enzystierten Bradyzoiten. Beide Wirkstoffe können die Blut-HirnSchranke sowie die Plazenta passieren (SCHOONDERMARK-VAN DE VEN et al. 1995). Da es sich bei den Medikamenten um Folsäureantagonisten handelt, ist die Behandlung nicht unumstritten. So kann es während der Therapie zu reversiblen Störungen der Hämatopoese kommen, so dass bei der Behandlung eine regelmäßige Kontrolle des Blutbildes sowie eine tägliche Applikation von Folsäure stattfinden sollte (LEHNER 1984; HUBBARD 1995; PARROTT 1997; CARPENTER et al. 2001; CATAO-DIAS 2001). 2. Literaturübersicht 61 Weitere für die Behandlung einer Toxoplasmose geeignete Chemotherapeutika sind Clindamycin und Spiramycin (BRACK 1987; WOLFF 1990, 1993; BRACK et al. 1995a; GOZALO u. TANTALEAN 1996; JOHNSON-DELANEY 1996). Während experimentell infizierte Totenkopfäffchen trotz einer Behandlung mit Spiramycin starben (CHANG u. PECHERE 1988), konnten SCHOONDERMARK-VAN DE VEN et al. (1994) in einer Studie mit Rhesusaffen die Wirksamkeit des Medikaments bei der Behandlung einer konnatalen Toxoplasmose nachweisen. Spiramycin musste dabei allerdings mindestens 3 Wochen verabreicht werden, um effektiv zu sein. Insgesamt führten spezifische Therapieversuche in der Vergangenheit selten zum Erfolg. Die alleinige Behandlung mit Clindamycin oder Sulfadiazin konnte die erkrankten Tiere nicht vor dem Verenden retten oder es kam nach Beendigung der Therapie zu einer Reaktivierung der Infektion (FRENKEL u. ESCAJADILLO 1987; ESCAJADILLO u. FRENKEL 1991; SPENCER et al. 2004). Auch Versuche von Kombinationsbehandlungen aus Sulfonamiden mit Trimethoprim oder Pyrimethamin scheiterten (DIETZ et al. 1997; BRACK et al. 1998). Hingegen beschrieb ISENBÜGEL (1983), dass durch die 16-tägige Gabe von MaderanR (Sulfadiazin und Pyrimethamin) als Kindersirup und dem zusätzlichen Einsatz von Vitaminpräparaten bei zwei schwer erkrankten Kattas eine Rekonvaleszenz erreicht werden konnte. Ein weiterer Therapieerfolg wurde von BRACK et al. (1995b) berichtet. Dabei konnte in einem Fall von massiven Verlusten bei Kattas und Totenkopfaffen eine Therapie mit Pyrimethamin und Sulfasalizin die verbliebenen Totenkopfaffen retten. Allerdings wurde nicht nachgewiesen, dass diese ebenfalls infiziert waren. Erwiesene Therapieerfolge wurden somit fast ausschließlich unter experimentellen Bedingungen erzielt. Das mag in erster Linie daran liegen, dass die wirksamen Chemotherapeutika frühzeitig und gezielt nach stattgefundener Infektion eingesetzt wurden. Der Einsatz von einem Sulfonamid in Kombination mit Trimethoprim oder Pyrimethamin zeigte sich bei der Behandlung am effektivsten (HARPER et al. 1985; SCHOONDERMARK-VAN DE VEN et al. 1995). Die Prognose ist bei akuten disseminierten Toxoplasmosen und spätem Behandlungsbeginn sehr ungünstig. Da keine geeignete Vakzine zur Verfügung steht, kommt der rechtzeitigen medikamentellen Behandlung der Toxoplasmose eine besondere Bedeutung zu (BACCIARINI et al. 2001b). Eine spezifische Therapie sollte bereits beim ersten Auftreten von klinischen Symptomen und schon im Verdachtsfall eingeleitet werden. Es wurden auch Überlegungen 62 2. Literaturübersicht angestellt, bei besonders gefährdeten oder wertvollen Tierbeständen eine regelmäßige Untersuchung der Antikörpertiter durchzuführen (WONG u. KOZEK 1974; WOOLF u. ANTHONEY 1982). Gegen die Gewebezysten von T. gondii, die die Gefahr einer Reaktivierung der Infektion bergen, gibt es zurzeit kein wirksames Medikament. Experimentell konnte eine Wirksamkeit von Hydroxynaphthoquinon nachgewiesen werden (referiert in CATAO-DIAS 2001). Tab.7: Medikamente und Dosierungen zur Therapie der Toxoplasmose bei nicht humanen Primaten Medikament Dosierung Clindamycin 12,5-25 mg/kg zweimal täglich p. o. über 4 Wochen Folsäure 0,04-0,2 mg/kg täglich p. o. während der Behandlung mit Pyrimethamin Pyrimethamin 2 mg/kg täglich p. o. über 3 Tage, dann 1 mg/kg täglich p. o. über 4 Wochen Für Menschenaffen liegt die maximale tägliche Dosis in den ersten 3 Tagen bei 100 mg und in den darauf folgenden 4 Wochen bei 25 mg. Spiramycin 150000-300000 I. E./kg p. o. Sulfadiazin 100 mg/kg täglich p. o. oder 25-50 mg/kg viermal täglich p. o. Für Menschenaffen liegt die maximale Dosis bei 6 g pro Behandlung. 2.6. Diagnostik von T.-gondii-Infektionen bei nicht humanen Primaten In diesem Kapitel werden das Prinzip sowie die Vor- und Nachteile der bislang verwendeten Testverfahren zur Diagnose von T.-gondii-Infektionen bei nicht humanen Primaten dargestellt. Die in epidemiologischen Studien verwendeten serologischen Methoden zum Nachweis von Antikörpern gegen T. gondii bei nicht experimentell infizierten nicht humanen Primaten wurden 2. Literaturübersicht 63 bereits im Kap. 2.5.2. mit den entsprechende Referenzen aufgeführt. Deshalb werden diese Referenzen an dieser Stelle nicht mehr erwähnt. 2.6.1. Indirekte Nachweismethoden 2.6.1.1. SFT Der Sabin-Feldman-Test (SFT) wurde in den späten 1940ern entwickelt (SABIN u. FELDMAN 1948). In der Humanmedizin erlangte dieses Verfahren insbesondere in der Diagnose von T.-gondiiInfektionen bei Schwangeren und Neugeborenen große Bedeutung. Trotz der Notwendigkeit von lebenden Tachyzoiten für dessen Durchführung ist er bis heute der Standardtest geblieben, an dem die Qualität anderer Testverfahren zur Diagnose einer T.-gondii-Infektion gemessen wird (ASHBURN 1992). Im SFT werden IgG1-, IgG3- und IgM-Antikörper gegen T. gondii erfasst (GROSS et al. 2004). Das Testprinzip beruht auf der Tatsache, dass sich vitale T.-gondiiTachyzoiten mit Methylenblau intensiv blau anfärben lassen, während die Parasiten in Anwesenheit spezifischer Antikörper nahezu ungefärbt bleiben. Als Voraussetzung für diese Änderung der Anfärbbarkeit wird ein humanes Serum als Aktivator (accessory factor) benötigt. Der Aktivator ist nach neueren Untersuchungen mit dem Komplement identisch. Das Testserum wird zunächst hitzeinaktiviert, um körpereigenes Komplement zu zerstören. Anschließend erfolgt nach Zusatz des Aktivatorserums eine Inkubation des Untersuchungsgutes mit lebenden Tachyzoiten bei 37 °C. Sind Antikörper gegen T. gondii im Testserum vorhanden, findet eine komplementvermittelte Zytolyse der Tachyzoiten statt und diese lassen sich durch die anschließend zugesetzte basische Methylenblaulösung nicht mehr anfärben (positive Reaktion). Ist das Testserum frei von spezifischen Antikörpern, findet keine Zytolyse statt und der Farbstoff wird in die Zellen eingeschleust, die dadurch eine tiefblaue Färbung (negative Reaktion) annehmen (BUNDESGESUNDHEITSBLATT 1989). Der SFT besitzt für die Untersuchung von humanen Seren eine sehr hohe Sensitivität und Spezifität. Unspezifische Reaktionen sind bei Humanseren selten. Da mit dem SFT auch sehr niedrige Antikörpertiter erfasst werden, ist der Test sowohl für die Untersuchung von akuten als auch von latenten T.-gondii-Infektionen geeignet. Nachteile des SFTs sind, dass er nicht automatisierbar ist 64 2. Literaturübersicht und dass immer frisch infizierte Versuchstiere als Quelle vitaler Tachyzoiten benötigt werden. Die Durchführung erfolgt daher nur noch in sehr wenigen Speziallaboren. Bei den nicht humanen Primaten wurde der Test in der Vergangenheit häufig genutzt (siehe Kap. 2.5.2.), ist aber in neuerer Zeit durch modernere Methoden wie IFAT, MAT und ELISA abgelöst worden. 2.6.1.2. IFAT Für den indirekten Immunfluoreszenzantikörpertest (IFAT) werden intakte T.-gondii-Tachyzoiten auf einem festen Träger (z. B. einem Objektträger) fixiert. Anschließend erfolgt eine Überschichtung des fixierten Antigens mit dem Testserum, das in verschiedenen Verdünnungsstufen auf markierten Flächen des Objektträgers aufgetragen wird. Im Serum vorhandene Antikörper gegen T. gondii lagern sich an die Zelloberfläche der Tachyzoiten und werden anschließend mit fluoreszeinmarkierten Sekundärantikörpern (Konjugat) nachgewiesen. Die zweiten Antikörper sind gegen bestimmte Immunglobuline der zu untersuchenden Tierart gerichtet. Die Auswertung erfolgt unter UV-Licht mit einem Fluoreszenzmikroskop. Als positives Ergebnis wird eine helle, ununterbrochene periphere Fluoreszenz des Parasiten gewertet. Die alleinige Fluoreszenz des apikalen Teils der Tachyzoiten (Polfluoreszenz) wird hingegen als unspezifische Reaktion beurteilt und durch eine Infektion mit anderen kreuzreagierenden apikomplexen Arten verursacht. Die mit dem IFAT messbaren Titer nehmen einen ähnlichen Verlauf wie durch den SFT bestimmte Titer (CARMICHAEL 1975). Im IFAT ist der Nachweis verschiedener Immunglobulinisotypen durch die Verwendung eines klassenspezifischen Konjugates (z. B. anti-IgG oder anti-IgM) möglich. Dadurch kann der IFAT für eine Bestimmung des Infektionszeitpunktes eingesetzt werden und eignet sich sowohl für den Nachweis von akuten als auch von latenten Infektionen. Die verschiedenen Immunglobulinisotypen werden nach einer Infektion unterschiedlich schnell gebildet und sind verschieden lange im Serum nachweisbar. In einer von ARAUJO et al. (1973) durchgeführten Studie wurden acht Bärenmakaken entweder subcutan oder intravenös mit T.-gondii-Tachyzoiten oder oral mit Gewebezysten infiziert. Bei fünf Tieren wurden im IFAT bereits nach einer Woche IgM-Antikörper 2. Literaturübersicht 65 gegen T. gondii ermittelt, nach zwei Wochen wiesen sieben Tiere einen spezifischen IgMAntikörpertiter auf. Nachteile des IFATs bestehen in der subjektiven Auswertung des Tests, für die ein geschultes Personal notwendig ist, sowie in der Zeitaufwendigkeit und einer möglichen Kreuzreaktion mit eng verwandten Apicomplexa. 2.6.1.3. Agglutinationstests Zu den bei nicht humanen Primaten verwendeten Agglutinationstests zählen der direkte Agglutinationstest (DAT), der indirekte Hämagglutinationstest (IHAT) sowie der LatexAgglutinationstest (LAT). Der DAT zum Nachweis von T.-gondii-Infektionen wurde erstmals von FULTON u. TURK (1959) beschrieben und durch DESMONTS u. REMINGTON (1980) modifiziert. Das Testprinzip beruht darauf, dass intakte, formalinbehandelte Tachyzoiten in der Gegenwart von spezifischen Antikörpern agglutinieren. Diese Agglutination wird durch den Zusatz von Farbstoffen sichtbar gemacht. Im DAT werden nur IgG-Antikörper gegen T. gondii detektiert, weil spezifische und unspezifische IgM-Antikörper durch den Zusatz von Mercapthoethanol zerstört werden. Bei dem in Mikrotiterplatten durchgeführten Test bildet sich bei Anwesenheit von spezifischen Antikörpern im Testserum durch Bindung der Antikörper an die Tachyzoiten ein Schleier, der den gesamten Boden der Plattenvertiefung bedeckt (positive Reaktion). Enthält das Testserum keine Antikörper gegen T. gondii, sinken die Tachyzoiten unvernetzt zu Boden und bilden am tiefsten Punkt der Vertiefung einen knopfförmigen Bodensatz (negative Reaktion). Der Test ist einfach durchführbar, besitzt eine hohe Sensitivität und Spezifität und ergibt bei Menschen und Tieren dem SFT vergleichbare Titer (referiert in CARME et al. 2002). Der DAT ist aber kommerziell nur schwer erhältlich. Der IHAT zum Nachweis von T.-gondii-Infektionen wurde erstmals von JACOBS u. LUNDE (1957) beschrieben. Bei diesem Test wird aus Tachyzoiten gewonnenes lösliches Antigen an Tannin-behandelte Erythrozyten gekoppelt und anschließend mit Glutaraldehyd stabilisiert. Sind in dem Testserum spezifische Antikörper gegen T. gondii enthalten, kommt es zu einer Agglutination 66 2. Literaturübersicht (positive Reaktion). Der Test ist zwar einfach durchzuführen und nicht speziesspezifisch, jedoch auch sehr störanfällig und die Ergebnisse sind schwer reproduzierbar (CARUANA 1980). Agglutinierende Antikörper treten nach einer Infektion später im Serum auf, als die im SFT nachweisbaren Antikörper. Das Testverfahren ist daher bei frischen Infektionen oft noch negativ (REMINGTON u. DESMONTS 1983). In der veterinärmedizinischen Labordiagnostik werden IHAT-Titer unter 1:128 als unspezifische Reaktionen gewertet (DUBEY et al. 1985b). Beim LAT wird aus T.-gondii-Tachyzoiten gewonnenes lösliches Antigen an Latex-Partikel gekoppelt. Sind im Testserum Antikörper gegen T. gondii enthalten, kommt es zu einer Agglutination der antigenbeschichteten Partikel. Dieser Test lässt sich einfach und zuverlässig mit dem Serum von Menschen und Tieren durchführen. Es ergeben sich dabei mit dem SFT vergleichbare Titer (BALFOUR et al. 1982). Ein Nachteil des LATs ist, dass durch IgM-Antikörper zu einem geringen Prozentsatz unspezifische (und somit falsch positive) Ergebnisse ausgelöst werden können (HOLLIMAN et al. 1989). 2.6.1.4. KBR Die Komplementbindungsreaktion (KBR) zum Nachweis von T.-gondii-Infektionen wurde erstmals von WARREN u. SABIN (1942) beschrieben. In der KBR wird eine definierte Menge Komplement mit einer Mischung aus Antigen und Testserum inkubiert. Sind in dem Testserum Antikörper gegen T. gondii enthalten, bildet sich ein Antigen-Antikörper-Komplex, an den sich das Komplement bindet. Enthält das Testserum keine spezifischen Antikörper, so bleibt das zugefügte Komplement frei in Lösung und verursacht bei einem dem Testansatz zugefügten Indikatorsystem, das Erythrozyten einer anderen Tierart enthält, eine Lysis der roten Blutkörperchen (negative Reaktion). Bei Anwesenheit von spezifischen Antikörpern im Testserum bleibt diese Hämolyse aus (positive Reaktion). Da in der KBR latente Infektionen nicht erfasst werden dient dieser Test in der Humanmedizin nur als ergänzende Methode. So gibt ein positives Ergebnis in der KBR zusammen mit den Ergebnissen aus IFAT oder SFT einen Hinweis auf das Vorliegen einer akuten T.-gondii-Infektion 2. Literaturübersicht 67 (BUNDESGESUNDHEITSBLATT 1989). Bei nicht humanen Primaten wurde die KBR entweder allein oder in Kombination mit dem SFT und/oder dem IFAT eingesetzt (siehe Kap. 2.5.2.). Da das Testverfahren sehr aufwendig ist, praktisch keine standardisierten Antigene und Reagentien erhältlich sind und der Test an jede Spezies neu angepasst werden muss, wird die KBR heute kaum noch eingesetzt. Stattdessen erfolgt heute der Nachweis spezifischer IgM-Antikörper (z. B. im IFAT oder ELISA). 2.6.1.5. ELISA Der Enzyme-linked Immunosorbent Assay (ELISA) wurde Anfang der 1970er Jahre entwickelt. In diesem Test können spezifische Antikörper oder Antigene nachgewiesen werden. Zum Nachweis von Antikörpern gegen T. gondii wird aus Tachyzoiten gewonnenes lösliches Antigen an einen festen Träger, z. B. an die Vertiefungen einer Mikrotiterplatte, gebunden und mit dem Testserum überschichtet. Sind spezifische Antikörper gegen T. gondii im Serum vorhanden, binden diese an das Antigen. Die übrigen, ungebundenen Antikörper werden durch nachfolgende Waschschritte entfernt. Der Nachweis der spezifischen Antikörper erfolgt durch die Zugabe eines enzymmarkierten Sekundärantikörpers. Das Konjugat bindet sich an den Antigen-AntikörperKomplex und das daran gekoppelte Enzym kann ein anschließend hinzugefügtes Substrat umsetzen, wobei eine Farbreaktion stattfindet. Die Enzym-Substrat-Reaktion wird nach einer bestimmten Zeit abgestoppt und das Ergebnis durch eine photometrische Messung quantitativ bestimmt. Dabei wird die Absorption oder die optische Dichte gemessen. Durch die Verwendung eines klassenspezifischen Konjugates eignet sich der ELISA sowohl für den Nachweis von akuten als auch von latenten T.-gondii-Infektionen. Zudem wird eine quantitative Bestimmung durch die Festlegung von Titern ermöglicht. Gegenüber dem IFAT besitzt er den Vorteil, dass die Erfassung der Ergebnisse objektiv geschieht. Der ELISA lässt sich leicht automatisieren und ist daher für Screening-Untersuchungen mit großen Probenzahlen geeignet. 68 2. Literaturübersicht 2.6.1.6. Immunoblot Für den Nachweis von Antikörpern gegen T. gondii im Immunoblot erfolgt zunächst mit Hilfe des stark ionischen Detergens Natriumdodecylsulfat (SDS) eine Auftrennung von löslichem Tachyzoiten-Antigen in der Polyacrylamidgel-Elektrophorese (PAGE). Die aufgetrennten Proteine werden anschließend elektrophoretisch auf eine Trägermembran übertragen und mit dem Testserum inkubiert. Sind spezifische Antikörper im Testserum enthalten, binden diese an die Antigenproteine und werden anschließend mit einem enzymmarkierten Konjugat nachgewiesen. Nachteile dieser Methode sind, dass nur der qualitative Nachweis der Infektion erfolgen kann somit keine Titerbestimmung möglich ist. Zudem ist für die Auswertung ein geschultes Personal notwendig. In einer von FURUTA et al. (2001) durchgeführten Studie wurde ein Immunoblot für den Nachweis von Antikörpern gegen T. gondii bei experimentell infizierten Totenkopfaffen benutzt. 2.6.2. Sonstige Nachweismethoden 2.6.2.1. Mikroskopischer und immunhistologischer Nachweis im Gewebe Lichtmikroskopisch können in histologischen Schnitten Gewebezysten von T. gondii nachgewiesen werden. Die Zysten liegen meist reaktionslos im Gewebe und finden sich in erster Linie im Gehirn aber auch in anderen Wirtsorganen (siehe Kap. 2.5.6.). Tachyzoiten von T. gondii befallen viele unterschiedliche Wirtszelltypen (siehe Kap. 2.5.6.). In einer Studie von EPIPHANIO et al. (2003) an verschiedenen Neuweltaffenspezies wurden mittels Transmissionselektronenmikroskopie Tachyzoiten von T. gondii u. a. in Endothelzellen, Makrophagen, Fibroblasten, Pneumozyten Typ I und II sowie in Erythrozyten nachgewiesen. Mit Hilfe von spezifischen Konjugaten kann der immunhistologische Nachweis des Parasiten erfolgen. WOHLSEIN et al. (1999) wiesen den Erreger in Organen von Kattas, Totenkopfaffen und Lisztaffen mit einem polyklonalen Antikörper gegen T. gondii aus dem Kaninchen als Primärantikörper sowie einem biotingekoppelten anti-Kaninchen-Konjugat aus der Ziege in einem Avidin-Biotin-Peroxidasekomplex-System nach. Für die immunhistologische Antigendarstellung 2. Literaturübersicht 69 wurde Diaminobenzidin-tetrahydrochlorid (DAB) als Chromogen verwendet und so die PeroxidaseAktivität sichtbar gemacht. Nachteilig an der mikroskopischen und immunhistologischen Untersuchung ist der hohe Zeitaufwand bei der Aufarbeitung und Untersuchung der Proben. Zudem ist die Wahrscheinlichkeit, dass man bei der Anfertigung eines histologischen Schnittes durch einen Gewebebezirk schneidet, der Parasitenmaterial enthält, nur gering. 2.6.2.2. PCR Die PCR (Polymerasekettenreaktion) ist eine molekularbiologische Methode, bei der aus der genomischen DNA von T. gondii definierte Stücke vervielfältigt werden. Nach Extraktion der DNA aus dem Organmaterial des zu untersuchenden Tieres erfolgt ein Zyklus mit schnellem Wechsel von verschiedenen Temperaturen. Nacheinander wird ein Schmelzen der doppelsträngigen DNA bei ca. 94 °C, die Anlagerung der Primer bei ca. 45-50 °C und die Primerextension bei ca. 72 °C in mehreren Zyklen wiederholt. Bei jedem Zyklus wird das von den Primern flankierte DNA-Stück verdoppelt. Die PCR-Produkte (Amplifikate) werden anschließend z. B. in der Elektrophorese in einem Agarosegel mit Hilfe eines Farbstoffs sichtbar gemacht. Für den Nachweis von T.-gondii-DNA bei Kattas, Totenkopfaffen und Lisztaffen wurde in einer von WOHLSEIN et al. (1999) durchgeführten Studie das B1-Genfragment mit Hilfe der Primer oligo 1 und oligo 4 amplifiziert. Es wurden dabei verschiedene formalinfixierte Organe der Tiere untersucht und dabei jeweils eine spezifische Bande mit 194 Basenpaaren nachgewiesen. Bei der von FURUTA et al. (2001) durchgeführten PCR wurde das NTPase-Gen von T. gondii amplifiziert. Hier erfolgte der Nachweis des Parasiten in Leber und Lunge von experimentell infizierten Totenkopfaffen. 70 2. Literaturübersicht 2.6.2.3. Biologische Verfahren Der Nachweis von T. gondii kann auch durch die Inokulation von Probenmaterial in Labortiere wie beispielsweise Mäuse durchgeführt werden. Als Proben können Sekrete, Exkrete, Körperflüssigkeiten und Gewebeproben dienen. Inokulierte Mäuse bilden nach der Infektion mit T.gondii-haltigem Probenmaterial spezifische Antikörper, die ca. 3 Wochen post infectionem serologisch nachgewiesen werden können. SCHOONDERMARK-VAN DE VEN et al. (1993) nutzten bei ihrer an experimentell infizierten trächtigen Rhesusaffen durchgeführten Studie diese Methode für den Nachweis einer vertikalen Infektion mit T. gondii, indem sie Amnionflüssigkeit intraperitoneal in Mäuse inokulierten (siehe Kap 2.5.3.). 3. Material und Methoden 71 3. MATERIAL UND METHODEN 3.1. Material 3.1.1. Geräte und Verbrauchsmaterialien Angaben zu Geräten und Verbrauchsmaterialien finden sich bei ihrer ersten Erwähnung im Text oder in Form einer Fußnote. 3.1.2. Reagenzien und Lösungen Alle verwendeten Chemikalien und Reagenzien sind bei ihrer ersten Erwähnung im Text mit einem Stern (*) gekennzeichnet und im Anhang 9.1. alphabetisch aufgeführt. Lösungen sind bei ihrer ersten Erwähnung im Text unterstrichen. Alle verwendeten Lösungen sowie deren Zusammensetzungen sind im Anhang 9.2. alphabetisch aufgeführt. 3.1.3. Seren von nicht humanen Primaten Die Blutentnahmen bei den nicht humanen Primaten erfolgten im Rahmen diagnostischer Maßnahmen zur Bestimmung T.-gondii-infizierter Tiere. Die Tab. 8 zeigt eine Übersicht über Anzahl, Tierart, laufende Nummer und Herkunft der im IgG-ELISA untersuchten Tiere. Bei den aus dem Serengeti-Park Hodenhagen stammenden Weißkopfmakis, Kattas und Totenkopfaffen wurden zur Feststellung einer eventuell stattfindenden Serokonversion sowie zur Untersuchung der Antikörperdynamik während des Aufenthaltes im Freigehege Verlaufsblutproben entnommen. Insgesamt fanden bei diesen Tieren von März bis Dezember 2004 bis zu vier Blutentnahmen statt. Im März und Dezember befanden sich die Tiere dabei im Winterquartier, während sie sich bei den Untersuchungsterminen im Mai und Juni in unterschiedlichen Freigehegen befanden. Diese Freigehege waren so angelegt, dass die Besucher des Parks durch sie 72 3. Material und Methoden hindurchlaufen konnten. Bei den Weißkopfmakis bildeten bei der Erstuntersuchung die Tiere H1H4, H5-H10, H21-H23 und H26 sowie H31-H33 jeweils eine Gruppe. Der Weißkopfmaki H32 musste auf Grund von Rangordnungskämpfen im Mai von seiner Gruppe getrennt werden und wurde schließlich im Herbst 2004 an eine Privatperson abgegeben. Ansonsten gab es unter den Weißkopfmakis hinsichtlich der Gruppenzusammensetzung während des gesamten Untersuchungszeitraums keine Veränderungen. Bei H1, H2, H6, H7, H10, H21 und H26 handelte es sich um männliche und bei H3-H5, H8, H9, H22, H23 sowie H31-H33 um weibliche Tiere. Der Weißkopfmaki H35 war ein Jungtier von H8 und H36 ein Jungtier von H9. Beide Nachkommen wurden im Juni 2004 geboren, eine Geschlechtbestimmung wurde bei den Tieren innerhalb des Untersuchungszeitraumes nicht durchgeführt. Das geschätzte Zahnalter der Weißkopfmakis H2, H3, H5, H7-9, H23 und H31 lag bei der Erstuntersuchung zwischen 2 und 3 Jahren. Das Alter der Tiere H1, H4, H10, H21 und H33 wurde auf 4 bis 6 Jahre und das der Tiere H6, H22, H26 und H32 auf 8 bis 10 Jahre geschätzt. Bei den aus dem Serengeti-Park Hodenhagen stammenden Totenkopfaffen bildeten bei der Erstuntersuchung die Tiere H11 und H12, H13-H20 sowie H27-H30 jeweils eine Gruppe. Zwischen Mai und Juni 2004 wurden die Tiere H11 und H12 sowie H27-H30 zu einer Gruppe zusammengefügt. Bei H18 und H29 handelte es sich um männliche, bei den übrigen Nummern um weibliche Tiere. Das geschätzte Zahnalter der Totenkopfaffen H11, H12, H18 und H28 lag bei der Erstuntersuchung zwischen 3 und 4 Jahren. Das Alter der Tiere H13, H16, H17, H19, H27, H29 und H30 wurde auf 6 bis 8 Jahre und das der Tiere H14, H15 und H20 auf über 10 Jahre geschätzt. Bei den aus Hodenhagen stammenden Kattas handelte es sich bei H24 um ein weibliches und bei H25 um ein männliches Tier. Beide wurden auf ein Alter zwischen 3 und 4 Jahren geschätzt und wurden zusammen mit den Weißkopfmakis H21-H23 und H26 in einer Gruppe gehalten. Bei allen übrigen nicht humanen Primaten fand nur eine Blutentnahme statt. Die Proben wurden in der Zeit zwischen Juni 2004 und Juli 2005 gewonnen. Bei den aus dem Deutschen Primatenzentrum stammenden Rhesusaffen wurden die Blutproben im Rahmen einer routinemäßigen Untersuchung auf Tuberkulose entnommen und das Serum anschließend für die Untersuchung im ELISA zur Verfügung gestellt. Alle untersuchten Tiere hatten Zugang zu einem Freigehege, welches für Besucher nicht zugänglich war. Bei den Rhesusaffen stammten die Tiere aus unterschiedlichen 3. Material und Methoden 73 Zuchtkolonien, deren Zusammensetzung nicht statisch war, sondern sich in unregelmäßigen Abständen änderte. Ansonsten wurden Tiere derselben Spezies innerhalb einer Gruppe gehalten. Bei dem aus dem Tier- und Freizeitpark Jaderberg stammenden Totenkopfaffen J4 sowie dem Katta J9 handelte es sich um weibliche Tiere, die übrigen Kattas, Totenkopfaffen sowie der Weißbüschelaffe waren männliche Tiere. Das Alter ist nicht bekannt. Bei dem aus dem Arche Noah Zoo Braunschweig stammenden Katta B1 handelte es sich um ein 6 Jahre altes männliches, bei dem Katta B2 um ein 9 Jahre altes weibliches Tier. Bei den Totenkopfaffen handelte es sich bei B7 um ein männliches und bei B3-B6 um weibliche Tiere. Das Männchen war zum Untersuchungszeitpunkt 14, B4-B6 waren 6 und B3 2 Jahre alt. Bei den verschiedenen Neuweltaffenspezies aus dem Zoologischen Garten Magdeburg handelte es sich bei M7 und M9 um weibliche, bei den übrigen Nummern um männliche Tiere. Die Tiere M2 und M1 waren 15 bzw. 17 Jahre alt, bei M3, M4 und M7 lag das Alter zwischen 8 und 9 und bei M5, M6, M8 und M9 zwischen 1 und 4 Jahren. Bei den Rhesusaffen aus dem Deutschen Primatenzentrum handelt es sich bei R1, R7, R11, R12 und R18 um männliche und bei R2-R6, R8-R10, R13-R17 und R19 um weibliche Tiere. Das Alter der Rhesusaffen R1, R8, R12, R15, R16, R17 und R19 lag zum Untersuchungszeitpunkt zwischen 1 und 2 Jahren, das von R4, R7, R11, R14 und R18 zwischen 3 und 4 Jahren; R3, R9, R10 und R13 waren 6 bis 8 Jahre und R2, R5 und R6 waren 13 bis 15 Jahre alt. Die Tiere R2, R3, R5, R6, R9 und R10 stammten aus dem Centre de Primatologie in Straßburg und befanden sich seit 1998 im Deutschen Primatenzentrum. Alle übrigen Rhesusaffen wurden im Deutschen Primatenzentrum geboren. Die drei ältesten Totenkopfaffen aus dem Serengeti-Park Hodenhagen waren Wildfänge aus Guayana, alle übrigen der untersuchten nicht humanen Primaten wurden in Gefangenschaft geboren. 74 3. Material und Methoden Tab. 8: Übersicht über die im IgG-ELISA untersuchten nicht humanen Primaten Tierart Anzahl laufende der Tiere Nummer (n) Herkunft der Tiere Weißkopfmaki 19 H1-H10, H21-H23, H26, Serengeti-Park Hodenhagen H31-H33, H35, H36 Katta 2 2 3 H24, H25 B1, B2 J7-J9 Serengeti-Park Hodenhagen Arche Noah Zoo Braunschweig Tier- und Freizeitpark Jaderberg Totenkopfaffe 14 5 5 H11-H20, H27-H30 J1-J5 B3-B7 Serengeti-Park Hodenhagen Tier- und Freizeitpark Jaderberg Arche Noah Zoo Braunschweig Weißbüschelaffe 1 1 J10 M9 Tier- und Freizeitpark Jaderberg Zoologischer Garten Magdeburg Schwarzer Löwenaffe 2 M3, M4 Zoologischer Garten Magdeburg Braunrücken-Tamarin 1 M1 Zoologischer Garten Magdeburg Goldkopflöwenaffe 1 M2 Zoologischer Garten Magdeburg Rothand-Tamarin 2 M5, M6 Zoologischer Garten Magdeburg Schwarzpinselaffe 2 M7, M8 Zoologischer Garten Magdeburg Rhesusaffe 19 R1-R19 Deutsches Primatenzentrum 3.1.4. Toxoplasma gondii Die zur Antigengewinnung verwendeten Tachyzoiten des T.-gondii-Stammes BK wurden freundlicherweise von Frau Dr. Ingrid Reiter-Owona vom Institut für Medizinische Mikrobiologie, Immunologie und Parasitologie der Rheinischen Friedrich-Wilhelms-Universität in Bonn zur Verfügung gestellt. Der Stamm wurde in Mäusen1 durch die intraperitoneale (i. p.) Injektion einer Tachyzoitensuspension in einem zweitägigen Rhythmus passagiert. 1 Stamm NMRI 3. Material und Methoden 75 3.1.5. Mäuse Für die Herstellung des ELISA-Antigens wurden 12 Wochen alte weibliche Mäuse2 aus einer spezifisch-pathogenfreien Zucht3 verwendet. Die Mäuse wurden in Gruppen von fünf bis zehn Tieren in Makrolonkäfigen Typ II auf Weichholzgranulat für Labortiere4 gehalten. Die Käfige und das Zubehör wurden in wöchentlichem Abstand gereinigt. Wasser und pelletiertes Fertigfutter5 stand den Tieren ad libitum zur Verfügung. Die Unterbringung der Tiere erfolgte in einem ausschließlich für diesen Zweck bestimmten separaten Raum. 3.2. Methoden 3.2.1. Serumgewinnung und -lagerung Die Blutentnahme bei den nicht humanen Primaten (siehe Kap. 3.1.3.) erfolgte aus der Vena femoralis unter Sedation6. Bei den Weißkopfmakis, den Kattas und den Rhesusaffen wurde jeweils eine Blutprobe von etwa 3-4 ml unter Verwendung von 0,8 mm Kanülen7 sowie 4,5 ml Vacutainern8 entnommen. Bei den Neuweltaffen wurden 1-ml-Spritzen9 sowie 0,5 mm Kanülen verwendet und eine Blutprobe von 1-2 ml gewonnen. Diese wurde in 1,5-ml-Reaktionsgefäße überführt. Nach einer Gerinnungszeit von 8 bis 24 Stunden bei Raumtemperatur wurde das Blut für 10 Minuten bei 700 g (Vacutainer) oder 6000 g (1,5-ml-Reaktionsgefäße) zentrifugiert10 2 Stamm NMRI 3 HARLAN-WINKELMANN, Borchen 4 ALTROMIN, Lage 5 ALTROMIN, Lage 6 Ursotamin -Injektionslösung, 5-20 mg/kg Kgw i. m., SERUMWERK, Bernburg ® Valium 10 Roche, 0,1-0,25 mg/kg Kgw i. m., HOFFMANN-LA ROCHE, Grenzach-Whylen 7 Kanülen für Vacuetten, WDT, Garbsen 8 Vacuetten zur Serumgewinnung, WDT, Garbsen 9 1-ml-Tb-Spritze ERSTA mit Silikon-Kolbenring, WDT, Garbsen ® ® 10 Labofuge 6000, HERAEUS, Osterode 11 Biofuge A, HERAEUS, Osterode 11 . Das 76 3. Material und Methoden Serum wurde abpipettiert und in Portionen zu maximal 0,5 ml bis zur weiteren Verwendung bei –20 °C eingefroren. 3.2.2. SFT Der SFT wurde dankenswerterweise von Frau Dr. Ingrid Reiter-Owona am Institut für Medizinische Mikrobiologie, Immunologie und Parasitologie der Rheinischen Friedrich-WilhelmsUniversität in Bonn durchgeführt. Da die Ergebnisse dieses Tests Voraussetzungen für einen Teil der eigenen Untersuchungen waren, werden die zugehörigen Ergebnisse unter Material und Methoden dargestellt (siehe Kap. 3.2.2.5.). 3.2.2.1. Untersuchungsgut Insgesamt wurden die Seren von 51 nicht humanen Primaten im SFT auf Antikörper gegen T. gondii getestet. Es wurden alle in Tab. 1 (Kap. 3.1.3.) aufgeführten Weißkopfmakis, Totenkopfaffen, Kattas sowie der Weißbüschelaffe J10 untersucht. Von den aus dem Serengeti-Park Hodenhagen stammenden Weißkopfmakis und Totenkopfaffen wurden bis zu drei Serumproben untersucht, die den Tieren an unterschiedlichen Zeitpunkten entnommen wurden (siehe Kap. 3.1.3.). Alle Seren wurden vor Durchführung des Tests für 60 Minuten bei 56 °C hitzeinaktiviert. 3.2.2.2. Antigengewinnung für den SFT Zur Gewinnung des T.-gondii-Antigens wurden Mäuse12 mit etwa 2,5 x 106 Tachyzoiten13 in max. 0,3 ml steriler physiologischer Kochsalzlösung i. p. infiziert. Etwa 48 Stunden p. i. wurde aus der Bauchhöhle der getöteten Tiere durch Spülung mit ca. 2 ml PBS das Exsudat gewonnen. Anschließend wurde jedes einzelne Exsudat mikroskopisch auf seinen Gehalt an Tachyzoiten und 12 Stamm NMRI, ca. 10 Wochen alt 13 T.-gondii-Stamm BK 3. Material und Methoden 77 auf eventuelle Verunreinigungen hin kontrolliert. Das gesammelte Exsudat enthielt ca. 20 x 106 Tachyzoiten pro ml. 3.2.2.3. Aktivatorserum Das Aktivatorserum stammte von einer T.-gondii-negativen Person, deren Serum zuvor im SFT auf seine lytischen Eigenschaften hin getestet worden war. In vorangegangenen Tests wurde sichergestellt, dass das Serum keine falsch positiven Reaktionen verursachte. 3.2.2.4. Testdurchführung 3.2.2.4.1. Vorversuch In einem Vorversuch mit einem bekannt positiven (Standardserum) und einem bekannt negativen humanen Serum wurde kontrolliert, ob mit dem gewonnenen Exsudat der vorgeschriebene Endtiter von 1:4000 erreicht wurde und das negative Serum keine Zytolyse induzierte. Bei diesem Ansatz wurde das Exsudat einmal unverdünnt und einmal in einer Verdünnung von 1:2 ausgetestet. Die Durchführung erfolgte in Mikrotiterplatten. Vorlegen der Kontrollseren: In die Reihen 1 und 2 sowie 3 und 4 wurden in die erste Vertiefung (A) je 50 µl positives bzw. negatives Kontrollserum vorgelegt. In die Vertiefungen B-H wurden zuerst je 25 µl PBS pipettiert, danach je 50 µl Aktivator eingefüllt. Die Serumverdünnung erfolgte von Reihe A-H mit jeweils 25 µl. Nach der Serumverdünnung gab man 50 µl Aktivator in Reihe A hinzu. Abschließend wurde in jede Vertiefung 25 µl T.-gondii-Exsudat unverdünnt (Reihe 1 und 3) oder 1:2 verdünnt (Reihe 2 und 4) pipettiert. 78 3. Material und Methoden Bei jedem Testansatz wurde eine Aktivator-Exsudat-Kontrolle mitgeführt, die 25 µl PBS anstelle von Serum enthielt. Die Mikrotiterplatte wurde mit Klebefolie14 verschlossen, kurz auf den Rüttler15 gestellt und danach für 30 Minuten in einem 37 °C warmen Wasserbad inkubiert. Als Indikator wurden dann in jede Vertiefung ca. 25 µl der gebrauchsfertigen Methylenblaulösung eingetropft. Nach kurzer Einwirkungszeit und Mischen mittels einer Pasteurpipette wurde pro Serumverdünnungsstufe je ein Tropfen der Suspension (ca. 10 µl) auf einen Objektträger gebracht und mikroskopisch16 ausgewertet (Objektiv 40x). Als positiv galt die Serumverdünnungsstufe, bei der die Anzahl der ungefärbten Tachyzoiten mehr als 50 % betrug. Für den Hauptversuch wurde diejenige Exsudat-Verdünnung ausgewählt, mit der das Standardserum den vorgeschriebenen Endtiter von 1:4000 erreichte. 3.2.2.4.2. Hauptversuch Der Hauptversuch entsprach im Wesentlichen dem Vorversuch. Neben dem Standardserum wurden jeweils 50 µl der unverdünnten Affenseren in Reihe A pipettiert. Von dort wurden 4-er Verdünnungsreihen (1:4, 1:16, 1:64, 1:256, 1:1024, 1:4096) hergestellt. Bei jedem Testansatz wurden eine Aktivator-Exsudat-Kontolle, welche 25 µl PBS anstelle des Serums enthielt, sowie das Standardserum mitgeführt. 3.2.2.4.3. Auswertung Wie bereits im Vorversuch beschrieben wurde bei der anschließenden mikroskopischen Auswertung des Versuchs von jeder Serumverdünnung ca. 10 µl gefärbte Suspension auf einen Objektträger gebracht. Es wurden dabei mehrere Gesichtsfelder durchgemustert (Objektiv 40x) und das Verhältnis von gefärbten zu ungefärbten Tachyzoiten ermittelt. Die negative (Antigen14 Plate Sealing Tape, ICN BIOMEDICALS INC., Kalifornien (USA) 15 MS 1 Minishaker, IKA-WORKS INC., Wilmington, North Carolina (USA) 16 LEITZ, Wetzlar 3. Material und Methoden 79 Aktivator-)Kontrolle sollte nicht mehr als 10 % ungefärbte Zellen (d. h. positiv reagierende Tachyzoiten) enthalten. Das positive Kontrollserum musste innerhalb von drei Serumverdünnungsstufen einen klaren Übergang von stark positiver (annähernd 100 % ungefärbte Tachyzoiten) zu eindeutig negativer Reaktion zeigen. Als SFT-Titer wurde diejenige reziproke Serumverdünnung angegeben, bei der die Zahl der ungefärbten Tachyzoiten noch mehr als 50 % betrug. Jede Serumprobe wurde bis zu dreimal untersucht und dabei jeweils der SFT-Titer bestimmt. Wich das Ergebnis der einzelnen SFTs um eine Titerstufe voneinander ab, wurde das Serum endgültig mit der höheren Titerstufe bewertet oder es wurde ein weiterer SFT durchgeführt. Ergaben sich bei drei durchgeführten SFTs drei unterschiedliche Titer, wurde der Endtiter durch das Mittel zwischen dem höchsten und dem niedrigsten Einzeltiter bestimmt. Seren mit einem Titer ≥ 1:16 wurden als positiv, Seren mit einem Titer von 1:4 wurden als grenzwertig und Seren mit einem Titer < 1:4 wurden als negativ beurteilt. 3.2.2.5. Ergebnisse aus dem SFT In der Tab. 9 sind die im SFT ermittelten Einzeltiter für die Serumproben aller Weißkopfmakis und der Kattas H24 und H25 für die Untersuchungszeitpunkte März, Juni und Dezember dargestellt. Die Serumproben vom Untersuchungszeitpunkt Mai wurden mit Ausnahme der des Weißkopfmakis H6 nicht im SFT untersucht. Das Tier H6 wies im Mai einen SFT-Titer von 1:1000 auf. Die jeweiligen Endtiter wurden nach den in 3.2.2.4.3. genannten Kriterien festgelegt und sind für die Weißkopfmakis in Tab. 13 in Kap. 4.2.1. sowie für die Kattas in Tab. 14 in Kap. 4.2.2. aufgeführt und werden dort den im ELISA ermittelten Endtitern gegenübergestellt. Der Tab. 9 ist zu entnehmen, dass der Weißkopfmaki H6 im März als negativ und an den übrigen Untersuchungszeitpunkten als positiv beurteilt wurde. Der Weißkopfmaki H9 wurde im März als grenzwertig und im Dezember als hoch positiv eingestuft. Bei diesen Tieren wurde somit im SFT eine Serokonversion nachgewiesen. Bei den übrigen Weißkopfmakis war die im SFT vorgenommene Beurteilung der Serumproben als positiv oder negativ über den gesamten Untersuchungszeitraum konstant. 80 3. Material und Methoden Die Serumproben der Kattas H24 und H25 wurden im SFT als positiv, die der Kattas J7-J9, B1 und B2 sowie des Weißbüschelaffen J10 wurden als negativ beurteilt. Ebenfalls negativ waren alle Serumproben der Totenkopfaffen. Bei den aus dem Serengeti-Park Hodenhagen stammenden Totenkopfaffen war dies für sämtliche Verlaufsblutproben der Fall. Tab. 9: Im SFT ermittelte Einzeltiter für die Serumproben der Weißkopfmakis und der Kattas Laufende Nummer Serum März A B H1 neg.a / n.u. / n.u.b neg. H2 256 / 1000 / n.u. 4000 / n.u. / n.u. 4000 / >64000 / n.u. H3 256 / 256 / n.u. 16000 / n.u. / n.u. 16000 / >64000 / n.u. H4 16 / 256 / 64 1000 / n.u. / n.u. 4000 / >64000 / n.u. H5 16 / 64 / n.u. 256 / n.u. / n.u. 1000 H6 neg. / n.u. / n.u. 64 / n.u. / n.u. 1000 / >64000 / n.u. H7 16 1000 / n.u. / n.u. 4000 / >64000 / n.u. / 64 C / n.u. Serum Juni A B C / n.u. / n.u. Serum Dezember A B C neg. c / n.u. / n.u. / >64000 / n.u. H8 64 / 256 / n.u. --- H9 4 / 4 --- H10 neg. / n.u. / n.u. neg. / n.u. / n.u. H21 16 / 256 / 64 1000 / n.u. / n.u. --- H22 64 / 256 / n.u. 1000 / n.u. / n.u. --- H23 16 / 64 / n.u. 1000 / n.u. / n.u. --- H26 16 / 16 256 / n.u. / n.u. 1000 / n.u. / n.u. H31 neg. / n.u. / n.u. neg. / n.u. / n.u. neg. / n.u. / n.u. H32 16 / 16 / n.u. 256 / n.u. / n.u. H33 neg. / n.u. / n.u. neg. / n.u. / n.u. / n.u. / 16 --4000 / >64000 / n.u. neg. / n.u. / n.u. --neg. / n.u. / n.u. H35 --- --- neg. / n.u. / n.u. H36 --- --- neg. / n.u. / n.u. H24 1000 / 4000 / n.u. 4000 / n.u. / n.u. H25 256 a / 256 / n.u. --- , negativ; b, nicht untersucht; c, keine Blutentnahme ----- 3. Material und Methoden 81 3.2.3. ELISA 3.2.3.1. Kontrollseren zur Optimierung der ELISAs Für die Etablierung der verschiedenen ELISA-Formate standen keine Referenzseren von experimentell infizierten Tieren zur Verfügung, da alle in die Untersuchungen einbezogenen nicht humanen Primaten geschützten Tierarten angehören, die in den Anhängen I und II des Washingtoner Artenschutzabkommens (CITES) aufgelistet sind. Daher wurden die Seren nicht humaner Primaten (siehe Kap. 3.1.3.) zunächst im SFT, dem in der Humanmedizin als Goldstandard geltenden Referenztest, auf Antikörper gegen T. gondii getestet. Die Weißkopfmakis waren neben den Kattas die einzige Spezies, bei denen im SFT positive und negative Tiere festgestellt wurden (siehe Kap. 3.2.2.5.). Da von den Weißkopfmakis eine größere Anzahl an Serumproben zur Verfügung stand, wurden von dieser Spezies Seren als Kontrollseren bei der Optimierung der ELISAs verwendet. Als Kontrollseren für den IgG-ELISA sowie für den IgGAviditäts-ELISA dienten diejenigen Seren der Weißkopfmakis, die im SFT bei einer Verdünnung von 1:4 negativ waren und die einen SFT-Antikörpertiter von mindestens 1:1000 aufwiesen. Es erfolgte somit eine Selektion von zu diagnostischen Zwecken gewonnenen Einzelseren unter Berücksichtigung der oben genannten Bedingungen, aus denen für die Etablierung dieser ELISAFormate ein Sammelserum hergestellt wurde, das als Kontrollserum diente und bei der Optimierung ausschließlich verwendet wurde. Für das positive Kontrollserum wurden jeweils 0,5 ml der Serumproben des Weißkopfmakis H2 aus den Untersuchungen im März und Juni sowie der Weißkopfmakis H4, H7, H21 und H22 aus der Untersuchung im Juni eingesetzt, da von diesen Serumproben eine ausreichend große Menge vorhanden war. Für das negative Kontrollserum wurden jeweils 0,5 ml der Serumproben der Weißkopfmakis H1, H10, H31 und H33 aus der Untersuchung im März sowie der Serumproben der Weißkopfmakis H10 und H31 aus der Untersuchung im Juni verwendet. Zur Etablierung des IgM-ELISAs wurde ebenfalls das o. g. negative Kontrollserum eingesetzt, wohingegen als positives Kontrollserum ein Einzelserum diente (Serum von Untersuchungszeitpunkt Juni). Dieses wies im SFT einen Antikörpertiter von 1:16000 auf. H3, 82 3. Material und Methoden 3.2.3.2. Antigengewinnung für den ELISA Zur Gewinnung von Antigen für den ELISA wurden 20 Mäuse mit ca. 3 x 106 T.-gondiiTachyzoiten in maximal 0,3 ml isotonischer Kochsalzlösung17 i. p. infiziert. Die Mäuse wurden am 3. Tag p. i. getötet und enthäutet. Es wurden ca. 2,5 ml physiologische Kochsalzlösung mit einer 0,6-mm-Kanüle in die Bauchhöhle injiziert und wieder abgezogen, nach Möglichkeit ohne dabei Blutgefäße zu verletzen. Eine derartige Spülung der Bauchhöhle wurde bei jeder Maus zwei- bis dreimal wiederholt und das Exsudat mikroskopisch18 auf Tachyzoiten, eine eventuelle Kontamination durch Wirtszellen sowie bakterielle Verunreinigungen untersucht. Die Exsudate wurden anschließend in zwei 50-ml-Zentrifugenröhrchen19 gesammelt und für 10 Minuten bei 700 g zentrifugiert. Der Überstand wurde bis auf 4 ml vorsichtig abpipettiert und das bei der Zentrifugation entstandene Pellet in diesem Rest resuspendiert. Die Tachyzoitensuspension wurde mittels Dichtegradienten-Zentrifugation mit Percoll ® (AMERSHAM BIOSCIENCES, Uppsala, Schweden) von Leukozyten, Erythrozyten und anderen Wirtszellen gereinigt. Dafür wurde zunächst eine isotonische Stammlösung aus neun Teilen ® Percoll und einem Teil steriler 10 x PBS hergestellt. Aus dieser wurde eine 90%ige, eine 80%ige, ® sowie eine 20%ige Percoll -Lösung durch Verdünnung mit isotonischer Kochsalzlösung gefertigt. In konischen 15-ml-Zentrifugenröhrchen20 wurde ein Gradient aus 3 ml isotonischem, 3 ml 90%igem, 3 ml 80%igem und 2 ml 20%igem Percoll ® geschichtet. Dieser wurde mit dem Peritonealexsudat überschichtet, welches dafür vorsichtig mit einer Spritze durch eine 0,4-mmKanüle auf den Gradienten gegeben wurde. Durch dieses Vorgehen wurde die Zellwand wirtseigener Makrophagen zerstört und auch bereits phagozytierte Tachyzoiten konnten noch gewonnen werden. Anschließend erfolgte eine 20minütige Zentrifugation bei 700 g, 15 °C und ® Auslauf ohne Bremse21. An der Grenzschicht zwischen isotonischem und 90%igem Percoll bildete 17 0,9%ige Infusionslösung, DELTA SELECT, Pfullingen 18 Standard-Lichtmikroskop, Objektiv 40 x, CARL ZEISS, Oberkochen 19 NUNC, Wiesbaden 20 NUNC, Wiesbaden 21 Megafuge 1,0 R, HERAEUS, Osterode 3. Material und Methoden 83 sich dabei eine deutliche weiße Schicht aus Tachyzoiten. Diese wurden mit einer Pasteurpipette vorsichtig abgesaugt und mikroskopisch auf ihre Reinheit überprüft. Die so gewonnenen Tachyzoiten wurden anschließend zweimal mit isotonischer Kochsalzlösung ® gewaschen, um vorhandene Percoll -Reste zu entfernen. Die Zentrifugation erfolgte hierbei für 10 Minuten bei 700 g. Der Überstand wurde bis auf 4 ml dekantiert und die Tachyzoiten in diesem Rest resuspendiert. Die gereinigte Suspension wurde nun mit Ultraschall22 behandelt, um die Tachyzoiten in Bruchstücke zu zerkleinern. Die Beschallung erfolgte im Ethanol-Eisbad, um eine Überhitzung und die daraus resultierende Proteindenaturierung zu verhindern, und wurde bei einer Amplitude von 24 für dreimal 1 Minute mit zweiminütigen Pausen durchgeführt. Nach der Beschallung erfolgte eine mikroskopische Kontrolle, ob alle Tachyzoiten in gleichmäßige Bruchstücke zerkleinert wurden. Nach Bestimmung der Proteinkonzentration (siehe Kap. 3.2.3.3) wurde die Antigensuspension in Portionen zu 100 µl bei –20 °C bis zur weiteren Verwendung eingefroren. 3.2.3.3. Bestimmung der Proteinkonzentration des Tachyzoitenantigens Die Proteinkonzentration des Antigens wurde mit Hilfe eines kommerziellen Testkits23 mit der Methode nach BRADFORD (1976) bestimmt. Das Testverfahren basiert auf dem Prinzip, dass eine saure Lösung des Farbstoffs Coomassie Brilliant Blue G-250 durch Proteinbindung einen sichtbaren Farbumschlag produziert. Der Farbstoff bindet dabei an basische und aromatische Aminosäurereste, wodurch seine anionische Form stabilisiert wird. Das Absorptionsmaximum des Farbstoffs wechselt dabei von 465 nm auf 595 nm. Mit Hilfe einer im Testkit enthaltenen Kontrolllösung24 mit einer definierten Proteinkonzentration wurde nach Angaben des Herstellers eine Standardkurve von 0 µg Protein/ml bis 20 µg Protein/ml 22 Ultraschallgerät 150 W Ultrasonic Disintegrator Mk2TM, MSE SCIENTIFIC INSTRUMENTS, Sussex, UK 23 BIO-RAD Protein Assay Kit I, BIO-RAD Laboratories GmbH, München 24 bovines γ-Globulin, Standard I 84 3. Material und Methoden hergestellt. Von der Antigensuspension wurden 5µl, 10µl und 20 µl jeweils im Doppelansatz einmal unverdünnt sowie in einer Verdünnung von 1:10 eingesetzt. Nach der Zugabe von jeweils 50 µl Farbstofflösung und einer Inkubationszeit von mindestens 5 bis maximal 60 Minuten wurde bei einer Wellenlänge von 600 nm mit dem ImmunoTM-Reader25 die optische Dichte bestimmt. Aus den gemessenen optischen Dichten und dem Proteingehalt der Standardverdünnungen wurde eine Eichkurve erstellt, mit deren Hilfe die Proteinkonzentration des Tachyzoitenantigens berechnet wurde. Dabei wurde eine Konzentration von 3,8 mg/ml ermittelt. 3.2.3.4. Konjugate Als Sekundärantikörper diente im IgG-ELISA sowie im IgG-Aviditäts-ELISA ein Meerrettichperoxidase(PO)-konjugierter polyklonaler Antikörper gegen Affen-IgG aus der Ziege26. Als Immunogen wurde bei der Herstellung IgG aus Sammelseren von Rhesusaffen verwendet. Die Aufreinigung des Antiserums erfolgte durch DEAE-Chromatograpie. Der Sekundärantikörper war gegen die Fc-Untereinheit des IgG-Moleküls gerichtet, wodurch eine strenge Isotypen-Spezifität gesichert wurde. Für den IgM-ELISA wurde ein ebenfalls PO-konjugierter Antikörper gegen die Fc-Untereinheit von Affen-IgM aus der Ziege27 verwendet. Da zur Zeit kommerziell keine Sekundärantikörper gegen Immunglobuline von Weißkopfmakis oder anderen Halbaffen erhältlich sind, musste auf die o. g. Konjugate zurückgegriffen werden. 3.2.3.5. IgG-ELISA Als Konjugat für den IgG-ELISA wurde PO-konjugiertes Ziege-Anti-Affe-IgG(Fc) verwendet (siehe auch Kap. 3.2.3.4.). 25 ImmunoTM-Reader NJ 2000, NUNC GmbH, Wiesbaden 26 GAMon/IgG(Fc)/PO, Chargennr. 5637, NORDIC IMMUNOLOGICAL LABORATORIES, Tilburg, NL 27 GAMon/IgM(Fc)/PO, Chargennr. 5662, NORDIC IMMUNOLOGICAL LABORATORIES, Tilburg, NL 3. Material und Methoden 85 3.2.3.5.1. Testdurchführung 1. Beschichtung der Mikrotiterplatten mit Antigen Für die Beschichtung der Mikrotiterplatten28 wurde jeweils eine neue Antigen-Portion aufgetaut. Das Antigen wurde im Volumenverhältnis 1:2 mit 8 M Harnstofflösung 15 Minuten lang bei Raumtemperatur inkubiert. Anschließend wurde eine gebrauchsfertige Verdünnung mit Beschichtungspuffer hergestellt und jeweils 100 µl dieser Lösung in eine Vertiefung der Mikrotiterplatte pipettiert29. Das Antigen wurde dabei in einer Konzentration von 1,13 µg/ 100 µl eingesetzt. Die Bestimmung der optimalen Antigengebrauchsverdünnung erfolgte durch Titration des Antigens (siehe Kap. 3.2.3.8.). Nach Abdeckung der Platten mit einer Klebefolie30 erfolgte eine mindestens 15stündige Inkubation bei 4 °C im Kühlschrank. 2. Waschen der Mikrotiterplatten Nach vorsichtigem Dekantieren des Inhaltes wurden die Platten dreimal für 5 Minuten mit PBS unter Verwendung des NUNC ImmunoTM Wash 1231 gewaschen. Nach dem letzten Waschgang wurden die Platten auf einem sauberen Handtuch ausgeschlagen. 3. Absättigung freier Bindungsstellen In jede Plattenvertiefung wurden 100 µl BSA-PBS pipettiert. Nach Abdeckung der Platten mit der ursprünglichen Klebefolie erfolgte eine einstündige Inkubation bei 37 Glasperlenwasserbad33. 4. Waschen der Mikrotiterplatten 28 96 Well Immuno Platten F96 Maxi Sorp, NUNC, Wiesbaden 29 Titertek Multichannel Pipette 50-200 µl, EFLAB, Helsinki, Finnland 30 Deckfolie für MicroWellTM-Platten, PVC/SI, NUNC, Wiesbaden 31 NUNC, Wiesbaden 32 Wärmeschrank HERAEUS T5042E, HERAEUS, Hanau 33 30 x 20 x 5 cm große Plastikschalen, 1 cm hoch mit Glasperlen (Durchmesser 4 mm) sowie mit Aqua bidestillata bis zur Oberfläche der Glasperlenschicht befüllt ® °C32 im 86 3. Material und Methoden Nach vorsichtigem Dekantieren des Inhaltes wurden die Platten dreimal für 5 Minuten mit PBSTween unter Verwendung des NUNC ImmunoTM Wash 12 gewaschen. Nach dem letzten Waschgang wurden die Platten auf einem sauberen Handtuch ausgeschlagen. 5. Aufbringen der Seren Die Seren wurden in Zweierschritten ab einer Verdünnung von 1:10 in BSA-PBS-Tween titriert, wobei jeweils 100 µl der Serumverdünnungen in die Plattenvertiefungen gegeben wurden. Wenn nur wenig Serum zur Verfügung stand, wurde bei den Wiederholungsuntersuchungen ab einer Verdünnung von 1:20 titriert. In die Vertiefung der auf jeder Platte mitgeführten Leerwertkontrolle wurden anstelle einer Serumverdünnung nur 100 µl BSA-PBS-Tween pipettiert. Als Serumkontrolle wurde das positive Referenzserum in einer Standardverdünnung von 1:40 eingesetzt. Nach Abdeckung der Platten mit der ursprünglichen Klebefolie erfolgte eine einstündige Inkubation bei 37 °C im Glasperlenwasserbad. 6. Waschen der Mikrotiterplatten Siehe Punkt 4. 7. Aufbringen des Konjugates Das Konjugat wurde in einer Verdünnung von 1:1000 eingesetzt. Nach Herstellung der KonjugatGebrauchsverdünnung mit BSA-PBS-Tween wurden in jede Plattenvertiefung mit Ausnahme des Leerwertes 100 µl dieser Lösung pipettiert, wohingegen bei der Leerwertkontrolle 100 µl BSAPBS-Tween eingesetzt wurde. Die optimale Konjugatverdünnung wurde durch Titration ermittelt (siehe Kap. 3.2.3.8.). Die Platten wurden mit einer neuen Klebefolie abgedeckt und für 1 Stunde bei 37 °C im Glasperlenwasserbad inkubiert. 8. Waschen der Mikrotiterplatten Siehe Punkt 4. 9. Aufbringen des Substratpuffers Das Ansetzen des Substratpuffers erfolgte in einem durch Ummantelung mit Alufolie lichtgeschützten Gefäß. Das OPD (o-Phenylenediamine-Dihydrochlorid)* und das H2O2* wurden dem Substratpuffer erst kurz vor dem Aufbringen auf die Platten zugegeben. Es wurden jeweils 3. Material und Methoden 87 50 µl der Substratlösung in jede Plattenvertiefung pipettiert und die Platten anschließend für 30 Minuten bei Raumtemperatur im Dunkeln inkubiert. 10. Abstoppen der Reaktion Die Reaktion wurde durch Zugabe von 50 µl 2,5 M H2SO4-Lösung in jede Vertiefung abgestoppt. 11. Messung der optischen Dichten Die Messung der optischen Dichten mit dem Immunoreader erfolgte möglichst rasch nach dem Abstoppen der Reaktion. Gemessen wurde bei Wellenlängen von 490 und 620 nm. Um eine Vergleichbarkeit der Messwerte zwischen unterschiedlichen Platten zu gewährleisten, wurden alle gemessenen optischen Dichten einer Platte auf den Wert des positiven Kontrollserums bezogen. Die daraus resultierenden Indexwerte wurden nach der folgenden Formel berechnet: O.D. des Testserums – O.D. des Leerwertes Index = ----------------------------------------------------------------------O.D. des positiven Referenzserums – O.D. des Leerwertes 3.2.3.5.2. Festlegung der Grenzwerte für den IgG-ELISA Um positive von negativen Reaktionen unterscheiden zu können, wurden für den IgG-ELISA Grenzwerte (Cut-offs) festgelegt. Bei der Berechnung der Grenzwerte wurden die Indexwerte von vier Weißkopfmakis einbezogen, deren Seren im gesamten Untersuchungszeitraum (März bis Dezember 2004) im SFT bei einer Verdünnung von 1:4 als negativ beurteilt wurden. Dabei handelt es sich um die Tiere H1, H10, H31 und H33 (siehe auch Tab. 9 in Kap. 3.2.2.5.). Jedes Serum wurde im IgG-ELISA mehrfach untersucht. Die Festlegung von Grenzwerten für den ELISA mit SFT-negativen Seren geschah unter der Hypothese, dass der SFT für die Untersuchung von Makiseren eine ähnlich hohe Spezifität besitzt wie für die Untersuchung von Humanseren. In Tab. 10 sind für die Serumverdünnungen 1:10, 1:20, 1:40, 1:80 sowie 1:160 die Anzahl der jeweils in die Berechnung einbezogenen Indexwerte aufgeführt und die daraus berechneten Mittelwerte, Standardabweichungen und Grenzwerte dargestellt. Ab einer Serumverdünnung von 1:320 wurde der für die Verdünnungsstufe 1:160 festgelegte Grenzwert verwendet. 88 3. Material und Methoden Die Festlegung von Grenzwerten für den IgG-ELISA erfolgte nach der folgenden Formel: + 3 x SD (Summe aus dem Mittelwert und der dreifachen Standardabweichung) Tab. 10: Festlegung der Grenzwerte für den IgG-ELISA Serumverdünnung Anzahl der Indexwerte (n) Mittelwert 1: 10 33 0,227 0,067 0,428 1: 20 47 0,220 0,059 0,397 1: 40 52 0,198 0,047 0,339 1: 80 52 0,177 0,046 0,315 1: 160 36 0,156 0,029 0,243 ( ) Standardabweichung (SD) Cut-off ( + 3 x SD) 3.2.3.5.3. Festlegung der Titer und Auswertung des IgG-ELISAs Als Titer wurde im IgG-ELISA diejenige reziproke Serumverdünnung angegeben, bei der die ermittelten Indexwerte zuletzt über den in Kap. 3.2.3.5.2. festgelegten Grenzwerten lagen oder zuletzt gleich den Grenzwerten waren. Für die Endbewertung eines Serums wurden mindestens zwei voneinander unabhängige Untersuchungen durchgeführt und dabei jeweils der Titer bestimmt. Wich das Ergebnis der einzelnen ELISAs um eine Titerstufe voneinander ab, wurde das Serum endgültig mit der höheren Titerstufe bewertet oder es wurde ein weiterer ELISA durchgeführt. Bei drei durchgeführten ELISAs wurde das Serum endgültig mit dem Titer bewertet, der bei zwei von drei ELISAs ermittelt wurde. Fielen alle drei ELISAs unterschiedlich aus, wurde der Endtiter durch das Mittel zwischen dem höchsten und dem niedrigsten Einzeltiter festgelegt. Seren mit einem Endtiter von ≥ 1:10 wurden als positiv beurteilt. Seren, deren ELISA-Indices unterhalb der Grenzwerte lagen bzw. einen Titer < 1:10 aufwiesen, wurden als negativ beurteilt. 3. Material und Methoden 89 3.2.3.6. IgG-Aviditäts-ELISA Alle Seren der nicht humanen Primaten, bei denen sich bei der Untersuchung im IgG-ELISA Indexwerte ergaben, die über den in Kap. 3.2.3.5.2. festgelegten Grenzwerten lagen, wurden anschließend im IgG-Aviditäts-ELISA untersucht. Als Konjugat wurde PO-konjugiertes Ziege-Anti-Affe-IgG(Fc) verwendet (siehe auch Kap. 3.2.3.4.), welches in einer Konzentration von 1:1000 eingesetzt wurde. Die Durchführung des IgG-Aviditäts-ELISAs entsprach im Wesentlichen der des IgG-ELISAs (siehe Kap. 3.2.3.5.1.). Die Untersuchung der Seren erfolgte hier jedoch immer in einer Doppelreihe. Die Seren wurden ab einer Verdünnung von 1:10 bis zu einer Verdünnung von 1:1280 titriert. Wenn nur wenig Serum zur Verfügung stand, wurde bei der Wiederholungsuntersuchung ab einer Verdünnung von 1:20 bis zu einer Verdünnung 1:2560 titriert. Nach der Seruminkubation wurde jeweils eine der beiden Reihen für 5 Minuten mit 200 µl 6 M Harnstoff in PBS-Tween inkubiert, wohingegen die andere Reihe, wie bei der Durchführung des IgG-ELISAs, für 5 Minuten mit PBS-Tween gewaschen wurde. 3.2.3.7. IgM-ELISA Im IgM-ELISA wurden alle Verlaufsblutproben der Weißkopfmakis untersucht (siehe Kap. 3.1.3.). Die Titration der Seren erfolgte ab einer Verdünnung von 1:20. Als Konjugat wurde POkonjugiertes Ziege-Anti-Affe-IgM(Fc) verwendet (siehe Kap. 3.2.3.4.), welches in einer Konzentration von 1:1000 eingesetzt wurde. Der IgM-ELISA wurde ansonsten wie in dem in Kap. 3.2.3.5.1. aufgeführten Protokoll durchgeführt. 3.2.3.8. Optimierung der ELISA-Formate In Vorversuchen wurden verschiedene ELISA-Formate zum Nachweis von Antikörpern gegen T. gondii bei Weißkopfmakis etabliert. Dabei wurden ein IgG-ELISA, ein IgG-Aviditäts-ELISA und 90 3. Material und Methoden ein IgM-ELISA entwickelt. Die Gebrauchskonzentrationen des Antigens sowie die optimalen Verdünnungen für das Konjugat wurden dabei durch Titration ermittelt. Da die zur Verfügung stehenden Volumina der Kontrollseren begrenzt waren, wurde durch Titration festgestellt, wie stark diese verdünnt werden können. Zudem wurde die Umsetzung des Substrats zu unterschiedlichen Zeitpunkten abgestoppt, um eine optimale Reaktionszeit zu ermitteln. Zur Bestimmung der optimalen Antigenkonzentration wurde eine Titration des Antigens in Zweierschritten ab einer Proteinkonzentration von 18 µg pro 100 µl Beschichtungspuffer durchgeführt. Dabei wurden zwei Reihen mit Antigen beschichtet, wobei die eine Reihe mit positivem und die andere mit negativem Kontrollserum in einer Verdünnung von 1:200 beschickt wurde. Der ELISA wurde ansonsten wie im oben aufgeführten Protokoll durchgeführt (siehe Kap. 3.2.3.5.1.). Als optimale Antigenkonzentration wurde die Konzentration, bei der die Differenz zwischen der optischen Dichte des positiven Kontrollserums und der optischen Dichte des negativen Kontrollserums am größten war, definiert. Zudem wurde die Gebrauchskonzentration des Antigens danach gewählt, dass sich für die optische Dichte des positiven Kontrollserums ein Wert innerhalb des Plateaubereichs ergab. Die Ergebnisse der Antigentitrationen für den IgG-ELISA sowie für den IgM-ELISA sind in der Abb. 3 (A-B) dargestellt. Als optimale Konzentration des Antigens wurde sowohl für den IgG-ELISA als auch für den IgM-ELISA eine Gebrauchskonzentration von 1,13 µg Protein pro Plattenvertiefung ermittelt. Die optimalen Konzentrationen wurden in Abb. 3 jeweils durch einen Pfeil gekennzeichnet. Zur Bestimmung der optimalen Konjugatverdünnungen wurde das Konjugat vor Anbruch jeder neuen Charge in mehreren Verdünnungen getestet (1:250, 1:500, 1:1000, 1:1500, 1:2000, 1:2500). Diese wurden dafür einzeln angesetzt und jeweils im Doppelansatz auf eine Reihe der Platte gegeben, wobei eine Reihe zuvor mit positivem und die andere mit negativem Kontrollserum in einer Verdünnung von 1:200 beschickt wurde. Der ELISA wurde ansonsten wie im oben aufgeführten Protokoll durchgeführt (siehe Kap. 3.2.3.5.1.). Als optimale Konjugatverdünnung wurde diejenige definiert, bei der die Differenz zwischen der optischen Dichte des positiven Kontrollserums und der des negativen Kontrollserums am größten war. Zudem wurde die Konjugatverdünnung so gewählt, dass sich für das positive Kontrollserum eine optische Dichte >1 ergab. Die Ergebnisse der Konjugattitrationen für den IgG- sowie für den IgM-ELISA sind in der 3. Material und Methoden 91 Abb. 3 (C-D) dargestellt. Als optimal wurde für beide Konjugate eine Verdünnung von 1:1000 ermittelt. Die Ermittlung von geeigneten Verdünnungen der Kontrollseren erfolgte ebenfalls durch Titration. Dabei wurden das positive sowie das negative Kontrollserum jeweils ab einer Verdünnung von 1:10 bis zu einer Verdünnung von 1:20480 titriert. Die Durchführung des ELISAs erfolgte ansonsten wie im oben aufgeführten Protokoll (siehe Kap. 3.2.3.5.1.). Die Ergebnisse der Titrationen der Referenzseren im IgG-ELISA sowie im IgM-ELISA sind in der Abb. 3 (E-F) dargestellt. Die Verdünnung des positiven Referenzserums wurde als optimal angesehen, wenn sie sich innerhalb des Plateaubereichs befand. Für die Serumkontrolle im IgG-ELISA wurde eine optimale Verdünnung von 1:40 ermittelt, für den IgM-ELISA ergab sich eine optimale Verdünnung von 1:80. Zur Bestimmung einer optimalen Inkubationszeit der Substratlösung wurde die Reaktion über einen Zeitraum von einer Stunde in Abständen von jeweils 10 Minuten abgestoppt. Als optimale Inkubationszeit wurde diejenige definiert, bei der die Differenz zwischen der optischen Dichte des positiven Kontrollserums und der des negativen Kontrollserums am größten war. Als optimaler Zeitraum erwies sich eine Inkubationszeit von 30 Minuten. 92 3. Material und Methoden A IgM-ELISA Antigenkonzentration in µg/100µl C IgM-ELISA 1,6 1,8 1,4 1,6 1,2 1,4 1 0,8 0,6 0,4 0,2 D 1,2 1 0,8 0,6 0,4 0,2 0 0 1000 1500 2000 2500 250 reziproke Konjugatverdünnung IgM-ELISA E 0,2 20480 10240 5120 2560 1280 320 640 160 80 40 20 10 0 20480 0,4 10240 0,6 5120 0,8 1280 2560 1 640 Optische Dichte 1,2 320 1,4 F 2 1,8 1,6 1,4 1,2 1 0,8 0,6 0,4 0,2 0 80 160 1,6 reziproke Serum verdünnung 1000 1500 2000 2500 reziproke Konjugatverdünnung 10 IgG-ELISA 500 40 500 20 250 Optische Dichte 9 Antigenkonzentration in µg/100µl Optische Dichte Optische Dichte IgG-ELISA 18 0,01 9 18 4,5 2,25 1,13 0,28 0,56 0,14 0,07 0,04 0,02 0,01 0 4,5 0,2 2,25 0,4 1,13 0,6 1 0,8 0,6 0,4 0,2 0 0,56 0,8 0,28 1 0,14 1,2 0,07 1,4 Optische Dichte Optische Dichte 1,6 B 2 1,8 1,6 1,4 1,2 0,04 1,8 0,02 IgG-ELISA reziproke Serum verdünnung Abb. 3: Titration von Antigen, Konjugat und Kontrollserum im IgG- und IgM-ELISA 3. Material und Methoden 93 3.2.4. Mausinokulation Der Katta H24 verstarb 13 Wochen nach der ersten Probennahme an einer Infektion mit Yersinia pseudotuberculosis und gelangte im Institut für Pathologie der Stiftung Tierärztliche Hochschule Hannover zur Sektion. Dabei wurden Gewebeproben des Tieres gewonnen und Teile des Gehirns in Mäuse inokuliert. 3.2.4.1. Aufbereitung des Gehirns Es wurde etwa ein Viertel des Gehirns in 100 ml PBS homogenisiert und in zwei 50-mlZentrifugenröhrchen überführt. Die Gehirnsuspension wurde anschließend für 10 Minuten bei 1400 g zentrifugiert. Der Überstand wurde dekantiert und das bei der Zentrifugation entstandene Sediment in 50 ml PBS resuspendiert. Die Suspension wurde in einen 250-ml-Erlenmeyerkolben gegeben, mit 50 ml einer 0,5%igen Trypsin-PBS-Lösung versetzt und für 30 Minuten im Wasserbad bei 37 °C inkubiert. Während der Inkubation wurde der Erlenmeyerkolben regelmäßig geschwenkt. Danach wurde die Suspension durch einen Trichter und drei Lagen Gaze in zwei 50ml-Zentrifugenröhrchen überführt und erneut für 10 Minuten bei 1400 g zentrifugiert. Anschließend wurde das Sediment zweimal mit PBS gewaschen (Zentrifugation für 10 Minuten bei 1400 g). Nach dem letzten Waschschritt wurde der Überstand dekantiert und das Sediment in jedem Röhrchen in 4,5 ml PBS resuspendiert. Der Suspension wurde jeweils 0,5 ml Penizillin/Streptomyzin* zugefügt. 3.2.4.2. Infektion der Mäuse Es wurden insgesamt sechs Mäuse34 mit jeweils 0,2 ml der Gehirnsuspension i. p. sowie s. c. infiziert. Drei Mäuse erhielten eine Suspension, bei der das Gehirn lediglich mit PBS homogenisiert wurde und drei Mäuse wurden mit einer Suspension infiziert, bei der das Gehirn nach dem oben aufgeführten Protokoll homogenisiert und trypsinisiert wurde. 34 NMRI, weiblich, ca. 18 Wochen alt 94 3. Material und Methoden Fünf Mäuse starben 1-10 Tage nach der Infektion. Von der einzigen überlebenden Maus, die bei der Infektion eine nur homogenisierte Gehirnsuspension erhielt, wurde 16 Tage p. i. Blut gewonnen35 und das Serum im SFT auf Antikörper gegen T. gondii untersucht. Die Maus wurde 46 Wochen p. i. getötet. Die eine Hälfte des Gehirns wurde zur Infektion weiterer Mäuse (1. Passage) und die andere für die Durchführung einer histologischen Untersuchung (siehe Kap. 3.2.6.) benutzt. 3.2.4.3. Untersuchung des Mäuseserums im SFT Das Serum der Maus (siehe Kap. 3.2.4.2.) wurde im SFT nach dem o. g. Protokoll (Kap. 3.2.2.) untersucht. 3.2.5. IFAT 3.2.5.1. Untersuchungsgut Im IFAT wurden die Seren von 4 Mäusen aus der 1. Passage (siehe Kap. 3.2.4.2.) untersucht. Die Blutentnahmen erfolgten ca. 16 Wochen nach der Infektion. 3.2.5.2. Antigengewinnung für den IFAT Zur Gewinnung von Antigen für den IFAT wurden 10 Mäuse36 mit ca. 3 x 106 T.-gondiiTachyzoiten37 in maximal 0,3 ml PBS i. p. infiziert. Die Tachyzoiten wurden 48 Stunden p. i. durch Spülung der Bauchhöhle mit steriler physiologischer Kochsalzlösung gewonnen. Das Exsudat jeder Maus wurde jeweils in einem 15-ml-Zentrifugenröhrchen gesammelt und für 5 Minuten bei 1400 g zentrifugiert. Anschließend wurde der Überstand abpipettiert, das Sediment in PBS resuspendiert und die Suspension erneut für 5 Minuten bei 1400 g zentrifugiert. Dieser Waschschritt wurde noch 35 Kapillarpipetten, ROTH, Karlsruhe 36 Stamm NMRI, weiblich, ca. 10 Wochen alt 37 Stamm BK 3. Material und Methoden 95 einmal wiederholt. Nach dem letzten Waschen wurde das Sediment in 0,5 ml PBS aufgeschwemmt und die Tachyzoiten vorsichtig resuspendiert. Zu jeder Suspension wurden 4,5 ml einer 1%igen Formaldehyd-Lösung gegeben und die Tachyzoiten damit 30 bis 60 Minuten fixiert. Anschließend erfolgten erneut zwei Waschschritte mit PBS (Zentrifugation für 10 Minuten bei 1400 g). Nach jedem Zentrifugieren wurde das Sediment sorgfältig resuspendiert. Nach dem letzten Zentrifugieren wurde das Sediment in 10 ml PBS resuspendiert und mit einer Zählkammer38 die Anzahl der Tachyzoiten bestimmt. Die Ausgangskonzentration wurde danach mit PBS so verdünnt, das ca. 2 x 106 Tachyzoiten pro ml enthalten waren. Nach einer Stunde Lagerung bei Raumtemperatur wurden auf die IFAT-Objektträger39 mit dem Dispenser40 10 µl Antigensuspension (etwa 1-2 x 104 Tachyzoiten) pro markiertes Feld aufgetragen. Die Trocknung erfolgte zunächst für eine Stunde bei Raumtemperatur und dann für eine Stunde bei 37 °C im Brutschrank. Anschließend wurden die Objektträger durch zehnmaliges, kurzes Eintauchen in destilliertes Wasser gewaschen und luftgetrocknet. Die Objektträger wurden luftdicht und feuchtigkeitsabweisend verpackt und mit dem Datum der Herstellung versehen. Die Lagerung erfolgte bei –80 °C für bis zu 6 Monate. 3.2.5.3. Konjugat Als Konjugat diente FITC (Fluoreszeinisothiocyanat)-konjugiertes Kaninchen-anti-Maus- 41 IgG(H+L) , das in einer Verdünnung von 1:62,5 verwendet wurde. 3.2.5.4. Kontrollseren Als negatives Kontrollserum wurde ein Sammelserum benutzt, welches aus Seren von nicht 38 Thoma, BRAND GmbH, Wertheim 39 16 wells à 6 mm, RENNER GmbH, Dannstadt 40 Multipette® plus, EPPENDORF, Hamburg 41 Artikelnummer 315-095-003, DIANOVA GmbH, Hamburg 96 3. Material und Methoden infizierten Mäusen42 hergestellt wurde. Als positives Kontrollserum diente ein Sammelserum aus Mäusen, die im Rahmen einer Studie mit dem T.-gondii-Stamm Dx infiziert wurden und bei denen 150 Tage p. i. eine Blutentnahme stattfand. 3.2.5.5. Testdurchführung 1. Auftauen der Objektträger Die mit T.-gondii-Tachyzoiten beschichteten Objektträger wurden etwa 15 Minuten bei Raumtemperatur aufgetaut. 2. Verdünnung der Testseren und Beschichtung der Objektträger Die Kontrollseren und die Testseren wurden in Zweierschritten ab einer Verdünnung von 1:20 bis 1:655360 mit PBS in einer Mikrotiterplatte titriert. Das negative und das positive Kontrollserum wurden jeweils von 1:20 bis 1:160 titriert. Je 10 µl der Serumverdünnungen wurden auf ein Objektträgerfeld aufgetragen. Die Seruminkubation erfolgte für 30 Minuten in einer feuchten Kammer bei 37 °C im Wärmeschrank. 3. Spülen, Waschen und Trocknen der Objektträger Nach der Inkubation wurde jeder Objektträger mit PBS abgespült und anschließend für 10 Minuten in mit PBS gefüllte Küvetten auf den Magnetrührer43 bei niedrigster Einstellung gestellt. Nach dem Waschen wurden die Objektträger aus den Küvetten entnommen und die anhaftende Flüssigkeit abgeklopft. Anschließend wurden die Objektträger für ca. 10 Minuten bei Raumtemperatur zum Trocknen aufgestellt. Danach wurden die Objektträger am Rand und zwischen den Vertiefungen mit Wattestäbchen abgetrocknet. 4. Inkubation mit Konjugat 42 Stamm NMRI 43 IKA Combimag RCT 74309, Jahnke & Kunkel GmbH, Staufen 3. Material und Methoden 97 Es wurde Evans Blau* als Gegenfärbung verwendet und eine Konjugatgebrauchslösung (1:62,5) aus 8 µl Konjugat und 492 µl Evans-Blau-Lösung hergestellt. Je 10 µl der Konjugatverdünnung wurden auf jedes Objektträgerfeld gegeben, worauf eine Inkubation für 30 Minuten bei 37 °C in der feuchten Kammer erfolgte. 5. Spülen und Waschen der Objektträger Siehe Punkt 3. 6. Eindecken der Objektträger Nachdem die Objektträger am Rand trockengewischt waren, wurden sie mit Eindeckmedium und mit einem großen Deckgläschen44 abgedeckt. Die Objektträger wurden in Alufolie eingewickelt und bis zur Auswertung bei Raumtemperatur aufbewahrt. 7. Auswertung Die Auswertung erfolgte mit dem Fluoreszenzmikroskop bei 400facher Vergrößerung, wobei folgende Einteilung vorgenommen wurde: 3+ der gesamte Parasit fluoresziert 2+ die Zellwand des Parasiten fluoresziert stark 1+ die Zellwand des Parasiten fluoresziert trace die Zellwand des Parasiten fluoresziert schwach oder die Polkappen fluoreszieren negativ keine Fluoreszenz, rötliche Färbung (Evans Blau) der Tachyzoiten Als Titer wurde diejenige Verdünnungsstufe des Serums angegeben, in der die Fluoreszenz des Parasiten noch mit 1+ beurteilt wurde. Eine alleinige Fluoreszenz an einem Pol der Parasiten (Polkappenfluoreszenz) wurde als unspezifisch bewertet. 44 Deckgläser für Mikroskopie, 24 x 66 mm, KNITTEL GLÄSER, Braunschweig 98 3. Material und Methoden 3.2.6. Histologische Untersuchung von Gewebeproben Von dem in der Sektion gewonnenen Gehirn des Kattas H24 sowie von dem Gehirn und der Lunge der Maus, die mit dem Gehirn des Kattas inokuliert wurde (siehe Kap. 3.2.4.), wurden nach einer routinemäßigen Paraffineinbettung histologische Schnitte in einer Schichtdicke von 4 µm angefertigt und diese im Färbeautomaten mit H.&E. gefärbt. Anschließend erfolgte eine lichtmikroskopische Untersuchung auf Gewebezysten von T. gondii. 4. Ergebnisse 99 4. ERGEBNISSE 4.1. Untersuchung von Serumproben nicht humaner Primaten im IgM-ELISA auf Antikörper gegen T. gondii Im IgM-ELISA wurden die Verlaufsblutproben aller 19 Weißkopfmakis untersucht. Dabei erwies sich dieses ELISA-Format als unbrauchbar, da bei den Tieren, bei denen im SFT eine Serokonversion nachgewiesen wurde (siehe Kap. 3.2.2.5.), im IgM-ELISA keine signifikanten Unterschiede zu den Titern der Tiere mit einer chronischen Infektion bestanden. Zur Bestimmung des Infektionsstadiums wurde daher bei den weiteren Untersuchungen ausschließlich der IgGAviditäts-ELISA benutzt. 4.2. Untersuchung von Serumproben nicht humaner Primaten im IgG-ELISA auf Antikörper gegen T. gondii und Vergleich mit den im SFT ermittelten Ergebnissen Um die Ergebnisse aus dem IgG-ELISA graphisch darstellen zu können, wurde aus den für eine Serumprobe ermittelten Indexwerten für jede Serumverdünnungsstufe der Mittelwert gebildet. Dieses Vorgehen ist exemplarisch für eine Serumprobe in Tab. 11 aufgeführt. 100 4. Ergebnisse Tab. 11: ELISA-Indices aus 3 Untersuchungen des Serums von dem Weißkopfmaki H23 (Probenahme März) und daraus berechneter Mittelwert für die graphische Darstellung Serumverdünnung 1: 10 1: 20 1: 40 1: 80 1: 160 1: 320 1: 640 1: 1280 1: 2560 1: 5120 1: 10240 1: 20480 a , nicht untersucht A 0,673 0,572 0,466 0,379 0,275 0,195 0,176 0,122 0,106 0,103 0,106 n.u. B 0,611 0,548 0,471 0,339 0,350 0,206 0,198 0,143 0,130 0,132 0,133 n.u. C n.u.a 0,653 0,482 0,414 0,299 0,221 0,161 0,139 0,101 0,097 0,104 0,098 Mittelwert 0,642 0,560 0,469 0,359 0,313 0,201 0,187 0,133 0,118 0,118 0,120 0,098 4.2.1. Weißkopfmakis Im IgG-ELISA wurden die Verlaufsblutproben aller 19 Weißkopfmakis auf Antikörper gegen T. gondii untersucht. Von jedem Tier waren bis zu vier Serumproben vorhanden (siehe Kap. 3.1.3.). In der Tab. 12 sind für jede Serumprobe die in den einzelnen IgG-ELISAs ermittelten Titer aufgeführt. Lagen die Indices dabei unterhalb der in Kap. 3.2.3.5.2. festgelegten Grenzwerte, wurde die Serumprobe als negativ bezeichnet. Die Festlegung der Endtiter und somit auch die endgültige Einstufung eines Serums als positiv oder negativ erfolgten nach den in Kap. 3.2.3.5.3. beschriebenen Kriterien. Die Endtiter (und die endgültige Beurteilung eines Serums) sind in der Tab. 13 aufgeführt, wo sie den im SFT ermittelten Endtitern gegenübergestellt werden. In der Tab. 13 wird deutlich, dass die Ergebnisse aus beiden Testverfahren hinsichtlich der Beurteilung der Seren als positiv oder negativ bei dem überwiegenden Teil der untersuchten Serumproben übereinstimmten. Unterschiedliche Ergebnisse wurden nur bei den Weißkopfmakis H6, H9 und H26 festgestellt. Das Serum von H6 wurde im März im SFT als negativ beurteilt, wies jedoch im ELISA einen Endtiter von 1:40 auf. Bei H9 wurde das Serum im SFT zum Untersuchungszeitpunkt März mit einem Endtiter von 1:4 als 4. Ergebnisse 101 Tab. 12: Im ELISA ermittelte Einzeltiter für die Serumproben der Weißkopfmakis Laufende Nummer Serum März A B C Serum Mai A B H1 neg.a/ neg. / neg. neg. / neg. / n.u.b neg. / neg. / n.u. neg. / neg. / neg. H2 2560 / 2560 / n.u. 2560 / 2560 / n.u. 5120 / 2560 / n.u. 1280 / 2560 / n.u. H3 2560 / 2560 / n.u. 2560 / 2560 / n.u. 5120 / 2560 / 1280 1280 / 1280 / n.u. H4 640 / 320 / 160 160 / 160 / 160 640 / 640 / n.u. 320 / 160 / n.u. H5 320 / 640 / n.u. 320 / 320 / n.u. 1280 / 640 / n.u. 320 / 160 / n.u. H6 160 / 10 10 10 / 10 / 10 160 / 40 / 20 H7 640 / 640 / n.u. 640 / 320 / n.u. 320 / 320 / n.u. 320 / 320 / n.u. H8 640 / 1280 / n.u. ---c --- --- H9 10 --- --- neg. / neg. / neg. H10 neg. / neg. / neg. neg. / neg. / neg. neg. / neg. / neg. neg. / neg. / neg. H21 640 / 640 / n.u. 640 / 320 / n.u. 640 / 640 / n.u. --- H22 1280 / 1280 / n.u. 640 / 1280 / n.u. 640 / 1280 / n.u. --- H23 160 / 160 / 160 160 / 320 / 160 160 --- H26 neg. / 10 / neg. neg. / neg. / 10 neg. / neg. / neg. neg. / neg. / 10 H31 neg. / neg. / neg. neg. / neg. / neg. neg. / neg. / neg. neg. / neg. / neg. H32 160 / 80 / 40 160 / 160 / n.u. 160 H33 neg. / neg. / neg. neg. / neg. / neg. neg. / neg. / neg. H35 --- --- --- neg. / neg. / n.u. --- --- neg. / neg. / neg. / neg. / neg. H36 a / 40 --b Serum Juni A B C / 10 / 10 C Serum Dezember A B C / 320 / 160 / 160 / n.u. --neg. / neg. / neg. c , negativ; , nicht untersucht; , keine Blutentnahme möglich grenzwertig und im Dezember mit einem Endtiter von > 1:64000 als hoch positiv beurteilt. Im IgGELISA ergab sich jedoch für beide Serumproben ein negatives Ergebnis. Das Serum von H26 wurde im ELISA zu allen vier Untersuchungszeitpunkten als negativ und im SFT als positiv beurteilt. Während im SFT bei den Tieren H6 und H9 eine Serokonversion nachgewiesen wurde (siehe Kap. 3.2.2.5.), blieben die im IgG-ELISA vorgenommenen Beurteilungen der Serumproben als positiv oder negativ bei allen Tieren über den gesamten Untersuchungszeitraum konstant. 102 4. Ergebnisse Tab. 13: Vergleich der im ELISA und SFT ermittelten Endtiter für die Serumproben der Weißkopfmakis Laufende März Nummer ELISA SFT Mai ELISA SFT Juni ELISA SFT Dezember ELISA SFT H1 negativ negativ negativ n.u.a negativ negativ negativ negativ H2 2560 1000 2560 n.u. 5120 4000 2560 >64000 H3 2560 256 2560 n.u. 2560 16000 1280 >64000 H4 320 64 160 n.u. 640 1000 320 >64000 H5 640 64 320 n.u. 1280 256 320 >64000 H6 40 negativ 10 1000 10 64 40 >64000 H7 640 64 640 n.u. 320 1000 320 >64000 b --- --- --- --- --- --- --- --- --- --- negativ >64000 H8 1280 H9 negativ 4 H10 negativ negativ negativ n.u. negativ negativ negativ negativ H21 640 64 640 n.u. 640 1000 --- --- H22 1280 256 1280 n.u. 1280 1000 --- --- H23 160 64 160 n.u. 160 1000 --- --- H26 negativ 16 negativ n.u. negativ 256 negativ 1000 H31 negativ negativ negativ n.u. negativ negativ negativ negativ H32 80 160 160 --- H33 negativ negativ negativ n.u. negativ negativ negativ negativ H35 --- --- --- --- negativ negativ --- --- negativ negativ 256 16 --- n.u. --- H36 --------a b , nicht untersucht; , keine Blutentnahme möglich 256 --- In der Abb. 4(A) sind für alle Weißkopfmakis die Mittelwerte der IgG-ELISA-Indices für die Erstuntersuchung, d. h. für den Zeitpunkt der ersten Probenahme, dargestellt. Die Verläufe der Serumtitrationen wurden in der Grafik entsprechend ihrer Beurteilung im SFT farbig gekennzeichnet. In der Abb. 4(A) wird deutlich, dass bei dem überwiegenden Teil der Serumproben eine positive Beurteilung im SFT mit entsprechend hohen ELISA-Indices einherging, wobei die jeweiligen Titrationskurven einen ähnlichen Verlauf nahmen wie die Titration des positiven Kontrollserums (siehe Kap.3.2.3.8.). Hingegen wiesen Serumproben mit einem negativen SFTErgebnis überwiegend niedrige Indexwerte auf, die unter den in Kap. 3.2.3.5.2. festgelegten 4. Ergebnisse 103 Grenzwerten lagen und in ihrem Verlauf der Titration des negativen Kontrollserums ähnelten. In der Abb. 4(B-F) sind für alle Weißkopfmakis die Mittelwerte der ELISA-Indices für die Erstuntersuchung als Säulendiagramm dargestellt. Jede Abbildung beinhaltet eine andere Serumverdünnung, wobei die Verdünnungen 1:10, 1:20, 1:40, 1:80 und 1:160 dargestellt sind. Die Säulen sind in den Abbildungen entsprechend der zuvor ermittelten SFT-Titer farbig markiert und mit der Nummer des entsprechenden Tieres gekennzeichnet. Die Reihenfolge der Säulen wurde dabei durch die Höhe des SFT-Titers bestimmt. Der Abb. 4(B-F) ist zu entnehmen, dass es bei dem überwiegenden Teil der Serumproben eine positive Korrelation zwischen Höhe des SFT-Titers und Höhe der ELISA-Indices gab. Zudem wird in der Abb. 4(B-F) deutlich, dass es bei Seren, die einen niedrigen Titer im ELISA aufwiesen, zu einem raschen Abfall der Indexwerte unterhalb des Grenzwertes kam. So wurde der Weißkopfmaki H32 bei der Erstuntersuchung im ELISA bis zu einer Verdünnungsstufe von 1:80 als positiv, ab einer Serumverdünnung von 1:160 jedoch als negativ beurteilt. Sollen im ELISA auch Tiere mit einem niedrigen Titer erfasst werden, sollte eine Titration daher möglichst ab einer Verdünnung von 1:10 durchgeführt werden. In der Abb. 5(A-C) sind die Mittelwerte der ELISA-Indices aus dem IgG-ELISA bei einer Serumverdünnung von 1:10 für die Untersuchungszeitpunkte März, Juni und Dezember als Säulendiagramm dargestellt und entsprechend ihrer Beurteilung im SFT farbig markiert. Da für die Serumproben, die im Mai gewonnen wurden, nur für den Weißkopfmaki H6 ein SFT-Ergebnis vorlag (siehe Kap. 3.2.2.5.), wurde dieser Untersuchungszeitpunkt nicht graphisch dargestellt. Die Säulen sind in den Abbildungen mit der Nummer der entsprechenden Tiere gekennzeichnet und nach Größe der Indexwerte bei der Untersuchung im März sortiert. In der Abb. 5(A-C) wird deutlich, dass sich die im IgG-ELISA ermittelten Ergebnisse bei allen Weißkopfmakis über den gesamten Untersuchungszeitraum konstant zeigten, während im SFT hinsichtlich der Beurteilung als positiv oder negativ bei den Weißkopfmakis H6 und H9 eine Serokonversion nachgewiesen wurde (siehe auch Kap. 3.2.2.5.). 104 4. Ergebnisse 1 ELISA-Index 1 0,8 0,6 0,4 0,8 0,6 0,4 SFT-positiv SFT-negativ Tiernum m er SFT-Titer > 256 SFT-Titer = 16 SFT-grenzw ertig C 1:20 1 1 ELISA-Index 1,2 0,6 0,4 SFT-Titer = 64 SFT-negativ D 1:40 1,2 0,8 SFT-Titer = 256 SFT-Titer = 4 0,8 0,6 0,4 0,2 0 0 2 3 8 22 4 21 5 7 23 32 26 9 6 1 10 31 33 35 36 0,2 2 3 8 22 4 21 5 7 23 32 26 9 6 1 10 31 33 35 36 ELISA-Index 2 3 8 22 4 21 5 7 23 32 26 9 6 1 10 31 33 35 36 20480 5120 10240 2560 1280 640 320 80 0 160 0 40 0,2 20 0,2 reziproke Serum verdünnung B 1:10 1,2 10 ELISA-Index A 1,2 Tiernum m er Tiernum m er SFT-Titer > 256 SFT-Titer = 256 SFT-Titer = 64 SFT-Titer >256 SFT-Titer = 256 SFT-Titer = 64 SFT-Titer = 16 SFT-Titer = 4 SFT-negativ SFT-Titer = 16 SFT-Titer = 4 SFT-negativ E 1 ELISA-Index 1 0,8 0,6 0,4 F 1:160 1,2 0,8 0,6 0,4 0,2 0 0 2 3 8 22 4 21 5 7 23 32 26 9 6 1 10 31 33 35 36 0,2 2 3 8 22 4 21 5 7 23 32 26 9 6 1 10 31 33 35 36 ELISA-Index 1:80 1,2 Tiernum m er Tiernum m er SFT-Titer >256 SFT-Titer = 256 SFT-Titer = 64 SFT-Titer > 256 SFT-Titer = 256 SFT-Titer = 64 SFT-Titer = 16 SFT-Titer = 4 SFT-negativ SFT-Titer = 16 SFT-Titer = 4 SFT-negativ Abb. 4: Erstuntersuchung der Weißkopfmakis im IgG-ELISA 4. Ergebnisse 105 A März 1,2 ELISA-Index 1 0,8 0,6 0,4 0,2 2 8 3 22 5 21 7 4 32 23 6 9 26 1 31 10 33 36 35 0 Tiernum m er SFT-positiv SFT-grenzw ertig SFT-negativ B Juni 1,2 ELISA-Index 1 0,8 0,6 0,4 0,2 2 8 3 22 5 21 7 4 32 23 6 9 26 1 31 10 33 36 35 0 Tiernum m er SFT-positiv SFT-negativ Dezember C 1,2 ELISA-Index 1 0,8 0,6 0,4 0,2 2 8 3 22 5 21 7 4 32 23 6 9 26 1 31 10 33 36 35 0 Tiernum m er SFT-positiv SFT-negativ Abb. 5: Untersuchung der Weißkopfmakis im IgG-ELISA bei einer Serumverdünnung von 1:10 zum Untersuchungszeitpunkt März, Juni und Dezember 106 4. Ergebnisse 4.2.2. Kattas Es wurden die Serumproben aller 7 Kattas im IgG-ELISA auf Antikörper gegen T. gondii untersucht. Von dem Katta H24 waren zwei Serumproben vorhanden (Untersuchungszeitpunkte März und Juni), bei den übrigen Tieren erfolgte nur eine Blutentnahme. In der Tab. 14 sind die im IgG-ELISA ermittelten Einzel- und Endtiter sowie die Endtiter aus dem SFT für die Kattas H24 und H25 aufgeführt. Die Serumproben der Kattas J7-J9, B1 und B2 waren sowohl im IgG-ELISA als auch im SFT bei allen Untersuchungen negativ. Hinsichtlich der Einstufung der Seren als positiv oder negativ lässt sich somit für alle 7 untersuchten Tiere eine Übereinstimmung der Ergebnisse aus beiden Testverfahren feststellen. In der Abb. 6(A) sind die Mittelwerte der ELISA-Indices für die Erstuntersuchung der Kattas dargestellt. Die Verläufe der Serumtitrationen sind entsprechend ihrer Beurteilung im SFT farbig gekennzeichnet. In der Abb. 6(B) sind für die Serumverdünnungsstufe 1:10 die Mittelwerte der ELISA-Indices als Säulendiagramm dargestellt. Die Säulen sind entsprechend der zuvor ermittelten SFT-Titer farbig markiert und mit der laufenden Nummer der Tiere gekennzeichnet. Der Abb. 6(AB) ist zu entnehmen, dass die Kattas H24 und H25, die bei der Erstuntersuchung im SFT beide einen Titer ≥ 1:256 aufwiesen, sich im IgG-ELISA durch hohe Indexwerte auszeichneten, die deutlich über den in Kap. 3.2.3.5.2. festgelegten Grenzwerten lagen, während die SFT-negativen Kattas niedrige ELISA-Indices aufwiesen, die unterhalb der Cut-offs lagen. Tab. 14: Vergleich der im ELISA und im SFT ermittelten Titer für die Serumproben der Kattas H24 und H25 Laufende Nummer H24 H25 a März ELISAa Einzeltiter 2560 / 2560 1280 / 1280 , keine Probenahme SFT Juni ELISA Einzeltiter Endtiter SFT 4000 640 / 640 640 4000 --- --- Endtiter 2560 1280 256 a --- 4. Ergebnisse 107 1 ELISA-Index 1 0,8 0,6 0,4 0,8 0,6 0,4 SFT-positiv 5120 SFT-negativ 10240 2560 1280 640 320 160 0 80 0 40 0,2 20 0,2 reziproke Serum verdünnung B 1:10 1,2 10 ELISA-Index A 1,2 H24 H25 J7 J8 J9 B1 B2 Tiernum m er SFT-Titer > 256 SFT-Titer = 256 SFT-negativ Abb. 6: Erstuntersuchung der Kattas im IgG-ELISA 4.2.3. Totenkopfaffen Es wurden die Serumproben von allen 24 Totenkopfaffen im IgG-ELISA auf Antikörper gegen T. gondii untersucht. Bei den 14 aus Hodenhagen stammenden Tieren waren bis zu vier verschiedene Serumproben vorhanden, die entsprechend dem Untersuchungsschema der Weißkopfmakis zu unterschiedlichen Zeitpunkten gewonnen wurden (siehe Kap. 3.1.3). Während im SFT sämtliche Serumproben der Totenkopfaffen als negativ beurteilt wurden (siehe Kap. 3.2.2.5.), waren bei Untersuchung der Seren im IgG-ELISA deutliche Unterschiede zwischen den Indexwerten der einzelnen Tiere festzustellen. Eine Festlegung von ELISA-Titern war jedoch bei diesen Tieren nicht möglich, da die für die Weißkopfmakis und Kattas verwendeten Grenzwerte bei den Totenkopfaffen nicht benutzt werden konnten. Bei den Totenkopfaffen wiesen bei Anwendung der Grenzwerte nämlich auch solche Seren einen Titer von bis zu 1:2560 auf, bei denen nur niedrige Indexwerte festgestellt wurden und die in ihrem Verlauf der Titration des negativen Kontrollserums ähnelten. Eine endgültige Einstufung der Seren als positiv oder negativ war unter diesen Umständen im IgG-ELISA nicht möglich. In der Abb. 7(A, C, E) sind die Mittelwerte der ELISA-Indices für die Erstuntersuchung der Totenkopfaffen dargestellt, wobei die Serumverläufe danach gekennzeichnet sind, ob die Mittelwerte der Indices bei einer Serumverdünnung von 1:10 über oder unter dem in Kap. 3.2.3.5.2. 108 4. Ergebnisse festgelegten Grenzwert von 0,428 lagen. Die 24 untersuchten Totenkopfaffen stammten aus drei unterschiedlichen Beständen (siehe Kap. 3.1.3) und wurden entsprechend ihrer Herkunft in verschiedenen Abbildungen dargestellt. In der Abb. 7(B, D, F) sind die Mittelwerte der ELISAIndices für die Erstuntersuchung der Totenkopfaffen bei einer Serumverdünnung von 1:10 als Säulendiagramm dargestellt. Die Säulen wurden in der Abb. 7(B, D, F) mit der laufenden Nummer der Tiere gekennzeichnet und nach Größe der Indexwerte sortiert. Die farbige Markierung der Säulen richtete sich danach, ob die Mittelwerte der ELISA-Indices bei einer Serumverdünnung von 1:10 über oder unter dem Grenzwert von 0,428 lagen. Der Abb. 7 ist zu entnehmen, dass bei 11 von 14 Totenkopfaffen aus Hodenhagen, bei 1 von 5 Totenkopfaffen aus Jaderberg und bei 3 von 5 Totenkopfaffen aus Braunschweig die Mittelwerte der ELISA-Indices für die Erstuntersuchung bei einer Serumverdünnung von 1:10 über 0,428 lagen. Bei den aus Hodenhagen stammenden Totenkopfaffen waren die im IgG-ELISA ermittelten Titrationskurven breit gestreut und wiesen in keinem Fall einen Plateaubereich auf, wie es bei der Titration des positiven Kontrollserums der Fall war (Kap. 3.2.3.8.). Bei den aus Jaderberg und Braunschweig stammenden Totenkopfaffen waren die Serumverläufe der Tiere, deren Indexwerte über 0,428 lagen (J1, B3, B6 und B7) deutlich von den Serumverläufen der Tiere abgesetzt, die unter dem Grenzwert lagen. Der Verlauf der Titrationskurve ähnelte dabei in jedem Fall der Titration des positiven Kontrollserums. Die für die Untersuchungszeitpunkte Mai, Juni und Dezember im IgG-ELISA ermittelten Indices für die aus Hodenhagen stammenden Totenkopfaffen waren mit den in der Erstuntersuchung festgestellten Werten vergleichbar. Da bei der Untersuchung der Totenkopfaffen im IgG-ELISA deutliche Unterschiede zwischen den Serumproben der einzelnen Tiere festgestellt wurden, zeigten die Ergebnisse im Vergleich mit dem SFT eine große Diskrepanz. 4. Ergebnisse 109 A 1,2 1,2 ELISA-Index 1 0,8 0,6 0,4 0,4 20 28 29 16 13 14 17 11 15 30 18 19 27 12 10240 5120 2560 640 1280 320 160 80 40 0 20 0 Tiernum m er SFT-negativ, Mittelw ert ELISA-Index > Grenzw ert SFT-negativ, Mittelw ert ELISA-Index > Grenzw ert SFT-negativ, Mittelw ert ELISA-Index < Grenzw ert SFT-negativ, MIttelw ert ELISA-Index < Grenzw ert C 1,2 1,2 1 1 ELISA-Index 1,4 0,8 0,6 0,4 0,8 0,6 0,4 10240 5120 2560 640 1280 320 160 80 0 40 0,2 0 20 0,2 reziproke Serum verdünnung D Jaderberg (1 : 10) 1,4 10 J1 J2 J3 J4 J5 Tiernum m er SFT-negativ, Mittelw ert ELISA-Index > Grenzw ert SFT-negativ, Mittelw ert ELISA-Index > Grenzw ert SFT-negativ, Mittelw ert ELISA-Index < Grenzw ert SFT-negativ, Mittelw ert ELISA-Index < Grenzw ert E Braunschweig 1,4 1,2 1,2 ELISA-Index 1 0,8 0,6 0,4 1 0,8 0,6 0,4 5120 2560 1280 640 320 160 80 40 0 20 0,2 0 10 0,2 reziproke Serum verdünnung F Braunschweig (1 : 10) 1,4 10240 ELISA-Index 0,6 0,2 Jaderberg ELISA-Index 1 0,8 0,2 reziproke Serum verdünnung B Hodenhagen (1 : 10) 1,4 10 ELISA-Index Hodenhagen 1,4 B6 B3 B7 B4 B5 Tiernum m er SFT-negativ, Mittelw ert ELISA-Index > Grenzw ert SFT-negativ, Mittelw ert ELISA-Index > Grenzw ert SFT-negativ, Mittelw ert ELISA-Index < Grenzw ert SFT-negativ, Mittelw ert ELISA-Index < Grenzw ert Abb. 7 : Erstuntersuchung der Totenkopfaffen im IgG-ELISA 110 4. Ergebnisse 4.2.4. Andere Neuweltaffen Außer den Totenkopfaffen wurden weitere Neuweltaffen im IgG-ELISA untersucht. Es wurden insgesamt 10 Tiere auf Antikörper gegen T. gondii getestet, wobei es sich um 6 verschiedene Affenspezies handelte (siehe Kap. 3.1.3). Ein SFT-Ergebnis lag nur für den Weißbüschelaffen J10 vor. Die Serumprobe des Tieres wurde als negativ beurteilt (siehe Kap. 3.2.2.5.). Aus den gleichen Gründen wie bei den Totenkopfaffen (siehe Kap. 4.2.3.) ließen sich auch bei diesen Tieren weder Titer festlegen noch eine endgültige Einstufung der Seren vornehmen. In der Abb. 8(A) sind die Mittelwerte der ELISA-Indices dargestellt. Die Verläufe der Serumtitrationen wurden danach gekennzeichnet, ob die Mittelwerte der ELISA-Indices bei einer Serumverdünnung von 1:10 über oder unter dem in Kap. 3.2.3.5.2. festgelegten Grenzwert von 0,428 lagen. In der Abb. 8(B) sind die Mittelwerte der ELISA-Indices für die Serumverdünnungsstufe 1:10 als Säulendiagramm dargestellt. Die Säulen wurden in den Abbildungen mit der laufenden Nummer der Tiere gekennzeichnet und nach Größe der Indexwerte sortiert. Die farbige Markierung der Säulen richtete sich danach, ob die Mittelwerte der ELISAIndices über oder unter 0,428 lagen. Der Abb. 8(A-B) ist zu entnehmen, dass bei M2 und M7 die Mittelwerte der ELISA-Indices bei einer Serumverdünnung von 1:10 etwas über 0,428 lagen. Es ließ sich jedoch feststellen, dass die ermittelten Indexwerte zwischen den einzelnen Tieren keine großen Unterschiede aufwiesen, sondern insgesamt relativ niedrig waren. Anhand des Serumverlaufes von M2 in Abb. 8(A) wird deutlich, dass die Cut-offs für diese Tiere nicht geeignet waren, da diese Serumprobe trotz der niedrigen Indices bei Anwendung der Grenzwerte einen Titer von 1:2560 aufweisen würde. Die Titrationskurve von M2 wurde in Abb. 8(A) durch einen Pfeil gekennzeichnet. 4. Ergebnisse 111 1,2 1 1 0,6 M9 M3 M5 J10 M1 10240 5120 2560 1280 640 320 80 160 0 40 0,2 0 20 0,2 M6 0,4 M4 0,4 0,8 M8 0,6 M7 0,8 M2 ELISA-Index 1,2 reziproke Serum verdünnung B 1:10 1,4 10 ELISA-Index A 1,4 Tiernum m er Mittelw ert ELISA-Index > Grenzw ert Mittelw ert ELISA-Index > Grenzw ert Mittelw ert ELISA-Index < Grenzw ert Mittelw ert ELISA-Index < Grenzw ert Abb. 8: Untersuchung der anderen Neuweltaffen im IgG-ELISA 4.2.5. Rhesusaffen Es wurden alle 19 Rhesusaffen im IgG-ELISA auf Antikörper gegen T. gondii untersucht. Ergebnisse aus dem SFT lagen für diese Tiere nicht vor. Die in Kap. 3.2.3.5.2. festgelegten Grenzwerte ließen sich bei dieser Spezies ebenfalls nicht anwenden, da alle untersuchten Tiere Indices aufwiesen, die weit über den Cut-offs lagen. Eine Titerfestlegung und eine endgültige Beurteilung der Seren im IgG-ELISA war deshalb ohne geeignete Kontrollseren auch bei den Rhesusaffen nicht möglich. In der Abb. 9(A) sind die Mittelwerte der ELISA-Indices dargestellt. Die Verläufe der Serumtitrationen sind danach gekennzeichnet, ob die Mittelwerte der ELISA-Indices bei einer Serumverdünnung von 1:10 über 1,2 oder unter 0,95 lagen. In der Abb. 9(B) sind für die Serumverdünnungsstufe 1:10 die Mittelwerte der ELISA-Indices als Säulendiagramm dargestellt. Die Säulen wurden in den Abbildungen mit der laufenden Nummer der Tiere gekennzeichnet und nach Größe der Indexwerte sortiert. Die farbige Markierung der Säulen richtete sich danach, ob die Mittelwerte der ELISA-Indices bei einer Serumverdünnung von 1:10 über 1,2 oder unter 0,95 lagen. 112 4. Ergebnisse Der Abb. 9(A-B) ist zu entnehmen, dass bei 13 Rhesusaffen die Mittelwerte der Indices bei einer Serumverdünnung von 1:10 über 1,2 und bei 6 Rhesusaffen unter 0,95 lagen. In der Abb. 9(A) lassen sich eindeutige Unterschiede zwischen den Titrationskurven der einzelnen Tiere feststellen. Die Serumverläufe der Rhesusaffen, bei denen die Indexwerte unter 0,95 lagen, nahmen einen konkaven Verlauf, während die Titrationskurven der übrigen Tiere konkav bis konvex waren und zum Teil einen Plateaubereich aufwiesen, wie es auch bei der Titration des positiven Kontrollserums der Weißkopfmakis der Fall war (siehe Kap. 3.2.3.8.). 1:10 1,4 1,4 1,2 1,2 1 0,8 0,6 0,4 1 0,8 0,6 0,4 Mittelw ert ELISA-Index bei 1:10 > 1,2 MIttelw ert ELISA-Index bei 1:10 < 0,95 10240 5120 2560 1280 640 320 160 80 0 40 0,2 0 20 0,2 reziproke Serum verdünnung B R05 R06 R03 R13 R07 R02 R10 R09 R11 R08 R04 R01 R12 R17 R14 R16 R18 R19 R15 ELISA-Index 1,6 10 ELISA-Index A 1,6 Tiernum m er Mittelw ert ELISA-Index bei 1:10 > 1,2 Mittelw ert ELISA-Index bei 1:10 < 0,95 Abb. 9 : Erstuntersuchung der Rhesusaffen im IgG-ELISA 4.3. Untersuchung von Serumproben nicht humaner Primaten im IgGAviditäts-ELISA zur Bestimmung des Infektionsstadiums der T.-gondiiInfektionen Um beurteilen zu können, ob es sich um akute oder chronische T.-gondii-Infektionen handelte, wurde mit allen Serumproben, bei denen die Indexwerte im IgG-ELISA über den in Kap. 3.2.3.5.2. festgelegten Grenzwerten lagen, ein IgG-Aviditäts-ELISA durchgeführt. Wurde ein deutlicher Unterschied zwischen den Indexwerten des Testansatzes ohne Harnstoff und des Testansatzes mit Harnstoff festgestellt, so deutete dies auf ein positives Ergebnis und somit auf ein frühes Stadium 4. Ergebnisse 113 der T.-gondii-Infektion hin. Bestand hingegen kaum ein Unterschied zwischen den Indexwerten der Testansätze, wurde dies als Hinweis auf eine chronische T.-gondii-Infektion der Tiere gewertet und deutete auf ein negatives Ergebnis hin. Da es bislang keine vergleichbaren Untersuchungen mit Seren von nicht humanen Primaten im IgG-Aviditäts-ELISA gibt, konnte keine endgültige Auswertung dieses Testverfahrens erfolgen. Wurde innerhalb einer untersuchten Spezies jeweils eine Serumprobe ermittelt, bei der ein Unterschied zwischen den Indexwerten bestand, sowie eine, die auf ein negatives Ergebnis hindeutete, wurden zwei entsprechende Serumtitrationen in diesem Kapitel dargestellt. Die für die übrigen Serumproben ermittelten Ergebnisse sind im Anhang in Kap. 9.3. aufgeführt. Die Ergebnisse aus dem IgG-Aviditäts-ELISA wurden alle auf ihre Reproduzierbarkeit hin überprüft, d. h. es wurden mit jeder Serumprobe mindestens zwei voneinander unabhängige Untersuchungen durchgeführt. 4.3.1. Weißkopfmakis Im IgG-Aviditäts-ELISA wurden alle Verlaufsblutproben der Weißkopfmakis H2-H8, H21-H23 und H32 untersucht. Bei H6 und H23 wurden bei der Erstuntersuchung im März sowie bei H23 auch bei der zweiten Probennahme im Mai geringe Unterschiede zwischen den Indexwerten des Testansatzes ohne Harnstoff und des Testansatzes mit Harnstoff festgestellt. Bei allen übrigen Serumproben der Weißkopfmakis bestand sowohl bei der Erstuntersuchung als auch bei den nachfolgenden Untersuchungszeitpunkten im IgG-Aviditäts-ELISA kaum ein Unterschied zwischen den Indexwerten des Testansatzes ohne Harnstoff und des Testansatzes mit Harnstoff. In der Abb. 10 sind die im IgG-Aviditäts-ELISA ermittelten Ergebnisse für die Weißkopfmakis H6 und H4 bei der Erstuntersuchung im März dargestellt. 114 4. Ergebnisse A B H4, März 0,8 0,6 0,6 ELISA-Index 0,4 0,2 0 0,4 0,2 ohne Harnstoff mit Harnstoff ohne Harnstoff 1280 reziproke Serum verdünnung 640 320 160 80 40 20 1280 reziproke Serum verdünnung 640 320 160 80 40 20 10 0 10 ELISA-Index H6, März 0,8 mit Harnstoff Abb. 10: Im IgG-Aviditäts-ELISA ermittelte Ergebnisse für die Weißkopfmakis H6 und H4 (März) 4.3.2. Kattas Im IgG-Aviditäts-ELISA wurden die Serumproben der Kattas H24 und H25 aus der Erstuntersuchung im März untersucht. Bei beiden Proben bestand kaum ein Unterschied zwischen den Indexwerten des Testansatzes ohne Harnstoff und des Testansatzes mit Harnstoff. 4.3.3. Totenkopfaffen Im IgG-Aviditäts-ELISA wurden die Serumproben der Totenkopfaffen H11, H13-H18, H20, H28H30, J1, B3, B6 und B7 aus der Erstuntersuchung untersucht. Bei H16, H17, J1, B3, B6 und B7 wurden deutliche, bei H11, H20, H28 und H29 wurden geringe und bei H13, H14, H15, H18 und H30 wurden kaum Unterschiede zwischen den Indexwerten des Testansatzes ohne Harnstoff und des Testansatzes mit Harnstoff festgestellt. In der Abb. 11 sind die Titrationskurven der Tiere B3 und H18 dargestellt. Bei den aus Hodenhagen stammenden Totenkopfaffen stand von den Serumproben der anderen Untersuchungszeitpunkte nicht ausreichend viel Serum zur Verfügung, so dass der IgG-AviditätsELISA mit diesen Proben nicht durchgeführt werden konnte. 4. Ergebnisse 115 A 0,8 ohne Harnstoff mit Harnstoff reziproke Serum verdünnung ohne Harnstoff 1280 640 320 160 1280 640 320 160 0 80 0 40 0,2 20 0,2 80 0,4 40 0,4 0,6 20 0,6 10 ELISA-Index 0,8 reziproke Serum verdünnung B H18 1 10 ELISA-Index B3 1 mit Harnstoff Abb. 11: Im IgG-Aviditäts-ELISA ermittelte Ergebnisse für die Totenkopfaffen B3 und H18 (März) 4.3.4. Andere Neuweltaffen Im IgG-Aviditäts-ELISA wurden die Serumproben der Neuweltaffen M2 und M7 untersucht. Bei beiden Proben wurden kaum Unterschiede zwischen den Indexwerten des Testansatzes ohne Harnstoff und des Testansatzes mit Harnstoff festgestellt. 4.3.5. Rhesusaffen Im IgG-Aviditäts-ELISA wurden die Serumproben aller 19 Rhesusaffen untersucht. Bei R2, R6, R7, R8, R10 und R11 wurden deutliche, bei R1, R3, R4, R5, R9, R12, R13 und R17 wurden geringe und bei R14, R15, R16, R18 und R19 wurden kaum Unterschiede zwischen den Indexwerten des Testansatzes ohne Harnstoff und des Testansatzes mit Harnstoff festgestellt. In der Abb. 12 sind die Ergebnisse der Tiere R8 und R16 dargestellt. 116 4. Ergebnisse A 1,2 1 1 ohne Harnstoff mit Harnstoff reziproke Serum verdünnung ohne Harnstoff 1280 640 320 1280 640 320 160 80 0 40 0,2 0 20 0,2 160 0,4 80 0,4 0,6 40 0,6 0,8 20 0,8 10 ELISA-Index 1,2 reziproke Serum verdünnung B R16 1,4 10 ELISA-Index R8 1,4 mit Harnstoff Abb. 12: Im IgG-Aviditäts-ELISA ermittelte Ergebnisse für die Rhesusaffen R8 und R16 4.4. Untersuchung der Serumprobe der Maus im SFT auf Antikörper gegen T. gondii Bei der Untersuchung der Serumprobe der Maus (siehe Kap. 3.2.4.2.) im SFT auf Antikörper gegen T. gondii wurde ein Titer von 1:256 ermittelt. 4.5. Untersuchung von Serumproben der Mäuse im IFAT auf Antikörper gegen T. gondii In der Tab. 15 sind für alle 4 im IFAT untersuchten Mäuse (siehe Kap. 3.2.4.2) die in den Verdünnungsstufen 1:1280 bis 1:81920 jeweils vorgenommenen Bewertungen aufgeführt. Da sich bei einer Serumverdünnung von 1:20 bis 1:1280 für alle Tiere eine Bewertung von 2+ ergab und ab einer Verdünnung von 1:81920 alle Seren als negativ eingestuft wurden, wurden diese Ergebnisse in der Tab. 15 ausgelassen. Für Maus 1 ergab sich ein Titer von 1:20480 und für die Mäuse 2 bis 4 ein Titer von 1:10240. 4. Ergebnisse 117 Tab. 15: Im IFAT ermittelte Ergebnisse für die Serumproben der Mäuse Serumverdünnunga laufende Nummer der Maus 1 2 3 a 4 1:1280 2+ 2+ 2+ 2+ 1:2560 1+ 1+ 1+ 2+ 1:5120 1+ 1+ 1+ 1+ 1:10240 1+ 1+ 1+ 1+ 1:20480 1+ trace trace trace 1:40960 trace trace negativ trace 1:81920 negativ negativ negativ negativ , die Serumverdünnungen 1:20 bis 1:640 sowie 1:163840 bis 1:655360 sind nicht aufgeführt 4.6. Histologische Untersuchung von Gewebeproben eines verstorbenen Kattas Bei der histologischen Untersuchung der Gewebeproben wurden sowohl im Gehirn des Kattas H24 als auch im Gehirn und in der Lunge der Maus (siehe Kap. 3.2.4.2.) Gewebezysten von T. gondii nachgewiesen. In der Abb. 13 ist eine Gewebezyste aus dem Gehirn des Kattas dargestellt. Die Aufnahme erfolgte mit dem 40er Objektiv (400fache Vergrößerung). 60 µm Abb. 13: Gewebezyste von T. gondii im Gehirn des Kattas H24 (H.&E. gefärbt) 118 4. Ergebnisse 4.7. Reproduzierbarkeit des IgG-ELISAs Zur Überprüfung der Reproduzierbarkeit des IgG-ELISAs erfolgte zunächst eine wiederholte Titration des positiven Kontrollserums. Aus den dabei ermittelten optischen Dichten wurde für die Serumverdünnungsstufen 1:10 bis 1:2560 der Mittelwert ( )gebildet und die Standardabweichung (SD) berechnet. Anschließend wurde der Variationskoeffizient (VK) nach der folgenden Formel ermittelt: VK = SD/ · 100 In der Tab. 16 sind für die Serumverdünnungsstufen 1:10 bis 1:2560 die Anzahl der in die Berechnung einbezogenen optischen Dichten (n) aufgeführt und die daraus berechneten Mittelwerte, Standardabweichungen und Variationskoeffizienten dargestellt. Ein Variationskoeffizient < 5 sprach für eine gute Reproduzierbarkeit, ein Variationskoeffizient < 10 war akzeptabel. Tab. 16: Berechnung des Variationskoeffizienten SerumverAnzahl der Mittelwert dünnung ODsa (n) ( ) Standardabweichung (SD) Variationskoeffizient (VK = s / · 100) 1:10 6 1,449 0,106 7,3 1:20 7 1,482 0,077 5,2 1:40 8 1,524 0,051 3,4 1:80 8 1,441 0,070 4,7 1:160 8 1,267 0,092 7,3 1:320 8 0,987 0,097 9,8 1:640 8 0,710 0,084 11,8 1:1280 8 0,497 0,083 16,7 1:2560 8 0,340 0,056 16,5 a , optische Dichten 5. Diskussion der Ergebnisse 119 5. DISKUSSION DER ERGEBNISSE 5.1. Problematik von T.-gondii-Infektionen bei nicht humanen Primaten und Zielsetzung dieser Dissertation Einige nicht humane Primaten gehören zu einer Gruppe von hochempfänglichen Spezies, die nach einer Infektion mit T. gondii an einer akuten disseminierten Toxoplasmose erkranken (INNES 1997). Insbesondere bei Neuweltaffen und Lemuren kommt es durch diesen Parasiten immer wieder zu Todesfällen. Da alle nicht humanen Primaten geschützte Tierarten sind, die in den Anhängen I und II des Washingtoner Artenschutzabkommens (CITES) aufgelistet sind, bedeuten solche Tierverluste nicht nur einen finanziellen Schaden für die jeweiligen Besitzer, sondern sind auch gegenüber dem Artenschutz relevant. Neben dem Tod einzelner Tiere können auf diese Weise auch Störungen innerhalb von Zuchtprogrammen verursacht werden, was bei Spezies, die vom Aussterben bedroht sind, besonders verheerend ist. So führt z. B. der Tod des dominanten Männchens zu schwerwiegenden Problemen in einer Zuchtgruppe, da sich die Integration neuer Tiere oft schwierig gestaltet. Prinzipiell besteht zwar die Möglichkeit einer Therapie der akuten Toxoplasmose, der Beginn der Behandlung muss jedoch sehr frühzeitig erfolgen, um bei den Tieren eine Rekonvaleszenz zu erreichen. Die Durchführung einer spezifischen Therapie scheitert deshalb in der Regel daran, dass die Erkrankung auf Grund der unspezifischen klinischen Symptome nicht oder wegen des akuten bis perakuten Verlaufes zu spät erkannt wird. In der Vergangenheit wurden Toxoplasmosen bei nicht humanen Primaten daher meistens erst in der Sektion diagnostiziert (JUAN-SALLES et al. 1997). Dabei erfolgte die Diagnose für die Therapie ebenfalls erkrankter Tiere in der Regel zu spät. Eine geeignete Vakzine als Schutz vor der Toxoplasmose steht für nicht humane Primaten zurzeit nicht zur Verfügung. Für Schafe ist ein attenuierter Lebendimpfstoff kommerziell erhältlich, der diese Tiere vor T.-gondii-verursachten Aborten schützt. Er enthält den T.-gondii-Stamm S48, der keine Gewebezysten in den Zwischenwirten bildet. Bei Schafen induziert der Impfstoff eine langanhaltende protektive Immunität, wobei eine Boosterung des Antikörpertiters auf natürlichem Weg durch die Aufnahme von sporulierten Oozysten auf der Weide stattfindet. Die Vakzine besitzt 120 5. Diskussion der Ergebnisse für Schafe keine nennenswerten Nebenwirkungen. Der Einsatz dieses Impfstoffs bei nicht humanen Primaten wäre jedoch ein nicht kalkulierbares Risiko für die Tiere. Da bei einer Lebendvakzine Mutationen des Impfstammes nicht ausgeschlossen werden können, wäre es denkbar, dass sich die Parasiten aus dem Impfstamm enzystieren und bei einer Immunsuppression des geimpften Tieres zu einer Reaktivierung gelangen. Auf diese Weise könnten die gleichen Krankheitssymptome hervorgerufen werden wie nach einer natürlichen Infektion mit dem Parasiten (HO-YEN 1992). Die Erprobung einer solchen Vakzinierung bei nicht humanen Primaten wäre somit nur als Tierversuch unter den dafür geltenden gesetzlichen Bestimmungen durchführbar. Das Krankheitsbild einer akuten Toxoplasmose bei nicht humanen Primaten ist variabel und unspezifisch (McKISSICK et al. 1968). Allein auf Grund des klinischen Bildes lässt sich die Diagnose daher nicht eindeutig stellen. Um akute Toxoplasmosen bei nicht humanen Primaten nicht erst in der Sektion sondern auch an lebenden Tieren zu diagnostizieren, ist die Entwicklung eines geeigneten serologischen Testverfahrens notwendig. Für erkrankte Tiere kann eine schnelle Diagnosefindung gefolgt von der Einleitung einer spezifischen Therapie lebensrettend sein. Es kann allerdings, z. B. durch den Versand der Serumproben, auch hier eine Zeitverzögerung entstehen und der Nachweis der T.-gondii-Infektion für die Therapie erkrankter Tiere ebenfalls zu spät erfolgen. Es müssen daher prophylaktische Maßnahmen bei der Bekämpfung der Toxoplasmose im Vordergrund stehen, um eine Infektion der nicht humanen Primaten mit dem Erreger zu verhindern. Dies ist insbesondere deshalb erforderlich, weil selbst eine rechtzeitig eingeleitete Therapie keine Garantie für das Überleben der Tiere ist. Akute Toxoplasmosen wurden bei nicht humanen Primaten bislang nur in Gefangenschaft beobachtet, d. h. die Tiere befanden sich zum Zeitpunkt der Erkrankung in zoologischen Gärten, in Forschungseinrichtungen oder wurden von Privatpersonen gehalten. In den meisten Fällen konnten die genauen Infektionswege dabei nicht ermittelt werden, sondern basierten nur auf Vermutungen. Dies begründet sich einerseits damit, dass in der Regel eine Vielzahl an möglichen Infektionsquellen bestand, und andererseits durch den Umstand, dass meistens nicht einmal bekannt war, ob es sich bei den Erkrankungen um Neuausbrüche, d. h. um frische Infektionen, oder um die Reaktivierung von chronischen Infektionen handelte. Bei Wildfängen kann im Falle einer Reaktivierung die Infektion mit dem Erreger bereits im natürlichen Habitat stattgefunden haben. 5. Diskussion der Ergebnisse 121 Über die immunologischen Grundlagen von T.-gondii-Infektionen bei nicht humanen Primaten ist bislang ebenfalls wenig bekannt. So konnte bisher kein objektiv belegbarer Grund dafür gefunden werden, warum Neuweltaffen und Lemuren signifikant häufiger mit letalen Erkrankungen auf eine T.-gondii-Infektion reagieren als Altweltaffen (BRACK et al. 1995b). Neuweltaffen sind zwar in der Lage, Antikörper gegen T. gondii auszubilden, deren Nachweis gelang in der Vergangenheit bei diesen Spezies jedoch weit weniger häufig als bei Altweltaffen. Es ist daher anzunehmen, dass Neuweltaffen wesentlich seltener eine chronische T.-gondii-Infektion ausbilden als Altweltaffen. Vermutlich handelt es sich bei den meisten der bei Neuweltaffen beobachteten Toxoplasmosen um frische Infektionen, bei denen es im Falle eines perakuten Verlaufs gar nicht erst zu einer Serokonversion kommt. Mit Hilfe eines serologischen Tests, der dafür geeignet ist, epidemiologische Reihenuntersuchungen z. B. in zoologischen Gärten durchzuführen, könnte frühzeitig festgestellt werden, ob der Parasit in den entsprechenden Tierbeständen vorkommt. Dabei wäre es sinnvoll, nicht nur diejenigen nicht humanen Primaten zu untersuchen, bei denen es nach einer Infektion mit dem Erreger zu Todesfällen kommt (z. B. Neuweltaffen und Lemuren), sondern auch diejenigen, die nach einer T.gondii-Infektion zwar in der Regel nicht erkranken, bei denen sich der Erreger jedoch oft serologisch nachweisen lässt (z. B. Altweltaffen). Diese Tiere könnten bei der Untersuchung als Indikator für die Prävalenz des Parasiten dienen. Unter der Voraussetzung, dass bekannt ist, ob T. gondii in einem Bestand endemisch auftritt, könnten gezielt präventive Maßnahmen ergriffen werden, um das Risiko eines seuchenhaften Ausbruchs der Toxoplasmose zu minimieren. Würde es dennoch zu einem Ausbruch kommen, könnte beim ersten Auftreten von klinischen Symptomen und schon im Verdachtsfall eine Therapie eingeleitet werden. Durch ein regelmäßig durchgeführtes Monitoring in Problembeständen könnten Neuinfektionen festgestellt und so die Wirksamkeit der prophylaktischen Maßnahmen überprüft werden. Wenn bekannt ist, welche Tiere einen Antikörpertiter gegen T. gondii aufweisen, hätte man im Falle eines Krankheitsausbruches auch einen Anhaltspunkt, ob es sich um eine frische Infektion oder um eine Reaktivierung handelt. Das Ziel der vorliegenden Arbeit war es, einen ELISA zu etablieren, mit dem ein breites Spektrum an Seren verschiedener Arten nicht humaner Primaten auf Antikörper gegen T. gondii untersucht werden kann. Bei der Etablierung wurden verschiedene Konjugate getestet und durch Schachbretttitrationen optimale Antigenkonzentrationen und optimale Verdünnungen für die 122 5. Diskussion der Ergebnisse Kontrollseren und das Konjugat ermittelt. Der ELISA sollte den serologischen Nachweis akuter Toxoplasmosen bei nicht humanen Primaten sowie die Durchführung eines Monitorings ermöglichen, wobei der Serengeti-Park Hodenhagen als Modell diente. In dem Park traten zwischen 1993 und 1998 zwei seuchenhafte Ausbrüche von akuten Toxoplasmosen unter den Kattas und den Totenkopfaffen auf. Innerhalb eines Jahres starben 15 von 17 Kattas sowie zwei von 14 Totenkopfaffen nach einem akuten bis perakuten Krankheitsverlauf, der mit unspezifischen klinischen Symptomen einherging. Bei den Totenkopfaffen abortierten alle acht graviden Weibchen oder gebaren tote Nachkommen. Bei einer weiteren Epidemie starben sechs von 17 Kattas, acht von 14 Totenkopfaffen sowie drei von drei Lisztaffen an einer akuten Toxoplasmose. Die Infektionswege konnten nicht ermittelt werden, es wurde jedoch eine Infektion durch mit Kot streunender Hauskatzen verunreinigte Einstreu vermutet. Es gelangten insgesamt sechs Kattas, zwei adulte Totenkopfaffen sowie eine Totgeburt und alle drei Lisztaffen im Institut für Pathologie der Stiftung Tierärztliche Hochschule Hannover zur Sektion. T. gondii wurde bei diesen Tieren immunhistologisch sowie in der PCR nachgewiesen. Zu Beginn dieser Arbeit war jedoch völlig unklar, ob auch die verbliebenen Kattas und Totenkopfaffen sowie weitere Affenarten mit T. gondii infiziert waren. Auffallend war, dass die Weißkopfmakis, die mit den Kattas teilweise im selben Gehege gehalten wurden, bislang nicht an einer Toxoplasmose erkrankt waren, obwohl beide Spezies als Angehörige der Lemuridae eine enge verwandtschaftliche Beziehung aufweisen. Später wurden auch in anderen zoologischen Gärten nicht humane Primaten auf T. gondii untersucht, um die Anzahl der Proben zu erweitern, die Anwendbarkeit des ELISAs bei weiteren Spezies auszutesten und einen Vergleich zwischen den verschiedenen Tierbeständen ziehen zu können. 5.2. Untersuchung von Serumproben nicht humaner Primaten im SFT auf Antikörper gegen T. gondii Da für die Etablierung der verschiedenen ELISA-Formate keine Referenzseren von experimentell infizierten Tieren zur Verfügung standen, wurden die Seren nicht humaner Primaten zunächst im SFT, dem in der Humanmedizin als Goldstandard geltenden Referenztest, auf Antikörper gegen T. gondii getestet. 5. Diskussion der Ergebnisse 123 Im SFT wurde bei keinem der Totenkopfaffen ein Antikörpertiter gegen T. gondii nachgewiesen, obwohl die in Hodenhagen untersuchten Tiere größtenteils aus der selben Gruppe stammten wie diejenigen, die in den vergangenen Jahren an einer Toxoplasmose gestorben waren. Daraus lässt sich schließen, dass es sich bei den in Hodenhagen bei den Totenkopfaffen beobachteten Epidemien jeweils um einen Neuausbruch der Erkrankung gehandelt haben muss und keine Reaktivierung von chronischen Infektionen stattfand. Bei den Weißkopfmakis und den Kattas wurden im SFT sowohl positive als auch negative Tiere festgestellt. Da bei den Weißkopfmakis bislang keine durch T. gondii verursachten Krankheitssymptome oder Todesfälle beobachtet wurden, handelte es sich bei den SFT-positven Tieren somit um latente Infektionen. Die Verwendung von SFT-positiven und SFT-negativen Serumproben der Weißkopfmakis als Kontrollseren für den IgG-ELISA sowie die Festlegung von Grenzwerten mit SFT-negativen Makiseren geschah unter der Hypothese, dass der SFT für die Untersuchung dieser Tiere eine ähnlich hohe Spezifität besitzt wie für die Untersuchung von Humanseren. Der Katta H24 war das einzige der untersuchten Tiere, bei dem der indirekte Nachweis der Infektion im SFT durch den direkten Nachweis des Parasiten in der histologischen Untersuchung als richtig positiv bestätigt werden konnte. Da die Weißkopfmakis und die Kattas eine enge verwandtschaftliche Beziehung aufweisen, ist jedoch zu vermuten, dass bei der Untersuchung der Seren im SFT für beide Spezies ähnliche Voraussetzungen gelten und der Test jeweils eine ähnliche diagnostische Richtigkeit aufweist. Die Anwendbarkeit des SFTs bei den Kattas trifft daher höchstwahrscheinlich auch auf die Weißkopfmakis zu. Es ist jedoch nicht gesagt, dass der SFT bei allen Primaten gleichermaßen als Goldstandard gelten kann, da die genetischen und somit auch die immunologischen Unterschiede zwischen Menschen, Halbaffen, Neuweltaffen und Altweltaffen dafür vermutlich zu groß sind. 5.3. Untersuchung von Serumproben nicht humaner Primaten im ELISA auf Antikörper gegen T. gondii 5.3.1. IgM-ELISA 124 5. Diskussion der Ergebnisse Obwohl im IgM-ELISA deutliche Unterschiede bei der Titration der verwendeten Kontrollseren festgestellt wurden, erwies sich dieses ELISA-Format bei der Untersuchung der Verlaufsblutproben der Weißkopfmakis als unbrauchbar. Hier zeigten die Titrationskurven aller Serumproben (mit Ausnahme der Serumproben von H3) einen ähnlichen Verlauf wie die Titration des negativen Kontrollserums. Dies war auch bei denjenigen Weißkopfmakis der Fall, bei denen im SFT eine Serokonversion nachgewiesen wurde. Für das im IgM-ELISA verwendete positive Kontrollserum (H3, Untersuchungszeitpunkt Juni) wurde im SFT zwar ein Titer von 1:16000, jedoch keine Serokonversion nachgewiesen. Auch im IgG-Aviditäts-ELISA wurde für die Serumprobe kein Unterschied zwischen den Indexwerten des Testansatzes ohne Harnstoff und des Testansatzes mit Harnstoff festgestellt. Es ist daher unwahrscheinlich, dass es sich bei dem Weißkopfmaki H3 tatsächlich um ein frisch mit T. gondii infiziertes Tier handelte. Es ist einerseits möglich, dass im Serum von H3 persistierende spezifische IgM-Antikörper gegen T. gondii enthalten waren oder dass es bei der Untersuchung des Serums in diesem ELISA-Format zu unspezifischen Reaktionen kam. 5.3.2. IgG-ELISA Da mir keine Referenzseren bei der Etablierung des ELISAs zur Verfügung standen, habe ich für die Beurteilung der Qualität meiner Untersuchungen einen Vergleich mit den im SFT ermittelten Ergebnissen geführt. Wegen der grundsätzlichen Unterschiede zwischen den beiden Testverfahren (z. B. Nachweis verschiedener Antikörperisotypen und -subklassen, Verwendung verschiedener Serumverdünnungen), war ein direkter Titervergleich nicht möglich. Ich habe deshalb nur die endgültige Einstufung der Seren als positiv oder negativ sowie die tendenzielle Titerhöhe (d. h. hohe oder niedrige Titer) verglichen. 5. Diskussion der Ergebnisse 125 5.3.2.1. Weißkopfmakis Die im SFT und im IgG-ELISA vorgenommenen Einstufungen der Makiseren als positiv oder negativ stimmten weitgehend überein. Wurde für eine Serumprobe im SFT ein positives und im IgG-ELISA ein negatives Ergebnis ermittelt, kann dies entweder die Folge einer unspezifischen (und somit falsch positiven) Reaktion im SFT sein oder ein falsch negatives Ergebnis im ELISA bedeuten. Die Grenzwerte des IgG-ELISAs wurden auf eine hohe Spezifität des Testes ausgerichtet (siehe Kap. 5.3.2.6.), eventuell wurden daher einige Seren, die nur einen niedrigen Antikörpertiter gegen T. gondii aufwiesen, im IgG-ELISA als negativ eingestuft. Dies könnte für die Serumproben von H9 und H26 zutreffen. Andererseits wurde jedoch das Serum von H6 (März) im SFT als negativ und im ELISA mit einem Titer von 1:40 als positiv beurteilt. Da im SFT für dieses Tier bei der Probennahme im Mai eine Serokonversion nachgewiesen wurde, ist es möglich, dass sich der Weißkopfmaki H6 erst kurz vor der Probennahme im März infiziert hat und diese frische Infektion zwar bereits im IgG-ELISA jedoch nicht im SFT erfasst wurde. In diesem Fall hätte der IgG-ELISA sogar eine höhere Sensitivität als der SFT. Bei einem Titervergleich von IgG-ELISA und SFT wurde für die Erstuntersuchung der Weißkopfmakis eine positive Korrelation zwischen der Titerhöhe im SFT und der Höhe der Indexwerte (und somit des Titers) im IgG-ELISA festgestellt. Für die im Dezember gewonnenen Serumproben wurden im SFT jedoch deutlich höhere Titer ermittelt als im IgG-ELISA. Eine mögliche Erklärung für diese unterschiedlichen Ergebnisse besteht in einer ungenügenden Inaktivierung der Seren vor der Durchfühung des SFTs. Um beurteilen zu können, ob bei den Weißkopfmakis eine Boosterung der Antikörpertiter stattfand, die nur im SFT und nicht im IgGELISA erfasst wurde, oder ob es bei der Untersuchung dieser Serumproben im SFT zu unspezifischen Reaktionen kam, wäre eine weitere Blutprobennahme erforderlich gewesen. Da es sich bei den untersuchten nicht humanen Primaten um Tiere aus einem Freizeitpark und nicht um Versuchstiere handelte, waren die Probennahmen auf einen bestimmten Untersuchungszeitraum (März bis Dezember 2004) begrenzt und konnten nicht beliebig fortgeführt werden. 126 5. Diskussion der Ergebnisse 5.3.2.2. Kattas Auf Grund der positiven Befunde in der histologischen Untersuchung konnte für den Katta H24 der indirekte Nachweis der Infektion im IgG-ELISA als richtig positiv bestätigt werden. Die hier ermittelten deutlichen Unterschiede zwischen den Indexwerten der SFT-negativen Kattas und diesem SFT-positiven und nachweislich mit T. gondii infiziertem Tier sprechen dafür, dass der IgGELISA für den Nachweis von T.-gondii-Infektionen bei Kattas eine ausreichende Sensitivität und Spezifität aufweist. 5.3.2.3. Totenkopfaffen sowie weitere Neuweltaffen Obwohl alle Serumproben der Totenkopfaffen im SFT als negativ eingestuft wurden, ähnelten die für diese Tiere im IgG-ELISA ermittelten Verläufe der Titrationskurven denen der Weißkopfmakis. Es wurden demnach deutliche Unterschiede zwischen den ELISA-Indices der einzelnen Totenkopfaffen festgestellt. Die unterschiedlichen Ergebnisse aus den beiden Testverfahren lassen sich entweder durch unspezifische (also falsch positive) Reaktionen im IgG-ELISA erklären oder sind Ausdruck dafür, dass der SFT für die Untersuchung von Neuweltaffen nicht anwendbar ist. Die Möglichkeit, dass beide Testverfahren gleichermaßen für die Untersuchung dieser Serumproben geeignet sind, ist unwahrscheinlich. Ansonsten hätte man bei einer richtig negativen Beurteilung der Seren im SFT gleichzeitig im IgG-ELISA wesentlich einheitlichere Ergebnisse erwartet und hier lediglich die Grenzwerte für diese Spezies anpassen müssen. Im Falle von unspezifischen Reaktionen des IgG-ELISAs wäre es denkbar, dass das verwendete Konjugat für die Totenkopfaffen nicht geeignet ist. Allerdings wurden im IgG-ELISA auch weitere Neuweltaffenspezies untersucht, bei denen einheitlich niedrige Indexwerte festgestellt wurden. Prinzipiell hätten auch bei diesen Tieren durch das Konjugat verursachte unspezifische Reaktionen auftreten müssen. Eine weitere Möglichkeit für die diskrepanten Ergebnisse besteht darin, dass die im SFT vorgenommenen Beurteilungen der Seren falsch negativ waren und im IgG-ELISA bei den Totenkopfaffen unterschiedliche Antikörpertiter gegen T. gondii nachgewiesen wurden. 5. Diskussion der Ergebnisse 127 Obwohl in Braunschweig und Jaderberg bislang keine durch T. gondii verursachten Erkrankungen oder Todesfälle nachgewiesen wurden, ergaben sich auch für diese Bestände unterschiedliche Ergebnisse aus beiden Testverfahren. Bei einem Vergleich der in den verschiedenen Beständen ermittelten Titrationskurven fiel auf, dass die Serumverläufe bei den Totenkopfaffen aus Braunschweig und Jaderberg im Gegensatz zu den Tieren aus Hodenhagen deutlich voneinander abgesetzt und bei den Tieren mit hohen Indexwerten durch einen Plateaubereich gekennzeichnet waren. Es besteht einerseits die Möglichkeit, dass hier spezifische Antikörpertiter gegen T. gondii nachgewiesen wurden und sich deshalb die Serumverläufe der positiven von den negativen Tieren unterschieden. Die in Hodenhagen ermittelten breit gestreuten Ergebnisse könnten dann auf eine Vielzahl unterschiedlicher Titer zurückgeführt werden. Andererseits könnte es bei den Serumproben aller drei Bestände zu unspezifischen Reaktionen im IgG-ELISA gekommen sein, wobei die Ergebnisse bei den Totenkopfaffen aus Braunschweig und Jaderberg nur auf Grund der geringeren Probenzahl deutlicher voneinander abgesetzt waren. 5.3.2.4. Rhesusaffen Da für die Rhesusaffen keine Ergebnisse aus dem SFT vorlagen, ist die Beurteilung der im IgGELISA ermittelten Verläufe der Titrationskurven schwierig. Grundsätzlich ergab sich auch für diese Tiere ein ähnliches Bild wie bei den Weißkopfmakis und den Kattas. Es wurden hier jedoch insgesamt wesentlich höhere Indexwerte ermittelt als bei den übrigen der untersuchten Spezies. Dies lässt sich damit begründen, dass bei der Herstellung des verwendeten Konjugats als Immunogen IgG aus Sammelseren von Rhesusaffen verwendet wurde und der Sekundärantikörper daher eine größere Affinität zu den im Probenserum enthaltenen Antikörpern aufweist. Bei den im IgG-ELISA festgestellten Unterschieden zwischen den einzelnen Rhesusaffen kann es sich entweder um den Nachweis unterschiedlicher spezifischer Antikörpertiter gegen T. gondii oder um unspezifische Reaktionen handeln. Es besteht zudem die Möglichkeit, dass alle Serumproben negativ sind. Allerdings hätte man für diesen Fall ein einheitlicheres Ergebnis der ELISA-Indices erwartet. 128 5. Diskussion der Ergebnisse 5.3.2.5. Prädispositionen im Zusammenhang mit T.-gondii-Infektionen Da Antikörpertiter gegen T. gondii bei den untersuchten nicht humanen Primaten sowohl bei Tieren beiderlei Geschlechts als auch unterschiedlichen Alters festgestellt wurden, ließen sich hier keine Prädispositionen für eine Infektion mit dem Parasiten erkennen. Nur bei den Rhesusaffen ergab sich die Tendenz, dass diejenigen Tiere, die die niedrigsten Indexwerte im IgG-ELISA aufwiesen, zu den jüngeren zählten. Die Gruppenzugehörigkeit der Weißkopfmakis und Totenkopfaffen aus Hodenhagen spielte beim Nachweis des Erregers keine Rolle. Die Tatsache, dass in Hodenhagen die Freigehege für Besucher zugänglich waren, machte bei einem Vergleich der für die Totenkopfaffen ermittelten Ergebnisse keinen Unterschied zwischen den drei untersuchten Beständen aus. Bei den Kattas wurden hingegen nur bei den Tieren aus Hodenhagen Antikörper gegen T. gondii nachgewiesen. Ob die Besucher hier bei der Übertragung des Parasiten eine Rolle gespielt haben, konnte allerdings nicht geklärt werden. Dass es sich bei den drei Totenkopfaffen H14, H15 und H20 um Wildfänge handelte, schien sich nicht begünstigend auf das Auftreten einer Infektion mit T. gondii auszuwirken, da für die Tiere H14 und H15 nur niedrige Indexwerte im IgGELISA ermittelt wurden. 5.3.2.6. Festlegung der Grenzwerte für den IgG-ELISA Bei der Festlegung der Grenzwerte (Cut-offs) für den IgG-ELISA wurden die Indexwerte derjenigen Tiere verwendet, deren Seren im gesamten Untersuchungszeitraum im SFT als negativ beurteilt wurden. Aus den Indices wurden die Mittelwerte und Standardabweichungen berechnet und die Grenzwerte für die jeweiligen Serumverdünnungen als Summe aus dem Mittelwert und der dreifachen Standardabweichung festgelegt. Bei dieser Methode wird in erster Linie Wert auf die Spezifität des Testes gelegt, d. h. die Grenzwerte werden so hoch angesetzt, dass negative Serumproben auch als negativ beurteilt werden. Da bei der Anfertigung dieser Arbeit jedoch keine negativen Referenzseren zur Verfügung standen, sind die Cut-offs als Richtwerte zu verstehen, um eine vorläufige Auswertung des ELISAs vornehmen zu können, und nicht als endgültige Grenzwerte. 5. Diskussion der Ergebnisse 129 5.3.2.7. Reproduzierbarkeit des IgG-ELISAs Um die Reproduzierbarkeit des IgG-ELISAs zu überprüfen, wurde für die Serumverdünnungen 1:10 bis 1:2560 der Variationskoeffizient aus den bei der Titration des positiven Kontrollserums ermittelten optischen Dichten berechnet. Ein Variationskoeffizient < 5 sprach dabei für eine gute Reproduzierbarkeit, ein Variationskoeffizient < 10 war akzeptabel. Der niedrigste Variationskoeffizient und somit die beste Reproduzierbarkeit wurde bei einer Serumverdünnung von 1:40 ermittelt. In dieser Verdünnung ergaben sich für das positive Kontrollserum optische Dichten innerhalb des Plateaubereichs (siehe Kap. 3.2.3.8.), daher traten hier die geringsten Schwankungen auf. Insgesamt ergaben sich bis zu einer Verdünnung von 1:320 akzeptable Werte für den Variationskoeffizienten. Dass ab einer Serumverdünnung von 1:640 Werte >10 ermittelt wurden, lässt sich dadurch erklären, dass der IgG-ELISA durch den geringeren Gehalt an Antikörpern gegen T. gondii hier störungsanfälliger war. 5.3.2.8. Abschließende Bewertung des IgG-ELISAs Es konnte in dieser Arbeit nicht endgültig geklärt werden, in welchem der beiden Testverfahren (ob SFT oder IgG-ELISA) die Serumproben im Einzelfall richtig beurteilt wurden und welcher Test grundsätzlich für welche Spezies die größere diagnostische Richtigkeit besitzt. Dafür wären Referenzseren notwendig gewesen oder es hätte für jedes der untersuchten Tiere ein direkter Nachweis von T. gondii erfolgen müssen (z. B. durch eine histologische Untersuchung post mortem). Eine Tötung der Tiere zu diesem Zweck war selbstverständlich obsolet. Für die Kattas konnte die grundsätzliche Anwendbarkeit des IgG-ELISAs nachgewiesen werden. Es ist daher zu vermuten, dass sich der Test auch für die Untersuchung weiterer Lemurenspezies eignet. Die weitgehende Übereinstimmung der Ergebnisse aus dem SFT und dem IgG-ELISA bei den Weißkopfmakis bekräftigt diese Hypothese. Es scheint daher möglich zu sein, bei Lemuren ein Monitoring mit Hilfe des IgG-ELISAs durchzuführen. Inwieweit sich der IgG-ELISA für den Nachweis von T.-gondii-Infektionen bei anderen Primatenspezies eignet, konnte nicht abschließend geklärt werden, da hierfür entsprechende 130 5. Diskussion der Ergebnisse Referenzseren notwendig gewesen wären. Es ist zu vermuten, dass der Test für jede Spezies (zumindest für Neuweltaffen und Altweltaffen) neu validiert werden muss, da die genetischen und immunologischen Unterschiede zwischen den einzelnen Arten zu groß sind, als dass sich ein serologischer Test für alle nicht humanen Primaten unter den gleichen Bedingungen anwenden ließe. 5.3.3. IgG-Aviditäts-ELISA Im Aviditäts-ELISA wird die Avidität, d. h. die Summe aller Bindungskräfte zwischen einem Antigen und den korrespondierenden Antikörpern, nachgewiesen. Die Avidität ist direkt nach einer Infektion niedrig und steigt in den folgenden Wochen und Monaten stetig an. Bei den ersten Antikörpern, die unmittelbar nach der Antigenpräsentation gebildet werden, ist die Anpassung an das Antigen noch weniger ausgeprägt und die Bindungskräfte sind geringer. Mit der Bildung von BGedächtniszellen steigt hingegen die Qualität der Antikörperreaktion und somit auch die Avidität (NOSSAL 1992). Das Prinzip des Aviditäts-ELISAs beruht auf der Tatsache, dass es leichter ist, die Bildung von Antigen-Antikörper-Komplexen zu verhindern (Dilutionsprinzip) oder diese aufzulösen (Elutionsprinzip), wenn die Avidität nicht in voller Stärke ausgeprägt ist. Bei dem in dieser Arbeit angewendeten Elutionsprinzip erfolgt nach der Bindung der Antikörper an das Antigen die Inkubation mit einem Agens, das Wasserstoffbrückenbindungen lösen kann (z. B. Harnstoff), wobei Bindungen mit niedriger Avidität leichter gelöst werden als hoch avide Bindungen (PULLEN et al. 1986). Bei einer vergleichenden Untersuchung von ELISAs nach dem Dilutions- und Elutionsprinzip erwies sich der Elutions-ELISA mit 6 M Harnstoff als der Test mit der deutlichsten Diskriminierung zwischen niedrig und hoch aviden Antikörpern (POLANEC et al. 1994). Daher wurde dieses Prinzip auch in dieser Arbeit angewendet. Da bislang keine vergleichbaren Untersuchungen mit Seren nicht humaner Primaten im AviditätsELISA durchgeführt wurden, ist nicht bekannt, wie viele Tage nach der Infektion mit T. gondii die deutlichsten Unterschiede zwischen den Testansätzen ermittelt werden und wie lange diese Unterschiede nachgewiesen werden können. In einer von SIMON (1995) durchgeführten Studie wurden bei experimentell mit T.-gondii-Oozysten infizierten Katzen und Schafen zwischen dem 28. 5. Diskussion der Ergebnisse 131 und 101. Tag p. i. bzw. zwischen dem 42. und 106. Tag p. i. deutliche Unterschiede im IgGAviditäts-ELISA nachgewiesen. Da das Ergebnis aus dem IgG-ELISA positiv sein muss, um den IgG-Aviditäts-ELISA beurteilen zu können, wurden nur diejenigen nicht humanen Primaten im IgG-Aviditäts-ELISA untersucht, deren Indexwerte im IgG-ELISA über den in Kap. 3.2.3.5.2. festgelegten Grenzwerten lagen. Es ist möglich, dass es sich bei denjenigen Tieren, bei denen ein deutlicher Unterschied zwischen den Indexwerten des Testansatzes ohne Harnstoff und des Testansatzes mit Harnstoff festgestellt wurde, um ein frühes Stadium der T.-gondii-Infektion handelt. Auffallend ist, dass die größten Unterschiede bei den Totenkopfaffen und den Rhesusaffen ermittelt wurden. Dies kann einerseits bedeuten, dass für diese Tiere im IgG-ELISA tatsächlich spezifische Antikörpertiter gegen T. gondii nachgewiesen wurden und dass im IgG-Aviditäts-ELISA der Nachweis von frischen T.-gondiiInfektionen erbracht wurde. Andernfalls wäre es sowohl im IgG-ELISA als auch im IgG-AviditätsELISA zu unspezifischen Reaktionen bei den Totenkopfaffen und den Rhesusaffen gekommen. Die Tatsache, dass sowohl bei denjenigen Totenkopfaffen und Rhesusaffen, bei denen im IgG-ELISA die niedrigsten Indexwerte festgestellt wurden (H15, H18, H30, R14, R15, R16, R18 und R19), als auch bei den Neuweltaffen M2 und M7 im IgG-Aviditäts-ELISA kaum ein Unterschied zwischen den Indexwerten der beiden Testansätze bestand, spricht jedoch dafür, dass sowohl im IgG-ELISA als auch im IgG-Aviditäts-ELISA ein richtig negatives Ergebnis für diese Tiere erhalten wurde. Für die Weißkopfmakis H6 und H9 wurde im SFT eine Serokonversion nachgewiesen, d. h. dass sich diese Tiere vermutlich innerhalb des Untersuchungszeitraums mit T. gondii frisch infiziert haben. Für H9 wurde im IgG-ELISA sowohl bei der Untersuchung im März als auch im Dezember ein negatives Ergebnis ermittelt, daher wurde mit diesen Serumproben kein Aviditäts-ELISA durchgeführt. Für H6 wurden im IgG-Aviditäts-ELISA bei der Erstuntersuchung im März geringe Unterschiede zwischen den Indexwerten der Testansätze festgestellt und es wurde im IgG-ELISA ein positives Ergebnis ermittelt. Im SFT hingegen ergab sich im März eine negative und erst im Mai eine positive Beurteilung. Die geringen Unterschiede im Aviditäts-ELISA können einerseits bedeuten, dass sich der Weißkopfmaki H6 kurz vor dem Untersuchungstermin im März mit T. gondii infiziert hat. In diesem Fall hätte man jedoch bei der im Mai gewonnenen Serumprobe deutlichere Unterschiede im IgG-Aviditäts-ELISA erwartet. Andererseits könnte die Infektion von H6 auch schon einige Wochen vor der Erstuntersuchung stattgefunden haben, so dass deutliche 132 5. Diskussion der Ergebnisse Unterschiede zwischen den Testansätzen nicht mehr nachgewiesen werden konnten. In diesem Fall wäre das Ergebnis aus dem SFT für die Erstuntersuchung im März falsch negativ. Eine endgültige Bewertung des IgG-Aviditäts-ELISAs kann nicht erfolgen, da zunächst die grundsätzliche Anwendbarkeit des Tests mit dem Serum von nachweislich frisch infizierten Tieren hätte bewiesen werden müssen. Da es sich jedoch bei den untersuchten nicht humanen Primaten nicht um experimentell infizierte Tiere gehandelt hat, gab es keinen Anhaltspunkt dafür, wann sich die Tiere mit dem Erreger infiziert haben. Eine experimentelle Infektion von nicht humanen Primaten zur Gewinnung entsprechender Referenzseren war bei der Anfertigung dieser Arbeit ausgeschlossen. Die ermittelten Ergebnisse können jedoch ein Hinweis darauf sein, dass sich der IgG-Aviditäts-ELISA für die Diagnostik von akuten T.-gondii-Infektionen bei nicht humanen Primaten eignet. 5.4. Untersuchung von Serumproben der Mäuse im IFAT und SFT auf Antikörper gegen T. gondii Durch die im SFT und im IFAT ermittelten positiven Befunde bei den inokulierten Mäusen konnte T. gondii bei dem Katta H24 indirekt nachgewiesen werden. Der Nachweis der Infektion bei den Mäusen kann als Beweis für die Infektion des Kattas gewertet werden. 5.5. Histologische Untersuchung von Gewebeproben des Kattas und der Maus Histologische Untersuchungen besitzen für den Nachweis von T. gondii grundsätzlich keine hohe Sensitivität. Ist nur eine geringe Anzahl an T.-gondii-Zysten in dem jeweiligen Gewebe vorhanden, ist die Wahrscheinlichkeit, eine solche Zyste in dem Gewebeschnitt nachzuweisen, nicht sehr groß. Aussagekräftig ist die histologische Untersuchung daher nur im positiven Fall, ist dann jedoch ein Beweis für eine Infektion mit dem Parasiten. Von dem Katta H24 wurde bei der Sektion Gehirnmaterial gewonnen und dieses in Mäuse inokuliert sowie für eine histologische Untersuchung benutzt. Durch den Nachweis von T.-gondii- 5. Diskussion der Ergebnisse 133 Zysten im Gehirn des Kattas sowie im Gehirn und in der Lunge einer Maus, die mit dem Gehirnmaterial inokuliert wurde, wurde somit in der histologischen Untersuchung bewiesen, dass der Katta H24 tatsächlich mit T. gondii infiziert war. 5.6. Ausblick In dieser Studie wurde die Grundlage für die Etablierung eines ELISAs geschaffen, mit dem nicht humane Primaten auf T. gondii serologisch untersucht werden können. Es gelang, die Anwendbarkeit des IgG-ELISAs bei Lemuren nachzuweisen, so dass die Voraussetzung für die Durchführung eines Monitorings bei diesen Spezies geschaffen wurde. Es wäre interessant, eine größere Anzahl an Lemuren zu untersuchen, um die Qualität des IgGELISAs hinsichtlich Sensitivität und Spezifität zu überprüfen und endgültige Grenzwerte festzulegen. Dafür wären jedoch negative Referenzseren notwendig. Um die Anwendbarkeit des IgG-ELISAs auf andere Primatenspezies auszuweiten, bestünde einerseits die Möglichkeit, weitere Konjugate auszutesten, was auf Grund der zu geringen Volumina der Serumproben, die in dieser Arbeit zur Verfügung standen, nicht möglich war. Durch die Erprobung weiterer Konjugate könnte überprüft werden, ob mit diesen Reagenzien bei den Neuweltaffen die gleichen Ergebnisse ermittelt werden oder ob der in dieser Arbeit verwendete Sekundärantikörper unspezifische Reaktionen hervorgerufen hat. Zudem könnte man Tiere infizieren, um entsprechende Referenzseren für die Validierung des ELISAs bei den einzelnen Spezies zu gewinnen. Wenn man die experimentelle Infektion von nicht humanen Primaten vermeiden will, ist es wichtig, dass diejenigen Tiere, die im ELISA serologisch untersucht werden, im Falle des Verendens zur Sektion gelangen. Hier kann durch eine parasitologische Untersuchung von Gewebeproben das zuvor gewonnene Serum als positiv oder negativ beurteilt werden, so wie dies auch bei dem Katta H24 der Fall war. Um einen serologischen Test für die Diagnose von akuten Toxoplasmosen zu etablieren, wäre die experimentelle Infektion von nicht humanen Primaten allerdings notwendig, um dabei Serum von nachweislich frisch infizierten Tieren zu gewinnen. Es ist denkbar, dass der IgG-Aviditäts-ELISA 134 5. Diskussion der Ergebnisse bei einer Validierung mit diesen Referenzseren für den Nachweis von frischen T.-gondiiInfektionen geeignet ist. Es wäre ebenfalls möglich, mit solchen Referenzseren sowie eventuell mit anderen Konjugaten den IgM-ELISA erneut auszutesten. Die Erprobung einer Vakzinierung von nicht humanen Primaten gegen T. gondii erscheint mit dem derzeitig erhältlichen Impfstoff nicht sehr sinnvoll, da selbst grundsätzliche Fragen, wie z. B. die Boosterung des Antikörpertiters erfolgen soll, bislang nicht geklärt werden konnten. Das Risiko für die Tiere übersteigt daher vermutlich den Nutzen der Impfung. Zudem wäre das Vorhandensein eines serologischen Tests zum Nachweis der Infektion die Voraussetzung für ein solches Projekt. Insgesamt lässt sich sagen, dass prophylaktische Maßnahmen zur Vermeidung der Infektion mit dem Parasiten grundsätzlich aussichtsreicher sind, als sich im Falle eines Ausbruchs der Toxoplasmose auf eine schnelle Diagnose und Therapie zu verlassen. Weitergehende Untersuchungen sollten daher auf die Durchführung eines Monitorings ausgerichtet sein. 6. Zusammenfassung 135 6. ZUSAMMENFASSUNG BRANDT, Anna Katharina (2006): Serologische Untersuchungen zur Toxoplasmose nicht humaner Primaten Es wurden Serumproben von 19 Weißkopfmakis (Eulemur fulvus albifrons), 7 Kattas (Lemur catta), 19 Rhesusaffen (Macaca mulatta), 24 Totenkopfaffen (Saimiri sp.) sowie 10 weiteren Neuweltaffen gesammelt und im Sabin-Feldman-Test (SFT) und im Enzyme-linked Immunosorbent Assay (ELISA) auf Antikörper gegen T. gondii untersucht. Unter Verwendung von SFT-positiven und SFT-negativen Seren der Weißkopfmakis als Kontrollseren wurde ein IgM-ELISA, ein IgGELISA und ein IgG-Aviditäts-ELISA zum Nachweis von Antikörpern gegen T. gondii bei nicht humanen Primaten etabliert. Bei der Bewertung des ELISAs erfolgte ein Vergleich mit den Ergebnissen aus dem SFT, der für die Untersuchung von Humanseren auf Antikörper gegen T. gondii als Goldstandard gilt. Für die Weißkopfmakis und Kattas stimmten die im SFT und im IgG-ELISA vorgenommenen Beurteilungen der Serumproben als positiv oder negativ weitgehend überein. Für die Totenkopfaffen ergaben sich unterschiedliche Ergebnisse, deren Ursache nicht geklärt werden konnte. Für die Rhesusaffen lagen keine Ergebnisse aus dem SFT vor. Im IgG-ELISA ergaben sich für diese Tiere ähnliche Serumverläufe wie bei den Weißkopfmakis und den Kattas, wobei die jüngsten Rhesusaffen die niedrigsten Indexwerte aufwiesen. Bei einem Katta wurden post mortem in der histologischen Untersuchung Gewebezysten von T. gondii nachgewiesen. Dadurch wurden für dieses Tier die im SFT und im IgG-ELISA ermittelten Ergebnisse als richtig positiv bestätigt und die grundsätzliche Anwendbarkeit des IgG-ELISAs für die Untersuchung von Lemurenseren auf Antikörper gegen T. gondii nachgewiesen. Zur Untersuchung des Infektionsstadiums der T.-gondii-Infektionen wurde ausschließlich der IgGAviditäts-ELISA benutzt, da sich der IgM-ELISA als ungeeignet erwies. Die größten Unterschiede zwischen den Testansätzen des IgG-Aviditäts-ELISAs wurden bei Totenkopfaffen und Rhesusaffen festgestellt, was auf ein frühes Stadium der T.-gondii-Infektionen bei diesen Tieren hindeutete. 136 6. Zusammenfassung 7. SUMMARY BRANDT, Anna Katharina (2006): Serological investigations about toxoplasmosis of non human primates Serum samples of 19 white-fronted brown lemurs (Eulemur fulvus albifrons), 7 ring-tailed lemurs (Lemur catta), 19 rhesus monkeys (Macaca mulatta), 24 squirrel monkeys (Saimiri sp.) and 10 other New world monkeys were collected and tested for antibodies against T. gondii by SabinFeldman dye test (SFT) and enzyme-linked immunosorbent assay (ELISA). Using SFT positive and SFT negative sera from white-fronted brown lemurs as serumcontrols an IgM ELISA, an IgG ELISA and an IgG avidity ELISA to detect antibodies against T. gondii was established. At assessment of ELISA a comparison with the results of SFT occured which is the golden standard for testing human sera for antibodies against T. gondii. In white-fronted brown lemurs and ring-tailed lemurs the assessments of serumsamples as positive or negative by SFT and IgG ELISA agreed to a large extent. There were different results for the squirrel monkeys, the cause of which could not be resolved. There were no results for the rhesus monkeys by SFT. For these animals similar serum titrations to white-fronted brown lemurs and ring-tailed lemurs arised by IgG ELISA – the youngest rhesus monkeys showed the lowest index values. In one ring-tailed lemur tissue cysts of T. gondii were demonstrated post mortem by histological examination. Because of this the results found by SFT and IgG ELISA for this animal were proved to be true and the suitability of IgG ELISA for testing sera from lemurs for antibodies against T. gondii was demonstrated. To examine the course of T. gondii infection only the IgG avidity ELISA was used, because the IgM ELISA proved to be unsuitable. In IgG avidity ELISA the greatest differences between test series were detected in squirrel monkeys and rhesus monkeys, this suggested that there was an early course of T. gondii infection in these animals. 8. Literaturverzeichnis 137 8. LITERATURVERZEICHNIS ALEXANDER, J., C.W. ROBERTS, W. WALKER, G. REICHMANN u. C.A. HUNTER (2000): The immunology of Toxoplasma gondii infection in the immune-competent host. In: P. AMBROISE-THOMAS u. P.E. PETERSEN (Hrsg.): Congenital Toxoplasmosis. Springer-Verlag, Frankreich, S. 69-82 ANDERSON, D.C., u. H.M. McCLURE (1982): Acute disseminated fatal toxoplasmosis in a squirrel monkey. J. Am. Vet. Med. Assoc. 181, 1363-1366 ANDERSON, D.C., u. H.M. McCLURE (1993): Toxoplasmosis. In: T.C. JONES, U. MOHR u. R.D. HUNT (Hrsg.): Nonhuman primates I. Springer-Verlag, Berlin, S. 63-69 ANDRADE, M., J.O. COELHO, C.P. CARDOSO, A.M. MARINHO u. R.S. MARCHEVSKY (2004): Demonstration of Toxoplasma gondii in squirrel monkeys by immunohistochemical analysis. Am. J. Primatol. 62(Suppl. 1), 111 ARAUJO, F.G., M.M. WONG, J. THEIS u. J.S. REMINGTON (1973): Experimental Toxoplasma gondii infection in a nonhuman primate. Am. J. Trop. Med. Hyg. 22, 465-472 ASAI, T., T. KINJO, N. MINAMOTO, M. SUGIYAMA, N. MATSUBAYASHI u. I. NARAMA (1991): Prevalence of antibodies to five selected zoonosis agents in monkeys. J. Vet. Med. Sci. 53, 553-559 ASHBURN, D. (1992): History and general epidemiology. In: D.O. HO-YEN u. A.W.L. JOSS (Hrsg.): Human Toxoplasmosis. Oxford Universitiy Press, New York, S. 1-25 BACCIARINI, L., J. VOELLM, M. JANOVSKY u. A. GROENE (2001a): Acute disseminated toxoplasmosis in a colony of squirrel monkeys (Saimiri boliviensis) in the Zoologischer Garten Basel, Switzerland. Erkr. Zootiere 40, 87-89 BACCIARINI, L., J. VOELLM, M. JANOVSKY, A. KAPPLER u. A. GROENE (2001b): Acute disseminated toxoplasmosis in a colony of squirrel monkeys (Saimiri boliviensis). Eur. J. Vet. Pathol. 7, 67-73 138 8. Literaturverzeichnis BALFOUR, A.H., D.G. FLECK, H.P.A. HUGHES u. D. SHARP (1982): Comparative study of three tests (dye test, indirect haemagglutination test, latex agglutination test) for the detection of antibodies to Toxoplasma gondii in human sera. J. Clin. Pathol. 35, 228-232 BAULU, J., G. EVANS u. C. SUTTON (2002): Pathogenic agents found in Barbados Chlorocebus aethiops sabaeus and in Old World and New World monkeys commonly used in biomedical research. Lab. Prim. Newsl. 41, 4-6 BENESON, M.W., E.T. TAKAFUJI, S.M. LEMON, R.L. GREENUP u. A.J. SULZER (1982): Oocyst-transmitted toxoplasmosis associated with ingestion of contaminated water. N. Engl. J. Med. 307, 666-669 BENIRSCHKE, K., u. R.J. LOW (1970): An animal model for human disease: Acute toxoplasmosis. Comp. Pathol. Bull. 2, 3-4 BENIRSCHKE, K., u. R. RICHART (1960): Spontaneous acute toxoplasmosis in a marmoset monkey. Am. J. Trop. Med. Hyg. 9, 269-273 BORST, G.H.A., u. F. VAN KNAPEN (1984): Acute acquired toxoplasmosis in primates in a zoo. J. Zoo Anim. Med. 15, 60-62 BOUER, A., K. WERTHER, J.L. CATAO-DIAS u. A.L.V. NUNES (1999): Outbreak of toxoplasmosis in Lagothrix lagotricha. Folia Primatol. 70, 282-285 BRACK, M. (1987): Agents transmissible from Simian to man. Springer-Verlag, New York, S. 324-330 BRACK, M., R. GOELTENBOTH u. W. RIETSCHEL (1995a): Primaten. In: R. GÖLTENBOTH (Hrsg.): Krankheiten der Zoo- und Wildtiere. Blackwell Wissenschafts-Verlag, Berlin, S. 25-66 BRACK, M., P. WOHLSEIN u. F.J.KAUP (1995b): Toxoplasmose nichthumaner Primaten. Erkr. Zootiere 37, 183-188 BRACK, M., P. WOHLSEIN, D. MINNEMANN u. H.P. BRANDT (1998): Toxoplasmosis outbreak in ring-tailed lemurs (Lemur catta) and squirrel monkeys (Saimiri sciureus). Prim. Rep. 50, 71-82 8. Literaturverzeichnis 139 BRADFORD, M.M. (1976): A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding. Anal. Biochem. 72, 248-254 BRITT, A., C. WELCH, A. KATZ, B. IAMBANA, I. PORTON I, R. JUNGE, G. CRAWFORD, C. WILLIAMS u. D. HARING (2004): The re-stocking of captive-bred ruffed lemurs (Varecia variegata variegata) into the Betampona Reserve, Madagascar: methodology and recommendations. Biodivers. Conserv. 13, 635-657 BUNDESGESUNDHEITSBLATT (1989): Verfahrensrichtlinien für die Laboratoriumsdiagnostik von parasitären Infektionen beim Menschen. VI. Spezielle Routinemethode zum Nachweis von Antikörpern gegen Toxoplasma gondii. Bekanntmachungen des BGA 12/89, 552-555 BUXTON, D. (1990): Ovine toxoplasmosis: a review. J. Roy. Soc. Med. 83, 509-511 BUXTON, D. (1998): Protozoan infections (Toxoplasma gondii, Neospora caninum and Sarcocystis spp.) in sheep and goats: recent advances. Vet. Res. 29, 289-310 CADAVID, A.P., L. CANAS, J.J. ESTRADA u. L.E. RAMIREZ (1991): Prevalence of anti-Toxoplasma gondii antibodies in Cebus spp in the Santa Fe Zoological Park of Medellin, Colombia. J. Med. Primatol. 20, 259-261 CARME, B., C. AZNAR, A. MOTARD, M. DEMAR u. B. DE THOISY (2002): Serologic survey of Toxoplasma gondii in noncarnivorous free-ranging neotropical mammals in French Guiana. Vector Borne Zoonotic Dis. 2, 11-17 CARMICHAEL, G.A. (1975): The application of the indirect fluorescent antibody technique for the detection of toxoplasmosis. Can. J. Med. Technol. 37, 168-171 CARPENTER, J.W., T.Y. MASHIMA u. D.J. RUPIPER (2001): Exotic animal formulary. 2. Aufl., Verlag Saunders, Philadelphia CARUANA, L. B. (1980): A study of variation in the indirect haemagglutination antibody test for toxoplasmosis. Am. J. Med. Technol. 46, 368-370 140 8. Literaturverzeichnis CATAO-DIAS, J.L. (2001): Medicine. In: M.E. FOWLER u. Z.S. CUBAS (Hrsg.): Biology, Medicine and Surgery of South American Wild Animals. Iowa State Univ. Press, Ames, S. 267-272 CHANG, J., R.W. KORNEGAY, J.L. WAGNER, E.M. MIKAT u. D.B.HACKEL (1980): Toxoplasmosis in a sifaka. In: R. J. MONTALI u. G. MIGAKI (Hrsg.): The Comparative Pathology of Zoo Animals. Smithsonian Institution Press, Washington, D.C., S. 347-352 CHANG, H.R., u. J.C.F. PECHERE (1988): Activity of spiramycin against Toxoplasma gondii in vitro, in experimental infections and in human infection. J. Antimicrob. Chemother. 22(Suppl. B), 87-92 CHATTERTON, J.M.W. (1992): Pregnancy. In: D.O. HO-YEN u. A.W.L. JOSS (Hrsg.): Human Toxoplasmosis. Oxford Universitiy Press, New York, S. 144-183 CHHABRA, M.B., R.C. MAHAJAN, N.K. GANGULY u. N.L. CHITKARA (1976): Prevalence of Toxoplasma antibodies in rhesus monkeys in India. Trop. Geogr. Med. 28, 101-103 CHINCHILLA, M., O.M. GUERRERO, A. CASTRO u. J. SABAH (1994): Cockroaches as transport hosts of the protozoan Toxoplasma gondii. Rev. Biol. Trop. 42, 329-331 CHOI, W.Y., J.E. YOO, H.W. NAM, C.Y. OH, S.W. KIM, K. KATAKURA u. A. KOBAYASHI (1987): Toxoplasma antibodies by indirect latex agglutination tests in zoo animals. Korean J. Parasitol. 25, 13-23 COWEN, D.W., u. A. WOLF (1945): Toxoplasmosis in the monkey. Acute fatal infection experimentally produced in a young Macaca mulatta. J. Infect. Dis. 77, 144-157 CULBERTSON, W.W., K.F. TABBARA u. G.R. O'CONNOR (1982): Experimental ocular toxoplasmosis in primates. Arch. Ophthalmol. 100, 321-323 CUNNINGHAM, A.A., D. BUXTON u. K.M. THOMSON (1992): An epidemic of toxoplasmosis in a captive colony of squirrel monkeys (Saimiri sciureus). J. Comp. Pathol. 107, 207-219 8. Literaturverzeichnis 141 DE ROADNICHE, E. (1954a): Spontaneous toxoplasmosis in the whiteface monkey, Cebus capucinus, in Panama. Am. J. Trop. Med. Hyg. 3, 1023-1025 DE ROADNICHE, E. (1954b): Susceptibility of the marmoset, Marikina geoffroyi, and the night monkey, Aotus zonalis, to experimental infection with Toxoplasma. Am. J. Trop. Med. Hyg. 3, 1023-1032 DE ROEVER-BONNET, H. (1972): Toxoplasmosis in tropical Africa. Trop. Geogr. Med. 24, 7-13 DESMONTS, G., u. J. COUVREUR (1974a): Toxoplasmosis in pregnancy and its transmission to the fetus. Bull. N. Y. Acad. Med. 50, 146-159 DESMONTS, G., u. J. COUVREUR (1974b): Congenital toxoplasmosis. A prospective study of 378 pregnancies. N. Engl. J. Med. 290, 1110-1116 DESMONTS, G., u. J.S. REMINGTON (1980): Direct agglutination test for diagnosis of Toxoplasma infection: method for increasing sensitivity and specifity. J. Clin. Microbiol. 11, 562-568 DE THOISY, B., M. DEMAR, C. AZNAR u. B. CARME (2003): Ecologic correlates of Toxoplasma gondii exposure in free-ranging neotropical mammals. J. Wildl. Dis. 39, 456-459 DE THOISY, B., I. VOGEL, J.M. REYNES, J.F. POULIQUEN, B. CARME, M. KAZANJI u. J.C. VIE (2001): Health evaluation of translocated free-ranging primates in French Guiana. Am. J. Primatol. 54, 1-16 DICKSON, J., J. FRY, R. FAIRFAX u. T. SPENCE (1983): Epidemic toxoplasmosis in captive squirrel monkeys (Saimiri sciureus). Vet. Rec. 112, 302 DIETZ, H.H., P. HENRIKSEN, V. BILLE-HANSEN u. S.A. HENRIKSEN (1997): Toxoplasmosis in a colony of New World monkeys. Vet. Parasitol. 68, 299-304 DÖBEREINER, J. (1955): Toxoplasmose espontânea em macaco. Veterinaria 9, 44-54 142 8. Literaturverzeichnis DRAPER, C.C., R. KILLICK-KENDRICK, W.M. HUTCHISON, J.C. SIIM u. P.C.C. GARNHAM (1971): Experimental toxoplasmosis in chimpanzees. Br. Med. J. 2, 375-378 DUBEY, J.P. (1977): Toxoplasma, Hammondia, Besnoitia, Sarcocystis and other tissue cyst-forming coccidia of man and animals. In: J.P. KREIER (Hrsg.): Parasitic Protozoa. Bd. 3, Academic Press, New York, S. 101-237 DUBEY, J.P. (1986): Toxoplasmosis. J. Am. Vet. Med. Assoc. 189, 166-170 DUBEY, J.P. (1993): Toxoplasma, Neospora, Sarcocystis, and other tissue cyst-forming coccidia of humans and animals. In: J.P. KREIER (Hrsg.): Parasitic Protozoa. Bd. 6, 2. Aufl., Academic Press, S. 1-158 DUBEY, J.P. (1995): Duration of immunity to shedding of Toxoplasma gondii oocysts by cats. J. Parasitol. 81, 410-415 DUBEY, J.P. (1996): Infectivity and pathogenicity of Toxoplasma gondii oocysts for cats. J. Parasitol. 82, 957-961 DUBEY, J.P. (1998a): Toxoplama gondii oocyst survival under defined temperatures. J. Parasitol. 84, 862-865 DUBEY, J.P. (1998b): Re-examination of resistance of Toxoplasma gondii tachyzoites and bradyzoites to pepsin and trypsin digestion. Parasitol. 116, 43-50 DUBEY, J.P. (1998c): Toxoplasmosis, sarcocystiosis, isosporosis, and cyclosporosis. In: S.R. PALMER, E.J.L. SOULSBY u. D.I.H. SIMPSON (Hrsg.): Zoonoses. Oxford University Press, Oxford, S. 579-97 DUBEY, J.P. (2000): The scientific basis for prevention of Toxoplasma gondii infection: studies on tissue cyst survival, risk factors and hygiene measures. 8. Literaturverzeichnis 143 In: P. AMBROISE-THOMAS u. E. PETERSEN (Hrsg.): Congenital Toxoplasmosis: Scientific Background, Clinical Management and Control. Springer-Verlag, Paris, S. 271-275 DUBEY, J.P., u. C.P. BEATTIE (1988): Toxoplasmosis of Animals and Man. CRC Press, Inc., Boca Raton, Florida DUBEY, J.P., G. DESMONTS, C. McDONALD u. K.W. WALLS (1985b): Serologic evaluation of cattle inoculated with Toxoplasma gondii: Comparison of Sabin-Feldman dye test and other agglutination tests. Am. J. Vet. Res. 46, 1085-1089 DUBEY, J.P., u. J.K. FRENKEL (1976): Feline toxoplasmosis from acutely infected mice and the development of Toxoplasma cysts. J. Protozool. 23, 537-542 DUBEY, J.P., L.W. KRAMER u. S.E. WEISBRODE (1985a): Acute death associated with Toxoplasma gondii in ring-tailed lemurs. J. Am. Vet. Med. Assoc. 187, 1272-1273 DUBEY, J.P., M.R. LAPPIN u. P. THULLIEZ (1995): Long-term antibody responses of cats fed Toxoplasma gondii tissue cysts. J. Parasitol. 81, 887-893 DUBEY, J.P., D. S. LINDSAY u. C.A. SPEER (1998a): Structures of Toxoplasma gondii tachyzoites, bradyzoites, and sporozoites and biology and development of tissue cysts. Clin. Microbiol. Rev. 11, 267-299 DUBEY, J.P., J.K. LUNNEY, S.K. SHEN, O.C.H. KWOK, D.A. ASHFORD u. P. THULLIEZ (1996): Infectivity of low numbers of Toxoplasma gondii oocysts to pigs. J. Parasitol. 82, 438-443 DUBEY, J.P., D.W. THAYER, C.A. SPEER u. S.K. SHEN (1998b): Effect of gamma irradiation on unsporulated and sporulated Toxoplasma gondii oocysts. Int. J. Parasitol. 28, 369-375 DURFEE, P.T., J.H. CROSS, RUSTAM u. SUSANTO (1976): Toxoplasmosis in man and animals in South Kalimantan (Borneo), Indonesia. Am. J. Trop. Med. Hyg . 25, 42-47 EKANAYAKE, D.K., R.P.V.J. RAJAPAKSE, J.P. DUBEY u. W.P.J. DITTUS (2004): Seroprevalence of Toxoplasma gondii in wild toque macaques (Macaca sinica) at Polonnaruwa, Sri Lanka. J. Parasitol. 90, 870-871 144 8. Literaturverzeichnis EPIPHANIO, S., J.L. CATAO-DIAS u. M.A.B.V. GUIMARAES (1999a): Toxoplasmosis in emperor tamarin (Saguinus imperator): Case report. Braz. J. Vet. Res. Anim. Sci. 36, 72-74 EPIPHANIO, S., M.A.B.V. GUIMARAES, D.L. FEDULLO, S.H.R. CORREA u. J.L. CATAODIAS (2000): Toxoplasmosis in golden-headed lion tamarins (Leontopithecus chrysomelas) and emperor marmosets (Saguinus imperator) in captivity. J. Zoo. Wildl. Med. 31, 231-235 EPIPHANIO, S., M.A.B.V. GUIMARAES, D.L. FEDULLO, S.H.R. CORREA u. J.L. CATAODIAS (1999b): Toxoplasmosis in Leontopithecus chrysomelas (Kuhl, 1820) and Saguinus imperator (Goeldi, 1907). Am. Assoc. Zoo Vet. Annu. Conf. Proc 1999, 337-338 EPIPHANIO, S., L.R.M. SA, R.H.F. TEIXEIRA u. J.L. CATAO-DIAS (2001): Toxoplasmosis in a wild-caught black lion tamarin (Leontopithecus chrysopygus). Vet. Rec. 149, 627-628 EPIPHANIO, S., I.L. SINHORINI u. J.L. CATAO-DIAS (2003): Pathology of toxoplasmosis in captive New World primates. J. Comp. Pathol. 129, 196-204 ESCAJADILLO, A., u. J.K. FRENKEL (1991): Experimental toxoplasmosis and vaccine tests in Aotus monkeys. Am. J. Trop. Med. Hyg. 44, 382-389 EVANS, R. (1992): Life cycle and animal infection. In: D.O. HO-YEN u. A.W.L. JOSS (Hrsg.): Human Toxoplasmosis. Oxford Universitiy Press, New York, S. 26-55 FELDMAN, H.A., u. L.T. MILLER (1956): Serological study of toxoplasmosis prevalence. Am. J. Hyg. 64, 320-335 FERRARONI, J.J., S.G. REED u. C.A. SPEER (1980): Prevalence of Toxoplasma antibodies in humans and various animals in the Amazon. Proc. Helminthol. Soc. Wash. 47, 148-150 FRENKEL, J.K. (2000): Biology of Toxoplasma gondii. In: P. AMBROISE-THOMAS u. P.E. PETERSEN (Hrsg.): Congenital Toxoplasmosis. Springer-Verlag, S.9-25 8. Literaturverzeichnis 145 FRENKEL, J.K., J.P. DUBEY u. N.L. MILLER (1970): Toxoplasma gondii: fecal stages identified as coccidian oocysts. Science 167, 893-896 FRENKEL, J.K., u. A. ESCAJADILLO (1987): Cyst rupture as a pathogenic mechanism of toxoplasmic encephalitis. Am. J. Trop. Med. Hyg. 36, 517-522 FRENKEL, J.K., u. O.E. SOUSA (1983): Antibodies to Toxoplasma in Panamanian mammals. J. Parasitol. 69, 244-245 FREYRE, A., J.P. DUBEY, D.D. SMITH u. J.K. FRENKEL (1989): Oocyst-induced Toxoplasma gondii infections in cats. J. Parasitol. 75, 750-755 FULTON, J. D., u. J.K. TURK (1959): Direct agglutination test for Toxoplasma gondii. Lancet 2, 1068-1071 FURLEY, C. (1996): The gorilla rescue project, Brazzaville, Congo. Int. Zoo News 43, 299-300 FURUTA, T., Y. UNE, M. OMURA, N. MATSUTANI, Y. NOMURA, T. KIKUCHI, S. HATTORI u. Y. YOSHIKAWA (2001): Horizontal transmission of Toxoplasma gondii in squirrel monkeys (Saimiri sciureus). Exp. Anim. 50, 299-306 GARDINER, C.H., R. FAYER u. J.P. DUBEY (1998): Apicomplexa--Toxoplasma and Hammondia In: C.H. GARDINER, R. FAYER u. J.P. DUBEY (Hrsg.): An Atlas of Protozoan Parasites in Animal Tissues. 2. Aufl., Armed Forces Institute of Pathology, Washington DC, S. 53-55 GEISSMANN, T. (2003): Vergleichende Primatologie. Springer Verlag, Berlin, Heidelberg GOZALO, A., u. M. TANTALEAN (1996): Parasitic protozoa in neotropical primates. Lab. Prim. Newsl. 35, 1-7 GRINER, L.A. (1983): Pathology of zoo animals. Zoological Society of San Diego, San Diego, S. 326-345 146 8. Literaturverzeichnis GROSS, U., M. HOLPERT u. S. GOEBEL (2004): Impact stage differentiation on diagnosis of toxoplasmosis. Ann. Ist. Super Sanità 40, 65-70 HARING, D., u. K. DAVIS (1998): Management of the Grey gentle or Eastern lesser bamboo lemur Hapalemur griseus griseus at Duke University Primate Center, Durham. Int. Zoo Yb. 36, 20-34 HARPER, J.S. III, W.T. LONDON u. J.L. SEVER (1985): Five drug regimens for treatment of acute toxoplasmosis in squirrel monkeys. Am. J. Trop. Med. Hyg. 34, 50-57 HESSLER, J.R., J.C. WOODARD u. P.C. TUCEK (1971): Lethal toxoplasmosis in a woolly monkey. J. Am. Vet. Med. Assoc. 159, 1588-1594 HILGENFELD, M. (1965a): Toxoplasmose bei Zootieren. Zool. Garten (Generalregister) 30, 262-270 HILGENFELD, M. (1965b): Zur Toxoplasmose der weiblichen Geschlechtsorgane. Erkr. Zootiere 7, 21-24 HILGENFELD, M. (1966): Toxoplasmose bei Affen. Erkr. Zootiere 8, 231-238 HOLLAND, G.N., G.R. O'CONNOR, R.F. DIAZ, P. MINASI u. W.M. WARA (1988): Ocular toxoplasmosis in immunosuppressed nonhuman primates. Invest. Ophthalmol. Vis. Sci. 29, 835-842 HOLLIMAN, R.E., J. JOHNSON u. K. DUFFY (1989): Discrepant Toxoplasma latex agglutination test results. J. Clin. Pathol. 42, 200-203 HO-YEN, D. O. (1992): The future. In: D.O. HO-YEN u. A.W.L. JOSS (Hrsg.): Human Toxoplasmosis. Oxford Universitiy Press, New York, S. 232-248 HUBBARD, G.B. (1995): Protozoal diseases of nonhuman primates. Semin. Avian Exot. Pet Med. 4, 145-149 8. Literaturverzeichnis 147 INNES, E.A. (1997): Toxoplasmosis: Comparative species susceptibility and host immune response. Comp. Immunol. Microbiol. Infect. Dis. 20, 131-138 INOUE, M. (1997): Acute toxoplasmosis in squirrel monkeys. J. Vet. Med. Sci. 59, 593-595 ISENBÜGEL, E. (1983): Akute Toxoplasmose in einem Katta (Lemur catta) Bestand. 2. Arbeitstagung der Zootierärzte im deutschsprachigen Raum, 38-43 ITAKURA, C., u. H. NIGI (1968): Histopathological observations on two spontaneous cases of toxoplasmosis in the monkey (Lemur catta). Nippon Juigaku Zasshi 30, 341-346 JACKSON, M.H. u. W.M. HUTCHISON (1989): The prevalence and source of Toxoplasma infection in the environment. Adv. Parasitol., 28, 55-105 JACOBS, L., u. M.N. LUNDE (1957): A haemagglutination test for toxoplasmosis. J. Parasitol. 43, 308-314 JENSEN, L., E. PETERSEN, S.A. HENRIKSEN, H.H. DIETZ u. P. LIND (1998): Monoclonal antibodies to Toxoplasma gondii strain 119 identify recently isolated Danish strains as one group. Int. J. Parasitol. 28, 1305-1313 JOHNSON, A.M. (1997): Speculation on possible life cycles for the clonal lineages in the genus Toxoplasma. Parasitol. Today 13, 393-397 JOHNSON, A.M. (1999): Is there more than one species in the genus Toxoplasma? Tokai J. Exp. Clin. Med. 23, 383-389 JOHNSON-DELANEY, C.A. (1996): Zoonotic parasites of selected exotic animals. Semin. Avian Exot. Pet Med. 5, 115-124 JUAN-SALLES, C., S. LOPEZ, D. BORRAS, M. DOMINGO, N. PRATS u. J. FERNANDEZ (1997): Disseminated toxoplasmosis in susceptible zoo species: A sporadic disease? Am. Assoc. Zoo Vet. Annu. Conf. Proc. 1997, 227-231 148 8. Literaturverzeichnis JUAN-SALLES, C., N. PRATS, A.J. MARCO, J.A. RAMOS-VARA, D. BORRAS u. J. FERNANDEZ (1998): Fatal acute toxoplasmosis in three golden lion tamarins (Leontopithecus rosalia). J. Zoo Wildl. Med. 29, 55-60 JUNGE, R.E. (2003): Prosimians. In: M.E. FOWLER u. R.E. MILLER (Hrsg.): Zoo and Wild Animal Medicine. 5.Aufl., WB Saunders, St Louis, S. 334-346 KAPPERUD, G., P.A. JENUM, B. STRAY-PEDERSEN, K.K. MELBY, A. ESKILD u. J. ENG (1996): Risk factors for Toxoplasma gondii infection in pregnancy: results of a prospective case-control study in Norway. Am. J. Epidemiol. 144, 405-412 KASCHULA, V.R., A.F. VAN DELLEN u. V. DE VOS (1978): Some infectious diseases of wild vervet monkeys (Cercopithecus aethiops pygerythrus) in South Africa. J. S. Afr. Vet. Assoc. 49, 223-227 KOPCIOWSKA, L. u. S. NICOLAU (1938): Toxoplasmose spontanée du chimpanzé. Compt. Rend. Soc. Biol. 129, 179-181 KOTULA, A.W., J.P. DUBEY, A.K. SHARAR, C.D. ANDREWS, S.K. SHEN u. D.S. LINDSAY (1991): Effect of freezing on infectivity of Toxoplasma gondii tissue cysts in pork. J. Food Prot. 54, 687-690 KRAHENBUHL, J.L., u. J.S. REMINGTON (1982): The immunology of Toxoplasma and toxoplasmosis. In: S. COHEN, K.S. WARREN (Hrsg.): Immunology of Parasitic Infections. Blackwell Scientific Publications, London, S. 356-421 KUNTZ, R.E., u. B.J. MYERS (1967): Microbiological parameters of the baboon (Papio sp.): Parasitology. In: H. VAGTBORG (Hrsg.): The Baboon in Medical Research. Bd. 2, University of Texas Press, Austin, S. 741-755 KUTICIC, V., u. T. WIKERHAUSER (1996): Studies of the effect of various treatments on the viability of Toxoplasma gondii tissue cysts and oocysts. In: U. GROSS (Hrsg.): Toxoplasma gondii. Springer-Verlag, Berlin, S. 261-265 8. Literaturverzeichnis 149 LABELLE, P., J.P. DUBEY, I. MIKAELIAN, N. BLANCHETTE, R. LAFOND, S. ST-ONGE u. D. MARTINEAU (2001): Seroprevalence of antibodies to Toxoplasma gondii in lynx (Lynx canadensis) and bobcats (Lynx rufus) from Quebec, Canada. J. Parasitol. 87, 1194-1196 LEE, J.J., G.F. LEEDALE u. P. BRADBURY (2000): An illustrated Guide to the Protozoa. Organisms traditionally referred to as protozoa, or newly discovered groups. 2. Aufl., Allen Press Inc, Lawrence LEHNER, N.D.M. (1984): Biology and diseases of Cebidae. In: J.F. FOX, B.J. COHEN u. F.M. LOEW (Hrsg.): Laboratory Animal Medicine. Academic Press, Orlando, Florida, S. 321-353 LEONG, K.M., S.P. TERRELL u. A. SAVAGE (2004): Causes of mortality in captive cotton-top tamarins (Saguinus oedipus). Zoo Biol. 23, 127-137 LEVADITI, C. u. R. SCHOEN (1933): Présence d`un toxoplasmose dans l`encéphale du cynocéphalus babuin. Bull. Soc. Path. Exot. 26, 402-405 LEVADITI, C., R. SCHOEN u. V. SANCHIS BAYARRI (1928): L’encéphalomyélite toxoplasmique chronique du lapin et de la souris. C. R. Séances Soc. Biol. Fil (Paris) 99, 37-40 LEVINE, N.D. (1985): Veterinary Protozoology. State University Press, Ames, Iowa LEVINE, N.D. (1988): The Protozoan Phylum Apikomplexa. Bd. 1 und 2, CRC Press, Boca Raton, Florida LUFT, B.J., u. J.S. REMINGTON (1992): Toxoplasmic encephalitis in AIDS. Clin. Infect. Dis. 15, 211-222 LUKESOVA, D., u. I. LITERAK (1998): Shedding of Toxoplasma gondii oocysts by Felidae in zoos in the Czech Republic. Vet. Parasitol. 74, 1-7 McCLURE, H.M., u. N.B. GUILLOUD (1971): Comparative pathology of the chimpanzee. In: G.H. BOURNE (Hrsg.): The Chimpanzee. 150 8. Literaturverzeichnis 4. Aufl., Karger-Verlag, Basel, S.103-277 McCONNELL, E.E., P.A. BASSON, V. DE VOS, B.J. MYERS u. R.E. KUNTZ (1974): A survey of diseases among 100 free-ranging baboons (Papio ursinus) from the Kruger National Park. Onderstepoort J. Vet. Res. 41, 97-167 McCONNELL, E.E., P.A. BASSON, B. WOLSTENHOLME, V. DE VOS u. H.H. MALHERBE (1973): Toxoplasmosis in free-ranging chacma baboons (Papio ursinus) from the Kruger National Park. Trans. R. Soc. Trop. Med. Hyg. 67, 851-855 McKISSICK, G.E., H.L. RATCLIFFE u. A. KOESTNER (1968): Enzootic toxoplasmosis in caged squirrel monkeys Saimiri sciureus. Pathol. Vet. 5, 538-560 MICHAELS, M.G., J.P. MCMICHAEL, K. BRASKY, S. KALTER, R.L. PETER, T.E. STARZL u. R.L. SIMMONS (1994): Screening donors for xenotransplantation. Transplantation 57, 1462-1465 MOHR, W., H. WAHLE u. A. STAMMLER (1955): Experimentelle Toxoplasma-Infektion beim Rhesusaffen. Z. Tropenmed. Parasitol. 6, 386-430 MONTALI, R.J., u. M. BUSH (1999): Diseases of the Callitrichidae. In: M.E. FOWLER u. R.E. MILLER (Hrsg.): Zoo and Wild Animal Medicine: Current Therapy. 4. Aufl., WB Saunders, Philadelphia, S. 369-376 MONTALI, R.J., M. BUSH, J. HESS, J.D. BALLOU, D.G. KLEIMAN u. B.B. BECK (1995): Ex situ diseases and their control for reintroduction of the endangered lion tamarin species (Leontopithecus spp.). Erkr. Zootiere 37, 93-98 MURATA, K. (1989): A serological survey of Toxoplasma gondii infection in zoo animals and other animals. Nippon Juigaku Zasshi 51, 935-940 NERY-GUIMARAES, F., u. A.J. FRANKEN (1971): Toxoplasmose em primates não humanos. II. Tentativas de infecções experimentais em Macaca mulatta, Cebus apella e Callithrix jacchus; e pesquisa de anticorpos em várias espécies de platyrrhinus. (Toxoplasmosis in nonhuman primates. II. Attempts at experimental infection in Macaca mulatta, Cebus apella and Callithrix jacchus, and search for antibodies in several species of platyrrhines.) Mem. Inst. Oswaldo Cruz 69, 97-111 8. Literaturverzeichnis 151 NERY-GUIMARAES, F., A.J. FRANKEN u. W.A. CHAGAS (1971): Toxoplasmose em primates não humanos. I. Infeccões naturais em Macaca mulatta e Cebus apella. (Toxoplasmosis in nonhuman primates. I. Natural infection in Macaca mulatta and Cebus apella.) Mem. Inst. Oswaldo Cruz 69, 77-87 NICOLLE, C., u. L. MANCEAUX (1908): Sur une infection à corps de Leishman (ou organismes voisins) du gondi. C. R. Hebd. Séances Acad. Sci. 147, 763-766 NICOLLE, C., u. L. MANCEAUX (1909): Sur une protozoaire nouveau du gondi. C. R. Hebd. Séances Acad. Sci. 148, 369-372 NIGI, H., u. C. ITAKURA (1968): Spontaneous toxoplasmosis in Lemur catta. Primates 9, 155-160 NOSSAL, G. J.V. (1992): The molecular and cellular basis of affinity maturation in the antibody response. Cell 68, 1-2 PARROTT, T.Y. (1997): An introduction to diseases of nonhuman primates. In: K.L. ROSENTHAL (Hrsg.): Practical Exotic Animal Medicine. Veterinary Learning Systems, Trenton, NJ, S. 258-263 PERRI, S.F., N.E. PALUMBO, M.H. HIGA u. H.E. BLATT (1992): Toxoplasmosis: An avirulent zoonosis in Hawaii. Contemp. Top. Lab. Anim. Sci. 31, 25 PERTZ, C., R.R. DUBIELZIG u. D.S. LINDAY (1997): Fatal Toxoplasma gondii infection in golden lion tamarins (Leontopithecus rosalia rosalia). J. Zoo Wildl. Med. 28, 491-493 POKORNY, J., J. HÜBNER u. M. ZASTERA (1961): Izolace kmenu Toxoplasma gondii z nĕktery ch domacich i volnĕ zĭjicich zvirat. Cesk. Epidemiol. Mikrobiol. Immunol. 10, 323-329 POTKAY, S. (1992): Diseases of the Callitrichidae: A review. J. Med. Primatol. 21, 189-236 POLANEC, J., I. SEPPÄLA, S. ROUSSEAU u. K. HEDMAN (1994): Evaluation of protein-denaturing immunoassays for avidity of immunoglobulin G to rubella virus. J. Clin. Lab. Analys. 8, 16-21 152 8. Literaturverzeichnis PROWTEN, A.W., R.V. LEE, R.M. KRISHNAMSETTY, S.K. SATCHIDANAND u. B.I.S. SRIVASTAVA (1985): T-cell lymphoma associated with immunologic evidence of retrovirus infection in a lowland gorilla. J. Am. Vet. Med. Assoc. 187, 1280-1282 PULLEN, G.R., M.G. FITZGERALD u. C.S. HOSKING (1986): Antibody avidity determination by ELISA using thiocyanate elution. J. Immunol. Methods 106, 119-125 RAO BHAU, L.N., T.K. KULSHRESTHA, S.K. BHANDARI u. J. SOKHEY (1987): Sero-epidemiology of toxoplasmosis in rhesus monkeys in India. Indian Vet. J. 64, 557-559 RATCLIFFE, H.L. (1954): Causes of death in the animal collection. Rept. Penrose Res. Lab. Zool. Soc. Philadelphia 1954, 6-16 RATCLIFFE, H.L. (1961): Causes of death in the animal collection. Rept. Penrose Res. Lab. Zool. Soc. Philadelphia 1961, 6-18 RATCLIFFE, H.L., u. C.B. WORTH (1951): Toxoplasmosis of captive wild birds and mammals. Am. J. Pathol. 27, 655-667 REMINGTON, J.S., O.A. SOAVE u. J. DAVIS (1965): A serological survey in three species of monkeys for antibodies to Toxoplasma. Am. J. Trop. Med. Hyg. 14, 724-726 REMINGTON, J.S., u. G. DESMONTS (1983): Toxoplasmosis. In: J.S. REMINGTON u. J.O. KLEIN (Hrsg.): Infectious Diseases of the Fetus and Newborn Infant. 2. Aufl., W.D. Saunders, Philadelphia, S. 143-263 RIEMANN, H.P., D.E. BEHYMER, M.E. FOWLER, T. SCHULZ, A. LOCK, J.G. ORTHOEFER, S. SILVERMAN u. C.E. FRANTI (1974): Prevalence of antibodies to Toxoplasma gondii in captive exotic mammals. J. Am. Vet. Med. Assoc. 165, 798-800 SABIN, A.B. (1939): Biological and immunological identity of Toxoplasma of animal and human origin. Proc. Soc. Exp. Biol. 41, 75-80 SABIN, A.B., u. H.A. FELDMAN (1948): Dyes as microchemical indicators of a new immunity phenomenon affecting a protozoan parasite (Toxoplasma). Science 108, 660-663 8. Literaturverzeichnis 153 SASSEVILLE, V.G., D.R. PAULEY, J.J. MACKEY u. M.A. SIMON (1995): Concurrent central nervous system toxoplasmosis and simian immunodeficiency virus-induced AIDS encephalomyelitis in a Barbary macaque (Macaca sylvana). Vet. Pathol. 32, 81-83 SCHOLTYSECK, E., u. G. PIEKARSKI (1965): Elektronenmikroskopische Untersuchungen an Merozoiten von Eimerien (Eimeria perforans und E. stiedae) und Toxoplasma gondii: Zur systematischen Stellung von T. gondii. Z. Parasitenkd. 26, 91-115 SCHOONDERMARK-VAN DE VEN, E., J. GALAMA, T. VREE, W. CAMPS, I. BAARS, T. ESKES, J. MEUWISSEN u. W. MELCHERS (1995): Study of treatment of congenital Toxoplasma gondii infection in rhesus monkeys with pyrimethamine and sulfadiazine. Antimicrob. Agents Chemother. 39, 137-144 SCHOONDERMARK-VAN DE VEN, E., W. MELCHERS, W. CAMPS, T. ESKES, J. MEUWISSEN u. J. GALAMA (1994): Effectiveness of spiramycin for treatment of congenital Toxoplasma gondii infection in rhesus monkeys. Antimicrob. Agents Chemother. 38, 1930-1936 SCHOONDERMARK-VAN DE VEN, E., W. MELCHERS, J. GALAMA, W. CAMPS, T. ESKES u. J. MEUWISSEN (1993): Congenital toxoplasmosis: An experimental study in rhesus monkeys for transmission and prenatal diagnosis. Exp. Parasitol. 77, 200-211 SEIBOLD, H.R., u. R.H. WOLF (1971): Toxoplasmosis in Aotus trivirgatus and Callicebus moloch. Lab. Anim. Sci. 21, 118-120 SERY, V., J. SAUER, P. VAN NONG, O. JIROVEC, J. JIRA u. J. SEEMAN (1959): Study of toxoplasmosis in Vietnam. J. Hyg. Epidemiol. Microbiol. Immunol. 3, 444 SIMON, K.G.M. (1995): Evaluierung diagnostischer Tests zur Untersuchung von Infektionen mit Toxoplasma gondii bei Katzen und Schafen. Hannover, Tierärztl. Hochschule, Diss. SPENCER, J.A., K.S. JOINER, C.D. HILTON, J.P. DUBEY, M. TOIVIO-KINNUCAN, J.K. MINC u. B.L. BLAGBURN (2004): Disseminated toxoplasmosis in a captive ring-tailed lemur (Lemur catta). J. Parasitol. 90, 904-906 154 8. Literaturverzeichnis STOLZ, G. (1962): Spontane, letal verlaufende Toxoplasmose bei einem Affen. Schweiz. Arch. Tierheilkd. 104, 162-166 SUREAU, P., J.P. RAYNAUD, C. LAPEIRE u. E.R. BRYGOO (1962): Premier isolement de Toxoplasma gondii à Madagascar. Toxoplasmose spontanée et expérimentale du Lemur catta. Bull. Soc. Pathol. Exot. Filiales 55, 358-362 SWENSON, R.B. (1993): Protozoal parasites of great apes. In: M.E. FOWLER (Hrsg.): Zoo and Wild Animal Medicine: Current Therapy. 3.Aufl., W.B. Saunders, Philadelphia, S. 352-355 SULAIMAN, L.H., J.W. MAK u. K. SURESH (1989): Prevalence of Toxoplasma antibodies in monkeys in Malaysia. Trop. Biomed. 6, 147-148 TENTER, A.M., A.R. HECKEROTH u. L.M. WEISS (2000): Toxoplasma gondii: from animals to humans. Int. J. Parasitol. 30, 1217-1258 THEZE, J. (1916): Pathologie de la Guyane française (Lépre, Filariose etc.). Rapport sur les travaux de l`Institute d`Hygiene et de Bactériologie 1914-1915. Bull. Soc. Pathol. Exot. 9, 446-469 THORINGTON, R.W. (1968): Observations of squirrel monkeys in a Columbian forest. In: L.A. ROSENBLUM u. R.W. COOPER (Hrsg.): The Squirrel Monkey. Academic Press, New York, S. 69-85 TUDGE, C. (1991): Veterinary science at London and Whipsnade: Cases and discoveries. In: C. TUDGE (Hrsg.): Science for Conservation. Zoological Society of London, London, S. 52-56 UILENBERG, G. (1970): Quelques protozaires parasites de mammifères sauvages à Madagascar. Ann. Parasitol. Hum. Comp. 45, 183-194 UILENBERG, G., u. J.J. RIBOT (1965): Note sur la toxoplasmose des lémuriens (Primates, Lemuridae). Rev. Elev. Med. Vet. Pays Trop. 19, 247-248 8. Literaturverzeichnis 155 UMINSKI, J., u. J. PIETRZYK (1961): Wyniki badan malp w kierunku toksoplazmozy przy pomocy odczynu wiazania dopelniacza. (Results of investigations performed by means of complement fixation test (C.F.T.) concerning toxoplasmosis in apes.) Wiad. Parazytol. 7(Suppl.), 411-412 VAN DEN AKKER, S. P.H. BOOL u. W.C. SPITS-ESHUIS (1959): Toxoplasmosis bij een hond. (Toxoplasmosis in a dog.) Tijdschr. Diergeneesk. 84, 767-773 WARREN, J., u. A.B. SABIN (1942): The complement fixation reaction in toxoplasmic infection. Proc. Soc. Exp. Biol. Med. 51, 11-14 WERNER, H., K. JANITSCHKE u. H. KOEHLER (1969): Über Beobachtungen an Marmoset-Affen Saguinus (Oedipomidas) nach oraler und intraperitonealer Infektion mit verschiedenen zystenbildenden Toxoplasma-Stämmen unterschiedlicher Virulenz . I. Mitteilung: Klinische, pathologisch-anatomische, histologische und parasitologische Befunde Zentralbl. Bakteriol. (Orig.) 209, 553-569 WOHLSEIN, P., H.P. BRANDT, M. BRACK, M. PETERS, G. SCHARES, M. BOER (1999): Immunohistological and molecular biological investigations on non-human primates with disseminated toxoplasmosis. Erkr. Zootiere. 39, 209-214 WOLFF, P.L. (1990): The parasites of New World primates: A review. Am. Assoc. Zoo Vet. Annu. Proc. 1990, 87-94 WOLFF, P.L. (1993): Parasites of New World primates. In: M.E. FOWLER (Hrsg.): Zoo and Wild Animal Medicine: Current Therapy. 3. Aufl., W.P. Saunders, Philadelphia, S. 378-389 WONG, M.M., u. W.J. KOZEK (1974): Spontaneous toxoplasmosis in macaques: A report of four cases. Lab. Anim. Sci. 24, 273-278 WONG, M.M., J. THEIS u. S. KARR JR (1974): Experimental toxoplasmosis in the stumptailed macaque (M. arctoides). J. Med. Primatol. 3, 195-212 WOOLF, A., u. T.R. ANTHONEY (1982): Dropping out. Lab. Anim. (NY) 11, 13-14 156 8. Literaturverzeichnis YAMAMOTO, M., M. TOKUCHI, S. HOTTA u. B. NOERJASIN (1970): A survey of anti-Toxoplasma hemagglutinating antibodies in sera from residents and certain species of animals in Surabaja, Indonesia. Kobe J. Med. Sci. 16, 273-280 ZAMAN, V., u. T.K. GOH (1968): Isolation of Toxoplasma gindii from the slow loris, Nycticebus coucang. Ann. Trop. Med. Parasitol. 62, 52-53 ZAMAN, V., u. A. KRISHNAMURTI (1969): Distribution of Toxoplasma cysts in the central nervous system of slow loris, Nycticebus coucang. Acta Trop. 26, 167-172 ZHANG, S.Y., M.X. WEI, Z.Y. ZHOU, J.Y. YU u. X.Q. SHI (2000): Prevalence of antibodies to Toxoplasma gondii in the sera of rare wildlife in the Shanghai Zoological Garden, People's Republic of China. Parasitol. Int. 49, 171-174 ZWART, P., M.J. KAASHOEK, M. VAN DER HAGE u. G.M. DORRESTEIN (1989): Erkrankungen südamerikanischer Säugetiere aus niederländischen Tiergärten. Erkr. Zootiere 31, 7-14 9. Anhang 157 9. ANHANG 9.1. Chemikalien und andere Reagenzien Tab. 17: Chemikalien und andere Reagenzien Produkt Bezug von bovines Serumalbumin (Fraction V, 96-99 % Albumin) SIGMA-ALDRICH, Steinheim C6H8O7 (Zitrat) SIGMA-ALDRICH, Steinheim CO(NH2)2 (Harnstoff) SERVA, Heidelberg Ethanol, absolut MERCK, Darmstadt Evans Blau MERCK, Darmstadt Formaldehydlösung, mind. 37%ig MERCK, Darmstadt Glyzerin MERCK, Darmstadt H2O2 (Wasserstoffperoxyd, 30%ig) SIGMA-ALDRICH, Steinheim H2SO4 (Schwefelsäure 95-97%ig) MERCK, Darmstadt KCl (Kaliumchlorid) MERCK, Darmstadt KH2PO4 (Kaliumdihydrogenphosphat) MERCK, Darmstadt Methylenblau MERCK, Darmstadt NaCl (Natriumchlorid) ROTH, Karlsruhe Na2CO3 (Natriumkarbonat) MERCK, Darmstadt NaHCO3 (Natriumhydrogenkarbonat) MERCK, Darmstadt Na2HPO4 (Natriumhydrogenphosphat) MERCK, Darmstadt Na2B4O7 (Dinatriumtetraborat) MERCK, Darmstadt OPD (o-Phenylendiamin-Dihydrochlorid) SIGMA-ALDRICH, Steinheim Penizillin/Streptomyzin (10000 IU/ml Penizillin + 10000 µg/ml Streptomyzin) p-Phenylendiamin GIBCO BRL, Eggenstein SIGMA-ALDRICH, Steinheim Trypsin DIFCO, Detroit, USA Tween 20 (Polyoxyethylen-Sorbitan-Monolaurat) SIGMA-ALDRICH, Steinheim 158 9. Anhang 9.2. Lösungen Beschichtungspuffer (Karbonat-Bikarbonat-Puffer, pH 9,6) Na2CO3 NaHCO3 Aqua bidestillata 1,59 g 2,93 g ad 1000 ml Der Puffer wurde in Portionen zu je 50 ml abgefüllt und bei –20 °C bis zum weiteren Gebrauch gelagert. 5 % BSA in PBS (BSA-PBS) BSA PBS 0,5 g ad 10 ml Die Lösung wurde jeweils frisch angesetzt. 2 % BSA in PBS-Tween (BSA-PBS-Tween) BSA PBS-Tween 0,2 g ad 10 ml Die Lösung wurde jeweils frisch angesetzt. Eindeckmedium Kochsalzlösung: Na2HPO4 + 2 H2O NaCl Aqua bidestillata 1,8 g 0,6 g ad 1000 ml Die Salze wurden in einem 1000-ml-Kolben gelöst, 20 ml dieser Lösung wurden in einen 100-mlKolben überführt. Dazu wurden 0,2 g p-Phenylendiamin* gegeben und gründlich gemischt. Anschließend wurden 180 ml Glyzerin* zugefügt. Der pH-Wert wurde mit KarbonatBikarbonatpuffer 0,5 M auf 8,0 eingestellt. Das Eindeckmedium wurde portioniert, mit Alufolie zugedeckt und bei –20 °C gelagert. Evans-Blau-Lösung Evans Blau Aqua bidestillata 0,2 g ad 100 ml 9. Anhang 159 1%ige Formaldehyd-Lösung Formaldehydlösung, mind. 37%ig* PBS 3 ml 108 ml 2,5 M H2SO4 (Stopperlösung) H2SO4 (96-99%ig) Aqua bidestillata 66,8 ml ad 500 ml Harnstoff Aqua bidestillata 48,0 g ad 100 ml 8 M Harnstoff in H2O Nach vollständiger Lösung des Harnstoffes wurde die Lösung in Portionen zu je 1 ml abgefüllt und bei –20 °C bis zum weiteren Gebrauch gelagert. 6 M Harnstoff in PBS-Tween Harnstoff PBS-Tween 36,0 g ad 100 ml Die Lösung wurde jeweils frisch angesetzt. 0,5 M Karbonat-Bikarbonatpuffer (pH 9,0) NaHCO3 Na2CO3 Aqua bidestillata 42,0 g 53,0 g ad 1000 ml Methylenblau* Ethanol, absolut* Na2CO3 Aqua bidestillata Na2B4O7* x 10 H2O Aqua bidestillata Lösung a Lösung b Lösung c 2,0 g ad 100 ml 5,3 g ad 1000 ml 1,91 g ad 100 ml 3 ml 9,73 ml 0,27 ml Methylenblaulösung Lösung a: Lösung b: Lösung c: Gebrauchslösung: 160 9. Anhang 10 x PBS (Stammlösung) NaCl KH2PO4 Na2HPO4 KCl Aqua bidestillata 400,0 g 10,0 g 57,5 g 10,0 g ad 5000 ml NaCl KH2PO4 Na2HPO4 KCl Aqua bidestillata 8,00 g 0,20 g 1,15 g 0,20 g ad 1000 ml 1 x PBS, pH 7,4 PBS-Tween, pH 7,4 Tween 20 PBS 0,5 ml ad 1000,0 ml 0,2 M Phosphatlösung Na2HPO4 Aqua bidestillata 28,4 g ad 1000 ml Die Lösung war bei 4 °C eine Woche haltbar. Substratpuffer für ELISA, pH 5,0 0,1 M Zitratlösung 0,2 M Phosphatlösung Aqua bidestillata OPD H2O2 (30 %) 18,2 ml 19,3 ml 37,5 ml 30 mg 30 µl 0,5 %ige Trypsin-PBS-Lösung Trypsin PBS 0,5 g ad 100 ml 0,1 M Zitratlösung C6H8O7 (wasserfrei) Aqua bidestillata Die Lösung war bei 4 °C eine Woche haltbar. 19,2 g ad 1000 ml 9. Anhang 161 9.3. Ergebnisse aus dem IgG-Aviditäts-ELISA Im Anhang sind alle im IgG-Aviditäts-ELISA ermittelten Ergebnisse aufgeführt, die nicht in Kap. 4.3. gezeigt sind. 9.3.1. Weißkopfmakis H2, Mai 1 1 0,8 0,6 0,4 0,4 0 0 320 1280 0,4 40 160 10 640 mit Harnsto ff o hne Harnsto ff mit Harnsto ff H3, März 1 1 1 0,2 ELISA-Index 1,2 0,4 0,8 0,6 0,4 0,2 0 40 160 640 o hne Harnsto ff mit Harnsto ff 40 160 o hne Harnsto ff H3, Juni 10 mit Harnsto ff 0,4 0,4 0,2 0 160 640 reziproke Serumverdünnung mit Harnsto ff 1 0,6 0 mit Harnsto ff H4, Mai 0,8 0,2 640 1,2 ELISA-Index ELISA-Index 0,6 160 o hne Harnsto ff 1 1 40 reziproke Serumverdünnung H3, Dezem ber 0,8 o hne Harnsto ff 0,4 640 1,2 40 0,6 reziproke Serumverdünnung 1,2 10 0,8 0 10 reziproke Serumverdünnung mit Harnsto ff 0,2 0 10 640 H3, Mai 1,2 0,6 160 o hne Harnsto ff 1,2 0,8 40 reziproke Serumverdünnung reziproke Serumverdünnung ELISA-Index ELISA-Index 0,6 0 H2, Dezem ber ELISA-Index 0,8 0,2 10 reziproke Serumverdünnung o hne Harnsto ff 1 0,6 0,2 80 1,2 0,8 0,2 20 H2, Juni ELISA-Index 1,2 ELISA-Index ELISA-Index H2, März 1,2 0,8 0,6 0,4 0,2 0 10 40 160 640 reziproke Serumverdünnung o hne Harnsto ff mit Harnsto ff 10 40 160 640 reziproke Serumverdünnung o hne Harnsto ff mit Harnsto ff 162 9. Anhang H4, Dezem ber 1 1 1 0,8 0,6 0,4 0,8 0,6 0,4 0,2 0,2 0 0 40 160 640 mit Harnsto ff 640 20 mit Harnsto ff 0,4 0,4 0 0 320 1280 0,6 0,4 0 40 160 10 640 reziproke Serumverdünnung mit Harnsto ff o hne Harnsto ff H6, Mai mit Harnsto ff 0,6 0,4 0,2 1,2 1 1 0,8 0,6 0,4 640 o hne Harnsto ff 0,8 0,6 0,4 0 10 40 160 20 640 reziproke Serumverdünnung reziproke Serumverdünnung mit Harnsto ff o hne Harnsto ff H7, März H7, Mai 1 0,8 0,6 0,4 0,2 0 0 10 40 160 640 reziproke Serumverdünnung o hne Harnsto ff mit Harnsto ff ELISA-Index 1 ELISA-Index 1 0,2 1280 mit Harnsto ff H7, Juni 1,2 0,4 320 o hne Harnsto ff mit Harnsto ff 1,2 0,6 80 reziproke Serumverdünnung 1,2 0,8 mit Harnsto ff 0,2 0 160 640 H6, Dezem ber 1,2 0,2 0 160 o hne Harnsto ff ELISA-Index ELISA-Index 1 0,8 40 reziproke Serumverdünnung H6, Juni 1,2 40 0,8 0,2 10 reziproke Serumverdünnung o hne Harnsto ff 1 0,6 0,2 mit Harnsto ff H5, Dezem ber 0,8 0,2 1280 1,2 ELISA-Index 0,6 320 o hne Harnsto ff 1 0,8 80 reziproke Serumverdünnung H5, Juni ELISA-Index ELISA-Index 160 o hne Harnsto ff 1 ELISA-Index 40 1,2 10 0,4 0 H5, Mai 80 0,6 reziproke Serumverdünnung 1,2 20 0,8 0,2 10 reziproke Serumverdünnung o hne Harnsto ff ELISA-Index 1,2 10 ELISA-Index H5, März 1,2 ELISA-Index ELISA-Index H4, Juni 1,2 0,8 0,6 0,4 0,2 0 20 80 320 1280 reziproke Serumverdünnung o hne Harnsto ff mit Harnsto ff 10 40 160 640 reziproke Serumverdünnung o hne Harnsto ff mit Harnsto ff 9. Anhang 163 H8, März 1,2 1 1 0,8 0,6 0,4 0,6 0,4 0,2 0 0 40 160 mit Harnsto ff 10 0,8 0,6 0,4 mit Harnsto ff 0,4 0 0 o hne Harnsto ff 0,8 0,6 0,4 0 40 160 640 10 reziproke Serumverdünnung mit Harnsto ff o hne Harnsto ff mit Harnsto ff 1 ELISA-Index 1,2 1 ELISA-Index 1,2 0,2 0,8 0,6 0,4 0,2 0 40 160 640 o hne Harnsto ff mit Harnsto ff 80 320 o hne Harnsto ff H23, Mai 10 mit Harnsto ff 0,6 0,4 0,6 0,4 0,2 0 640 reziproke Serumverdünnung o hne Harnsto ff mit Harnsto ff mit Harnsto ff H32, März 1 0 640 1,2 0,8 0,2 160 o hne Harnsto ff ELISA-Index ELISA-Index 1 40 reziproke Serumverdünnung H23, Juni 0,8 160 0,4 1280 1,2 40 0,6 reziproke Serumverdünnung 1,2 10 0,8 0 20 reziproke Serumverdünnung mit Harnsto ff 0,2 0 10 640 H23, März 1 0,4 160 o hne Harnsto ff 1,2 0,6 40 reziproke Serumverdünnung H22, Juni 0,8 mit Harnsto ff 0,2 10 640 640 1 0,6 0,2 160 H22, März 0,8 0,2 40 reziproke Serumverdünnung 1,2 H22, Mai ELISA-Index 640 ELISA-Index ELISA-Index ELISA-Index 1 reziproke Serumverdünnung ELISA-Index 160 H21, Juni 1,2 o hne Harnsto ff 40 o hne Harnsto ff 1 160 0,4 reziproke Serumverdünnung 1,2 40 0,6 0 H21, Mai 10 0,8 0,2 10 640 reziproke Serumverdünnung o hne Harnsto ff 1 0,8 0,2 10 H21, März 1,2 ELISA-Index ELISA-Index ELISA-Index H7, Dezem ber 1,2 1 0,8 0,6 0,4 0,2 0 10 40 160 640 reziproke Serumverdünnung o hne Harnsto ff mit Harnsto ff 10 40 160 640 reziproke Serumverdünnung o hne Harnsto ff mit Harnsto ff 164 9. Anhang H32, Juni 1,2 1,2 1 1 ELISA-Index ELISA-Index H32, Mai 0,8 0,6 0,4 0,2 0 0,8 0,6 0,4 0,2 0 10 40 160 640 10 reziproke Serumverdünnung o hne Harnsto ff 40 160 640 reziproke Serumverdünnung mit Harnsto ff o hne Harnsto ff mit Harnsto ff 9.3.2. Kattas H24, März H25, März 1,2 1 ELISA-Index ELISA-Index 1,2 0,8 0,6 0,4 0,2 0 1 0,8 0,6 0,4 0,2 0 10 40 160 640 10 o hne Harnsto ff 40 160 640 reziproke Serumverdünnung reziproke Serumverdünnung mit Harnsto ff o hne Harnsto ff mit Harnsto ff 9.3.3. Totenkopfaffen H11, März H13, März ELISA-Index ELISA-Index 1 0,8 0,6 0,4 1,2 1 1 0,8 0,6 0,4 0,2 0,2 0 0 10 40 160 640 reziproke Serumverdünnung o hne Harnsto ff mit Harnsto ff H14, März 1,2 ELISA-Index 1,2 0,8 0,6 0,4 0,2 0 20 80 320 1280 reziproke Serumverdünnung o hne Harnsto ff mit Harnsto ff 10 40 160 640 reziproke Serumverdünnung o hne Harnsto ff mit Harnsto ff 9. Anhang 165 H15, März H16, März 1,2 1 0,8 0,6 0,4 0,8 0,6 0,4 0,2 0,2 0 0 10 40 160 640 0,4 0 o hne Harnsto ff 40 160 o hne Harnsto ff H20, März 10 640 mit Harnsto ff 0,6 0,4 0,2 0 0 10 40 160 0,8 0,6 0,4 0,2 0 10 640 40 160 640 10 reziproke Serumverdünnung reziproke Serumverdünnung o hne Harnsto ff 1 0,8 0,2 mit Harnsto ff o hne Harnsto ff mit Harnsto ff 1 1,2 0,2 ELISA-Index 1 ELISA-Index 1,4 0,4 0,8 0,6 0,4 0,2 0 40 160 640 reziproke Serumverdünnung o hne Harnsto ff mit Harnsto ff B7 1,2 1 0,8 0,6 0,4 0,2 0 10 40 160 640 reziproke Serumverdünnung o hne Harnsto ff mit Harnsto ff mit Harnsto ff 1 0,8 0,6 0,4 0,2 0 10 640 B6 1,2 0,6 160 o hne Harnsto ff J1 H30, März 40 reziproke Serumverdünnung 1,2 0,8 mit Harnsto ff H29, März ELISA-Index ELISA-Index 0,4 640 1,2 1 0,6 160 o hne Harnsto ff H28, März 0,8 40 reziproke Serumverdünnung 1,2 1 ELISA-Index 0,6 reziproke Serumverdünnung 1,2 ELISA-Index 0,8 0,2 10 reziproke Serumverdünnung mit Harnsto ff ELISA-Index 1 ELISA-Index ELISA-Index 1 ELISA-Index H17, März 1,2 1,2 0 10 40 160 640 reziproke Serumverdünnung o hne Harnsto ff mit Harnsto ff 10 40 160 640 reziproke Serumverdünnung o hne Harnsto ff mit Harnsto ff 166 9. Anhang 9.3.4. Andere Neuweltaffen M7 1,2 1 1 ELISA-Index ELISA-Index M2 1,2 0,8 0,6 0,4 0,2 0,8 0,6 0,4 0,2 0 0 10 40 160 10 640 reziproke Serumverdünnung o hne Harnsto ff 40 160 640 reziproke Serumverdünnung mit Harnsto ff o hne Harnsto ff mit Harnsto ff 9.3.5. Rhesusaffen R2 10 40 160 640 10 mit Harnsto ff 160 640 reziproke Serumverdünnung o hne Harnsto ff 640 10 mit Harnsto ff mit Harnsto ff 40 160 640 reziproke Serumverdünnung o hne Harnsto ff 160 640 o hne Harnsto ff mit Harnsto ff R6 1,6 1,4 1,2 1 0,8 0,6 0,4 0,2 0 10 40 reziproke Serumverdünnung ELISA-Index ELISA-Index 0,8 0,6 0,4 0,2 0 R5 ELISA-Index 40 160 o hne Harnsto ff R4 1,6 1,4 1,2 1 0,8 0,6 0,4 0,2 0 10 40 1,6 1,4 1,2 1 reziproke Serumverdünnung reziproke Serumverdünnung o hne Harnsto ff R3 1,6 1,4 1,2 1 0,8 0,6 0,4 0,2 0 ELISA-Index ELISA-Index ELISA-Index R1 1,6 1,4 1,2 1 0,8 0,6 0,4 0,2 0 mit Harnsto ff 1,6 1,4 1,2 1 0,8 0,6 0,4 0,2 0 10 40 160 640 reziproke Serumverdünnung o hne Harnsto ff mit Harnsto ff 9. Anhang 167 R9 0,8 0,6 0,4 0,2 0 10 40 160 10 640 reziproke Serumverdünnung o hne Harnsto ff 10 640 640 10 40 10 mit Harnsto ff 160 o hne Harnsto ff R18 640 mit Harnsto ff R19 ELISA-Index 1,6 1,4 1,2 1 0,8 0,6 0,4 0,2 0 160 640 reziproke Serumverdünnung mit Harnsto ff 1,6 1,4 1,2 1 0,8 0,6 0,4 0,2 0 10 40 160 640 reziproke Serumverdünnung o hne Harnsto ff 40 160 640 o hne Harnsto ff mit Harnsto ff R17 reziproke Serumverdünnung mit Harnsto ff mit Harnsto ff reziproke Serumverdünnung ELISA-Index ELISA-Index ELISA-Index o hne Harnsto ff ELISA-Index 160 1,6 1,4 1,2 1 0,8 0,6 0,4 0,2 0 640 640 1,6 1,4 1,2 1 0,8 0,6 0,4 0,2 0 R15 160 160 R13 o hne Harnsto ff mit Harnsto ff reziproke Serumverdünnung o hne Harnsto ff 40 40 o hne Harnsto ff reziproke Serumverdünnung R14 40 mit Harnsto ff ELISA-Index ELISA-Index ELISA-Index 160 1,6 1,4 1,2 1 0,8 0,6 0,4 0,2 0 10 10 reziproke Serumverdünnung R12 o hne Harnsto ff 40 640 1,6 1,4 1,2 1 0,8 0,6 0,4 0,2 0 reziproke Serumverdünnung 10 160 o hne Harnsto ff R11 40 40 1,6 1,4 1,2 1 0,8 0,6 0,4 0,2 0 reziproke Serumverdünnung mit Harnsto ff 1,6 1,4 1,2 1 0,8 0,6 0,4 0,2 0 10 R10 1,6 1,4 1,2 1 0,8 0,6 0,4 0,2 0 ELISA-Index ELISA-Index ELISA-Index R7 1,6 1,4 1,2 1 mit Harnsto ff 1,6 1,4 1,2 1 0,8 0,6 0,4 0,2 0 10 40 160 640 reziproke Serumverdünnung o hne Harnsto ff mit Harnsto ff Hannover, den 28.2.2006 Erklärung Hiermit erkläre ich, dass ich die Dissertation mit dem Titel „Serologische Untersuchungen zur Toxoplasmose nicht humaner Primaten“ selbstständig verfasst habe. Bei der Anfertigung wurde für die statistische Auswertung die Hilfe von Herrn Dr. Rohn vom Institut für Biometrie, Epidemiologie und Informationsverarbeitung der Stiftung Tierärztliche Hochschule Hannover in Anspruch genommen. Die Durchführung des SFTs erfolgte von Frau Dr. Ingrid Reiter-Owona am Institut für Medizinische Mikrobiologie, Immunologie und Parasitologie der Rheinischen FriedrichWilhelms-Universität in Bonn. Ich habe keine entgeltliche Hilfe von Vermittlungs- bzw. Beratungsdiensten (Promotionsberater oder anderer Personen) in Anspruch genommen. Niemand hat von mir mittelbar oder unmittelbar entgeltliche Leistungen für Arbeiten erhalten, die im Zusammenhang mit dem Inhalt der vorgelegten Dissertation stehen. Ich habe die Dissertation am Institut für Parasitologie der Stiftung Tierärztliche Hochschule Hannover angefertigt. Die Dissertation wurde bisher nicht für eine Prüfung oder Promotion oder für einen ähnlichen Zweck zur Beurteilung eingereicht. Ich versichere, dass ich die vorstehenden Angaben nach bestem Wissen vollständig und der Wahrheit entsprechend gemacht habe. DANKSAGUNG Ein herzliches Dankeschön geht an... ... Frau Prof. Dr. Astrid M. Tenter für die Überlassung des interessanten Themas sowie für die freundliche Betreuung und gute Unterstützung bei der Anfertigung dieser Dissertation. ... Herrn Prof. Dr. Michael Böer für die gute Zusammenarbeit und die stets freundliche Unterstützung bei der Probennahme. ... den Serengeti-Park Hodenhagen, insbesondere an die Familie Sepe, ohne deren Einverständnis diese Dissertation nicht möglich gewesen wäre, sowie an die Tierpfleger für ihre Hilfsbereitschaft. ... Frau Dr. Ingrid Reiter-Owona sowie an die Mitarbeiter des Instituts für Medizinische Mikrobiologie, Immunologie und Parasitologie der Rheinischen Friedrich-Wilhelms-Universität in Bonn für die Untersuchung der Serumproben im SFT und die Überlassung des T.-gondii-Stammes BK. ... die Mitarbeiter des Deutschen Primatenzentrums in Göttingen, insbesondere an Frau Dr. Annette Schrod für die Hilfestellung beim Erlernen der Blutprobennahme sowie an Frau Dr. Kerstin Mätz-Rensing für das Sammeln und Versenden der Serumproben. ... den Arche Noah Zoo Braunschweig, den Tier- und Freizeitpark Jaderberg sowie den Zoologischen Garten Magdeburg, insbesondere an Herrn Pierre Grothmann, Herrn Dr. Minnemann und Herrn Dr. M. Tanner für die gute Zusammenarbeit und für die Möglichkeit, die Tiere auf T. gondii zu untersuchen, sowie an alle Tierpfleger für ihre Hilfsbereitschaft. ... alle Mitarbeiter des Instituts für Parasitologie der Stiftung Tierärztliche Hochschule Hannover, insbesondere an alle Mitglieder meiner Arbeitsgruppe für die stets entgegengebrachte Hilfsbereitschaft und das gute Arbeitsklima sowie an Frau Sabine Streichan, Frau Claudia Backenecker und Frau Amelie Kraemer für die Unterstützung bei der Probennahme. ... Herrn Dr. Karl Rohn aus dem Institut für Biometrie, Epidemiologie und Informations- verarbeitung der Stiftung Tierärztliche Hochschule Hannover für die Beratung. ... Herrn Norbert Schulze, der für mich einen Kescher gebastelt hat. ... die Tierärztliche Gemeinschaftspraxis Heeslingen für die spontan gewährten Urlaubstage. ... meine Eltern, die mich während der ganzen Zeit finanziell unterstützt und trotzdem nie gedrängt haben. ... Heinke, die auch während ihrer schwersten Stunden noch an mich und an diese Dissertation dachte. ... Christian für die große Unterstützung (insbesondere in der Endphase!) sowie an alle meine Freunde für das Verständnis, wenn ich mal wieder keine Zeit hatte. ... den gelben Institutsbus, der trotz des lauten Geklappers nie liegengeblieben ist.