Gentest ermöglicht Diagnose des Familiären Mittelmeerfiebers
Werbung
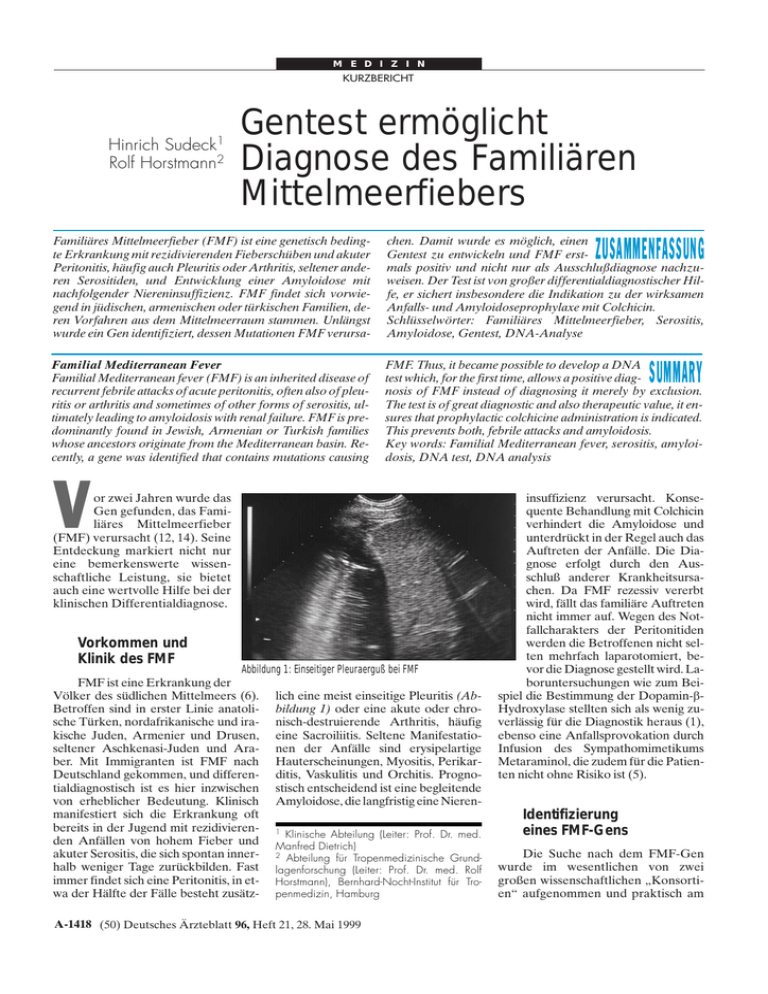
M E D I Z I N KURZBERICHT Hinrich Sudeck1 Rolf Horstmann2 Gentest ermöglicht Diagnose des Familiären Mittelmeerfiebers ZUSAMMENFASSUNG Familiäres Mittelmeerfieber (FMF) ist eine genetisch bedingte Erkrankung mit rezidivierenden Fieberschüben und akuter Peritonitis, häufig auch Pleuritis oder Arthritis, seltener anderen Serositiden, und Entwicklung einer Amyloidose mit nachfolgender Niereninsuffizienz. FMF findet sich vorwiegend in jüdischen, armenischen oder türkischen Familien, deren Vorfahren aus dem Mittelmeerraum stammen. Unlängst wurde ein Gen identifiziert, dessen Mutationen FMF verursa- chen. Damit wurde es möglich, einen Gentest zu entwickeln und FMF erstmals positiv und nicht nur als Ausschlußdiagnose nachzuweisen. Der Test ist von großer differentialdiagnostischer Hilfe, er sichert insbesondere die Indikation zu der wirksamen Anfalls- und Amyloidoseprophylaxe mit Colchicin. Schlüsselwörter: Familiäres Mittelmeerfieber, Serositis, Amyloidose, Gentest, DNA-Analyse Familial Mediterranean Fever Familial Mediterranean fever (FMF) is an inherited disease of recurrent febrile attacks of acute peritonitis, often also of pleuritis or arthritis and sometimes of other forms of serositis, ultimately leading to amyloidosis with renal failure. FMF is predominantly found in Jewish, Armenian or Turkish families whose ancestors originate from the Mediterranean basin. Recently, a gene was identified that contains mutations causing FMF. Thus, it became possible to develop a DNA test which, for the first time, allows a positive diagnosis of FMF instead of diagnosing it merely by exclusion. The test is of great diagnostic and also therapeutic value, it ensures that prophylactic colchicine administration is indicated. This prevents both, febrile attacks and amyloidosis. Key words: Familial Mediterranean fever, serositis, amyloidosis, DNA test, DNA analysis V or zwei Jahren wurde das Gen gefunden, das Familiäres Mittelmeerfieber (FMF) verursacht (12, 14). Seine Entdeckung markiert nicht nur eine bemerkenswerte wissenschaftliche Leistung, sie bietet auch eine wertvolle Hilfe bei der klinischen Differentialdiagnose. Vorkommen und Klinik des FMF Abbildung 1: Einseitiger Pleuraerguß bei FMF FMF ist eine Erkrankung der Völker des südlichen Mittelmeers (6). lich eine meist einseitige Pleuritis (AbBetroffen sind in erster Linie anatoli- bildung 1) oder eine akute oder chrosche Türken, nordafrikanische und ira- nisch-destruierende Arthritis, häufig kische Juden, Armenier und Drusen, eine Sacroiliitis. Seltene Manifestatioseltener Aschkenasi-Juden und Ara- nen der Anfälle sind erysipelartige ber. Mit Immigranten ist FMF nach Hauterscheinungen, Myositis, PerikarDeutschland gekommen, und differen- ditis, Vaskulitis und Orchitis. Prognotialdiagnostisch ist es hier inzwischen stisch entscheidend ist eine begleitende von erheblicher Bedeutung. Klinisch Amyloidose, die langfristig eine Nierenmanifestiert sich die Erkrankung oft bereits in der Jugend mit rezidivieren- 1 Klinische Abteilung (Leiter: Prof. Dr. med. den Anfällen von hohem Fieber und Manfred Dietrich) akuter Serositis, die sich spontan inner- 2 Abteilung für Tropenmedizinische Grundhalb weniger Tage zurückbilden. Fast lagenforschung (Leiter: Prof. Dr. med. Rolf immer findet sich eine Peritonitis, in et- Horstmann), Bernhard-Nocht-Institut für Trowa der Hälfte der Fälle besteht zusätz- penmedizin, Hamburg A-1418 (50) Deutsches Ärzteblatt 96, Heft 21, 28. Mai 1999 SUMMARY insuffizienz verursacht. Konsequente Behandlung mit Colchicin verhindert die Amyloidose und unterdrückt in der Regel auch das Auftreten der Anfälle. Die Diagnose erfolgt durch den Ausschluß anderer Krankheitsursachen. Da FMF rezessiv vererbt wird, fällt das familiäre Auftreten nicht immer auf. Wegen des Notfallcharakters der Peritonitiden werden die Betroffenen nicht selten mehrfach laparotomiert, bevor die Diagnose gestellt wird. Laboruntersuchungen wie zum Beispiel die Bestimmung der Dopamin-βHydroxylase stellten sich als wenig zuverlässig für die Diagnostik heraus (1), ebenso eine Anfallsprovokation durch Infusion des Sympathomimetikums Metaraminol, die zudem für die Patienten nicht ohne Risiko ist (5). Identifizierung eines FMF-Gens Die Suche nach dem FMF-Gen wurde im wesentlichen von zwei großen wissenschaftlichen „Konsortien“ aufgenommen und praktisch am M E D I Z I N KURZBERICHT selben Tag abgeschlossen. Der Weg torische Reaktion verantwortlich ner regional prävalenten Infektionswar mühsam und beschreibt die inzwi- sein. Die Pathogenese der Amyloido- krankheit denken. Für diese Hypotheschen üblich gewordene Suche nach se wird damit allerdings nicht erklärt. se könnte auch sprechen, daß verschiepathogenetisch wichtigen Genen dene Mutationen des Gens in denseldurch „positional cloning“. Zunächst ben Populationen gefunden wurden. wurde der FMF-Defekt durch KoppDa sowohl die einzelnen Mutationen Genetische Epidemiologie lungsanalysen auf einen Bereich von als auch die klinischen Zeichen in bedes FMF einigen Millionen Basenpaaren auf stimmten ethnischen Gruppen mit unZusätzliche Polymorphismen um terschiedlicher Häufigkeit und IntenChromosom 16 lokalisiert (9). Unter Verwendung zusätzlich entwickelter das Marenostrin-Gen und deren Ver- sität auftreten, hat man begonnen, die Marker wurde in betroffenen Famili- teilung im Mittelmeerraum lassen ver- Art der Mutation als prognostischen en und Populationen gezielt nach auf- muten, daß die für FMF verantwortli- Faktor zu verwenden. So deutet sich schlußreichen Rekombinationen ge- chen Mutationen sehr alt sind, zunächst zum Beispiel an, daß M694V mit einem sucht, die den Genort schließlich auf im Nahen Osten vorhanden waren und hohen und V726A mit einem geringezwei- bis dreihunderttauren Risiko für Amyloidose send Basenpaare einengten einhergehen könnte (12). (13). Von beiden konkurrie- Identifizierte Mutationen des FMF-Gens renden Konsortien wurde E148Q1 E167D T267I P369S F479L die gesamte Region komGentest für FMF 2 M680I I692del M694I M694V K695R plett sequenziert, um dort A744S R761H Die bislang gefundeBereiche zu identifizieren, V726A nen Mutationen liegen in die für ein Protein kodieren, 1 ) bedeutet den Austausch von Glutaminsäure (E) durch Glutdrei Abschnitten des Madas eine Rolle im Entzünamin (Q) in Aminosäureposition 148; D=Asparaginsäure, dungsprozeß spielen könn- T=Threonin, I=Isoleucin, P=Prolin, S=Serin, F=Phenylalanin, renostrin-Gens. Wir haben hergete. Schließlich wurde ein L=Leucin, M=Methionin, V=Valin, K=Lysin, R=Arginin, Oligonukleotide stellt, die in der PolymeraKandidat ausfindig gemacht A=Alanin. se-Kettenreaktion die Amund Pyrin/Marenostrin ge2) bedeutet die Deletion von Isoleucin in Aminosäureposition 692. plifikation der Segmente nannt. Der Hinweis, daß es bewirken, die die bisher sich um den richtigen Kanidentifizierten Mutationen didaten handelt, ergab sich, umfassen (12). Durch autoals im Marenostrin-Gen matisierte Sequenzierung Mutationen gefunden wurdes Amplifikationsproden, deren homozygotes dukts lassen sich die Proben oder kombiniert heterozyzuverlässig (Grafik) und regotes Vorkommen mit dem lativ einfach analysieren. Auftreten der Erkrankung Die klinische Bedeutung korrelierte. Bislang sind 13 des Tests soll mit zwei BeiPunktmutationen beschriespielen illustriert werden: ben, die die Aminosäurese« Eine 33jährige Patiquenz des Proteins an jeentin aus dem Kaukasus leiweils einer Position verän- Abbildung 2: Vermutete Ausbreitung der FMF-Mutationen, modifiziert nach (2) det seit dem 18. Lebensjahr dern (Tabelle 1). Zwar ist das Marenostrin-Gen vermutlich sich von dort in biblischer Zeit, also vor unter rezidivierender Übelkeit, mennicht das alleinige FMF-Gen (12), über 2000 Jahren nach Europa, Nord- struationsabhängigen abdominellen doch scheint es für den größten Teil afrika und Armenien ausgebreitet ha- Koliken und Fieber bis 41°C. Seit Beder Erkrankungsfälle verantwortlich ben (Abbildung 2). Der Gendefekt ist ginn der Symptomatik 1983 zahlreiche heute sehr häufig; bei nordafrikani- Krankenhausaufenthalte mit unterzu sein. Die Funktion von Marenostrin ist schen Juden und Armeniern wurden schiedlichen Verdachtsdiagnosen, unbislang unbekannt. Ähnlichkeiten in Heterozygotenfrequenzen von bis zu ter anderem Porphyrie. 1983 Appenseiner abgeleiteten Aminosäurese- 20 Prozent gefunden (4, 11). Das läßt dektomie, 1995 Laparoskopie mit quenz mit bekannten Proteinen lassen vermuten, daß der heterozygote Zu- Nachweis von Verwachsungen. 1997 vermuten, daß es als Transkriptions- stand ähnlich wie bei anderen Erb- erstmals Verdacht auf FMF, wegen Unfaktor wirken könnte, der regulato- krankheiten wie zum Beispiel Sichel- sicherheit der Diagnose jedoch keine risch die Aktivierungsphase neutro- zellanämie (7) oder Mukoviszidose (8) konsequente Colchicin-Behandlung. philer Granulozyten beendet. Bei einen evolutionären Vorteil bietet. Bei Anfang 1998 Untersuchung im BernFMF könnten zum Beispiel die muta- FMF wurde eine gewisse Resistenz ge- hard-Nocht-Institut mit Nachweis tionsbedingten Änderungen in der gen Asthma bronchiale vermutet (3), mäßiger allgemeiner EntzündungszeiStruktur des Marenostrins die Inakti- doch läßt das umschriebene Verbrei- chen, einer mikrozytären Anämie und vierungsfunktion stören und so für ei- tungsgebiet des Gens im Mittelmeer- einer grenzwertig vergrößerten Milz; ne pathologisch gesteigerte inflamma- raum am ehesten an den Schutz vor ei- kein Nachweis einer bakteriellen oder A-1420 (52) Deutsches Ärzteblatt 96, Heft 21, 28. Mai 1999 M E D I Z I N KURZBERICHT viralen Infektion oder einer Kollagenose; Metaraminol-Test negativ, Serum-Amyloid nicht erhöht. Der Gentest ergab eine kombinierte Heterozygotie für M680I und M694V (Grafik). ¬ Eine 30jährige Patientin aus der Türkei leidet seit dem 15. Lebens- tersuchung ergab initial unauffällige Entzündungsparameter, vermindertes Speichereisen, kein erhöhtes SerumAmyloid. Nach einem akuten Schmerzereignis entwickelte sich ein flüchtiger kleiner Pleuraerguß. Der Gentest ergab eine kombinierte Heterozygotie Grafik A CodonPositionen B 680 694 726 694 PatientenSequenzen A T G/C A/G T G A/G T G G T/C T KontrollSequenzen A T G A T G A T G G T T Punktmutationen im Marenostrin-Gen als Ursache für FMF. Bei kombiniert Heterozygoten wie in den vorliegenden Fällen finden sich die Mutationen auf jeweils nur einem der beiden vorhandenen Allele, deshalb ergibt sich an den betroffenen Positionen eine Mischsequenz aus dem normalen und dem mutierten Allel. A) Betroffene Codons bei Patientin A (obere Sequenzen) mit entsprechenden Kontrollsequenzen (unten): Ein Austausch G —> C verändert das Codon ATG in Position 680 zu ATC und bewirkt damit in dieser Position einen Ersatz der Aminosäure Methionin durch Isoleucin; ein Austausch A —> G auf dem anderen Allel der Patientin bewirkt in Position 694 ATG —> GTG und damit einen Ersatz von Methionin durch Valin. B) Betroffene Codons bei Patientin B: Ein Austausch A —> G verändert das Codon ATG in Position 694 zu GTG und bewirkt einen Ersatz der Aminosäure Methionin durch Valin; ein Austausch T —> C auf dem anderen Allel der Patientin bewirkt in Position 726 GTT —> GCT und damit einen Ersatz von Valin durch Alanin. Der Austausch von Aminosäuren führt vermutlich zu einer Funktionsstörung des betroffenen Proteins Marenostrin jahr unter rezidivierenden Anfällen von Fieber mit Schüttelfrost, abdominellen Beschwerden, Arthralgien und thorakalen Schmerzen. Verdacht auf FMF, im Verlauf vorherrschend Symptome einer Sacroiliitis. Beginn einer Colchicin-Behandlung, obwohl diagnostische Unsicherheit blieb, da zwei Metaraminol-Tests ohne eindeutiges Ergebnis verliefen. Anfang 1998 brach die Patientin die Behandlung ab, da sie von der Medikamentenwirkung nicht überzeugt war, sich ein Kind wünschte und eine medikamentöse Fruchtschädigung befürchtete. Eine weiter Un- für M694V und V726A (Grafik). Da Hinweise dafür vorliegen, daß Colchicin keine Gefahr für eine eventuelle Schwangerschaft darstellt (14), wurde die Behandlung mit Zustimmung der Patientin wieder aufgenommen. Insgesamt haben wir seit Beginn 1998 in 30 Fällen durch den Gentest die Diagnose eines FMF bestätigt. In den beiden beschriebenen Kasuistiken war die Sicherung der Diagnose von besonderer Bedeutung, da sie die Patientinnen von der Indikation der möglicherweise lebenswichtigen Colchicin-Therapie überzeugte. Zitierweise dieses Beitrags: Dt Ärztebl 1999; 96: A-1418–1421 [Heft 21] Literatur 1. Ben-Chetrit E, Gutman A, Levy M: Dopamine-beta-hydroxylase activity in familial Mediterranean fever. Lancet 1990; 335: 176. 2. Ben-Chetrit E, Levy M: Familial Mediterranean fever. Lancet 1998; 351: 659–664. 3. Brenner-Ullman A, Melzer-Ofir H, Daniels M, Shohat M: Possible protection against asthma in heterozygotes for familial Mediterranean fever. Am J Med Genet 1994; 53: 172–175. 4. Daniels M, Shohat T, Brenner-Ullman A, Shohat M: Familial Mediterranean fever: high gene frequency among the non-Ashkenazic and Ashkenazic Jewish populations in Israel. Am J Med Genet 1995; 55: 311–314. 5. Huppertz HI, Michels H: Der Metaraminol-Test in der Diagnostik des Familiären Mittelmeerfiebers. Mschr Kinderheilkunde 1988; 136: 243–245. 6. Livneh A, Langevitz P, Zemer D et al.: The changing face of familial Mediterranean fever. Semin Arthritis Rheum 1996; 26: 612–627. 7. Pasvol G, Weatherall DJ, Wilson RJM: Cellular mechanism for the protective effect of haemoglobin S against P. falciparum malaria. Nature 1978; 274: 701– 703. 8. Pier GB, Grout M, Zaidi T et al.: Salmonella typhi uses CFTR to enter intestinal epithelial cells. Nature 1998; 393: 79–82. 9. Pras E, Aksentijevich I, Gruberg L et al.: Mapping of a gene causing familial Mediterranean fever to the short arm of chromosome 16. N Engl J Med 1992; 326: 1509–1513. 10. Rabinovitch O, Zemer D, Kukia E, Sohar E, Mashiach S: Colchicine treatment in conception and pregnancy: two hundred thirty-one pregnancies in patients with familial Mediterranean fever. Am J Reprod Immunol 1992; 28: 245–246. 11. Rogers DB, Shohat M, Petersen GM et al.: Familial Mediterranean fever in Armenians: autosomal recessive inheritance with high gene frequency. Am J Med Genet 1989; 34: 168–172. 12. The International FMF Consortium: Ancient missense mutations in a new member of the RoRet gene family are likely to cause familial Mediterranean fever. Cell 1997; 90: 797–807. 13. The French FMF Consortium: Localization of the familial Mediterranean fever gene (FMF) to a 250-kb interval in nonAshkenazi Jewish founder haplotypes. Am J Hum Genet 1996; 59: 603–612. 14. The French FMF Consortium: A candidate gene for familial Mediterranean fever. Nat Genet 1997; 17: 25–31. Anschrift für die Verfasser Dr. med. Hinrich Sudeck Klinische Abteilung Bernhard-Nocht-Institut für Tropenmedizin Bernhard-Nocht-Straße 74 20359 Hamburg Deutsches Ärzteblatt 96, Heft 21, 28. Mai 1999 (53) A-1421











