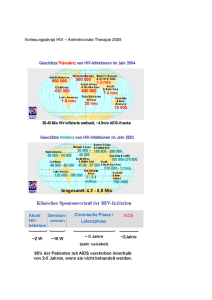
anhang i zusammenfassung der merkmale des arzneimittels
Werbung

ANHANG I ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS 1 1. BEZEICHNUNG DES ARZNEIMITTELS TRIZIVIR Filmtabletten 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG Jede Filmtablette enthält 300 mg Abacavir als Abacavirhemisulfat, 150 mg Lamivudin und 300 mg Zidovudin. Hilfsstoffe siehe Abschnitt 6.1. 3. DARREICHUNGSFORM Filmtablette. Blaugrüne, kapselförmige Filmtabletten, die auf einer Seite mit der Prägung “GX LL1” versehen sind. 4. KLINISCHE ANGABEN 4.1 Anwendungsgebiete Trizivir ist angezeigt zur Behandlung von Infektionen mit dem humanen Immundefizienz-Virus (HIV) bei Erwachsenen. Diese fixe Kombination ersetzt die drei Arzneistoffe Abacavir, Lamivudin und Zidovudin, die in gleicher Dosierung einzeln angewendet werden. Es wird empfohlen, während der ersten 6 bis 8 Wochen der Behandlung Abacavir, Lamivudin und Zidovudin einzeln anzuwenden (siehe Abschnitt 4.4). Die Wahl dieser fixen Kombination sollte primär nicht nur auf Überlegungen zur möglichen Adhärenz, sondern hauptsächlich auf Überlegungen zur Wirksamkeit und zum Risiko dieser drei Nukleosidanaloga beruhen. Der Nachweis des Nutzens von Trizivir basiert vor allem auf den Ergebnissen von Studien, die bei antiretroviral nicht vorbehandelten oder mäßig vorbehandelten Patienten durchgeführt wurden, bei denen die Krankheit noch nicht weit fortgeschritten war. Bei Patienten mit einer hohen Viruslast (> 100.000 Kopien/ml) ist die Wahl der Behandlung besonders sorgfältig abzuwägen (siehe Abschnitt 5.1). 4.2 Dosierung, Art und Dauer der Anwendung Die Therapie sollte von einem Arzt, der Erfahrung in der Behandlung der HIV-Infektion besitzt, verschrieben werden. Die empfohlene Dosierung für Trizivir bei Erwachsenen (18 Jahre und älter) beträgt eine Tablette zweimal täglich. Trizivir kann mit oder ohne eine Mahlzeit eingenommen werden. Wenn der Abbruch der Behandlung mit einem der arzneilich wirksamen Bestandteile von Trizivir angezeigt ist oder wenn eine Dosisreduktion erforderlich ist, stehen Monopräparate mit Abacavir, Lamivudin und Zidovudin zur Verfügung. Patienten mit eingeschränkter Nierenfunktion: Während eine Anpassung der Dosierung von Abacavir bei Patienten mit einer Nierenfunktionsstörung nicht notwendig ist, sind die Lamivudin- und Zidovudinspiegel bei Patienten mit eingeschränkter Nierenfunktion aufgrund der verringerten Ausscheidung erhöht. Da bei diesen Patienten eine Dosisanpassung notwendig sein kann, wird bei Patienten mit eingeschränkter Nierenfunktion (Kreatinin-Clearance ≤ 50 ml/min) die Anwendung von 2 Abacavir-, Lamivudin- und Zidovudin-haltigen Monopräparaten empfohlen. Der Arzt sollte auf die jeweiligen Produktinformationen für diese Präparate zurückgreifen. Trizivir sollte nicht im Endstadium einer Nierenerkrankung angewendet werden (siehe Abschnitte 4.3 und 5.2). Patienten mit eingeschränkter Leberfunktion: Die Anwendung von Trizivir ist bei Patienten mit Leberfunktionsstörungen kontraindiziert (siehe Abschnitte 4.3 und 5.2). Ältere Patienten: Pharmakokinetische Daten von Patienten über 65 Jahre liegen derzeit nicht vor. Wegen altersbedingter Veränderungen wie z. B. der Einschränkung der Nierenfunktion oder einer Änderung der hämatologischen Parameter ist bei diesen Patienten besondere Vorsicht geboten. Dosisanpassung bei Patienten mit hämatologischen Nebenwirkungen: Wenn der Hämoglobinspiegel auf unter 9 g/dl bzw. 5,59 mmol/l oder die Zahl der neutrophilen Granulozyten auf unter 1,0 x 109/l fällt, kann eine Anpassung der Zidovudin-Dosis erforderlich sein (siehe Abschnitte 4.3 und 4.4). Da eine derartige Anpassung der Dosierung mit Trizivir nicht möglich ist, sind in diesen Fällen Abacavir-, Lamivudin- und Zidovudin-haltige Monopräparate anzuwenden. Der Arzt sollte auf die jeweiligen Produktinformationen für diese Präparate zurückgreifen. 4.3 Gegenanzeigen Trizivir ist bei Patienten mit einer bekannten Überempfindlichkeit gegenüber Abacavir, Lamivudin oder Zidovudin oder einem der sonstigen Bestandteile kontraindiziert. Siehe INFORMATION ZU ÜBEREMPFINDLICHKEITSREAKTIONEN IM KASTEN in den Abschnitten 4.4 und 4.8. Trizivir ist bei Patienten im Endstadium einer Nierenerkrankung kontraindiziert. Die Anwendung von Trizivir ist bei Patienten mit Leberfunktionsstörungen kontraindiziert. Aufgrund des arzneilich wirksamen Bestandteils Zidovudin ist Trizivir bei Patienten mit einer abnorm niedrigen Anzahl neutrophiler Granulozyten (< 0,75 x 109/l) oder mit abnorm niedrigen Hämoglobinspiegeln (<7,5 g/dl oder 4,65 mmol/l) kontraindiziert (siehe Abschnitt 4.4). 4.4 Warnhinweise und Vorsichtsmaßnahmen für die Anwendung In diesem Abschnitt sind die Warnhinweise und Vorsichtsmaßnahmen, die für Abacavir, Lamivudin und Zidovudin relevant sind, aufgeführt. Es gibt keine zusätzlichen, für das Kombinationspräparat Trizivir relevanten Warnhinweise und Vorsichtsmaßnahmen. Überempfindlichkeitsreaktion (siehe auch Abschnitt 4.8): In klinischen Studien kam es bei ca. 4 % der Patienten, die Abacavir (das auch der arzneilich wirksame Bestandteil in Ziagen ist) erhielten, zum Auftreten einer eine Überempfindlichkeitsreaktion. Einige dieser Fälle waren lebensbedrohlich und verliefen trotz Vorsichtsmaßnahmen tödlich. • Beschreibung Überempfindlichkeitsreaktionen werden durch das Auftreten von Symptomen charakterisiert, die auf eine Multiorganbeteiligung hinweisen. Bei fast allen Überempfindlichkeitsreaktionen tritt Fieber und/oder Hautausschlag als Teil des Syndroms auf. Andere Anzeichen oder Symptome können respiratorische Anzeichen und Symptome wie Dyspnoe, Halsschmerzen, Husten und abnorme Röntgenthoraxbefunde (vor allem lokalisierbare Infiltrate), gastrointestinale Symptome wie Übelkeit, Erbrechen, Diarrhoe oder Bauchschmerzen sein. Diese Symptome können dazu führen, dass eine Hypersensitivitätsreaktion fälschlicherweise als respiratorische Erkrankung (Pneumonie, Bronchitis, Pharyngitis) oder Gastroenteritis diagnostiziert wird. Andere häufig beobachtete Anzeichen oder Symptome einer 3 Überempfindlichkeitsreaktion können Lethargie oder ein allgemeines Krankheitsgefühl und Muskelund Gelenkbeschwerden (Myalgie, selten Myolyse, Arthralgie) sein. Die mit einer solchen Überempfindlichkeitsreaktion verbundenen Symptome verschlechtern sich bei Fortsetzen der Behandlung und können lebensbedrohlich werden. Nach Absetzen der Behandlung mit Abacavir verschwinden diese Symptome für gewöhnlich. • Umgang/ Vorgehensweise Die Symptome einer Überempfindlichkeitsreaktion treten gewöhnlich innerhalb der ersten sechs Wochen nach Beginn der Behandlung mit Abacavir auf, allerdings können diese Reaktionen zu jeder Zeit während der Therapie auftreten. Die Patienten sollten engmaschig überwacht werden, besonders während der ersten zwei Monate der Behandlung mit Trizivir, wobei ärztliche Untersuchungen mindestens alle zwei Wochen durchgeführt werden sollten. Patienten, bei denen während der Therapie eine Überempfindlichkeit diagnostiziert wird, MÜSSEN Trizivir sofort absetzen. Trizivir oder jedes andere Abacavir-haltige Arzneimittel (z. B. Ziagen) DARF von Patienten, die eine Therapie aufgrund einer Überempfindlichkeitsreaktion abgebrochen haben, NIE WIEDER eingenommen werden. Eine Wiederaufnahme der Behandlung mit Abacavir nach einer Überempfindlichkeitsreaktion führt zu einem raschen Wiederauftreten der Symptome innerhalb von Stunden. Diese wiederauftretende Überempfindlichkeitsreaktion verläuft normalerweise schwerer als bei der ersten Verabreichung und kann möglicherweise zu lebensbedrohlichem Blutdruckabfall und zum Tod führen. Um Verzögerungen bei der Diagnosestellung zu vermeiden und das Risiko einer lebensbedrohlichen Überempfindlichkeitsreaktion zu minimieren, muss Trizivir dauerhaft abgesetzt werden, wenn eine Überempfindlichkeitsreaktion nicht ausgeschlossen werden kann, auch wenn andere Diagnosen (respiratorische Erkrankungen, grippeähnliche Erkrankungen, Gastroenteritis oder Reaktionen auf andere Medikamente) in Frage kommen. Besondere Vorsicht ist bei solchen Patienten geboten, die gleichzeitig eine Behandlung mit Trizivir und anderen Arzneimitteln beginnen, die bekannterweise toxische Hautreaktionen verursachen (z. B. nicht-nukleosidanaloge Reverse-Transkriptase-Hemmer - NNRTI). Es ist derzeit schwierig, zwischen den von anderen Arzneimitteln verursachten Hautausschlägen und der durch Abacavir hervorgerufenen Überempfindlichkeitsreaktion zu unterscheiden. • Vorgehen bei erneuter Einnahme von Trizivir nach vorherigem Abbruch der Behandlung Wenn die Behandlung mit Trizivir aus irgendeinem Grund abgebrochen wurde und eine Wiederaufnahme der Behandlung in Betracht gezogen wird, muss der Grund für den Abbruch festgestellt werden, um zu beurteilen, ob bei dem Patienten Symptome einer Überempfindlichkeitsreaktion aufgetreten waren. Wenn eine Überempfindlichkeitsreaktion nicht ausgeschlossen werden kann, darf Trizivir oder jedes andere Abacavir-haltige Arzneimittel (z. B. Ziagen) nicht wieder angewendet werden. Nach Wiederaufnahme einer Therapie mit Abacavir sind rasch einsetzende, z. T. lebensbedrohlich verlaufende Überempfindlichkeitsreaktion bei Patienten aufgetreten, die zum Zeitpunkt des ersten Absetzens von Abacavir nur ein typisches Anzeichen für eine Überempfindlichkeitsreaktion zeigten (Hautausschlag, Fieber, gastrointestinale Symptome, respiratorische Symptome oder Allgemeinsymptome wie Abgeschlagenheit und Krankheitsgefühl). Das häufigste isoliert auftretende Symptom einer Überempfindlichkeitsreaktion war Hautausschlag. Darüber hinaus, wurde in sehr seltenen Fällen eine Überempfindlichkeitsreaktion bei Patienten beschrieben, die Abacavir nach einer Unterbrechung erneut einnahmen, vorher jedoch keine Symptome einer Überempfindlichkeitsreaktion gezeigt hatten. Wenn entschieden wird, Trizivir bei solchen 4 Patienten erneut einzusetzen, muss dies in beiden Fällen in einer Einrichtung geschehen, wo eine rasche medizinische Hilfe gewährleistet ist. • Grundlegende Informationen für den Patienten Der verschreibende Arzt muss sicherstellen, dass die Patienten über die folgenden Informationen zur Überempfindlichkeitsreaktion vollständig aufgeklärt sind: - Die Patienten müssen über die Möglichkeit einer Überempfindlichkeitsreaktion durch Abacavir, die zu einer lebensbedrohlichen Reaktion und zum Tod führen kann, aufgeklärt werden. - Patienten, die Anzeichen oder Symptome einer möglichen Überempfindlichkeit entwickeln, MÜSSEN SOFORT KONTAKT zu Ihrem Arzt AUFNEHMEN. - Patienten mit einer Überempfindlichkeit gegen Abacavir sollen daran erinnert werden, dass sie niemals wieder Trizivir oder ein anderes Abacavir-haltiges Arzneimittel (z. B. Ziagen) einnehmen dürfen. - Um eine Wiedereinnahme von Trizivir bei Patienten, die bereits eine Überempfindlichkeitsreaktion entwickelt haben, zu verhindern, sollten diese Patienten ihre restlichen Trizivir Filmtabletten gemäß der örtlichen Bestimmungen vernichten und Ihren Arzt oder Apotheker um Rat fragen. - Patienten, die Trizivir aus irgendeinem Grund abgesetzt haben, insbesondere wegen Nebenwirkungen oder einer Erkrankung, müssen darauf hingewiesen werden, vor einer erneuten Einnahme mit ihrem Arzt zu sprechen. - Die Patienten sollten auf die Wichtigkeit einer regelmäßigen Trizivir-Einnahme hingewiesen werden. - Jeder Patient sollte darauf hingewiesen werden, die Gebrauchsinformation, die in jeder TrizivirPackung enthalten ist, zu lesen. Auch eine Warnhinweis-Karte ist der Trizivir-Packung beigefügt. Die Patienten sollten daran erinnert werden, dass es wichtig ist, diese Karte aus der Packung zu entnehmen und immer bei sich zu tragen. Laktatazidose: Über das Auftreten von Laktatazidosen, die in der Regel mit Hepatomegalie und Hepatosteatose assoziiert waren, wurde unter Behandlung mit Nukleosidanaloga berichtet. Frühe Anzeichen (symptomatische Hyperlaktatämie) beinhalten gutartige Verdauungsbeschwerden (Übelkeit, Erbrechen und Bauchschmerzen), unspezifische Beeinträchtigungen des Wohlbefindens, Appetitlosigkeit, Gewichtsverlust, respiratorische Symptome (schnelle und/oder tiefe Atmung) oder neurologische Symptome (einschließlich motorischer Schwäche). Die Laktatazidosen sind mit einer hohen Mortalität verbunden und können mit Pankreatitis, Leberversagen oder Nierenversagen assoziiert sein. Laktatazidosen treten im Allgemeinen nach wenigen oder mehreren Monaten Behandlung auf. Die Behandlung mit Nukleosidanaloga sollte bei Auftreten symptomatischer Hyperlaktatämie und metabolischer Azidose/Laktatazidose, progressiver Hepatomegalie oder rasch ansteigenden Transaminasespiegeln abgebrochen werden. Vorsicht ist bei der Verabreichung von Nukleosidanaloga an jeden Patienten (vor allem an adipöse Frauen) mit Hepatomegalie, Hepatitis oder anderen bekannten Risikofaktoren für Lebererkrankungen sowie Hepatosteatose (einschließlich bestimmter Arzneimittel und Alkohol) geboten. Patienten mit einer Hepatitis-C-Koinfektion, die mit Interferon alpha und Ribavirin behandelt werden, stellen eine besondere Risikogruppe dar. 5 Patienten mit einem erhöhten Risiko müssen engmaschig überwacht werden. Die antiretrovirale Kombinationstherapie wurde mit einer Fettumverteilung (Lipodystrophie) bei HIVPatienten in Verbindung gebracht. Die Langzeitwirkungen dieser Ereignisse sind derzeit nicht bekannt. Die Kenntnisse über den Mechanismus sind unvollständig. Es wurde ein Zusammenhang zwischen der viszeralen Lipomatose und Proteasehemmern (PI) sowie der Lipoatrophie und nukleosidanalogen Reverse-Transkriptase-Hemmern (NRTI) hergestellt. Ein erhöhtes Risiko für eine Lipodystrophie wurde mit individuellen Faktoren, wie z. B. höherem Alter, und mit Arzneimittelabhängigen Faktoren, wie eine länger andauernde antiretrovirale Behandlung und den damit verbundenen metabolischen Störungen, assoziiert. Im Rahmen der klinischen Untersuchung sollte auf körperliche Anzeichen von Fettumverteilung geachtet werden. Die Messung der Serumlipide im Nüchternzustand und der Blutglucose sollte erwogen werden. Lipidstörungen sollten entsprechend der klinischen Situation behandelt werden (siehe Abschnitt 4.8). Hämatologische Nebenwirkungen: Bei Patienten, die Zidovudin erhalten, ist mit dem Auftreten von Anämie, Neutropenie und Leukopenie (normalerweise auf die Neutropenie folgend) zu rechnen. Diese treten vermehrt bei hohen Zidovudin-Dosierungen (1200 - 1500 mg/Tag) auf und bei Patienten, deren Knochenmarksreserve vor Behandlungsbeginn vermindert ist, vor allem bei fortgeschrittener HIVErkrankung. Die hämatologischen Parameter sollen daher bei Patienten, die Trizivir erhalten, sorgfältig überwacht werden (siehe Abschnitt 4.3). Diese hämatologischen Nebenwirkungen treten gewöhnlich nicht eher als 4 bis 6 Wochen nach Behandlungsbeginn auf. Es wird für Patienten mit fortgeschrittener symptomatischer HIV-Erkrankung generell empfohlen, innerhalb der ersten drei Monate der Therapie mindestens alle 2 Wochen und anschließend mindestens einmal monatlich eine Blutuntersuchung durchzuführen. Bei Patienten im Anfangsstadium der HIV-Erkrankung sind hämatologische Nebenwirkungen selten. Abhängig vom Allgemeinzustand des Patienten können die Blutuntersuchungen in größeren Zeitabständen, z. B. alle 1 bis 3 Monate durchgeführt werden. Zusätzlich kann beim Auftreten schwerer Anämien oder einer Verringerung der Knochenmarksreserve während der Behandlung mit Trizivir oder bei Patienten, die vor der Behandlung eine Beeinträchtigung des Knochenmarks aufwiesen, z. B. Hämoglobin < 9 g/dl (5,59 mmol/l) oder Neutrophilenzahl < 1,0 x 109/l, eine Dosisanpassung für Zidovudin erforderlich sein (siehe Abschnitt 4.2). Da eine derartige Dosisreduktion mit Trizivir nicht möglich ist, sind Abacavir-, Lamivudin- und Zidovudin-haltige Monopräparate anzuwenden. Der Arzt sollte auf die jeweiligen Produktinformationen für diese Arzneimittel zurückgreifen. Pankreatitis: Selten traten Fälle von Pankreatitis bei Patienten unter Abacavir-, Lamivudin- und Zidovudinbehandlung auf. Es ist jedoch nicht geklärt, ob diese Fälle im Zusammenhang mit der Einnahme dieser Arzneimittel standen oder ob sie eine Manifestation der HIV-Grunderkrankung waren. Die Behandlung mit Trizivir ist sofort abzubrechen, wenn klinische Anzeichen oder Symptome oder auch Abweichungen der Laborwerte, die auf eine Pankreatitis hindeuten, auftreten. Lebererkrankungen: Falls Lamivudin gleichzeitig für die Behandlung einer HIV- und HBV-Infektion angewendet wird, stehen zusätzliche Informationen zur Anwendung von Lamivudin in der Behandlung von Hepatitis-B-Infektionen in der Fachinformation zu Zeffix zur Verfügung. Die Wirksamkeit und Unbedenklichkeit von Trizivir wurde bei Patienten mit zugrunde liegenden signifikanten Leberstörungen nicht belegt. Trizivir ist bei Patienten mit Leberfunktionsstörungen kontraindiziert (siehe Abschnitt 4.3). Patienten, die an chronischer Hepatitis B oder C leiden und mit einer antiretroviralen Kombinationstherapie behandelt werden, haben ein erhöhtes Risiko für schwere hepatische Nebenwirkungen mit potenziell tödlichem Verlauf. Für den Fall einer gleichzeitigen antiviralen Therapie von Hepatitis B oder C lesen Sie bitte die betreffenden Produktinformationen dieser Arzneimittel. 6 Wenn Trizivir bei Patienten mit zusätzlicher Hepatitis-B-Infektion abgesetzt wird, wird eine regelmäßige Kontrolle der Leberfunktionswerte und HBV-Replikationsmarker empfohlen, da ein Absetzen von Lamivudin zu einer akuten Exazerbation der Hepatitis führen kann (siehe Produktinformation zu Zeffix). Patienten mit vorbestehender eingeschränkter Leberfunktion einschließlich einer chronisch-aktiven Hepatitis zeigen eine erhöhte Häufigkeit von Leberfunktionsstörungen unter einer antiretroviralen Kombinationstherapie und sollten entsprechend der klinischen Praxis überwacht werden. Bei Anzeichen einer Verschlechterung der Lebererkrankung bei solchen Patienten muss eine Unterbrechung oder ein Absetzen der Behandlung in Betracht gezogen werden. Kinder und Jugendliche: Da nur unzureichende Daten vorliegen, wird die Anwendung von Trizivir bei Kindern oder Jugendlichen nicht empfohlen. In dieser Patientengruppe sind Überempfindlichkeitsreaktionen besonders schwer zu identifizieren. Opportunistische Infektionen: Die Patienten sollten darauf hingewiesen werden, dass Trizivir oder eine andere antiretrovirale Therapie nicht zu einer Heilung der HIV-Infektion führt und dass sie auch weiterhin opportunistische Infektionen oder andere Komplikationen einer HIV-Infektion entwickeln können. Daher sollten die Patienten unter enger klinischer Überwachung durch Ärzte bleiben, die Erfahrung in der Behandlung derartiger HIV-assoziierter Erkrankungen besitzen. Sonstiges: Die Patienten sollten darüber aufgeklärt werden, dass die derzeitige antiretrovirale Therapie einschließlich der Behandlung mit Trizivir das Risiko einer Übertragung von HIV auf andere durch sexuellen Kontakt oder Kontamination mit Blut nicht herabsetzt. Angemessene Vorsichtsmaßnahmen sollten daher weiterhin getroffen werden. Bisher liegen unzureichende Daten zur Wirksamkeit und Unbedenklichkeit von Trizivir bei gemeinsamer Anwendung mit nicht nukleosidanalogen Reverse-Transkriptase-Hemmern oder Proteasehemmern vor (siehe Abschnitt 5.1). 4.5 Wechselwirkungen mit anderen Arzneimitteln und sonstige Wechselwirkungen Da Trizivir Abacavir, Lamivudin und Zidovudin enthält, kann möglicherweise jede bisher für die einzelnen Arzneistoffe berichtete Wechselwirkung auch bei Einnahme von Trizivir auftreten. Die Wahrscheinlichkeit von metabolischen Wechselwirkungen mit Lamivudin ist aufgrund der geringen Metabolisierung, der begrenzten Plasmaproteinbindung und der fast vollständigen renalen Clearance gering. Zidovudin wird hauptsächlich über hepatische Konjugation als inaktiver Glucuronidmetabolit ausgeschieden. Arzneimittel, welche hauptsächlich über die Leber metabolisiert und ausgeschieden werden, besonders solche, die glucuronidiert werden, können möglicherweise den Abbau von Zidovudin hemmen. Basierend auf den Ergebnissen von In-vitro-Versuchen und den bekannten Hauptabbauwegen von Abacavir ist das Potential von Abacavir für über Cytochrom P450 vermittelte Interaktionen mit anderen Arzneimitteln gering. Klinische Studien haben gezeigt, dass es keine klinisch signifikanten Wechselwirkungen zwischen Abacavir, Lamivudin und Zidovudin gibt. Die nachfolgend aufgeführten Wechselwirkungen sollten nicht als vollständig, sondern als repräsentativ für Arzneimittelgruppen angesehen werden, bei denen besondere Vorsicht angezeigt ist. Wechselwirkungen mit Abacavir Basierend auf den Ergebnissen von In-vitro-Versuchen und den bekannten Hauptmetabolisierungswegen von Abacavir ist das Potential von Abacavir für über Cytochrom P450 vermittelte Interaktionen mit anderen Arzneimitteln gering. Cytochrom P450 spielt bei der Metabolisierung von Abacavir keine wesentliche Rolle, und Abacavir hemmt keine durch CYP 3A4 vermittelten Metabolisierungen. Abacavir hat auch in vitro gezeigt, dass es die Metabolisierung, die über die Enzyme CYP 3A4, CYP 2C9 oder CYP 2D6 vermittelt wird, in klinisch relevanten Konzentrationen 7 nicht hemmt. Daher ist die Wahrscheinlichkeit von Wechselwirkungen mit antiretroviralen Proteasehemmern und anderen Arzneimitteln, die über die wichtigsten Cytochrom-P450-Enzyme abgebaut werden, gering. Starke Enzyminduktoren wie Rifampicin, Phenobarbital und Phenytoin können durch ihre Wirkung auf die UDP-Glucuronyltransferase die Plasmakonzentrationen von Abacavir geringfügig verringern. Die Metabolisierung von Abacavir wird durch Ethanol verändert, was zu einem Anstieg des AUCWertes von Abacavir um etwa 41 % führt. Diese Befunde werden jedoch als klinisch nicht signifikant angesehen. Abacavir hat keinen Einfluss auf die Metabolisierung von Ethanol. Retinoidverbindungen werden mittels Alkoholdehydrogenase eliminiert. Wechselwirkungen mit Abacavir sind möglich, wurden jedoch nicht untersucht. In einer pharmakokinetischen Studie führte die gleichzeitige Verabreichung von zweimal täglich 600 mg Abacavir mit Methadon zu einer 35 %igen Reduktion der Cmax von Abacavir und einer einstündigen Verlängerung der tmax, während die AUC unverändert blieb. Diese Änderungen in der Pharmakokinetik von Abacavir werden nicht als klinisch relevant angesehen. In dieser Studie erhöhte Abacavir die mittlere systemische Methadon-Clearance um 22 %. Die Induktion Arzneimittelmetabolisierender Enzyme kann daher nicht ausgeschlossen werden. Patienten, die mit Methadon und Abacavir behandelt werden, sollten auf Hinweise von Entzugssymptomen, die auf eine Unterdosierung hinweisen, überwacht werden, da gelegentlich eine erneute Methadon-Einstellung erforderlich sein kann. Wechselwirkungen mit Lamivudin Die Möglichkeit von Wechselwirkungen von Trizivir mit anderen gleichzeitig verabreichten Arzneimitteln sollte in Betracht gezogen werden, vor allem wenn diese Arzneimittel hauptsächlich durch aktive Nierensekretion, speziell über das Transportsystem für Kationen ausgeschieden werden, wie z. B. Trimethoprim. Nukleosidanaloga (wie z. B. Zidovudin, Didanosin und Zalcitabin) und einige andere Arzneimittel (z. B. Ranitidin, Cimetidin) werden nur teilweise über diesen Mechanismus ausgeschieden und zeigten keine Wechselwirkungen mit Lamivudin. Die gleichzeitige Gabe von 160 mg Trimethoprim/800 mg Sulfamethoxazol führt zu einer 40 %igen Erhöhung des Lamivudin-Plasmaspiegels aufgrund des Bestandteils Trimethoprim; der Bestandteil Sulfamethoxazol verursacht keine Wechselwirkungen. Solange jedoch keine Niereninsuffizienz vorliegt, ist in diesen Fällen eine Anpassung der Dosierung von Lamivudin nicht notwendig (siehe Abschnitt 4.2). Lamivudin hat keinen Einfluss auf die Pharmakokinetik von Trimethoprim und Sulfamethoxazol. Wenn eine gleichzeitige Anwendung mit Co-trimoxazol angebracht ist, sollten die Patienten klinisch überwacht werden. Die gleichzeitige Anwendung von Trizivir mit hohen Dosen Cotrimoxazol zur Behandlung von Pneumocystis-carinii-Pneumonie (PCP) und Toxoplasmose sollte vermieden werden. Die gemeinsame Verabreichung von Lamivudin mit intravenösem Ganciclovir oder Foscarnet wird bis zum Vorliegen weiterer Informationen nicht empfohlen. Lamivudin kann die intrazelluläre Phosphorylierung von Zalcitabin hemmen, wenn beide Arzneimittel gleichzeitig verabreicht werden. Die Kombination von Trizivir mit Zalcitabin wird daher nicht empfohlen. Die Metabolisierung von Lamivudin verläuft nicht über CYP 3A. Wechselwirkungen mit Arzneimitteln, die über dieses System verstoffwechselt werden (z. B. Proteasehemmer und NichtNukleosidanaloga), sind daher unwahrscheinlich. Wechselwirkungen mit Zidovudin 8 Die vorliegenden begrenzten Daten lassen vermuten, dass die gleichzeitige Gabe von Zidovudin und Rifampicin die Fläche unter der Plasma-Konzentrations-Zeit-Kurve (AUC) von Zidovudin um 48 % ± 34 % senkt, die klinische Bedeutung dieser Wechselwirkung ist jedoch unbekannt. Begrenzte Erfahrungen deuten darauf hin, dass Probenecid die mittlere Halbwertszeit und die Fläche unter der Plasma-Konzentrations-Zeitkurve (AUC) von Zidovudin durch Verringerung der Glucuronidierung erhöht. Durch Probenecid wird die renale Ausscheidung des Glucuronids (und möglicherweise von Zidovudin selbst) verringert. Über erniedrigte Phenytoin-Blutspiegel wurde bei einigen Patienten, die Zidovudin erhalten haben, berichtet, in einem Fall wurde dagegen ein erhöhter Blutspiegel beobachtet. Bei gleichzeitiger Gabe von Trizivir und Phenytoin sollten daher die Phenytoin-Spiegel sorgfältig überwacht werden. In einer Studie zur Pharmakokinetik zeigte die gleichzeitige Verabreichung von Zidovudin und Atovaquon eine Erniedrigung der Clearance des oral verabreichten Zidovudins, die zu einem Anstieg der AUC des Zidovudins im Plasma um 35 % ± 23 % führte. Die klinische Relevanz ist aufgrund der begrenzten Datenlage unbekannt. Die gleichzeitige Gabe von Valproinsäure oder Methadon mit Zidovudin führte zu einem Anstieg der AUC und einer korrespondierenden Abnahme der Clearance von Zidovudin. Da nur begrenzte Daten zur Verfügung stehen, ist die klinische Relevanz nicht bekannt. Andere Arzneimittel können die Biotransformation von Zidovudin hemmen, und zwar infolge einer kompetitiven Hemmung der Glucuronidierung oder durch direkte Hemmung der mikrosomalen Metabolisierung in der Leber. Hierzu zählen u. a. Acetylsalicylsäure, Codein, Morphin, Indometacin, Ketoprofen, Naproxen, Oxazepam, Lorazepam, Cimetidin, Clofibrat, Dapson und Isoprinosin. Derartige Arzneimittel sollen daher aufgrund möglicher Wechselwirkungen nur mit Vorsicht mit Trizivir kombiniert werden, insbesondere bei der Langzeittherapie. Ribavirin und Stavudin antagonisieren in vitro die antivirale Wirkung von Zidovudin. Eine gleichzeitige Behandlung mit Ribavirin oder Stavudin und Trizivir sollte daher vermieden werden. Das Risiko von Nebenwirkungen durch Zidovudin kann erhöht sein, wenn gleichzeitig potentiell nephrotoxische oder knochenmarksschädigende Mittel, insbesondere in einer Akuttherapie, angewendet werden. Dazu gehören u. a. systemisch verabreichtes Pentamidin, Dapson, Pyrimethamin, Co-trimoxazol, Amphotericin, Flucytosin, Ganciclovir, Interferon, Vincristin, Vinblastin und Doxorubicin. Wenn die gleichzeitige Behandlung mit Trizivir und einem dieser Arzneimittel erforderlich ist, sollten die Nierenfunktion und die hämatologischen Parameter besonders sorgfältig überwacht werden und, falls nötig, die Dosierungen eines oder mehrerer Arzneimittel verringert werden. Begrenzte Daten aus klinischen Studien geben keinen Hinweis auf ein signifikant erhöhtes Nebenwirkungsrisiko bei gleichzeitiger Anwendung von Zidovudin mit Co-trimoxazol (siehe die für Co-trimoxazol relevante Information oben unter Wechselwirkungen mit Lamivudin), Pentamidin als Aerosol, Pyrimethamin und Aciclovir. Die gleichzeitige Anwendung von Trizivir mit hohen Dosen Co-trimoxazol zur Behandlung einer Pneumocystis-carinii-Pneumonie (PCP) und Toxoplasmose sollte vermieden werden. 4.6 Schwangerschaft und Stillzeit Schwangerschaft Trizivir wird nicht zur Anwendung bei Schwangeren empfohlen. Es liegen keine Daten über die Anwendung von Trizivir während der Schwangerschaft vor. Beim Menschen passieren Lamivudin und Zidovudin die Plazenta, für Abacavir ist dies im Tierversuch belegt. Studien mit Abacavir, Lamivudin und Zidovudin bei Tieren haben Reproduktionstoxizität gezeigt (siehe Abschnitt 5.3). Da die 9 arzneilich wirksamen Bestandteile von Trizivir möglicherweise die DNA-Replikation hemmen, stellt jede Anwendung, besonders während der ersten 3 Schwangerschaftsmonate, ein mögliches Risiko für den Fetus dar. Stillzeit Sowohl Lamivudin als auch Zidovudin gehen beim Menschen in ähnlicher Konzentration, wie man sie im Serum findet, in die Muttermilch über. Es wird erwartet, dass Abacavir auch in die menschliche Muttermilch übergeht, auch wenn dies noch nicht bestätigt wurde. Es wird daher empfohlen, dass Mütter, während sie mit Trizivir behandelt werden, ihre Kinder nicht stillen. Außerdem wird empfohlen, dass HIV-infizierte Frauen nach Möglichkeit ihre Kinder nicht stillen sollten, um eine Übertragung von HIV zu vermeiden. 4.7 Auswirkungen auf die Verkehrstüchtigkeit und das Bedienen von Maschinen Es wurden keine Studien zu den Auswirkungen auf die Verkehrstüchtigkeit und das Bedienen von Maschinen durchgeführt. Der klinische Zustand des Patienten und das Nebenwirkungsprofil von Trizivir sollten bei der Beurteilung der Fähigkeit des Patienten, ein Fahrzeug zu führen oder Maschinen zu bedienen, in Betracht gezogen werden. 4.8 Nebenwirkungen Überblick Nebenwirkungen wurden bei der Therapie der HIV-Erkrankung mit Abacavir, Lamivudin und Zidovudin allein oder in Kombination berichtet. Da Trizivir Abacavir, Lamivudin und Zidovudin enthält, können die bei den Einzelkomponenten auftretenden Nebenwirkungen erwartet werden. Das Sicherheitsprofil von Trizivir ist bisher noch nicht durch klinische Studien belegt. Die Nebenwirkungen, die im Zusammenhang mit Abacavir, Lamivudin und Zidovudin berichtet wurden, sind in Tabelle 2 unten dargestellt. Bei vielen dieser unerwünschten Ereignisse ist nicht geklärt, ob sie im Zusammenhang mit der Einnahme des arzneilich wirksamen Bestandteils oder einem anderen aus dem Spektrum der zur Behandlung der HIV-Infektion angewendeten Arzneimittel stehen oder ob sie eine Folge der Grunderkrankung sind. Überempfindlichkeit gegenüber Abacavir (siehe auch Abschnitt 4.4): In klinischen Studien entwickelten etwa 4 % der Patienten unter Abacavir-Behandlung eine Überempfindlichkeitsreaktion; einige dieser Fälle waren lebensbedrohlich und verliefen trotz Vorsichtsmaßnahmen tödlich. Diese Reaktion wird durch das Auftreten von Symptomen charakterisiert, die auf eine Multiorganbeteiligung hinweisen. Bei fast allen Patienten mit Überempfindlichkeitsreaktionen treten Fieber und/oder Hautausschlag (gewöhnlich makulopapulös oder urtikariell) als Teil des Syndroms auf, jedoch traten Überempfindlichkeitsreaktionen auch ohne Fieber oder Hautausschlag auf. Die Anzeichen und Symptome, die mit einer Überempfindlichkeitsreaktion auf Abacavir einhergehen, sind in Tabelle 1 zusammengefasst. Diese wurden entweder in klinischen Studien oder nach der Markteinführung beobachtet. Bei einigen Patienten mit einer Überempfindlichkeitsreaktion wurde anfänglich eine Gastroenteritis, eine respiratorische Erkrankung (Pneumonie, Bronchitis oder Pharyngitis) oder eine grippeähnliche Erkrankung vermutet. Durch die Verzögerung der Diagnose der Überempfindlichkeitsreaktion kam es zu einem Fortsetzen oder einer Wiederaufnahme der Therapie mit Abacavir. Dies führte zu einer Verschlimmerung der Überempfindlichkeitsreaktionen oder zum Tod. Daher sollte bei Patienten mit Symptomen, die auf diese Erkrankungen hinweisen, eine Überempfindlichkeitsreaktion in Betracht gezogen und sorgfältig abgeklärt werden. 10 Die Symptome traten gewöhnlich innerhalb der ersten sechs Wochen (mittlere Zeit bis zum Auftreten 11 Tage) nach Beginn der Behandlung mit Abacavir auf, allerdings können diese Reaktionen zu jeder Zeit während der Therapie auftreten. Eine engmaschige medizinische Überwachung ist während der ersten zwei Monate erforderlich, und Untersuchungen sollten mindestens alle zwei Wochen durchgeführt werden. Risikofaktoren, mit denen sich das Auftreten oder die Schwere einer Überempfindlichkeitsreaktion gegenüber Abacavir vorhersagen lassen, sind nicht bekannt. Es ist jedoch wahrscheinlich, dass eine intermittierende Therapie das Risiko einer Sensibilisierung und das Auftreten von klinisch signifikanten Überempfindlichkeitsreaktionen erhöht. Folglich sollten die Patienten auf die Wichtigkeit einer regelmäßigen Trizivir-Einnahme hingewiesen werden. Eine Wiederaufnahme der Behandlung mit Trizivir oder jedem anderen Abacavir enthaltenden Arzneimittel nach einer Überempfindlichkeitsreaktion führt zu einem raschen Wiederauftreten der Symptome innerhalb von Stunden. Diese wiederauftretende Überempfindlichkeitsreaktion verlief normalerweise schwerer als bei der ersten Verabreichung und kann möglicherweise zu lebensbedrohlichem Blutdruckabfall und zum Tod führen. Patienten, die eine Überempfindlichkeit entwickelt haben, müssen Trizivir absetzen und dürfen niemals wieder mit Trizivir oder einem anderen Abacavir-haltigen Arzneimittel (z. B. Ziagen) behandelt werden. Um Verzögerungen bei der Diagnosestellung zu vermeiden und das Risiko einer lebensbedrohlichen Überempfindlichkeitsreaktion zu minimieren, muss Trizivir dauerhaft abgesetzt werden, wenn eine Überempfindlichkeitsreaktion nicht ausgeschlossen werden kann, auch wenn andere Diagnosen (respiratorische Erkrankungen, grippeähnliche Erkrankungen, Gastroenteritis oder Reaktionen auf andere Medikamente) in Frage kommen. Nach Wiederaufnahme einer Therapie mit Abacavir sind rasch einsetzende, z. T. lebensbedrohlich verlaufende Überempfindlichkeitsreaktionen bei Patienten aufgetreten, die zum Zeitpunkt des ersten Absetzens von Abacavir nur ein typisches Anzeichen für eine Überempfindlichkeitsreaktion zeigten (Hautausschlag, Fieber, gastrointestinale Symptome, respiratorische Symptome oder Allgemeinsymptome wie Lethargie und Krankheitsgefühl). Das häufigste isoliert auftretende Symptom einer Überempfindlichkeitsreaktion war der Hautausschlag. Darüber hinaus wurde in sehr seltenen Fällen eine Überempfindlichkeitsreaktion bei Patienten beschrieben, die Abacavir nach einer Unterbrechung erneut einnahmen, vorher jedoch keine Symptome einer Überempfindlichkeitsreaktion gezeigt hatten. Wenn entschieden wurde, Trizivir bei solchen Patienten erneut einzusetzen, muss dies in beiden Fällen in einer Einrichtung geschehen, wo eine rasche medizinische Hilfe gewährleistet ist. Jeder Patient muss auf die Gefahr einer Überempfindlichkeitsreaktion auf Abacavir hingewiesen werden. Tabelle 1: Zusammenfassung der Anzeichen und Symptome, die mit einer Überempfindlichkeitsreaktion auf Abacavir verbunden sind (Anzeichen und Symptome, die bei mindestens 10 % der Patienten mit einer Überempfindlichkeitsreaktion auf Abacavir berichtet wurden, sind fett gedruckt). Organsystem Nebenwirkung Magen-Darm-Trakt Übelkeit, Erbrechen, Diarrhoe, Bauchschmerzen, Geschwüre im Mund Neurologisches System/ Psyche Kopfschmerzen, Parästhesie 11 Blutbild Lymphopenie Leber/Pankreas Erhöhte Leberwerte, Hepatitis, Leberversagen Muskel- und Skelettsystem Myalgie, selten Myolyse, Arthralgie, Erhöhung der KreatinPhosphokinase Respirationstrakt Dyspnoe, Halsschmerzen, Husten, akutes Atemnotsyndrom bei Erwachsen (akutes Lungenversagen), respiratorische Insuffizienz Haut Hautausschlag (gewöhnlich makulopapulös oder urtikariell) Urogenitaltrakt Erhöhung des Kreatinins, Nierenversagen Sonstige Fieber, Lethargie, allgemeines Krankheitsgefühl, Ödeme, Lymphadenopathie, Blutdruckabfall, Konjunktivitis, Anaphylaxie Nebenwirkungen, die mit den einzelnen arzneilich wirksamen Bestandteile berichtet wurden Die Nebenwirkungen, die mit den einzelnen Substanzen von Trizivir berichtet wurden, werden in Tabelle 2 präsentiert. Bei Auftreten eines dieser Symptome muss die Möglichkeit einer Überempfindlichkeitsreaktion sorgfältig abgeklärt und ausgeschlossen werden. Tabelle 2: Nebenwirkungen, die in Zusammenhang mit den einzelnen arzneilich wirksamen Bestandteilen von Trizivir berichtet wurden (Nebenwirkungen, die bei mindestens 5 % der Patienten berichtet wurden, sind fett gedruckt). Abacavir Lamivudin Zidovudin WICHTIG: Bezüglich Informationen zu Abacavir-Überempfindlichkeitsreaktionen siehe die Beschreibung oben in dem Kasten und Tabelle 1 Kardiomyopathie. Kardiovaskuläre Nebenwirkungen Nebenwirkungen auf den Gastrointestinaltrakt Übelkeit, Erbrechen, Diarrhoe. Übelkeit, Erbrechen, Diarrhoe, Bauchschmerzen oder -krämpfe. Übelkeit, Erbrechen, Anorexie, Diarrhoe, Bauchschmerzen, Pigmentierung der Mundschleimhaut, Dyspepsie und Flatulenz. Neurologische/ psychiatrische Nebenwirkungen Kopfschmerzen. Kopfschmerzen, Schlaflosigkeit, periphere Neuropathie (oder Parästhesie). Kopfschmerzen, Schlaflosigkeit, Parästhesie, Schwindel, Schläfrigkeit, Konzentrationsschwäche, Krämpfe, Angst, Depression. Neutropenie und Anämie, (beide gelegentlich in schwerer Form) traten bei der Kombination mit Zidovudin auf, Thrombozytopenie, sehr selten isolierte Anämie, Neutropenie und Leukopenie (nähere Informationen siehe unten), Thrombozytopenie und Panzytopenie mit Knochenmarkhypoplasie, selten isolierte Aplasie der Erythopoese ("Pure red cell aplasia"), sehr selten aplastische Anämie. Hämatologische Nebenwirkungen 12 Aplasie der Erythopoese ("Pure red cell aplasia"). vorübergehender Anstieg der Leberenzyme (AST, ALT), selten Hepatitis, Anstieg der Serumamylase und Pankreatitis. Lebererkrankungen wie schwere Hepatomegalie mit Steatose, erhöhte Werte von Leberenzymen und Bilirubin im Blut, Pankreatitis. Nebenwirkungen auf das MuskelSkelett-System Muskelfunktionsstörungen, Arthralgie, Rhabdomyolyse. Myalgie, Myopathie. Respiratorische Nebenwirkungen Husten, nasale Symptome. Husten, Dyspnoe. Nebenwirkungen auf Leber/ Pankreas Pankreatitis. Nebenwirkungen auf die Haut Hautausschlag (ohne systemische Symptome) Sehr selten Erythema multiforme, StevensJohnson-Syndrom und toxische epidermale Nekrolyse. Hautausschlag, Alopezie. Hautausschlag, Pigmentierung der Nägel und der Haut, Urtikaria, Juckreiz, Schwitzen. Metabolische/ endokrine Nebenwirkungen Laktatazidose. Laktatazidose. Laktatazidose. Sonstige Nebenwirkungen Fieber, Lethargie, Müdigkeit, Anorexie. Fieber, allgemeines Krankheitsgefühl, Müdigkeit. Allgemeines Krankheitsgefühl, Fieber, Miktionsdrang, Geschmacksstörungen, allgemeines Schmerzgefühl, Schüttelfrost, Brustschmerzen, ein grippeähnliches Syndrom, Gynäkomastie, Schwäche. Nebenwirkungen in Verbindung mit Abacavir: Viele der oben aufgelisteten Nebenwirkungen treten häufig (Übelkeit, Erbrechen, Diarrhoe, Fieber, Lethargie, Hautausschlag) Patienten mit Überempfindlichkeit gegenüber Abacavir auf. Daher müssen Patienten, bei denen eines oder mehrere dieser Symptome auftritt, sorgfältig auf das Vorhandensein einer Überempfindlichkeitsreaktion hin untersucht werden. Wenn Trizivir aufgrund solcher Symptome bei Patienten abgesetzt wurde und entschieden wird, ein Abacavir-haltiges Arzneimittel erneut einzusetzen, muss dies in einer Einrichtung geschehen, wo eine rasche medizinische Hilfe gewährleistet ist (siehe Abschnitt 4.4). Sehr selten wurde über Fälle von Erythema multiforme, Stevens-Johnson-Syndrom oder toxischer epidermaler Nekrolyse berichtet, bei denen eine Überempfindlichkeit gegen Abacavir nicht ausgeschlossen werden konnte. In solchen Fällen müssen Abacavir-haltige Arzneimittel dauerhaft abgesetzt werden. Hämatologische Nebenwirkungen in Verbindung mit Zidovudin: 13 Anämie, Neutropenie und Leukopenie traten vermehrt bei hohen Dosierungen (1200 - 1500 mg/Tag), sowie bei Patienten im fortgeschrittenen Stadium der HIV-Erkrankung (besonders, wenn die Knochenmarkreserve vor Behandlungsbeginn vermindert war) und insbesondere bei CD4-Zellwerten von unter 100/mm³ auf. Eine Dosiserniedrigung oder ein Therapieabbruch können erforderlich sein (siehe Abschnitt 4.4). Zur Behandlung der Anämie können Transfusionen erforderlich sein. Neutropenien sind häufiger bei Patienten mit verminderter Neutrophilen-Konzentration, niedrigen Hämoglobinwerten sowie niedrigen Vitamin-B12-Werten zu Beginn der Zidovudin-Therapie. Laktatazidose: Im Zusammenhang mit der Gabe von Nukleosidanaloga wurde über das Auftreten von Laktatazidosen, die in manchen Fällen tödlich verliefen und die üblicherweise mit schwerer Hepatomegalie und Hepatosteatose assoziiert waren, berichtet (siehe Abschnitt 4.4). Lipodystrophie/Stoffwechselerkrankungen: Die antiretrovirale Kombinationstherapie wurde mit einer Umverteilung des Körperfetts (Lipodystrophie) bei HIV-Patienten assoziiert, einschließlich eines Verlustes von peripherem und fazialem Unterhautfettgewebe, vermehrtem intraabdominellen und viszeralen Fettgewebe, Hypertrophie der Brüste und dorsozervikaler Fettansammlung (Stiernacken). Die antiretrovirale Kombinationstherapie wurde mit Stoffwechselanomalien assoziiert, wie Hypertriglyceridämie, Hypercholesterinämie, Insulinresistenz, Hyperglykämie und Hyperlaktatämie (siehe Abschnitt 4.4). 4.9 Überdosierung Es liegen keine Erfahrungen zur Überdosierung mit Trizivir vor. Nach einer akuten Überdosierung mit Lamivudin oder Zidovudin wurden keine anderen spezifischen Anzeichen oder Symptome außer den im Abschnitt Nebenwirkungen beschriebenen festgestellt. Über Todesfälle wurde nicht berichtet und alle Patienten erholten sich. In klinischen Studien mit Abacavir wurden Einzeldosen bis zu 1200 mg und Tagesdosen bis zu 1800 mg verabreicht. Es wurden keine unerwarteten Nebenwirkungen berichtet. Die Wirkung höherer Dosen ist nicht bekannt. Im Falle einer Überdosierung ist der Patient auf Anzeichen einer Intoxikation (siehe Abschnitt 4.8) zu beobachten und, wenn erforderlich, die notwendige unterstützende Therapie zu verabreichen. Da Lamivudin dialysierbar ist, kann eine Hämodialyse bei der Behandlung der Überdosierung durchgeführt werden, obgleich dies nicht gezielt untersucht wurde. Hämodialyse und Peritonealdialyse scheinen nur einen begrenzten Effekt auf die Elimination von Zidovudin zu haben, beschleunigen aber die Elimination des Glucuronidmetaboliten. Es ist nicht bekannt, ob Abacavir durch Peritonealdialyse oder durch Hämodialyse eliminiert werden kann. 5. PHARMAKOLOGISCHE EIGENSCHAFTEN 5.1 Pharmakodynamische Eigenschaften Pharmakotherapeutische Gruppe: Nukleosidanaloge Reverse-Transkriptase-Hemmer, ATC-Code: J05A F30. Wirkungsweise und Resistenz Abacavir, Lamivudin und Zidovudin sind nukleosidanaloge Reverse–Transkriptase-Hemmer und hochwirksame, selektive Inhibitoren von HIV-1 und HIV-2. 14 Alle drei Arzneistoffe werden sequentiell durch intrazelluläre Kinasen zum 5’-Triphosphat (TP) metabolisiert. Lamivudin-TP, Carbovir-TP (das aktive Triphosphat von Abacavir) und Zidovudin-TP stellen sowohl Substrate als auch kompetitive Inhibitoren der reversen Transkriptase des HIV dar. Hauptsächlich wird die antivirale Aktivität jedoch durch die Einfügung des Monophosphats in die virale DNA bedingt. Dabei kommt es zum Kettenabbruch. Abacavir-, Lamivudin- und ZidovudinTriphosphate zeigen eine signifikant geringere Affinität zu der DNA-Polymerase der Wirtszellen. Es hat sich gezeigt, dass Lamivudin und Zidovudin bei der Hemmung der Replikation von HIV in Zellkulturen stark synergistisch wirken. Abacavir zeigt in vitro in Kombination mit Nevirapin und Zidovudin synergistische Effekte. In Kombination mit Didanosin, Zalcitabin, Lamivudin und Stavudin zeigen sich additive Effekte. Abacavir-resistente HIV-1-Isolate wurden in vitro selektiert und sind mit spezifischen genotypischen Veränderungen in der die Reverse-Transkriptase (RT)-codierenden Region (Codons M184V, K65R, L74V und Y115F) verbunden. Die virale Resistenz gegen Abacavir entwickelt sich in vitro und in vivo relativ langsam und erfordert eine Vielzahl von Mutationen, um eine 8fache Erhöhung der IC50 gegenüber dem Wildtyp-Virus zu erreichen, welche einen klinisch relevanten Wert darstellen kann. Gegenüber Abacavir resistente Isolate können auch eine reduzierte Empfindlichkeit auf Lamivudin, Zalcitabin und/oder Didanosin zeigen, bleiben aber gegenüber Zidovudin und Stavudin empfindlich. Eine Kreuzresistenz zwischen Abacavir, Lamivudin oder Zidovudin und Proteasehemmern oder nicht nukleosidanalogen Reverse-Transkriptase-Hemmern ist unwahrscheinlich. Eine verminderte Empfindlichkeit gegenüber Abacavir wurde bei klinischen Isolaten von Patienten mit unkontrollierter viraler Replikation festgestellt, die mit anderen Nukleosidinhibitoren vorbehandelt und gegen diese resistent waren. Es ist unwahrscheinlich, dass klinische Isolate mit 3 oder mehr nukleosidanalogen Reverse-Transkriptase-Hemmern in Verbindung stehenden Mutationen gegenüber Abacavir empfindlich sind. Klinische Erfahrung In einer randomisierten, doppel-blinden, placebokontrollierten, klinischen Studie wurde die Kombination aus Abacavir, Lamivudin und Zidovudin mit der Kombination aus Indinavir, Lamivudin und Zidovudin bei nicht vorbehandelten Patienten verglichen. Aufgrund des hohen Anteils vorzeitiger Abbrüche (42 % der Patienten beendeten die randomisierte Behandlung bis Woche 48), kann keine definitive Schlussfolgerung in Hinblick auf die Gleichwertigkeit der beiden Therapieregimes in Woche 48 gezogen werden. Obwohl eine vergleichbare antivirale Wirksamkeit im Abacavir- und Indinavir-Arm in Hinblick auf den Anteil der Patienten mit einer nicht nachweisbaren Viruslast (< 400 Kopien/ml; Intent–to-treat-Analyse (ITT), 47 % gegenüber 49 %; As-treated-Analyse (AT), 86 % gegenüber 94 % in der Abacavir bzw. Indinavir-Kombination) beobachtet wurde, favorisierten die Ergebnisse die Kombination mit Indinavir insbesondere in der Untergruppe der Patienten mit einer hohen Viruslast (Ausgangswert mehr als 100.000 Kopien/ml; ITT 46 % versus 55 %; AT 84 % versus 93 % bei Abacavir bzw. Indinavir). In einer noch laufenden klinischen Studie mit antiretroviral nicht vorbehandelten Patienten über 16 Wochen zeigte die Kombination von Abacavir, Zidovudin und Lamivudin einen ähnlichen antiviralen Effekt wie die Kombination von Nelfinavir, Lamivudin und Zidovudin. Bei antiretroviral nicht vorbehandelten Patienten war die Dreifachkombination Abacavir, Lamivudin und Zidovudin der Kombination mit Lamivudin und Zidovudin in Hinsicht auf die Dauer der antiretroviralen Antwort über 48 Wochen überlegen. In einer ähnlichen Patientenpopulation wurde eine über 120 Wochen andauernde antiretrovirale Antwort bei ca. 70 % der Patienten gezeigt. Bei antiretroviral nicht vorbehandelten Patienten, die mit der Kombination Abacavir, Lamivudin, Zidovudin und Efavirenz im Rahmen einer kleinen, noch laufenden, offenen Pilotstudie behandelt wurden, betrug der Anteil der Patienten mit einer nicht nachweisbaren Viruslast (< 400 Kopien/ml) ca. 90 %, davon wiesen 80 % nach 24 Wochen Behandlung weniger als 50 Kopien/ ml auf. 15 Bei Patienten mit einer initialen Viruslast von < 5.000 Kopien/ml und einer moderaten antiretroviralen Vorbehandlung führte die zusätzliche Gabe von Abacavir zu einer bestehenden Therapie mit Lamivudin und Zidovudin zu einem moderaten Abfall der Viruslast in Woche 48. Zur Zeit liegen keine Daten zur Anwendung von Trizivir bei stark vorbehandelten Patienten, Patienten mit einem Therapieversagen oder Patienten mit fortgeschrittener Erkrankung (CD4-Zellen < 50 Zellen/mm³) vor. Bei stark vorbehandelten Patienten wird der Grad des Nutzens dieser Nukleosidkombination von der Art und Dauer der vorherigen Therapie abhängen, die möglicherweise HIV-1-Varianten mit einer Kreuzresistenz gegenüber Abacavir, Lamivudin oder Zidovudin selektiert hat. Bis heute liegen unzureichende Daten zur Wirksamkeit und Sicherheit von Trizivir bei gemeinsamer Verabreichung mit nicht nukleosidanalogen Reverse-Transkriptase-Hemmern oder Proteasehemmern vor. 5.2 Pharmakokinetische Eigenschaften Resorption Abacavir, Lamivudin und Zidovudin werden nach oraler Verabreichung schnell und gut aus dem Magen-Darm-Trakt resorbiert. Die absolute Bioverfügbarkeit von oral verabreichtem Abacavir, Lamivudin und Zidovudin liegt bei Erwachsenen um 83 %, 80 - 85 % bzw. 60 - 70 %. In einer pharmakokinetischen Studie bei HIV-1-infizierten Patienten waren die pharmakokinetischen Parameter von Abacavir, Lamivudin und Zidovudin im Steady State bei Gabe von Trizivir allein ähnlich der bei Gabe der Kombinationstablette mit Lamivudin/Zidovudin zusammen mit Abacavir. Ähnlich waren auch die Werte, die in einer Bioäquivalenzstudie mit Trizivir bei gesunden Probanden erhalten wurden. In einer Bioäquivalenzstudie wurde die Kombinationstablette mit Lamivudin/Zidovudin mit der Kombination aus Lamivudin 150 mg Tabletten und Zidovudin 300 mg Tabletten verglichen. In therapeutischer Dosierung (eine Filmtablette Trizivir zweimal täglich) bei Patienten betrugen die mittleren Cmax–Werte (Variationskoeffizient) für Abacavir, Lamivudin und Zidovudin im Steady-State 3,49 µg/ml (45 %), 1,33 µg/ml (33 %) und 1,56 µg/ml (83 %). Die entsprechenden Cmin–Werte konnten für Abacavir nicht ermittelt werden, für Lamivudin betragen sie 0,14 µg/ml (70 %) und für Zidovudin 0,01 µg/ml (64 %). Die mittleren AUC-Werte (Variationskoeffizient), über das Dosierungsintervall von 12 Stunden gemessen, betrugen für Abacavir, Lamivudin und Zidovudin 6,39 µg.h/ml (31 %), 5,73 µg.h/ml (31 %) und 1,50 µg.h/ml (47 %). Auch der Einfluss von Nahrungsmitteln auf die Rate und das Ausmaß der Resorption wurden untersucht. Es zeigte sich, dass die Kombinationstablette mit Lamivudin/Zidovudin bei nüchternen Probanden bioäquivalent zu Lamivudin 150 mg und Zidovudin 300 mg, die als Monopräparate in Kombination verabreicht wurden, war. In einer Bioäquivalenzstudie wurde Trizivir mit der Gabe von Abacavir 300 mg, Lamivudin 150 mg und Zidovudin 300 mg bei gemeinsamer Verabreichung verglichen. Ebenfalls untersucht wurde der Einfluss von Nahrung auf die Rate und das Ausmaß der Resorption. Es wurde gezeigt, dass Trizivir im Hinblick auf die AUC∞ und die Cmax bioäquivalent mit den Monopräparaten Abacavir 300 mg, Lamivudin 150 mg und Zidovudin 300 mg bei gemeinsamer Gabe war. Nahrungsmittel führten zu einer Herabsetzung der Resorptionsrate von Trizivir (leichte Abnahme von Cmax (im Mittel 18 bis 32 %) und einem Anstieg von tmax (um ca. 1 Stunde), aber nicht zu einer Veränderung des Ausmaßes der Resorption (AUC∞). Diese Veränderungen werden nicht als klinisch relevant angesehen, und es werden keine Nahrungsmitteleinschränkungen für die Verabreichung von Trizivir empfohlen. Ein mäßiger Anstieg der Cmax (28 %) wurde für Zidovudin beobachtet, wenn Zidovudin zusammen mit Lamivudin verabreicht wurde, obgleich die Gesamtexposition (AUC) nicht signifikant verändert wurde. Zidovudin hat keinen Einfluss auf die Pharmakokinetik von Lamivudin. Ein Einfluss von 16 Abacavir auf Zidovudin (Reduktion der Cmax um 20 %) und auf Lamivudin (Reduktion der Cmax um 35 %) wurde beobachtet. Verteilung Aus Studien, in denen Abacavir, Lamivudin bzw. Zidovudin intravenös verabreicht wurde, ist bekannt, dass das mittlere Verteilungsvolumen 0,8 l/kg, 1,3 l/kg bzw. 1,6 l/kg beträgt. Lamivudin besitzt ein lineares pharmakokinetisches Verhalten über die therapeutische Dosierungsbreite und eine begrenzte Bindung an das Hauptplasmaprotein Albumin (< 36 % an Serumalbumin in In-vitroStudien). Die Plasmaproteinbindung von Zidovudin beträgt 34 - 38 %. In-vitro-Studien zur Plasmaproteinbindung zeigen, dass Abacavir bei therapeutischer Konzentration nur geringfügig bis mäßig (∼49 %) an humanes Plasmaprotein bindet. Dies weist auf eine geringe Wahrscheinlichkeit von Wechselwirkungen mit anderen Arzneimitteln durch Verdrängung aus der Plasmaproteinbindung hin. Wechselwirkungen durch eine Verdrängung aus der Plasmaproteinbindung werden für Trizivir nicht erwartet. Die Daten zeigen, dass Abacavir, Lamivudin und Zidovudin in das zentrale Nervensystem (ZNS) eindringen und in der Cerebrospinalflüssigkeit (CSF) nachweisbar sind. Das durchschnittliche Verhältnis der Lamivudin- bzw. Zidovudin-Konzentration in der Cerebrospinalflüssigkeit zum Serumbetrug 2 - 4 Stunden nach der oralen Verabreichung ca. 0,12 bzw. 0,5. Das genaue Ausmaß der ZNSPenetration von Lamivudin und seine Korrelation mit einer klinischen Wirksamkeit ist nicht bekannt. Studien mit Abacavir zeigen, dass das Verhältnis Cerebrospinalflüssigkeit zur Plasma-AUC zwischen 30 und 44 % liegt. Die erreichten Werte der Höchstkonzentrationen lagen 9fach höher als die IC50 von Abacavir von 0,08 µg/ml oder 0,26 µM, wenn Abacavir in einer Dosierung von 600 mg zweimal täglich verabreicht wird. Metabolisierung Die Metabolisierung spielt bei der Elimination von Lamivudin eine untergeordnete Rolle. Lamivudin wird vor allem in unveränderter Form renal ausgeschieden. Die Wahrscheinlichkeit von metabolischen Arzneimittelwechselwirkungen mit Lamivudin ist aufgrund der wenig ausgeprägten hepatischen Metabolisierung (5 - 10 %) und der niedrigen Plasmaproteinbindung gering. Der Hauptmetabolit von Zidovudin sowohl im Plasma als auch im Urin ist das 5’-Glucuronid. 50 80 % der verabreichten Dosis werden als Glucuronid mit dem Urin ausgeschieden. 3’-Amino-3’Desoxythymidin (AMT) wurde als weiterer Metabolit von Zidovudin nach intravenöser Verabreichung identifiziert. Abacavir wird hauptsächlich über die Leber metabolisiert, wobei ca. 2 % der verabreichten Dosis in unveränderter Form renal ausgeschieden werden. Primär erfolgt die Metabolisierung beim Menschen über die Alkoholdehydrogenase und durch Glucuronidierung. Das führt zur Bildung der 5’Carboxysäure und des 5’-Glucuronids. Diese stellen ca. 66 % einer Dosis dar und werden im Urin gefunden. Elimination Die beobachtete Eliminationshalbwertszeit für Lamivudin beträgt 5 - 7 Stunden. Die mittlere systemische Clearance von Lamivudin beträgt ca. 0,32 l/h/kg, wobei die renale Clearance via aktiver tubulärer Sekretion stark überwiegt (> 70 %). Studien an Patienten mit Nierenfunktionsstörung zeigten, dass die Elimination von Lamivudin durch die Nierenfunktionsstörung beeinflusst wird. Eine Reduzierung der Dosis ist für Patienten mit einer Kreatinin-Clearance ≤ 50 ml/min erforderlich (siehe Abschnitt 4.2). In Studien wurde nach intravenöser Gabe von Zidovudin eine mittlere terminale Plasmahalbwertszeit von ca. 1,1 Stunden und eine mittlere totale Clearance von 1,6 l/h/kg gemessen. Die renale Clearance 17 von Zidovudin wird auf 0,34 l/h/kg geschätzt, was auf glomeruläre Filtration und aktive renale Ausscheidung über die Nieren hindeutet. Die Zidovudin-Spiegel sind bei Patienten mit fortgeschrittener Nierenfunktionsstörung erhöht. Die mittlere Halbwertszeit von Abacavir beträgt ca. 1,5 Stunden. Nach mehrfacher oraler Verabreichung von zweimal täglich 300 mg Abacavir gibt es keine signifikante Akkumulierung von Abacavir. Die Ausscheidung von Abacavir erfolgt über hepatische Metabolisierung mit anschließender Exkretion der Metaboliten vor allem über den Urin. Ca. 83 % einer verabreichten Abacavir-Dosis werden in Form der Metaboliten und als unverändertes Abacavir mit dem Urin ausgeschieden, der Rest mit den Faeces. Besondere Patientengruppen: Patienten mit Leberfunktionsstörungen: Es liegen keine Daten zur Anwendung von Trizivir bei Patienten mit Leberfunktionsstörungen vor. Begrenzte Daten von Patienten mit Leberzirrhose lassen vermuten, dass Zidovudin bei Patienten mit Leberfunktionsstörungen aufgrund der herabgesetzten Glucuronidierung akkumuliert. Daten, die man von Patienten mit mittelschwerer bis schwerer Leberfunktionsstörung erhalten hat, zeigen, dass die Pharmakokinetik von Lamivudin durch die Leberfunktionsstörung nicht signifikant beeinflusst wird. Abacavir wird hauptsächlich über die Leber metabolisiert. Die Pharmakokinetik von Abacavir wurde bei Patienten mit geringgradiger Leberfunktionsstörung (Child-Pugh Score 5-6) untersucht, die eine Einzeldosis von 600 mg erhielten. Die Resultate zeigten hauptsächlich einen Anstieg der AUC von Abacavir um das 1,89fache [1,32; 2,70] und der Eliminationshalbwertszeit von Abacavir um das 1,58fache [1,22; 2,04]. Aufgrund der starken Variabilität der Abacavir-Exposition ist es nicht möglich, eine Empfehlung für eine Dosisreduktion für Patienten mit geringfügiger Leberfunktionsstörung zu geben. Für Patienten mit mittelschwerer bis schwerer Einschränkung der Leberfunktion liegen keine pharmakokinetischen Daten zu Abacavir vor. Es wird erwartet, dass die Plasmakonzentrationen von Abacavir bei diesen Patienten variieren und stark ansteigen (siehe Abschnitt 4.3). Patienten mit Nierenfunktionsstörungen: Die beobachtete Eliminationshalbwertszeit für Lamivudin beträgt 5 bis 7 Stunden. Die mittlere systemische Clearance von Lamivudin beträgt ca. 0,32 l/h/kg, wobei die renale Clearance via aktiver tubulärer Sekretion stark überwiegt ( > 70 %). Studien an Patienten mit Nierenfunktionsstörung zeigen, dass die Ausscheidung von Lamivudin durch eine Nierenfunktionsstörung beeinflusst wird. Nach intravenöser Gabe von Zidovudin wurde eine mittlere terminale Plasmahalbwertszeit von ca. 1,1 Stunden gemessen. Die mittlere systemische Clearance betrug 1,6 l/h/kg, die renale Clearance von Zidovudin wird auf 0,34 l/h/kg geschätzt, was auf glomeruläre Filtration und aktive renale Ausscheidung über die Nieren hindeutet. Die Zidovudin-Spiegel sind bei Patienten mit fortgeschrittener Nierenfunktionsstörung erhöht. Abacavir wird hauptsächlich über die Leber metabolisiert, ca. 2 % werden unverändert über den Urin ausgeschieden. Die Pharmakokinetik von Abacavir bei Patienten im Endstadium einer Nierenerkrankung ist ähnlich der bei Patienten mit normaler Nierenfunktion. Daher ist eine Dosisreduktion bei Patienten mit Nierenfunktionsstörung nicht notwendig. Da eine Anpassung der Dosierung von Lamivudin und Zidovudin notwendig sein kann, wird empfohlen, dass bei Patienten mit herabgesetzter Nierenfunktion (Kreatinin-Clearance < 50 ml/min.) die Monopräparate von Abacavir, Lamivudin und Zidovudin angewendet werden. Die Anwendung von Trizivir bei Patienten im Endstadium einer Nierenerkrankung ist kontraindiziert (siehe Abschnitt 4.3). Ältere Patienten: Die Pharmakokinetik wurde bei Patienten über 65 Jahre nicht untersucht. 18 5.3 Präklinische Daten zur Sicherheit Es liegen keine Daten zur Anwendung einer Kombination aus Abacavir, Lamivudin und Zidovudin bei Tieren vor. Klinisch relevante toxische Wirkungen der drei Arzneistoffe sind Anämie, Neutropenie und Leukopenie. Mutagenität und Karzinogenität Weder Abacavir, Lamivudin noch Zidovudin wirken in Bakterientests mutagen, zeigen aber wie viele andere Nukleosidanaloga eine Aktivität in In-vitro-Untersuchungen an Säugerzellen wie dem MausLymphom-Test. Dies stimmt mit der diesbezüglichen bekannten Aktivität anderer Nukleosidanaloga überein. Lamivudin zeigte in In-vivo-Studien in Dosierungen, bei denen Plasmakonzentrationen erreicht wurden, die um den Faktor 40 - 50 höher lagen als die üblichen klinischen Plasmakonzentrationen, keine genotoxische Aktivität. Zidovudin zeigte nach mehrfacher oraler Verabreichung im Mikrokerntest an Mäusen und Ratten klastogene Wirkungen. Bei einer Untersuchung von Lymphozyten aus peripherem Blut von AIDS-Patienten, die Zidovudin erhielten, wurde eine erhöhte Anzahl von Chromosomenbrüchen beobachtet. Eine Pilotstudie hat gezeigt, dass Zidovudin in die nukleäre Leukozyten-DNA von Erwachsenen einschließlich Schwangeren inkorporiert wird, die Zidovudin zur Behandlung der HIV-1-Infektion oder zur Vorbeugung einer Übertragung des Virus von der Mutter auf das Kind einnehmen. Zidovudin wurde ebenso in die DNA von Leukozyten aus Nabelschnurblut von Säuglingen mit Zidovudin behandelter Mütter inkorporiert. In einer Studie zur transplazentaren Genotoxizität an Affen wurde Zidovudin allein mit der Kombination aus Zidovudin und Lamivudin in Dosen, die der Dosierung beim Menschen entsprechen, verglichen. Diese Studie zeigte, dass Feten, die in utero der Kombination ausgesetzt waren, eine höhere Rate an nukleosidanaloger DNA, inkorporiert in verschiedenen fetalen Organen, aufwiesen und verkürzte Telomere häufiger als bei allein Zidovudin ausgesetzten Feten auftraten. Die klinische Bedeutung dieser Befunde ist nicht bekannt. Abacavir weist in vitro und in vivo in hohen Konzentrationen ein schwaches Potential auf, Chromosomenschäden zu verursachen. Daher muss ein mögliches Risiko für den Menschen gegen den zu erwartenden Nutzen der Behandlung abgewogen werden. Das karzinogene Potential einer Kombination aus Abacavir, Lamivudin und Zidovudin wurde nicht untersucht. In Langzeitstudien zur Karzinogenität nach oraler Anwendung an Mäusen und Ratten zeigte Lamivudin kein karzinogenes Potential. In Studien zur Karzinogenität mit Zidovudin nach oraler Anwendung an Mäusen und Ratten wurden spät auftretende vaginale Epitheltumore beobachtet. In einer später durchgeführten Studie zur intravaginalen Karzinogenität wurde die Hypothese bestätigt, dass die Vaginaltumore das Ergebnis der langandauernden lokalen Einwirkung des hochkonzentrierten, unmetabolisierten Zidovudins im Urin auf das vaginale Epithel der Nager ist. Es wurden keine anderen geschlechts- oder speziesabhängigen Tumore, die auf Zidovudin zurückzuführen werden können, beobachtet. Zusätzlich wurden zwei transplazentale Karzinogenitätsstudien an Mäusen durchgeführt. In einer Studie, die vom National Cancer Institute der USA durchgeführt wurde, wurde Zidovudin in maximal tolerierten Dosen an trächtige Mäuse vom 12. bis 18. Tag der Schwangerschaft verabreicht. Ein Jahr nach der Geburt wurde bei der Nachkommenschaft, die der höchsten Dosierung (420 mg/kg Körpergewicht) ausgesetzt war, ein Anstieg der Tumorrate in der Lunge, der Leber und im weiblichen Genitaltrakt festgestellt. In einer zweiten Studie wurde Zidovudin 24 Monate lang in Dosen bis zu 40 mg/kg an Mäuse verabreicht, wobei die Verabreichung am 10. Schwangerschaftstag begann. Die durch die Behandlung bedingten Befunde waren auf spät auftretende vaginale Epitheltumore begrenzt. Diese wurden in einer ähnlichen Rate und zu einem ähnlichen Zeitpunkt beobachtet, wie in der oralen Standardstudie zur 19 Karzinogenität. Die zweite Studie lieferte daher keinen Beweis, das Zidovudin als ein transplazentales Karzinogen wirkt. Daraus wird geschlossen, dass die transplazentalen Karzinogenitätsdaten aus der ersten Studie ein hypothetisches Risiko darstellen, das gegen den erwiesenen therapeutischen Nutzen abgewogen werden sollte. Studien zur Karzinogenität mit oral verabreichtem Abacavir an Mäusen und Ratten zeigten einen Anstieg der Inzidenz maligner und nicht-maligner Tumore. Maligne Tumore traten im Drüsengewebe der Vorhaut männlicher Tiere sowie dem Drüsengewebe der Klitoris weiblicher Tiere beider Spezies auf, sowie in der Schilddrüse männlicher und in der Leber, der Harnblase, den Lymphknoten und der Unterhaut weiblicher Ratten. Die Mehrheit dieser Tumore trat bei den Abacavir-Höchstdosen von 330 mg/kg/Tag bei Mäusen und 600 mg/kg/Tag bei Ratten auf. Eine Ausnahme waren die Tumore des Vorhautdrüsengewebes, die bei Mäusen bei einer Dosis von 110 mg/ kg auftraten. Die systemische Exposition, bei der sich bei Mäusen und Ratten keine Wirkung zeigte, entsprach der 3- und 7fachen beim Menschen zu erwartenden systemischen Exposition während einer Behandlung. Obgleich das karzinogene Potential für den Menschen unbekannt ist, deuten diese Daten darauf hin, dass ein mögliches karzinogenes Risiko für Menschen durch den klinischen Nutzen aufgewogen wird. Toxizität nach wiederholter Gabe In Toxizitätsstudien zeigte sich, dass die Behandlung mit Abacavir zu einem Anstieg des Lebergewichts bei Ratten und Affen führt. Die klinische Relevanz dieses Befundes ist unbekannt. Ausgehend von klinischen Studien gibt es keinen Hinweis, dass Abacavir hepatotoxisch ist. Beim Menschen wurde keine Autoinduktion der Metabolisierung von Abacavir oder Induktion der Metabolisierung von anderen Arzneistoffen, die über die Leber metabolisiert werden, beobachtet. An den Herzen von Mäusen und Ratten wurde nach 2-jähriger Verabreichung von Abacavir eine schwache myokardiale Degeneration beobachtet. Die systemischen Expositionen entsprachen einer 7bis 24fachen beim Menschen zu erwartenden Exposition. Die klinische Relevanz dieses Befundes ist letztendlich noch nicht klar. Reproduktionstoxizität In Tierstudien wirkte Lamivudin nicht teratogen, es gab aber Hinweise auf eine Erhöhung der frühen Embryoletalität bei Kaninchen bei relativ niedriger systemischer Exposition vergleichbar der, die beim Menschen erzielt wird. Bei Ratten wurde selbst bei sehr hoher systemischer Exposition, kein ähnlicher Effekt beobachtet. Zidovudin zeigte bei beiden Tierspezies eine ähnliche Wirkung, aber nur bei sehr hoher systemischer Exposition. Maternal-toxische Dosen von Zidovudin führten bei Ratten während der Organogenese zu einer erhöhten Rate von Missbildungen bei den Feten. Bei niedrigeren Dosen wurden hingegen keine Hinweise auf fetale Missbildungen beobachtet. Es wurde gezeigt, dass Abacavir auf den sich entwickelnden Embryo und Fetus bei Ratten aber nicht bei Kaninchen toxisch wirkt. Die Befunde umfassten ein herabgesetztes Körpergewicht der Feten, Ödeme bei den Feten, eine Zunahme von Veränderungen bzw. Missbildungen des Skeletts, frühen intrauterinen Tod und Todgeburten. Aufgrund dieser embryo-fetalen Toxizität können keine Rückschlüsse in Hinblick auf das teratogene Potential von Abacavir gezogen werden. Eine Fertilitätsstudie bei Ratten hat gezeigt, dass Abacavir keinen Effekt auf die männliche oder weibliche Fertilität hat. Ebenso hatten weder Lamivudin noch Zidovudin eine Wirkung auf die Fertilität. Es hat sich gezeigt, dass Zidovudin die Anzahl der Spermien, die Morphologie der Spermien und deren Beweglichkeit beim Mann nicht beeinflusst. 20 6. PHARMAZEUTISCHE ANGABEN 6.1 Hilfsstoffe Tablettenkern: Mikrokristalline Cellulose, Poly(O-carboxymethyl)stärke-Natriumsalz (Typ A), Magnesiumstearat. Filmüberzug: Opadry Green 03B11434 enthält: Hypromellose, Titan(IV)-oxid, Macrogol, Indigocarmin-Aluminiumsalz, Eisenoxidhydrat. 6.2 Inkompatibilitäten Nicht zutreffend. 6.3 Dauer der Haltbarkeit 2 Jahre 6.4 Besondere Lagerungshinweise Nicht über 30°C lagern. 6.5 Art und Inhalt des Behältnisses Trizivir Filmtabletten sind in opaken PVC-Aclar-Durchdrückpackungen mit je 40 bzw. 60 Filmtabletten oder in kindergesicherten HDPE-Flaschen mit 60 Filmtabletten erhältlich. 6.6 Hinweise für die Handhabung Keine speziellen Hinweise. 7. PHARMAZEUTISCHER UNTERNEHMER Glaxo Group Ltd Greenford Middlesex UB6 0NN Vereinigtes Königreich 8. ZULASSUNGSNUMMERN EU/1/00/156/001 - Durchdrückpackung (40 Tabletten) EU/1/00/156/002 - Durchdrückpackung (60 Tabletten) EU/1/00/156/003 - Flasche (60 Tabletten) 9. DATUM DER ZULASSUNG/VERLÄNGERUNG DER ZULASSUNG 28. Dezember 2000 10. STAND DER INFORMATION 21 ANHANG III ETIKETTIERUNG UND PACKUNGSBEILAGE 22 B. PACKUNGSBEILAGE 23 GEBRAUCHSINFORMATION TRIZIVIR FILMTABLETTEN Bitte lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Einnahme dieses Arzneimittels beginnen. Heben Sie die Packungsbeilage auf. Vielleicht möchten Sie diese später nochmals lesen. Wenn Sie weitere Fragen haben, wenden Sie sich bitte an Ihren Arzt oder Apotheker. Dieses Arzneimittel wurde Ihnen persönlich verschrieben und darf nicht an Dritte weitergegeben werden. Es kann anderen Menschen schaden, auch wenn diese dieselben Symptome haben wie Sie. ÜBEREMPFINDLICHKEITSREAKTION Da Trizivir Abacavir enthält, das auch der arzneilich wirksame Bestandteil in Ziagen ist, können Patienten, die Trizivir einnehmen, möglicherweise eine Überempfindlichkeitsreaktion (schwerwiegende allergische Reaktion) entwickeln. Diese kann lebensbedrohlich werden, wenn Sie Trizivir weiterhin nehmen. Es ist wichtig, dass Sie die Informationen über diese Reaktion im Abschnitt Warnhinweise dieser Gebrauchsinformation sorgfältig lesen. Außerdem finden Sie eine Warnhinweiskarte in dieser Packung, die Sie und medizinisches Personal auf Überempfindlichkeitsreaktionen gegenüber Trizivir aufmerksam machen soll. Diese Karte sollten Sie ablösen und immer bei sich tragen. SETZEN SIE SICH SOFORT MIT IHREM ARZT IN VERBINDUNG, damit er entscheiden kann, ob Sie die Therapie mit Trizivir absetzen sollen, wenn: 1) Sie einen Hautausschlag bekommen ODER 2) Sie aus mindestens ZWEI der folgenden Gruppen eines oder mehrere der unten aufgeführten Symptome entwickeln: - Fieber - Kurzatmigkeit, Halsschmerzen oder Husten - Übelkeit oder Erbrechen oder Durchfall oder Bauchschmerzen - starke Müdigkeit oder diffuse Schmerzen oder ein allgemeines Krankheitsgefühl Wenn Sie Trizivir aufgrund einer solchen Überempfindlichkeitsreaktion abgesetzt haben, NEHMEN SIE NIE WIEDER Trizivir oder ein anderes Abacavir-haltiges Arzneimittel (z. B. Ziagen) ein, da es innerhalb von Stunden zu einem lebensbedrohlichen Blutdruckabfall oder zum Tod kommen kann. Wenn Sie auf Trizivir überempfindlich reagieren, sollten Sie alle nicht eingenommenen Tabletten entsorgen. Fragen Sie Ihren Arzt oder Apotheker um Rat. Diese Packungsbeilage beinhaltet: 1. Was ist Trizivir und wofür wird es angewendet? 2. Was müssen Sie vor der Einnahme von Trizivir beachten? 3. Wie ist Trizivir einzunehmen? 4. Welche Nebenwirkungen sind möglich? 5. Wie ist Trizivir aufzubewahren? 6. Weitere Angaben TRIZIVIR Filmtabletten Die arzneilich wirksamen Bestandteile in jeder Trizivir Filmtablette sind 300 mg Abacavir (als Abacavirhemisulfat), 150 mg Lamivudin und 300 mg Zidovudin. 24 Die sonstigen Bestandteile sind Mikrokristalline Cellulose, Poly(O-carboxymethyl)stärke-Natriumsalz und Magnesiumstearat im Tablettenkern. Der Filmüberzug enthält Hypromellose, Titan(IV)-oxid, Macrogol, Indigocarmin-Aluminiumsalz, Eisenoxidhydrat. Hersteller Pharmazeutischer Unternehmer Glaxo Wellcome Operations Priory Street Ware Hertfordshire SG12 0DJ Vereinigtes Königreich Glaxo Group Ltd Greenford Middlesex UB6 0NN Vereinigtes Königreich 1. WAS IST TRIZIVIR UND WOFÜR WIRD ES ANGEWENDET? Trizivir enthält Abacavir, Lamivudin und Zidovudin. Alle diese Substanzen gehören zu einer Gruppe von antiretroviralen Arzneimitteln, sogenannte nukleosidanaloge Reverse-Transkriptase-Hemmer (NRTI), die zur Behandlung der Infektion mit dem humanen Immunschwäche-Virus (HIV) angewendet werden. Diese drei Arzneimittel können jeweils einzeln in Kombination mit anderen Arzneimitteln zur Behandlung der HIV-Infektion angewendet werden, oder sie können gemeinsam angewendet werden. Die Dosierung der einzelnen Wirkstoffe in Trizivir entspricht der Dosierung, die empfohlen wird, wenn die Arzneimittel getrennt angewendet werden. Trizivir wird zur Behandlung der HIV-Infektion bei Erwachsenen eingesetzt. Es wird nicht zur Anwendung bei Kindern oder Jugendlichen empfohlen, da die Datenlage unzureichend ist. Es senkt die HIV-Viruslast und hält sie auf einem niedrigen Niveau. Es steigert auch die CD4-Zellzahl. CD4Zellen gehören zu den weißen Blutkörperchen, die eine wichtige Rolle bei der Aufrechterhaltung eines gesunden Immunsystems und dem Kampf gegen Infektionen spielen. Patienten sprechen unterschiedlich auf die Behandlung mit Trizivir an. Ihr Arzt wird die Wirksamkeit Ihrer Behandlung überwachen. Die kapselförmigen Filmtabletten sind blaugrün und auf einer Seite mit der Prägung “GX LL1” versehen. Sie sind in Durchdrückpackungen mit 40 oder 60 Tabletten oder in Flaschen mit kindersicherem Verschluss mit 60 Tabletten erhältlich. 2. WAS MÜSSEN SIE VOR DER EINNAHME VON TRIZIVIR BEACHTEN? TRIZIVIR darf nicht eingenommen werden, wenn bei Ihnen schon früher eine Überempfindlichkeitsreaktion gegenüber Trizivir oder einem anderen Arzneimittel, das Abacavir enthält (Ziagen), gegenüber Lamivudin oder Zidovudin oder einem der sonstigen Bestandteile von Trizivir aufgetreten ist. wenn Sie eine Lebererkrankung haben. wenn Sie an einer schweren Nierenerkrankung leiden. wenn Sie eine sehr geringe Anzahl roter Blutkörperchen (Anämie) oder sehr geringe Anzahl weißer Blutkörperchen (Neutropenie) haben. Im Zweifelsfall fragen Sie bitte Ihren Arzt. Warnhinweise und Vorsichtsmaßnahmen für die Anwendung Überempfindlichkeitsreaktion (schwere allergische Reaktion): Ca. 4 von 100 Patienten, die mit Abacavir behandelt werden, entwickeln eine Überempfindlichkeitsreaktion. Die am häufigsten beobachteten Anzeichen für eine Überempfindlichkeitsreaktion sind erhöhte Temperatur (Fieber) und Hautausschlag. Andere häufige Symptome sind Übelkeit, Erbrechen, Durchfall, Bauchschmerzen und starke Müdigkeit. Andere Symptome können Gelenk- oder 25 Muskelschmerzen, Anschwellen des Nackens, Kurzatmigkeit, Halsschmerzen, Husten, Kopfschmerzen einschließen. Gelegentlich können eine Entzündung des Auges (Konjunktivitis), Geschwüre im Mundbereich oder niedriger Blutdruck auftreten. Die Symptome der allergischen Reaktion können zu jedem Zeitpunkt der Behandlung mit Abacavir auftreten, normalerweise jedoch während der ersten 6 Behandlungswochen. Die Symptome verschlechtern sich, wenn Sie Abacavir weiter einnehmen und können bei weiterer Einnahme lebensbedrohlich werden. SETZEN SIE SICH SOFORT MIT IHREM ARZT IN VERBINDUNG, damit er entscheiden kann, ob Sie die Therapie mit Trizivir absetzen sollen, wenn: 1) Sie einen Hautausschlag bekommen ODER 2) Sie aus mindestens ZWEI der folgenden Gruppen eines oder mehrere der unten aufgeführten Symptome entwickeln: - Fieber - Kurzatmigkeit, Halsschmerzen oder Husten - Übelkeit oder Erbrechen oder Durchfall oder Bauchschmerzen - starke Müdigkeit oder diffuse Schmerzen oder ein allgemeines Krankheitsgefühl Wenn Sie Trizivir aufgrund einer solchen Überempfindlichkeitsreaktion abgesetzt haben, NEHMEN SIE NIE WIEDER Trizivir oder ein anderes Abacavir-haltiges Arzneimittel (z. B. Ziagen) EIN, da es innerhalb von Stunden zu einem lebensbedrohlichen Blutdruckabfall oder zum Tod kommen kann. Falls Sie die Therapie mit Trizivir aus irgendeinem Grund unterbrochen haben, besonders wenn Sie der Meinung waren, Nebenwirkungen oder eine andere Erkrankung zu bekommen, suchen Sie vor einer erneuten Einnahme von Trizivir unbedingt Ihren Arzt auf. Ihr Arzt wird überprüfen, ob die bei Ihnen aufgetretenen Symptome auf eine Überempfindlichkeitsreaktion zurückzuführen sein könnten. Wenn Ihr Arzt meint, dass ein möglicher Zusammenhang besteht, wird er Sie anweisen, nie wieder Trizivir oder ein anderes Abacavir-haltiges Arzneimittel (z. B. Ziagen) einzunehmen. Es ist wichtig, dass Sie diese Anweisung befolgen. Vereinzelt traten lebensbedrohliche Überempfindlichkeitsreaktionen bei Patienten auf, die Abacavir wieder einnahmen, nachdem bei Ihnen nur eines der auf der Warnhinweiskarte aufgeführten Symptome vor der Therapieunterbrechung aufgetreten war. In sehr seltenen Fällen wurde von Überempfindlichkeitsreaktionen bei Patienten berichtet, die Abacavir nach einer Therapieunterbrechung wieder einnahmen und keines dieser Symptome vor der Therapieunterbrechung an sich beobachtet hatten. Wenn Sie auf Trizivir überempfindlich sind, sollten Sie das restliche, nicht verwendete Trizivir vollständig entsorgen. Fragen Sie Ihren Arzt oder Apotheker um Rat. Informieren Sie Ihren Arzt über jedes neue Symptom, das während der Einnahme von Trizivir auftritt. Dabei kann es sich um Nebenwirkungen aufgrund eines der arzneilich wirksamen Bestandteile handeln. Ihr Arzt wird vielleicht entscheiden, Ihnen Abacavir, Lamivudin und Zidovudin als Einzelpräparate anstelle von Trizivir zu verschreiben. Die Gruppe von Arzneimitteln, zu denen auch Trizivir gehört (nukleosidanaloge ReverseTranskriptase-Hemmer), kann eine Erkrankung hervorrufen, die als Laktatazidose (erhöhter Milchsäurewert im Blut) bezeichnet wird und von einer Lebervergrößerung begleitet wird. Eine Laktatazidose, wenn sie auftritt, entwickelt sich meist nach einigen Monaten Behandlung. Tiefes, beschleunigtes Atmen, Schläfrigkeit und unspezifische Symptome wie Übelkeit, Erbrechen und Bauchschmerzen können auf die Entwicklung einer Laktatazidose hinweisen. Diese seltene, aber schwerwiegende Nebenwirkung tritt häufiger bei Frauen auf, vor allem bei Frauen mit starkem Übergewicht. Besondere Vorsicht ist geboten, wenn bei Ihnen bereits eine Lebererkrankung vorliegt. Ihr Arzt wird Ihren Gesundheitszustand während der Einnahme von Trizivir regelmäßig auf Anzeichen einer sich entwickelnden Laktatazidose hin kontrollieren. 26 Bei Patienten, die eine antiretrovirale Kombinationstherapie erhalten, können eine Umverteilung, Ansammlung oder ein Verlust von Körperfett auftreten. Suchen Sie Ihren Arzt auf, wenn Sie Veränderungen der Körperfettverteilung bemerken. Bitte informieren Sie Ihren Arzt, wenn Sie eine Lebererkrankung in Ihrer Vorgeschichte haben. Patienten mit chronischer Hepatitis B oder C, die mit antiretroviralen Mitteln behandelt werden, haben ein erhöhtes Risiko für schwere und möglicherweise lebensbedrohliche Nebenwirkungen an der Leber und benötigen daher regelmäßige Blutuntersuchungen im Rahmen der Kontrolle der Leberfunktion. Wenn Sie eine Hepatitis-B-Infektion haben, sollten Sie Trizivir ohne Rücksprache mit Ihrem Arzt keinesfalls absetzen, da Sie einen Hepatitis-Rückfall erleiden könnten. Ein solcher Rückfall kann schwerer verlaufen, wenn zusätzlich eine schwere Lebererkrankung besteht. Entzündungen der Bauchspeicheldrüse (Pankreatitis) traten bei einigen Patienten, die mit Lamivudin und Zidovudin behandelt wurden, auf, jedoch war es nicht klar, ob diese aufgrund des Arzneimittels oder der HIV-Infektion selbst auftraten. Wenn Ihr Arzt klinische Anzeichen, Symptome oder Laborwertveränderungen, die auf eine Pankreatitis hindeuten, bei Ihnen feststellt, wird er die Behandlung mit Trizivir sofort beenden. Trizivir hilft, Ihre Erkrankung unter Kontrolle zu halten, heilt sie aber nicht. Es ist erforderlich, dass Sie Trizivir regelmäßig jeden Tag einnehmen. Beenden Sie die Einnahme nicht, bevor Sie mit Ihrem Arzt gesprochen haben. Falls Sie jedoch den Verdacht haben, dass sich bei Ihnen eine Überempfindlichkeitsreaktion entwickelt (siehe oben), setzen Sie sich sofort mit Ihrem Arzt in Verbindung. Ihr Arzt wird entscheiden, ob Sie die Einnahme von Trizivir beenden müssen. Zidovudin kann die Produktion der roten Blutkörperchen beeinflussen, was zu einer Anämie (Blutarmut) führt. Wenn dies auftritt, sind die Anzeichen Müdigkeit und Kurzatmigkeit. Weniger häufig kann die Produktion einer bestimmten Art von weißen Blutkörperchen herabgesetzt werden, was Sie anfälliger gegenüber Infektionen machen kann. Ihr Arzt wird Sie von Zeit zu Zeit zu einem Bluttest auffordern, um die Anzahl der Blutkörperchen zu bestimmen. Diese Wirkungen sind im Allgemeinen reversibel. Die Behandlung mit Trizivir verringert nicht das Risiko einer Übertragung von HIV auf andere durch Sexualkontakt oder Kontamination mit Blut. Daher sollen weiterhin entsprechende Vorsichtsmaßnahmen angewendet werden. Es können auch weiterhin andere Infektionen oder Komplikationen im Zusammenhang mit der HIVInfektion auftreten. Daher sollten Sie regelmäßig Ihren behandelnden Arzt aufsuchen, während Sie Trizivir einnehmen. Schwangerschaft Trizivir wird NICHT zur Anwendung bei schwangeren Frauen empfohlen. Wenn sie schwanger sind oder bald schwanger werden möchten, müssen Sie Ihren Arzt informieren. Stillzeit Es wird empfohlen, während der Einnahme von Trizivir NICHT zu stillen. Außerdem wird empfohlen, dass HIV-infizierte Frauen unter gar keinen Umständen ihre Kinder stillen sollten, um eine Übertragung von HIV von der Mutter auf das Kind zu vermeiden. Wenn Sie stillen, müssen Sie Ihren Arzt informieren. Verkehrstüchtigkeit und das Bedienen von Maschinen Es wurden keine Studien zu den Auswirkungen von Trizivir auf die Verkehrstüchtigkeit und das Bedienen von Maschinen durchgeführt. Bevor Sie in Betracht ziehen, ein Fahrzeug zu führen oder Maschinen zu bedienen, sollten Sie Ihren gesundheitlichen Zustand und die möglichen Nebenwirkungen von Trizivir bedenken. 27 Wechselwirkungen mit anderen Arzneimitteln Informieren Sie Ihren Arzt oder Apotheker über alle Medikamente, die Sie einnehmen oder bis vor kurzem eingenommen haben, auch solche, die Sie ohne Rezept gekauft haben! Trizivir soll nicht zusammen mit Stavudin, Zalcitabin, Ribavirin, Injektionen von Ganciclovir oder Foscarnet eingenommen werden. Die Einnahme von Trizivir mit bestimmten anderen Arzneimitteln kann zu Wechselwirkungen führen, welche möglicherweise Nebenwirkungen verstärken. Es ist wichtig, dass Sie Ihren Arzt informieren, wenn Sie eines der folgenden Medikamente einnehmen (fragen Sie Ihren Arzt, wenn Sie sich nicht sicher sind): - - Phenytoin, Valproinsäure, Phenobarbital, Oxazepam, Lorazepam. Acetylsalicylsäure (eine Substanz, die in vielen Arzneimitteln gegen Schmerzen und Fieber enthalten ist), Codein, Morphin, Methadon, Rifampicin, Indometacin, Ketoprofen, Naproxen, Cimetidin, Clofibrat, Isoprinosin, Probenecid. Pentamidin, Pyrimethamin, Co-trimoxazol, Dapson, Atovaquon, Amphotericin, Flucytosin, Interferon. Vincristin, Vinblastin und Doxorubicin. Alkohol erhöht die Abacavir-Konzentration im Blut. Wenn Sie Arzneimittel mit Vitamin A oder einem Vitamin-A-Derivat, z. B. Isotretinoin, einnehmen, sollten Sie Ihren Arzt informieren, da Vitamin A ebenfalls die Abacavir-Konzentration im Blut erhöhen kann. Wenn Sie Methadon einnehmen, muss Ihr Arzt unter Umständen Ihre Methadon-Dosis anpassen, da Abacavir (einer der arzneilich wirksamen Bestandteile in Trizivir) die Ausscheidungsrate von Methadon aus dem Körper erhöht. Dies wird jedoch die meisten Methadon-Patienten nicht betreffen. 3. WIE IST TRIZIVIR EINZUNEHMEN? Nehmen Sie Trizivir immer genau nach Anweisung Ihres Arztes ein und vergewissern Sie sich, dass Sie möglichst keine Dosis vergessen. Im Zweifelsfall sollten Sie Ihren Arzt oder Apotheker fragen. Die übliche Dosis für Erwachsene beträgt 1 Tablette zweimal täglich. Es sollten ca. 12 Stunden zwischen den Einnahmen der beiden Tabletten liegen. Nehmen Sie die Tablette unzerkaut mit Wasser ein. Trizivir kann mit oder ohne eine Mahlzeit eingenommen werden. Wenn Ihr Arzt die Dosis von Trizivir verringern möchte, z. B. wenn Sie Probleme mit der Nierenfunktion haben, dann kann Ihre Medikation auf Lamivudin, Zidovudin und Abacavir als getrennte Arzneimittel geändert werden. Wenn Sie eine größere Menge von Trizivir eingenommen haben, als Sie sollten: Wenn Sie versehentlich zu viel Trizivir eingenommen haben, sollten Sie Ihren Arzt oder Apotheker informieren oder mit der nächsten Notfallaufnahme Kontakt aufnehmen, um weiteren Rat einzuholen. Wenn Sie die Einnahme von Trizivir vergessen haben: Es ist wichtig, die gesamte verschriebene tägliche Dosis einzunehmen, um sicher zu gehen, dass der Nutzen der Behandlung möglichst groß ist. Wenn Sie die Einnahme einer Dosis von Trizivir vergessen haben, nehmen Sie es, sobald Sie daran denken, ein und setzen dann die Einnahme wie vorher fort. Nehmen Sie nicht eine doppelte Dosis zum Ausgleich der vergessenen Dosis ein. Es ist wichtig, Trizivir regelmäßig einzunehmen, da eine unregelmäßige Einnahme das Risiko einer Überempfindlichkeitsreaktion erhöhen kann. Auswirkungen, wenn die Behandlung mit Trizivir unterbrochen wird: 28 Falls Sie die Therapie mit Trizivir aus irgendeinem Grund unterbrochen haben, besonders wenn Sie der Meinung waren, Nebenwirkungen oder auch eine andere Erkrankung zu bekommen, suchen Sie vor einer erneuten Einnahme von Trizivir unbedingt Ihren Arzt auf. Es ist möglich, dass Ihr Arzt eine erneute Einnahme von Trizivir unter klinischer Kontrolle durchführen möchte, um schnellen Zugriff auf medizinische Hilfe zu haben. 4. WELCHE NEBENWIRKUNGEN SIND MÖGLICH? Wie alle Arzneimittel kann Trizivir Nebenwirkungen haben. Bei der Behandlung einer HIV-Infektion kann man nicht immer mit Sicherheit sagen, ob die auftretende Nebenwirkung durch Trizivir oder ein gleichzeitig eingenommenes anderes Arzneimittel oder durch die HIV-Erkrankung selbst verursacht wird. Aus diesem Grund ist es sehr wichtig, dass Sie Ihren Arzt über alle Veränderungen Ihres Gesundheitszustandes informieren. Sie sollten über diese Aufstellung möglicher Nebenwirkungen von Trizivir nicht verunsichert sein, da diese bei Ihnen nicht auftreten müssen. Bei ungefähr vier von hundert Patienten, die mit Abacavir behandelt wurden, ist über eine Überempfindlichkeitsreaktion (schwerwiegende allergische Reaktion) berichtet worden. Diese ist im Abschnitt 2 “Warnhinweise und Vorsichtsmaßnahmen für die Anwendung“ dieser Gebrauchsinformation beschrieben. Es ist wichtig, dass Sie die Information über diese schwerwiegende Reaktion lesen und verstehen. Häufig auftretende Nebenwirkungen, die bei mindestens 5 von 100 Patienten beobachtet wurden, sind fett gedruckt. • • • • • • • • • • Brustschmerzen können auftreten, die möglicherweise auf eine Herzmuskelerkrankung, auch Kardiomyopathie genannt, hindeuten. Übelkeit, Erbrechen, Bauchschmerzen und -krämpfe, Durchfall, Appetitlosigkeit, Blähungen und Verdauungsstörungen. Kopfschmerzen, Schwindel, Taubheit, Kribbeln oder Schwächegefühl in den Gliedmaßen, Krämpfe (Anfälle), Schlafstörungen, Müdigkeit, Angst, Depression, allgemeines Unwohlsein. Husten, Nasenbeschwerden, Atemlosigkeit. Gelenkschmerzen, Muskelerkrankungen einschließlich seltener Berichte über den Zerfall von Muskelgewebe. Ermüdung, Fieber, allgemeines Krankheitsgefühl und Lethargie. Geschmacksstörungen, Geschwüre im Mund, Entzündungen des Auges (Konjunktivitis), Schüttelfrost, häufiges Wasserlassen, Vergrößerung der Brust bei männlichen Patienten, Schmerzen in der Brust, grippeähnliche Symptome. Anämie (niedrige Anzahl roter Blutkörperchen) und Neutropenie/Leukopenie (niedrige Anzahl weißer Blutkörperchen), traten gelegentlich auch in schwerer Form auf. Die Abnahme der Produktion roter Blutkörperchen kann sich durch die Symptome Müdigkeit und Atemnot bemerkbar machen. Die Abnahme der Produktion bestimmter weißer Blutkörperchen kann zu einer erhöhten Anfälligkeit gegenüber Infektionen führen. Farbveränderungen der Nägel und der Haut, Farbflecken im Mund, Hautausschlag, in sehr seltenen Fällen wurde über schwerwiegende Hautreaktionen berichtet, Blasen, Juckreiz, Schwitzen und Haarausfall. Lebererkrankungen, z. B. Lebervergrößerung, Fettleber, Gelbsucht und selten Hepatitis. Entzündung der Bauchspeicheldrüse. Über eine Abnahme der Blutplättchen (Blutzellen, die für die Blutgerinnung wichtig sind) wurde berichtet. Wenn Sie wenige Blutplättchen haben, stellen Sie vielleicht fest, dass Sie leichter blaue Flecken entwickeln. In seltenen Fällen wurde bei Patienten, die mit nukleosidanalogen Reverse-Transkriptase-Hemmern behandelt wurden, eine Erkrankung beobachtet, die als Laktatazidose bezeichnet wird. Dabei kann die Erhöhung der Milchsäure im Körper Wassermangel verursachen, der bis zum Koma führen kann (für weitere Informationen siehe Abschnitt Warnhinweise und Vorsichtsmaßnahmen für die Anwendung). 29 Eine antiretrovirale Kombinationsbehandlung kann aufgrund einer veränderten Fettverteilung zu einer Veränderung der Körperform führen. Dies kann Fettverlust an Beinen, Armen und im Gesicht, eine Fettzunahme am Bauch und in anderen inneren Organen, Brustvergrößerung und Fettgeschwülste im Nacken („Stiernacken“) einschließen. Die Ursache dieser Veränderungen und ihre Langzeitauswirkungen auf die Gesundheit sind derzeit nicht bekannt. Eine antiretrovirale Kombinationsbehandlung kann auch erhöhte Blutwerte für Milchsäure und Zucker, eine Hyperlipidämie (erhöhte Blutfettwerte) und eine Insulinresistenz verursachen. Informieren Sie Ihren Arzt oder Apotheker, wenn Sie Nebenwirkungen bemerken, die nicht in dieser Packungsbeilage aufgeführt sind. 5. WIE IST TRIZIVIR AUFZUBEWAHREN? Arzneimittel für Kinder unzugänglich aufbewahren. Nicht über 30°C lagern. Sie dürfen das Arzneimittel nach dem auf der Verpackung angegebenen Verfallsdatum nicht mehr verwenden. 30 6. WEITERE ANGABEN Falls weitere Informationen über das Arzneimittel gewünscht werden, setzen Sie sich bitte mit dem örtlichen Vertreter des Pharmazeutischen Unternehmers in Verbindung. Belgique/België/Belgien GlaxoSmithKline s.a./n.v. Rue du Tilleul 13 B-1332 Genval Tél/Tel: + 32 (0)2 656 21 11 Luxembourg/Luxemburg GlaxoSmithKline s.a./n.v. Rue du Tilleul 13 B-1332 Genval Belgique/Belgien Tél/Tel: + 32 (0)2 656 21 11 Danmark GlaxoSmithKline Pharma A/S Nykær 68 DK-2605 Brøndby Tlf: + 45 36 35 91 00 Nederland GlaxoSmithKline BV Huis ter Heideweg 62 NL-3705 LZ Zeist Tel: + 31 (0)30 6938 100 Deutschland GlaxoSmithKline GmbH & Co. KG D- 80700 München Tel.: +49 (0)89 36044 8701 Norge GlaxoSmithKline AS Forskningsveien 2A Postboks 180 Vinderen N-0319 Oslo Tlf: + 47 22 70 20 00 Ελλάδα GlaxoSmithKline Α.Ε.Β.Ε Λεωφ. Κηφισίας 266 GR-152 32 Χαλάνδρι Αθήνα Τηλ: + 30 210 68 82 100 Österreich GlaxoSmithKline Pharma GmbH Albert-Schweitzer-Gasse 6 A-1140 Wien Tel: + 43 (0)1 97075-0 España GlaxoSmithKline, S.A. Parque Tecnológico de Madrid c/ Severo Ochoa 2 E-28760 Tres Cantos Madrid Tel: + 34 902 202 700 Portugal Glaxo Wellcome Farmacêutica, Lda. R. Dr. António Loureiro Borges, 3 Arquiparque, Miraflores P-1495-131 Algés Tel: + 351 21 412 95 00 France Laboratoire GlaxoSmithKline 100, route de Versailles F-78163 Marly-le-Roi Cedex Tél : + 33 (0)1 39 17 84 44 Suomi/Finland GlaxoSmithKline Oy PL/PB 24 FIN-02231 Espoo/Esbo Puh/Tel: + 358 (0) 10 30 30 30 31 Ireland GlaxoSmithKline (Ireland) Limited Stonemasons Way Rathfarnham IRL-Dublin 16 Tel: + 353 1 4955000 Sverige GlaxoSmithKline AB Aminogatan 27 P.O. Box 263 S-431 23 Mölndal Tel: + 46 (0)31 67 09 00 Ísland GlaxoSmithKline ehf Þverholt 14 IS-105 Reykjavík Tel: + (354) 530 3700 United Kingdom GlaxoSmithKline UK Stockley Park West Uxbridge Middlesex UB11 1BT-UK Tel: + 44 (0)20 8990 9000 Italia GlaxoSmithKline S.p.A. Via Alessandro Fleming, 2 I-37135 Verona Tel: + 39 (0)45 9218 111 Stand der Information: 32