Lösung für die 5. Aufgabe
Werbung

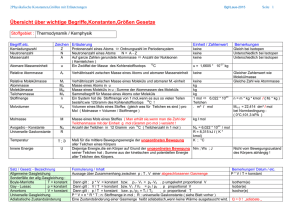
In einem Bombenkalorimeter mit einer Wärmekapazität von 641 J/K wurden 0,3212 g Glucose verbrannt. Der beobachtete Temperaturanstieg betrug 7,793 K. Berechnen Sie (a) ∆CH, (b) ∆CU und (c) ∆BH von Glucose. + 6 → 6 + 6 a) ∗∆ Δ H=− ∗∆ =− ! " % 641 & ∗ 7,793& 2% Δ H=− = 2801854,266% = 2801,85 0,3212!/0 180,16 !/0 b) Δ H = Δ U + p∆V Δ U = Δ H − p∆V Da die Drücke nicht bekannt sind kann man nach der universalen Gasgleichung diesen Term ersetzen p∆V = ΔnRT Δ U = Δ H − ΔnRT Nach der Reaktionsgleichung der Verbrennung werden 6 mol Gase eingesetzt und 6 mol Gas erzeugt. Δn = 6 − 6 = 0 Anmerkung: Es werden hier nur die Stoffmengenänderungen der Gase betrachtet, da diese den größten Anteil am Volumen der beteiligten Stoffe ausmachen. Die Feststoffe (Glucose) bzw. Flüssigkeiten (Wasser) können vernachlässigt werden. Δ U = 2801,85 kJ J − 0mol ∗ 8,314 ∗ 298,15& mol K ∗ mol Δ U = 2801,85 kJ mol c) Δ? Δ? = 6 ∗ Δ? @ AB C + 6 ∗ Δ? @DB AC − @Δ C = 6 ∗ −393,51 + 6 ∗ −285,83 − @−2801,85C Δ? = −1274,19 2% !/0 Zusatz zu a) Erläuterung der Formel: Δ H=− ∗∆ Diese Formel wird aus der kalorischen Zustandsgleichung hergeleitet: (Auszug aus chemie.de) Die kalorische Zustandsgleichung, auch als Energiegleichung bezeichnet, beschreibt die Verknüpfung der inneren Energie U bzw. der Enthalpie H mit jeweils drei thermodynamischen Zustandsgrößen, dem Volumen V (bzw. dem Druck p), der Temperatur T und der Stoffmenge n. Für U = U(T,V,n1,...,nk) und H = H(T,p,n1,...,nk) ergeben sich die totalen Differentiale: Mit der Annahme dni = 0 (konstante Stoffmenge) und den Beziehungen bzw. folgt bzw. wobei CV die isochore Wärmekapazität und CP die isobare Wärmekapazität ist. Bei der Bombenkalorimetrie ist das Volumen konstant. Die Änderung des Druckes während der Verbrennung ist im Gegensatz zu der freiwerdenden Energie minimal und kann Näherungsweise auch al konstant angenommen werden (in Bezug auf den Praktikumsversuch V14). Bei anderen Kalorimetern wird von vornherein ein Druck von ca. 100 bar auf die Bombe gegeben, wo man den Druck als konstant annehmen kann. Deshalb kann zur Berechnung der Enthalpie bezogen auf die Stoffmenge folgende Formel herangezogen werden: Δ H=− ∗∆