Anorganische Peroxide und Radikale(Benjamin Scharbert)
Werbung

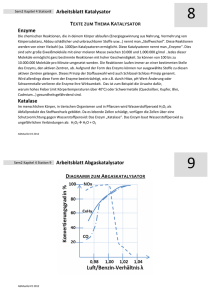
Anorganische Peroxide und Radikale von Benjamin Scharbert Inhalt: 1. Anorganische Peroxide: 1.1 1.2 1.3 1.4 Grundsätzliches Na2O2 BaO2 H2O2 2. Radikale: 2.1 2.2 2.3 2.4 2.5 Grundsätzliches Sauerstoff Stickstoffmonoxid Hydroxylradikal Kettenreaktionen mit HX 1.1 Grundsätzliches zu Peroxiden Peroxide enthalten Sauerstoff mit der Oxidationszahl -1. Charakterischtisch ist die R – O – O – R Bindung. Beispiele: H – O – O – H , Na – O – O – Na Die O – O Bindung ist schwach da die freien Elektronenpaare der Sauerstoffe wechselwirken und sind deshalb metastabil. Beim Erhitzen zersetzen sich die Peroxide in das Oxid und O2. Bekannt sind die Peroxide der Alkalimetalle, sowie der von Ca, Sr, Ba. Wichtig sind Na2O2 und BaO2. 1.1 Grundsätzliches zu Peroxiden Ionische Peroxide sind formal Salze der schwachen Säure H2O2. Löst man metallische Peroxide unter Kühlung in Wasser erhält man eine alkalische Lsg und H2O2. Na2O2 + 2 H2O Æ H2O2 + NaOH Ohne Kühlung zersetzt sich, wegen der Temperaturerhöhung unter der katalytischen Wirkung der OH- Ionen des Wassers, daß H2O2 zu O2. Na2O2 + H2O Æ 2 NaOH + ½ O2 1.2 Na2O2 Na2O2 entsteht beim Verbrennung von Natrium an der Luft. 2 Na + O2 Æ Na2O2 ∆H° = -505 KJ/mol Es ist bis 500°C thermisch stabil, mit oxidierbaren Substanzen (Schwefel, Kohlenstoff, Alluminiumpulver) reagiert es explosiv. Verwendung in der Industrie: Bleichen von Papier und Textilrohstoffen. Mit CO2 entwickeln alle Alkalimetallperoxide Sauerstoff. Na2O2 + CO2 Æ Na2CO3 + ½ O2 1.3 BaO2 Durch Oxidation von BaO erhält man BaO2. Ba + ½ O2 500-600°C 2 bar BaO2 ∆H° = -71 KJ/mol Bei höherer Temperatur wird O2 wieder abgegeben, bei 800°C Beträgt der Druck 1 bar. BaO2 dient als Sauerstoffüberträger bei der Entzündung von Thermitgemischen. 1.4 Wasserstoffperoxid H 147pm O O 95° 111° Diederwinkel H Durch die Verdrillung wird die Abstoßung der freien Elektronenpaare der Sauerstoffatome verringert. Die noch vorhandene Wechselwirkung Ist die Ursache für die geringe Bindungsenergie der O – O Bindung. H2O2 ist eine sehr schwache Säure (KS = 10-12). Gegenüber vielen Verbindungen Wirkt H2O2 sowohl in saurer als auch in alkalischer Lösung oxidierend. H2O2 + 2H3O+ + 2e- 4 H2O E° = +1,78V H2O2 oxidiert SO2 zu SO42-, NO2- zu NO3-, Fe II zu Fe III, Cr III zu Chromat. 1.4 Wasserstoffperoxid Gegenüber starken Oxidationsmitteln wirkt H2O2 reduzierend. H2O2 + 2H2O O20 + 2H3O+ + 2e- E° = +0,68V Dies ist gegenüber MnO4-, Cl2, Ce IV, PbO2 und O3 der Fall. Permanganat wird zur titrimetrischen Bestimmung von H2O2 benutzt. 2 MnO4- + 6 H3O+ + 5 H2O2 2 Mn2+ + 14H2O + 5O2 1.4 Wasserstoffperoxid Herstellung von H2O2: Heute wird H2O2 überwiegend nach dem Anthrachinonverfahren hergestellt O2 H2 / Pd Durch Oxidation mit Luftsauerstoff entsteht H2O2 und Anthrachinon aus Anthrahydrochinon. Früher wurde H2O2 hauptsächlich durch Elektrolyse von H2SO4 hergestellt.Dabei bildete sich Peroxodischwefelsäure die dann wieder zu H2SO4 und H2O2 hydrolysiert wird. 2.1 Grundsätzliches zu Radikalen Als Radikale bezeichnet man in der Chemie Atome oder Moleküle mit mindestens einem ungepaarten Elektron, die meist besonders reaktionsfreudig sind. Bedingt durch ihre hohe Reaktivität existieren Radikale meistens nur sehr kurze Zeit. Ausnahmen sind stabilisierte Radikale. Radikale lassen sich durch Einwirkung von UV-Licht auf Halogenmoleküle leicht erzeugen. X:X UV-Licht 2 X . 2.2 Sauerstoff Das Sauerstoff-Atom hat im Grundzustand 6 Valenzelektronen auf dem 2. Hauptenergieniveau. Die 12 Valenzelektronen eines O2 Sauerstoffmoleküls werden auf vier bindende (σs, σx, πy, und πz) aber nur drei antibindende Molekülorbitale (σs*, πy*, πz*) verteilt. Die bindenden x-, y- und z-Molekülorbitale ergeben eine Dreifachbindung. Dieses Modell entspricht eher dem Bindungsabstand von 121 pm und der Bindungsenergie von 498 kJ/mol als das Doppelbindungsmodell. Außerdem erklärt dieses Modell den radikalischen Charakter des Sauerstoffs, der durch die beiden ungepaarten Elektronen der antibindendem p-Molekülorbitale hervorgerufen wird. Sauerstoff ist demnach ein permanentes Diradikal. 2.2 Sauerstoff Die korrekte Schreibweise wäre: .O O. 2.3 Stickstoffmomoxid N O. Labortechnisch kann NO durch Reduktion von verdünnter Salpetersäure mit Kupfer gewonnen werden. Industriell wird das Gas durch die katalytische Ammoniakverbrennung (Ostwaldverfahren) gewonnen. 2.4 Hydroxylradikal Das Hydroxylradikal ist eines der häufigsten Radikale in der Atmosphäre. Es spielt eine wichtige Rolle für den Abbau von Luftverunreinigungen und kann als chemisches Waschmittel der Atmosphäre bezeichnet werden. Das Hydroxylradikal entsteht in der Atmosphäre aus Ozon, Wasser und UV-Strahlung. Es ist außerdem wichtig für die Knallgasreaktion und bei Verbrennungen. Knallgasreaktion: H2 → H + H (Kettenstart) H + O2 → OH + O O + H2 → OH + H OH + H2 → H2O + H .O H 2.5 Kettenreaktionen mit HX H2 → H + H (Kettenstart) H + X:X → HX + X X + H2 → HX + H Quellenangaben: Riedel – Anorganische Chemie 5. Auflage www.wikipedia.de Fragen?