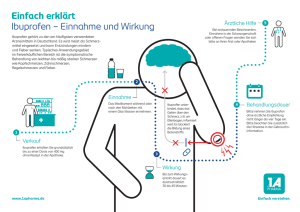
Fachinformation 1. Bezeichnung des Arzneimittels Spidifen
Werbung

Fachinformation 1. Bezeichnung des Arzneimittels Spidifen® 400 mg Filmtablette Wirkstoff: Ibuprofen 2. Qualitative und quantitative Zusammensetzung 1 Filmtablette enthält 400 mg Ibuprofen (in situ Bildung des Arginin-Salzes) Sonstige Bestandteile: 16,7 mg Sucrose 82,7 mg Natrium Die vollständige Auflistung der sonstigen Bestandteile siehe Abschnitt 6.1. 3. Darreichungsform Filmtablette Weiße kapselförmige Filmtablette mit einseitiger Bruchkerbe. Die Bruchkerbe dient nur zum Teilen der Tablette für ein erleichtertes Schlucken und nicht zum Aufteilen in gleiche Dosen. 4. Klinische Angaben 4.1 Anwendungsgebiete Spidifen® 400 mg Filmtabletten werden angewendet zur symptomatischen Behandlung von leichten bis mäßig starken Schmerzen bei • • • • 4.2 Zahnschmerzen Kopfschmerzen Fieber Primärer Dysmenorrhoe Dosierung, Art und Dauer der Anwendung Nebenwirkungen können minimiert werden, wenn die zur Symptomkontrolle erforderliche niedrigste wirksame Dosis über den kürzest möglichen Zeitraum angewendet wird (siehe Abschnitt 4.4). Seite: 1 von 12 spcde_spidifen400mg_10_2015 Erwachsene und Kinder über 12 Jahren erhalten zu Beginn der Behandlung 400 mg Ibuprofen. Wenn notwendig kann alle 4 bis 6 Stunden eine weitere Filmtablette Spidifen® 400 mg eingenommen werden. Die maximale Dosis über 24 Stunden beträgt 1200 mg. Das Produkt ist nicht für Kinder unter 12 Jahren geeignet, da eine Tablette mehr Ibuprofen enthält als für diese Pateintengruppe empfohlen wird. Art und Dauer der Anwendung: Zum Einnehmen Spidifen® 400 mg Filmtabletten werden unzerkaut mit einem Glas Wasser (200 ml) eingenommen. Spidifen® 400 mg Filmtabletten sollten nicht länger als 7 Tage oder in höherer Dosierung ohne ärztlichen Rat. eingenommen werden. Wenn die Beschwerden bestehen bleiben oder sich verschlimmern sollte der Patient angehalten werden, seinen Arzt zu konsultieren. Für Patienten, die einen empfindlichen Magen haben, empfiehlt es sich, Spidifen® 400 mg Filmtabletten während der Mahlzeiten einzunehmen. Bei Patienten mit Einschränkung der Nieren- oder Leberfunktion oder des Herzens sollte die Dosierung reduziert werden. 4..3 Gegenanzeigen Spidifen® ist kontraindiziert bei Patienten mit: - einer bekannten Überempfindlichkeit gegen den Wirkstoff Ibuprofen oder einen der sonstigen Bestandteile des Arzneimittels; bekannten Überempfindlichkeitsreaktioen (z. B. Bronchospasmus, Asthma, Rhinitis oder Urtikaria) nach der Einnahme von Acetylsalicylsäure oder anderen nicht-steroidalen Entzündungshemmern in der Vergangenheit gastrointestinalen Blutungen oder Perforation in der Anamnese im Zusammenhang mit einer vorherigen Therapie mit nicht-steroidalen Antirheumatika/Antiphlogistika (NSAR) bestehenden oder in der Vergangenheit wiederholt aufgetretenen peptischen Ulzera oder Hämorraghien (mindestens 2 unterschiedliche Episoden nachgewiesener Ulzeration oder Blutung) andere aktive Blutungen wie zerebrovaskuläre Blutungen oder Colitis ulcerosa schweren Leber- oder Niereninsuffizienz hämorrhagischer Diathese Schwangerschaft, im letzten Drittel (s. Abschnitt 4.6 Schwangerschaft und Stillzeit) schwerer Herzinsuffizienz (NYHA-Klasse IV) Seite: 2 von 12 spcde_spidifen400mg_10_2015 4.4 Besondere Warnhinweise und Vorsichtsmaßnahmen für die Anwendung Nebenwirkungen können reduziert werden, indem die niedrigste wirksame Dosis über den kürzesten, zur Symptomkontrolle erforderlichen Zeitraum angewendet wird (s. Abschnitt 4.2 und Gastrointestinale Sicherheit und cardiovaskuläre Risken weiter unten). Gastrointestinale Wirkungen • Die Anwendung von Spidifen® 400 mg Filmtabletten in Kombination mit NSAR, einschließlich selektiver Cyclooxigenase-2 Hemmer, sollte vermieden werden. • Ältere Patienten: Bei älteren Patienten kommt es unter NSAR-Therapie häufiger zu unerwünschten Wirkungen, vor allem zu gastrointestinalen Blutungen und Perforationen, auch mit letalem Ausgang (s. Abschnitt 4.2). • Gastrointestinale Blutungen, Ulzera und Perforationen: Gastrointestinale Blutungen, Ulzera oder Perforationen, auch mit letalem Ausgang, wurden unter allen NSAR berichtet. Sie traten mit oder ohne vorherige Warnsymptome bzw. schwerwiegende gastrointestinale Ereignisse in der Anamnese zu jedem Zeitpunkt der Therapie auf. Das Risiko gastrointestinaler Blutung, Ulzeration oder Perforation ist höher mit steigender NSAR-Dosis, bei Patienten mit Ulzera in der Anamnese, insbesondere mit den Komplikationen Blutung oder Perforation (s. Abschnitt 4.3), und bei älteren Patienten. Diese Patienten sollten die Behandlung mit der niedrigsten verfügbaren Dosis beginnen. Für diese Patienten sowie für Patienten, die eine begleitende Therapie mit niedrig dosierter Acetylsalicylsäure (ASS) oder anderen Arzneimitteln, die das gastrointestinale Risiko erhöhen können, benötigen (s. Abschnitt 4.5), sollte eine Kombinationstherapie mit protektiven Arzneimitteln (z. B. Misoprostol oder Protonenpumpenhemmer) in Betracht gezogen werden (s. unten und Abschnitt 4.5). • Patienten mit gastrointestinaler Erkrankungen in der Vergangenheit, insbesondere in höherem Alter, sollten jegliche ungewöhnliche Symptome im Bauchraum (vor allem gastrointestinale Blutungen) insbesondere am Anfang der Therapie melden. • Vorsicht ist angeraten, wenn die Patienten gleichzeitig Arzneimittel erhalten, die das Risiko für Ulzera oder Blutungen erhöhen können, wie z. B. orale Kortikosteroide, Antikoagulanzien wie Warfarin, selektive Serotonin-Wiederaufnahmehemmer oder Thrombozytenaggregationshemmer wie ASS (s. Abschnitt 4.5). • Wenn es bei Patienten unter Spidifen® 400 mg Filmtabletten zu gastrointestinalen Blutungen oder Ulzera kommt, ist die Behandlung abzusetzen. • NSAR sollten bei Patienten mit einer gastrointestinalen Erkrankung in der Anamnese (Colitis ulcerosa, Morbus Crohn) mit Vorsicht angewendet werden, da sich ihr Zustand verschlechtern kann (s. Abschnitt 4.8). Seite: 3 von 12 spcde_spidifen400mg_10_2015 Kardiovaskuläre und zerebrovaskuläre Wirkungen • Angemessene Beobachtung und Beratung Vorsicht ist vor Beginn einer Behandlung von Patienten mit einer Vorgeschichte an Bluthochdruck und/oder leichter bis mäßig schwerer Herzinsuffizienz geboten, da Flüssigkeitseinlagerung, Bluthochdruck und Ödeme in Verbindung mit NSAR-Therapie berichtet wurden. Klinische Studien weisen darauf hin, dass die Anwendung von Ibuprofen insbesondere in hohen Dosen (2 400 mg/Tag) möglicherweise mit einem geringfügig erhöhten Risiko arterieller thrombotischer Ereignisse (zum Beispiel Myokardinfarkt oder Schlaganfall) assoziiert ist. Insgesamt weisen epidemiologische Studien nicht darauf hin, dass Ibuprofen in niedrigen Dosen (z. B. ≤1 200 mg/Tag) mit einem erhöhten Risiko arterieller thrombotischer Ereignisse assoziiert ist. Bei Patienten mit unkontrollierter Hypertonie, Herzinsuffizienz (NYHA II-III), bestehender ischämischer Herzkrankheit, peripherer arterieller Verschlusskrankheit und/oder zerebrovaskulärer Erkrankung sollte Ibuprofen nur nach sorgfältiger Abwägung angewendet und hohe Dosen (2 400 mg/Tag) vermieden werden. Eine sorgfältige Abwägung sollte auch vor Beginn einer Langzeitbehandlung von Patienten mit Risikofaktoren für kardiovaskuläre Ereignisse (z. B. Hypertonie, Hyperlipidämie, Diabetes mellitus, Rauchen) stattfinden, insbesondere wenn hohe Dosen von Ibuprofen (2 400 mg/Tag) erforderlich sind. • Bei einer langfristigen gewohnheitsmäßigen Anwendung von Schmerzmitteln besteht das Risiko von Kopfschmerzen und einer Analgetikanephropathie. • Vorsicht ist geboten bei Patienten mit Blutgerinnungsstörungen und Leber- Herz- oder Niereninsuffizienz • Ibuprofen kann die objektiven und subjektiven Zeichen einer Infektion maskieren. In Einzelfällen ist im zeitlichen Zusammenhang mit der systemischen Anwendung von NSAR eine Verschlimmerung von Infektionen (z. B. Entwicklung einer nekrotisierenden Fasciitis) beschrieben worden. Die Anwendung von Ibuprofen bei Patienten mit Infektionen sollte daher mit Vorsicht erfolgen. • Bei Patienten mit Bronchialasthma oder allergischen Erkrankungen in der Vorgeschichte kann ein Brochospasmus provoziert werden. • Die Anwendung bei Patienten mit systemischen Lupus erythematosus oder anderen kollagenösen Erkankungen sollte mit Vorsicht erfolgen. • Die Anwendung von Ibuprofen kann möglicherweise die weibliche Fertilität beeinträchtigen, daher wird die Anwendung nicht bei Frauen empfohlen, die schwanger werden möchten. • Wenn Frauen Konzeptionsschwierigkeiten haben oder eine Untersuchung zur Abklärung einer Unfruchtbarkeit durchführen Seite: 4 von 12 spcde_spidifen400mg_10_2015 • 4.5 lassen, sollte das Absetzen von Spidifen® Filmtablettten erwogen werden. Dieses Arzneimittel enthält 16,7 mg Sucrose pro Tablette bzw. Dosis, wenn es gemäß der Dosierungsempfehlung eingenommen wird. Patienten mit der seltenen hereditären Fructose-Intoleranz, GlucoseGalactose-Malabsorption oder Saccharase-Isomaltase Mangel sollten dieses Arzneimittel nicht einnehmen. • Spidifen® 400 mg Filmtabletten enthalten 82,7 mg Natrium pro Tablette/Dosis. Dies muss bei der Anwendung bei Patienten, die eine natriumkontrollierte Diät einhalten müssen, beachtet werden. • Patienten, bei denen unter der Therapie mit Spidifen® 400 mg Filmtabletten visuelle Störungen auftreten, sollten die Therapie abbrechen und einen Augenarzt aufsuchen. • NSAR können zu einer Erhöhung der Ergebnisse der Leberfunktionsteste führen. • Unter NSAR-Therapie wurde sehr selten über schwerwiegende Hautreaktionen, einige mit letalem Ausgang, einschließlich exfoliative Dermatitis, Stevens-Johnson-Syndrom und toxische epidermale Nekrolyse, berichtet (s. Abschnitt 4.8). Das höchste Risiko für derartige Reaktionen scheint zu Beginn der Therapie zu bestehen, da diese Reaktionen in der Mehrzahl der Fälle im ersten Behandlungsmonat auftraten. Beim ersten Anzeichen von Hautausschlägen, Schleimhautläsionen oder sonstigen Anzeichen einer Überempfindlichkeitsreaktion sollten Spidifen® 400 mg Filmtabletten abgesetzt werden. Wechselwirkungen mit anderen Arzneimitteln und sonstige Wechselwirkungen • Die Wirksamkeit von Furosemd und Thiazid-Diuretika kann verringert werden, wahrscheinlich infolge einer Natriumretention durch eine Hemmung der Prostaglandinsynthese in den Nieren. • Anti-Koagulantien: NSAR’S können die Wirkung von Anti-Koagulantien, wie Warfarin erhöhen (siehe Abschnitt 4.4) • Ibuprofen kann möglicherweise die Wirkung von Antihypertensiva abschwächen. In der Folge kann die gleichzeitige Einnahme von NSAR’s und ACE-Inhibitoren oder Betablockern mit einem erhöhten Risiko für ein akutes Nierenversagen einhergehen • Der ulzerogene Effekt kann durch die gleichzeitige Gabe von Cortikosteroiden erhöht werden. • In der Literatur sind einzelne Fälle von erhöhten Plasmakonzentrationen von Digoxin, Phenytoin oder Lithium bei gleichzeitiger Gabe mit Ibuprofen beschrieben worden. • Glucocorticoide: erhöhtes Risiko für gastrointestinale Ulzera oder Blutungen (s. Abschnitt 4.4) Seite: 5 von 12 spcde_spidifen400mg_10_2015 4.6 • Acetylsalicylsäure: Die gleichzeitige Verabreichung von Ibuprofen und Acetylsalicylsäure wird im Allgemeinen aufgrund des Potenzials für vermehrte Nebenwirkungen nicht empfohlen. • Experimentelle Daten weisen darauf hin, dass Ibuprofen die Wirkung niedrig dosierter Acetylsalicylsäure auf die Thrombozytenaggregation kompetitiv hemmen kann, wenn beide gleichzeitig verabreicht werden. Obwohl Unsicherheiten in Bezug auf die Extrapolation dieser Daten auf die klinische Situation bestehen, kann die Möglichkeit, dass eine regelmäßige Langzeitanwendung von Ibuprofen die kardioprotektive Wirkung niedrig dosierter Acetylsalicylsäure reduzieren kann, nicht ausgeschlossen werden. Bei gelegentlicher Anwendung von Ibuprofen ist eine klinisch relevante Wechselwirkung nicht wahrscheinlich (siehe Abschnitt 5.1) • Ibuprofen kann die Methotrexatkonzentrationen im Plasma erhöhen. • Thrombozytenaggregationshemmer und selektive Serotonin Wiederaufnahmehemmer (SSRI): erhöhtes Risiko gastrointestinaler Blutungen (s. Abschnitt 4.4) • Die gleichzeitige Einnahme von Zidovudine und Ibuprofen kann das Risiko für für Hämarthrosen und Hämatome bei HIV-positiven Hämophilie-Patienten erhöhen. • Die gleichzeitige Verabreichung von Ibuprofen und Tacrolimus kann das Risiko für Nephrotoxizität durch eine Verringerung der renalen Prostaglandinsynthese erhöhen. • Ibuprofen kann den blutzuckersenkenden Effekt von oralen Antidiabetika und Insulin verstärken. Möglicherweise muss die Dosis angepasst werden. • Beeinflussung diagnostischer Testergebnisse: Blutungszeit (die Blutungszeit kann verlängert werden bis zu einem Tag nach Therapieende) Serumglucosekonzentrationen (können verringert sein) Creatininclearance (kann verringert sein) Hämotokrit oder Hämoglobin (kann verringert sein) BUN, Serumkreatininkonzentrationen und Serumkalium (können erhöht sein) Leberfunktionstest (Transaminasenerhöhung möglich) • Die gleichzeitige Gabe von Ibuprofen mit niedrig dosierter Acetylsalicylsäure kann die Inhibition der COX-1 und der Thrombocytenaggregationshemmung durch die niedrig dosierte Acetylsalicylsäure beeinträchtigen. Schwangerschaft und Stillzeit Die Hemmung der Prostaglandinsynthese kann die Schwangerschaft und/oder die embryo-fetale Entwicklung negativ beeinflussen. Daten aus epidemiologischen Studien weisen auf ein erhöhtes Risiko für Fehlgeburten sowie kardiale Missbildungen nach der Anwendung eines Prostaglandin-synthesehemmers in der Frühschwangerschaft hin. Es wird angenommen, dass das Risiko mit der Dosis und der Dauer der Therapie steigt. In Tierversuchen zeigte sich Reproduktionstoxizität (siehe Abschnitt 5.3).Während des ersten und zweiten Schwangerschaftstrimesters Seite: 6 von 12 spcde_spidifen400mg_10_2015 sollte Ibuprofen nur gegeben werden, wenn dies unbedingt notwendig ist. Falls Ibuprofen von einer Frau angewendet wird, die versucht schwanger zu werden oder wenn es während des ersten oder zweiten Schwangerschaftstrimesters angewendet wird, sollte die Dosis so niedrig und die Behandlungsdauer so kurz wie möglich gehalten werden. Während des dritten Schwangerschaftstrimesters können alle Prostaglandinsynthesehemmer den Fetus folgenden Risiken aussetzen: • kardiopulmonale Toxizität (mit vorzeitigem Verschluss des Ductus arteriosus und pulmonaler Hypertonie); • Nierenfunktionsstörung, die zu Nierenversagen mit Oligohydramniose fortschreiten kann; die Mutter und das Kind, am Ende der Schwangerschaft, folgenden Risiken aussetzen: • mögliche Verlängerung der Blutungszeit, ein thrombozytenaggregationshemmender Effekt, der selbst bei sehr geringen Dosen auftreten kann; • Hemmung von Uteruskontraktionen, mit der Folge eines verspäteten oder verlängerten Geburtsvorganges. Daher ist Ibuprofen während des dritten Schwangerschaftstrimesters kontraindiziert. Der Wirkstoff Ibuprofen und seine Abbauprodukte gehen nur in geringen Mengen in die Muttermilch über. Da nachteilige Folgen für den Säugling bisher nicht bekannt geworden sind, wird bei kurzfristiger Anwendung eine Unterbrechung des Stillens bei Anwendung in der empfohlenen Dosierung für leichte bis mäßige Schmerzen und Fieber in der Regel nicht erforderlich sein. 4.7 Auswirkungen auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen Müdigkeit und Schwindel sind mögliche unerwünschte Effekte , die nach der Einnahme von NSAR auftreten können, und die Fähigkeit des Patienten zur aktiven Teilnahme am Straßenverkehr und zum Bedienen von Maschinen beeinträchtigt 4.8 Nebenwirkungen Nebenwirkungen sind primär mit den pharmakologischen Eigenschaften von Ibuprofen auf die Prostaglandinsynthese verbunden. Am häufigsten wird über Dyspepsie und Durchfall berichtet. Über Ödeme, Bluthochdruck und Herzversagen ist in Verbindung mit der Einnahme von NSAR berichtet worden. Klinische Studien weisen darauf hin, dass die Anwendung von Ibuprofen insbesondere in hohen Dosen (2400 mg täglich) möglicherwiese mit einem geringfügig erhöhten Risiko arterieller thrombotischer Ereignisse (zum Beispiel Myokardinfarkt oder Schlaganfall) assoziiert ist (siehe Abschnitt 4.4). Bei der Bewertung von Nebenwirkungen werden folgende Häufigkeiten zugrunde gelegt: Sehr häufig: Seite: 7 von 12 Häufig: spcde_spidifen400mg_10_2015 ≥ 1/10 der Behandelten Gelegentlich: ≥ 1/1000 < 1/100 der Behandelten Sehr selten: < 1/10000 der Behandelten ≥1/100 < 1/10, der Behandelten Selten: ≥ 1/10000 < 1/1000 der Behandelten Unbekannt: Häufigkeit auf Grundlage der verfügbaren Daten nicht abschätzbar Organsystem Erkrankungen des Gastrointestinaltraktes Dyspepsie, Durchfall Bauchschmerzen, Übelkeit Peptische Ulcera, gastrointestinale Blutung Obstipation Appetitlosigkeit Allgemeine Erkrankungen und Beschwerden am Verabreichungsort Ödeme Herzerkrankungen Herzversagen Gefäßerkrankungen Bluthochdruck Erkrankungen des Nervensystems Kopfschmerzen, Müdigkeit Hörstörungen Erkrankungend er Haut und des Unterhautzellgewebes Hauterkrankungen, Rash Juckreiz, Urtikaria, Purpura, Angioödem Bullöse Dermatosen wie Erythema multiforme, exfoliative Dermatitis, StevenJohnson Syndrom, toxisch epidermale Nekrolyse, allergische Vaskulitis Erkrankung des Blutes und des lymphatischen Systems Thrombocytopenie, Agranulocytose, aplastische Anämie Erkrankungen der Niere und ableitenden Harnwege Hämaturie Interstitielle Nephritis, papilläre Nekrose, Nierenversagen Leber- und Galleerkrankungen Lebererkrankungen Erkrankungen des Immunsystems Allergische Reaktionen Anaphylaxie Erkrankungen der Atemorgane, des Brustraumes und des Mediastinums Asthma, Verschlechterung eines bestehenden Asthmas, Brochospasmus, Seite: 8 von 12 Nebenwirkung Sehr häufig häufig gelegentlich Selten unbekannt unbekannt unbekannt unbekannt häufig selten häufig gelegentlich Sehr selten selten selten Sehr selten selten gelegentlich selten gelegentlich spcde_spidifen400mg_10_2015 Atemnot 4.9 Überdosierung Infolge einer Überdosierung können folgende Symptome auftreten: Nausea, Magenschmerzen, Erbrechen (Blut), und Durchfall (Blut), Müdigkeit, Krämpfe, Nystagmus und Doppelsehen, Kopfschmerzen und Tinnitus. Im Fall einer schweren Intoxikation können auch noch Nierenfunktionsstörungen, Hypotension, Bewusstseinstörungen und Koma auftreten, wobei nicht klar ist, ob die Nierenfunktionsstörung durch die Intoxikation oder die Hypotension verursacht wird. Eine Magenentleerung sollte so schnell wie möglich erfolgen. Wenn möglich, sollte der Patient erbrechen. Bei Bewusstlosigkeit, sollte eine Magenspülung und eine Korrektur von Elektrolytveränderungen in Erwägung gezogen werden. 5. PHARMAKOLOGISCHE EIGENSCHAFTEN 5.1 Pharmakodynamische Eigenschaften Pharmacotherapuetische Gruppe: Antientzündliches und antirheumatisches Arzneimittel, nicht steroidal, Propionsäurederivat ATC-Code: M01AE01 Ibuprofen ist ein Phenylpropionsäurederivat. Es ist ein Prostaglandinsynthetaseinhibitor mit analgetischen, antipyretischen und antiinflammatorischen Eigenschaften. Bei Zahnschmerzen wird eine bedeutende Schmerzlinderung nach 25-30 Minuten erreicht. Experimentelle Daten weisen darauf hin, dass Ibuprofen die Wirkung niedrig dosierter Acetylsalicylsäure auf die Thrombozytenaggregation kompetitiv hemmen kann, wenn beide gleichzeitig verabreicht werden. Einige pharmakodynamische Studien zeigten, dass es bei Einnahme von Einzeldosen von 400 mg Ibuprofen innerhalb von 8 Stunden vor oder innerhalb von 30 Minuten nach der Verabreichung von Acetylsalicylsäure-Dosen mit schneller Freisetzung (81 mg) zu einer verminderten Wirkung von Acetylsalicylsäure auf die Bildung von Thromboxan oder die Thrombozytenaggregation kam. Obwohl Unsicherheiten in Bezug auf die Extrapolation dieser Daten auf die klinische Situation bestehen, kann die Möglichkeit, dass eine regelmäßige Langzeitanwendung von Ibuprofen die kardioprotektive Wirkung niedrig dosierter Acetylcysteinsäure reduzieren kann, nicht ausgeschlossen werden. Bei gelegentlicher Anwendung von Ibuprofen ist eine klinisch relevante Wechselwirkung nicht wahrscheinlich (siehe Abschnitt 4.5).. 5.2 Pharmakokinetische Eigenschaften Die pharmakokinetischen Parameter von Spidifen 400 mg können wie folgt zusammengefasst werden: Seite: 9 von 12 spcde_spidifen400mg_10_2015 Absorption: maximale Ibuprofen-Plasma-Konzentrationen von ungefähr 40µg/ml werden ca. 35 Minuten nach der Gabe von Spidifen 400 mg erreicht. Gleichzeitige Nahrungsaufnahme beeinflusst nicht das Ausmaß der Absorption, verzögert aber die Absorption um ca. 1 Stunde und führt zu niedriger Cmax (ca. 50%). Verteilung: Ibuprofen wird zu etwa 99 % an konjugierte Plasmaproteine gebunden und wird hauptsächlich im Plasma-Kompartiment verteilt. Es diffundiert langsam in die synovialen Räume und wird von dort aus langsamer ausgeschieden als aus dem Plasma. Biotransformation: Ibuprofen wird hautsächlich in der Leber durch Hydroxylierung und Carboxylierung der Isobutylgruppe metabolisiert. Die Metaboliten habe keine bekannte pharmakologische Aktivität. Elimination: Die Plasma-Halbwertszeit beträgt 1-2 Stunden. Mehr als 90 % der verabreichten Dosis können im Urin als Metabolite und ihre Konjugate wieder gefunden werden. Weniger als 1 % der Dosis wird unverändert über den Urin ausgeschieden. 5.3 Präklinische Daten zur Sicherheit Die subchronische und chronische Toxizität von Ibuprofen zeigte sich in Tierversuchen vor allem in Form von Läsionen und Ulzera im Magen-Darm-Trakt. In-vitro- und In-vivo-Untersuchungen ergaben keine klinisch relevanten Hinweise auf mutagene Wirkungen von Ibuprofen. In Studien an Ratten und Mäusen wurden keine Hinweise auf kanzerogene Effekte von Ibuprofen gefunden. Ibuprofen führte zu einer Hemmung der Ovulation beim Kaninchen sowie zu Störungen der Implantation bei verschiedenen Tierspezies (Kaninchen, Ratte, Maus). Reproduktionstoxizitätsstudien an Ratte und Kaninchen haben gezeigt, dass Ibuprofen die Plazenta passiert. Nach Gabe von maternal toxischen Dosen traten bei Nachkommen von Ratten vermehrt Missbildungen auf (Ventrikelseptumdefekte). 6. PHARMAZEUTISCHE ANGABEN 6.1 Liste der sonstigen Bestandteile Tablettenkern: Arginin Natriumhydrogencarbonat Crospovidon Magnesiumstearat (Ph. Eur.) Bestandteile des Filmüberzuges: Hypromellose Sucrose Titandioxid (E 171) Macrogol 4000 Seite: 10 von 12 spcde_spidifen400mg_10_2015 6.2 Inkompatibilitäten Nicht zutreffend. 6.3 Dauer der Haltbarkeit Die Dauer der Haltbarkeit beträgt 3 Jahre. 6.4 Besondere Vorsichtsmaßnahmen für die Aufbewahrung Keine besonderen Vorsichtsmaßnahmen für die Aufbewahrung. 6.5 Art und Inhalt des Behältnisses Spidifen 400 mg Tabletten sind in Polyethylen/Aluminium/Polyamid Blistern verpackt. Eine Faltschachtel enthält 10, 20 oder 24 Tabletten. 6.6 Besondere Vorsichtsmaßnahmen für die Beseitigung Keine besonderen Anforderungen. 7. Inhaber der Zulassung Zambon GmbH Fraunhoferstr. 18b 82152 Planegg/Martinsried Telefon: 089/2000203-54 Telefax: 089/200203-66 Seite: 11 von 12 spcde_spidifen400mg_10_2015 8. Zulassungsnummer(n) 41041.00.01 9. Datum der Erteilung der Zulassung / Verlängerung der Zulassung 05.11.2002 /30. April 2007 10. Stand der Information 10/2015 11. Verkaufsabgrenzung Apothekenpflichtig Seite: 12 von 12 spcde_spidifen400mg_10_2015