Abb_Vorlesung _7.12.2010
Werbung

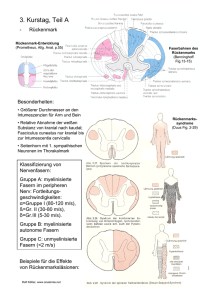
Vorlesung "Molekülphysik/Festkörperphysik" Wintersemester 2010/2011 Prof. Dr. F. Kremer Übersicht der Vorlesung am 7.12.2010 • σ- und π-Bindungen • Hybridisierung (sp, sp2, sp3) • Walsh-Diagramme • Das Benzol-Molekül 1 Fig. 1: Die Orbitale p und p´können als Linearkombination von px und py dargestellt werden, aber diese Kombinationen sind nicht orthogonal. (b) Die orthogonalen Hybride durch "zumischen" von s-Orbitalen. Fig. 2: Abhängigkeit des "s-Charakters" (a2) von dem Winkel zwischen zwei äquivalenten Hybriden gemäß Gleichung (9). Der p-Charakter ist 1-a2. Das Grundprinzip der Hybridisierung ist die Minimierung der Gesamtenergie durch Maximierung der (negativen) Bindungsenergie von Atomen im Molekül. Dies wird erreicht dadurch, dass der Überlapp der Wellenfunktion zwischen zwei Atomen optimal wird. Unterschiedliche Hybridorbitale führen dementsprechen zu unterschiedlichen geometrischen Anordnungen. Hybridtyp Anzahl Geometrie Beispiel sp 2 linear C2H2 sp2 3 eben, 120° C 2H4 2 sp3 4 Tetraeder CH4 sp2d 4 eben, quadratisch XeF4 sp3d 5 dreiseitige Doppelpyramide SF4 sp3d2 6 Oktaeder SF6 Tab. 1: Geometrische Anordnung von gerichteten Bindungen einiger Hybridorbitale Fig. 3: Walsh-Molekülorbital-Diagramm für AH2-Moleküle Walsh-Diagramme Man kann die Bindungswinkel beliebiger AH2-Moleküle (A steht für ein Atom) an Hand von sogenannten Walsh-Diagrammen überlegen (Fig. 4). 3 Fig. 4: In diesen Diagrammen ist die Abhängigkeit der Energie aller relevanten Molekülorbitale vom Bindungswinkel dargestellt. Man sieht, dass die σs- und σuOrbitale die lineare Konfiguration bevorzugen, während die Besetzung der π-Orbitale die gewinkelte Struktur favorisiert. Addiert man für ein spezielles AH2-Molekül die Energie aller besetzten Orbitale, so hat diese Gesamtenergie ein Minimum bei einem bestimmten Winkel α. Dies ist dann der Bindungswinkel im Grundzustand des Moleküls. So werden z. B. in H2O-Molekül mit Valenzelektronen die vier untersten Orbitale mit je zwei Elektronen besetzt. Die Gesamtenergie hat ein Minimum bei α = 105°. Delokalisierte π-Elektronensysteme Es gibt eine wichtige Klasse von Molekülen, die konjugierten und aromatischen Moleküle, bei denen delokalisierte Elektronen eine wichtige Rolle spielen, z. B. Butadien (Fig. 5) und Benzol (Fig. 6). Fig. 5: Das Butadienmolekül Fig. 6: Das Benzolmolekül 4 Kontrollfragen zur Vorlesung am 7.12.2010 63. Was ist eine σ-, was ist eine π-Bindung? 64. Was heißt Hybridisierung und welche physikalischen Ursachen hat sie? 65. Wie unterscheiden sich die Hybridtypen sp, sp2, sp3, sp2d,sp3d, sp3d2? 66. Welche Information enthält ein Walsh-Diagramm? 67. Wie kommen delokalisierte π-Elektronensysteme zustande? 5