Document
Werbung

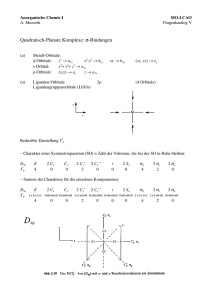
Anorganische Chemie I A. Mezzetti MO-LCAO Musterlösung VI π-Bindungen in quadratisch-planaren Komplexen (a) Schreiben Sie die reduzible Darstellung Γ für die π-Ligandengruppenorbitale auf und bestimmen Sie die darin enthaltenen irreduziblen Darstellungen. π – – Metall-Orbitale: Liganden-Orbitale ??? 2p (? Orbitale) (8 Orbitale) Ligandengruppenorbitale (LGOs) z M y x Wir haben vereinfacht angenommen, dass der Charakter einer Symmetrieoperation ist gleich der Anzahl der Vektoren, die bei der SO in Ruhe gelassen werden. Diese Vereinfachung funktioniert hier nicht: Wir müssen den Charakter für jeden Vektor ermitteln und alle Beiträge addieren, um den Gesamtcharakter für eine Klasse von Symmetrieoperationen zu berechnen. Beispiel: σh: (4 Vektoren in Ruhe → Beitrag ist +4) + (4 Vektoren um 180° rotiert→ Beitrag ist –4) = 0 Reduzible Darstellung Γ D4h Γ π E 8 2 C4 0 π C2 0 2 C2’ 2 C2’’ i –4 0 0 2 S4 0 σh 0 2 σv 0 Reduktion: N = 1 " ! rx !!ix !n x hx Γ Π 8 0 0 –4 0 0 0 0 h = Gesamtzahl der Symmetrieoperationen in der PG = 16 0 0 2 σd 0 Aus der Reduktion ergibt sich: Γπ = a2g + b2g + eg + a2u + b2u + eu Metall k.O. dxy (dxz,dyz) pz k. O. (px,py) (b) Zeichnen Sie die LGOs und die dazu passenden Metallorbitale! a2g und b2u sind strikt nichtbindend, weil das Metall keine Orbitale mit solcher Symmetrie besitzt. Das Metall-a2u-Orbital (pz) überlappt sehr schwach mit dem LGO der gleichen Symmetrie und kann als nicht bindend betrachtet werden. Dasselbe gilt für die eu-Orbitale. Somit sind nur die b2g- und egOrbitale relevant: eg b2g stärkste Überlappung M M M dxy dyz dxz eu a2u z y x überlappen weniger stark als b2g M * pz sehr schwache Überlappung M M px py Die stärkste Wechselwirkung ergibt sich für die b2g-Orbitale, weil ein Metall-Orbital mit vier LGO's überlappt (bei eg ein Metall-Orbital mit zwei LGO's). Demzufolge sind die Effekte auf die Energie der b2g-Orbitale am grössten (siehe unten). (c) Für die π-Bindungen sind im Prinzip zwei Fälle möglich: – π-Donoren: Die π-Orbitale der 4 Liganden L sind energetisch tief liegende, besetzte π-Orbitale. – π-Akzeptoren: Die π-Orbitale der 4 Liganden L sind energetisch hoch liegende, leere π*Orbitale. Zeichnen Sie die passenden Orbitalenergieschemata der Komplexe A und B (mit Angabe der Elektronen)! Wir müssen jetzt zwei Fälle unterscheiden (bitte wenden: 1) Die 4 Liganden L besitzen energetisch tief liegende, besetzte π-Orbitale, sind also π-Donoren: 2b1g* " " 1b2g* ! 2a1g " 1eg* ! b2g eg b1g eu a1g besetzt eg (!) b2g (!) 1eg besetzt 1b2g M ML4 L4 Die π-Bindung ist dativ: Die Elektronen werden von den Liganden zum Metall transferiert. Deshalb destabilisiert sie die Metallorbitale, vor allem das d(xy)-Orbital (b2g) (beste Überlappung, siehe oben), welches π-antibindenden Charakter bekommt. Somit übersteigt seine Energie die vom schwach σ-antibindenden d(z2)-Orbital (2a1g). Für die d8-Konfiguration heisst es, dass d(xy) das HOMO des Komplexes ist. N.B.: π-Donoren destabilisieren die d-Orbitale des Metalls mit π-Symmetrie (d ). In der Regel besitzen planar quadratische Komplexe die d8-Elektronenkonfiguration und die d -Orbitale des Metalls sind vollständig besetzt. Deshalb ist zu erwarten, dass planar quadratische d8Komplexe mit starken π-Donoren nicht besonders stabil sind! π π 2) 4 Liganden L mit energetisch hoch liegenden, unbesetzten π-Orbitalen (π-Akzeptoren): 1b2g* 1eg* b2g (!) eg (!) unbesetzt 2b1g* " 2a1g " " eg b2g 1eg ! 1b2g ! b1g eu a1g M ML4 besetzt L4 Die π-Bindung ist hier eine M→L-Rückbindung. Die Elektronen werden Metall zu unbesetzten Ligandenorbitalen transferiert. Deshalb stabilisiert die π-Bindung die Metallorbitale, vor allem das d(xy)-Orbital (b2g), welches π-bindenden Charakter hat. Somit ist seine Energie niedriger als die vom schwach σ-antibindenden d(z2)-Orbital (2a1g). In der d8-Konfiguration ist nun das d(z2)-Orbital das HOMO des Komplexes. Da es sterisch unbehindert ist (es liegt mehrheitlich ausserhalb der xyEbene), ist d(z2) für einen nukleophilen Angriff bestens geeignet (oxidative Addition, siehe Anorg. Chem. 3)! N.B.: π-Akzeptoren stabilisieren die vollständig besetzten d-Orbitale des Metalls mit π-Symmetrie (d ). Planar quadratische d8-Komplexe mit starken π-Akzeptoren sind besonders stabil und trotzdem reaktiv als Nukleophile, weil die π-Rückbindung die Elektronendichte des HOMO nicht senkt (siehe oben)! π (d) Vergleichen Sie die Orbitalenergieschemata der Komplexe A und B mit den Voraussagen der Kristallfeld-Theorie für einen planar quadratischen Komplex. Was fällt Ihnen auf? Aus dem AC1-Skript (S. 100): Tetragonale Symmetrie und planar-quadratische Komplexe in KFT: oktaedrisch tetragonal planar-quadratisch Das KFT-Energieschema (siehe oben) entspricht dem der π-Donoren, in dem die Energie des d(z2)Orbitals unterhalb der Energie des d(xy)-Orbitals liegt. Das MO-LCAO-Schema zeigt, dasss dies nur für π-Donoren gilt. Hingegen stabilisieren π-Akzeptoren alle Orbitale mit π-Symmetrie. Daher ist das d(z2)-Orbital das HOMO. Diese Tatsache hat wichtige Konsequenzen auf die Reaktivität dieser Komplexe!





![ÜBERGANGSMETALLKOMPLEXE Na2[Fe(CN)5NO] ⋅ 2H2O](http://s1.studylibde.com/store/data/002682926_1-4994fab9e6ff9a7ce3deb92323ee5953-300x300.png)