uebungsblatt 5_Lsg
Werbung
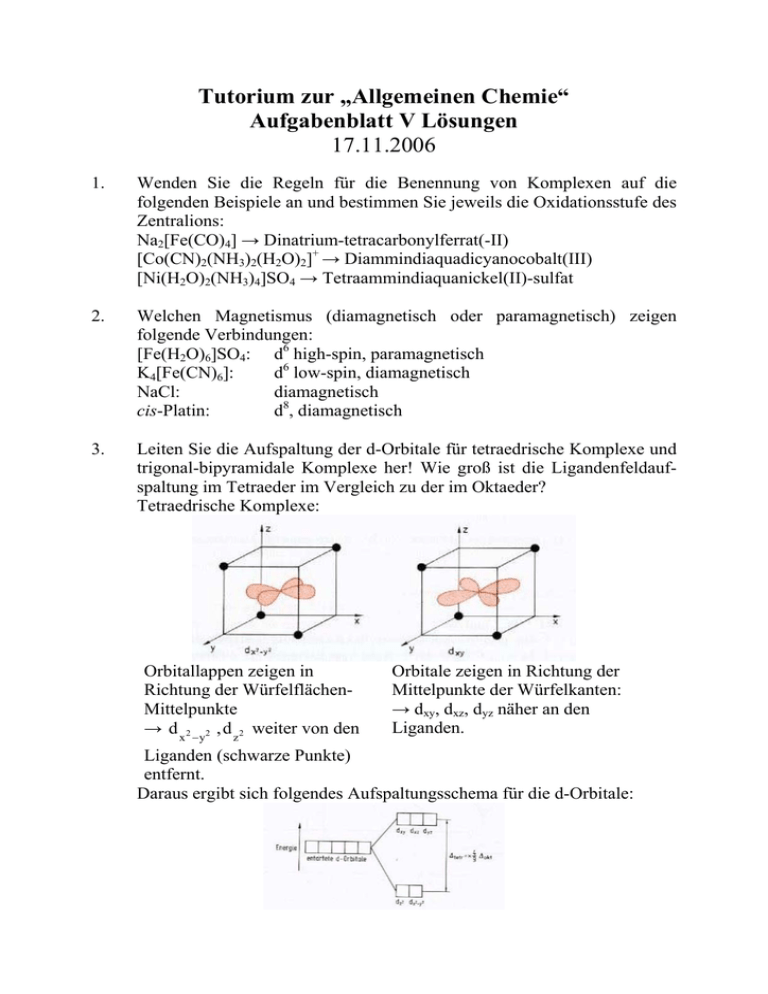
Tutorium zur „Allgemeinen Chemie“ Aufgabenblatt V Lösungen 17.11.2006 1. Wenden Sie die Regeln für die Benennung von Komplexen auf die folgenden Beispiele an und bestimmen Sie jeweils die Oxidationsstufe des Zentralions: Na2[Fe(CO)4] → Dinatrium-tetracarbonylferrat(-II) [Co(CN)2(NH3)2(H2O)2]+ → Diammindiaquadicyanocobalt(III) [Ni(H2O)2(NH3)4]SO4 → Tetraammindiaquanickel(II)-sulfat 2. Welchen Magnetismus (diamagnetisch oder paramagnetisch) zeigen folgende Verbindungen: [Fe(H2O)6]SO4: d6 high-spin, paramagnetisch K4[Fe(CN)6]: d6 low-spin, diamagnetisch NaCl: diamagnetisch cis-Platin: d8, diamagnetisch 3. Leiten Sie die Aufspaltung der d-Orbitale für tetraedrische Komplexe und trigonal-bipyramidale Komplexe her! Wie groß ist die Ligandenfeldaufspaltung im Tetraeder im Vergleich zu der im Oktaeder? Tetraedrische Komplexe: Orbitallappen zeigen in Richtung der WürfelflächenMittelpunkte → d x 2 − y2 , d z 2 weiter von den Orbitale zeigen in Richtung der Mittelpunkte der Würfelkanten: → dxy, dxz, dyz näher an den Liganden. Liganden (schwarze Punkte) entfernt. Daraus ergibt sich folgendes Aufspaltungsschema für die d-Orbitale: Trigonal-bipyramidale Komplexe: Aufspaltung der d-Orbitale in 3 Niveaus: Die direkte Orientierung des d z 2 -Orbitals in Richtung der axialen Liganden bewirkt dessen starke Destabilisierung, während die entarteten dxz, dyz-Orbitale am schwächsten mit den „Punktladungen“ (Liganden) wechselwirken und daher stabilisiert werden. Die beiden Orbitale in der äquatorialen Ebene, dxy und d x 2 − y 2 werden schwach destabilisiert. d z2 d x 2 − y2 , dxy dxz, dyz 4a. Erläutern Sie den Begriff „Chelat-Effekt“. Warum sind Chelatkomplexe allgemein sehr stabil? Höhere thermodynamische Stabilität von Komplexen mit mehrzähnigen Liganden im Vergleich zu entsprechenden Komplexen mit einzähnigen Liganden. Grund: positive Reaktionsentropie: Erhöhung der Teilchenzahl: L L) +6L → M( L M(L)6 + 3 L 3 Häufig auch energetisch günstiger. 4b. Geben Sie Beispiele für Chelat-Liganden (min. zwei)! Ethylendiamin, EDTA Vgl. Lehrbuch 5. Rubin ist ein Mineral, das im Wesentlichen aus Al2O3 (Korund) besteht. Seine rote Farbe erhält Rubin durch den Einbau von Cr(III) in manche der Oktaederlücken. Smaragd ist ein Mineral, das im Wesentlichen aus einem Beryllium-Aluminium-Silikat besteht, in das an wenigen Stellen Cr(III) anstelle Al(III) eingebaut ist. Die grüne Farbe von Smaragd kommt durch die Cr(III) Ionen zustande. Warum kann ein und dasselbe Übergangsmetall-Ion, das in beiden Verbindungen jeweils durch Sauerstoff-Funktionen koordiniert ist, so verschiedene Farben verursachen? Die grüne Farbe des Smaragds kommt durch die Absorption von rotem Licht (Komplementärfarbe zu grün) zustande. Die rote Farbe des Rubins durch Absorption von blauem Licht. Blaues Licht hat eine höhere Energie als rotes Licht. Folglich ist die Ligandenfeldaufspaltung im Smaragd kleiner als im Rubin. 6. Zeichnen Sie die Strukturen von: XeF2, SF6, SF4, [XeF5]–, ClF3 F F Xe F F F F , F F F F F S S F F F , F , F Cl Xe F F ; F F





![Präparat: K33[Cr(SCN)66]](http://s1.studylibde.com/store/data/002578957_1-9c877bc8bca57be33671e7c29a6a4f80-300x300.png)
![ÜBERGANGSMETALLKOMPLEXE Na2[Fe(CN)5NO] ⋅ 2H2O](http://s1.studylibde.com/store/data/002682926_1-4994fab9e6ff9a7ce3deb92323ee5953-300x300.png)