Ligandenfeldtheorie (oktaedrische Komplexe)
Werbung

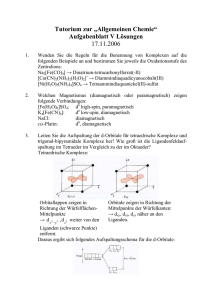
Ligandenfeldtheorie (oktaedrische Komplexe) Die Ligandenfeldtheorie beschreibt die Wechselwirkung der d-Elektronen des Zentralatoms mit den Liganden. Mit ihr kann man das magnetische Verhalten und die Absorptionsspektren (Farbe) der Komplexe einiger Übergangsmetalle erklären. Ein Übergangsmetallion (z.B. Fe2+ oder Ni2+) hat 5 d-Orbitale. Bei einem isolierten Ion haben diese die gleiche Energie, sie sind entartet. Ein Komplex besteht aus dem Koordinationszentrum (Zentralion oder -atom) und der Ligandenhülle (Ligand: Ionen oder Moleküle). In einem oktaedrischen Komplex ist das Zentralion von 6 Liganden umgeben, welche auf den Koordinatenachsen liegen (x,y,z). Die Liganden nähern sich also verstärkt den d(z2) und den d(x2y2) Orbitalen. Diese Orbitale werden dadurch energetisch angehoben, also ungünstiger. Die d(xy), d(xz) und d(yz) Orbitale werden dagegen energetisch abgesenkt so dass die Energie des Systems insgesamt konstant bleibt. Die Aufspaltungsenergie wird mit „∆“ bezeichnet. Aus der Aufspaltung der d-Orbitale ergeben sich für Übergangsmetallionen mit 4, 5, 6 oder 7 dElektronen jeweils zwei mögliche Elektronenzustände. high-spin-Zustand: das Zentralion besitzt entsprechend der Hundschen Regel die größtmögliche Zahl ungepaarter d-Elektronen. low-spin-Zustand: das Zentralion besitzt die kleinstmögliche Zahl ungepaarter d-Elektronen. Entscheidend dafür welcher Zustand gebildet wird ist die Frage ob es für ein Elektron günstiger ist das energetisch höhere dz2 bzw. dx2-y2-Orbital zu besetzen oder die Spinpaarungsenergie Espin aufzubringen. Wenn ∆>Espin ist, entsteht ein low-spin-Komplex, wenn ∆<Espin ist entsteht ein highspin-Komplex. Die spektrochemische Reihe gibt die Fähigkeit der Liganden an, d-Orbitale aufzuspalten. I- < Cl- < F- < OH- < H2O < NH3 > CN-, CO schwache Liganden schwache Aufspaltung starke Liganden starke Aufspaltung Liganden mit schwacher Aufspaltung bilden high-spin-Komplexe, Liganden mit starker Aufspaltung low-spin-Komplexe. Magnetisches Verhalten: Ionen können diamagnetisch (Stoff wird vom Magnetfeld abgestoßen; Teilchen besitzen keine ungepaarten Elektronen) oder paramagnetisch (Stoff wird in das Magnetfeld hineingezogen; Teilchen besitzen ungepaarte Elektronen) sein. Man kann folglich mittels magnetischer Messungen feststellen, ob es sich um einen high-spin- oder einen low-spin-Komplex handelt. Es werden dann magnetische Momente gemessen, die bestimmten Anzahlen ungepaarter Elektronen entsprechen. Absorptionsspektren: Ionen der Übergangsmetalle mit unvollständig aufgefüllten d-Niveaus sind in wässriger Lösung farbig. Dies kommt dadurch zustande, dass ein Elektron im Ligandenfeld durch Lichtabsorption angeregt wird und aus dem niedrigeren in den höheren Energiezustand übergeht. Dazu wird die Energie benötigt, die ∆ entspricht. Diese Energie entspricht einer bestimmten Wellenlänge, welche aus dem „normalen“ Licht absorbiert wird. Der entstehende Farbeindruck entspricht der Komplementärfarbe. Quellen: Riedel: Anorganische Chemie http://www.ddesignmedia.de/Komplex_Chemie/HTML/GMS/Ligandenfeldtheorie/Ligthe.htm http://de.wikipedia.org/wiki/Ligandenfeldtheorie Fragen 1.) Geben Sie die Besetzung der d-Orbitale im oktaedrischen Ligandenfeld von Cu2+ an (d9). Gibt es für dieses Ion high- und low-spin-Komplexe? 2.) Welchen Elektronenzustand (high- oder low-spin) hat der Komplex [Mn(CN)6]3-? Geben Sie die Besetzung der d-Orbitale von high- und low-spin-Mn(III)-Komplexen in der Kästchenschreibweise an!










![Präparat: K33[Cr(SCN)66]](http://s1.studylibde.com/store/data/002578957_1-9c877bc8bca57be33671e7c29a6a4f80-300x300.png)