1 Anorganische Chemie I Fragenkatalog V A. Mezzetti 1
Werbung

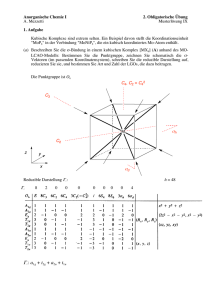
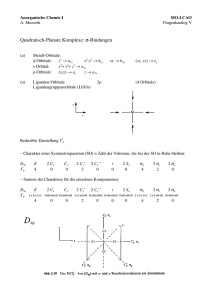
Anorganische Chemie I A. Mezzetti Fragenkatalog V 1. Obligatorische Übung Aufgabe 1 Der farblose, diamagnetische Komplex trans-[Co(CO)3(PPh3)2]+ (A) ist trigonal bipyramidal. (a) Bestimmen Sie Oxidationszahl, Elektronenkonfiguration, VE-Zahl und Punktgruppe von A! (b) Entwickeln Sie ein KFT-Aufspaltungsmuster für A. Dabei sollen Sie zuerst anhand der Symmetrie feststellen, in wie viele Sätze die d-Orbitale aufspalten, die Wechselwirkungen zwischen den Liganden und dem Metall skizzieren, das Energieschema zeichnen, und die Elektronen einfüllen. Hinweis: Verwenden Sie die oktaedrische Struktur (Oh-Punktgruppe) als Ausgangspunkt und passen Sie sie an! (a) [Co(CO)3(PPh3)2]+ d8 Co(I) 18 VE D3h (b) Die D3h-Charaktertafel zeigt, dass die d-Orbitale in drei Sätze aufspalten: a1', e' und e" (in der D3h-Punkgruppe nimmt man die Richtung der C3-Achse als z-Achse): Die M–L-Wechselwirkungen bestimmen die Reihenfolge der Energie der a1'-, e'- und e"-Sätze. Mit einem oktaedrischen Komplex (Oh-Punktgruppe) als Ausgangspunkt erhält man: Oh z L x M L –L L L y D3h L L L M L L L L Die Entferung eines Liganden in der xy-Ebene entlastet das x2–y2-Orbital wesentlich. Der Effekt wird durch die Drehung von zwei Liganden weg von der y-Achste verstärkt, wobei das xyOrbital destabilisiert wird: xy x L y x2–y2 L L 120 ° L L L 120 ° Aus der Skizze kann man schätzen, dass die Destabilisiert des xy-Orbitals durch Liganden weniger als die Hälfte ist als die Destabilisierung im oktaedrischen Komplex. Erklärung: In A werden nur zwei von vier Lappen des xy-Orbitals beansprucht (der dritte Ligand liegt auf einer Knotenebene) und die entsprechenden Liganden befinden sich nicht auf der Achse des Orbitals, wo die Elektronendichte am grössten ist. Im Gegensatz sind in einem oktaedrischen Komplex vier Liganden direkt zum x2–y2-Orbital gerichtet. 1 Somit ist die Stabilisierung des x2–y2-Orbitals grösser als die Destabilisierung des xy-Orbitals. Demzufolge liegt die Energie des entarteten e'-Satzes (xy und x2–y2) eher tief. Da die Änderungen für z2- und (xz,yz) (e'') vergleichsmässig klein sind, kann man folgendes Energieschema entwerfen: für d8: D3h Oh a1' a1' e' e' e'' e'' (c) Die trigonale bipyramidale (TBP) Struktur eignet sich besonders gut für d8-Komplexe. Wieso? D4h D3h Oh x2–y2 (b1g) a1' eg xy (b2g) z2 (a1g) e' t2g e'' (xz, yz) (eg) Das erarbeitete Energieschema zeigt, dass in der trigonalen bipyramidalen Struktur 4 Orbitale energetisch relativ tief liegen. Diese bieten Platz für die acht Elektronen der d8-Elektronen konfiguration ohne grossen Energieverlust. In der oktaedrischen Geometrie wären die eg-Orbitale besetzt. Die andere Struktur, die sich gut für d8-Komplexe eignet, ist die planar quadratische. Wie in der Vorlesung diskutiert, hebt die Dissoziation der Liganden entlang der z-Achse die Entartung der eg-Orbitale auf und senkt die Energie des z2-Orbitals. Der Gesamteffekt auf die Energie der orbitale ist vergleichbar. Aufgabe 2 Betrachten Sie den Komplex trans-[CrF2(en)2]+ (B). (a) Bestimmen Sie Oxidationszahl, Elektronenkonfiguration, VE-Zahl und Punktgruppe von B. trans-[CrF2(en)2]+ Cr(III) d3 15 VE D4h (ohne Chelatringe) 2 (b) In der Beschreibung der σ-Bindung in B (en = Ethylendiamin) anhand des MO-LCAO-Modells werden die F- und N-Donoren getrennt behandelt, weil sie nicht äquivalent sind (es gibt keine Symmetrieoperation, die die axialen und äquatorialen Donoren in einander überführt). Die reduziblen Darstellungen für die N4- und F2-LGOs lauten: N4 F2 z M y M x Reduzible Darstellung Γ für die N4- und F2-Donoren: σ Γ (N4) 4 Γ (F2) 2 0 2 σ σ 0 2 2 0 0 0 0 0 0 0 Γ (N)4: a1g + b1g + eu 4 0 2 2 0 2 Γ (F)2: a1g + a2u σ σ Die LGOs sind (Die Position des Metalls ist mit "M" angedeutet): N4 F2 M M M M M M a1g a2u z x eu b1g a1g y Die σ-antibindenden Orbitale (σ*) sind: F2 M N4 M M M M z x z y x 3a1g x y 2b1g x y 4a1g y M 2eu a2u 3 (b) Stellen Sie das Energieniveauschema auf (mit Elektronen)! (2 Punkte) 2eu 2a2u 4a1g (s) p eu a2u s a1g d b1g a1g b2g eg 2b1g 3a1g (z2) b2g eg vollständig besetzt (12 e–) b1g eu a1g N4 a2u a1g F2 1b1g 1eu 1a2u 2a1g 1a1g Qualitativ unterscheidet sich das Energieschema wenig von der Situation in der Oh-Symmetrie. Die xy-, xz- und yz-Orbitale sind in beiden Fällen σ-nichtbindend. Die 3a1g- und 2b1g-Orbitale, die hauptsächlich x2–y2- bzw. z2-Charakter besitzen, sind σ-antibindend (σ*). Vereinfachend betrachten wir diese als Metallorbitale, obwohl sie eine (antibindende) Linearkombination zwischen Metall- und Ligandenorbitalen sind. Für die Bestimmung der relativen Energien der x2–y2- und z2-Orbitale ist die Betrachtung der Feldstärke der Liganden hilfreich. Der Fluoroligand liegt tiefer in der spektroskopischen Reihe als en. Somit ist die Ligandenfeldaufspaltung für F– kleiner ist als für en. Da die Ligandenfeldaufspaltung der Energiedifferenz zwischen t2g- und eg-Orbitalen (oder analogen) entspricht, darf man davon ausgehen, dass das die Energie des 3a1g-Orbitals (hauptsächlich durch z2 beschrieben) in B niedriger ist, als die vom x2–y2-Orbital. Diese kleine Energiedifferenz spielt aber keine Rolle, auch weil das Metallion nur drei Elektronen besitzt. (c) Das magnetische Moment von B wird durch die Anzahl der ungepaarten Elektronen bestimmt. Davon gibt es drei. Aus der Spin-only-Formel: µ = 2 S(S +1) = n ( n + 2 ) = 3 (3+ 2 ) = 15 = 3.87 BM 4




![ÜBERGANGSMETALLKOMPLEXE Na2[Fe(CN)5NO] ⋅ 2H2O](http://s1.studylibde.com/store/data/002682926_1-4994fab9e6ff9a7ce3deb92323ee5953-300x300.png)



