Anorganische Chemie I 2. Obligatorische Übung A. Mezzetti
Werbung

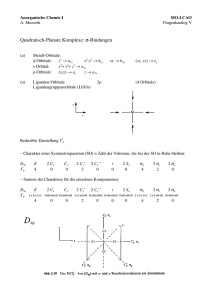
Anorganische Chemie I A. Mezzetti 2. Obligatorische Übung Musterlösung IX 1. Aufgabe Kubische Komplexe sind extrem selten. Ein Beispiel davon stellt die Koordinationseinheit "MoP8" in der Verbindung "MoNiP8", die ein kubisch koordiniertes Mo-Atom enthält. (a) Beschreiben Sie die σ-Bindung in einem kubischen Komplex [MX8] (A) anhand des MOLCAO-Modells: Bestimmen Sie die Punktgruppe, zeichnen Sie schematisch die σVektoren (im passenden Koordinatensystem), schreiben Sie die reduzible Darstellung auf, reduzieren Sie sie, und bestimmen Sie Art und Zahl der LGOs, die dazu beitragen. Die Punktgruppe ist Oh C4, C2 = C42 C3 M !h C2 z y x !d Reduzible Darstellung Γ : h = 48 σ 8 Γ σ 2 0 0 Γ : a1g + t2g + a2u + t1u σ 0 0 0 0 0 4 (b) Zeichnen Sie die LGOs, die zur M–X-Bindung beitragen. s M dxz a1g M s t2g M z t1u y x (c) Energieniveauschema t1u* p t1u s a1g a1g* t2g* (xy, xz, yz) d t2g eg (nicht bindend) eg (x2–y2, z2) a2u (nicht bindend) vollständig besetzt (16 e–) a2u t2g t1u a1g t2g t1u a1g Welche Elektronenkonfigurationen würden sich am besten für die kubische Koordination eignen? Es gibt nur 2 nichtbindende Orbitale (eg), die ohne Destabilisierung besetzt werden können. Somit sind die d1-, d2-, low-spind d3- und low-spin d4-Konfigurationen günstig. Die Bedingungen für die Elektronenpaarung sind ähnlich wie in oktaedrischen Komplexen, weil die Ligandenfeldaufspaltung im kubischen Feld ähnlich ist wie die im Oktaederfeld (siehe Skript): ! w 8 = ! 9 o (d) Welche Reihenfolge der Energien der d-Orbitale würde eine KFT-Analyse ergeben? Die KFT-Analyse gibt genau die gleiche Reihenfolge der Energie der d-Orbitale. Die Wechselwirkung der t2g-Orbitale mit den Liganden ist grösser als die der eg-Orbitale. Qualitativ ist die Situation ähnlich wie in tetraedrischen komplexen, allerdings ist die Ligandenfeldaufspaltung (be gleichen Liganden) doppelt so gross, weil es 8 anstatt 4 Liganden gibt. (e) Die Analyse der LGOs sollte mögliche Gründe für die Seltenheit der kubischen Koordination ergeben. Welche? Man kann mindestens zwei Gründe nennen: – Wie in tetraedrischen Komplexen ist die Überlappung der Liganden- und Metallorbitale (ausser fürs s-Metallorbital) schlecht, weil die Ligandorbitale nicht direkt zu den Metallorbitalen gerichtet sind. – Von den 8 LGOs, nur 7 können mit Metallorbitalen überlappen. Das LGO mit a2u-Symmetrie hat keinen passenden Partner am Metall. Somit ist die σ-Bindungsordnung kleiner als 1 (7 Elektronenpaare sind auf 8 M–L-Bindungen verteilt). Eine solche Situation haben wir noch nie angeftroffen. 2. Aufgabe Sowohl FeF2 als auch K3[CoF6] enthalten sechsfach koordinierte high-spin-Metallionen. Das Elektronenspektrum von FeF2 zeigt Absorptionen bei 6 990 und 10 660 cm–1, während K3[CoF6] Absorptionen bei 10 200 und 14 500 aufweist. Gemäss Text besitzen beide Verbindungen die high-spin-d6-Konfiguration. Somit erwartet man eine einzige Bande für den 5T2g → 5EgÜbergang. Dessen ungeachtet, ist es ersichtlich, dass der Co(III)-Komplex die energiereicheren Absorptionen hat. Beide Komplexe enthalten sechs Fluoroliganden in einer oktaedrischen Umbegung. (Obwohl die oktaedrische Symmetrie in der Aufgabetext nicht ausdrücklich erwähnt wurde, ist es naheliegend, dass die Fe(II) ionen Oktaederlücken besetzen.) Somit kann man schliessen, dass der Co(III)Komplex den grösseren Wert von Δo aufweist. Da beide Komplexe den gleichen Ligandensatz besitzen, ist die Differenz in der Ligandenfeldaufspaltung dem Metall zurückzuführen. Aufgrund der höheren Oxidationszahl erwartet man für den Co(III)-Komplex ein grösseres Δo als für Fe(II). Somit ist Frage a beantwortet. (b) Erklärung der Aufspaltung: Beide am Übergang beteiligten Zustände sind JahnTeller instabil. Für den angeregten Zustand (5Eg) erwartet man einen wesentlichen JahnTeller-Effekt im oktaedrischen Ligandenfeld.