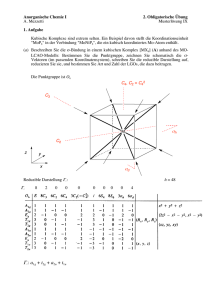
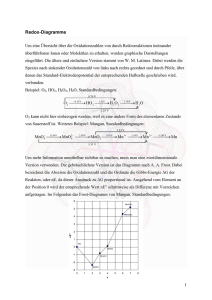
t2g
Werbung

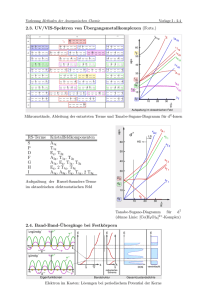
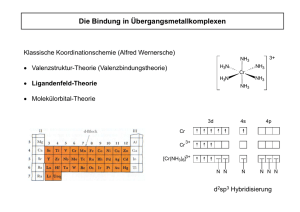
Anorganische Chemie I A. Mezzetti 1. Elektronenspektren Fragenkatalog X Kn[VF6] (n muss bestimmt werden) (B) hat µeff = 2.66 BM. Sein UV-VIS-Spektrum enthält eine sehr schwache Bande (10'000 cm–1) und drei starke Banden (17'000, 27'000, 35'000 cm–1). Eine vierte Bande (45'000 cm–1) wird einem Laporte-erlaubten Übergang zugeordnet. (a) Bestimmen Sie Oxidationszustand und Elektronenkonfiguration von Vanadium! (b) Ordnen Sie die d-d-Banden zu den jeweiligen elektronischen Übergängen zu. Dazu verwenden Sie das passende Tanabe-Sugano-Diagramm. Wieso ist die Bande bei 10'000 cm–1 besonders schwach? (c) Was ist der Laporte-erlaubte Übergang? Skizzieren Sie ihn anhand eines vereinfachten MOLCAO-Diagramms! (d) Das freie, gasförmige Vanadiumion hat ein Racah-Parameter B von 812 cm–1. Aus dem UV-VISSpektrum wurde ein Wert B = 712 cm–1 ermittelt. Berechnen Sie das nephelauxetische Verhältnis und diskutieren Sie den Charakter der V–F-Bindung! (e) Erwarten Sie eine strukturelle Verzerrung der Koordinationssphäre von B? Begründen Sie Ihre Antwort! 2. CO ist ein stärker π-Akzeptor als CN– und Chrom befindet sich im Periodensystem links von Eisen. Deshalb werden die Charge-Transfer-Banden im [Cr(CO)6] als MLCT gedeutet, die von [Fe(CN)6]n-Komplexen (n = –3 oder –4) hingegen als LMCT. Erklären Sie wieso anhand eines qualitativen MO-LCAO-Diagramms! 3. Die Reaktion von [Cr(OH2)6]Clx (x muss bestimmt werden) mit NH3 (g) in EtOH-Lösung gibt [Cr(NH3)6]Clx (B). Der isolierte Komplex B hat µeff = 4.85 BM und ist nur unter einer NH3 (g)Atmosphäre stabil. Sein UV-Vis-Spektrum enthält eine sehr breite, starke Bande (16'000 cm–1) und eine schwächere Bande bei 8'500 cm–1. (a) Bestimmen Sie Oxidationszustand und Elektronenkonfiguration von Chrom und erklären Sie die magnetischen Eigenschaften und das UV-Vis-Spektrum von B anhand eines KFT-Energiediagramms! (b) Wieso ist B nur unter NH3 (g) stabil? Nennen Sie die thermodynamischen und kinetischen Faktoren, die dazu beitragen! (c) Das Elektronenspektrum von B kann dadurch erklärt werden, dass der Grundzustand ausserordentlich stark verzerrt ist, der angeregte Zustand aber sehr schwach. Erklären Sie Art, Grund, Ausmass und Effekt dieser Verzerrungen auf das Spektrum! Dazu sollen Sie die passende Charaktertafel verwenden (siehe Rückseite). Tanabe-Sugano-Diagramme: Bitte wenden! Anorganische Chemie I A. Mezzetti 1. Elektronenespektren Fragenkatalog X Kn[VF6] (n muss bestimmt werden) (B) hat µeff = 2.66 BM. Sein UV-VIS-Spektrum enthält eine sehr schwache Bande (10'000 cm–1) und drei starke Banden (17'000, 27'000, 35'000 cm–1). Eine vierte Bande (45'000 cm–1) wird einem Laporte-erlaubten Übergang zugeordnet. (a) Bestimmen Sie Oxidationszustand und Elektronenkonfiguration von Vanadium! L. µeff = 2.66 BM → 2 ungepaarte Elektronen → V(III), d2 → K3[VF6] (l.s. d4 würde ebenfalls 2 ungepaarte Elektronen enthalten, low-spin V(I) mit sechs negativen Liganden macht chemisch keinen Sinn. Um einen niedrigen OZ zu stabilisieren braucht man πAkzeptor-Liganden, was F– nicht ist). (b) Ordnen Sie die d-d-Banden zu den jeweiligen elektronischen Übergängen zu. Dazu verwenden Sie das passende Tanabe-Sugano-Diagramm. Wieso ist die Bande bei 10'000 cm–1 besonders schwach? a) b) c) d) e) 10'000 cm–1 17'000 cm–1 27'000 cm–1 35'000 cm–1 45'000 cm–1 sehr schwach "stark" "stark" "stark" sehr stark → → → → → Laporte verboten, spin verboten Laporte verboten, spin erlaubt Laporte verboten, spin erlaubt Laporte verboten, spin erlaubt Laporte erlaubt → 3T1g → 1Eg / 1T2g → 3T1g → 3T2g → 3T1g → 3T1g → 3T1g → 3A2g → LM-charge transfer (c) Was ist der Laporte-erlaubte Übergang? Skizzieren Sie ihn anhand eines vereinfachten MOLCAO-Diagramms! Energieschema [VF6]3– 3– F F F V F F F F6 (nur π) eg t2g2 Oh A pπ(F) besetzt (t1g , t1u , t2u) (d) Das freie, gasförmige Vanadiumion hat ein Racah-Parameter B von 812 cm–1. Aus dem UV-VISSpektrum wurde ein Wert B = 712 cm–1 ermittelt. Berechnen Sie das nephelauxetische Verhältnis und diskutieren Sie den Charakter der V–F-Bindung! Nephelauxetisches Verhältnis ! = B' 712 cm !1 = = 0.88 B 812 cm !1 Mit β = 0.88 ist die V–F-Bindung ist weitgehend ionisch! (e) Erwarten Sie eine strukturelle Verzerrung der Koordinationssphäre von B? Begründen Sie Ihre Antwort! Die d2-Elektronenkonfiguration ist Jahn-Teller instabil, aber die Entartung betrifft die t2gOrbitale, die σ-nichtbindend sind. Demzufolge ist nur eine kleine Verzerrung zu erwarten. Die Erfahrung zeigt, dass nur h.s. d4 - und d9-Komplexe strukturelle Verzerrungen aufweisen, die einfach messbar sind. 2. CO ist ein stärker π-Akzeptor als CN– und Chrom befindet sich im Periodensystem links von Eisen. Deshalb werden die Charge-Transfer-Banden im [Cr(CO)6] als MLCT gedeutet, die von [Fe(CN)6]n-Komplexen (n = –3 oder –4) hingegen als LMCT. Erklären Sie wieso anhand eines qualitativen MO-LCAO-Diagramms! L. Die Charge-Transfer-Banden von [Fe(CN)6]n– wurden als LMCT zugeordnet: [Fe(CN)6]3– low-spin d5 t 25g Übergänge: π → t 25g (A), t 25g → π* (B) [Fe(CN)6]4– low-spin d6 t 26g Übergänge: t 26g → π* (B) CO OC OC Cr 4– / 3– CN CO CO NC NC Fe CO CN Oh Oh [Cr(CO)6] CO (nur π) [Fe(CN)6]4– / 3– t2g, π*(CN) t2g, π*(CO) t1g , t1u , t2g , t2u t1g , t1u , t2u eg CN CN CN (nur π) t1g , t1u , t2g , t2u t1g , t1u , t2u π*(CN) unbesetzt π*(CO) unbesetzt eg C t2g6 B t2g5 or 6 t1g , t1u , t2u (CO, besetzt) t2g (CO) besetzt t1g , t1u , t2g , t2u π(CO) besetzt t1g , t1u , t2u (CN, besetzt) t2g (CN) besetzt A t1g , t1u , t2g , t2u π(CN) besetzt Im Eisen(III)-Komplex sind zwei Gruppen von Übergängen möglich (A und B). Die A-Banden erscheinen im VIS-Bereich, weil ΔE klein ist. Die zweite Absorption (B) betrifft die unbesetzten eg-Orbitale. Sie ist im UV-Bereich, weil die Energiedifferenz zwischen den betroffenen Orbitalen grösser ist. Die A-Banden sind im Spektrum von [Fe(CN)6]4– nicht vorhanden, weil der Fe(II)-Komplex die d6-Elektronenkonfiguration besitzt. Somit werden die Banden von LMCT-Übergängen (ligand-tometal-charge-transfer) verursacht: Die Hauptdifferenzen zwischen [Cr(CO)6] und Fe(CN)6]4– sind: – CO ist ein stärker π-Akzeptor als CN–: Somit liegen die Energien der π*-(CO)-Orbitale tiefer als die der π*-(CN)-Orbitale, was die Energie der M→L-Übergänge gegenüber der L→MÜbergänge senkt. – Chrom befindet sich im Periodensystem links von Eisen: Demzufolge liegen die Cr-d-Orbitale energetisch höher als die Fe-d-Orbitale, was ebenfalls die Energie der M→L-Übergänge senkt. 3. Die Reaktion von [Cr(OH2)6]Clx (x muss bestimmt werden) mit NH3 (g) in EtOH-Lösung gibt [Cr(NH3)6]Clx (B). Der isolierte Komplex B hat µeff = 4.85 BM und ist stabil nur unter einer NH3 (g)-Atmosphäre. Sein UV-Vis-Spektrum enthält eine sehr breite, starke Bande (16'000 cm–1) und eine schwächere Bande bei 8'500 cm–1. (a) Bestimmen Sie Oxidationszustand und Elektronenkonfiguration von Chrom und erklären Sie die magnetischen Eigenschaften und das UV-Vis-Spektrum von B anhand eines KFT-Energiediagramms! L. µeff = 4.85 BM → 4 ungepaarte Elektronen → Cr(IV), hs d4 → [Cr(NH2)6]Cl2 (hs d6 würde ebenfalls 4 ungepaarte Elektronen enthalten, Cr(0) mit Liganden, die keine πAkzeptoren sind, macht chemisch keinen Sinn.) KFT Diagramm ohne J.–T.-Verzerrung mit eg, !* eg, !* t2g t2g (b) Wieso ist B nur unten NH3 (g) stabil? Nennen Sie die thermodynamischen und kinetischen Faktoren, die dazu beitragen! – Thermodynamische Faktoren: In der hs-d4-Elektronenkonfiguration sind einige M–L-Bindungen geschwächt, weil ein σ*-Orbital besetzt ist (siehe oben). – Kinetische Faktoren: hs-d4-Komplexe sind labil, was ihre Zersetzung beschleunigt. (c) Das Elektronenspektrum von B kann dadurch erklärt werden, dass der Grundzustand ausserordentlich stark verzerrt ist, der angeregte Zustand aber sehr schwach. Erklären Sie Art, Grund, Ausmass und Effekt dieser Verzerrungen auf das Spektrum! L. Die Strukturen von oktaedrischen high-spin d4 und d9-Komplexen zeigen starke Jahn-TellerVerzerrungen, weil der Grundzustand stark jahn-Teller-verzerrt ist (siehe oben). Im angeregten Zustand ist die Verzerrung viel kleiner, weil die Entartung die t2g-Orbitale betrifft: E AZ 2 3 AZ 1 2 GZ 2 1 GZ 1 GZ (ohne J-T) GZ 1 (mit J-T) GZ 2 (mit J-T) AZ 1 AZ 2 (mit J-T) (mit J-T) AZ (ohne J-T) Die schwache Bande bei 8'500 cm–1 lässt sich dadurch erklären, dass die Verzerrung des Grundzustandes so stark ist, dass die entsprechende Bande (Übergang 1) energetisch hoch genug liegt, dass sie beobachtet wird. Die kleine Aufspaltung der Hauptbande bei 16'000 cm–1 ist im Einklang mit der schwachen Verzerrung der t2g2eg2-Elektronenkonfiguration, in der die Entartung σ-nichtbindende Orbitale betrifft. Tanabe-Sugano-Diagramme