Vorlesung ACII-2 (LA) Kapitel 8
Werbung

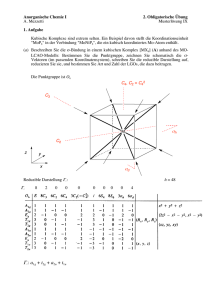
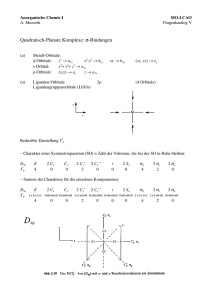
8. Molekülorbitaltheorie der Komplexe Theorie der Molekülzustände (WW der d-AO′s mit Atomrümpfen von Metallzentren und Liganden) als lineare Kombination von Atomorbitalen des ÜM (d-AO′s) und Liganden (Gruppen). 8.1 Symmetrie von Atomorbitalen In Kap. 8 wurden die d-AO′s im Oh (Td)-Fall in t2g (t2)- und eg (e)-AO′s aufgespalten. Diese Bezeichnungen resultieren aus der Gruppentheorie und bestimmen das Symmetrieverhalten der AO′s (und der Ligandengruppenorbitale). • Zur Terminologie: a) Wichtige Symmetrieelemente: E, Cn, σv, σh, σd, i, Sn b) s-Orbital im Oh (Td)-Fall: a1g (a1) a: singulär, sym. zu Cn (HA); 1: sym. zu C2 (σv); g: sym. (gerade) gegen i (nur bei Oh) c) p-Orbitale im Oh (Td)-Fall: t1u (t2) t: dreifach entartet (px, y, z); 1: sym. zu C2 (σv) u: asym. (ungerade) gegen i; 2: asym. zu C2 (σv) d) d-Orbitale im Oh (Td)-Fall: t2g und eg (t2 und e) t: dreifach entartet (dxy,xz,yz); 2: asym. zu C2 (σv); g: sym. (gerade) gegen i (nur bei Oh); e: zweifach entartet (dx2-y2,z2); • Zur Verdeutlichung: z C4 z C2 C2 y x y x s totalsymmetrisch a1g y py (px,z): t; i : u; 1 : sym. C2, σyz t1u y C2 C2 x x z z dx2-y2 (dz2): e; i : g; (1 : sym. C2, σxz) eg dxy (dxz, dyz): t; i : g; 2 : asym. C2, σxz t2g 8.2 LCAO-MO-Methode: Molekülorbitale entstehen durch lineare Kombination von Atomorbitalen des Metalls (s, p, d der Valenzschale) und freien Orbitalen der Liganden (σ- und π-Symmetrie); n AO′s generieren n bindende und n antibindende MO′s. Ohne WW: nichtbindende MO′s • σ-Symmetrie: 0 Knotenebene in Kernverbindungslinie (ML); σab-MO′s: zusätzlich 1 KE ⊥ ML M L M L b ab σ -MO 2 3 n d sp -Hybrid sp -Hybrid σ -MO (1KE ⊥ ML) H2 C M M C O b σ -MO 2 3 nb d sp und σ (CO) C H2 b σ -MO 2 3 b d sp und π (C2H4) • π-Symmetrie: 1 Knotenebene in Kernverbindungslinie (1 KE ⎜⎜ ML) M Lig M πb-MO: dπ-pπ Beispiel: Lig = O2− M A B πb-MO: dπ-pπab Beispiel: A B = CO, N2 πab-MO's: zusätzlich 1 KE ⊥ ML Lig πb-MO: dπ-dπ Beispiel: Lig = PF3 M A B πb-MO: dπ-pπab Beispiel: A B = C2H4, C2H2, N2, O2 • δ-Symmetrie: 2 Knotenebenen in der Kernverbindungslinie, nur bei ÜM (d-AO′s) möglich Beispiel: Re2Cl82−: 1σ der d-AO′s (dz2)-, 2π (dxz,yz)- und 1δ (dxy)-Bindung, ekliptische Anordnung der Liganden beider Molekülhälften + − M + − + − y dxy − M + y dxy x • Ligandengruppenorbitale: (orthogonale Vektoren) Ein Ensemble von n Liganden bildet ⇒ n auf das Zentrum gerichtete σ-Orbitale (0 KE) und ⇒ 2n π-Orbitale aus (je 1 KE) ⇒ Sie überlappen mit den symmetrie-adaptierten s-, p- und d-AO′s des ÜM (Kap. 7.7) ⇒ Sie bilden dann n σb- und n σab- und (3n-9)nb bzw. (9-n) πb- und (9-n) πab-MO′s aus ⇒ Energetische Reihenfolge: d < s < p; σLig < d-AO′s; aber σ-Bdg > π-Bdg 8.3 MO-Diagramm im Oktaeder • Mögliche Wechselwirkungen (σ-Bindungen) d-AO′s s px, y, z dx2-y2,z2 ; dxy, xz, yz Oh a1g t1u eg 6 σ-Orb./Lig. a1g t1u eg Überlappung + + + Charakter t2g – bindend/antibindend; nichtbindend (σnb; M) z z y y x z y x x dx2-y2 + 4 × σ dz2 + 6 × σ s+6×σ a1g eg z z z y y y x x x px + σx py + σy pz + σz t1u Wechselwirkung der 6 AO's mit 6 σ-Ligandengruppenorbitalen zu 6 σ-MO's. M-AO's 6 Liganden (σ-Typ) MO's t1uab a1gab p t1u s d a1g egab Δo ab nb eg t2g t2gnb b (π) egb a1g + t1u + eg t1ub a1gb • MO-Schema von ML6 (nur σ-Bindungen) • Mögliche Wechselwirkungen (mit π-Bindungen) d-AO′s s px, y, z dx2-y2,z2 ; dxy, xz, yz Oh a1g t1u eg t2g 12 π-Orb./Lig. – t1u – t2g + t1g + t2u Überlappung (+) – + – (πb+πab) Charakter – – πb+πab z z z y y x x px + πyz y x py + πxz pz + π xy π-MO's: t1u (wurde bereits für σ-Bindung benutzt) z z z + + + + y + dxz + π xz + x x x y dyz + π yz dxy + π xy π-MO's: t2g ⇒ 2 Fälle für π-Wechselwirkungen von (3p-AO′s = t1u-Typ und) 3d-AO′s (t2g-Typ) mit πLigandengruppenorbitalen zu Β-MO′s: a) t2g-Lig: besetzt ⇒ energieärmer: π-Donoren: Beispiel CoF63-, kleines Δo b) t2g-Lig: leer ⇒ energiereicher: π-Akzeptoren: Beispiel Co(CN)63-, großes Δo y M-AO's MO's 6 Liganden (σ + π) σab p t1u egab s Δo a1g d (M) ab t2gab eg nb b t2g t2g b πb(Lig) t2g (π, besetzt) σ b(Lig) a1g + t1u + eg (σ) • MO-Schema von ML6 (mit π-Donor) _____________________________________________________________________ M-AO's 6 Liganden (σ + π) MO's t1uab p t1u a1gab s t2gab (Lig) a1g d Δo eg egab t2g (π, leer) nb t2g b t2gb (M) σb a1g + t1u + eg (σ) • ab MO-Schema von ML6 (mit π-Akzeptor) • MO-Erklärung der 18 VE-Regel (im Oh-Fall): a) Besetzung von n σb- und (9-n)nb-MO′s mit 18 Elektronen b) Reine σ-Donoren wie H2O oder Amine: mittleres 10 Dq, VE ≤ 18 (t2gnb) c) σ-Donor-π-Donoren wie Halogene, O2-, S2-: kleines 10 Dq, VE ≥ 18 (t2gab und egab) d) σ-Donor-π-Akzeptoren wie CO, CN¯, NO, PF3: großes 10 Dq, VE = 18 (t2gb) e) Erklärung der spektrochemischen Serie ist möglich • MO-Schema von Cr(CO)6 o 6 × CO Cr(CO)6 Cr a1g t1u antibindende MO's t2g t1g 4p t2u t1u eg 2π ab 10 Dq 4s t2g eg t1u a1g t1u 6 3d 24 b-MO's mit 48 COElektronen besetzt ab 5σ t2u t1u t2g eg t1u a1g insgesamt mit 54 Elektronen besetzt 1π b b 4σ 6 × 8 VE = 48 VE 8.4 MO-Diagramm im Tetraeder • MO′s mit σ-Bindungen d-AO′s s px, y, z dx2-y2,z2 ; dxy, xz, yz Td a1 t2 e t2 4 σ-Orb./Lig. a1 t2 – – Überlappung + + – – Charakter bindend/antibindend; M-AO's nichtbindend (Lig) MO's 4 Liganden (σ-Typ) t2ab p a1ab t2 s a1 ab nb d t2 e e t2 b a1 + t2 t2b a1b • MO-Schema von ML4 (nur σ-Bindungen) ________________________________________________________________________ • MO′s mit π-Bindungen d-AO′s s px, y, z dx2-y2,z2 ; dxy, xz, yz Td a1 t2 e t2 8 π-Orb./Lig. – – e t2 + t1 Überlappung – – + + – Charakter – bindend/antibindend; nicht bindend – M-AO's 4 Liganden (σ und π) MO's t2ab σab p t2 s a1 t2ab a1 πab eab e + t1 + t2 (π) d t2 e t1 nb (Lig) πb t 2b eb σ a1 + t2 (σ) b • MO-Schema von ML4 (σ- und π-Bindungen) _________________________________________________________________________ Folge: a) 2 π-Bindungen (e-Typ) sind im Tetraeder begünstigt b) 3 weitere π-Bindungen (t2-Typ) sind möglich (Beispiel OsO4 mit 4 π-Bindungen) 8.5 MO-Diagramm im Quadrat • MO′s mit σ- und π-Bindungen d-AO′s s px, y, z dx2-y2,z2 ; D4h a1g eu + a2u b1g + a1g b2g + eg 4 σ-Orb./Lig. a1g eu b1g + (a1g) 8 π-Orb./Lig. eu + a2u Überlappung + + + dxy, xz, yz b2g + eg + a2g + b2u + + + + – – 4 Liganden (σ + π) MO's M eu a2u p a1g b1g eu + a2u s a1g (dxy) b2g a1g eg 8 d nb-MO's d (dx2y2) (dz2) (dxz, yz) b2u a2g π eu eg + a1g + b2g + b1g a2u eg a2g + b2u + eu + a2u + eg + b2g πb b2g eu σ a1g + b1g + eu b b1g σ a1g • MO-Schema von ML4 (Quadrat; σ- und π-Bindungen) ___________________________________________________________________________ 8.6 Isolobal-Analogie Sie verbrückt wegen elektronischer und struktureller Gemeinsamkeiten (Ähnlichkeiten) die organische, metallorganische und anorganische Chemie (R. Hoffmann, 1983). Td-Prinzip bei HG-Elementen (8 VE-Regel): CH4 CH3 CH2 CH (Moleküle und Fragmente) Oh-Prinzip bei NG-Elementen (18 VE-Regel): ML6 • ML5 ML4 ML3 (Moleküle und Fragmente) Grenzorbitalbereich bei Fragmentbildung Fragmentbildung d.h. Ligand-Entfernung unter Bindungsbruch verursacht Absenkung eines σab-MO′s (Zentrum) in nb-Bereich Bei Td: CHn-Gerüst mit (4-n)-Grenzorbitalen (n = 3, 2, 1) auf Td-Ecken Bei Oh: MLn-Gerüst mit (6-n)-Grenzorbitalen (n = 5, 4, 3) auf Oh-Ecken + t2g(π)-MO′s CH4 p CH2 CH3 a1 sp3 Td σ = a1 + t2 ML6 e b2 a1 s C-ATOM CH a1 C3v C2v C3v a1 + e a1 + b1 a1 ML5 ML4 ML3 p z s a1 y x d t2g METALL d2sp3 a1 a1 b2 e a2 + b1 + b2 b2 + e a1 + e Oh C4v C2v C3v Cr(CO)6 Mn(CO)5 Fe(CO)4 Co(CO)3 σ = a1g + t1u + eg 2a1 + b1 + e 2a1 + b1 + b2 a1 + e • Grenzorbitalbereiche bei sukzessiver Fragmentbildung im Td- und Oh-Fall ___________________________________________________________________________ • Definition Molekülfragmente sind isolobal, wenn Anzahl, Symmetrie, Energie, Gestalt und Elektronenbesetzung ihrer Grenzorbitale vergleichbar (ähnlich, nicht identisch) sind. Symbol: Beispiele: o d7-ML5 Mn(CO)5 CpFe(CO)2 o CH3 (Methyl) d8-ML4 Fe(CO)4 CpRhCO o CH2 (Methyliden) d9-ML3 Co(CO)3 CpNi o CH (Methylidin) • Spezialfall: Planare Systeme Entfernung beider axialer Liganden aus oktaedrischen Fragmenten ML5 bzw. ML4 führt zur Absenkung des antibindenden dz2-AO′s in den nichtbindenden Grenzorbitalbereich. Trotz Fehlens zweier Liganden werden zwei zusätzliche Elektronen aufgenommen. Es resultieren neue isolobale Relationen: dn-ML5 Cr(CO)5 o dn+2-ML3 und dn-ML4 PtCl3− o Fe(CO)4 dn+2-ML2 Ni(PR3)2 Pt(CO)2 Weitere Fragmentbildung in Richtung planare Komplexe ________________________________________________________________________ • Planare Komplexe bei d8- und d10-Systemen Hier resultieren relativ stabile tetragonal bzw. trigonal planare Komplexe bereits bei Besetzung mit 16 Elektronen (16 VE-Regel): tetragonal • planar trigonal (Ph3P)2PtCl2 (Ph3P)2Pt(C2H4) (CO)2PtCl2 (Ph3P)2PtO2 (Ph3P)3RhCl Ni(C2H4)3 (Ph3P)2Rh(CO)Cl NiCDT Isolobal-Relationen Erweiterung auf andere Koordinationszahlen (als 6) ist durch gegenseitigen Ersatz von Liganden und ÜM-Elektronenpaaren möglich: Beispiel: KZ = 8: • d2-ML8-System (18 VE) d3-ML7 o CH3 d4-ML6 o CH2 (CpV(CO)3) d5-ML5 o CH (CpMo(CO)2) Übersicht der Isolobal-Relationen Organisches Fragment VE KZ = 4 Metallorganisches Fragment mit ursprünglicher KZ (bei Achtzehn-Elektronen-Regel) VE/KZ = 9 8 7 6 5 8 CH4 18 d0-ML9 d2-ML8 d4-ML7 d6-ML6 d8-ML5 7 CH3 17 d1-ML8 d3-ML7 d5-ML6 d7-ML5 d9-ML4 6 CH2 16 d2-ML7 d4-ML6 d6-ML5 d8-ML4 d10-ML3 5 CH 15 d3-ML6 d5-ML5 d7-ML4 d9-ML3 VE KZ = 4 VE/KZ = 4 3 6 CH2 14 d8-ML3 d10-ML2 (bei Sechzehn-Elektronen-Regel) • Beispiele: Zu Alkanen, Alkenen und Alkinen isolobale ÜM-Komplexe Alkane KZ = 8 KZ = 7 V(CO)6a) KZ = 6 Mn2(CO)10 KZ = 5 Co2(CO)8 [CpM(CO)3]2 [CpFe(CO)2]2 [CpNiCO]2 (M = Cr, Mo, W) [CpCr(NO)2]2 Fe2(CO)8b) ene [CpRhCO]2 [CpFeNO]2 ine [CpM(CO)2]2 [CpFeCO]4c) (M = Mo, W) a) Ausnahme; b) instabil (Matrix); [(CO)3M]4c) (M = Co, Rh, Ir) c) Dimer instabil (⇒ Tetrahedran-Bildung)









![ÜBERGANGSMETALLKOMPLEXE Na2[Fe(CN)5NO] ⋅ 2H2O](http://s1.studylibde.com/store/data/002682926_1-4994fab9e6ff9a7ce3deb92323ee5953-300x300.png)