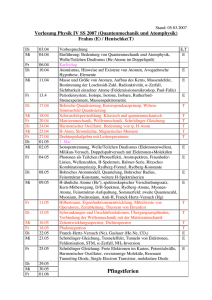
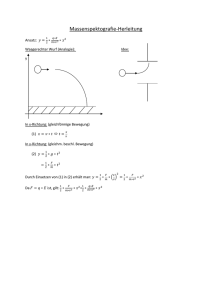
Grundlagen der Chemie
Werbung

Grundlagen der Chemie Prof. Dr. Sabine Prys • Allgemeine Chemie • Organische Chemie – Atombau, Elektronenkonfigurationen, Periodensystem – Bindungslehre – Grundbegriffe – Nomenklatur • Thermodynamik – Energieerhaltung – Gasgesetze – Arbeit , Energie, Ethalpie, Entropie • Anorganische Chemie – Redoxreaktionen, Säuren und Basen – Nomenklatur Klausurtermin: Fr 11.7.2014 um 9:30 in der Aula Naturwissenschaftliche Grundlagen @designed by ps Lernmechanismus Gedächtnismodell nach Atkinson & Shiffrin Kurzzeitgedächtnis akkustische Speicherung Umweltinformation Selektive Aufmerksamkeit 1 2 3 4 5 6 7 Langzeitgedächtnis semantische Speicherung Vertiefendes Wiederholen Vergessen durch Ersetzen Vergessen durch Störung 1 Skripte & Literatur http://webuser.hs-furtwangen.de/~neutron/lehrveranstaltungen.html Empfohlene Literatur Übungsfragen Atomphysik - Periodensystem Prof. Dr. Sabine Prys Naturwissenschaftliche Grundlagen @designed by ps 2 Inhalte 1. 2. 3. 4. 5. 6. Grundbegriffe und Einheiten Materiebegriff Atommodell Periodensystem Standardmodell Antimaterie 1 Basiswissen Masse Molzahl Zeit Länge Druck Dichte Wirkungsgrad m n t l oder r p Atommasse Teilchenzahl Temperatur Fläche Volumen Energie Wärme Arbeit Entropie Enthalpie M N T Fl V E Q W S H 3 1.1 Physikalische Einheiten Länge Fläche Volumen Kraft Druck Energie Temperatur Zeit Stoffmengen l Fl V F p E T t n [m] [m2] [m3] [N] [Pa = N/m2 = kg/(m.s2)] [J = Nm = kg.m2/s2] [K] [y(a),m,d,min,s] [mol] 1.1.1 Das SI-System SI = Système International d' Unités IS = International System of Units Basisgröße Basiseinheit Abkürzung Länge Masse Stromstärke Zeit Temperatur Lichtstärke Stoffmenge Ebener Winkel Raumwinkel Meter Kilogramm Ampere Sekunde Kelvin Candela Mol Radiant Steradiant m kg A s K cd mol rad sr http://www.chemie.fu-berlin.de/chemistry/general/si.html 4 1.1.2 Avogadrokonstante & Mol Avogadrozahl: Anzahl von Atomen oder Molekülen in der Stoffmenge von einem Mol CODATA-Empfehlung (2002) NA = 6,022 141 5(10) 1023 mol − 1 1 Mol = NA Teilchen 1 Mol = Molekulargewicht, angegeben in Gramm 1 Mol He = 4,003 g 1 Mol N2 = 14,007 x 2 = 28,014 g 1 Mol NaCl = 22,990 + 35,453 = 58,443 g Molekülvolumen abgeschätzt von Loschmidt Zahl der Moleküle pro Volumeneinheit berechnet http://physics.nist.gov/cuu/Constants/index.html 1.1.2.1 Umrechnungen mithilfe der Avogadrokonstante NA • Universelle Gaskonstante (R) Boltzmannkonstante (kB) R N A kB • Faraday Konstante (F) Elementarladung (e) F NA e • Molmasse (M) Teilchenmasse (mM) Teilchenmenge (m) Molzahl (n) M N A mM • m n N N A VM 0 L Loschmidt Konstante Molvolumen bei Normalbedingungen (VM0) 5 1.1.3 Atomare Masseneinheit u unified atomic mass 12 g C 6,0221415(10) 1023 C-Atome 1 C Atom 1u 12 g 12 u 6,022 10 23 1 g 1,660538921(73) 1027 kg 6,022 10 23 Wieviel u wiegt 1 Molekül Aspirin ? http://physics.nist.gov/cuu/Constants/index.html 1.1.3.1 Übung ? Wieviel u wiegt 1 Molekül Aspirin Aspirin = Acetylsalicylsäure C 9 H 8 O4 M = 180,16 g/mol m = 180,16 u 6 1.1.4 Druck p F Fl Druck = Kraft / Fläche Pascal: Pa = N/m2 = kg/m s2 1bar = 100 000 Pa ~ atmosphärischer Luftdruck Normaldruck Standarddruck p = 1 atm = 101,325 kPa = 1013,25 mbar p = 1 atm = 101,325 kPa = 1013,25 mbar http://www.ebgymhollabrunn.ac.at/ipin/ph-druck.htm http://cicum92.cup.uni-muenchen.de/puchinger/glossar/glossarB2.html 1.1.5 Abgeleitete Größen Geschwindigkeit v v l t l t D = Weg = Zeit m s Strahlungsdosis D [m] [s] E m E = Energie m = Masse [J] [kg] J Sv kg http://www.chemie.fu-berlin.de/chemistry/general/si.html 7 1.1.6 Geometriebetrachtungen Wie berechnet man – Kreisumfang Ukreis – Kreisfläche Fkreis – Kugeloberfläche Fkugel – Kugelvolumen Vkugel U kreis 2 r ? Fkreis r 2 Fkugel 4 r 2 Vkugel 4 r 3 3 r2 h – Zylindervolumen Vzylinder Vzylinder – Quadervolumen Vquader Vquader a b c 1.1.7 Sinusschwingung Sinus und Kosinus sind elementare mathematische Funktionen – die eine Schwingung beschreiben können: y=sin(x) y =cos(x) – die die Seitenlängenverhältnisse im Dreieck beschreiben können Gegenkathete Hypothenuse Ankathete cos( x) Hypothenuse sin( x) Graphik: http://de.wikipedia.org 8 1.1.8 Der Raumwinkel Sx Graphik: http://de.wikipedia.org Ω = Raumwinkel S = auf eine Kugel projizierte Fläche r = Radius der Kugel S r2 Anwendungen: Lichtkegel in der Beleuchtungstechnik, Strahlungskegel, etc.. 1.1.8.1 Die Einheit des Raumwinkels Raumwinkel: Verhältnis zweier Flächen SI 1 m²/m²; SI-Name: Steradiant Einheit-Zeichen sr 1 sr = 1 m²/m² = 1 das Einheit-Zeichen sr kann auch weggelassen werden (nicht jedoch bei Anwendungsfeldern, bei denen intensiv mit Raumwinkeln gerechnet wird, z.B. in der Lichttechnik). Die SI-Einheiten für Lichtstärke und Lichtstrom unterscheiden sich nur durch Steradiant. 9 Übungsaufgabe ? Wie groß ist der Raumwinkel der vollen Kugeloberfläche ? = S / r2 = 4.r2/r2 = 4. Sr = 12,57 sr 1.1.9 Polarkoordinaten der Ebene Karthesische Koordinaten: Angabe von x und y Polarkoordinaten (Kreiskoordinaten): Angabe von Koordinatenursprung r und Strahlrichtung (Polarwinkel) Graphik: http://de.wikipedia.org 10 1.1.9.1 Polarkoordinatenumrechnung Polarkoordinate karthesische Koordinaten: x = r cos ( ) y = r sin ( ) Kartesische Koordinaten Polarkoordinaten: r x2 y2 x für y 0 r x arccos für y 0 r arccos 1.1.10 Polarkoordinaten des Raumes Polarkoordinaten (Kugelkoordinaten): Angabe von Koordinatenursprung r und Strahlrichtungen Graphik: http://de.wikipedia.org 11 1.2 Vorsilben Vorsilbe Abkürzung Zehnerpotenz Dezimalzahl FemtoPicoNanoMikroMilliKilo Mega Giga Tera Peta f p n µ m k M G T P 10 E-15 10 E-12 10 E-09 10 E-06 10 E-03 10 E+03 10 E+06 10 E+09 10 E+12 10 E+15 0.000 000 000 000 001 0.000 000 000 001 0.000 000 001 0.000 001 0.001 1000 1000000 1000000000 1000000000000 1000000000000000 http://physics.nist.gov/cuu/Units/prefixes.html 1.3 Griechische Buchstaben = = = = = = = = = = = = Alpha Beta Gamma Delta Epsilon Zeta Eta Theta Jota Kappa Lambda My = = = = = = = = = = = = Ny Xi Omikron Pi Rho Sigma Tau Ypsilon Phi Chi Psi Omega 12 1.4 Differenzen und Summen • Differenz Differenzenquotient Steigung einer Geraden • • Differential • Differentialquotient Steigung einer Kurventangenten Unendliche kleine Größe dy dE lim E y' E 0 dx • Summe Addition kleiner Größen • Endzustand – Ausgangszustand y y2 y1 S E E2 E1 x x2 x1 n x1 x2 x3 ...xn xi i 1 • Integral • Addition unendlich kleiner Größen n n dx lim x i 1 x 0 i 1 i 1.5 Geraden und Ebenen Graphik: http://de.wikipedia.org Gerade: wird durch mindestens 2 Punkte P,Q, beschrieben: Y = ax + b a = Steigung b = Schnittpunkt mit Y-Achse Ebene: wird durch mindestens 3 Punkte beschrieben Z = ax + by + c 13 2 Was ist Materie ? Was ist Materie ? Was ist ein Stoff ? Materieaggregationen 2.1 Masse-Energie Das Weltall besteht aus Materie und strahlender Energie. Materie ist jegliche Art von Masse -Energie, die sich langsamer als Licht fortbewegt, strahlende Energie dagegen, ist jegliche Art von Masse-Energie, die sich mit Lichtgeschwindigkeit bewegt Linus Pauling E = m.c2 14 2.4 Atome, Elemente, Verbindungen Atome Unter Atomen versteht man die kleinsten Bestandteile der der chemischen Elemente, die dessen Eigenschaften aufweisen Chemisches Element Unter einem chemischen Element versteht man einen Stoff, der sich chemisch nicht mehr weiter in andere Stoffe zerlegen lässt. Chemische Verbindung Unter einer chemischen Verbindung versteht man einen Stoff, der aus Atomen mehrerer verschiedener Elemente besteht und einheitliche physikalisch-chemische Eigenschaften wie z.B. Schmelz- und Siedepunkt aufweist. 3 Atommodelle Vordenker: • Demokrit (ca. 500 v.Chr.): Alle Stoffe bestehen aus definierten kleinsten Teilchen den Atomen von Atomos Teilchen des Unteilbaren • Daniel Sennert (1618): Gesetz der Erhaltung der Elemente. Bei einer chemischen Reaktion gehen Elemente weder verloren, noch werden Elemente neu geschaffen. • Robert Boyle (1661): Elemente sind bestimmte primitive und einfache, völlig unvermischte Körper, sie enthalten keine anderen Körper, sie sind Zutaten, aus denen alle perfekt gemischten Körper zusammengesetzt sind und in welche diese letztlich zerlegt werden. • Antoine Laurent de Lavoisier (1785): Gesetz der Erhaltung der Masse. Die Summe der Massen der Edukte ist stets gleich der Summe der Massen der Produkte. • Jeremias Benjamin Richter (1791/92): Gesetz der äquivalenten Proportionen. 15 3.3 Das RUTHERFORDsche Atommodell Atomkernmodell: winziger Kern = Massepunkt Planetenmodell: Elektronen bewegen sich auf Kreisbahnen um den Kern Kreisbahn entsteht durch Gleichgewicht von Coulomb- und Zentrifugalkraft Negative Ladung Positive Ladung Widerspruch zu den Gesetzen der Elektrodynamik ! instabile Elektronenbahnen 3.3.1 Das RUTHERFORD-Experiment Goldfolie Film Streuung von Alphateilchen an Goldfolie erklärbar Berechnung einfacher Atomspektren möglich 16 3.4 Das BOHRsche Atommodell = 10-7 - 10-10 m Kern: Protonen Neutronen (+) (n) Elektronenhülle: Elektronen (-) Postuliert stabile Elektronenkreisbahnen ! 3.4.1 Stabile Elektronenbahnen 1. BOHRsche Quantenbedingung: stabile Bahnen wenn das Produkt aus Kreisumfang und Elektronenimpuls ein Vielfaches des PLANCKschen Wirkungsquantums h ist (2 rn ) (me vn ) l h l = 0,1,2,3…, r = Bahnradius, me = Elektronenmasse, ve = Geschwindigkeit 2. BOHRsche Frequenzbedingung: Durch Energiezufuhr ist ein Übergang zwischen den Bahnen möglich, wenn absorbierte Energie genau der Energiedifferenz E zwischen den Bahnen entspricht: E h E2 E1 E1 = Energie Schale 1, E2 = Energie Schale 2, = Frequenz 17 3.4.1.1 PLANCKsches Wirkungsquantum • Definition der Energie E: E h c h 6,626 068 76 10 34 Js c = Lichtgeschwindigkeit, = Wellenlänge • h hat die Dimension einer Wirkung ! 3.4.2 Elektronen Schalen 2n2 Elektronen pro Schale E n = 4 N-Schale n = 3 M-Schale n = 2 L-Schale n = 1 K-Schale 1 Z e 2 me Z 2 e 4 En 2 rn 2 n2 2 En n Z e rn me = = = = = = = Schalenenergie Schalennummer Ordnungszahl Elementarladung Orbitalradius Elektronenmasse h / 2 18 3.4.2.1 Angeregte Zustände Grundzustand = energetisch niedrigste Elektronenkonfiguration Angeregte Zustände = Elektronenkonfigurationen wo nach Energiezufuhr höhere Energieniveaus besetzt werden (z.B. durch Photonenabsorption oder durch unelastische Stösse) Der Zerfall in der Grundzustand erfolgt entweder induziert oder spontan und wird entweder begleitet von Strahlungsemission (Photonenaussendung) oder strahlungslos durch Aussenden weniger fest gebundener Elektronen (Auger-Elektronen) Beispiel: die Flammenfärbung von Alkali- und Erdalkalimetallen durch Stoßanregung zwischen Atomen und Molekülen in der heißen Flamme 3.4.3 Die Wasserstoffspektrallinien Spektrum des Wasserstoffatoms P O N M L PFUND BRACKETT PASCHEN BALMER K LYMAN Spektralserien 19 3.4.4 Das Wasserstoffspektrum Graphik: http://www.physics.utoledo.edu/ 3.4.4.1 Flammenfärbung • Anregung von Elektronen auf ein höheres Energieniveau • Flamme eines (Bunsen)Brenners bei > 1000°C • Instabiler angeregter Elektronenzustand Zurückfallen in das Ausgangsniveau Aussenden einer elementspezifischen Energie mit Wellenlänge im sichtbaren Bereich Graphik: http://de.seilnacht.com 20 3.4.4.2 Elementanalyse Flammenfärbung verschiedener Metalle: Kupferacetat Eisen Kaliumiodid Strontiumnitrat Magnesium Natriumchlorid Graphik: http://www.experimentalchemie.de/ 3.4.5 Das Bohr/Sommerfeldsche Atommodell Erweiterung des Atommodells durch Sommerfeld: Die Bahnen müssen nicht kreisförmig sein ! Haselnuss 100 m 1 cm 21 3.5 Wellenmechanisches Atommodell Elektronen = stehende Welle Wellenfunktion eines Elektrons (r,E) Aufenthaltsbereich eines Elektrons 2(r,E) SCHRÖDINGER-Gleichung H = E Energiezustände eines Elektrons E Kernabstand r 3.5.1 Stehende Welle U n 2 n 1,2,3,4,... U n = Kreisumfang = Schwingungsordnung = Wellenlänge Graphik: http://uni-ka.lanable.de/html/exphys1/exse18.htm 22 3.5.2 Natur von Wellen & Teilchen Wellennatur Teilchennatur • • • • • • • • • • • • • • Wellenlänge, Amplitude Wellenfunktion Orbitale 2 Stehende Wellen / Wellenoptik Interferenzen Ausbreitungsgeschwindigkeit Energie: E = h. Unschärfe Ort, Masse, Impuls Bewegungsgleichungen Geometrische Optik (Newton) Ionisationsvermögen Geschwindigkeit Energie: E = ½ m.v2 Keine Unschärfe 3.5.2.1 Wiederholung: Energie • Schwingungsenergie h = Plancksches Wirkungsquantum = Schwingungsfrequenz c = Lichtgeschwindigkeit = Wellenlänge • Bewegungsenergie m = Masse v = Geschwindigkeit • Wärmeenergie kB = Boltzmannkonstante T = absolute Temperatur E h h E 1 2 mv 2 E 3 k BT 2 c Welche anderen Energiebegriffe gibt es noch ? 23 3.5.3 Messgrößen Klassische Mechanik: (makroskopische Teilchen) Ort & Impuls sind prinzipiell exakt messbar Quantenmechanik: (mikroskopische Teilchen) Verteilung von Orts & Impulsaussagen hängen beide von der Wellenfunktion ab Standardabweichungen der Messungen sind voneinander abhängig 3.5.4 Die Unschärferelation Quantenmechanische Aussagen sind Wahrscheinlichkeitsaussagen ! • Bei quantenmechanischen Teilchen ist es unmöglich Ort x und Impuls p gleichzeitig beliebig genau zu messen x p 2 • Bei quantenmechanischen Teilchen ist es unmöglich den Zeitpunkt t eines Vorganges und die dabei übertragene Energie E gleichzeitig beliebig genau zu messen t E 2 Je genauer eine dieser Größen bestimmt wird, desto ungenauer erscheint die andere ! 24 3.5.5 DE BROGLIE-Wellenlänge • DE BROGLIE: auch massereiche Teilchen haben Wellencharakter – 1923 "Dualität von Welle und Korpuskel" – 1927 Bestätigung durch Doppelspaltexperiment von Clinton Davisson und Lester Germer • Hat das Teilchen einen Impuls p, so ist seine Wellenlänge λ : h p p h c c c = Lichtgeschwindigkeit (299 792 458 ms-1) h = PLANCKsches Wirkungsquantum (6,626 068 96 . 10-34 Js) = Frequenz der Lichtwelle Datenquelle: NIST (Mohr) 2010 3.5.6 Das Doppelspaltexperiment Die bekannte Intensitätsverteilung entsteht erst, wenn viele Elektronen den Spalt passiert haben und man über die Lichtblitze mittelt. Die vielen Elektronen bilden dann die statistische Gesamtheit. http://www.mathematik.tudarmstadt.de/~ziegler/qm.html#wofuer Graphik: http://www.iap.uni-bonn.de/ P2K/schroedinger/two-slit2.html 25 3.5.6.1 Schrödingers Katze(n) Lebt Schrödingers Katze noch? Keine Ahnung, schau halt nach! In einer statistischen Gesamtheit von Schrödingerkatzen leben nach der Zeit t noch 100*exp(-t*ln(2)/T) Prozent, wobei T=Halbwertszeit des Radioisotops 3.5.7 Wellenmechanikprinzipien Quantenmechanik = statistische Theorie • Welle – Teilchen Dualismus h p • Wellenmechanik: Teilchen Wellenfunktion 1. 2. komplexwertig keine Messgröße 2 (Betragsquadrat) Aufenthaltswahrscheinlichkeit des Teilchens (r,t) SCHRÖDINGER-Gleichung Wahrscheinlichkeitsaussagen ! 26 3.5.7.1 Interferenzen Graphik: http://de.wikipedia.org/ 3.5.8 Die Wellenfunktion von Elektronen Allgemeine Wellenfunktion für monochromatische Welle in r-Richtung (r , t ) c ei (t kr ) Realer Anteil der Wellenfunktion (r , t ) c cos( t k r ) Zustandsfunktion 27 3.5.8.1 Zustandsfunktionen Quantenmechanische Zustände rt rt C CrCt Linearkombination der Zustände (Überlagerung) a rb rc Cr Aufenthaltswahrscheinlichkeit A2.sin2t 68 67 66 65 64 63 62 61 60 59 58 57 56 55 54 53 52 51 50 49 48 47 4645 44 7 89 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 3.5.8.2 Wellenmechanik in der Chemie • Zustandsüberlagerung (Interferenz) mit gegenseitiger Beeinflussung Linearkombinationen von Wellenfunktionen chemische Bindungen • Zustandsüberlagerung (Superposition) ohne gegenseitige Beeinflussung Linearkombinationen von Wellenfunktionen Molekülgeometrie Beispiel: Welche Form hat das Wassermolekül ? 28 3.5.9 SCHRÖDINGER Gleichung • • Grundgleichung der nichtrelativistischen Quantenmechanik zeitliche Entwicklung des Zustands eines Quantensystems i (r,t) m V(r,t) • 2 (r , t ) 2 (r , t ) V (r , t ) (r , t ) t 2m = Wellenfunktion z.B. des Elektrons = Masse z.B. des Elektrons = Potentielle Energie z.B. des Elektrons = Nabla-Operator Lösung der zeitunabhängigen SCHRÖDINGERgleichung: Berechnung der Energiezustände E 3.5.10 Elektronen als stehende Wellen Stehende Wellen • sind Wellen, bei denen die räumliche Lage der Schwingungsbzw. Wellenbäuche und –knoten sich zeitlich nicht ändert; • sind Wellen, die keine Energie transportieren Für die Strecke U , auf der die Schwingung stattfindet, muss gelten, dass sie ein Vielfaches n der Wellenlänge ist. U n 2 n 1,2,3,4,... U n d = Streckenlänge = Schwingungsordnung = Wellenlänge U Graphik: http://unika.lanable.de/html/exphys1/ exse18.htm 29 3.5.10.1 Stehende Wellen (a) d U n U d n = 1 Grundschwingung 2 n 1,2,3,4,... d n = 2 1. Oberschwingung d n = 3 2. Oberschwingung n = 4 3. Oberschwingung 3.5.10.3 Stehende Wellen (c) 325,00 40,00 320,00 45,00 315,00 50,00 310,00 55,00 305,00 60,00 300,00 65,00 295,00 70,00 290,00 75,00 285,00 80,00 280,00 85,00 275,00 90,00 270,00 95,00 265,00 100,00 260,00 105,00 255,00 110,00 250,00 115,00 245,00 120,00 240,00 125,00 235,00 130,00 230,00 135,00 225,00 140,00 220,00 145,00 215,00 150,00 210,00 155,00 205,00 160,00 200,00 165,00 195,00 170,00 190,00 185,00 180,00 175,00 n = 1 Grundschwingung , , 335,00 30,00 330,00 35,00 325,00 40,00 320,00 45,00 315,00 50,00 310,00 55,00 305,00 60,00 300,00 65,00 295,00 70,00 290,00 75,00 285,00 80,00 280,00 85,00 275,00 90,00 270,00 95,00 265,00 100,00 260,00 105,00 255,00 110,00 250,00 115,00 245,00 120,00 240,00 125,00 235,00 130,00 230,00 135,00 225,00 140,00 220,00 145,00 215,00 150,00 210,00 155,00 205,00 160,00 200,00 165,00 195,00 170,00 190,00 185,00 180,00 175,00 n = 3 2. Oberschwingung 360,00 5,00 355,00 10,00 350,00 15,00 345,00 20,00 340,00 25,00 335,00 30,00 330,00 35,00 325,00 40,00 320,00 45,00 315,00 50,00 310,00 55,00 305,00 60,00 300,00 65,00 295,00 70,00 290,00 75,00 285,00 80,00 280,00 85,00 275,00 90,00 270,00 95,00 265,00 100,00 260,00 105,00 255,00 110,00 250,00 115,00 245,00 120,00 240,00 125,00 235,00 130,00 230,00 135,00 225,00 140,00 220,00 145,00 215,00 150,00 210,00 155,00 205,00 160,00 200,00 165,00 195,00 170,00 190,00 185,00 180,00 175,00 n = 2 1. Oberschwingung 360,00 5,00 355,00 10,00 350,00 15,00 345,00 20,00 340,00 25,00 335,00 30,00 330,00 35,00 325,00 40,00 320,00 45,00 315,00 50,00 310,00 55,00 305,00 60,00 300,00 65,00 295,00 70,00 290,00 75,00 285,00 80,00 280,00 85,00 275,00 90,00 270,00 95,00 265,00 100,00 260,00 105,00 255,00 110,00 250,00 115,00 245,00 120,00 240,00 125,00 235,00 130,00 230,00 135,00 225,00 140,00 220,00 145,00 215,00 150,00 210,00 155,00 205,00 160,00 200,00 165,00 195,00 170,00 190,00 185,00 180,00 175,00 n = 4 3. Oberschwingung Polarkoordinatendarstellung 30 3.5.10.4 Orbitale: sin2x d d 0,00 360,00 5,00 355,00 10,00 350,00 15,00 345,00 20,00 340,00 25,00 335,00 30,00 330,00 35,00 325,00 40,00 320,00 45,00 315,00 50,00 310,00 55,00 305,00 60,00 300,00 65,00 295,00 70,00 290,00 75,00 285,00 80,00 280,00 85,00 275,00 90,00 270,00 95,00 265,00 100,00 260,00 105,00 255,00 110,00 250,00 115,00 245,00 120,00 240,00 125,00 235,00 130,00 230,00 135,00 225,00 140,00 220,00 145,00 215,00 150,00 210,00 155,00 205,00 160,00 200,00 165,00 195,00 170,00 190,00 175,00 185,00 180,00 n=1 1 73 2345 72 71 70 69 67 68 67 89 66 65 10 64 11 63 12 62 13 61 14 60 15 59 16 58 17 57 18 56 19 55 20 54 21 53 22 52 23 51 24 50 25 49 26 48 27 47 28 46 29 45 30 44 31 43 32 42 33 41 34 40 35 39 36 38 37 n=2 3.5.11 Quantenmechanik Quantenmechanik = statistische Theorie Klassische Mechanik: kontinuierliche Grössen Quantenmechanik: diskontinuierliche Grössen • „Quantisierung“: Quantenzahlen erforderlich • Quantenzahlen sind einfache Zahlen, die den Zustand eines quantenphysikalischen Systems beschreiben • Durch einen vollständigen Satz von Quantenzahlen ist der Zustand des Systems eindeutig festgelegt • Beschreibt das Verhalten einer statistischen Gesamtheit • Kann Vernichtung oder Erzeugung von Teilchen nicht beschreiben 31 3.5.12 Die Hauptquantenzahl n Die Hauptquantenzahl n beschreibt die Schale, zu der der Zustand eines Elektrons gehört, Bohr/Sommerfeldsche Theorie: n beschreibt Bahngröße Schrödingersche Theorie: n beschreibt Orbitalgröße 3.5.13 Der Drehimpuls des Elektrons • Ein Elektron mit der Masse m und der Ladung e, das sich mit der Geschwindigkeit v auf einem Kreis mit dem Radius r bewegt hat ein magnetisches Dipolmoment und einen Drehimpuls L von: Lrp p mv L r m,-e Bahndrehimpuls v Linearer Impuls l = 0,1,2,3,… (2 r ) (m v) l h L , gekoppelt 32 3.5.14 Drehimpulsquantenzahl l Der Drehimpuls ist ein ganzzahliges Vielfaches von ħ quantisierte Grösse 2 r m v l h L l h 2 l 0,1,2,3,...(n 1) Bohr/Sommerfeldsche Theorie: l Beschreibt die Form der Elektronenbahn Schrödingersche Theorie: l Beschreibt die Form des Orbitals (s,p,d,f,…) 3.5.15 Magnetquantenzahl m Bohr/Sommerfeldsche Theorie: m beschreibt die Orientierung der Bahn im Raum Schrödingersche Theorie: m beschreibt die Orientierung des Orbitals im Raum Beispiel: Orbital in X-Richtung Orbital in Y-Richtung Orbital in Z-Richtung 33 3.5.16 Spinquantenzahl s Bohr/Sommerfeldsche Theorie: Elektronendrehung um eigene Achse Eigendrehimpuls = Spin Schrödingersche Theorie: Elektronendrehung um eigene Achse Eigendrehimpuls = Spin S Der Betrag des Spins kann die Werte annehmen: S s Für das Elektron kann der Betrag des Spins nur sein: s 1 2 3.5.17 „Elektronenschalen“ • Alle Zustände mit demselben Wert für n bilden eine Schale, – es gibt 2n2 Zustände in einer Hauptschale; • Die Hauptschalen mit n>1 bestehen aus unter Schalen, – es gibt n+1 Unterschalen in einer Hauptschale • Alle Zustände mit den selben Werten für n und l bilden eine Unterschale, alle Zustände dieser Unterschale haben dieselbe Energie – es gibt 2(2l +1) Zustände in einer Unterschale. 34 3.5.17.1 Elektronenquantenzahlen Quantenzahl Symbol erlaubte Werte Bedeutung Hauptquantenzahl n 1,2,3,4,5,... Kernabstand, Energie Nebenquantenzahl l 0,1,2, ... (n-1) Bahndrehimpuls Magnetquantenzahl m 0,1,2, ... , l Drehimpulsorientierung Spinquantenzahl ½ Eigendrehimpuls s der Bahndrehimpuls gibt den Orbitaltyp (s,p,d,f..) an; die Drehimpulsorientierung gibt die Orbitallage .(bei p: x,y,z, etc) an 3.5.18 Atomorbitale • Atomorbitale AO sind 3-dimensionale stehende Materiewellen, die den Aufenthaltsbereich (keine klar definierte Bahn !) der Elektronen darstellen. Das energieärmste Orbital entspricht dem Grundzustand (Grundschwingung), energiereichere Orbitale entsprechen angeregten Zuständen (Oberschwingungen) z z x y s-AO: Drehimpuls l = 0 x y p-AO: Drehimpuls l = 1 35 3.5.18.1 Atomorbitale s px l=0 m=0 l =1 m=1 dz 2 dx2-y2 dxy py pz m=0 m=-1 dyz dxz 3.5.18.2 Elektronenkonfigurationen I Element H n 1 l m s 0 s1 0 +1/2 He 1 0 s2 0 +1/2,-1/2 Li 1 2 0 0 s2 s1 0 0 +1/2,-1/2 +1/2 Be 1 2 0 0 s2 s2 0 0 +1/2,-1/2 +1/2,-1/2 B 1 2 0 0 1 s2 s2 p1 0 0 0 px 1 +1/2,-1/2 +1/2,-1/2 +1/2 0 0 1 s2 0 0 0 1 px 1 py1 +1/2,-1/2 +1/2,-1/2 +1/2 +1/2 C 1 2 s2 p2 36 3.5.18.3 Elektronenkonfigurationen II Element N O n 1 2 1 2 l 0 0 1 0 0 1 s2 s2 p3 s2 s2 p4 m s 0 0 0 1 -1 +1/2,-1/2 +1/2,-1/2 +1/2 +1/2 +1/2 0 0 0 1 -1 px1 py1 pz1 px2 py1 pz1 +1/2,-1/2 +1/2,-1/2 +1/2,-1/2 +1/2 +1/2 3.5.18.4 Elektronenkonfigurationen III Element F Ne n 1 2 2 1 2 2 l 0 0 1 0 0 1 s2 s2 p5 s2 s2 p6 m s 0 0 0 1 -1 +1/2,-1/2 +1/2,-1/2 +1/2,-1/2 +1/2,-1/2 +1/2 0 0 0 1 -1 px2 py2 pz1 px2 py2 pz2 +1/2,-1/2 +1/2,-1/2 +1/2,-1/2 +1/2,-1/2 +1/2,-1/2 37 3.5.19 Die Struktur der Elektronenschalen Hauptschalen n bestehen aus Unterschalen l Die Besetzung erfolgt nach strengen Regeln. Pro Schale 2n2 Elektronen m= 0 1 0 -1 2 1 0 -1 -2 3 2 1 0 -1 -2 -3 n=4 n=3 n=2 n=1 l= s p d f 0 1 2 3 3.5.20 Die Besetzung von Elektronenschalen Schreibweise: nlx n l = Schalennummer = Unterschale s,p,d,f.. x = Zahl e- pro Orbital Besetzungszahl, kein Exponennt ! H He Li Be B C N 1 s1 1 s2 1 s2 1 s2 1 s2 1 s2 1 s2 2 s1 2 s2 2 s2 2 s2 2 s2 Valenzelektronen 2p1 2p2 2p3 38 3.5.20.1 Das Pauli – Prinzip • In einem Atom können keine zwei Elektronen in allen vier Quantenzahlen (Hauptquantenzahl, Drehimpulsquantenzahl, Magnetquantenzahl und Spinquantenzahl), die zu seiner Zustandsbeschreibung im Atommodell notwendig sind, übereinstimmen. • Als Folge des Pauliprinzips werden die Orbitale immer mit Elektronenpaaren besetzt, die entgegengesetzten Spin aufweisen. 3.5.20.2 Die HUNDsche Regel • Energiegleiche Orbitale einer Unterschale werden zunächst einfach besetzt 39 3.5.20.3 Elektronenkonfiguration von N PAULI Prinzip - HUNDsche Regel E n=3 n=2 n=1 s p d Elektron mit positiver Spinrichtung Elektron mit negativer Spinrichtung 3.5.20.4 Elektronenkonfiguration von Na 23 11 Schreibweisen Na 1s2 2s2 2p6 3s1 n=4 n=3 n=2 n=1 40 3.5.20.5 Das Energieprinzip Grundzustand: werden stets zunächst energieärmste Orbitale Orbitalenergien näherungsweise Elektroneneinbauschema 3.5.20.6 Elektronenkonfiguration von K Energieprinzip E n=4 n=3 4s n=2 n=1 s p Elektron mit positiver Spinrichtung d Elektron mit negativer Spinrichtung 41 Welches Element ist das ? [Ar] 3d10 4s2 4p6 = ? ? n=4 n=3 n=2 n=1 s p d f 4 Das Periodensystem der chemischen Elemente Atome sind die -einst als unteilbar geglaubten- kleinsten Bestandteile der der chemischen Elemente, die dessen Eigenschaften aufweisen Entwicklung 1829 DÖBEREINER ordnet Elemente nach Eigenschaften 1864 MEYER führt Tabellensystem ein 1869 MENDELEJEFF erstellt Urform des heutigen PS Voraussagen über fehlende Elemente möglich 118 chemische Elemente konnte man identifizieren. Oberhalb der Ordnungszahl 82 sind sie alle radioaktiv ! 42 4.1 Systematik der Elektronenkonfiguration Elektronenkonfiguration Anzahl der Bindungselektronen ablesbar Wertigkeit in Molekülen erkennbar Eigenschaften vorhersagbar 4.2 Perioden und Gruppen Perioden Hauptgruppen I II III IIII V VI VII VIII 1 2 1H 3Li 2He 4Be 5B 6C 7N 8O 9F 10Ne 3 11Na 12Mg 13Al 14Si 15P 16S 17Cl 18Ar 4 19K 20Ca 31Ga 32Ge 33As 34Se 35Br 36Kr 5 37Rb 38Sr 49In 50Sn 51Sb 52Te 53I 54Xe 6 55Cs 56Ba 81Tl 82Pb 83Bi 84Po 85At 86Rn 7 87Fr 88Ra 113 114 115 116 117 118 43 4.2.1 Hauptgruppenelemente (s,p) I Alkalimetalle Li, Na, K, Rb, Cs, Fr sehr reaktive Metalle Erdalkalimetalle Be, Mg, Ca, Ba, Sr, Ra weniger reaktive Metalle Erdmetalle B, Al, Ga, In, Tl Leichtmetalle Kohlenstoffgruppe C, Si, Ge, Sn, Pb zunehmend metallisch II III IIII V Stickstoffgruppe N, P, As, Sb, Bi zunehmend metallisch Chalkogene O, S, Se, Te, Po Erzbildner Halogene F, Cl, Br, I, At Salzbildner Edelgase He, Ne, Ar, Kr,Xe, Rn innerte Gase VI VII VIII 4.2.2 Nebengruppenelemente (s,d) Scandium-Gruppe IIIb Sc s2p6d1 Sc 1s2 2s2 p6 3s2 p6 d1 4s2 Y 1s2 2s2 p6 3s2 p6 d10 4s2 p6 d1 La 1s2 2s2 p6 3s2 p6 d10 4s2 p6 d10 Ac 1s2 2s2 p6 3s2 p6 d10 4s2 p6 d10 f14 5s2 5s2 p6 d1 6s2 5s2 p6 d10 6s2 p6 d1 7s2 Valenzelektronen: s, d 44 4.2.3 Lanthanoide und Actinoide (s,d,f) 57La [Xe] 5d1 6s2 58Ce [Xe] 4f2 6s2 59Pr [Xe] 4f3 6s2 60Nd [Xe] 4f4 6s2 89Ac [Rn] 6d1 7s2 90Th [Rn] 6d2 7s2 91Pa [Rn] 5f2 6d1 7s2 92U [Rn] 5f3 6d1 7s2 Valenzelektronen: s, d, f 4.2.3.1 Webelements (1) http://www.webelements.com 45 4.2.3.2 Webelements (2) http://www.webelements.com 4.2.3.3 IUPAC Periodensystem http://www.iupac.org/fileadmin/user_upload/news/IUPAC_Periodic_Table-1Jun12.pdf 46 4.3 Die periodischen Eigenschaften der Elemente • • • • • Gasförmige Elemente • Flüssige Elemente • Feste Elemente Atomdurchmesser Ionisierungsenergie Elektronenaffinität Elektronegativität • Radioaktive Elemente • Metallcharakter • Halbleitereigenschaften 4.3.1 Atomdurchmesser I II III IIII V VI VII VIII 1 2 1H 3Li 4Be 5B 6C 7N 8O 9F 2He 10Ne 3 11Na 12Mg 13Al 14Si 15P 16S 17Cl 18Ar 4 19K 20Ca 31Ga 32Ge 33As 34Se 35Br 36Kr 5 37Rb 38Sr 49In 50Sn 51Sb 52Te 53I 54Xe 6 55Cs 56Ba 81Tl 82Pb 83Bi 84Po 85At 86Rn 7 87Fr 88Ra 113 114 115 116 117 118 47 4.3.2 Ionisierungsenergie Na EI EI Na+ + eKation = Ionisierungsenergie = 8,3 . 10-19 J (pro Atom) wächst mit Z sinkt, wenn rAtom wächst nimmt ab wie folgt: s>p>d>f Die Ionisierungsenergie ist die Energie, die benötigt wird, um ein Atom oder Molekül zu ionisieren, d. h. um ein Elektron vom Atom oder Molekül zu trennen 4.3.2.1 Ionisierungsenergie Diagramm http://www.chemgapedia.de 48 4.3.2.2 Ionisierungsenergie im PS I II III IIII V VI VII VIII 1 2 1H 3Li 2He 4Be 5B 6C 7N 8O 9F 10Ne 3 11Na 12Mg 13Al 14Si 15P 16S 17Cl 18Ar 4 19K 20Ca 31Ga 32Ge 33As 34Se 35Br 36Kr 5 37Rb 38Sr 49In 50Sn 51Sb 52Te 53I 54Xe 6 55Cs 56Ba 81Tl 82Pb 83Bi 84Po 85At 86Rn 7 87Fr 88Ra 113 114 115 116 117 118 4.3.2.3 Höhere Ionisierungsenergien Ionisierungsenergien der Elemente Z = 1, ..12 Z Element Ionisierungsenergie in eV zur Abtrennung des x-ten Elektrons 1 2 3 4 5 6 7 1 2 3 4 5 6 7 8 9 10 11 12 H He Li Be B C N O F Ne Na Mg 13,6 24,6 5,4 9,3 8,3 11,3 14,5 13,6 17,4 21,6 5,1 7,6 54,4 75,6 18,2 25,1 24,4 29,6 35,2 35,0 41,0 47,3 15,0 122,4 153,9 37,9 47,9 47,4 54,9 62,6 64,0 71,6 80,1 217,7 259,3 64,5 77,5 77,4 87,2 97,1 98,9 109,3 340,1 391,9 97,9 113,9 114,2 126,4 138,6 141,2 489,8 551,9 138,1 157,1 157,9 172,4 186,7 666,8 739,1 185,1 207,0 208,4 225,3 49 4.3.3 Elektronenaffinität EE Cl. + e- (kJ / mol) - 72 -333 -364 -342 -295 H F Cl Br I Cl- Anion EE = Elektronenaffinität = - 6,0 . 10-19 J (pro Atom) bei Halogenen besonders groß ! Die Energiedifferenz zwischen dem Grundzustand eines neutralen Atoms und dem Grundzustand des zugehörigen Anions wird als Elektronenaffinität bezeichnet 4.3.4 Elektronegativität - Bedeutung Maßzahl: Atom 1 EN Bindungselektronen Atom 2 Anziehungskraft auf Bindungselektronen bei F am größten, bei Fr am kleinsten ! H Fr F Cl Br I EN 2,1 0,7 4,0 3,0 2,8 2,4 50 4.3.4.1 Elektronegativität - Berechnung Maßzahl: EN Berechnung nach Mulliken, 1966 X + eX EN ~ EE EI XX+ + e- 1 EE EI 2 4.3.4.2 Elektronegativität im PS I II III IIII V VI VII VIII 1 2 1H 2He 3Li 4Be 5B 6C 7N 8O 9F 10Ne 3 11Na 12Mg 13Al 14Si 15P 16S 17Cl 18Ar 4 19K 20Ca 31Ga 32Ge 33As 34Se 35Br 36Kr 5 37Rb 38Sr 49In 50Sn 51Sb 52Te 53I 54Xe 6 55Cs 56Ba 81Tl 82Pb 83Bi 84Po 85At 86Rn 7 87Fr 88Ra 113 114 115 116 117 118 51 4.3.4.3 Elektronegativität Diagramm F 4,5 Cl 4 Br I Elektronegativit 3,5 3 2,5 2 1,5 1 0,5 0 1 21 41 61 81 101 Ordnungszahl 4.3.4.4 Die Elektronegativitätsskala H 2,1 Li 1,0 Na 0,9 Mg 1,2 K Ca 0,8 1,0 Rb Sr 0,8 1,0 Be 1,5 Al 1,5 Sc 1,3 B 2,0 Si 1,8 C 2,5 P 2,1 Ti Ge As 1,6 1,7 2,0 Y Zr Sn Sb Te 1,3 1,6 1,7 1,8 2,1 N 3,0 S 2,5 Se 2,4 O 3,5 F 4,0 Cl 3,0 Br 2,8 I 2,4 Cs Ba 0,7 0,9 1 EN 2 3 4 52 4.3.5 Metallische Eigenschaften plastisch verformbar elektrische Leiter Leitfähigkeit sinkt mit steigender Temperatur relativ große Atomradien Atomgitter geringe Ionisierungsenergie Wärmeleiter Supraleiter ca. 30 metallische Elemente Metallglanz 4.3.5.1 Metallcharakter im PS Metallcharakter I Nichtmetallcharakter II III IIII V VI VII VIII 1 2 1H 3Li 4Be 5B 6C 7N 8O 9F 10Ne 3 11Na 12Mg 13Al 14Si 15P 16S 17Cl 18Ar 4 19K 20Ca 31Ga 32Ge 33As 34Se 35Br 36Kr 5 37Rb 38Sr 49In 50Sn 51Sb 52Te 53I 54Xe 6 55Cs 56Ba 81Tl 82Pb 83Bi 84Po 85At 86Rn 7 87Fr 88Ra 113 114 115 116 117 118 Metalle 2He Halbmetalle Nichtmetalle 53 4.5.1 Metallklassifizierungen Dichte Leichtmetalle < 4 - 5 g/cm3 e.g. Al, Mg Schwermetalle > 4 - 5 g/cm3 e.g. Pb, Cd Elektrochemische Spannungsreihe K, Na, Mg, Al, Zn, Fe, Pb, Cu, Ag, Au kathodisch anodisch Weniger edel Korrodierende Metalle Edelmetalle Nicht korrodierende Metalle 4.5.2 Die elektrochemische Spannungsreihe Potenzial gegenüber Standardwasserstoffelektrode * Li( s ) Li(aq ) e K(s) K ( aq ) Ca( s ) Ca e 2 ( aq ) E 0 3,04 V E 0 2,92 V 2e Al( s ) Al 3 ( aq ) 3e 2 ( aq ) Mn( s ) Mn 2 ( aq ) Zn( s ) Zn 2 ( aq ) S ( s ) 2e E 0 0,15 V E 2,71 V Cu( s ) Cu(2aq ) 2e E 0 0,34 V E 1,68 V 0 E 1,19 V 0 E 0,76 V 0 2I ( aq ) 2 ( aq ) Fe I 2 ( aq ) 2e 3 ( aq ) Fe Ag ( s ) Ag ( aq ) ( aq ) e E 0 0,54 V e E 0 0,77 V E 0 0,80 V Br2 ( aq ) 2e E 0 1,07 V E 0 0,48 V 2 Br Fe( s ) Fe(2aq ) 2e E 0,41 V 6 H 2O O2 ( g ) 4 H 3O(aq ) 4e E 0 1,23 V Cd ( s ) Cd (2aq ) 2e E 0 0,40 V 2Cl(aq ) Cl2 ( aq ) 2e S 2 ( aq ) Sn( s ) Sn 2e 2 ( aq ) Pb( s ) Pb * 2e 2e E 2,87 V 0 E 0 0,00 V Sn(2aq ) Sn(4aq ) 2e 0 Na ( s ) Na(aq ) e H 2 2 H 2O 2 H 3O(aq ) 2e E 0,14 V E 0,13 V 2e ( aq ) H 2 2 H 2O 2 H 3O 0 0 0 Au( s ) Au ( aq ) 2F 3 ( aq ) E 0 1,50 V E 0 2,87 V 3e F2 ( aq ) 2e E 0 1,36 V 2e E 0 0,00 V 54 4.6.1 Halbmetalleigenschaften I 1 2 3 4 5 6 7 II III IIII V VI VII 1H VIII 2He 3Li 4Be 5B 6C 7N 8O 9F 10Ne 11Na 12Mg 13Al 14Si 15P 16S 17Cl 18Ar 19K 20Ca 31Ga 32Ge 33As 34Se 35Br 36Kr 37Rb 38Sr 49In 50Sn 51Sb 52Te 53I 54Xe 55Cs 87Fr 56Ba 88Ra 81Tl 82Pb 83Bi 84Po 85At 86Rn 113 114 115 116 117 118 B, Si, Ge, As, Te mehrere Elementmodifikationen z.B. kristallines und amorphes Si Leitfähigkeit steigt mit der Temperatur Halbleitereigenschaften Elektronenleitung Defektelektronenleitung 4.6.2 Dotiermittel I II III IIII V VI VII VIII 1 2 1H 3Li 2He 4Be 5B 6C 7N 8O 9F 10Ne 3 11Na 12Mg 13Al 14Si 15P 16S 17Cl 18Ar 4 19K 20Ca 31Ga 32Ge 33As 34Se 35Br 36Kr 5 37Rb 38Sr 49In 50Sn 51Sb 52Te 53I 54Xe 6 55Cs 56Ba 81Tl 82Pb 83Bi 84Po 85At 86Rn 7 87Fr 88Ra 113 114 115 116 117 118 p-type Dotiermittel Akzeptor Atome n-type Dotiermittel Donator Atome 55 5 Elementarteilchen 5.1.1 Elementarteilchengruppen Elementarteilchen Leptonen leichte Teilchen Mesonen gerade Anzahl von Quarks Neutrinos ... Elektronen ... Baryonen schwere Teilchen Hyperonen ... Bosonen "Kraftteilchen" Nukleonen Neutronen Protonen Quarks Quarks Photonen ... 56 5.1.2 Leptonen - leichte Teilchen Name Symbol Ruhemasse [MeV] Ladung Elektron Müon Tau eµ- 0,511 105,6 1784 -1 +1 -1 +1 -1 +1 e+ µ+ + Spin mittlere Lebensdauer [s] 1/2 1/2 1/2 stabil 2. 10-6 3. 10-13 Elektron- Neutrino ee ? 0 0 1/2 stabil ? Müon-Neutrino µµ ? 0 0 1/2 stabil ? Tau-Neutrino ? 0 0 1/2 stabil ? Leptonen + Quarks = Grundbausteine der Materie + Antimaterie 5.1.3 Mesonen - Teilchen aus 2 Quarks Name Symbol Pionen 135 Kaonen K0K0 Kaonen Pionen Ruhemasse [MeV] Ladung 0 Quarkaufbau Spin mittlere Lebensdauer [s] uu dd 0 8.10-17 ud du 0 2,6 .10-8 ds d s 0 10-10 -5.10-8 us 0 1,2.10-8 140 +1 -1 498 0 0 K K 494 +1 -1 J / Psi J/ 3098 0 cc 1 1.10-20 D-Null D 1863 0 cu 0 1.10-12 D-Plus D 1863 1 cd 0 4.10-13 Ypsilon Y 9460 0 bb 1 1.10-20 su 57 5.1.4 Baryonen Name Symbol Ruhemasse [MeV] Proton p p 938,3 Neutron n n 939,6 Lambda 1115 Sigma-Plus 1189 Sigma-Minus 1197 Sigma-Null 1192 Xi-Minus 1321 Xi-Null 1315 Omega-Minus 1672 Charm-Lambda c c 2280 - schwere Teilchen Ladung +1 0 0 +1 -1 0 -1 0 -1 +1 5.1.5 Eichbosonen Name Symbol Photon W-Teilchen Z-Teilchen Gluon W W Z g Ruhemasse [MeV] -1 0 0 +1 -1 0 1 0 -1 +1 Quarkaufbau Spin mittlere Lebensdauer [s] u u d uud ½ stabil d d u ddu ½ ca. 900 u d s uds ½ 2,6.10-10 u u s uus ½ 8.10-11 d d s dds ½ 1,5.10-10 u d s uds ½ 6.10-20 d s s dss ½ 1,6.10-10 u s s uss ½ 3.10-10 s s s sss ½ 8.10-11 u d c udc ½ 2.10-13 - Austauschteilchen Ladung ~83 000 ~93 000 0 0 1 0 0 Spin 1 -1 1 1 mittlere Lebensdauer [s] stabil 10-25 10-25 stabil Austauschteilchen, übertragen Kräfte 58 5.1.6 Quarks - Bausteine für Elementarteilchen Name Symbol up down strange charm bottom (beauty) top (truth) u u d d s s c c b b t t Ruhemasse [MeV] ~5 ~10 ~100 ~1500 ~4700 ? Ladung 2/3 - /3 -1/3 -1/3 1/3 2/3 -2/3 1/3 -1/3 1/3 2/3 -2/3 Spin mittlere Lebensdauer [s] ½ ½ ½ ½ ½ ½ stabil verschieden verschieden verschieden verschieden verschieden Elementarteilchen aus Quarktripletts : Baryonen Elementarteilchen aus Quarkdubletts: Mesonen 5.1.6.1 „Visual“- Quarks top up down bottom strange charm 59 6 Anti-Materie • Zu jedem Teilchen gibt es ein Anti-Teilchen (gleiche Masse, aber entgegengesetzte Ladung) • Tritt ein Teilchen mit seinem Anti-Teilchen in Wechselwirkung, so werden beide vernichtet, es entstehen Photonen oder Mesonen • Das Photon ist mit seinem Anti-Teilchen identisch Übungsfragen 1 1. 2. 3. 4. 5. 6. 7. 8. 9. 10. 11. 12. Wie kann man Energie definieren ? Was ist die physikalische Einheit der Energie ? Welches Grundprinzip ist bei allen Energieumwandlungen zu berücksichtigen ? Was versteht man unter einem Raumwinkel ? Was versteht man unter einem Mol ? Was ist ein u ? Was ist das SI-System ? Wie kann man Materie definieren ? Welche Erkenntnis gewann man aus dem Experiment von RUTHERFORD ? Beschreiben Sie das BOHRsche Atommodell, wo sind die Schwächen ? Wie viele Elektronen können sich maximal in der L-Schale aufhalten ? Erläutern Sie den Welle-Teilchen Dualismus ! 60 Übungsfragen 2 13. 14. 15. 16. 17. 18. 19. 20. 21. 22. 23. 24. Was versteht man unter der HEISENBERGschen Unschärferelation ? Was ist eine „stehende Welle“ ? Was versteht man unter einem Orbital ? Was versteht man unter Quantenzahlen, welche kennen Sie und welche Bedeutung haben diese ? Nach welchen Prinzipien werden die Elektronenschalen besetzt (Erläuterungen) ? Was sind die Elektronenkonfigurationen von Silizium, Zinn und Blei ? Was sind Nukleonen, welche gibt es ? Woraus bestehen Protonen ? Was sind Quarks ? Zu welchen Elementarteilchengruppen gehören Elektronen, Protonen bzw. Neutronen ? Welche Spektrallinien (Serien) kennt man beim Wasserstoff ? Unterscheiden sich die H-Isotope in den Spektralserien ? Übungsfragen 3 25. 26. 27. 28. 29. 30. 31. 32. 33. 34. 35. 36. Was versteht man unter der Ordnungszahl eines Atoms ? Was versteht man unter der Massezahl eines Atoms ? Wodurch unterscheiden sich Haupt- und Nebengruppen im PS ? Was sind Salzbildner ? Welche Elemente sind Erzbildner ? In welcher Gruppe befinden sich Uran und Plutonium ? Was ist das chemische Kurzzeichen für Eisen ? Was versteht man unter Ionisierungsenergie ? Was versteht man unter Elektronenaffinität ? Was versteht man unter Elektronegativität ? Welches Element hat die größte Elektronegativität ? Wie viele Elemente sind bekannt ? Bis welcher Ordnungszahl existieren stabile Isotope ? 61 Referenzen 1. 3. 4. J. Hoinkins; E. Lindner; Chemie für Ingenieure; Verlag: Wiley-VCH Verlag GmbH & Co. KGaA, 2007 P.W. Attkins; L. Jobnes; Chemie – einfach alles; Verlag: Wiley-VCH Verlag GmbH & Co. KGaA, 2006 Römpp‘s Chemie Lexikon DTV-Atlas zur Chemie 5. http://akratochwill.homepage.t-online.de/b1b/b66_11.htm 2. @ CURS Information Server designed by S. Prys 2013 ;-) 62