M L L L L L M L L L L L
Werbung
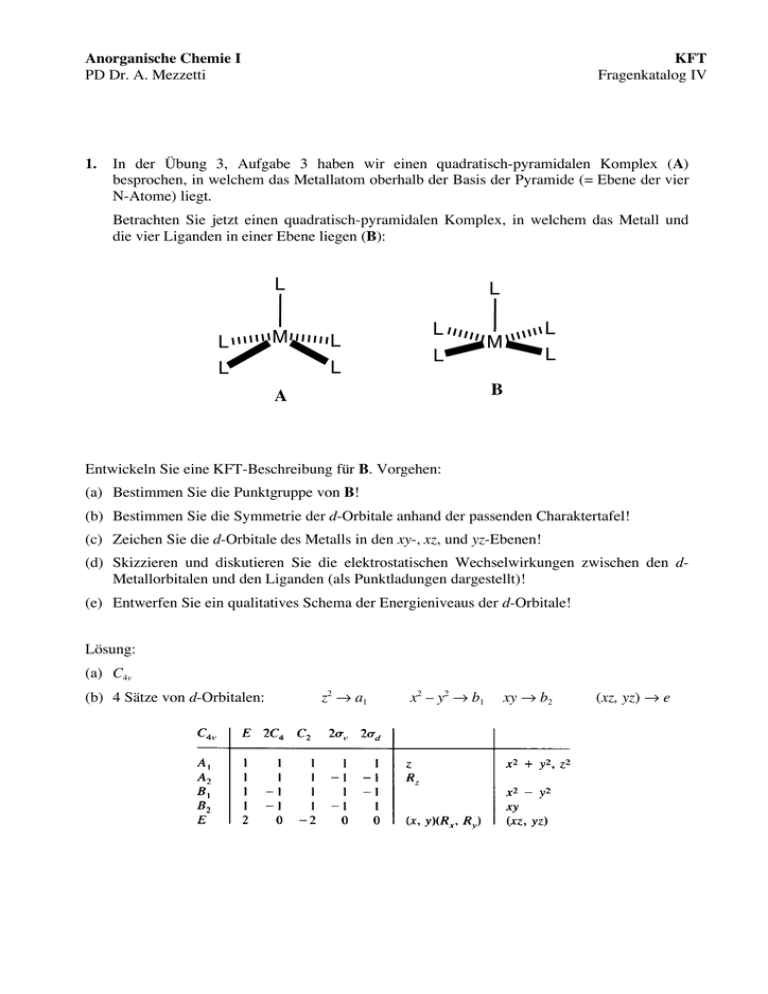
Anorganische Chemie I PD Dr. A. Mezzetti 1. KFT Fragenkatalog IV In der Übung 3, Aufgabe 3 haben wir einen quadratisch-pyramidalen Komplex (A) besprochen, in welchem das Metallatom oberhalb der Basis der Pyramide (= Ebene der vier N-Atome) liegt. Betrachten Sie jetzt einen quadratisch-pyramidalen Komplex, in welchem das Metall und die vier Liganden in einer Ebene liegen (B): L L L M L L L L L L L M B A Entwickeln Sie eine KFT-Beschreibung für B. Vorgehen: (a) Bestimmen Sie die Punktgruppe von B! (b) Bestimmen Sie die Symmetrie der d-Orbitale anhand der passenden Charaktertafel! (c) Zeichen Sie die d-Orbitale des Metalls in den xy-, xz, und yz-Ebenen! (d) Skizzieren und diskutieren Sie die elektrostatischen Wechselwirkungen zwischen den dMetallorbitalen und den Liganden (als Punktladungen dargestellt)! (e) Entwerfen Sie ein qualitatives Schema der Energieniveaus der d-Orbitale! Lösung: (a) C4v (b) 4 Sätze von d-Orbitalen: z2 → a1 x2 – y2 → b1 xy → b2 (xz, yz) → e (c) Komplex B: xy-Ebene: x x2–y2 xy z2 y xz-Ebene (dasselbe in der yz-Ebene!): z yz (oder xz) z2 y Wir verwenden immer die oktaedrische Struktur als Referenz. In Struktur B werden alle Orbitale mit z-Komponente stabilisiert, weil eine Ladung entlang der z-Achse entfernt wird. Das z2-Orbital wird stark stabilisiert (direkte WW mit der Punktladung!). Die 4 Liganden in der xy-Ebene bleiben, wo sie sind. Trotzdem zeigt die Tabelle der relativen Energien der dOrbitale (S. 100 vom Skript), dass die Energie des x2–y2-Orbitals angehoben wird. Dies folgt aus dem Prinzip der Erhaltung des Energieschwerpunktes. Die Energie der e-Orbitale wird gesenkt (aber weniger als z2, weil ihre Wechselwirkung mit der Punktladung schwächer ist): C4v z L L x Oh L FeII L L L L FeII L [ML6] y [ML5] (B) b1 2 C4v L L L L L L FeII L L [ML5] (A) 2 x –y eg a1 z2 b2 xy e xz, yz t2g b1 x2–y2 a1 e z2 xz, yz b2 xy Bitte beachten Sie, dass diese Situation sich derjenigen von Komplex A unterscheidet. In A liegt das Metallatom oberhalb der quadratischen Ebene. Dadurch entstehen elektrostatische Wechselwirkungen zwischen den e-Orbitalen (yz, yz) und den vier Liganden in der Grundfläche der Pyramide (siehe Schema unten). Dadurch werden die e-Orbitale destabilisiert. Gleichzeitig nehmen die WW zwischen den Ladungen auf der Grundfläche der Pyramide und allen Orbitalen mit einer Komponente in der xy-Ebene (x2–y2, xy, z. T. auch z2) ab. Deshalb sinkt die Energie der x2–y2- und xy-Orbitale. Dies ist im Komplex B nicht der Fall, weil die 4 Liganden in der xy-Ebene bleiben. Komplex A: Die 4 Ladungen liegen NICHT in der xy-Ebene! x x 2 –y 2 xy z2 y z y z2 yz (oder xz) Grundsätzliches Problem: Die Strukturen, die wir bis jetzt besprochen haben (z. B. oktaedrische Komplexe und B) lassen sich mit Hilfe eines einzelnen Parameters beschreiben (die M–L-Bindungslänge). Die Symmetrie bestimmt dann die Position der Liganden. Dies trifft für Struktur A nicht zu: Neben der M–L-Bindungslänge muss man auch bestimmen, wie gross der L–M–L-Winkel in der Grundfläche der Pyramide ist. Anders ausgedrückt, wird die Feldstärke in A nicht durch ein einziges Parameter (Δ) gegeben, sondern sind zwei Parameter nötig. Deshalb sind unsere Überlegungen über die Energieniveaus von A als qualitativ zu betrachten! Trotzdem sind diese Überlegungen wertvoll. Sie zeigen, dass in Struktur A alle LigandenMetall-Wechselwirkungen schwächer sind als in Struktur B. Dadurch ist die gesamte Kristallfeld-Aufspaltung kleiner. Dies passt zur Beobachtung, dass funffach-koordiniertes Fe(II) in Myoglobin high spin ist! 2. Der grüne paramagnetische Komplex [NiCl2(PPh3)2] (A) reagiert mit (o-CH3C6H4)MgBr (1 Äquivalent) unter Bildung eines roten, diamagnetischen Komplexes B. (a) Welche Formel hat B? (b) Ermitteln Sie mittels KFT die Strukturen von A und B! (c) Erklären Sie, wieso A und B unterschiedliche Strukturen besitzen! (d) Erklären Sie die magnetischen Eigenschaften und Farben von A und B! L. (a) [NiCl2(PPh3)2] (A) + (o-CH3C6H4)MgBr → [NiCl(o-CH3C6H4)(PPh3)2] (B) + MgBrCl grün orange (b) tetraedrisch (high spin) planar quadratisch (low-spin) planarquadratisch tetraedrisch b1g, x2–y2 t2 (xy, xz, yz) !t 10 Dq b2g, xy e (z2, x2–y2) a1g, z2 eg, (xz, yz) paramagnetisch diamagnetisch In quadratisch planaren Komplexen ist ΔE zwischen d(xy) und d(x2–y2) (= 10 Dq) viel grösser als die Δt Aufspaltung (= 4.45 Dq, siehe Huheey S. 470, Tab 11.5). Dies erklärt: (d) Farbe: Mögliche Übergänge sind e4t4 → e3t5 (a) für den tetraedrischen Komplex und eg4a1g2b2g2b1g0 → eg4a1g2b2g1b1g1 (b) für den planar quadratischen Komplex. Übergang b beansprucht energiereichere Photonen (blaues Licht) als a (rotes Licht). Die Komplexe besitzen die Komplementärfarbe (orange bzw. grün). (d) Magnetische Eigenschaften für d8 Komplexe: tetraedrisch, high spin → 2 ungepaarte Elektronen. Quadratisch planar, low spin: keine ungepaarten Elektronen (siehe Schemata oben). Wieso aber ist [NiCl2(PPh3)2] tetraedrisch und [NiCl(o-CH3C6H4)(PPh3)2] quadratisch planar? Es gibt (1) elektronische und (2) sterische Gründe. – Spin-Paarung tritt erst ein, wenn die gesamte Feldstärke der Liganden gross genug ist. In [NiCl(o-CH3C6H4)(PPh3)2] ist der Chloro-Ligand (ein schwach-Feld-Ligand) durch einen Aryl-Liganden (stark-Feld-L.) substituiert worden, was die low-spin quadratisch planare Struktur begünstigt, weil alle Ligandenfeldaufspaltungen grösser werden. – Der Chloro-Ligand ist grösser (van der Waals-Radius!) als ein C-Atom, die Arylgruppe ist flach und findet zwischen den 2 PPh3-Liganden besser Platz. Die tetraedrische Struktur ist für [NiCl2(PPh3)2] weniger gehindert als die quadratisch planare. Die sterischen Abstossungen zwischen den Liganden gleichen den Verlust an Ligandenfeldstabilisierungsenergie aus.











