GfE-Nachrichten
Werbung
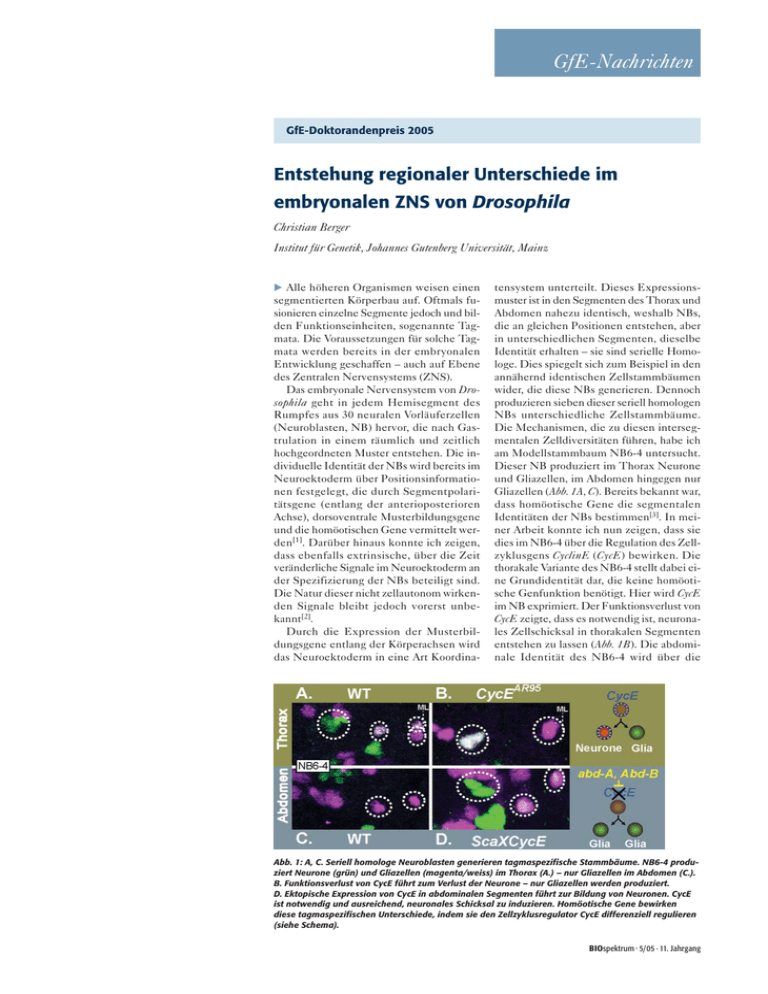
GfE-Nachrichten GfE-Doktorandenpreis 2005 Entstehung regionaler Unterschiede im embryonalen ZNS von Drosophila Christian Berger Institut für Genetik, Johannes Gutenberg Universität, Mainz Alle höheren Organismen weisen einen segmentierten Körperbau auf. Oftmals fusionieren einzelne Segmente jedoch und bilden Funktionseinheiten, sogenannte Tagmata. Die Voraussetzungen für solche Tagmata werden bereits in der embryonalen Entwicklung geschaffen – auch auf Ebene des Zentralen Nervensystems (ZNS). Das embryonale Nervensystem von Drosophila geht in jedem Hemisegment des Rumpfes aus 30 neuralen Vorläuferzellen (Neuroblasten, NB) hervor, die nach Gastrulation in einem räumlich und zeitlich hochgeordneten Muster entstehen. Die individuelle Identität der NBs wird bereits im Neuroektoderm über Positionsinformationen festgelegt, die durch Segmentpolaritätsgene (entlang der anterioposterioren Achse), dorsoventrale Musterbildungsgene und die homöotischen Gene vermittelt werden[1]. Darüber hinaus konnte ich zeigen, dass ebenfalls extrinsische, über die Zeit veränderliche Signale im Neuroektoderm an der Spezifizierung der NBs beteiligt sind. Die Natur dieser nicht zellautonom wirkenden Signale bleibt jedoch vorerst unbekannt[2]. Durch die Expression der Musterbildungsgene entlang der Körperachsen wird das Neuroektoderm in eine Art Koordina- tensystem unterteilt. Dieses Expressionsmuster ist in den Segmenten des Thorax und Abdomen nahezu identisch, weshalb NBs, die an gleichen Positionen entstehen, aber in unterschiedlichen Segmenten, dieselbe Identität erhalten – sie sind serielle Homologe. Dies spiegelt sich zum Beispiel in den annähernd identischen Zellstammbäumen wider, die diese NBs generieren. Dennoch produzieren sieben dieser seriell homologen NBs unterschiedliche Zellstammbäume. Die Mechanismen, die zu diesen intersegmentalen Zelldiversitäten führen, habe ich am Modellstammbaum NB6-4 untersucht. Dieser NB produziert im Thorax Neurone und Gliazellen, im Abdomen hingegen nur Gliazellen (Abb. 1A, C). Bereits bekannt war, dass homöotische Gene die segmentalen Identitäten der NBs bestimmen[3]. In meiner Arbeit konnte ich nun zeigen, dass sie dies im NB6-4 über die Regulation des Zellzyklusgens CyclinE (CycE) bewirken. Die thorakale Variante des NB6-4 stellt dabei eine Grundidentität dar, die keine homöotische Genfunktion benötigt. Hier wird CycE im NB exprimiert. Der Funktionsverlust von CycE zeigte, dass es notwendig ist, neuronales Zellschicksal in thorakalen Segmenten entstehen zu lassen (Abb. 1B). Die abdominale Identität des NB6-4 wird über die Abb. 1: A, C. Seriell homologe Neuroblasten generieren tagmaspezifische Stammbäume. NB6-4 produziert Neurone (grün) und Gliazellen (magenta/weiss) im Thorax (A.) – nur Gliazellen im Abdomen (C.). B. Funktionsverlust von CycE führt zum Verlust der Neurone – nur Gliazellen werden produziert. D. Ektopische Expression von CycE in abdominalen Segmenten führt zur Bildung von Neuronen. CycE ist notwendig und ausreichend, neuronales Schicksal zu induzieren. Homöotische Gene bewirken diese tagmaspezifischen Unterschiede, indem sie den Zellzyklusregulator CycE differenziell regulieren (siehe Schema). BIOspektrum · 5/05 · 11. Jahrgang GfE-Nachrichten Funktion der homöotischen Gene abdominal-A und Abdominal-B bestimmt. Diese Gene reprimieren die Expression von CycE. Eine ektopische Expression von CycE im abdominalen NB6-4 führte zu einer Transformation des abdominalen Zellstammbaums in einen thorakalen, Neurone und Glia generierenden Stammbaum. CycE ist demnach auch ausreichend, neuronales Schicksal entstehen zu lassen (Abb. 1D). Faktoren, die normalerweise mit CycE interagieren, um den Zellzyklus zu kontrollieren (z. B. dacapo, dE2F, dRbf), zeigten keine ähnlichen Effekte[4]. Insofern könnte diese neue zelldeterminierende Funktion von CycE unabhängig von seiner Funktion im Zellzyklus sein. Diese Hypothese wird zurzeit geprüft. Somit konnte ich in meiner Doktorarbeit zeigen, dass regionale Unterschiede im embryonalen ZNS von Drosophila über homöotische Gene und deren Regulation von CycE vermittelt werden. Literatur [1] Technau G.M., Berger C., Urbach R. (2005): Generation of cell diversity and segmental pattern in the embryonic CNS of Drosophila. Dev Dyn (Submitted). [2] Berger C., Urban J., Technau G.M. (2001): Stage-specific inductive signals in the Drosophila neuroectoderm control the temporal sequence of neuroblast specification. Development 128: 3243–3251. [3] Prokop A., Technau, G.M. (1994): Early tagmaspecific commitment of Drosophila CNS progenitor NB1-1. Development 111: 79–88. [4] Berger C., Pallavi S.K., Prasad M., Shashidhara, L.S., Technau G.M. (2005): A critical role for Cyclin E in cell fate determination in the central nervous system of Drosophila. Nat Cell Biol 7: 56–62. Korrespondenzadresse: Dr. Christian Berger Institut für Genetik Johannes Gutenberg-Universität Mainz Johannes-Joachim-Becherweg 32 D-55099 Mainz [email protected] Christian Berger Jahrgang 1972, 1992–2000 Studium der Biologie an der Universität Mainz. 2000–2004 Promotion am Institut für Genetik bei Prof. Technau. Projekt in Kooperation mit Prof Shashidhara am CCMB Hyderabad/Indien. Seit 2005 Postdoc im Labor von Prof. Technau. BIOspektrum · 5/05 · 11. Jahrgang