Kolorektales Karzinom - metastasiert
Werbung
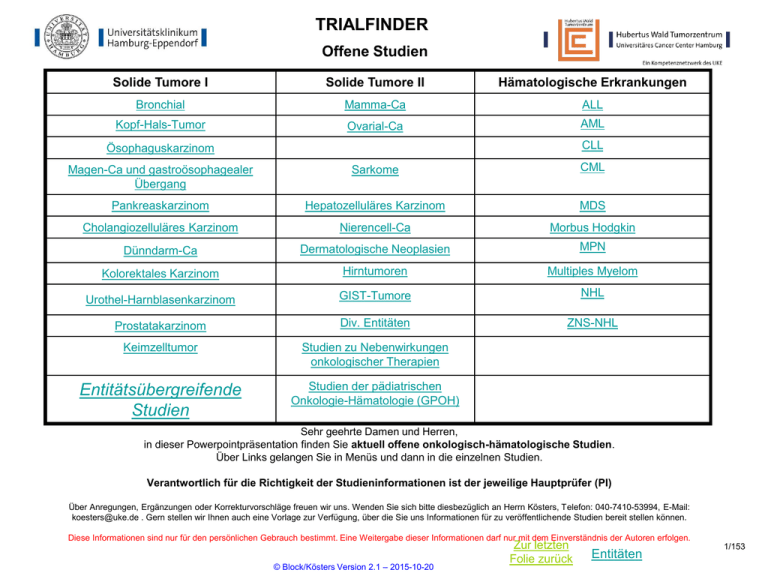
TRIALFINDER Offene Studien Solide Tumore I Solide Tumore II Hämatologische Erkrankungen Bronchial Mamma-Ca ALL Kopf-Hals-Tumor Ovarial-Ca AML CLL Ösophaguskarzinom Magen-Ca und gastroösophagealer Übergang Sarkome CML Pankreaskarzinom Hepatozelluläres Karzinom MDS Cholangiozelluläres Karzinom Nierencell-Ca Morbus Hodgkin Dünndarm-Ca Dermatologische Neoplasien MPN Kolorektales Karzinom Hirntumoren Multiples Myelom Urothel-Harnblasenkarzinom GIST-Tumore NHL Prostatakarzinom Div. Entitäten ZNS-NHL Keimzelltumor Studien zu Nebenwirkungen onkologischer Therapien Entitätsübergreifende Studien Studien der pädiatrischen Onkologie-Hämatologie (GPOH) Sehr geehrte Damen und Herren, in dieser Powerpointpräsentation finden Sie aktuell offene onkologisch-hämatologische Studien. Über Links gelangen Sie in Menüs und dann in die einzelnen Studien. Verantwortlich für die Richtigkeit der Studieninformationen ist der jeweilige Hauptprüfer (PI) Über Anregungen, Ergänzungen oder Korrekturvorschläge freuen wir uns. Wenden Sie sich bitte diesbezüglich an Herrn Kösters, Telefon: 040-7410-53994, E-Mail: [email protected] . Gern stellen wir Ihnen auch eine Vorlage zur Verfügung, über die Sie uns Informationen für zu veröffentlichende Studien bereit stellen können. Diese Informationen sind nur für den persönlichen Gebrauch bestimmt. Eine Weitergabe dieser Informationen darf nur mit dem Einverständnis der Autoren erfolgen. © Block/Kösters Version 2.1 – 2015-10-20 Zur letzten Folie zurück Entitäten 1/153 Ansprechpartner im Onkologischen Zentrum Studienbaum Ösophaguskarzinom PD Dr. Andreas Block Tel.: 040-7410-55470 Dr. Alexander Stein Tel.: 040-7410-56882 Ösophagus – irresektabel oder metastasiert © Block/Kösters Version 2.1 – 2015-10-20 Zur letzten Folie zurück Entitäten 2/153 Studienbaum Ösophaguskarzinom (irresektabel oder metastasiert) Plattenepithel-/ Adenokarzinom Adenokarzinom Ansprechpartner im Onkologischen Zentrum PD Dr. Andreas Block Tel.: 040-7410-55470 Dr. Alexander Stein Tel.: 040-7410-56882 nicht metastasiert / lokal fortgeschritten / irresektabel LEOPARD II UKE*, HOPA* metastasiert / lokal fortgeschritten siehe Pfad Magenkarzinom * UKE= Universitätsklinikum Hamburg Eppendorf-II. Medizinische Klinik, HOPA = Hämatologisch Onkologische Praxis Altona © Block/Kösters Version 2.1 – 2015-10-20 Zur letzten Folie zurück Entitäten 3/153 Studienbaum Magenkarzinom + Gastroösophagealer Übergang resektabel Ansprechpartner im Onkologischen Zentrum PD Dr. Andreas Block Tel.: 040-7410-55470 Dr. Alexander Stein Tel.: 040-7410-56882 Zur Zeit gibt es keine offene Studie * UKE= Universitätsklinikum Hamburg Eppendorf-II. Medizinische Klinik, HOPA = Hämatologisch Onkologische Praxis Altona © Block/Kösters Version 2.1 – 2015-10-20 Zur letzten Folie zurück Entitäten 4/153 Ansprechpartner im Onkologischen Zentrum Studienbaum Magenkarzinom PD Dr. Andreas Block Tel.: 040-7410-55470 Dr. Alexander Stein Tel.: 040-7410-56882 Magenkarzinom + Gastroösophagaler Übergang – resektabel Magenkarzinom + Gastroösophagaler Übergang - metastasiert – Erstlinie Magenkarzinom + Gastroösophagaler Übergang - metastasiert – Salvage © Block/Kösters Version 2.1 – 2015-10-20 Zur letzten Folie zurück Entitäten 5/153 Studienbaum Magenkarzinom + Gastroösophagealer Übergang metastasiert - Erstlinie Ansprechpartner im Onkologischen Zentrum PD Dr. Andreas Block Tel.: 040-7410-55470 Dr. Alexander Stein Tel.: 040-7410-56882 MATEO HER2- HOPE* Erstlinie HER2+ JACOB UKE* * UKE= Universitätsklinikum Hamburg Eppendorf-II. Medizinische Klinik HOPE = Hämatologisch Onkologische Praxis Eppendorf © Block/Kösters Version 2.1 – 2015-10-20 Zur letzten Folie zurück Entitäten 6/153 Jacob A DOUBLE-BLIND, PLACEBO-CONTROLLED, RANDOMIZED, MULTICENTER PHASE III STUDY EVALUATING THE EFFICACY AND SAFETY OF PERTUZUMAB IN COMBINATION WITH TRASTUZUMAB AND CHEMOTHERAPY IN PATIENTS WITH HER2-POSITIVE ADVANCED GASTRIC CANCER Einschlusskriterien • Histologically confirmed (by enrolling center) metastatic adenocarcinoma of thestomach or GEJ • HER2-positive tumor defined as either IHC 3+ or IHC 2+, the latter in combination with ISH+, as assessed by a sponsor-designated central laboratory on a primary or metastatic tumor • Eastern Cooperative Oncology Group (ECOG) PS 0 or 1 • Life expectancy >= 3 months Arm A: Pertuzumab +Trastuzumab - Fluoropyrimidine -Cisplatin R Ausschlusskriterien • Previous systemic cytotoxic chemotherapy for advanced (metastatic) disease • Previous treatment with any HER2-directed therapy, at any time, for any duration • History or evidence of brain metastasis • Radiotherapy within 30 days before the first dose of study treatment (within 2 weeks if given as palliation to peripheral bone metastases, if recovered from all toxicities) Arm B: Placebo +Trastuzumab -Fluoropyrimidine -Cisplatin Beginn 15.08.2013 Ansprechpartner UKE: PI Dr. Alexander Stein SI PD Dr. Andreas Block. SK Anja Weber Ende 040-7410-56882 040-7410-55470 040-7410-55489 © Block/Kösters Version 2.1 – 2015-10-20 [email protected] [email protected] [email protected] Zur letzten Folie zurück Entitäten 7/153 Studienbaum Magenkarzinom + Gastroösophagealer Übergang metastasiert - Salvagetherapie Ansprechpartner im Onkologischen Zentrum PD Dr. Andreas Block Tel.: 040-7410-55470 Dr. Alexander Stein Tel.: 040-7410-56882 RADPAC HER2- HOPA*, HOPE* ab Zweitlinie HER2- CabaGast UKE* * UKE= Universitätsklinikum Hamburg Eppendorf-II. Medizinische Klinik, HOPA = Hämatologisch Onkologische Praxis Altona, HOPE = Hämatologisch Onkologische Praxis Eppendorf © Block/Kösters Version 2.1 – 2015-10-20 Zur letzten Folie zurück Entitäten 8/153 RAD001-RADPAC A randomized, double blind, multi-center phase III study evaluating paclitaxel with and without RAD001 in patients with gastric carcinoma who have progressed after therapy with a fluoropyrimidine-containing regimen Arm A: Paclitaxel + Placebo R Arm B: Paclitaxel + RAD001(Everolimus) Beginn 28.06.2012 Ende offen Ansprechpartner: HOPE PI Prof. Dr. S. Hegewisch-Becker SK Detlef Fabian HOPA PI PD Dr. Gunter Schuch SK Dr. Michael von Staden Einschlusskriterien • Histologically or cytologically confirmed and documented gastric adenocarcinoma or adenocarcinoma of the esophagogastric junction, if they have advanced disease (inoperable, recurrent or metastatic disease) • Documented progressive disease during/after one or two prior treatments containing 5FU/Platinum and /or its precursors or derivates in the palliative settings. Neoadjuvant/adjuvant treatment is not counted, unless progression occurs <6 months after completion of the treatment.In these cases, neoadjuvant/adjuvant treatment is counted as one line. Aussschlusskriterien • Current treatment with any anti cancer therapy or treatment with anti cancer therapy ≤ 2 weeks prior to study treatment start unless rapidly progressing disease is measured 040-4602001 040-42916356 [email protected] [email protected] 040- 38021260 040- 38021283 [email protected] [email protected] © Block/Kösters Version 2.1 – 2015-10-20 Zur letzten Folie zurück Entitäten 9/153 Ansprechpartner im Onkologischen Zentrum Studienbaum Kolorektales Karzinom Dr. Alexander Stein Tel.: 040-7410-56882 PD Dr. Andreas Block Tel.: 040-7410-55470 Kolorektales Karzinom (sämtliche) Kolorektales Karzinom – nicht metastasiert Kolorektales Karzinom - Primärtumormanagment Kolorektales Karzinom - metastasiert – liver only Kolorektales Karzinom - metastasiert – firstline - Sequenztherapie Kolorektales Karzinom - metastasiert – firstline - Erhaltungstherapie Kolorektales Karzinom - metastasiert – salvage Kolorektales Karzinom - nicht resektabel, UICC IV © Block/Kösters Version 2.1 – 2015-10-20 Zur letzten Folie zurück Entitäten 10/153 Ansprechpartner im Onkologischen Zentrum Studienbaum kolorektales Karzinom PD Dr. Andreas Block Tel.: 040-7410-55470 Dr. Alexander Stein Tel.: 040-7410-56882 Rektumkarzinom – nicht metastasiert Kolonkarzinom – nicht metastasiert © Block/Kösters Version 2.1 – 2015-10-20 Zur letzten Folie zurück Entitäten 11/153 Ansprechpartner im Onkologischen Zentrum Studienbaum kolorektales Karzinom PD Dr. Andreas Block Tel.: 040-7410-55470 Dr. Alexander Stein Tel.: 040-7410-56882 CoCSTOM Rektumkarzinom © Block/Kösters Version 2.1 – 2015-10-20 Zur letzten Folie zurück Entitäten 12/153 Ansprechpartner im Onkologischen Zentrum Studienbaum Kolorektales Karzinom PD Dr. Andreas Block Tel.: 040-7410-55470 Dr. Alexander Stein Tel.: 040-7410-56882 Interventionsstudie zur Prävention © Block/Kösters Version 2.1 – 2015-10-20 Saphir Zur letzten Folie zurück Entitäten 13/153 Saphir Interventionsstudie zur Optimierung des präventiven Verhaltens erstgradig Verwandter, die mittelbar durch an kolorektalem Karzinom erkrankte Patienten betroffen sind Verbesserung der Darmkrebsvorsorge bei erstgradig Verwandten von Darmkrebspatienten Einschlusskriterien Intervention (Arzt – Patient) INPUT 45 bis 60 min. Intervention: Coaching und Befähigung • Patienten die an kolorektalem Karinom erkrankt sind • Vorliegen des Einverständnisses zur Weitergabe der persönlichen Daten • Diagnosestellung vor max. 6 Monaten Informationstransfer auf Laienebene (Analyse) Aufklärungsmaterial Ausschlusskriterien OUTPUT Durchgeführte Vorsorgekoloskopie bei erstgradig Angehörigen gem. S3 – Leitlinie Erfassung durch Studienzentrale Beginn April 2014 Ende Ansprechpartner PI PD Dr. med. Andreas Block, MBA Dr. jur. Fabian-S. Frielitz, M.A., MBA SK Christine Fehrs Prof. Dr. med. Alexander Katalinic Dr. med. Maike Schnoor • schwere psychische Erkrankungen offen Tel.:+49 (0)40 7410-55470 Tel.: +49(0)40 7410-58073 Tel.: +49(0)40-7410-55237 [email protected] [email protected] [email protected] Tel.: +49 (0)451 500 - 5440 Tel.: +49 (0)451 500 - 5422 [email protected] [email protected] © Block/Kösters Version 2.1 – 2015-10-20 Zur letzten Folie zurück Entitäten 14/153 Studienbaum - metastasiert - liver only Kolorektales Karzinom Ansprechpartner im Onkologischen Zentrum Dr. Alexander Stein Tel.: 040-7410-56882 PD Dr. Andreas Block Tel.: 040-7410-55470 Primärtumor + Lebermetastasen primär nicht resektabel ras-wt/mt CELIM2 UKE* * UKE= Universitätsklinikum Hamburg Eppendorf-II. Medizinische Klinik © Block/Kösters Version 2.1 – 2015-10-20 Zur letzten Folie zurück Entitäten 15/153 LICC L-BLP25 in Patienten mit kolorektalem Karzinom nach kurativer Lebermetastasenresektion- eine randomisierte, placebokontrollierte, multizentrische, multinationale, doppelblinde Phase II Studie R Beginn L-BLP-25 Arm: Einmalige iv Infusion mit 300mg/m² Cyclophosphamid 3 Tage vor erster L-BLP-25 Vakzinierung 8 aufeinanderfolgende Vakzinierungen mit 930 µg L-BLP-25 Placeboarm: einmalige iv Infusion 0,9%ige Kochsalzlösung 8 aufeinanderfolgende Placebo- Injektionen JAN 2012 Ansprechpartner HOPE: PI Prof. S. Hegewisch-Becker SI Dr. Eray Gökkurt SK David Rodenberg Einschlusskriterien • Histologisch gesicherte Diagnose eines Adenokarzinoms des Kolons oder des Rektums mit kompletter Resektion des primären Tumors und keinem Hinweis auf ein lokales Rezidiv • Metastasierung der Leber mit kürzlich erfolgter Resektion (R0 od R1) aller Lebermetastasen (<8Wo vor Randomisierung), sowohl primär oder auch sekundär (nach Chemtherapie) Aussschlusskriterien • Andere Metastasen, mit Ausnahme Lebermetastasen • R2 und Rx resezierte Lebermetastasen; Patienten mit R1 resezierten Lebermetastasen dürfen eingeschlossen werden, wenn eine Nachresektion durch den Operateur als nicht indiziert oder nicht notwendig gesehen wurde • Erhalt einer Chemotherapie innerhalb von 4 Wo vor Randomisierung Ende offen 040-4602001 040-4602001 040-42916356 © Block/Kösters Version 2.1 – 2015-10-20 [email protected] [email protected] [email protected] Zur letzten Folie zurück Entitäten 16/153 Studienbaum - metastasiert - firstline Kolorektales Karzinom Ansprechpartner im Onkologischen Zentrum Dr. Alexander Stein Tel.: 040-7410-56882 PD Dr. Andreas Block Tel.: 040-7410-55470 Sequenztherapie nicht resektables KRK RAS-Wildtyp FIRE4 UKE* PERMAD UKE* nicht resektables KRK RAS-unabhängig weniger intensive Therapie sinnvoll (2 fach/3 fach) ML 22011 HOPA*, HOPE*, SOHB * * UKE= Universitätsklinikum Hamburg Eppendorf-II. Medizinische Klinik, HOPE = Hämatologisch Onkologische Praxis Eppendorf HOPA = Hämatologisch Onkologische Praxis Altona, SOHB = Schwerpunktpraxis Onkologie Hämatologie Ballindamm © Block/Kösters Version 2.1 – 2015-10-20 Zur letzten Folie zurück Entitäten 17/153 Studienbaum - metastasiert - firstline Kolorektales Karzinom Ansprechpartner im Onkologischen Zentrum Dr. Alexander Stein Tel.: 040-7410-56882 PD Dr. Andreas Block Tel.: 040-7410-55470 Erhaltungstherapie nicht resektables KRK RAS-Wildtyp, 5-FU/FA+/- Panitumab Panama HOPA nicht resektables KRK RAS-unabhängig anti PD-L1/ BRAFi + EGFRi Modul nicht resektables KRK RAS-unabhängig nach 3 – 6 Monaten Induktion Impala UKE* HOPA * UKE= Universitätsklinikum Hamburg Eppendorf-II. Medizinische Klinik, HOPA = Hämatologisch Onkologische Praxis Altona, © Block/Kösters Version 2.1 – 2015-10-20 Zur letzten Folie zurück Entitäten 18/153 ML22011 Sequenzielle Erstlinientherapie des metastasierten kolorektalen Karzinoms mit Capecitabine/ FUFA, Irinotecan und Bevacizumab Arm A: Capecitabine plus Bevacizumab oder FUFA plus Bevacizumab R Arm B: XELIRI plus Bevacizumab oder FOLFIRI plus Bevacizumab Beginn JUN 2013 Ansprechpartner: HOPE PI Prof. Dr. S. Hegewisch-Becker SK Detlef Fabian HOPA PI PD Dr. Gunter Schuch SK Dr. Michael von Staden SOHB PI Dr. Jan Wierecky SK Dorothea Zäch Einschlusskriterien • Histologisch gesichertes metastasiertes kolorektales Karzinom • Metastasen sind nicht resektabel oder der Patient kann oder will sich einer chirurgischen Massnahme nicht unterziehen • Keine vorausgegangene Chemotherapie der metastasierten Erkrankung Aussschlusskriterien • Primär resektable Metastasen und Wunsch des Patienten, sich einem chirurgischen Eingriff zu unterziehen Ende offen 040-4602001 040-42916356 [email protected] [email protected] 040- 38021260 040- 38021283 [email protected] [email protected] 040-357177726 040-357177726 [email protected] [email protected] © Block/Kösters Version 2.1 – 2015-10-20 Zur letzten Folie zurück Entitäten 19/153 Studienbaum - metastasiert - Salvagetherapie Kolorektales Karzinom Zweitlinie Salvagetherapie Ansprechpartner im Onkologischen Zentrum Dr. Alexander Stein Tel.: 040-7410-56882 PD Dr. Andreas Block Tel.: 040-7410-55470 TRICC-C Z.n. irinotecan - haltiger Erstlinie HOPA* INSIGHT Indikation für Regorafenib HOPE* * UKE= Universitätsklinikum Hamburg Eppendorf-II. Medizinische Klinik, HOPA = Hämatologisch Onkologische Praxis Altona, HOPE = Hämatologisch Onkologische Praxis Eppendorf © Block/Kösters Version 2.1 – 2015-10-20 Zur letzten Folie zurück Entitäten 20/153 TRICC-C A multicenter, randomized, phase II trial: BIBF 1120 vs. placebo in patients receiving oxaliplatin plus fluorouracil and leucovorin (mFOLFOX6) for advanced, chemorefractory metastatic colorectal cancer (mCRC) Arm A: mFOLFOX6 + BIBF1120 2x200mg/d, d1-d14, repeated every 14d R Arm B: mFOLFOX6 + Placebo Beginn Q3-2013 Einschlusskriterien • Histologically proven colorectal adenocarcinoma • Intended treatment with mFOLFOX6 after one prior palliative chemotherapy for metastatic CRC • ECOG 0-1 Aussschlusskriterien • Prior treatment with more than one line of palliative standard chemotherapy for CRC, prior treatment with a tyrosine kinase inhibitor, prior palliative treatment with an oxaliplatin containing regime Ende offen Ansprechpartner HOPA: PI PD Dr. Gunter Schuch 040- 38021260 [email protected] SI SK 040- 38021230 040- 38021283 [email protected] [email protected] Dr. Erik Engel Dr. Michael von Staden © Block/Kösters Version 2.1 – 2015-10-20 Zur letzten Folie zurück Entitäten 21/153 Ansprechpartner im Onkologischen Zentrum Studienbaum Pankreaskarzinom PD Dr. Andreas Block Tel.: 040-7410-55470 Dr. Alexander Stein Tel.: 040-7410-56882 Pankreas - resektabel Pankreas - metastasiert oder irresektabel © Block/Kösters Version 2.1 – 2015-10-20 Zur letzten Folie zurück Entitäten 22/153 Studienbaum Pankreaskarzinom - resektabel Ansprechpartner im Onkologischen Zentrum PD Dr. Andreas Block Tel.: 040-7410-55470 Dr. Alexander Stein Tel.: 040-7410-56882 NEOPA neoadjuvant UKE* resektabel apact adjuvant UKE* * UKE= Universitätsklinikum Hamburg Eppendorf-II. Medizinische Klinik, HOS = Hämatologie Onkologie Schnelsen © Block/Kösters Version 2.1 – 2015-10-20 Zur letzten Folie zurück Entitäten 23/153 Studienbaum Pankreaskarzinom - metastasiert oder irresektabel Ansprechpartner im Onkologischen Zentrum PD Dr. Andreas Block Tel.: 040-7410-55470 Dr. Alexander Stein Tel.: 040-7410-56882 Pankreas MEDAC UKE* Metastasiert oder irresektabel Polo gBRCA-Mutation und kein Progreß nach platinhaltiger Therapie UKE* Maestro HOPE* CONKO-007 Irresektabel, nicht metastasiert HOS* UKE* * UKE= Universitätsklinikum Hamburg Eppendorf-II. Medizinische Klinik, HOPE = Hämatologisch Onkologische Praxis Eppendorf HOS = Hämatologie Onkologie Schnelsen © Block/Kösters Version 2.1 – 2015-10-20 Zur letzten Folie zurück Entitäten 24/153 Maestro-TH302 A randomized, double blind, Phase III study of the efficacy and safety of Gemcitabine in combination with TH-302 compared with Gemcitabine in combination with Placebo in previously untreated subjects with metastatic or locally advanced unresectable pancreatic adenocarcinoma Einschlusskriterien • Locally advanced unresectable or metastatic pancreatic ductal adenocarcinoma proven by histology or cytology and previously untreated with chemotherapy or systemic therapy other than: - Radiosensitizing doses of 5-fluorouracil - Radiosensitizing doses of Gemcitabine if relapse occured at least 6 months after completion of Gemcitabine - Neoadjuvant Chemotherapy if relapse occured at least 6 months after surgical resection - Adjuvant Chemotherapy if relapse occured at least 6 months after completion of adjuvant Chemotherpay Aussschlusskriterien • Significant cardiac or peripheral vascular arterial disease • Concomitant treatment with radiotherapy Gemcitabine + TH-302 R Gemcitabine + Placebo Beginn Ende Ansprechpartner HOPE: PI Prof. Dr. S. Hegewisch-Becker SI Dr. Eray Gökkurt SK Detlef Fabian 040-4602001 040-4602001 040-42916356 © Block/Kösters Version 2.1 – 2015-10-20 [email protected] [email protected] [email protected] Zur letzten Folie zurück Entitäten 25/153 LEOPARD II Definitive radiochemotherapy with 5-FU / cisplatin plus/minus cetuximab in unresectable locally advanced esophageal cancer: a phase II study ARM A: Cetuximab, 5-FU,Cisplatin, Radiotherapy R ARM B: 5-FU, Cisplatin, Radiotherapy Einschlusskriterien • Alter 18 - 75 • Karnofky >=70 • Histologisch nachgewiesenes Plattenepithel- oder Adeno-carcinom des Ösophagus • keine Vorbehandlung Ausschlusskriterien • Allergien gegen chimäre Antikörper • Andere Krebserkrankungen (ausser kurativ behandelte Basalzellen-Ca oder Cervix-Ca • Aktive Hauterkrankung > Grade 1 • FEV1 < 1,1 • Metastasen Synopse der Studie Beginn 15.09.2011 Ende 02/2014 Ansprechpartner: UKE: PI Prof Cordula Petersen SI PD Dr. Andreas Block et al. SK Susanne Pohl HOPA: PI PD Dr. Gunter Schuch SK Dr. Michael von Staden 040-7410-57351 040-7410-55470 040-7410-55891 [email protected] [email protected] [email protected] 040- 38021260 040- 38021283 [email protected] [email protected] © Block/Kösters Version 2.1 – 2015-10-20 Zur letzten Folie zurück Entitäten 26/153 Ansprechpartner im Onkologischen Zentrum PD Dr. Andreas Block Tel.: 040-7410-55470 Dr. Alexander Stein Tel.: 040-7410-56882 Studienbaum Cholangiozellulläres Karzinom ACTICCA Adjuvante Chemotherapie nach kurativer Resektion © Block/Kösters Version 2.1 – 2015-10-20 Zur letzten Folie zurück Entitäten 27/153 Studienbaum CML Ansprechpartner im Onkologischen Zentrum Dr. Philipe Schafhausen Tel.: 040-7410-57122 CML V Primärtherapie Neu diagnostizierte CML in chronischer Phase Avillion Folgetherapie Vorbehandelte CML in 1. chronischer Phase © Block/Kösters Version 2.1 – 2015-10-20 DECLINE Zur letzten Folie zurück Entitäten 28/153 Ansprechpartner im Onkologischen Zentrum Studienbaum Keimzelltumore Prof. Carsten Bokemeyer Tel.: 040-7410-52960 PD Dr. Karin Oechsle Tel.: 040-7410-50667 PD Dr. Gunhild von Amsberg Tel.: 040-7410-53962 Nichtseminome und Seminome Registerstudie national Metastasiert – Poor Risk - national Primärtherapie Seminom II A/B GOP-Register Mikro-RNA-Studie Ansprechpartner Ansprechpartner Dr. Christoph Seidel Dr. Christoph Oing © Block/Kösters Version 2.1 – 2015-10-20 SAKK 01/10 040-7410040-7410-52358 Zur letzten Folie zurück [email protected] [email protected] Entitäten 29/153 Registerstudie zur Primärtherapie - national Registerstudie zur primären Hochdosis-Chemotherapie bei "poor risk" Patienten mit metastasiertem Keimzelltumor. Registerstudie, es findet keine Randomisierung statt Die Zentren entscheiden sich je nach Patient, welche Chemotherapie gegeben wird Ein- und Ausschlusskriterien • keine Datensammlung zur Art der Primärtherapie PEB, PEI (konventionell), Hochdosis PEI oder Sonstige Beginn 22.02.2011 Ende Ansprechpartner UKE: PI Prof. Carsten Bokemeyer SI PD Dr. K. Oechsle et al. SK Ina Böhlke offen 040-7410-52960 040-7410-50667 040-7410-57118 © Block/Kösters Version 2.1 – 2015-10-20 [email protected] [email protected] [email protected] Zur letzten Folie zurück Entitäten 30/153 Studienbaum Kopf-Hals Tumore (SCCHN) Ansprechpartner im Onkologischen Zentrum Dr. Philippe Schafhausen Tel.: 040-7410-57122 Prof. Rainer Knecht Tel.: 040-7410-53300 Stadium III/IV, rezidiviert und/oder metastasiert RESGEX Platinrefraktär, rezidiviert und/oder metastasiert CA209-141 © Block/Kösters Version 2.1 – 2015-10-20 Zur letzten Folie zurück Entitäten 31/153 Ansprechpartner im Onkologischen Zentrum Studienbaum MDS Dr. Philipe Schafhausen Tel.: 040-7410-57122 Intermediär – high risk Vidaza allo © Block/Kösters Version 2.1 – 2015-10-20 Zur letzten Folie zurück Entitäten 32/153 Vidaza allo Comparison between 5-azacytidine treatment and 5-azacytidine followed by allogeneic stem cell transplantation in elderly patients with MDS according to donor availability 4 Zyklen 5-Azacytidine 7 x 75 mg/qm + Spendersuche HLA-identischer Familienspender oder passender Fremdspender (10/10) Beginn Ja Donor verfügbar ? Nein 7/2011 Ansprechpartner UKE: PI Prof. Nicolaus Kröger SI Dr. Christine Wolschke SK Marion Heinzelmann Allogene Stammzelltransplantation nach dosisreduzierter Konditionierung Weiterführung der 5-Azacytidine Therapie bis Progress bzw. inakzeptable Toxizität Einschlusskriterien • de novo od. therapieassoziierte MDS/CMML (WBC < 13/nl, intermed. Risk II od. high risk, od. intermed. I-risk mit high risk zytogen. Veränderungen, sek. AML mit Blasten <= 30 % • Keine vorausgegangene Therapie bzw. max. 1 Zyklus 5Azacytidine • Alter 55 – 70 Jahre Ende 7/2017 040-7410-55864 040-7410-54188 040-7410-54188 © Block/Kösters Version 2.1 – 2015-10-20 [email protected] [email protected] [email protected] Zur letzten Folie zurück Entitäten 33/153 Ansprechpartner im Onkologischen Zentrum Studienbaum Morbus Hodgkin Prof. Judith Dierlamm Tel.: 040-7410-59782 Niedriges Risiko HD 16 Intermediäres Risiko HD 17 Primärtherapie Rezidivtherapie Beobachtungsstudie ! Vorübergehender Rekrutierungsstop ! HD-R3i Verträglichkeit und Wirksamkeit von Thiothepa © Block/Kösters Version 2.1 – 2015-10-20 Zur letzten Folie zurück NIS TTACT Entitäten 34/153 HD 16 HD16 frühe Stadien - Therapieoptimierungsstudie in der Primärtherapie des frühen Hodgkin Lymphoms: Therapiestratifizierung mittels FDG-PET ARM A 2x ABVD R PET +/- PET + ARM B 2x ABVD 20 Gy IF-RT 20 Gy IF-RT PET - N a c h s o r g e Einschlusskriterien • • • histologisch gesicherte Erstdiagnose des HL Stadium I/II ohne die Risikofaktoren: grosser Mediastinaltumor, Extranodalbefall, hohe BSG,3 oder mehr LKRegionen therapienaiv für HL Synopse der Studie Beginn 10.12.2009 Ansprechpartner UKE: PI Prof. Dr. Judith Dierlamm SI Dr. Tina Tomann et al. SK Klemens Kösters Ende 30.12.2014 040-7410-59782 040-7410-23061 040-7410-53994 © Block/Kösters Version 2.1 – 2015-10-20 [email protected] [email protected] [email protected] Zur letzten Folie zurück Entitäten 35/153 HD 17 HD16 frühe Stadien - Therapieoptimierungsstudie in der Primärtherapie des frühen Hodgkin Lymphoms: Therapiestratifizierung mittels FDG-PET ARM A 2x BEACOPPesk 2x ABVD R PET +/- PET + ARM B 2x BEACOPPesk 2x ABVD 30 Gy IF-RT 30 Gy IF-RT PET - N a c h s o r g e Einschlusskriterien • • • • histologisch gesicherte Erstdiagnose des HL Stadium I/II A mit den Risikofaktoren: grosser Mediastinaltumor, Extranodalbefall, hohe BSG,3 oder mehr LKRegionen Stadium IIB mit den RF hohe BSG und 3 oder mehr LK-Regionen therapienaiv für HL Synopse der Studie Beginn 12.12.2011 Ansprechpartner UKE: PI Prof. Dr. Judith Dierlamm SI Dr. Tina Tomann et al. SK Klemens Kösters Ende 01.12.2016 040-7410-59782 040-7410-23061 040-7410-53994 © Block/Kösters Version 2.1 – 2015-10-20 [email protected] [email protected] [email protected] Zur letzten Folie zurück Entitäten 36/153 Ansprechpartner im Onkologischen Zentrum Studienbaum MPN Dr. Philipe Schafhausen Tel.: 040-7410-57122 PD Dr. Gunhild von Amsberg Tel.: 040-7410-53962 GS-US-352-0101 Primäre Myelofibrose oder Post-Polycythämia vera Post-Essentielle Thrombozythämie Post-Myelofibrose © Block/Kösters Version 2.1 – 2015-10-20 GS-US-352-1214 Zur letzten Folie zurück Entitäten 37/153 Ansprechpartner im Onkologischen Zentrum Studienbaum Multiples Myelom Primärtherapie PD Dr. Mascha Binder Tel.: 040-7410-58787 Dr. Christine Wolschke Tel.: 040-7410-58129 Induktion – Alter 18 - 65 DSMM XIV Induktion – Alter 60 - 70 DSMM XIII Behandlung von Knochenschmerzen Erhaltungstherapie Amyloidose (light chain) AMG 162 Oral Ixazomib Citrat Millenium C16019 Millenium C16011 relapsed oder refraktär © Block/Kösters Version 2.1 – 2015-10-20 Zur letzten Folie zurück Entitäten 38/153 DSMM XIII The combination of Lenalidomide and Dexamethasone with or without intensification by high-dose Melphalan in the treatment of multiple myeloma Arm A1: Lenalidomid 25 mg oral d 1 – d21 + Dexamethason 40 mg oral d 1,8,15,22 Wdhl. Tag 29, Therapie bis zum Progress, maximal 5 Jahre innerhalb der Studie R Arm A2: Induktion mit 3 Zyklen Lenalidomid 25 mg oral d 1 – d21 + Dexamethason 40 mg oral d 1,8,15,22 Wdhl. Tag 29, dann Tandem-Hochdosis-Melphalan (140 mg/qm) mit PBSCT, dann Erhaltungstherapie mit Lenalidomid 10 mg/Tag bis zum Progress bzw. maximal 5 Jahre innerhalb der Studie Nach 3 Zyklen Induktion werden alle Patienten einer Stammzellmobilisierung und –sammlung unterzogen (CE mit GCSF oder G-CSF mono). Beginn 01.04.2010 Einschlusskriterien • Alter 60 – 70 Jahre • Symptomatisches Multiples Myelom, das eine Therapie erfordert • Nachweis von monoklonalem Protein im Serum und/oder Urin Synopse der Studie Ende 06/2013 Ansprechpartner UKE: PI Dr. Timon Hansen et al. SI PD Dr. Mascha Binder SK Anja Weber 040-7410-20911 040-7410-58787 040-7410-55489 © Block/Kösters Version 2.1 – 2015-10-20 [email protected] [email protected] [email protected] Zur letzten Folie zurück Entitäten 39/153 Ansprechpartner im Onkologischen Zentrum Studienbaum Bronchial-CA PD Dr. Nils Thoennissen Tel.: 040-7410-51836 PD Dr. Dr. Sonja Loges 040-7410-51969 NSCLC Plattenepithelkarzinom abbvie M11-089 Primärtherapie © Block/Kösters Version 2.1 – 2015-10-20 Zur letzten Folie zurück Entitäten 40/153 Ansprechpartner im Onkologischen Zentrum Studienbaum NHL Prof. Judith Dierlamm Tel.: 040-7410-59782 Beobachtungsstudie Verträglichkeit und Wirksamkeit von Thiothepa StiL-7 Morbus Waldenström Agressiv Diffus großzelliges B-Zell NIS TTACT < 60 good prognosis – Kein Bulk IPI 0 Flyer < 60 good prognosis – Mit Bulk IPI 0 Unfolder > 60 OPTIMAL > 60 NHL © Block/Kösters Version 2.1 – 2015-10-20 Zur letzten Folie zurück Entitäten 41/153 StiL-NHL-7 Prospektiv randomisierte multizentrische Studie zur Therapieoptimierung (Primärtherapie) fortgeschrittener progredienter follikulärer sowie anderer niedrigmaligner Lymphome sowie von Mantelzell-Lymphomen ! Nur Morbus Waldenström wird in diese Studie eingeschlossen ! Rituximab alle 2 Monate – 2 Jahre Andere niedrigmaligne und Mantelzell Lymphome 6 Zyklen Bendamustin/ Rituximab + 2 x Rituximab R Nachbeobachtung Einschlusskriterien • histologisch verifiziertes CD20-positives B-Zell-Lymphom • Marginalzonenlymphom, nodales und generalisiertes • Mantelzell-Lymphom • keine Vorbehandlung mit Zytostatika, Interferonen od. Antikörpern • Stadium II od. IV od. Stadium II bulky disease • ECOG 0-2 • aktuelle Histologie nicht älter als 6 Mon. Synopse der Studie Beginn 01.11.2009 Ansprechpartner UKE: PI Prof. Judith Dierlamm SI Dr. Tina Tomann SK Brigitte Martin Ende offen 040-7410-59782 040-7410-23061 040-7410-56545 © Block/Kösters Version 2.1 – 2015-10-20 [email protected] [email protected] [email protected] Zur letzten Folie zurück Entitäten 42/153 Flyer Randomisierte Studie zum Vergleich einer Immuntherapie mit 6 Zyklen des monoklonalen anti-CD20Antikörpers Rituximab in Kombination mit 6 oder 4 Zyklen einer Chemotherapie mit CHOP in 21tägigen Intervallen bei Patienten mit aggressiven CD20-positiven B-Zell-Lymphomen im Alter von 18-60 Jahren ohne Risikofaktor (alltersadaptierter IPI=0) und ohne große Tumormasse (Durchmesser <7.5 cm) 6 x R-CHOP-21 Einschlusskriterien • • R • Patienten sind 18 – 60 Jahre Stadium I – IV ohne Risikofaktoren (IPI=0) Kein Bulk 4 x R-CHOP-21 + 2 x Rituximab Synopse der Studie Beginn 23.11.2006 Ansprechpartner UKE: PI Prof. Carsten Bokemeyer SI Prof. Dr. Dr. Judith Dierlamm SK Petra Kühne Ende offen 040-7410-53962 040-7410-59782 040-7410-54353 © Block/Kösters Version 2.1 – 2015-10-20 [email protected] [email protected] [email protected] Zur letzten Folie zurück Entitäten 43/153 Unfolder Randomisierte Studie zum Vergleich einer kombinierten Immunochemotherapie mit 6 Zyklen des monoklonalen anti-CD20-Antikörpers Rituximab in Kombination mit 6 Zyklen einer Chemotherapie mit CHOP in 21-tägigen oder 14-tägigen Intervallen jeweils mit und ohne konsolidierender Strahlentherapie von großen Tumormassen und/oder Extranodalbefällen bei Patienten mit aggressiven CD20+ B-Zell-Lymphomen im Alter von 18-60 Jahren mit altersadaptiertem IPI=1 (alle) oder IPI=0 mit großen Tumormassen (Durchmesser >= 7.5 cm) 6 x R-CHOP-21 Einschlusskriterien • • R 6 x R-CHOP-14 + GCSF Beginn 23.11.2006 Ansprechpartner UKE: PI Prof. Carsten Bokemeyer SI Prof. Dr. Dr. Judith Dierlamm SK Petra Kühne Patienten sind 18 – 60 Jahre Stadium I – IV mit Risikofaktoren (IPI=1) oder IPI=0 mit grossen Tumormassen Synopse der Studie Ende offen 040-7410-53962 040-7410-59782 040-7410-54353 © Block/Kösters Version 2.1 – 2015-10-20 [email protected] [email protected] [email protected] Zur letzten Folie zurück Entitäten 44/153 Studienbaum ZNS-NHL Beobachtungsstudie Ansprechpartner im Onkologischen Zentrum Prof. Mascha Binder Tel.: 040-7410-58787 Verträglichkeit und Wirksamkeit von Thiothepa Primärtherapie NIS TTACT MATRix © Block/Kösters Version 2.1 – 2015-10-20 Zur letzten Folie zurück Entitäten 45/153 ESPAC 4 A phase III, two arm, open-label, multi-centre randomised clinical trial comparing combination gemcitabine and capecitabine therapy with gemcitabine alone ARM A: Gemcitabine OP ARM B: Gemcitabine + Capecitabine Einschlusskriterien • Pat. nach kompletter makroskopischer Resektion (R0 od. R1) eines Adeno-Ca des Pankreas • periampulläres Karzinom • kein Nachweis einer Aszites, Lebermetastasen, Streuung auf andere abdomin. Organ od. Metastasen • Lebenserwartung > 3 Monate • keine vorhergehende o. best. maligne Diagnose (ausgenommen: Basaliom der Haut od. situ Ca der Cervix Ausschlusskriterien • vorangegangene oder begleitende Chemotherapie • Pankreas-Lymphom • makroskopisch sichtbare Tumorreste Synopse der Studie Beginn 12/2011 Ansprechpartner UKE: PI Prof. Jakob Izbicki SI Dr. Christiane Hanselmann SK Cornelia Thieme Ende 11/2016 040-7410-53401 040-7410-54403 040-7410-59960 © Block/Kösters Version 2.1 – 2015-10-20 [email protected] [email protected] [email protected] Zur letzten Folie zurück Entitäten 46/153 Pankreas Medac Gemcitabin versus Mitomycin versus Gemcitabin/Mytomycin bei Patienten mit fortgeschrittenem Pankreascarcinom, Randomisierte Phase II-Studie R Arm A Mitomycin 6 mg/qm, i.v. Bolus, d 1 Gemcitabin 800 mg/qm, i.v., d 1,8,15 Arm B weggefallen durch Amendment Arm C Gemcitabin 1000 mg/qm, i.v., d 1,8,15 Wiederholung des Zyklus jeweils am Tag 29 Einschlusskriterien • Histologisch oder zytologisch gesicherte Diagnose eines lokal fortgeschrittenen oder metastasierten oder rezidivierten Pankreaskarzinoms der Stadien (UICC 1997) III bis IV • Keine vorangegangene Chemotherapie, Radiotherapie oder Immuntherapie • keine Herzinsuffizienz NYHA II//IV • Kein COPD Synopse der Studie Beginn 18.02.2004 Ansprechpartner UKE: PI Prof. Carsten Bokemeyer SI PD Dr. Andreas Block SK Ina Böhlke Ende 12/2013 040-7410-53962 040-7410-55470 040-7410-57118 © Block/Kösters Version 2.1 – 2015-10-20 [email protected] [email protected] [email protected] Zur letzten Folie zurück Entitäten 47/153 Ansprechpartner im Onkologischen Zentrum Dr. Maxim Kebenko Tel.: 040-7410-53970 Studienbaum Sarkome Weichteilsarkome Angiosarkome Knochensarkome Firstline, metastasiert oder fortgeschritten EPAZ Fortgeschritten und/oder metastasiert EVA EWING-Sarkom © Block/Kösters Version 2.1 – 2015-10-20 EWING 2008 Zur letzten Folie zurück Entitäten 48/153 EWING 2008 EWING 2008 Induktion 6 x VIDE Vincristine Ifosfamide Doxorubicin Etoposide Beginn O p e r a t i o n R a n d o m i s a t i o n 06/2008 Ansprechpartner UKE: PI PD Dr. Nils Thoennissen SI Dr. Gabriela Thoennissen SK R1 – Standard Risk VAC/VAI + Zoledronic Einschlusskriterien • histologisch gesichertes Ewing Sarkom des Knochens oder der Weichteile • Karnofsky Indes > 50% • Alter > 2 und < 50 Jahren Ausschlusskriterien • weitere bösartige Erkrankung • andere medizinische, psychiatrische oder patientenbezogene Faktoren, die die Complience des Patienten in Frage stellen R2 – High Risk VAI, dann Busulfan + Melphalan + PBSCT R3 – Very High Risk Treosulfan/Melphalan + PBSCT + VAC Ende 12/2014 040-7410-51836 040-7410-23033 [email protected] [email protected] © Block/Kösters Version 2.1 – 2015-10-20 Zur letzten Folie zurück Entitäten 49/153 Ansprechpartner im Onkologischen Zentrum Studienbaum ALL Prof. Walter Fiedler Tel.: 040-7410-53919 Alle ALL - Studien sind geschlossen. Alle ALL-Patienten werden analog zu den untenstehenden Studien behandelt. Alle ALL-Patienten werden in die Registerstudie aufgenommen P r i m ä r t h e r a p i e GMALL 7/2003, Amendment 6 15 - 55 B-Vorläufer, T-ALL > 55 B-ALL, Burkitt, hochmalignes B-NHL GMALL-Elderly, Amendment 5 GMALL-B-ALL/ NHL-2002, Amendment 9 Konsensempfehlung T-LBL T-LBL © Block/Kösters Version 2.1 – 2015-10-20 Zur letzten Folie zurück Entitäten 50/153 AMLSG-15-10 Randomized Phase III Study of Low-Dose Cytarabine and Etoposide with or without All-Trans Retinoic Acid in Older Patients not Eligible for Intensive Chemotherapy with Acut Myeloid Leukemia an NPM1 Mutation Cytarabin + ATRA Zyklus 1 - 6 R Etoposid Zyklus 1 50 mg/qm i.v. Tag 1 – 3 Zyklus 2 – 6 100 mg/d/p.o. Tag 1 - 3 Einschlusskriterien • Neu diagnostizierte AML • Vorliegen einer NPM1Genmutation • Alter > ´60 Jahre • Keine vorherige Chemotherapie Ausschlusskriterien • Kreatinin > 1,5 x NN • Bilirubin, AST, ALT > 2,5 x NN Synopse der Studie Beginn 01.08.2011 Ansprechpartner UKE: PI Prof. Walter Fiedler SI Dr. Mirjam Wüsthof et al. SK Petra Kühne Ende 31.12.2016 040-7410-53919 040-7410-55692 040-7410-54353 © Block/Kösters Version 2.1 – 2015-10-20 [email protected] [email protected] [email protected] Zur letzten Folie zurück Entitäten 51/153 AMLSG-09-09 Phase III study of chemotherapy in combination with ATRA with or without gemtuzumab ozogamicin in patients with acute myeloid leukemia and NPM1 gene mutation. 2 Zyklen Induktionstherapie: Cytarabin + ATRA + Idarubicin (Tg 1 +3 + 5, bei Pat. < 60) (Tg 1 + 3 bei Pat. > 60) + Etoposid (Tg 1 + 3) 3 Zyklen Konsolidierungtherapie Cytarabin + ATRA Einschlusskriterien • Neu diagnostizierte AML • Vorliegen einer NPM1Genmutation • Alter >= 18 jahre Ausschlusskriterien • Andere rekurrente genetische Veränderungen • Kreatinin > 1,5 x NN • Bilirubin, AST, AP > 2, 5 x NN Synopse der Studie Beginn 12/2010 Ansprechpartner UKE: PI Prof. Walter Fiedler SI Dr. Maxim Kebenko et al. SK Monika von der Born Ende offen 040-7410-53919 040-7410-53970 040-7410-54354 © Block/Kösters Version 2.1 – 2015-10-20 [email protected] [email protected] [email protected] Zur letzten Folie zurück Entitäten 52/153 Ansprechpartner im Onkologischen Zentrum Studienbaum CUP Dr. Alexander Stein Telefon: 040-7410-56882 PACET-CUP CUP Sinnvolles Umgehen mit einer Krebserkrankung Interventionsprogramm für schwerkranke Krebspatienten © Block/Kösters Version 2.1 – 2015-10-20 Zur letzten Folie zurück CALM Entitäten 53/153 PACET-CUP Open labeled, randomized multi-center phase II study evaluating the efficacy and safety of Paclitaxel/Carboplatin with and without Cetuximab as first-line treatment of adeno- and undifferentiated CUP. Arm A: Carboplatin + Paclitaxel – 6 Zyklen R Arm B: Carboplatin + Paclitaxel + Cetuximab – 6 Zyklen Einschlusskriterien • Histologisch oder zytologisch gesichertes CUP Ausschlusskriterien • EGFR-Vortherapie • Frauen mit prädominanten axillären LK • Frauen mit Peritonealcarcinose • Männer > 50 Jahre mit retroperitonealen oder mediastinalen LK Synopse der Studie Beginn 20.10.2011 Ansprechpartner UKE: PI Dr. Alexander Stein SI PD Dr. Florian Langer et al. SK Peter Lasch Ende offen 040-7410-56882 040-7410-52453 040-7410-59879 [email protected] [email protected] [email protected] © Block/Kösters Version 2.1 – 2015-10-20 Zur letzten Folie zurück Entitäten 54/153 Synchronous Resection of the primary tumor versus no resection prior to systemic therapy in patients with colon cancer an synchronous unresectable metastases (UICC stage IV). A randomized controlled mulicenter trial (SYNCHRONOUS-Trial) Experimenteller Arm Resektion des im Colon lokalisierten Primärtumors vor Beginn einer systemischen Therapie. Die Art der Therapie ist abhängig von der Lokalisation des Tumors. Entsprechend der S3 Leitlinie des kolorektalen Karzinoms R Kontrollarm Primär systemische Therapie gemäß lokalen Standards und/oder aktueller Leitlinien ohne vorausgegangene Resektion des Tumors. Die systemische Therapie ist nicht vorgegeben. Einschlusskriterien • Erstdiagnose eines histologisch gesicherten Kolonkarzinoms • Synchrone Fernmetastase ohne kurative Interventionsmöglichkeit • Resektabler Primarius • ECOG performance 0 – 2 Ausschlusskriterien • Rektumkarzinom • Tumorbedingte Symptome, welche mit dringlicher Operationsindikation einergehen • Chemotherapie und/oder Radiation innerhalb der letzten 6 Monate Synopse der Studie Beginn 09/2011 Ansprechpartner UKE: PI Prof. Dr. Jakob Izbicki SI PD Dr. Andreas Block et al. SK Christine Fehrs Ende 09/2013 040-7410-53401 040-7410-55450 040-7410-55237 © Block/Kösters Version 2.1 – 2015-10-20 [email protected] [email protected] [email protected] Zur letzten Folie zurück Entitäten 55/153 Studienbaum Dermatologische Neoplasien Ansprechpartner im Onkologischen Zentrum Prof. Ingrid Moll Tel.: 040-7410-52631 Prof. Walter Fiedler Tel.: 040-7410-53919 Nicht resezierbar oder metastasiert Columbus Malignes Melanom nicht resezierbar oder metastasiert CA184143 Ipilimumab © Block/Kösters Version 2.1 – 2015-10-20 Zur letzten Folie zurück Entitäten 56/153 Studienbaum Nebenwirkungen onkologischer Therapien Hauttoxizitäten bei kolorektalem Karzinom AIO-LQ-0110 © Block/Kösters Version 2.1 – 2015-10-20 Zur letzten Folie zurück Entitäten 57/153 Studienbaum Urothel-Harnblasenkarzinome Ansprechpartner im Onkologischen Zentrum PD Dr. Michael Rink Tel.: 040-7410-54779 PD Dr. Gunhild von Amsberg Tel.: 040-7410-53962 lokal fortgeschritten oder metastasiert GO29293 Erstlinientherapie Harnblasen-Ca Rezidiv/Progress metastasiert Biotest platinrefraktär GO29294 © Block/Kösters Version 2.1 – 2015-10-20 Zur letzten Folie zurück Entitäten 58/153 Ansprechpartner im Onkologischen Zentrum PD Dr. Gunhild von Amsberg Tel.: 040-7410-53962 Studienbaum Prostata-Ca Ansprechpartner in der Martiniklinik Dr. Petra Strölin Tel.:040-7410-51359 Offene radikale Prostatektomie mit Lymphadenektomie PerClot® nicht metastasiert Prosper nicht metastasiert Spartan Firstline High-Risk, Metastatic Hormone-Naive Prostate Cancer (mHNPC) Zytiga-Abiraterone Metastasiertes, kastrationsresistentes Prostatakarzinom Prospect metastasiert Kastrationsrefraktäres Prostata-Ca Cabaxitel Standard vs. individueller Dosierung © Block/Kösters Version 2.1 – 2015-10-20 Zur letzten Folie zurück CAINTA Entitäten 59/153 Ansprechpartner im Onkologischen Zentrum Studienbaum Mamma-Ca Prof. Volkmar Müller Tel.: 040-7410-50228 adjuvant Primäres Mamma-Ca GAIN-2 nach neoadjuvanter Chemotherapie PENELOPEB Her2 neg. TREAT CTC Her2 pos. KAITLIN BRCA1/2 pos., triple – neg. OLYMPIA Her2 – neg. - Her2 positive CTC Metastasiert DETECT III DETECT IV Her2 – pos.. - Her2 negative CTC Bio - Marin PARP - 673 BRCA - Mutation Biotest 3-fach Rezeptor-negativ Mamma-Ca beim Mann MALE © Block/Kösters Version 2.1 – 2015-10-20 Zur letzten Folie zurück Entitäten 60/153 Theresa A PHASE III RANDOMIZED, MULTICENTER, TWO-ARM, OPEN-LABEL TRIAL TO EVALUATE THE EFFICACY OF T-DM1 COMPARED WITH TREATMENT OF PHYSICIAN’S CHOICE IN PATIENTS WITH HER2-POSITIVE METASTATIC BREAST CANCER WHO HAVE RECEIVED AT LEAST TWO PRIOR REGIMENS OF HER2-DIRECTED THERAPY Einschlusskriterien R ARM A: Therapie nach Entscheidung des Prüfarztes (muss bei Studieneinschluss festgelegt sein) ARM B: T-DM 1 • Metastatic or unresectable locally advanced/recurrent breast cancer HER2-positive disease documented as ISH-positive and/or 3+ by IHC on previously collected tumor tissue and prospectively confirmed central laboratory prior to study enrollment. Tumorgewebe muss vorhanden sein. • Disease progression on the last regimen received as defined by the investigator. • Prior treatment with an anthracycline, trastuzumab, a taxane, lapatinib, and capecitabine in the neoadjuvant, adjuvant, locally advanced, or recurrent/metastatic setting and documented disease progression (by investigator assessment) after at least two regimens of HER2-directed therapy in the metastatic or unresectable locally advanced/recurrent setting. • Patients must have had at least 6 weeks of prior exposure in the metastatic (or unresectable locally advanced/recurrent) setting to lapatinib and capecitabine (given together or separately) unless they were intolerant of lapatinib and/or capecitabine. Patients who were found to be intolerant to lapatinib can be considered eligible if they experienced disease progression during a single trastuzumab-based regimen in the metastatic (or unresectable locally advanced/recurrent) setting. Ausschlusskriterien • Brain metastases that are untreated or symptomatic, or require any radiation, surgery, or steroid therapy to control symptoms from brain metastases within 2 months of randomization Beginn 01/2012 Ansprechpartner UKE: PI Prof. Dr. Volkmar Müller SI Dr. Fabian Trillsch SK Fr. Natascha Gaskill Ende ca. 06/2013 040/7410-52510 040/7410-52510 040/7410-58130 © Block/Kösters Version 2.1 – 2015-10-20 [email protected] [email protected] [email protected] Zur letzten Folie zurück Entitäten 61/153 APHINITY BIG 4-11/BO25126/TOC4939G, a randomized, multicenter, double-blind, placebo-controlled, phase III study evaluating the efficacy and safety of pertuzumab as adjuvant therapy in patients with operable HER2-positive primary breast cancer. Einschlusskriterien ARM A: Adjuvante Chemotherapie plus Trastuzumab (verschiedene Regime gestattet) und Placebo R ARM B: Adjuvante Chemotherapie plus Trastuzumab (verschiedene Regime gestattet) und Pertuzumab Beginn 01/2012 Ansprechpartner UKE: PI Prof. Dr. Volkmar Müller SI Dr. Fabian Trillsch SK Fr. Natascha Gaskill • Adequately excised, non-metastatic operable primary invasive carcinoma of the breast • Known hormone receptor status • Randomization to take place between 3-7 weeks after surgery for breast cancer and treatment to start within 1 week of randomization • Baseline LVEF ≥55% • HER2-positive breast cancer confirmed by central laboratory (Tumorblock benötigt) • Non-hormonal contraception during study and for ≥ 6 months after last study treatment Ausschlusskriterien • History of any prior invasive breast carcinoma or history of non-breast malignancies within the previous 5 years • Any clinical T4 tumour as defined by TNM or any node-negative tumour ≤0.5 cm • Previous systemic chemotherapy or radiation therapy for cancer • Previous anti-HER2 therapy or other biologic or immunotherapy for cancer • Serious cardiac or other illness that may interfere with planned treatment • Abnormal laboratory tests (including serum total bilirubin, serum creatinine, total white blood cells, neutrophils, platelets) Ende ca. 06/2013 040/7410-52510 040/7410-52510 040/7410-58130 © Block/Kösters Version 2.1 – 2015-10-20 [email protected] [email protected] [email protected] Zur letzten Folie zurück Entitäten 62/153 Studienbaum Ovarial-Ca Ansprechpartner im Onkologischen Zentrum PD Dr. Sven Mahner Tel.: 040-7410-50207 (high-grade serös oder BRACA1/2 pos.) / Erhaltungstherapie AGO Ovar 2.22 Platinsensibles Rezivdiv AGO Ovar 2.21 Platinresistentes oder intermediär-platinsensibles Rezidiv © Block/Kösters Version 2.1 – 2015-10-20 NOGGO-AGO-TOPAZ Zur letzten Folie zurück Entitäten 63/153 AGO-OVAR 17 / BOOST Eine prospektive randomisierte Phase III Studie zur Evaluierung der optimalen Therapiedauer von Bevacizumab in Kombination mit Paclitaxel und Carboplatin bei Patientinnen mit primärem epithelialem Ovarial-, Tuben- oder Peritonealkarzinom BOOST (Bevacizumab Ovarian Optimal Standard Treatment) Einschlusskriterien ARM A: 6x Carboplatin (AUC 5) / Paclitaxel (175 mg/m²) + Bevacizumab 15mg/kg über 15 Monate R • • • • 1:1 Epitheliales Ovarial-, Tuben- oder Peritonealkarzinom (durch spezialisierte patholog. Zweitbegurachtung best.) FIGO-Stadium IIB – IV Therapiebeginn innerhalb von 8 Wochen nach zytoreduktiver Operation ECOG ≤2 Aussschlusskriterien ARM B: 6x Carboplatin (AUC 5) / Paclitaxel (175 mg/m²) + Bevacizumab 15mg/kg über 30 Monate Beginn Anfang 2012 Ansprechpartner UKE: PI PD Dr. Sven Mahner SI Dr. Fabian Trillsch SK Fr. Sylke Krenkel • • • • • Vorherige systemische Therapie des Ovarialkarzinoms Geplante OPs während der Behandlungsphase Störungen der Wundheilung, Ulzerationen, Frakturen Thrombose/TIA/SAB < 6 Monate vor Randomisierung Klinisch signifikante kardiovaskuläre Erkrankung/ HTN Ende Mitte 2014 040/7410-52510 040/7410-52510 040/7410-57970 © Block/Kösters Version 2.1 – 2015-10-20 [email protected] [email protected] [email protected] Zur letzten Folie zurück Entitäten 64/153 TRIAS Randomisierte doppelt-verblindete, Placebo-kontrollierte multizentrische Phase II-Studie zur Erfassung der Wirksamkeit und Sicherheit von Sorafenib kombiniert mit der Standardtherapie mit Topotecan bei Patientinnen mit Platin-resistentem rezidiviertem Ovarial-Karzinom Einschlusskriterien Experimenteller Arm: 6x Topotecan 1,25mg/m² KOF d1-5 i.v. + Sorafenib 2x 400mg/d oral d6-15 q3w anschließend Sorafenib 2x 400mg/d tgl. R • • • 1:1 Standard Arm: 6x Topotecan 1,25mg/m² KOF d1-5 i.v. + Placebo 2x 400mg/d oral d6-15 q3w anschließend Placebo 2x 400mg/d tgl. Beginn Januar 2010 Ansprechpartner UKE: PI PD Dr. Sven Mahner SI Dr. Fabian Trillsch SK Fr. Magdalena Torbinska Platin-refraktäres/-resistentes Ovarialkarzinom-Rezidiv: Progress während einer platin-basierten Chemotherapie oder innerhalb von 6 Monaten nach Abschluss einer platin-basierten Chemotherapie weniger als 2 vorangegangene Chemotherapien ECOG ≤ 1 Aussschlusskriterien • • • • • Zerebrale Metastasen Zweitmalignom < 5 Jahre vor Studieneinschluss OP < 4 Wochen vor Studieneinschluss Thrombose/TIA/SAB < 6 Monate vor Randomisierung Klinisch signifikante kardiovaskuläre Erkrankung/ HTN Ende offen 040/7410-52510 040/7410-52510 040/7410-58134 © Block/Kösters Version 2.1 – 2015-10-20 [email protected] [email protected] [email protected] Zur letzten Folie zurück Entitäten 65/153 FERGI A Phase II double-blind, placebo controlled randomized Study of GDC-0941 or GDC-0980 with Fulvestrant versus Fulvestrant in advanced or metastatic breast cancer in patients who experienced progression after prior endocrine therapy Einschlusskriterien ARM A: Fulvestrant 500 mg i.m. Q4W + GDC-0941 340 mg p.o. täglich (PI3-Kinase-Inhibitor) R 1:1:1 - Progress/ Rezidiv eines metastasierten oder lokal fortgeschrittenen Mammakarzinoms - ER positiv, Her2 negativ - Aromatasehemmer als letzte Therapie - Postmenopausaler Hormonstatus ARM B: Fulvestrant 500 mg i.m. Q4W + GDC-0980 30 mg p.o. täglich (mTOR-Inhibitor) Aussschlusskriterien ARM C: Fulvestrant 500 mg i.m. Q4W + Placebo p.o. täglich Bei Krankheitsprogress wird ein Cross-Over angeboten (in Arm A/B) Beginn 06/2012 - >1 Chemotherapie oder >2 endokrine Therapien für das metastasierte Mammakarzinom - Vorherige Therapie mit Fulvestrant, PI3K-/mTOR-Inibotor - Therapie/Radiatio <2 Wochen vor Randominisierung - anti-hyperglykämische Therapie - chronische Steroidtherapie Ende: ca. 06/2013 Ansprechpartner UKE: PI Prof. Dr. Volkmar Müller SI Dr. Fabian Trillsch SK Fr. Esther Freese 040/7410-52510 040/7410-52510 040/7410- 58172 © Block/Kösters Version 2.1 – 2015-10-20 [email protected] [email protected] [email protected] Zur letzten Folie zurück Entitäten 66/153 Ansprechpartner im Onkologischen Zentrum Studienbaum Hepatocelluläres-Ca PD Dr. Henning Wege Tel.: Dr. 040-7410-52945 Systemische Erstlinientherapie bei KRAS Mutation Refametinib Systematische Zweitlinientherapie nach METIV-HCC Progress/Intoleranzunter Sorafenib Systemische Zweitlinientherapie nach Progress unter Sorafenib Resorce © Block/Kösters Version 2.1 – 2015-10-20 Zur letzten Folie zurück Entitäten 67/153 PerClot® Eine prospektive, randomisierte, kontrollierte klinische Studie zur Beurteilung der Sicherheit und Wirksamkeit eines Polysaccharids zur zusätzlichen Blutstillung und Erhebung der postoperativen Wunddrainagemengen bei Patienten, die sich einer radikalen retropubischen Prostatektomie mit Lymphadenektomie unterziehen (kurz PerClot® -Studie) Behandlung mit PerClot® Randomisation 1:1 Behandlung ohne PerClot® Beginn 09/2012 Ansprechpartner UKE: PI Dr. med. Lars Budäus SI Dr. Petra Strölin SK Anke Renter Einschlusskriterien • Offenen radikale Prostatektomie mit Lymphadenektomie • D‘Amico intermediate or high risk Ausschlusskriterien • Z.n. Thrombose • Z.n. Thrombophlebitis Ende offen 040-7410-52960 040-7410-50667 040-7410-53115 © Block/Kösters Version 2.1 – 2015-10-20 [email protected] [email protected] [email protected] Zur letzten Folie zurück Entitäten 68/153 EPAZ A randomized phase II trial comparing pazopanib with doxorubicin as first line treatment in elderly patients with metastatic or advanced soft tissue sarcoma (controlled intervention): Arm A: Docorubicin 75mg/m² BSA, d1, q3wk, i.v 18 weeks or until disease progession, treatment failure, or death due to any cause, whichever occurs first R (experimental intervention): Arm B: Pazopanib 800mg, p.o., daily Until disease progession, treatment failure, or death due to any cause, whichever occurs first Einschlusskriterien • age ≥ 60 Jahre • ECOG 0 – 2 • Histological confirmed diagnosis of metastatic or advanced STS of intermediate or high grade with disease within 6 month prior to study inclusion Ausschlusskriterien • Prior malignancy • History or clinical evidence of CNS metastases • Clinically significant gastrointestinal abnormalities Synopse der Studie Beginn 10.09.2012 Ende offen Ansprechpartner UKE: PI SI SK Dr. Alexander Stein PD Dr. N. Thoennissen Petra Kühne 040-7410-56882 040-7410-51836 040-7410-54353 © Block/Kösters Version 2.1 – 2015-10-20 [email protected] [email protected] [email protected] Zur letzten Folie zurück Entitäten 69/153 AMLSG 16-10 Phase-II study evaluating midostaurin in induction, consolidation and maintenance therapy also after allogeneic blood stem cell transplantation in patients with newly diagnosed acute myeloid leukemia exhibiting a FLT3 internal tandem duplication Vorübergehender Rekrutierungsstop 1.Priorität Allogene HSCT FLT3 Mutations Screening innerhalb 48 Std Daunorubicin60mg/m² iv d1-3 Cytarabin 200mg/m²/Tag iv d1-7* Hochdosis Cytarabin** * Optionale Applikation eines zweiten Zyklus Daunorubicin/Cytarabin bei Patienten, Start: Tag 30 nach allo HSCT Midostaurin 2.Priorität 3x High-Dose Cytarabine Midostaruin Erhaltungstherapie 1 Jahr Erhaltungstherapie die im Knochenmark die Kriterien einer partiellen Remission nach dem ersten Induktionszyklus erreicht haben Midostaurin ** Erste Konsolidierung mit einem Zyklus Hochdosis Cytarabin, optional vor allogener Blutstammzelltransplanation; Cytarabin 18-65 Jahre:3g/m², q12hr (d1,3,5); > 65 Jahre: 1g/m², q12hr (d1,3,5) Einschlusskriterien • Nachweis einer FLT3-ITD • Alter 18 - ≤ 70 • Keine vorherige Behandlung der AML(Ausnahme bis zu 7 Tage Hydroxurea) Ausschlusskriterien • AML mit t(8;21(q22;q22)RUNX1RUNX1T1 • AML mit inv(16)(p13.1q22) oder t(16;16)(p13.1;q22); CBFB-MYH11 • AML mit t(15;17)(q22;q12);PML-RARA • ECOG >2 Synopse der Studie Beginn 17.07.2012 Ende offen Ansprechpartner UKE: PI Prof. Walter Fiedler SI Dr. Melanie Janning et al. SK Petra Kühne 040-7410-53919 040-7410-55692 040-7410-54353 [email protected] [email protected] [email protected] © Block/Kösters Version 2.1 – 2015-10-20 Zur letzten Folie zurück Entitäten 70/153 PROTECT (VEG113387) Randomisierte, doppelblinde, placebokontrollierte Studie der Phase III zur Untersuchung der Wirksamkeit und Sicherheit von Pazopanib als adjuvante Therapie bei Patienten mit lokalisiertem oder lokal fortgeschrittenem Nierenzellkarzinom nach einer Nephrektomie Einschlusskriterien • • Experimenteller Arm oral agent, administered at 800 mg daily (200 mg tablets x 4), continuously for 12 months. Dose can be reduced, interrupted or discontinued due to adverse events or intolerance • R Ausschlusskriterien • • Placebo-Arm placebo matching pazopanib 200 mg tablets, administered at 800 mg daily (200 mg tablets x 4), continuously for 12 months. Dose can be reduced, interrupted or discontinued due to adverse events or intolerance Beginn Nichtmetastasierter Tumor (M0) Grading: pT2, G3 oder G4, N0 pT3, G beliebig, N0 oder pT4, G beliebig, N0 oder pT beliebig, G beliebig, N1 Therapienaiv 04/2010 Ansprechpartner UKE: PI Dr. Roman Heuer SI Dr. Christian Eichelberg SK Christine Heinzer Frühere maligne Erkrankung Klinisch relevante gastrointestinale Anomalien Ende 04/2017 040-7410-53443 040-7410-54782 040-7410-54836 © Block/Kösters Version 2.1 – 2015-10-20 [email protected] [email protected] [email protected] Zur letzten Folie zurück Entitäten 71/153 MARC-2 Eine offene, einarmige Phase IV-Studie über Patienten mit metastasiertem Nierenzellkarzinom, die nach Versagen der ersten gegen VEGF gerichteten Therapie mit Everolimus behandelt werden. Es soll festgestellt werden, welche Biomarker Patienten aufweisen, die von der Therapie profitieren bzw. nicht profitieren. Einschlusskriterien • Einarmige Studie 10 mg Everolimus tgl. • Ausschlusskriterien • Die Behandlung erfolgt bis zur dokumentierten Krankheitsprogression nach den RECISTKriterien, dem Auftreten inakzeptabler Toxizität oder dem Abbruch aus einem anderen Grund. • Beginn 03/2011 Ansprechpartner UKE: PI PD Dr. Michael Rink SI Dr. Andreas Becker SK Christine Heinzer Metastasierte Patienten nach Versagen TKI-Therapie (Sutent, Nexavar, Votrient) mit (überwiegend) klarzelliger Histologie Nephrektomie-präparat ECOG 0 - 2 Patienten, die mehr als eine VEGFRTKI-Therapie oder eine vorherige Therapie mit Bevacizumab +/- Interferon erhalten haben Eine VEGFR-TKI-Therapie innerhalb von 14 Tagen vor Beginn der Einnahme der Studienmedikation Ende 03/2015 040-7410-54779 040-7410-53445 040-7410-54836 © Block/Kösters Version 2.1 – 2015-10-20 [email protected] [email protected] [email protected] Zur letzten Folie zurück Entitäten 72/153 Ansprechpartner im Onkologischen Zentrum Studienbaum Nierenzell-Ca PD Dr. Michael Rink Tel.: 040-7410-54779 PD Dr. Gunhild von Amsberg Tel.: 040-7410-53962 Marc-2 metastasiert SWITCH 2 metastasiert/fortgeschritten SOHB* unbehandelt/metastasiert/fortgeschritten CA209-214 * UKE= Universitätsklinikum Hamburg Eppendorf-II. Medizinische Klinik, SOHB = Schwerpunktpraxis Onkologie Hämatologie Ballindamm © Block/Kösters Version 2.1 – 2015-10-20 Zur letzten Folie zurück Entitäten 73/153 SWITCH 2 Phase III randomisierte, sequentielle, offene Studie zur Bewertung der Wirksamkeit und Sicherheit von Sorafenib gefolgt von Pazopanib versus Pazopanib gefolgt von Sorafenib für die Behandlung des fortgeschrittenem/metastasierten Nierenzellkarzinoms Sorafenib 400 mg (2st. Line) Beginn 30.06.2012 Ende 30.06.2014 Ansprechpartner SOHB PI Dr. Jan Wierecky SK Dorothea Zäch 040-3571777-0 040-3571777-26 Follow-up q 3 months Pazopanib 800 mg (2st. Line) Progress / Intolerable Toxity Treatment-free Period Pazopanib 800 mg (1st. Line) Progress / Intolerable Toxity R Sorafenib 400 mg (1st. Line) Einschlusskriterien • Patienten mit metastasiertem / fortgeschrittenem Nierenkrebs (alle Histologien), die nicht für Zytokintherapie geeignet sind und für die die Studienmedikation als Erstlinienbehandlung indiziert ist • Alter >= 18 und <= 85 • Karnofky-Index >= 70&% Aussschlusskriterien • Vorgeschichte von Herzerkrankungen: Herzinsuffizienz > NYHA Grad 2 oder mit LVEF zur Baseline-Echokardiografie < 50%, (Echokardiografie ist optional); koronare Herzerkankung (MI länger als 6 Monate vor Eintritt in die Studie ist erlaubt); Herzrhythmusstörungen, die Antiarrhythmika benötigen (Betablocker oder Digoxin sind erlaubt) • Nicht eingestellter Hypertonus (definiert als Blutdruck von >=150 mmHg systolisch und/oder >= 90 mmHg diastolisch unter Medikation [email protected]; [email protected] [email protected] © Block/Kösters Version 2.1 – 2015-10-20 Zur letzten Folie zurück Entitäten 74/153 MALE (GBG 54) Eine prospektive, randomisierte, multizentrische Phase II Studie zur Evaluierung der Östradiolsuppression unter Tamoxifen alleine versus Tamoxifen plus GnRH-Analogon versus Aromatase-Inhibitor plus GnRH-Analogon in der (neo-) adjuvanten und palliativen Therapie männlicher Patienten mit Brustkrebs R 1:1:1 ARM A (Standardtherapie): Einschlusskriterien Tamoxifen 20 mg ARM B: Tamoxifen 20 mg - männliche Pat. - histologisch gesichertes, invasives Mamma-Ca oder DCIS - adjuvante, neoadjuvante oder metastasierte Situation - vorherige Chemotherapie ist erlaubt + GnRH-Analogon - komplettes Staging < 4 Wochen vor Studienbeginn Aussschlusskriterien ARM C: Aromatase-Inhibitor (Exemestan 25 mg) + GnRH-Analogon Therapiedauer im Rahmen der Studie 6 Monate. Danach Fortführung gemäß AGO-Leitlinien Beginn 08/2012 - Weibliche Patienten Vorherige antihormonelle Therapie des Mamma-Ca Lebenserwartung unter 6 Monaten. Prostatakarzinom oder PSA > 2,5 ng/ml. Thromboembolische Ereignisse < 5 Jahre Ende 6/ 2014 Ansprechpartner UKE: PI Prof. Dr. Volkmar Müller SI PD Dr. Isabell Witzel SK Fr. Esther Freese 040/7410-52510 040/7410-54355 040/7410-58172 © Block/Kösters Version 2.1 – 2015-10-20 [email protected] [email protected] [email protected] Zur letzten Folie zurück Entitäten 75/153 Targit-E Targit-E(lderly)- Prospective phase II study of intraoperative radiotherapy (IORT) in elderly patients with small breast cancer Einschlusskriterien ARM A: Breast conserving surgery + sentinel + IORT with 20 Gy No risk factors: follow up R • • • Aussschlusskriterien • ARM B: Breast conserving surgery + sentinel + IORT with 20 Gy If Risk factors: additional percutaneous WBRT with 46 Gy Beginn January 2011 Histologically verified invasive-ductal breast cancer cT1 or small cT2 (< 3.5 cm) cN0 cM0 > 70 years of age • • Extensive intraductal component (EIC) Multifocality/-centricity Lymph vessels invasion Ende December 2015 Ansprechpartner UKE: PI Dr. Ursula Scholz SI Cordula Petersen SK Esther Freese 040-741053523 040-7410-57351 040-7410- © Block/Kösters Version 2.1 – 2015-10-20 [email protected] [email protected] [email protected] Zur letzten Folie zurück Entitäten 76/153 JBAL Phase II,LY 2157299 Monotherapy or LY 2157299 plus Lomustine compared to Lomustine Monotherapy in Patients with recurrent Glioblastoma Einschlusskriterien: R ARM A: LY 2157299 Monohydrate • ARM B: LY 2157299 Monohydrate+Lomustine • • relapsed GBM IV or secondary GBM IV 1 prior TMZ regime and RTX Interval of 30 days from the last Chemo Aussschlusskriterien: ARM C: Placebo+Lomustine • • • Beginn: Oktober 2012 presence of cardiac disease 6 months prior study entry prior Bevacizumab,Gliadel Ende offen Ansprechpartner UKE: PI Prof. Dr. M.Westphal SI Dr. T. Martens SK M. Beyer / S. Winkler 040-7410-52750 040-7410-57054 040-7410-35316 © Block/Kösters Version 2.1 – 2015-10-20 [email protected] [email protected] [email protected] Zur letzten Folie zurück Entitäten 77/153 Novocure Phase III, Novo TTF-100A together with TMZ compared to TMZ alone in Patients with newly diagnosed GBM IV. Einschlusskriterien: ARM A:Novo TTF-100A+TMZ • • • new GBM IV KPS > 70% Start at least 4 weeks out from surgery Aussschlusskriterien: R • pacemaker,shunts, defibrillator, brain stimulator, significant TAA ARM B:TMZ Beginn: 2009 Ende offen Ansprechpartner UKE: PI Prof. Dr. M.Westphal SI Dr. T. Martens SK M. Beyer / S. Winkler 040-7410-52750 040-7410-57054 040-7410-35316 © Block/Kösters Version 2.1 – 2015-10-20 [email protected] [email protected] [email protected] Zur letzten Folie zurück Entitäten 78/153 Ansprechpartner im Onkologischen Zentrum Studienbaum Hirntumoren Prof. Manfred Westphal Tel.: 040-7410-53750 Prof. Judith Dierlamm Tel.: 040-7410-59782 Novocure Firstline JBAL Salvage Gliom WHOGrad I+II BRF117019 Gliom WHOGrad III+IV BRF117019 BRAF V600 EMutation © Block/Kösters Version 2.1 – 2015-10-20 Zur letzten Folie zurück Entitäten 79/153 Ansprechpartner im Onkologischen Zentrum Studienbaum AML Prof. Walter Fiedler Tel.: 040-7410-53919 Alle AML-Patienten werden in die AML-Registerstudie aufgenommen! > 60, weniger intensiv AMLSG-15-10 NPM1-Mutation AMLSG-09-09 Primärtherapie mutiert FLT3-Mutation AMLSG-16-10 Vorübergehender Rekrutierungsstop BGBC003 Phase I Relapsed/Refractory SAIL-AML © Block/Kösters Version 2.1 – 2015-10-20 Zur letzten Folie zurück Entitäten 80/153 Ansprechpartner im Onkologischen Zentrum Studienbaum CLL Prof. Mascha Binder Tel.: 040-7410-58787 CLL12 Unbehandelt, Stadium BINET A © Block/Kösters Version 2.1 – 2015-10-20 Zur letzten Folie zurück Entitäten 81/153 Optimal > 60 Improvemant of Outcome an Reduction of Toxicity in Elderly Patients with CD20+ Aggressive B-Cell Lymphoma by an Optimised Schedule of Monoclonal Antibody Rituximab, Substitution of Conventional by Liposomal Vincristine, and FDG-PET based Reduction of Therapy. 4xR-CHOP-14 +G-CSF favourable PET-0 PET + 2xR-CHOP-14 +G-CSF, 2xR d91,d105 + RTX PET + 2xR-CHLIP-14 +G-CSF, 2xR d91,d105 + RTX PET-4 R Einschlusskriterien PET- 4xR-CHLIP-14 +G-CSF 4xR d63, d77, d91,d105 + RTX PET6xR-CHOP-14 +G-CSF + 1xR d84 Ricover R + Opti-R Beginn - 1xR d98 R PET-0 15.02.2013 Ansprechpartner UKE: Leiter der Prüfgruppe Stellvertreter SK R O p t i R 6xCHOP-14 +G-CSF + 1xR d-4,-1,1,4,14,28,42,56 + 4xR d91,126,175,238 + RTX - 4xR d91,126,175,238 PET-6 6xCHLIP-14 +G-CSF + 1xR d-4,-1,1,4,14,28,42,56 • Age 61-80 years Risk Group: diagnosis of agressive CD20+ B-NHL ECOG: 0-2 Ausschlusskriterien PET-6 6xR-CHLIP-14 +G-CSF + 1xR d84 less favourable 1xR d98 + RTX • • • • • already initiated lymphoma therapy serious accompanying disorder CNS ivolvement of lymphoma Synopse der Studie Ende offen Prof. Dr. Dr. Judith Dierlamm Dr. Tina Tomann Petra Kühne 040-7410-59782 040-7410-53980 040-7410-54353 © Block/Kösters Version 2.1 – 2015-10-20 [email protected] [email protected] [email protected] Zur letzten Folie zurück Entitäten 82/153 CML V Therapieoptimierung bei neu diagnostizierten Ph/BCR-ABL-positiven Patienten mit chronischer myeloischer Leukämie in chronischer Phase mit Nilotinib- basierter Induktion und Nilotini- oder Interferon- alpha Erhaltungsphase. R Arm A: Nilotinib Arm B: Nilotinib mit Interferon Einschlusskriterien • neu diagnostizierte Ph und oder BCR-ABL positive CML in chronischer Phase in den letzten 6 Monaten Ausschlusskriterien • Keine Vorbehandlung, außer 6 Monate mit Hydroxyurea und max. 6 Wochen Imatinib oder Nilotinib Weitere Informationen Beginn 13.11.2012 Ende offen Ansprechpartner UKE: PI Dr. Phillipe Schafhausen SI Dr. Gunhild von Amsberg SK Juliane Granzow 040-7410-57122 040-7410-53962 040-7410-57843 [email protected] [email protected] [email protected] © Block/Kösters Version 2.1 – 2015-10-20 Zur letzten Folie zurück Entitäten 83/153 RESORCE Eine multizentrische, randomisierte, doppelblinde Phase III-Studie mit Regorafenib vs. best supportive care (BSC) als Zweitlinientherapie bei Patienten mit Hepatozellulärem Karzinom nach Progress unter Sorafenib. Einschlusskriterien Regorafenib 160mg (4x40mg) über 3 Wochen, dann 1 Woche Pause (über 4 Zyklen) + BSC R 2:1 Randomisierung Primärer Endpunkt: Gesamtüberleben Sekundäre Endpunkte: PFS, ORR, TTP, Sicherheit Ausschlusskriterien BSC + Placebo - Visiten zweiwöchentlich/MRT alle 6 Wochen Beginn II. Quartal 2013 Histologische Sicherung Progress unter Sorafenib BCLC B/C; ECOG 0-1 Child Pugh A Messbare und Behandelbarer Tumor Vortherapie mit VEGF Inhibitoren Intoleranz von Sorafenib Ende: offen Ansprechpartner UKE: PI PD Dr. Henning Wege SI Dr. Tobias Werner SK Nadine Grigo 0152/22816347 0152/22815671 040/7410-52647 © Block/Kösters Version 2.1 – 2015-10-20 [email protected] [email protected] [email protected] Zur letzten Folie zurück Entitäten 84/153 EORTC-62091 TRUSTS: A phase IIb/III multicenter study comparing the efficacy of TRabectedin administered as a 3-hour or 24-hour infusion to doxorubicin in patients with advanced or metastatic Untreated Soft Tissue Sarcoma Einschlusskriterien • First Step N=120 Patients Doxorubicin 75 mg/qm q3week Trabectedin 1,3 mg/qm i.V. 3 h q3week Trabectedin 1,5 mg/qm i.V. 24 h q3week Interim Analysis R Second Step N=250 Patients Doxorubicin 75 mg/qm q3week Trabectedin 3 h OR Trabectedin 24 h • • • Histologically proven advanced and/or metastatic malignant soft tissue sarcoma intermediate/highgrade, excluding the following tumor types (Appendix B): • Well-differentiated liposarcoma • Embryonal rhabdomyosarcoma • Chondrosarcoma (excluding extraskeletal myxoid chondrosarcom • Osteosarcoma (excluding extraskeletal osteosarcoma) • Ewing tumors / primitive neuroectodermal tumor (PNET) • Gastro-intestinal stromal tumors (GIST) • Dermatofibrosarcoma protuberans No other investigational agents within 28 days prior to treatment start and while on protocol treatment. At least 18 years old. Within 21 days prior to treatment start: Synopse der Studie Rekrutierung: Beginn 29.05.2013 Ansprechpartner UKE: PI Dr. Alexander Stein SK Peter Lasch Ende. 040-7410-56882 040-7410-59879 © Block/Kösters Version 2.1 – 2015-10-20 [email protected] SI [email protected] Zur letzten Folie zurück Entitäten 85/153 CALM-Studie CALM-Managing Cancer and Living Meaningfully – Adaption und Implementierung eines Interventionsprogramms für schwer kranke Krebspatienten – eine bizentrische randomisiert kontrollierte Interventionsstudie Einschlusskriterien • ≥18 Jahre • deutschsprachig • Metastasierende/fortgeschrittene Erkrankung (UICC Stadium III/IV) • Depressivität (PHQ ≥9) Arm A: 66 Patienten Erhalten manualisierte CALM-Psychotherapie R Ausschlusskriterien • Leukämien & Lymphome • psychotherapeutische Behandlung • akute Suizidalität • Körp. (Karnofsky <70) & kognitive Einschränkungen Arm B: 66 Patienten Erhalten Supportive psychoonkologische Intervention Beginn 1.1.2013 Ansprechpartner UKE: PI Prof. Dr. Dr. Martin Härter SI Dr. Frank Kindermann Dr. Christina Rosenberger SK Katharina Scheffold Ende offen 040-7410-52978 040-7410-56694 040-7410-56208 040-7410-56203 [email protected] [email protected] [email protected] [email protected] © Block/Kösters Version 2.1 – 2015-10-20 Zur letzten Folie zurück Entitäten 86/153 SWITCH 2 Phase III randomisierte, sequentielle, offene Studie zur Bewertung der Wirksamkeit und Sicherheit von Sorafenib gefolgt von Pazopanib versus Pazopanib gefolgt von Sorafenib für die Behandlung des fortgeschrittenen/metastasierten Nierenzellkarzinoms Sorafenib 400 mg (2st. Line) Beginn 30.06.2012 Ende 30.06.2014 Ansprechpartner SOHB PI Dr. Jan Wierecky SK Dorothea Zäch 040-3571777-0 040-3571777-26 Follow-up q 3 months Pazopanib 800 mg (2st. Line) Progress / Intolerable Toxity Pazopanib 800 mg (1st. Line) Treatment-free Period R Progress / Intolerable Toxity Sorafenib 400 mg (1st. Line) Einschlusskriterien • Patienten mit metastasiertem / fortgeschrittenem Nierenkrebs (alle Histologien), die nicht für Zytokintherapie geeignet sind und für die die Studienmedikation als Erstlinienbehandlung indiziert ist • Alter >= 18 und <= 85 • Karnofky-Index >= 70&% Aussschlusskriterien • Vorgeschichte von Herzerkrankungen: Herzinsuffizienz > NYHA Grad 2 oder mit LVEF zur Baseline-Echokardiografie < 50%, (Echokardiografie ist optional); koronare Herzerkankung (MI länger als 6 Monate vor Eintritt in die Studie ist erlaubt); Herzrhythmusstörungen, die Antiarrhythmika benötigen (Betablocker oder Digoxin sind erlaubt) • Nicht eingestellter Hypertonus (definiert als Blutdruck von >=150 mmHg systolisch und/oder >= 90 mmHg diastolisch unter Medikation [email protected]; [email protected] [email protected] Zur letzten © Block/Kösters Version 2.1 – 2015-10-20 Folie zurück Entitäten 87/153 CA184143 Ipilimumab Multinationale, prospektive Beobachtungsstudie an Patienten mit nicht resezierbaren oder metastasierten Melanomen Kohorten-Studie mit umfassender Patienten-Befragungen alle 3 Monate: Kohorte 1: Ipilimumab Kohorte 2ff: andere 2°line Chemotherapien (DTIC, Fotemustine, Temodal etc.) • Forschungsziele: Ipilimumab – NW-Auftreten, NW-Schwere, NW-Behandlung, Auswirkungen auf QoL, Arbeitsleistung und allg. Zufriedenheit, OS und PFS im Vergleich Einschlusskriterien • • • • Aussschlusskriterien • • Beginn 2.9.2013 Fortgeschrittenes oder nicht resektables Malignes Melanom 2° line Therapie - mindestens eine vorangegangene Chemotherapie (adjuvante Therapie zählt nicht dazu) > 18 Jahre alt Einschluss bis max. 21 Tage nach oder max. 28 Tage vor Start 2°line Therapie > 1 Zyklus 2° line Therapie erhalten andere Onkologische Chemotherapien bzw. Studien Ende Ansprechpartner: UKE PI / Vertreter Prof. I. Moll/Dr. D. Durak SI R. Lüneburg SK S. Pohl 040-7410-52630 040-7410-53648/45 040-7410-55891 [email protected] [email protected], r. [email protected] [email protected] © Block/Kösters Version 2.1 – 2015-10-20 Zur letzten Folie zurück Entitäten 88/153 AIO-LQ-0110 - Panitumab-kutane-NW /LQ Durchführung der klinischen Prüfung zweier vorbeugender Behandlungsstrategien der durch Panitumumab-vermittelten Hauttoxizität und Ermittlung der Lebensqualität von Patienten mit kolorektalem Karzinom mit kras-Wildtyp -Beginn der Behandlung mit der präventiven Studien-medikation am Tag vor Start der Panitumumab Behandlung Einschlusskriterien: • -Fragebogen zur Lebensqualitat und Bewertung Hauttoxizität (WoMoScore, NCI CTCV4 u.a.) alle 2 Wo. insges. 8 Wo. lang - Feuchtigkeits- + Sonnenschutzcreme begleitend • • • Metastasiertem kolorektalem Karzinom vom KRAS- und NRAS Wildtyp (Exon 2,3,4) geplante Behandlung mit Panitumumab gemäß Fachinformation ECOG 0-2 Lebenserwartung mindestens 12 Wo. Ausschlusskriterien: • Doxyzyklin: 100 mg 2x tgl. R • Erythromycin-Salbe (2%): Gesicht, Hände, Füsse, Nacken, Rücken 1x tgl. z.N. • • Bisherige Behandlungen gegen EGFR mit Anti-Krebswirkstoffen (z.B. Cetuximab, Panitumumab, Erlotinib, Gefitinib, Lapatinib) Hautausschlag, der vor oder aus anderen Grunden als der Panitumumab Behandlung besteht oder andere Hauterkrankungen die den Panitumumab-induzierten Hautausschlag beeinflussen können. Paralle Behandlung mit Anti-Tumor Substanzen als Panitumumab andere Karzinome (<=5 Jahre her) excl. Nicht-Melanom-Hautkrebs oder Zervixkarzinom FIGO-Stadium 0-1, wenn der Patient kontinuierlich krankheitsfrei Synopse der Studie Beginn 25.6.2013 Ende Ansprechpartner: UKE PI Dr. A. Stein SI Dr. Claas Kohrmeyer SK Susanne Pohl 040-7410-56882 040-7410-53644 040-7410-55891 [email protected] [email protected] [email protected] © Block/Kösters Version 2.1 – 2015-10-20 Zur letzten Folie zurück Entitäten 89/153 CabaGast Multizentrische Phase II Studie mit Cabazitaxel bei vorbehandelten Patienten mit fortgeschrittenem oder metastasiertem Adenokarzinom des ösophagogastralen Übergangs und des Magens Einschlusskriterien: • • • • • • Cabazitaxel (20 mg/qm i.v. 1 h alle 3 Wochen) bis zum Progress oder inaktzetablen Nebenwirkungen Inoperables oder metastasiertes Adenokarzinom des ösophagogastralen Übergangs oder des Magens Vorgangegangene palliative Chemotherapie Progressive Disease nach Recist 1.1 Alter >= 18 Jahre ECOG >= 1 Adäquate Organfunktionen und hämatologische / biochemische Parameter Ausschlusskriterien: • • • Bösartige Zweiterkrankung die < 5 Jahre zurückliegt (Ausnahme: In-situ Karzinom der Zervix, adäquat behandeltes Basalzellenkarzinom der Haut Schwerwiegende internistische Nebenerkrankungen, einschließlich eines unkontrollierten Diabetes mellitus, oder eine akute Infektion Periphere Neuropathie > NCL Grad II Synopse der Studie Beginn 18.12.2013 Ende offen Ansprechpartner: PI PD Dr. Andreas Block SI Dr. Christian Frenzel SK Thomas Müller 040-7410-56882 040-7410-53644 040-7410-57725 © Block/Kösters Version 2.1 – 2015-10-20 [email protected] [email protected] [email protected] Zur letzten Folie zurück Entitäten 90/153 Celim 2 Cetuximab/FOLFIRI with or without oxaliplatin and FOLFOXIRI with or without bevacizumab in neoadjuvant treatment of non-resectable colorectal liver metastases Einschlusskriterien • Non-resectable, histologically confirmed, synchronous or metachronous colorectal liver metastases. • Non-resectability will be documented by a local multidisciplinary tumour board with participation of a surgeon experienced in liver surgery Aussschlusskriterien • • Any evidence of extrahepatic metastases, distant lymph node metastases and primary tumour recurrence Patients with b-raf mutations Synopse der Studie Beginn MAR 2014 Ansprechpartner: PI Dr. Alexander Stein SI PD Dr. Andreas Block SK Anja Weber Ende offen 040-7410 55489 040-7410 56305 040-7410 55489 © Block/Kösters Version 2.1 – 2015-10-20 [email protected] [email protected] [email protected] Zur letzten Folie zurück Entitäten 91/153 NIS TTACT Eine nicht-interventionelle prospektive Erhebung zur Verträglichkeit und Wirksamkeit von Thiotepahaltigen Hochdosis-Chemotherapien (HDCT) mit anschließender autologer Stammzelltransplantation im routinemäßigen Einsatz bei erwachsenen Patienten mit B- oder T-ZellLymphomen (Non Hodgkin Lymphome oder Hodgkin Lymphome) mit oder ohne ZNS-Beteiligung oder mit primärem ZNS-Lymphom Thiotepa-haltige Hochdosis-Chemotherapien vor ASCT: zum Beispiel - Thiotepa + BCNU +/- Etoposid - Thiotepa + Etoposid + AraC + Melphalan (TEAM) - Thiotepa + andere ASCT Einschlusskriterien • Vorliegen des Einverständnisses zur Weitergabe der persönlichen Daten • Alter ≥ 18 Jahre • Patienten mit dokumentierten B- oder T-Zell-Lymphomen (Non Hodgkin Lymphome oder Hodgkin Lymphome) mit oder ohne ZNS-Beteiligung oder mit primärem ZNS-Lymphom • Erstmalige autologe Stammzelltransplantation (ASCT) • Thiotepa-haltige Hochdosis-Chemotherapie vor ASCT Beobachtung und Dokumentation der Therapie bis 1 Jahr nach ASCT Beginn MAR 2014 Ansprechpartner: PI PD Dr. Mascha Binder SI Dr. Anna Flammiger SK Brigitte Martin Synopse der Studie Ende offen 040-7410 58787 040-7410 58798 040-7410 56545 © Block/Kösters Version 2.1 – 2015-10-20 [email protected] [email protected] [email protected] Zur letzten Folie zurück Entitäten 92/153 ACTICCA-1 Adjuvant chemotherapy with Gemcitabine and Cisplatin compared to observation after curative intent resection of cholangiocarcinoma Eligibility criteria for enrolment phase 1. Suspicion of or histologically/cytologically confirmed adenocarcinoma of biliary tract (intrahepatic, hilar or extrahepatic cholangicarcinoma) scheduled for radical surgical therapy 2. No prior chemotherapy for cholangiocarcinoma Eligibility criteria for treatment phase 1. Histologically confirmed adenocarcinoma of biliary tract (intrahepatic, hilar or extrahepatic cholangicarcinoma) after radical surgical therapy with macroscopically complete resection (Carcinoma of the gallbladder and mixed tumor entities (HCC/CCA) are excluded) 2. Macroscopically complete resection (R0/1) within 6 (-16) weeks before scheduled start of chemotherapy R Synopse der Studie Beginn 24.02.2014 Ende offen Ansprechpartner: PI Dr. Henning Wege SI Dr. Alexander Stein et.al SK Anja Weber 040-7410-52945 040-7410-55489 040-7410-55489 © Block/Kösters Version 2.1 – 2015-10-20 [email protected] [email protected] [email protected] Zur letzten Folie zurück Entitäten 93/153 NEOPA Neoadjuvante Radiochemotherapie für resezierbare, nicht metastasierte Adenokarzinome des Pankreaskopfes (NEOPA) Einschlußkriterien u.a. 1. Histologisch gesichertes, resektables Adenokarzinom des Pankreaskopfes bzw. Prozessus uncinatus mit einer Tumorgröße von 2 cm (oder größer ≥cT2) und/oder engem Kontakt zur mesenteriko-portalen Gefäßachse (Vena mesenterica superior, Vena portae) 2. Fehlende Evidenz von Fernmetastasen (Leber, Peritoneum, Lunge, andere Organe) Ausschlußkriterien u.a. 1. Tumore des Pankreaskörpers und/oder –schwanzes (Läsionen linksseitig der Vena mesenterica superior) 2. Tumorspezifische Vorbehandlung Synopse der Studie Beginn 12.02.2014 Ende 08/2020 Ansprechpartner: PI Prof. Dr. Izbicki SI Dr. Gebauer / Dr. Tachezy SK Cornelia Thieme 040-7410-54401 040-7410-52401 040-7410-57061 © Block/Kösters Version 2.1 – 2015-10-20 [email protected] [email protected] [email protected] Zur letzten Folie zurück Entitäten 94/153 Refametinib (BAY 86-9766 / 16728) •Eine multizentrische, einarmig-unkontrollierte, unverblindete Phase II Studie mit Refametinib in Kombination mit Sorafenib als Erstlinientherapie bei Patienten mit einem Hepatozellulären Karzinom mit RAS Mutation Screening auf K/N-RAS Mutation (Blutentnahme) Wichtige Einschlusskriterien Mutation nicht vorhanden Mutation vorhanden Bildgebende oder histologische Diagnose BCLC B/C, ECOG 0-1, Child-Pugh A Messbarer Tumor nach RECIST Wichtige Ausschlusskriterien Hepatische Enzephalopathie in der Anamnese Vorherige Behandlung mit TKI oder VGEF-Inhibitor Keine Studienteilnahme, Standardtherapie Refametinib + Sorafenib - Visiten (drei)wöchentlich* - MRT alle 6 Wochen - Endpunkt: Therapieansprechen (ORR) Beginn I. Quartal 2014 Ende: offen Ansprechpartner: PI PD Dr. Henning Wege SI Dr. Tobias Werner SK Canan Kurnaz 0152 22 81 63 47 0152 22 81 56 71 040 7410-52647 * 1. und 2. Zyklus wöchentlich, danach alle 3 Wochen © Block/Kösters Version 2.1 – 2015-10-20 [email protected] [email protected] [email protected] [email protected] Zur letzten Folie zurück Entitäten 95/153 METIV-HCC •Eine multizentrische, randomisierte, doppelblinde Phase III-Studie mit Tivantinib (ARQ 197) bei Patienten mit MET High Hepatozellulären Karzinom als Zweitlininientherapie nach Progress oder Intoleranz unter Sorafenib Screening auf MET Status (Bestehende oder neue Histologie) Wichtige Einschlusskriterien Histologische Sicherung mit MET High Progress/Intoleranz unter Sorafenib BCLC B/C, ECOG 0-1, Child-Pugh A Messbarer Tumor MET „low“ Wiederholung der Biopsie MET „low“ MET „high“ Randomisierung 2:1 -Tivantinib vs. Placebo -Visiten alle 4 Tage* -Endpunkt:: Überleben (OS) Wichtige Ausschlusskriterien >1 Vortherapie Keine Studienteilnahme, Standardtherapie Beginn II. Quartal 2013 Ende: offen Ansprechpartner: PI PD Dr. Henning Wege SI Dr. Tobias Werner SK Canan Kurnaz 0152 22 81 63 47 0152 22 81 56 71 040 7410-52647 *1. Zyklus alle 4 Tage, ab dem 2. Zyklus wöchentlich © Block/Kösters Version 2.1 – 2015-10-20 [email protected] [email protected] [email protected] [email protected] Zur letzten Folie zurück Entitäten 96/153 HD-R3i-Phase II Phase II Studie zur Bewertung der Sicherheit von RAD001 (Everolimus) in Kombination mit DHAPStandardchemotherapie bei Patienten mit rezidiviertem oder refraktärem Hodgkin Lymphom ! Vorübergehender Rekrutierungsstop ! SC-Apherese (SC-Apherese) Einschlusskriterien • Histologically confirmed early or late first relapsed classical HL - 28 Beginn EverDHAP EverDHAP (PET-)CT 15 36 Placebo- Placebo- DHAP DHAP 07.05.2014 danach folgt i. d. Regel HD-Beam + PBSCT Scree ning randomization •patients with refractory HL •WHO activity index <=2 •Life expectancy of > 3 months with treatment Ausschlusskriterien •Liver disease as indicated by ASAT ≥ 3 x ULN •Patients who have a history of another primary malignancy ≤ 3 years, with the exception of nonmelanoma skin cancer, completely resected melanoma TNMpT1 and carcinoma in situ of uterine cervix Synopse der Studie Ende offen Ansprechpartner UKE: PI Prof. Dr. Judith Dierlamm SI Dr. Tina Tomann et al. SK Klemens Kösters •Age at entry: 18-60 years 040-7410-59782 040-7410-23061 040-7410-53994 © Block/Kösters Version 2.1 – 2015-10-20 [email protected] [email protected] [email protected] Zur letzten Folie zurück Entitäten 97/153 Millenium C16019 A Phase 3, Randomized, Placebo-Controlled, Double-Blind Study of Oral Ixazomib Citrate (MLN9708) Maintenance Therapy in Patients With Multiple Myeloma Following Autologous Stem Cell Transplant Einschlusskriterien • Adult male or female patients 18 years or older with a confirmed diagnosis of symptomatic multiple myeloma according to standard criteria • Started screening no earlier than 75 days after transplant, completed screening within 15 days, and randomized no later than 115 days after transplant • Patient must have not received post-ASCT consolidation therapy • Documented results of cytogenetics/ fluorescence in situ hybridization (FISH) obtained at any time before transplant, and ISS staging at the time of diagnosis available. Ausschlusskriterien • Multiple myeloma which has relapsed following primary therapy or is not responsive to primary therapy. For this study, stable disease following ASCT will be considered nonresponsive to primary therapy. • Double (tandem) ASCT. • Radiotherapy within 14 days before the first dose of study drug • Central nervous system involvement • Major surgery within 14 days before randomization Weitere Informationen Nicht aus dem KIS-System Beginn 26.08.2014 Ende Ansprechpartner: PI Dr. med Timon Hansen SI PD Dr. med Mascha Binder SK Petra Kühne offen 040-7410-20911 040-7410-58787 040-7410-54353 [email protected] [email protected] [email protected] © Block/Kösters Version 2.1 – 2015-10-20 Zur letzten Folie zurück Entitäten 98/153 Millenium C16011 • A Phase 3, Randomized, Controlled, Open-label, Multicenter, Safety and Effiacy Study of Dexmethason Plus MLN9708 or Physician´s Choice of Treatment Administered to Patients With Relapsed or Refractory Sytemic Light Chain (AL) Amyloidosis 24 weeks double-blind Arm 1 Dexamethason plus MLN9708 (n= 124) R Arm 2 (1:1) Physician´s choices •Dexamethason alone •Dexamethason + melphalan •Dexamethason + cyclophosphamide •Dexamethason + Thaildomid •Dexamethason + lenalidomid •(n=124) Einschlusskriterien • ≥ 18 years old • Biospiy-proven diagnosis of AL amyliodosis • Measurable disease as defined by serum differnatial free light chain concentration • Objective, measurable major (cardiac or renal) organ amyliod involvement • Must be relapsed or refractory after 1 or 2 prior therapies Ausschlusskriterien • Amyliodosis due to mutations of the transthyretin gene or presence of other non-AL amyliodosis • Medically documented cardiac syncope, uncomesated NYHA Class 3 or 4, myocardialminfarction within the previous 6 month, unstable angina pectoris • Clinically overt multiple myeloma, according to IMWG criteria Weitere Informationen Nicht aus dem KIS-System Beginn 12.06.2014 Ende Ansprechpartner: PI Dr. med Timon Hansen SI PD Dr. med Mascha Binder SK Petra Kühne offen 040-7410-20911 040-7410-58787 040-7410-54353 [email protected] [email protected] [email protected] © Block/Kösters Version 2.1 – 2015-10-20 Zur letzten Folie zurück Entitäten 99/153 BRF117019 Gliome WHO-Grad I+II A Phase II, Open-label, Study in Subjects with BRAF V600E Mutated Rare Cancers with Several Histologies to Investigate the Clinical Efficacy and Safety of the Combination Therapy of Dabrafenib and Trametinib Inclusion Criteria: 1. 2. 3. 4. Subjects will receive 5. - dabrafenib 150 mg BID orally plus - trametinib 2 mg once daily BRAF V600E mutation-positive tumor. ECOG performance status: 0, 1 or 2 Histologically confirmed recurrent or progressive WHO Grade 1-2 glioma. Must have measurable non-enhancing disease based on two-dimensional MRI (with contrast) assessments, except for pilocytic astrocytomas Must be receiving a stable or decreasing dose of corticosteroid treatment for 5 days prior to baseline MRI. General Exclusion Criteria orally on a continuous dosing schedule. 1. 2. 1. 2. 3. 4. 5. Prior treatment with enzyme-inducing anticonvulsants within 14 days prior to enrollment. Radiotherapy treatment within 3 months prior to enrollment. Prior treatment with BRAF and/or MEK inhibitor(s) History or evidence of cardiovascular risk History or current evidence/risk of RVO or CSR History of Interstitial lung disease or pneumonitis, Another malignancy Presence of cerebral metastases, symptomatic or untreated leptomeningeal or spinal cord compression, pre-existing Grade 2 peripheral neuropathy Synopse der Studie Beginn 13.06.2014 Ende Ansprechpartner: PI Dr. Alexander Stein SI Dr. Julia Quidde SK Thomas Müller offen 56882 53552 57725 [email protected] [email protected] [email protected] © Block/Kösters Version 2.1 – 2015-10-20 Zur letzten Folie zurück Entitäten 100/153 BRF117019 Gliome WHO-Grad III+IV A Phase II, Open-label, Study in Subjects with BRAF V600E Mutated Rare Cancers with Several Histologies to Investigate the Clinical Efficacy and Safety of the Combination Therapy of Dabrafenib and Trametinib Inclusion Criteria: 1. 2. 3. 4. 5. 6. Subjects will receive - dabrafenib 150 mg BID orally plus -trametinib 2 mg once daily BRAF V600E mutation-positive tumor. ECOG performance status: 0, 1 or 2 Histologically confirmed recurrent or progressive WHO Grade 3-4 glioma. Had prior treatment with radiotherapy and first-line chemotherapy Must have measurable disease at least 1 cm x 1 cm using Modified RANO response Criteria Must be receiving a stable or decreasing dose of corticosteroid treatment for 5 days prior to baseline MRI. General Exclusion Criteria orally on a continuous dosing schedule. 1. 2. 1. 2. 3. 4. 5. Prior treatment with enzyme-inducing anticonvulsants within 14 days prior to enrollment. Radiotherapy treatment within 3 months prior to enrollment. Prior treatment with BRAF and/or MEK inhibitor(s) History or evidence of cardiovascular risk History or current evidence/risk of RVO or CSR History of Interstitial lung disease or pneumonitis, Another malignancy Presence of cerebral metastases, symptomatic or untreated leptomeningeal or spinal cord compression, pre-existing Grade 2 peripheral neuropathy Synopse der Studie Beginn 13.06.2014 Ende Ansprechpartner: PI Dr. Alexander Stein SI Dr. Julia Quidde SK Thomas Müller offen 56882 53552 57725 [email protected] [email protected] [email protected] © Block/Kösters Version 2.1 – 2015-10-20 Zur letzten Folie zurück Entitäten 101/153 BRF117019 GIST A Phase II, Open-label, Study in Subjects with BRAF V600E Mutated Rare Cancers with Several Histologies to Investigate the Clinical Efficacy and Safety of the Combination Therapy of Dabrafenib and Trametinib Inclusion Criteria: Subjects will receive - dabrafenib 150 mg BID orally plus -trametinib 2 mg once daily orally on a continuous dosing schedule. 1. 2. 3. 4. 5. BRAF V600E mutation-positive tumor. ECOG performance status: 0, 1 or 2 Histologically confirmed diagnosis of c-Kit and PDGFRA wild-type GIST. Must have metastatic or locally advanced, unresectable, or recurrent post-surgical disease. Must have at least one measurable lesion per RECIST, version 1.1, outside of the prior radiation field or within the field with evidence of progression. General Exclusion Criteria 1. 2. 3. 4. 5. Prior treatment with BRAF and/or MEK inhibitor(s) History or evidence of cardiovascular risk History or current evidence/risk of RVO or CSR History of Interstitial lung disease or pneumonitis, Another malignancy Presence of cerebral metastases, symptomatic or untreated leptomeningeal or spinal cord compression, pre-existing Grade 2 peripheral neuropathy Synopse der Studie Beginn 13.06.2014 Ende Ansprechpartner: PI Dr. Alexander Stein SI Dr. Julia Quidde SK Thomas Müller offen 56882 53552 57725 [email protected] [email protected] [email protected] © Block/Kösters Version 2.1 – 2015-10-20 Zur letzten Folie zurück Entitäten 102/153 BRF117019 Dünndarm-Ca A Phase II, Open-label, Study in Subjects with BRAF V600E Mutated Rare Cancers with Several Histologies to Investigate the Clinical Efficacy and Safety of the Combination Therapy of Dabrafenib and Trametinib Inclusion Criteria: 1. 2. 3. Subjects will receive - dabrafenib 150 mg BID orally plus -trametinib 2 mg once daily 4. 5. orally on a continuous dosing schedule. BRAF V600E mutation-positive tumor. ECOG performance status: 0, 1 or 2 Histologically confirmed, metastatic or locally advanced adenocarcinoma of the small intestine Must have at least one measurable lesion per RECIST, version 1.1 outside of the prior radiation field or within the field with evidence of progression. Must have failed first-line chemotherapy General Exclusion Criteria 1. 2. 3. 4. 5. Prior treatment with BRAF and/or MEK inhibitor(s) History or evidence of cardiovascular risk History or current evidence/risk of RVO or CSR History of Interstitial lung disease or pneumonitis, another malignancy Presence of cerebral metastases, symptomatic or untreated leptomeningeal or spinal cord compression, pre-existing >= Grade 2 peripheral neuropathy Synopse der Studie Beginn 13.06.2014 Ende Ansprechpartner: PI Dr. Alexander Stein SI Dr. Julia Quidde SK Thomas Müller offen 56882 53552 57725 [email protected] [email protected] [email protected] © Block/Kösters Version 2.1 – 2015-10-20 Zur letzten Folie zurück Entitäten 103/153 Ansprechpartner im Onkologischen Zentrum Studienbaum GIST-Tumoren Beschreibung PD Dr. Nils Thoennissen Tel.: 0407410-51836 Dr. Alexander Stein Tel.: 040-7410-56882 BRAF V600 EMutation © Block/Kösters Version 2.1 – 2015-10-20 BRF117019 Zur letzten Folie zurück Entitäten 104/153 Ansprechpartner im Onkologischen Zentrum Studienbaum Dünndarm-Tumoren Salvage PD Dr. Andreas Block Tel.: 040-7410-55470 Dr. Alexander Stein Tel.: 040-7410-56882 BRAF V600 EMutation © Block/Kösters Version 2.1 – 2015-10-20 BRF117019 Zur letzten Folie zurück Entitäten 105/153 Prospect-Studie Randomisierte, doppelblinde Phase-3-Studie zur Wirksamkeit von PROSTVAC-V/F ± GM-CSF bei Männern mit asymptomatischem oder minimal symptomatischem metastatischem, kastrationsresistentem Prostatakarzinom (BNIT-PRV-301) PROSTVAC-VF + GM-CSF Randomisation PROSTVAC-VF + GM-CSF-Placebo 1:1 Doppelplacebo (leerer Geflügelpocken-Vektor/+GMCSF-Placebo Beginn 07/2014 Einschlusskriterien (u.a.) • Progressiv fortschreitendes metastasiertes Prostatakarzinom • Chemotherapienaiv • Testosteron im Kastrationsniveau • frühere Pockenschutzimpfung • Lebenserwartung > 1 Jahr • adäquate Knochenmark-, Leberund Nierenfunktion Ausschlusskriterien (u.a.) • Opiate • Viszerale Metastasen • Immunsuppression • PSA-Verdopplungszeit <1Monat Ende offen Ansprechpartner: PI Dr. med. Petra Strölin SI Prof. Dr. Thomas Steuber SK Anke Renter 040-7410-51311 040-7410-51311 040-7410-53115 © Block/Kösters Version 2.1 – 2015-10-20 [email protected] [email protected] [email protected] Zur letzten Folie zurück Entitäten 106/153 Zytiga-Abiraterone (PCR3011)-Studie A Randomized, Double-blind, Comparative Study of ZYTIGA® (Abiraterone Acetate) Plus Low-dose Prednisone Plus Androgen Deprivation Therapy (ADT) Versus ADT Alone in Newly Diagnosed Subjects With High-Risk, Metastatic Hormone-Naive Prostate Cancer (mHNPC) Randomisation 1:1 Abirateronacetat 1000mg + Prednison 5mg + Androgen Deprivation Therapy (ADT) (n= 635) Placebo + ADT (n= 635) Beginn 05/2014 Einschlusskriterien (u.a.) • Neu diagnostiziertes metastasiertes Hormonnaives Prostatakarzinom (mHNPC) • Mindestens 2 der 3 HochrisikoPrognosefaktoren: • Gleason ≥ 8 • 3 oder mehr Knochenmetastasen • Viszerale Metastasen Ausschlusskriterien (u.a.) • Hirnmetastasen • Chron. Erkrankung mit Prednison > 5mg täglich • Virushepatitis • Signifikante Herzerkrankung, NYHA II-IV Ende offen Ansprechpartner: SI Dr. med. Petra Strölin PI Prof. Dr. Thomas Steuber SK Anke Renter 040-7410-51311 040-7410-51311 040-7410-53115 © Block/Kösters Version 2.1 – 2015-10-20 [email protected] [email protected] [email protected] Zur letzten Folie zurück Entitäten 107/153 COLUMBUS A Phase III randomized, 3-arm, open label, multicenter study of LGX818 plus MEK162 and LGX818 monotherapy compared with vemurafenib in patients with unresectable or metastatic BRAF V600 mutant melanoma Inclusion criteria: ARM A: LGX818 (BRAF inhibitor) – tabl. R ARM B: LGX818 + MEK 162 (BRAF + MEK inhibitor) – tabl. • • • • • • Male or female patient, age ≥ 18 years; Histologically confirmed diagnosis of locally advanced, unresectable or metastatic cutaneous melanoma AJCC Stage IIIB, IIIC or IV; Presence of BRAF V600E and/or V600K mutation in tumor tissue prior to enrollment, as determined by a Novartis designated central laboratory(ies); Naïve untreated patients or patients who have progressed on or after prior first-line immunotherapy for unresectable locally advanced or metastatic melanoma; Evidence of at least one measurable lesion (RECIST version 1.1); ECOG performance status of 0 or 1. ARM C: Vemurafenib/Zelboraf® Exclusion criteria: • - Visits every 4 weeks (=cycle duration) Dermatological examination every 8 weeks Tumor evaluation RECIST1.1 all 8 weeks Ophthalmological evaluation all 4 weeks in combination arm or in case of baseline abnormalities (minimum every 12 weeks!) - PK sampling Cycle 1,2,3 – day1 - LQ questionnaire every 8 weeks - cardiac exminations every 12 weeks Beginn 7/2014 Active central nervous system (CNS) lesion (i.e., those with radiographically unstable, symptomatic lesions); • Non-cutaneous melanoma; • History of leptomeningeal metastases; • History or current evidence of retinal vein occlusion (RVO) or current risk factors for RVO (e.g. uncontrolled glaucoma or ocular hypertension, history of hyperviscosity or hypercoagulability syndromes); • History of Gilbert’s syndrome; • Previous or concurrent malignancy with exceptions; • Prior therapy with a BRAF inhibitor and/or a MEK inhibitor; • Any previous chemotherapy treatment, extensive radiotherapy or investigational agent other than immunotherapy, or more than one line of immunotherapy for locally advanced unresectable or metastatic melanoma; • Impaired cardiovascular function or clinically significant cardiovascular diseases Ende 2015/16 Ansprechpartner: PI / Vertreter Prof. I. Moll/Prof. W. Fiedler 040-7410-52630 SI Dr. D. Durak, R. Schmidt 040-7410-53648/45 A. Vanegas-Ramirez SK S. Pohl 040-7410-55891 [email protected] [email protected], [email protected] [email protected] [email protected] © Block/Kösters Version 2.1 – 2015-10-20 Zur letzten Folie zurück Entitäten 108/153 apact A Phase 3, Multicenter, Open-Label, Randomized Study of nab-Paclitaxel Plus Gemcitabine versus Gemcitabine Alone as Adjuvant Therapy in Subjects with Surgically Resected Pancreatic Adenocarcinoma Einschlusskriterien • ARM A: nab-Paclitaxel + Gemcitabin • • • • • • • R ARM B: Gemcitabin mono Histologisch gesichertes reseziertes (R0 oder R1) ductales Adenokarzinom des Pankreas Tumorstatus T 1-3, N0-1, M0 ECOG 0-1 ANC ≥ 1500/mm3 PLT ≥ 100,000/mm3 HB ≥ 9 g/dL AST / ALT ≤ 2.5 x ULN Bilirubin gesamt ≤ ULN Ausschlusskriterien • • Vorausgegangene neo-adjuvante Ctx, Strahlentherapie, oder systemische Therapie Metastasen oder lokales Rezidiv des Pankreaskarzinom Weitere Informationen Nicht aus dem KIS-System Beginn 16.09.2014 Ende Ende 2015 Ansprechpartner: PI Priv.-Doz. Dr. med. Andreas Block 040/7410-56305 SI Prof. Dr. Bokemeyer / Dr. Alsdorf / Dr. Frenzel / Dr. Quidde / Dr. Stein SK Dipl.-Dok. Ina Böhlke 040/7410-57118 © Block/Kösters Version 2.1 – 2015-10-20 [email protected] [email protected] Zur letzten Folie zurück Entitäten 109/153 abbvie M11-089 Randomized, Double-Blind, Multicenter, Phase 3 Study Comparing Velparib Plus Carboplatin and Paclitaxel Versus Palcebo Plus Carboplatin and Paclitaxel in Previously Untreated Advanced or Metastatic Squamous Non-Small Cell Lung Cancer (NSCLC) ARM A: Carbo/Paclitaxel + Veliparib 120 mg BID R ARM B: Carbo/Paclitaxel + Placebo BID Einschlusskriterien Fortgeschrittenes, nicht-resektables oder metasiertes Plattenepithel NSCLC • Keine vorhergegangene systemische Therapie • Lebenserwartung > 12 Wochen Ausschlusskriterien • Periphere Neuropathie ≥ Grad 2 • Nicht-Plattenepithel NSCLC oder bekannte EGFR Mutation oder ALK Gen Rearrangement Weitere Informationen Nicht aus dem KIS-System Beginn 03.09.2014 Ende 09/2015 Ansprechpartner: PI Dr. Lars Arne Berger SI PD Dr. Dr. Sonja Loges SK Dipl.-Dok. Ina Böhlke 040-7410-53980 040-7410-51969 040-7410-57118 © Block/Kösters Version 2.1 – 2015-10-20 [email protected] [email protected] [email protected] Zur letzten Folie zurück Entitäten 110/153 GS-US-352-0101 A Phase 3, Randomized, Double-blind Active-controlled Study Evaluateing Momelotinib vs. Ruxolitinib in Subjects with primary Myelofibrosis (PMF) or Post-polycythemia Vera or Post-essential Thrombocythemia Myelofibrosis (Post-PV/ET MF) 24 weeks double-blind Open-lable Arm 1 MMB 200mg tablet once daily an ruxolitinib placebo twice daily R (1:1) After completion of double-blind treatment phase subjects will be eligible to receive open-label MMB in the open-lable phase Arm 2 Einschlusskriterien • ≥ 18 years old • Palpable splenomegaly at least 5 cm below left costall margin • ECOG 0-2 • Confirmed Diagnosis of PMF or PostPV/ET-MF in accordance with the WHO or IWG-MRT criteria Ausschlusskriterien Ruxolitinib twice daily an MMB placebo 200mg tablet once daily • • • • Prior splenectomy Splenic irridation within 3 Monath prior to the first IP Eligible for allogeneic bone marrow or stem cell transplntation QTc interval > 450 msec, unless attributet to bundle branch block Weitere Informationen Nicht aus dem KIS-System Beginn 15.07.2014 Ende Ansprechpartner: PI Dr. Philippe Schafhausen SI PD Dr. G. von Amsberg SK Johanna Gödecke offen 040-7410-57123 040-7410-57843 [email protected] [email protected] [email protected] © Block/Kösters Version 2.1 – 2015-10-20 Zur letzten Folie zurück Entitäten 111/153 AMG 162 A Randomized, Double-Blind, Multicenter Study of Denosumab Compared With Zoledronic Acid (Zometa) in the Treatment of Bone Disease in Subjects with Newly Diagnosed Multiple Myeloma Einschlusskriterien • • • • • • ≥ 18 years old ECOG 0-2 Newly diagnosed multiple myeloma as defined by the 3 criteria below: • Monoclonal plasma cells in the bone marrow greater than or equal to 10% and/or presence of a biopsy-proven plasmacytoma • Monoclonal protein present in the serum and/or urine • Measurable disease as defined by the following; Ausschlusskriterien • • Nonsecretory multiple myeloma based upon standard Mcomponent criteria (ie, measurable serum/urine M-component) unless the baseline serum free lightchain level is elevated POEMS syndrome (polyneuropathy, organo-megaly, endocrinopathy, monoclonalprotein, and skin changes) Weitere Informationen Nicht aus dem KIS-System Beginn 18.4.2014 Ende Ansprechpartner: PI Dr. med Timon Hansen SI PD Dr. med Mascha Binder SK Petra Kühne offen 040-7410-20911 040-7410-58787 040-7410-54353 [email protected] [email protected] [email protected] © Block/Kösters Version 2.1 – 2015-10-20 Zur letzten Folie zurück Entitäten 112/153 Avillion A Multicenter Phase 3 Randomized, Open-Label Study of Bosutinib versus Imatinib in Adult Patients with Newly Diagnosed Chronic Phase Chronic Myelogenous Leukemia Einschlusskriterien Molecular diagnosis of CP CML of ≤ 6 months (from initial diagnosis). • ARM A: Bosutinib 400 mg, oral, 1x/d (a) R ARM B: Imatinib 400 mg, oral, 1x/d • Diagnosis of CP CML with molecular confirmation by detection of BCR-ABL rearrangement at screening (cytogenetic assessment for Philadelphia chromosome is not required for enrollment); diagnosis of CP CML will be defined as all of the following: <15% blasts in peripheral blood and bone marrow; (b) <30% blasts plus promyelocytes in peripheral blood and bone marrow; (c) <20% basophils in peripheral blood; (d) ≥100 x 109/L platelets (≥100,000/mm3); (e) No evidence of extramedullary disease except hepato-splenomegaly; AND (f) No prior diagnosis of AP or BP CML. Philadelphia chromosome status will be identified at screening. Both Philadelphia positive (Ph+) and Philadelphia negative (Ph-) patients may be included. Weitere Informationen Nicht aus dem KIS-System Beginn 15.9.2014 Ansprechpartner: PI PD Dr. med Gunhild von Amsberg SI Dr. med Philipp Schafhausen SK Petra Kühne Ende offen 040-7410-53962 040-7410-57122 040-7410-54353 © Block/Kösters Version 2.1 – 2015-10-20 [email protected] [email protected] [email protected] Zur letzten Folie zurück Entitäten 113/153 CoCSTOM Prospective randomised multicentre investigator initiated study: Randomised trial comparing completeness of adjuvant chemotherapy after early versus late diverting stoma closure in low anterior resection for rectal cancer Einschlusskriterien • • • • • • Temporary diverting stoma (independent from the stoma type) Elective curative low anterior resection (LAR) with total mesorectal excision (TME) after neoadjuvant chemoradiation for UICC II-III rectal cancer No anastomotic leakage after LAR Indication for adjuvant chemotherapy Written informed consent Age >18 years Ausschlusskriterien • • • • • Beginn 2/2014 Ende Ansprechpartner: PI Prof. Jakob Izbicki SI PD Dr. med. Asad Kutup SK Christine Fehrs ASA >3 Inflammatory bowel disease Contraindication to adjuvant chemothe-rapy after rectal cancer resection Immunocompromised patients Participation in another intervention-trial with interference of intervention and outcome of this study Synopse der Studie offen 040-7410-53401 040-7410-53525 040-7410-55237 © Block/Kösters Version 2.1 – 2015-10-20 [email protected] [email protected] [email protected] Zur letzten Folie zurück Entitäten 114/153 SAIL-AML An Investigator-Sponsored Study To Evaluate Ara-C and Idarubicin in Combination with the Selective Inhibitor Of Nuclear Export (SINE) Selinexor (KPT-330) in Patients with Relapsed Or Refractory AML Baslíne Translational research prior to first induction cycle (optional) Bone marrow aspirates pre and 24 hr post single Selinexor dose 1 Induktion 4 weeks D1-7 continous AraC D1,3,5 Idarubicin D2,4 Selinexor D 9,11,16, 18,23,25 Selinexor (twice weekly) Recommend: Allogenic SCT EOT • CR 2 Induktion 4 weeks PR D1-7 continous AraC D1,3,5 Idarubicin D2,4 Selinexor D 9,11,16, 18,23,25 Selinexor (twice weekly) 50% blast reduction • D1-3 6 doses of AraC D 2,4,9,11,16,18,23,25 Selinexor (twice weekly) Cytological or histological diagnosis of AML with the exception of promyelocytic leukemia (AML M3) Men and women aged ≥18 years and eligible for standard dose of chemotherapy (7+3); Patients must have relapsed/refractory disease (relapse after stem cell transplantation is permitted) as defined as: patients with <PR after first cycle of induction chemotherapy, or patients with <CR(i) after second cycle of induction chemotherapy, or patients who relapse after conventional chemotherapy or patients who have undergone a single stem cell transplantation and who have relapse of their AML. Ausschlusskriterien Maintenance : Selinexor (twice weekly) until relapse or maximal 1 year after start of treatment EOT Ende • EOT PD Consolidation (3x4 weeks) Beginn Maintenance : Selinexor (twice weekly) until PD or maximal 1 year after start of treatment PD Any other CR and not eligible for allogenic SCT Non responders /PD Einschlusskriterien • • • • • • Treatment with any investigational agent within four weeks. Cumulative anthracycline dose (daunorubicin or equivalent) >360 mg/m² HIV infection Presence of any medical or psychiatric condition which may limit full compliance with the study, including but not limited to: Presence of CNS leukemia Unresolved toxicity from previous anti-cancer therapy or incomplete recovery from surgery. Weitere Informationen offen Nicht aus dem KIS-System Ansprechpartner: PI Prof. Walter Fiedler SI Dr. Maxim Kebenko et al. SK Petra Kühne 040-7410-53919 040-7410-53970 040-7410-54353 [email protected] [email protected] [email protected] © Block/Kösters Version 2.1 – 2015-10-20 Zur letzten Folie zurück Entitäten 115/153 GO29293 A PHASE II, MULTICENTER, SINGLE-ARM STUDY OF MPDL3280A IN PATIENTS WITH LOCALLY ADVANCED OR METASTATIC UROTHELIAL BLADDER CANCER Einschlusskriterien • Cohort 1 (ca. 30 Pat.): (therapienaiv, Cisplatin ungeeignet) MPDL3280A IV 1200 mg, absolut Tag 1 • • • • • • R Histologically or cytologically documented locally advanced (T4b, any N; or any T, N 2-3) Eastern Cooperative Oncology Group (ECOG) performance status of 0 or 1 Patients with ECOG 2 are allowed in Cohort 1. ANC ≥ 1500/mm3 PLT ≥ 100,000/mm3 HB ≥ 9 g/dL AST / ALT ≤ 5 x ULN Bilirubin gesamt ≤ 1.5 × ULN Ausschlusskriterien Cohort 2 (ca. 300 Pat) : (während oder nach cisplatin - oder carboplatinhaltiger Therapie nach oder bei Progress der Erkrankung) MPDL3280A IV 1200 mg, absolut Tag 1 Beginn 16.09.2014 Any approved anti-cancer therapy, including chemotherapy, or hormonal therapy within 3 weeks prior to initiation of study treatment; the following exceptions are allowed: Palliative radiotherapy for bone metastases completed > 7 days prior to baseline imaging Hormonereplacement therapy or oral contraceptives • Leptomeningeal disease Weitere Informationen Ende Ende 2015 Ansprechpartner: PI PD Dr. med. Gunhild von Amsberg SI Dr. Christoph Seidel SK Johanna Gödeke • Nicht aus dem KIS-System 040/7410-56305 040-7410-57843 © Block/Kösters Version 2.1 – 2015-10-20 [email protected] [email protected] [email protected] Zur letzten Folie zurück Entitäten 116/153 CLL12 A placebo-controlled, double-blind, randomized, multicenter, three arm phase III study to compare the efficacy and safety of ibrutinib vs. watch and wait in previously untreated early Binet stage A CLL patients with risk of early disease progression Screening Fragen zur Krankheitsgeschichte & Allgemeinbefinden Körperlich Untersuchung, Blutentnahme Gewicht, Lebensqualität Medikamenteneinnahme, Schwangerschaftstest Hepatitis und HIV Niedriges Risiko Mittleres/hohes(sehr hohes) Risiko Sie werden routinemäßig beobachtet Sie erhalten das Studienmedikament (Placebo oder Ibrutinib) Alle 3 Monate Monatlich Zyklus 1 – 6 Einschlusskriterien • • • • Confirmed diagnosis of previously untreated CLL according to the updated iwCLL guidelines Stage Binet A without need for treatments ECOG performance status 0 – 2 Absolute neutrophil count (ANC ≥ 1 x 109 / L) Ausschlusskriterien Ausgabe Studienmedikation, Blutentnahme, Gewicht, Schwangerschaftstest Körperlich Untersuchung, Blutentnahme, Gewicht, Beurteilung des Krankheitsverlaufs Alle 3 Monate ab Zyklus 6 Ausgabe Studienmedikation, Blutentnahme, Gewicht, Schwangerschaftstest • • • • Alle 3 Zyklen Körperlich Untersuchung, Blutentnahme, Gewicht Alle 3 Monate Nachbeobachtung (nach Therapieende) Beurteilung des Krankheitsverlaufs Beginn 16.09.2014 • Any prior CLL specific therapy Prior treatment with Ibrutinib or BTK inhibitors Chronic use of steroids in excess of prednisone 20mg/day or its equivalent Active infections requiring systemic antibiotics Requires anticoagulant with warfarin or phenoprocoumon History of stroke or intracranial hemorrhage within 6 months prior to randomization Synopse der Studie Ende Ende 2024 Ansprechpartner: PI PD Dr. Mascha Binder SI Dr. Anna Flammiger SK Thomas Müller 040-7410 58787 040-7410 58798 040-7410-57725 © Block/Kösters Version 2.1 – 2015-10-20 [email protected] [email protected] [email protected] Zur letzten Folie zurück Entitäten 117/153 GEXmab52201 – RESGEX Randomized, controlled, open label, multicenter, phase II study to evaluate the efficacy and safety of CetuGEX™ plus chemotherapy in comparison to cetuximab plus chemotherapy for the treatment of patients with stage III/IV recurrent and/or metastatic squamous cell carcinoma of the head and neck ARM A: six cycles of 5-fluorouracil and cisplatin in combination with CetuGEX™ followed by single-agent maintenance therapy CetuGEX™ R 1:1 ARM B: six cycles of 5-fluorouracil and cisplatin in combination with cetuximab followed by single-agent maintenance therapy cetuximab Inclusion criteria: 1. Patients with histologically confirmed recurrent and/or metastatic EGFR-positive SCCHN not eligible for local treatment. 2. Patients with measurable disease according to Response Evaluation Criteria in Solid Tumors (RECIST) 1.1. Exclusion criteria: 1. Prior systemic chemotherapy, except if given as part of a multimodal treatment for locally advanced disease which was completed more than 6 months prior to screening. 2. Cetuximab or other EGFR targeting agent treatment, except if given as part of a multimodal treatment for locally advanced disease which was completed more than 6 months prior to screening. Weitere Informationen Nicht aus dem KIS-System Beginn Sept.2014 Ansprechpartner: PI: Philippe Schafhausen Stellvertreter: Michael Schmitz SZ: Thomas Müller Ende 2016 Tel: 040/7410-57122 Tel: 040/7410-18611 Tel: 040/7410-57725 © Block/Kösters Version 2.1 – 2015-10-20 [email protected] [email protected] [email protected] Zur letzten Folie zurück Entitäten 118/153 CONKO-007 Randomisierte Phase-III-Studie zum Stellenwert einer Radiochemotherapie nach Induktionschemotherapie beim lokal begrenzten, inoperablen Pankreaskarzinom: Chemotherapie gefolgt von Radiochemotherapie im Vergleich zur alleinigen Chemotherapie Einschlusskriterien • Bioptisch gesichertes Adenokarzinom des Pankreas • Nicht resektabler Tumor • Keine Fernmetastasen Aussschlusskriterien • Synchrone Zweitmalignome • Frühere Radio-oder Chemotherapie Beginn März 2014 Ansprechpartner: PI Dr. Matthias Bertram SI Dr. Sigrun Müller- Hagen SK Susanne Göricke Ende offen 040 -593545 15 040- 593545 15 040- 593545 15 © Block/Kösters Version 2.1 – 2015-10-20 [email protected] [email protected] [email protected] Zur letzten Folie zurück Entitäten 119/153 Clinical Protocol CA209-141 An Open Label, Randomized Phase 3 Clinical Trial of Nivolumab vs Therapy of Investigator`s Choice in Recurrent or Metastatic Platinum-refractory Squamous Cell Carcinoma of the Head and Neck (SCCHN) Einschlusskriterien • ARM N: Nivolumab • • • • • • • • • R ARM IC: Methotrexate oder Docetaxel (Prüfarztentscheidung) Histologisch gesichertes, rezidiviertes oder metastasiertes SCCHN (Mundhöhle, Pharynx, Larynx) Keine lokale Therapie möglich UICC Stadium III-IV ECOG 0-1 Tumorprogress innerhalb von 6 Monaten nach Platin-basierter Therapie WBC ≥ 2000/mm3, ANC ≥ 1500/mm3, PLT ≥ 100,000/mm3, HB ≥ 9 g/dL AST / ALT ≤ 3 x ULN Bilirubin gesamt 1.5 ≤ ULN Kreatinin ≤ 1.5 x ULN Tumorgewebe vor Therapiestart Aussschlusskriterien • • • Patienten mit immunsuppressiver Therapie Aktive Knochenmetastasen oder aktive Hirnmetastasen Alle toxischen Nebenwirkungen vorangegangener Tumortherapien > Grad 1 Weitere Informationen Nicht aus dem KIS-System Beginn 01.10.2014 Ende Januar 2016 Ansprechpartner: PI Prof. Dr. Rainald Knecht 040/7410-53300 SI Dr. Schafhausen, Dr. Chia-Jung Busch/ Dr. Möckelmannl / Dr. Münscher / Herr Hezel SK Bianca Jungfer 040/7410-55458 © Block/Kösters Version 2.1 – 2015-10-20 [email protected] [email protected] Zur letzten Folie zurück Entitäten 120/153 Spartan-Studie Randomisierte (2:1), multizentrische, doppelblinde, klinische Phase-III-Studie zur Beurteilung der Wirksamkeit und Sicherheit von ARN-509 im Vergleich zu Placebo bei Männern mit Hochrisiko- (M0) - CRPC, definiert als PSA-Verdopplungszeit (PSADT) ≤10 Monate. ARN-509 240mg +ADT Randomisation 2:1 Placebo + ADT Beginn 10/2014 Einschlusskriterien (u.a.) • Kastrationsresistentes Prostatakarzinom bei kontinuierlicher Androgendeprivationstherapie (ADT) / nach Orchiektomie • Hohes Risiko für Metastasen (PSA-Verdopplung-szeit ≤10 Monate) bei kontinuierlicher ADT/nach Orchiektomie Ausschlusskriterien (u.a.) • Viszerale Metastasen Ende offen Ansprechpartner: SI Dr. med. Petra Strölin PI Prof. Dr. Thomas Steuber SK Anke Renter 040-7410-51311 040-7410-51311 040-7410-53115 © Block/Kösters Version 2.1 – 2015-10-20 [email protected] [email protected] [email protected] Zur letzten Folie zurück Entitäten 121/153 SAKK 01/10 Carboplatin chemotherapy and involved node radiotherapy in stage IIA/B seminoma Einschlusskriterien • • Stage IIA Stage IIA/B seminoma 1 dose (21 days) of carboplatin AUC 7 36 Gy (18 x 2 Gy) involved node radiotherapy Aussschlusskriterien Followup Stage IIB Histologically confirmed classical seminoma treated with primary inguinal orchidectomy ≤ 12 weeks before registration pT1-4 cN1-2 cM0 according to UICC TNM 2009 36 Gy (18 x 2 Gy) involved node radiotherapy • • • • Mixed histology seminoma Elevated levels of AFP (≥ULN) Any prior adbdominal/pelvic radotherapy Any anti-cancer therapy after primary tumor resection Weitere Informationen Nicht aus dem KIS-System Beginn 12.05.2014 Ende 2036 Ansprechpartner: PI PD Dr. med. Karin Oechsle SI Dr. med. Lars Arne Berger SK Dipl.-Dok. Ina Böhlke +49 (0)40 7410 -23021 9-51096 (intern) +49 (0)40 7410 -57118 © Block/Kösters Version 2.1 – 2015-10-20 [email protected] [email protected] [email protected] Zur letzten Folie zurück Entitäten 122/153 MATRix High-dose chemotherapy and autologous stem cell transplant or consolidating conventional chemotherapy in primary CNS lymphoma - randomized phase III trial • Conventional Consolidation ARM A 2 cycles Rituximab 375mg/qm MTX 3,5 g/qm AraC2x2g/qm Thiotepa30 mg/qm stemcell harvest Einschlusskriterien Response Assessment III 60 days after Randomization PCNSL <= 65 J or 66 – 70 J with ECOG <= 2 High Dose Consolidation ARM B R-DeVIC Rituximab 375mg/qm (d0) Dexamethasone 40 mg/d (d1-3) VP-16 100 mg/qm (d1-3) Ifospamide 1500 mg/qm/d (d1-3) Caroboplatin 300 mg/qm (d1) HDT-ASCT BCNU 400mg/qm (d -6) Thiotepa 2x5mg/kg/d (d-5(-4)) + ASCT (d0) 2 x every 3 weeks • Aussschlusskriterien • • Response Assessment I Not eligible for randomization: PD • • 2 cycles Rituximab 375mg/qm MTX 3,5 g/qm AraC2x2g/qm Thiotepa30 mg/qm Randomization • Not eligible for randomization: PD Immunocompetent patients with newlydiagnosed primary central nervous system B-cell lymphoma Age 18-65 years irrespective of ECOG or 66-70 years (with ECOG Performance Status ≤ 2) Disease exclusively located in the CNS Congenital or acquired immunodeficiency Systemic lymphoma manifestation (outside the CNS) Isolated ocular lymphoma without manifestation in the brain parenchyma or spinal cord Previous Non-Hodgkin lymphoma at any time Synopse der Studie Response Assessment II Beginn 4.11.2014 Ende Ansprechpartner: PI Prof. Mascha Binder SI PD Dr. Nils Thoennissen SK Klemens Kösters +49 (0)40 7410 -58787 +49 (0)40 7410 -51836 +49 (0)40 7410 -53994 © Block/Kösters Version 2.1 – 2015-10-20 [email protected] [email protected] [email protected] Zur letzten Folie zurück Entitäten 123/153 Ansprechpartner im Onkologischen Zentrum Studienbaum Entitätsübergreifende Studien Phase I - Studie PD Dr. Andreas Block Tel.: 040-7410-55470 relapsed/refractory Gastrointestinal Adenocarcinoma © Block/Kösters Version 2.1 – 2015-10-20 AMG 211 Zur letzten Folie zurück Entitäten 124/153 AMG 211 A Phase 1 Study Evaluating the Safety, Tolerability, Pharmacokinetics, Pharmacodynamics, and Efficacy of AMG 211 Administered as Continuous Intravenous Infusion in Subjects with Relapsed / Refractory Gastrointestinal Adenocarcinoma Indikation: Erneut aufgetretene oder therapieresistente gastrointestinale Tumore mit bekannter Expression von CEA (carcinoembryonic antigen) Studiendesign: Kohortenbasierte Studie zur Bestimmung der MTD unter 7- / 14oder 28-tägiger Dauerinfusion von AMG211 mit einer Startdosis von 200µg/d Einschlusskriterien (u. a.) Pathologically documented, diagnosed GI adenocarcinoma (including but not limited to esophageal, gastric, small intestine, colorectal, or pancreatic cancers) that has failed standard treatments or for which standard curative or palliative measures do not exist or are no longer effective At least 1 measurable tumor lesion Archival tumor tissue available or is willing to undergo biopsy of a tumor lesion before the start of treatment Adequate hematological, renal, and liver function Auschlusskriterien (u. a.) Active infection or prior use of IV antibiotics for treatment of infection within2 weeks prior to starting therapy with AMG 211 Corrected QT interval (QTc) ≥ 500 milliseconds at screening Hepatitis B and/or C , HIV Major surgery within 28 days of study day 1 Vaccination within 2 weeks prior to starting therapy with AMG 211 Weitere Informationen Nicht aus dem KIS-System Beginn 01.12.2014 Ende Ende 2015 Ansprechpartner: PI Prof. Dr. Walter Fiedler SI Dr. Maxim Kebenko SK Peter Lasch 040/7410-53919 040/7410-52921 040/7410-59879 © Block/Kösters Version 2.1 – 2015-10-20 [email protected] [email protected] [email protected] Zur letzten Folie zurück Entitäten 125/153 OVAR 2.22 (NOVA) Eine randomisierte, doppel-blinde Phase III-Studie zur Erhaltungstherapie mit Niraparib vs. Placebo bei Patientinnen mit platinsensiblen rezidivierendem Ovarialkarzinom. Beginn 2015 Ende Ansprechpartner: PI PD Dr. Sven Mahner SI Prof. Dr. Volkmar Müller SK Esther Freese 040/7410-50207 040/7410-52510 040/7410- 58172 © Block/Kösters Version 2.1 – 2015-10-20 [email protected] [email protected] [email protected] Zur letzten Folie zurück Entitäten 126/153 AGO OVAR 2.21 Eine prospektive, randomisierte klinische Phase III Studie zur Prüfung von Carboplatin/Gemcitabin/ Bevacizumab vs. Carboplatin/pegyliertes liposomales Doxorubin/ Bevacizumab bei Patientinnen mit platinsensiblen rezidivierendem Ovarialkarzinom. Einschlusskriterien • Alter ≥ 18 Jahre •platinsensibles Rezidiv eines Ovarial-, Tubenoder primären Peritonealkarzinoms (> 6 Monate nach platinbasierter Ersttherapie) • bei Rezdivoperation muss die Pat. innerhalb von 8 Wochen postoperativ eine CTx tolerieren können • ECOG 0-2 • Lebenserwartung > 3 Monate Beginn 2015 Ende Ansprechpartner: PI PD Dr. Sven Mahner SI Prof. Dr. Volkmar Müller SK Sandra Bertram-Schemmel 040/7410-50207 040/7410-52510 040/7410-58134 © Block/Kösters Version 2.1 – 2015-10-20 [email protected] [email protected] Zur letzten [email protected] Folie zurück Entitäten 127/153 NOGGO-AGO-TOPAZ Eine Phase I/II-Studie mit Pazopanib und wöchentlichem Topotecan bei Patientinnen mit platinresistentem oder intermediär-sensitivem rezidivierten Ovarialkarzinom Beginn 2015 Ende Ansprechpartner: PI PD Dr. Sven Mahner SI Prof. Dr. Volkmar Müller SK Natasha Gaskill 040/7410-50207 040/7410-52510 040/7410-58130 © Block/Kösters Version 2.1 – 2015-10-20 [email protected] [email protected] Zur letzten [email protected] Folie zurück Entitäten 128/153 Treat CTC Therapiemöglichkeit nach Abschluss einer adjuvanten Chemotherapie bei nodalpositiven Patientinnen oder bei Patientinnen mit Residuen nach abgeschlossener neoadjuvanter Therapie. Beginn 2015 Ende Ansprechpartner: PI Prof. Dr. Volkmar Müller SI PD Dr. Isabell Witzel SK Sandra Bertram-Schemmel 040/7410-52510 040/7410-54355 040/7410-58134 © Block/Kösters Version 2.1 – 2015-10-20 [email protected] [email protected] Zur letzten [email protected] Folie zurück Entitäten 129/153 PENELOPEB Phase III-Studie zur Evaluation von Palbociclib, einem Hemmer der Cyclin-Kinase 4/6, im Vergleich zu einem Placebo bei Patientinnen mit HR+/HER2-normalem primärem Brustkrebs mit hohem Rückfallrisiko nach neoadjuvanter Chemotherapie Beginn 2015 Ende Ansprechpartner: PI PD Dr. Isabell Witzel SI Prof. Dr. Volkmar Müller SK Esther Freese 040/7410-54355 040/7410-52510 040/7410- 58172 © Block/Kösters Version 2.1 – 2015-10-20 [email protected] [email protected] [email protected] Zur letzten Folie zurück Entitäten 130/153 OLYMPIA Phase III-Studie zur Evaluation von Olaparib, einem PARP-Inhibitor, im Vergleich zu einem Placebo bei Patientinnen mit dem Nachweis einer BRCA1/2 Mutation und triple-negativem Brustkrebs nach adjuvanter oder neoadjuvanter Chemotherapie Beginn 2015 Ende Ansprechpartner: PI PD Dr. Isabell Witzel SI Prof. Dr. Volkmar Müller SK Sandra Bertram-Schemmel 040/7410-54355 040/7410-52510 040/7410-58134 © Block/Kösters Version 2.1 – 2015-10-20 [email protected] [email protected] Zur letzten [email protected] Folie zurück Entitäten 131/153 KAITLIN Phase III- Studie zum Vergleich von Trastuzumab plus Pertuzumab plus einem Taxan nach Anthrazyklinen vs. Trastuzumab-Emtansine plus Pertuzumab nach Anthrazyklinen als adjuvante Therapie bei Patientinnen mit Her2-positivem primärem Brustkrebs Beginn 2015 Ende Ansprechpartner: PI PD Dr. Isabell Witzel SI Prof. Dr. Volkmar Müller SK Natasha Gaskill 040/7410-54355 040/7410-52510 040/7410-58130 © Block/Kösters Version 2.1 – 2015-10-20 [email protected] [email protected] Zur letzten [email protected] Folie zurück Entitäten 132/153 GAIN2 Phase III Studie zum Vergleich einer intensivierten dosisdichten adjuvanten Therapie mit EnPC im Vergleich zu einer dosisdichten, adaptierten Therapie mit dtEC-dtD bei Patienten mit einem frühen Hochrisiko-Mammakarzinom •Hochrisiko-Brustkrebs definiert als: -HER2-positiver oder triple-negativer Tumor unabhängig vom Nodalstatus oder -Luminal B-Tumor (ER und/oder PgR-positiv, HER2-negativ, Ki-67 > 20%) mit befallenen Lymphknoten oder -mindestens 4 befallene Lymphknoten mit jeder Tumorbiologie Beginn 08/2012 Ende ca. 06/2015 Ansprechpartner UKE: PI Prof. Dr. Volkmar Müller SI PD Dr. Isabell Witzel SK Fr. Esther Freese 040/7410-52510 040/7410-54355 040/7410- 58172 © Block/Kösters Version 2.1 – 2015-10-20 [email protected] [email protected] [email protected] Zur letzten Folie zurück Entitäten 133/153 DETECT-Studien Multizentrische Studien bei Patientinnen mit HER2-negativem metastasiertem Brustkrebs und zirkulierenden Tumorzellen (CTC) Beginn 01/2012 Ende Ansprechpartner: PI Prof. Dr. Volkmar Müller SI Dr. Fabian Trillsch SK Sylke Krenkel ca. 06/2015 040/7410-52510 040/7410-52510 040/7410-57970 © Block/Kösters Version 2.1 – 2015-10-20 [email protected] [email protected] Zur letzten [email protected] Folie zurück Entitäten 134/153 Bio Marin PARP - 673 Studie als Chance für Patientinnen mit metastasiertem Mammakarzinom und einer BRCA-Mutation. Behandlung Einarmige nicht randomisierte orale Therapie mit BMN 673 bis Progress der Erkrankung Beginn 2015 Einschlusskriterien Metastasiertes Mammakarzinom Vorausgehende Therapie mit Platin und mehr als 8 Wochen Progressionsfrei Mehr als 2 Chemotherapie-Regime für die metastasierte Erkrankung (ab 3. Therapielinie) Ende Ansprechpartner: PI PD Dr. Isabell Witzel SI Prof. Dr. Volkmar Müller SK Natasha Gaskill 040/7410-54355 040/7410-52510 040/7410-58130 © Block/Kösters Version 2.1 – 2015-10-20 [email protected] [email protected] Zur letzten [email protected] Folie zurück Entitäten 135/153 GS-US-352-1214 A Phase 3, Randomized Study To Evaluate the Efficacy of Momelotinib Versus Best Available Therapy in Anemic or Thrombocytopenic Subjects with Primary Myelofibrosis, Post-polycythemia Vera Myelofibrosis, or Post-essential Thrombocythemia Myelofibrosis who were Treated with Ruxolitinib Einschlusskriterien Randomized treatment phase (24 weeks) Arm 1 MMB 200mg tablet once daily R (1:2) Arm 2 Best available Therapy Beginn 25.11.2014 Ende Extended Treatment Phase (max. 168 weeks) After completion of the randomized treatment phase, subjects of both arms will have the option to receive MMB in an extended treatment phase for up to additional 168 weeks •≥ 18 years old •Palpable splenomegaly at least 5 cm below left costall margin •ECOG 0-2 •Confirmed Diagnosis of PMF or Post-PV/ET-MF in accordance with the WHO or IWG-MRT criteria •Currently or previously treated with ruxolitinib for PMF or Post-PV/ET MF for at least 28 days •If not receiving myelofibrosis therapy, must remain off therapy for at least 2 weeks prior to screen date and through the screening period Ausschlusskriterien •Prior splenectomy •Splenic irridation within 3 Monath prior to the first IP •QTc interval > 450 msec, unless attributet to bundle branch block •Presence of peripheral neuropathy ≥ CTCAE Grade 2 Weitere Informationen offen Nicht aus dem KIS-System Ansprechpartner: PI Dr. Philippe Schafhausen SI PD Dr. G. von Amsberg SK Johanna Gödeke 040-7410-57123 040-7410-57843 [email protected] [email protected] [email protected] © Block/Kösters Version 2.1 – 2015-10-20 Zur letzten Folie zurück Entitäten 136/153 CAINTA Offene, randomisierte Studie im Parallelgruppendesign bei Patienten mit fortgeschrittenem, kastrationsrefraktärem Prostatakarzinom (CRPC) unter Cabazitaxel-Behandlung zum Vergleich der Standarddosierung mit einer pharmakologisch individualisierten Dosierung ARM A: standard dosing Cabazitaxel t 25 mg/m2 resistant prostate adenocarcinoma, that progressed during or after completion of previous docetaxel treatment. - Patients with a formal indication for monotherapy with IV cabazitaxel at 3-weekly cycles. - Measurable or non-measurable (evaluable) disease according to the RECIST criteria, version 1.1. R ARM B: Cabazitaxel PK-guided dosing Beginn 15.12.2014 Einschlusskriterien: - Patients with histologically or cytologically proven, castration Aussschlusskriterien: - Previous treatment with cabazitaxel. - Prior malignancy. Adequately treated basal-cell or squamous-cell skin or superficial (pTis, pTa, and pT1) bladder cancer are allowed, as well as any other cancer for which chemotherapy has been completed ≥ 5 years ago and from which the patient has been disease-free for ≥ 5 years. Ende 2016 Ansprechpartner: PI PD Dr. Gunhild von Amsberg SI PD Dr. Andreas Block SK Thomas Müller Synopse der Studie 040/741050662 040/741055470 040/741057724 © Block/Kösters Version 2.1 – 2015-10-20 [email protected] [email protected] [email protected] Zur letzten Folie zurück Entitäten 137/153 DECLINE Imatinib 400 mg daily versus Nilotinib 300 mg twice daily in patients with chronic myeloid leukemia (CML) in 1st chronic phase and confirmed major molecular response (MMR) receiving Imatinib at a dose of 400 mg daily. An openlabel, randomized multicenter phase III b study to determine the conversion rate from MMR to molecular response ≥ 4 log (MR4) after two years Einschlusskriterien: - CML in 1st chronic phase, with chronic phase defined as blasts < 15% in blood and/or bone marrow and peripheral blood basophils < 20% and platelets ≥ 100 G/L - Pretreatment with Imatinib with a treatment duration of at least 2 years and a dosage of 400 mg daily during the last 12 months before informed consent - Molecular response with BCR-ABL/control gene ratio > 0.005% and ≤0.2% receiving Imatinib at 400 mg daily at most recent assessment during 6 months before informed consent will qualify for screening. ARM A: Imatinib 400mg/d R Aussschlusskriterien: ARM B: Nilotinib 2x 300mg/d - Evidence of features of accelerated or blast phase at any time (by European Leukemia Net; at least one crit.) - Previous loss of hematologic or cytogenetic response - Finding of a secondary BCR-ABL resistance mutation at any time - Patients who had prior allogeneic, syngeneic or autologous bone marrow transplant or stem cell transplant Synopse der Studie RekrutierungsBeginn 30.01.2015 Ansprechpartner: PI Dr. Philippe Schafhausen SI PD Dr. Gunhild von Amsberg SK Johanna Gödeke 040/741057123 040/741050662 040/741057843 © Block/Kösters Version 2.1 – 2015-10-20 [email protected] [email protected] [email protected] Zur letzten Folie zurück Entitäten 138/153 DSMM XIV Lenalidomide, Adriamycin, Dexamethasone (RAD) versus Lenalidomide,Bortezomib, Dexamethasone (VRD) For Induction in Newly Diagnosed Multiple Myeloma followed by Response-adapted Consolidation and Lenalidomide Maintenance - A Randomized Multicenter Phase III Trial by Deutsche Studiengruppe Multiples Myelom (DSMM XIV) bRAD (28-Tage Zyklus / 3 Zyklen) Lenalidomid 25 mg oral d 1 – d 21 + Adriamycin 9 mg/qm, iv, d 1-4, als Druckinfusion + Dexamethason 40 mg oral d 1-4 und d 17-20, Pegfilgrastim 6 mg, subkutan d 5 R VRD (21-Tage Zyklus / 3 Zyklen) Lenalidomid 25 mg oral d 1 – d 14 + Bortezomib 1,3 mg/qm,subkutan, d 1, 4, 8, 11 + Dexamethason 40 mg oral d 1+2, 4+5, 8+9, 11+12 Einschlusskriterien • 18 - 65 • Geeignet für autologe und allogene Stammzelltransplantation • Keine systemische Vortherapie • Neu diagnostiziertes Myelom Ausschlusskriterien • Schwangere oder stillende Frauen • Nicht sekretierendes MM • Überempfindlichkeit gegen Aciclovir oder ähnliche andere antivirale Medikamente Synopse der Studie Beginn 08.01.2015 Ende offen Ansprechpartner UKE: PI PD Dr. Mascha Binder SI Dr. Timon Hansen et al. SK Petra Kühne 040-7410-58787 040-7410-20911 040-7410-54353 © Block/Kösters Version 2.1 – 2015-10-20 [email protected] [email protected] [email protected] Zur letzten Folie zurück Entitäten 139/153 MATEO Randomized controlled trial of S-1 maintenance therapy in metastatic esophagogastric cancer MATEO (maintenance Teysuno in esophagogastric carcinoma) R Beginn Arm A:Patients will continue with S-1 de-escalation phase starting at week 13 until disease progression, toxicities requiring discontinuation, withdrawal of consent, pregnancy, death or lost to follow up whichever occurs first. In patients with drug-related severe toxicity S-1 dose will be adjusted or study treatment will be terminated. Arm B: Patients will continue to receive the same polychemotherapy as during induction therapy until tumor progression, toxicities requiring discontinuation, withdrawal of consent, pregnancy, death or loss to follow up whichever occurs first 10.11.2014 Inclusion Criteria • Histologically confirmed metastatic or locally advanced unresectable gastric adenocarcinoma or adenocarcinoma of the esophagus or the esophagogastric junction (Her2/neu negative or with unknown Her-2/neu status) • Adjuvant/neoadjuvant or perioperative chemotherapy or chemo-)radiotherapy must have been finished at least 6 months before study entry • No previous systemic treatment (i.e.chemotherapy) for metastatic disease Exclusion Criteria • Previous major sugery within the last 28 days before the start of the induction treatment. The implantation of a central venous access (e.g. porth-a cath system) is allowed • Previous systemic treatment (i.e. chemotherapy) for metastatic disease Ende offen Ansprechpartner: PI Prof. S. Hegewisch-Becker SI Dr. Eray Gökkurt SK Detlef Fabian 040-4602001 040-4602001 040-42916356 © Block/Kösters Version 2.1 – 2015-10-20 [email protected] [email protected] [email protected] Zur letzten Folie zurück Entitäten 140/153 CA 209-214 A Phase 3, Randomized, Open-Label Study of Nivolumab Combined with Ipilimumab Versus Sunitinib Monotherapy in Subjects with Previously Untreated, Advanced or Metastatic Renal Cell Carcinoma Key Inclusion Criteria: Histological confirmation of RCC with a clear-cell component Advanced (not amenable to curative surgery or radiation therapy) or metastatic (AJCC Stage IV) RCC No prior systemic therapy for RCC with the following exception: Karnofsky Performance Status (KPS) of at least 70% Measurable disease as per RECIST 1.1 Tumor tissue available Key Exclusion Criteria: Any history of or current CNS metastases. Prior systemic treatment with VEGF or VEGF receptor targeted therapy (including, but not limited to, sunitinib,pazopanib, axitinib, tivozanib, and bevacizumab). Prior treatment with an anti-PD-1, anti-PD-L1, anti-PD-L2, anti-CD137, or anti-CTLA-4 antibody, or any other antibody or drug specifically targeting T-cell costimulation or checkpoint pathways. Ongoing symptomatic cardiac dysrhythmias, uncontrolled atrial fibrillation, or prolongation of the Fridericia corrected QT (QTcF) interval defined as > 450 msec for males and > 470 msec for females, where QTcF = QT / 3√RR Beginn 09.02.2015 Ansprechpartner: PI PD Dr. med. Gunhild von Amsberg SI PD Dr. Michael Rink SK Peter Lasch Weitere Informationen Ende voraussichtlich Ende 2015 Nicht aus dem KIS-System 040/7410-56305 040/7410-54779 040/7410-59879 © Block/Kösters Version 2.1 – 2015-10-20 [email protected] [email protected] [email protected] Zur letzten Folie zurück Entitäten 141/153 BGBC003 A Phase I multicenter open-label study of BGB324 as asingle agent and in combination with cytarabine in patients with acute myeloid leukemia Part B1 Single agent BGB324 N=14 Safety, tolerability, efficacy AML unsuitable for chemotherapy Dose escalation Enrolment into MTD phase Dose allocation >3 patients/cohort to receive daily doses of BGB324 (21-day cycles) until DLT or study withdrawal. Safety, tolerability, PK, efficacy assessed in relapsed/refractory AML Enrol a minimum of 10 patients at MTD/RP2D SMC review Beginn 01/2015 Einschlusskriterien •Histological or cytological confirmation of AML (with the exception of AML M3) •Eastern Cooperative Oncology Group (ECOG) performance status 0, 1 or 2 •Age 18 years or older Part B2 BGB324 + Ara-C N=14 Safety, tolerability, PK, efficacy newly diagnosed AML unsuitable for chemotherapy Ausschlusskriterien •Pregnant or lactating •Hematopoietic stem cell transplantation within 6 months •Inability to tolerate oral medication Ongoing infection requiring systemic treatment. Patients who are on prophylactic antimicrobials or who have been afebrile for 48 hours following the initiation of antimicrobials are eligible Ende offen Ansprechpartner UKE: PI Prof. Walter Fiedler SI PD Dr. Sonja Loges. SK Petra Kühne 040-7410-53919 040-7410-51969 040-7410-54353 [email protected] [email protected] [email protected] © Block/Kösters Version 2.1 – 2015-10-20 Zur letzten Folie zurück Entitäten 142/153 SENTINEL An Investigator Initiated Phase 1 Trial To Evaluate mFOLFOX6 With Selinexor (KPT-330), An Oral Selective Inhibitor Of Nuclear Export (SINE), In Patients With Metastatic Colorectal Cancer Dose level 1 Inclusion Criteria • Patients with histologically confirmed diagnosis of colorectal cancer presenting with unresectable stage IV (UICC) disease (primary tumor may be present) • Patients who are feasible for treatment with FOLFOX (prior adjuvant or palliative treatment is allowed) • ECOG Performance status ≤ 1 • Age ≥18 years Exclusion Criteria • Patients with significant medical illness that in the investigator’s opinion cannot be adequately controlled with appropriate therapy or would compromise the patient’s ability to tolerate this therapy • Treatment with any systemic anticancer therapy ≤ 3 weeks prior to cycle 1 day 1 • Uncontrolled active infection (Hepatitis B and C infection are NOT exclusion criteria) and/or known HIV infection • Renal failure requiring haemodialysis or peritoneal dialysis • Patients who are pregnant or breast-feeding 6 Patients If 0 or 1 DLT then ... Next Dose level If 2 or 3 DLT then ... If 4 or 6 DLT then...... 3 additional patients at the same dose level If no additional DLT If additional DLT Dose escalation will be stopped In case of dose level 1, dose level -1 will be explored. Dose escalation will be stopped Synopse der Studie Beginn 03/2015 Ende offen Ansprechpartner UKE: PI Prof. Carsten Bokemeyer SI Dr. Alexander Stein SK Peter Lasch 040-7410-52960 040-7410-56882 040-7410-59879 [email protected] [email protected] [email protected] © Block/Kösters Version 2.1 – 2015-10-20 Zur letzten Folie zurück Entitäten 143/153 Ansprechpartner im Onkologischen Zentrum Studienbaum Kolorektales Karzinom nicht resektabel Phase I PD Dr. Andreas Block Tel.: 040-7410-55470 Dr. Alexander Stein Tel.: 040-7410-56882 UICC IV Sentinel * UKE= Universitätsklinikum Hamburg Eppendorf-II. Medizinische Klinik © Block/Kösters Version 2.1 – 2015-10-20 Zur letzten Folie zurück Entitäten 144/153 PROSPER-Studie Eine multinationale, randomisierte, doppelblinde, placebokontrollierte Phase-III-Studie zur Wirksamkeit und Sicherheit von Enzalutamid bei Patienten mit nicht metastasiertem, kastrationsresistentem Prostatakarzinom Enzalutamid Randomisation 2:1 Placebo Beginn 11/2014 Ende offen Ansprechpartner: SI Dr. med. Petra Strölin PI Prof. Dr. Thomas Steuber SK Anke Renter 040-7410-51311 040-7410-51311 040-7410-53115 © Block/Kösters Version 2.1 – 2015-10-20 Einschlusskriterien (u.a.) • Kastrationsresistentes Prostatakarzinom (Pca) bei laufender Androgendeprivationstherapie / nach Orchiektomie • PSA-Verdopplungszeit ≤10 Monate • asymptomatisches Pca, ECOG 0-1 Ausschlusskriterien (u.a.) • Metastasen • Krampfanfälle in der Vorgeschichte • klinisch bedeutende kardiovaskuläre Erkrankung [email protected] [email protected] [email protected] Zur letzten Folie zurück Entitäten 145/153 GISG-06 (EVA) EVA (evaluation of votrient in angiosarcoma): einarmige, multizentrische offene Phase-II-Studie zur Überprüfung der Wirksamkeit der Kombination von Paclitaxel mit Pazopanib bei fortgeschrittenen und rezidivierten Angiosarkomen Paclitaxel 70 mg/m² an Tag 1, 8 , 15 im 28-Tage Zyklus 6 Zyklen Pazopanib 800 mg oral täglich Bis zum Progress Beginn 01.03.2015 Ansprechpartner: PI SI Dr. Maxim Kebenko SK Peter Lasch Ende voraussichtlich Ende 2017 040/7410-51752 040/7410-59879 © Block/Kösters Version 2.1 – 2015-10-20 Key Inclusion Criteria (u. a.): - Patienten mit histologisch gesichertem Angiosarkom. Es können Patienten mit primären oder sekundären Angiosarkomen (z.B. strahleninduziert bzw. AS in chronischem Lymphödem) eingeschlossen werden. - Die Erkrankung muss lokal fortgeschritten d.h. nicht resektabelund/ oder metastasiert sowie innerhalb von 6 Monaten vor Studieneinschluss objektivprogredient sein. - ECOG ≤ 2 - Patienten mit mindestens einer messbaren Hautmanifestation oder einer mit CT oder MRT messbaren Läsion (RECIST Version 1.1) . Key Exclusion Criteria (u. a.): - Patienten, die eine aktive Therapie für eine andere maligne Erkrankung als das Angiosarkom benötigen. - Behandlung mit einem Taxan innerhalb der letzten 12 Monate vor Studieneinschluss - Vorhandensein von ZNS- oder leptomeningealen Sarkomatosen. Ein Screening mit Kopfbildgebung (kranielles CT oder MRT) ist nur bei klinischen Auffälligkeiten notwendig Weiterführende Informationen [email protected] [email protected] Zur letzten Folie zurück Entitäten 146/153 MODUL A MULTI-CENTRE RANDOMISED CLINICAL TRIAL OF BIOMARKER-DRIVEN MAINTENANCE TREATMENT FOR FIRST-LINE METASTATIC COLORECTAL CANCER Einschlusskriterien 1. Histologically confirmed mCRC 2. Measureable, unresectable disease according to RECIST 1.1 3. No prior chemotherapy for CRC in the metastatic setting Aussschlusskriterien 1. Less than 6 months from completion of any prior adjuvant chemotherapy or radiotherapy. 2. Prior or current treatment with bevacizumab or any other anti-angiogenic drug (i.e. antiVEGF or vascular endothelial growth factor receptor [VEGFR] therapies or tyrosine kinase inhibitors) Beginn 30.04.2015 Ende 30.04.2017 Ansprechpartner: PI Alexander Stein SI Julia Quidde SK Thomas Müller 040 – 7410 56882 040 – 7410 53552 040 – 7410 57725 [email protected] [email protected] [email protected] © Block/Kösters Version 2.1 – 2015-10-20 Zur letzten Folie zurück Entitäten 147/153 PERMAD Personalized marker-driven early switch to aflibercept in patients with metastatic colorectal cancer. A run in marker determination phase followed by a marker-driven randomized part - a multicenter, multinational, two-part, phase II trial. Randomization All patients in the marker driven part with change of respective marker profile and at least stable disease according to RECIST v1.1 will be randomized to Arm A (conventional switch of chemotherapy together with the anti-angiogenic agent) Bevacizumab and mFOLFOX6 (continuation of same regimen until progressive disease (PD) according to RECIST v1.1, switch to aflibercept and FOLFIRI after PD) Arm B (early marker-driven switch of anti-angiogenic agent and maintenance of chemotherapy) Aflibercept and mFOLFOX6 (change of bevacizumab to aflibercept and continuation of mFOLFOX6 until PD according to RECIST v1.1, followed by change to FOLFIRI after PD) All enrolled patients will be treated 2nd line with aflibercept and FOLFIRI every two weeks. Einschlusskriterien 1. Patients with histologically confirmed diagnosis of colorectal cancer presenting with unresectable stage IV (UICC) disease (primary tumor may be present) 2. Patients with at least one measurable lesion, with size > 1 cm (RECIST v1.1) 3. ECOG Performance status ≤ 2 Aussschlusskriterien 1. Treatment with any other investigational agent within 30 days prior to entering this study. 2. Prior systemic or local treatment of metastatic disease. 3. Prior adjuvant or neo-adjuvant chemotherapy/radiotherapy completed less than 6 months prior to study entry. Synopse der Studie Beginn 01.04.2015 Ansprechpartner: PI Alexander Stein SI Julia Quidde SK Thomas Müller Ende 01.04.2017 040 – 7410 56882 040 – 7410 53552 040 – 7410 57725 [email protected] [email protected] [email protected] © Block/Kösters Version 2.1 – 2015-10-20 Zur letzten Folie zurück Entitäten 148/153 Studienbaum - metastasiert Kolorektales Karzinom Ansprechpartner im Onkologischen Zentrum Dr. Alexander Stein Tel.: 040-7410-56882 PD Dr. Andreas Block Tel.: 040-7410-55470 Primärtumormanagement asymptomatischer Primärtumor mit synchronen irresektablen Metastasen * UKE= Universitätsklinikum Hamburg Eppendorf-II. Medizinische Klinik © Block/Kösters Version 2.1 – 2015-10-20 Synchronous UKE* Zur letzten Folie zurück Entitäten 149/153 Biotest An open-label, two-stage Phase I / IIa dose-escalation study of BT062 in metastatic triple receptornegative breast cancer and in metastatic transitional cell carcinoma of the urinary bladder Einschlusskriterien • Metastatic TNBC (stage IV, any T, any N, M1) with histochemical confirmation of the absence (< 1%) of progesterone receptors (PR), estrogen receptors (ER) and human epidermal growth factor receptors (HER2); Fluorescence in-situ hybridization (FISH) negative or immunohistochemistry (IHC) < 2 score points in all examined lesions Or • metastatic TCCUB (stage IV; any T, any N, M1); Ausschlusskriterien • • Beginn 14.05.2015 History of allergy against study drug related components or drugs; Administration of chemotherapy or radiotherapy within 3 weeks prior to Day 1 (day of first dose of study drug) or during the study; Ende Ansprechpartner: PI PD Dr. G. von Amsberg SI PD Dr. Andreas Block SK Johanna Gödecke 040-7410-53962 040-7410-55470 040-7410-57843 [email protected] [email protected] [email protected] © Block/Kösters Version 2.1 – 2015-10-20 Zur letzten Folie zurück Entitäten 150/153 GO29294 A Phase III, Open-Label, Multicenter, Randomized Study to Investigate the Efficacy and Safety of MPDL3280A (AntiPD-L1 Antidbody) Compared with Chemotherapy in Patients with Locally Advanced or Metastatic Urothelial Bladder Cancer after Failure with Platinum-Containing Chemotherapy Advanced/metastatic UBC Patients who have failed prior platinum therapy N=767 Einschlusskriterien • Central testing for PD-L1 status Stratification • Chemotherapy (vinflunine vs. Taxane • Tumor tissue PD-L1 expression (ICH 0/1 vs 2/3) • Prognostic factors (0 vs. 1/2/3) • Liver metastasis (Yes vs. No) Arm B Vinflunine 320 mg/m2 q3w Or paclitaxel 175 mg/m2 q3w Or docetaxel 75 mg/m2 q3w Arm A MPDL3280A 1200 mg q3w Disease progression No crossover allowed • • • Histologically or cytologically documented locally advanced (T4b, any N; or any T, N 2-3) or metastatic (M1, Stage IV) UBC (also termed TCC or UCC of the urinary tract; including renal pelvis, ureters, urinary bladder, an urethra Measurable disease, as defined by RECIST v1.1 ECOG 0 or 1 Life expectancy >= 12 weeks Ausschlusskriterien • Any approved anti-cancer therapy, including chemotherapy or hormonal therapy within 3 weeks prior to initiation of study treatment • Treatment with any other investigational agent or participation in another clinical trial with therapeutic intent within 28 days prior to enrollment Survival follow-up Beginn 14.05.2015 Ende Ansprechpartner: PI PD Dr. G. von Amsberg SI Dr. Christoph Seidel SK Johanna Gödecke Weitere Informationen Nicht aus dem KIS-System 040-7410-53962 040-7410040-7410-57843 [email protected] [email protected] [email protected] © Block/Kösters Version 2.1 – 2015-10-20 Zur letzten Folie zurück Entitäten 151/153 POLO - Studie Eine randomisierte, doppelblinde, placebokontrollierte, multizentrische Phase-III-Studie zu einer Erhaltungsmonotherapie mit Olaparib bei Patienten mit metastasiertem Pankreaskarzinom mit gBRCA-Mutation, die keine Krankheitsprogression unter einer platinbasierten Erstlinienchemotherapie zeigten Einschlusskriterien Olaperib 300mg bid • • Randomisierung 3:2 (Olaparb:Placebo) R Aussschlusskriterien • Placebo Beginn September 2015 Ansprechpartner: PI Alexander Stein SI Julia Quidde SK Thomas Müller gBRCA1 oder gBRCA2 Mutation mindestens 4 Monate platinbasierte Erstlinienchemotherapie Krankheitsprogression unter einer platinbasierten Erstlinienchemotherapie Ende 040 – 7410 56882 040 – 7410 53552 040 – 7410 57725 [email protected] [email protected] [email protected] © Block/Kösters Version 2.1 – 2015-10-20 Zur letzten Folie zurück Entitäten 152/153 Studien der pädiatrischen Onkologie und Hämatologie Ansprechpartner im Onkologischen Zentrum Kay Witetschek Tel.: 040-7410-56822 Studien und Registerstudien der GPOH www.kinderkrebsinfo.de/e1676/e9032/index_ger.html Entitäten © Block/Kösters Version 2.1 – 2015-09-17 153/155