Wie antibiotisch therapieren?
Werbung

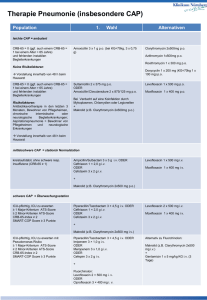
Foto: mauritius images Streptococci pneumoniae AMBULANT ERWORBENE PNEUMONIE Wie antibiotisch therapieren? Die Diagnostik und Behandlung erfolgt entsprechend der Leitlinien 2009. Innovative Biomarker zur Abschätzung von Krankheitsschwere und Prognose des Patienten sind in Entwicklung. ie ambulant erworbene Pneumonie (community acquired pneumonia = CAP) ist eine der weltweit häufigsten Infektionserkrankungen mit hoher Letalität. Nach Daten des Bundesinstitutes für Qualitätssicherung (BQS) werden in Deutschland jährlich > 200 000 CAP-Patienten stationär behandelt. Somit ist die CAP eine Volkskrankheit, die ähnlich häufig vorkommt wie Schlaganfall oder Herzinfarkt. Die Letalität der CAP steigt mit Alter und Komorbiditäten (1–4). Die durchschnittliche Letalität hospitalisierter Patienten beträgt circa 12,9 Prozent D TABELLE 1 CRB-65-Risikoscore Pneumonie-bedingte Desorientiertheit (Mental confusion) Atemfrequenz >= 30/min (Respiratory Rate) Blutdruck (systolisch < 90 mmHg oder diastolisch <= 60 mmHg (Blood Pressure) Alter > 65 Jahre (Age > 65 years) Die Risikoklasse wird durch Addition jeweils eines Punktes für ein Kriterium errechnet. Eingruppierung der Patienten in die Risikoklassen: 1. Risikoklasse 1 = 0 vorhandene Kriterien nach CRB-65 (Sterblichkeit niedrig: ca. 1 Prozent) 2. Risikoklasse 2 = 1–2 vorhandene Kriterien nach CRB-65 (Sterblichkeit mittel: ca. 8 Prozent) 3. Risikoklasse 3 = 3–4 vorhandene Kriterien nach CRB-65 (Sterblichkeit hoch: ca. (31–34 Prozent) 10 (1). Das heißt: In Deutschland versterben jedes Jahr > 20 000 Patienten mit dieser Diagnose. Diagnose Ein radiologischer Infiltratnachweis sollte erfolgen, um unnötige Antibiotikaverordnungen zu vermeiden und Differenzialdiagnosen auszuschließen (5). Ambulant ist eine zeitnahe Röntgendiagnostik nicht immer möglich. Klinische Präsentation und ein Serum-CRP-Wert über 30 mg/L geben gute Hinweise auf das Vorliegen einer bakteriellen Infektion, Procalcitonin-Konzentrationen liefern zu diesem Zweck keine diagnostisch relevanten Informationen (6). Der Einsatz von CRP-Soforttests (point of care) trägt dazu bei, die Verschreibungsrate von Antibiotika zu reduzieren (7, 8). Risikostratifizierung Eine Entscheidungshilfe, ob eine ambulante oder stationären Therapie erfolgen sollte, bietet der vom Kompetenznetzwerk CAPNETZ entwickelte CRB-65-Score (Tabelle 1) (4). Eine exaktere Risikostratifizierung lässt sich durch Zunahme des Komorbiditätenprofils und initialer Sauerstoffsättigung erreichen (9). In Notaufnahmen steht im Vordergrund, CAP-Patienten mit hohem Risiko des raschen Organversagens zu identifizieren. Als Risikofaktoren für diese Patienten zeigten sich: ● Heimsauerstofftherapie ● multilobuläres Infiltrat Perspektiven der Infektiologie 2015 | Deutsches Ärzteblatt TABELLE 2 Häufigste Erreger der CAP in Deutschland (13) Häufigkeit Erreger Sehr häufig (40–50 Prozent) S. pneumoniae Gelegentlich (5–10 Prozent) H. influenzae M. pneumoniae Respiratorische Viren Selten (<5 Prozent) S. aureus Legionella spp. C. pneumoniae Etwa 20–25 Prozent Erreger ungeklärt ● ● pneumoniebedingte Verwirrtheit und auffällige Vitalzeichen (10). Kardiovaskuläre Risikofaktoren haben einen signifikanten Einfluss auf das Mortalitätsrisiko der CAP: pro-Adrenomedullin als kardiovaskulärer Biomarker ist ein Prädiktor für die 28 Tage – wie auch für die Langzeitmortalität der CAP (11). Mikrobiologische Diagnostik und Erregerspektrum, Resistenzlage Pneumokokken sind die wichtigsten Pneumonieerreger (12, 13) (Tabelle 2). In Deutschland spielt die Penizillinresistenz der Pneumokokken keine bedeutende Rolle (ars.rki.de, Daten aus 2013). Makrolidresistenzen liegen in Deutschland um 13 Prozent (ars.rki.de, Daten aus 2013). Fluorchinolone (Moxifloxacin, Levofloxacin) finden eine (zu) breite Verwendung. Die Resistenzraten gegenüber dieser Antibiotikaklasse sind gering (ars.rki.de, Daten aus 2013). Als Erreger der CAP finden sich Legionellen in circa fünf Prozent der Fälle (14). Pseudomonas spp spielen als Erreger der CAP in Deutschland eine untergeordnete Rolle; häufig sind diese Keime als Besiedlung zu werten (13). Risikofaktoren für eine Pseudomonas-CAP sind chronische, strukturelle Lungenerkrankungen, Krankenhausaufenthalte und antimikrobielle Vortherapie (5) (Tabelle 3). Antimikrobielle Therapie Die Grundzüge der antimikrobiellen Therapie sind Tabelle 4 dargestellt. Dabei ist die unmittelbare Einleitung der empirischen antimikrobiellen Therapie von entscheidender prognostischer Bedeutung: Für jede Stunde Aufschub des Therapiebeginns zeigte sich bei Patienten, die im septischem Schock sind, eine Zunahme der Letalität um mehr als sieben Prozent (15). Leichte CAP: Ambulante Therapie CRB-65-Risikoscore = 0–1: Patienten ohne schwere Komorbiditäten und ohne Antibiotikavortherapien in den vorausgehenden drei Monaten erhalten eine Monotherapie mit Amoxicillin. Bei Penizillinunverträglichkeit kann ein neueres Makrolid oder Doxycyclin Perspektiven der Infektiologie 2015 | Deutsches Ärzteblatt eingesetzt werden. Fluorchinolone werden bei dieser Patientengruppe nicht empfohlen (5). Liegen Risikofaktoren für gramnegative oder resistente Erreger vor, sollte eine Kombinationstherapie, bestehend aus Amoxicillin und einem ß-Lactamaseinhibitor, verordnet werden. Bei Therapieversagen beziehungsweise Penizillinunverträglichkeit kann mit einem pneumokokkenwirksamen Fluorchinolon behandelt werden. Bei Verdacht auf eine Infektion durch Mykoplasmen, Chlamydien oder Legionellen wird eine Kombinationstherapie aus Betalaktam/Makrolid empfohlen (5). Mittelschwere CAP: Normalstation CRB-65-Risikoscore = 1–2: Vor Therapieeinleitung empfiehlt sich die Entnahme von zwei Blutkulturen, Durchführung eines Legionella-Ag-Test im Urin und gegebenenfalls eine diagnostische Pleurapunktion (5). Pneumokokken bleiben die häufigsten Erreger. Einbezogen in die Therapieplanung müssen Haemophilus influenzae, gramnegative Enterobakterien, Legionella pneumophila sowie respiratorische Viren. Chlamydia pneumoniae spielt als Erreger der CAP in Deutschland eine untergeordnete Rolle (16). Die antimikrobielle Initialtherapie sollte parenteral appliziert werden. Gut wirksame Antibiotika sind die Cephalosporine Ceftriaxon, Cefotaxim, Cefuroxim oder Aminopenicilline mit ß-Lactamaseinhibitor wie Amoxicillin/Clavulansäure oder Ampicillin/Sulbactam. Beobachtungsstudien zeigen einen Vorteil der Kombinationstherapie mit Makroliden bei schwerer erkrankten Patienten (17–19). Bei Verdacht einer Legionelleninfektion sollte eine Kombinationstherapie durchgeführt werden (14). Neue Fluorchinolone (Moxifloxacin, Levofloxacin) können als Monotherapie eingesetzt werden. Schwere CAP (sCAP): Intermediär- oder Intensivstation CRB-65-Risikoscore = 2–3: Um ausreichende Serum- und Gewebekonzentrationen zu erreichen, sollte die Therapie parenteral appliziert werden, nach Stabilisierung des Zustandes ist bei Patienten mit sCAP, die nicht mehr intensivmedizinisch überwacht werden müssen, eine Deeskalation auf eine orale Therapie möglich (20). CAPNETZ-Daten zeigen, dass die meisten sCAPPatienten nicht zur Risikogruppe für P. aerigunosa TABELLE 3 Risiken für eine Pseudomonas-aerigunosa-Pneumonie Schwere strukturelle chronische Lungenerkrankung mit Antibiotikavortherapie oder vorausgegangener Hospitalisierung in den letzten 3 Monaten z. B. COPD mit Lungenemphysem Bekannte Kolonisation durch P. aerigunosa Bronchieektasen Mukoviszidose 11 zählen. Bei Patienten ohne Risiko für P. aeroginosa wird eine Kombination eines ß-Lactams mit einem Makrolid oder Gyrasehemmer empfohlen (5). Bei einer ausgewählten Patientengruppe kann eine Monotherapie mit pneumokokkenwirksamen Flurochinolonen erfolgen (21), bei schwerem Krankheitsbild und Beatmungspflichtigkeit in Kombination mit einem ß-Lactam (22). Bei Patienten mit strukturellen Lungenerkrankungen und antibiotischer Vortherapie sollte eine empirische antipseudomonale Kombinationstherapie aus einem pseudomonas- und pneumokokkenwirksamen ß-Lactam (Piperacillin + Sulbactam oder Tazobactam, Cefepim, Imipinem, Meropenem) alternativ einem pseudomonasaktivem Fluorchinolon (Ciprofloxacin, Levofloxacin) eingeleitet werden (5). Dauer der antimikrobiellen Therapie ● Die antibiotische Therapie bei leichter und mittelschwerer CAP kann 48–72 Stunden nach klini- scher Besserung mit Entfieberung, frühestens nach fünf Tagen beendet werden. ● Eine Therapiedauer von mehr als sieben Tagen ist im Regelfall nicht erforderlich (5). ● Eine Therapie von acht bis zehn Tagen beziehungsweise fünf Tagen nach Entfieberung wird bei sCAP-Patienten ohne Komplikationen empfohlen, bei nachgewiesener Infektion durch P. aeruginosa acht bis 15 Tage. Verlaufskontrollen Eine Reevaluation ambulant behandelter Patienten ist nach 48 (–72) Stunden empfohlen. Hospitalisierte Patienten müssen bezüglich Krankheitsprogression und Vorhandensein der Kriterien einer Überwachungspflicht beobachtet werden. Eine Verlaufsbeobachtung von CRP wird empfohlen, ein fehlender Abfall nach 72 Stunden kann ein Hinweis für ein Therapieversagen sein. Eine radiologische Abschlusskontrolle wird bei Patienten mit Risikofaktoren für eine Tumorerkrankung frühestens 14 Tage nach Therapieende empfohlen (5). TABELLE 4 Antibiotische Therapieoptionen zur empirischen Initialtherapie bei CAP nach 5 Behandlungsort Bevorzugte Therapieoption Substanzen/Tagesdosis Ambulante Therapie ohne antibiotische Vorbehandlung oder schwere Begleiterkrankung Mittel der Wahl: Aminopenicillin p.o. Alternativ: Makrolid p.o. Tetracyclin p.o. Amoxicillin = 70 kgKG: 3 × 1 g p.o. < 70 kgKG: 3 × 0,75 g p.o. Azithromycin 1,5 g Gesamtdosis p.o. Clarithromycin 2 × 500 mg p.o. Doxycyclin initial 1 × 200 mg p.o. = 70 kgKG: 1 × 500 mg p.o. < 70 kgKG: 1 × 100 mg p.o. Ambulante Therapie mit antibiotischer Vorbehandlung oder schweren Begleiterkrankungen oder Heimbewohner Mittel der Wahl: Aminopenicillin/ ß-Lactamaseinhibitor p.o. Therapie auf Normalstation Mittel der Wahl: ß-Lactam i.v. ggfs.s.+ Makrolid i.v./p.o. Alternativ: Fluorchinolon II/IV p.o. Alternative: Fluorchinolon II/IV i.v./p.o. Amoxicillin/Clavulansäure 2 × 875/125 mg p.o. Ampicillin/Sulbactam 2 × 750 mg p.o. Moxifloxacin 1 × 400 mg p.o. Levofloxacin 1 × 500 mg p.o. Ceftriaxon 1 × 2 g i.v. Cefotaxim 3 × 2g i.v. Amoxicillin/Clavulansäure 3 × 2,2 g i.v. Ampicillin/Sulbactam 3 × 3 g i.v. ggfs.s. + Clarithromycin 2 × 500mg i.v. oder orales Makrolid wie oben Moxifloxacin 1 × 400 mg i.v. oder p.o. Levofloxacin 1–2 × 500 mg i.v.oder p.o. Therapie auf Intensivstation Mittel der Wahl: ß-Lactam i.v.+ Makrolid i.v. Alternative bei Pat. ohne septischen Schock/invasive Beatmung: Fluorchinolon i.v. 12 Piperacillin/Tazobactam 3 × 4,5 g i.v. Ceftriaxon 1 × 2–4 g i.v. Cefotaxim 3–4 × 2 g i.v. + Clarithromycin 2 × 500 mg i.v. Levofloxacin 2 × 500 mg i.v. Moxifloxacin 1 × 400 mg i.v. Perspektiven der Infektiologie 2015 | Deutsches Ärzteblatt Die Impfung mit dem PCV 13 und PPV 23 wird diskutiert, um gegen weitere Kapseltypen zu schützen. Die Sächsische Impfkommission und Centers for Disease Control (CDC) haben dieses Vorgehen für Erwachsene über 60 in die Impfempfehlungen 2015 aufgenommen (25, 26). Die STIKO empfiehlt aktuell eine Pneumokokkenimmunisierung bei Erwachsenen ab 60 einmalig mit Polysaccaridimpfstoff (Tabelle 6). Angesichts der aktuellen Ergebnisse der CAPiTA-Studie wie auch den vorliegenden Daten zur Herdenimmunität wird eine Aktualisierung der Impfempfehlung seitens der STIKO erwartet. Streptococcus pneumoniae im FalschfarbenTransmissionselektronenmikroskop. Das Grampositive Bakterium scheidet viskoses Material aus, um eine Kapsel um seine Zellwand zu bilden. Foto: CNRI/SPL Agentur Focus Zusammenfassung und Ausblick Prävention durch Immunisierung In zahlreichen Studien konnte nach Immunisierung gegen Influenzaviren eine signifikante Reduktion der Influenzanachweisraten und Hospitalisierungen gezeigt werden. Eine saisonale Influenzaimmunisierung ist daher entsprechend der STIKO-Empfehlungen anzuraten (Tabelle 5). Gegen Pneumokokkeninfektionen stehen der nichtkonjugierte Impfstoff PPV 23 und die konjugierten Impfstoffe PCV 7 und PCV 13 zur Verfügung. Seit Einführung der Impfung von Kindern bis 24 Monaten mit PCV 7 beziehungsweise 13 ist ein signifikanter Rückgang der Pneumokokkeninfektionen durch die in den Impfstoffen enthaltenen Serotypen zu verzeichnen; hinzu tritt der Effekt einer guten Herdenimmunität bei nicht-immunisierten Erwachsenen (23). In der CAPiTA-Studie konnte die Immunisierung mit PCV13 das Auftreten von Impfstoff-Serotyp-bedingter CAP sowie nichtbakteriämischer/nicht-invasiver Impfstoff-Serotyp-bedingter CAP bei Patienten über 65 signifikant reduzieren (24). 14 ● Diagnostik und Therapie der CAP erfolgt entsprechend der Leitlinien 2009. ● Eine Aktualisierung wird noch in diesem Jahr erwartet – bei der Therapie wird es jedoch keine größeren Änderungen geben. ● Bei der CAP fehlen Biomarker zur Abschätzung der Krankheitsschwere und der Prognose des einzelnen Patienten. ● Forschungsprojekte wie das BMBF-geförderte PROGRESS bearbeiten die Fragestellung mittels Genotypisierung sowie Transkriptom- und Proteomuntersuchungen. Mit Ergebnissen wird in den nächsten ▄ zwei Jahren gerechnet. DOI: 10.3238/PersInfek.2015.06.05.02 Dr. med. Petra Creutz Prof. Dr. med. Norbert Suttorp Charité, Universitätsmedizin Berlin Medizinische Klinik – Infektiologie und Pneumologie, Charité Campus Virchowklinikum, Charité Camus Mitte, Charité Campus Benjamin Franklin Interessenkonflikt: Frau Creutz erklärt, dass kein Interessenkonflikt vorliegt. Von Herrn Suttorp lag bei Druckschluß kein Interessenkonflikt vor. @ Literatur im Internet: www.aerzteblatt.de/lit2315 Empfohlene Internetadressen: bqs-qualitaetsreport.de; capnetz.de; progress-cap.de; ars.rki.de IMPRESSUM E-Mail: [email protected] Perspektiven der Infektiologie in Verbindung mit dem Deutschen Ärzteblatt Verlag, Anzeigendisposition und Vertrieb: Deutscher Ärzte-Verlag GmbH, Dieselstraße 2, 50859 Köln Postfach 40 02 65, 50832 Köln Chefredakteur: Egbert Maibach-Nagel (verantwortlich für den Gesamtinhalt im Sinne der gesetzlichen Bestimmungen), Köln Geschäftsführer: Norbert A. Froitzheim, Jürgen Führer Konzeption und Redaktion: Dr. med. Vera Zylka-Menhorn Assistenz: Angelika Falk-Stiller Telefon-Sammelnummer: 02234 7011-0, Fax: 02234 7011-460; Internet: www.aerzteverlag.de E-Mail: [email protected] Chefs vom Dienst: Gisela Klinkhammer, Herbert Moll Produktmanagement: Sabine Bosch Layout: Klaus Fröhlich, Jörg Kremers, Michael Peters Druck: L.N. Schaffrath DruckMedien, Geldern Redaktionsanschrift: Ottostraße 12, 50859 Köln Telefon: 02234 7011-115, Fax: 02234 7011-568 Internet: www.aerzteblatt.de „Perspektiven der Infektologie“ erscheint in der Zuständigkeit des Ressorts „Medizinreport“ des Deutschen Ärzteblattes. Perspektiven der Infektiologie 2015 | Deutsches Ärzteblatt AMBULANT ERWORBENE PNEUMONIE Wie antibiotisch therapieren? Die Diagnostik und Behandlung erfolgt entsprechend der Leitlinien 2009. Es fehlen Biomarker zur Abschätzung der Krankheitsschwere und der Prognose des einzelnen Patienten. LITERATUR 1. www.bqs-qualitaetsreport.de/2008/ergebnisse/leistungsberei che/pneumonie/ergebnisse 2. Niederman MS, McCombs JS, Unger AN, Kumar A, Popovian R: The cost of treating community-acquired pneumonia. Clin Ther 1998; 20: 820–37. 3. Ewig S: Community-acquired pneumonia: definition, epidemiology, and outcome. Semin Respir Infect 1999; 14: 94–102. 4. Bauer TT, Ewig S, Marre R, et al.: CRB-65 predicts death from community-acquired pneumonia. J Intern Med 2006; 260: 93–101. 5. Höffken G, Lorenz J, Kern W, et al.: Epidemiologie, Diagnostik, antimikrobielle Therapie und Management von erwachsenen Patienten mit ambulant erworbenen unteren Atemwegsinfektionen sowie ambulant erworbener Pneumonie – Update 2009. Pneumologie 2009; 63: e1–68. 6. Vugt van SF, Broekhuizen BDL, Lammers C, et al.: Use of serum C reactive protein and procalcitonin concentrations in addition to symptomas and signs to predict pneumonia in patients presenting to primary care with acute cough: diagnostic study. BMJ 2013; 346: f2450. 7. Cals JW, Schot MJ, de Jong SA, et al.: Point-of-care C-reactive protein testing and antibiotic prescribing for respiratory tract infections: a randomized controlled trial. Ann Fam Med 2010; 8: 124–33. 8. Huang Y, Chen R, Wu T, et al.: Association between point-of-care CRP testing and antibiotic prescribing in respiratory tract infections: a systematic review and meta-analysis of primary care studies. Br J Gen Pract 2013; 63: 767–94. 9. Kolditz M, Ewig S, Schütte H, et al.: Assessment of oxygenation and comorbidities improves outcome prediction in patients with community-acquired pneumonia with a low CRB-65 score. J Intern Med Jan 2015; 16. DOI: 10.1111/joim.12349. [Epub ahead of print] 10. Kolditz M, Ewig S, Klapdor B, et al.: Community-acquired pneumonia as emergency: predictors of early deterioration. Thorax Published Online First: March, 17, 2015 DOI: 10.1136 / thoraxjnl-2014–206744. 11. Krüger S, Ewig S, Giersdorf S, Hartmann O, Suttorp N, Welte T; the CAPNETZ study group: Cardiovascular and inflammatory biomarkers to predict short- and long-term survival in communityacquired pneumonia. Am J Respir Crit Care Med 2010; 182: 1426–34. 12. Pletz MW, Baum von H, van der Linden M, et al.: The burden of pneumococcal pneumonia – experience of the German competence network CAPNETZ. Pneumologie 2012; 8: 470–5. 13. Welte T, Marre R, Suttorp N: What is new in the treatment of community-acquired pneumonia? Med Klin (Munich) 2006; 101: 313–20. 5 14. Von Baum H, Ewig S, Marre R, et al.: Community-acquired Legionella pneumonia: new insights from the German competence network for community acquired pneumonia. Clin Infect Dis 2008; 46:1356–64. 15. Kumar A, Roberts D, Wood KE, et al.: Duration of hypotension before initiation of effective antimicrobial therapy is the critical determinant of survival in human septic shock. Crit Care Med 2006; 34:1589–96. 16. Wellinghausen N, Straube E, Freidank H, et al.: Low prevalence of Chlamydia pneumoniae in adults with community-acquired pneumonia. Int J Med Microbiol 2006; 296: 485–91. 17. Aspa J, Rajas O, Rodrigez de CF, et al.: Impact of initial antibiotic choice on mortality from pneumococcal pneumonia. Eur Respir J 2006; 27: 1010–9. 18. Baddour LM, Yu VL, Klugman KP, et al.: Combination antibiotic therapy lowers mortality among severely ill patients with pneumococcal bacteremia. Am J Respir Crit Care Med 2004; 170: 400–44. 19. Tessmer A, Welte T, Martus P, Schnoor M, Marre R, Suttorp N: Impact of intravenous ß-lactam/macrolide versus ß-lactam monotherapy on mortality in hospitalized patients with communityacquired pneumonia. J Antimicrob Chemother 2009; 63: 1025–33. 20. Oosterheert JJ, Bonten MJ, Schneider MM, et al.: Effectiveness of early switch from intravenous to oral antibiotics in severe community acquired pneumonia: multicentre randomised trial. BMJ 2006; 333: 1193–7. 21. Leroy O, Saux P, Bedos JP, et al.: Comparison of levofloxacin and cefotaxime combined with ofloxacin for ICU patients with community-acquired pneumonia who do not require vasopressors. Chest 2005; 128: 172–83. 22. Rodriguez A, Mendia A, Sirvent JM, et al.: Combination antibiotic therapy improves survival in patients with community-acquired pneumonia and shock. Crit Care Med 2007; 35:1493–8. 23. Pilishvili T, Lexau C, Farley MM, et al.: Sustained reductions in invasive pneumococcal disease in the era of conjugate vaccine. J Infect Dis 2010; 201: 32–41. 24. Bonten MJ, Huijts SM, Bolkenbaas M, et al.: Polysaccharide conjugate vaccine against pneumococcal pneumonia in adults. N Engl J Med 2015; 19; 372: 1114–25. 25. Empfehlungen der Sächsischen Impfkommission zur Durchführung von Schutzimpfungen im Freistaat Sachsen vom 2. 9. 1993; Stand: 1. 1. 2015 26. Tomczyk S, Bennett NM, Stoecker C, et al.: Use of 13-valent pneumococcal conjugate vaccine and 23-valent pneumococcal polysaccharide vaccine among adults aged ≥ 65 years: Recommendations of the advisory committee on immunization practices (ACIP). CDC, Morbidity and Mortality Weekly Report (MMWR) 2014; 63: 822–5. 27. Epidemiologisches Bulletin, Robert Koch-Institut, August 2014, Nr. 34; www.rki.de. Perspektiven der Infektiologie 2015 | Deutsches Ärzteblatt