Zeitpunkt der Synthese und Zusammensetzung der messenger
Werbung

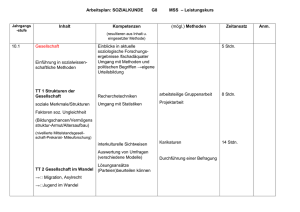
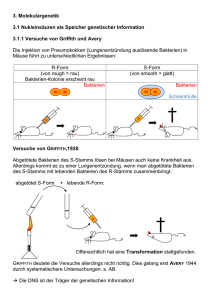
ZEITPUNKT DER SYNTHESE UND ZUSAMMENSETZUNG DER MESSENGER-RNS 331 Z e i t p u n k t der Synthese u n d Z u s a m m e n s e t z u n g der messenger-RNS bei KB-Zellen nach Adenovirus-Infektion Von K urt K öhler und T a k esh i O daka * Aus dem Max-Planck-Institut für Virusforschung, Abteilung für physikalische Biologie, Tübingen (Z. Naturforschg. 19 b, 331—336 [1964] ; eingegangen am 8. November 1963) Time of synthesis and base composition of messender-RNA in adenovirus infected KB-cells has been studied. KB-cells infected with Adnovirus type 2 do not carry out viral synthesis when low concentrations of Actinomycin are present in the medium. The whole period from the time of in­ fection up to the 16th hour after infection is sensitive to the inhibitor. During various intervals after infection, pulse labelled RNA was investigated for its base com­ position. During the course of viral synthesis kinds of RNA which show a transient tendency to match Adenovirus-DNA in its base composition appear. It is proposed that this type of RNA is messenger-RNA due to its sensitivity to Actinomycin and its base composition. Adenovirus Typ 2, dessen genetisches M aterial eine Doppelstrang-DNS i s t 1, läßt sich in Zellkultu­ ren von HeLa- oder KB-Zellen leicht vermehren. Nach der Infektion mit diesem Virus wird in der Zelle eine neue DNS synthetisiert, die mit Viruspro­ tein umhüllt, zur neuen infektiösen Einheit wird. Diese DNS hat eine von der normalen KB-Zelle ver­ schiedene Zusam m ensetzung 1. Außerdem werden mindestens 2 neue Proteine synthetisiert2, die nur in infizierten Zellen mit Antiseren gegen gereinigtes Adenovirus nachweisbar sind. Die Synthese dieser Proteine sollte nach den allgemeinen Erfahrungen durch eine besondere Messenger-RNS (m-RNS)** vermittelt werden, die an der infektiösen Virus-DNS synthetisiert wird und spezifischer Inform ationsträ­ ger ist. Eine ausführliche Darlegung der messenger-RNSHypothese ist kürzlich von S i b a t a n i 3 geschrieben worden, so daß die folgenden Postulate ohne Kom­ m entar bleiben können. Messenger-RNS sollte erstens ein der DNS ent­ sprechendes oder angenähertes Basenverhältnis haben, sofern beide Stränge oder die gesamte Länge der Stränge statistisch gleiche Basenverteilung haben und m-RNS produzieren. Sie sollte zweitens durch kurze Pulse mit Isotopen zu markieren sein, drittens sich mit der DNS, an der sie gebildet wurde, hybri­ disieren lassen und viertens eine spezifische P rotein­ Z e l l k u l t u r e n : Das Adenovirus Typ 2 (St. Louis) wurde auf KB-Zellen vermehrt, die von der Italdiagnostic bezogen wurden. Die Anzucht geschah in R o u x - Kolben (ca. 160 cm2 Fläche) mit Hilfe von E a g l e s Medium (modifiziert nach D u l b e c c o 5 bzw. M a r c u s und Mitarbb. 6) und 5% Kälberserum. Vor der Infektion wurden die Zellschichten nach zweimaliger Waschung mit „Tris“ gepufferter Salzlösung 5 mit 0,5 ml Virussuspension inokuliert und 60 Min. bei Zimmertem­ peratur stehengelassen. Darauf wurden die Kulturen mit dem modifizierten E a g l e s Medium übergossen und bis zur Aufarbeitung inkubiert. Sie wurden dann trypsiniert und in einem Zentrifugenglas gesammelt und ca. 108 Zellen in 30 ml modifiziertem E a g l e ohne Phosphat 30 Min. lang in Suspensionskultur gehalten, * Stipendiat der „Alexander v. Humbold-Stiftung“. 1 M. G r e e n , Cold Spring Harbor Sympos. quantitat. Biol. 27, 219 [1962]. 2 z. B. W . C. W il c o x , H. S. G in s b e r g u . T. A . A n d e r s o n , J. exp. Medicine 118, 307 [1963]. ** Abkürzungen: m-RNS = Messenger RNS, r-RNS = Ribosomen-RNS, A = Adenylsäure, U = Uridylsäure, G = Guanylsäure, C = Cytidylsäure. 3 A. S ib a t a n i , Exp. Cell Res. Suppl. 9, 289 [1963]. 4 E. R e i c h , R . M . F r a n k l i n , A. J. S h a t k i n u . E. L. T a tu m , Proc. nat. Acad. Sei. USA 48.1238 [1962]. 5 R . D u lb e c c o u . G. F r e e m a n , Virology 8, 396 [1959]. 6 P . I. M a r c u s , S . J. C i e c i u r a u . T . T . P u c k , J. exp. Medicine 104, 615 [1956]. synthese im zellfreien System ergeben. Fünftens wird m-RNS-Synthese durch Actinomycin spezifisch gehemmt. Actinomycin D beeinflußt die Synthese verschiede­ ner RNS-Viren, wie z. B. Polio- und Mengovirus nicht. Dagegen wird z. B. die Vermehrung des Vaccinevirus (DNS) im Cytoplasma von L-Zellen unterdrückt4, was auf die Beteiligung einer m-RNS schließen läßt. Es werden hier Ergebnisse mitgeteilt, die zeigen, daß Actinomycin die Adenovirussynthese hemmt und daß sich eine durch Puls markierte RNS nach Infektion in ihrer Zusammensetzung der Adeacovirus-DNS annähert. M aterial und M ethoden Dieses Werk wurde im Jahr 2013 vom Verlag Zeitschrift für Naturforschung in Zusammenarbeit mit der Max-Planck-Gesellschaft zur Förderung der Wissenschaften e.V. digitalisiert und unter folgender Lizenz veröffentlicht: Creative Commons Namensnennung-Keine Bearbeitung 3.0 Deutschland Lizenz. This work has been digitalized and published in 2013 by Verlag Zeitschrift für Naturforschung in cooperation with the Max Planck Society for the Advancement of Science under a Creative Commons Attribution-NoDerivs 3.0 Germany License. Zum 01.01.2015 ist eine Anpassung der Lizenzbedingungen (Entfall der Creative Commons Lizenzbedingung „Keine Bearbeitung“) beabsichtigt, um eine Nachnutzung auch im Rahmen zukünftiger wissenschaftlicher Nutzungsformen zu ermöglichen. On 01.01.2015 it is planned to change the License Conditions (the removal of the Creative Commons License condition “no derivative works”). This is to allow reuse in the area of future scientific usage. 332 K. KÖHLER UND T. ODAKA sodann wurden 4 mC Phosphat zugefügt und 25 Min. weitergerührt. Danach wurden die Zellen abzentrifu­ giert und mit einer Dodecylsulfat-Lösung von 60 cC lysiert (s.u.). E x t r a k t i o n : Für die Extraktion wurden meh­ rere Methoden durchprobiert7-10 und schließlich das folgende als das einfachste und erfolgreichste Verfah­ ren beibehalten: P henol: (handelsübl., Fa. Merck, Darmstadt) wurde mit Wasser .gesättigt und auf 100 ml 5 ml 1-n. NaOH zugefügt, so daß sich ein pn von 7 —8 er­ gab. D odecylsulfat: zu 100 ml Salzlösung 5 von pn 7,4 wur­ den 2 g Dodecylsulfat (Fa. Heyl, Berlin, 2-mal ge­ reinigt und kristallisiert nach C restfield und Mit­ arbb. n ) und 0,125 g Bentonit Nr. 2 (Fa. Roth, Karlsruhe) gegeben. Beide Medien wurden auf 60 C vorgewärmt und die übliche zweimalige Phenolextraktion mit je 50 ml von jedem der genannten Medien durchgeführt; nach 5 Min. Schütteins wurden die Phasen durch Zentrifuga­ tion getrennt. Die vereinigten Pufferphasen wurden mit 3 Volu­ mina Alkohol gefällt und über Nacht bei —20 °C stehengelassen. Danach wurde zentrifugiert („KühlStock“ 3000 U/min, 15 Min.), einmal mit Alkohol ge­ waschen und das Sediment mit 20 ml 0,1-m. NaCl-Lösung in 0,05-«. N a-P04-Puffer und einer Spur Bentonit bei Zimmertemperatur gerührt. Der Überstand wurde säulen-chromatographisch auf getrennt. S ä u l e n c h r o m a t o g r a p h i e : Es wurden die Erfahrungen von Sueoka u . a. 10, 12 genutzt. 12 g HyfloSupercel wurden mit 3 ml methyliertem Albumin ge­ koppelt und eine Säule von ca. 2 cm Durchmesser und ca. 10 cm Höhe gegossen. Auf diese wurde mit 0,3 atm Druck der Überstand der Extraktion absorbiert und 2mal mit 20 ml 0,1-m. NaCl (ph 6,7) gewaschen. Es wurde mit einem log. Gradienten von 0,1-m. nach 2 -m. NaCl eluiert. Die Apparatur enthielt ein Durchflußphotometer (LKB-Uvicord, Messung bei 254 la/x) und registrierendem Schreiber, sodann einem „Durchfluß­ zählrohr“, welches an einem registrierenden Schreiber (Modell F + H) angeschlossen war. Die 5 ml Proben wurden schließlich mit einem Fraktionssammler gesam­ melt. (Das „Durchflußzählrohr“ bestand aus einer Spi­ rale aus Polyäthylenschlauch und einem Endfensterzählrohr FHZ 12 a). Die Proben wurden im Zeiss-Spektralphotometer und mit einem Flüssigkeitszählrohr (FHZ 44) an einem Telefunkengerät nachgemessen. 5, 217 [1962]. J. E. D a r n e l l , B i o d i e m . B i o p h y s i c . R e s . C o m m . 7,4 8 6 [1962]. G . P . G e o r g i e v u . V. L. M a n t i e v a , B i o c h i m . b i o p h y s i c a A c t a [ A m s t e r d a m ] 61. 153 [1962]. L. P h i l i p p s o n , J. G e n . P h y s i o l . 4 , 899 [1961]. A . M . C h e s t f i e l d , K. C . S m i t h u . F. W. A l l e n , J. b i o l . C h e m i s t r y 216, 185 [1955]. 7 H . H . H ia tt, 8 9 10 11 K. J. m o le c u la r B io l. S cherrer u . B a s e n a n a l y s e : Die für die Basenanalye vor­ gesehenen Röhrchen wurden vereinigt, mit Hefe-RNS versetzt und mit 0,2-n. Perchlorsäure (Endkonz.) ge­ fällt. Nach 15 Min. (bei 4 cC) wurde abzentrifugiert, der Überstand abgekippt und sofort 0,5-n. KOH zuge­ geben und 18 Stdn. bei 37 °C hydrolysiert. Das mit Perchlorsäure in Gegenwart von Phenolrot bei 4 °C neutralisierte Hydrolysat wurde auf eine Dowex 1 x 2 (400 mesh) Säule, ca. 1 cm Durchmesser, 35 cm Höhe, gegeben und mit einem log. Gradienten von H20 nach 0,1-n. HCl eluiert13. Die Elution der Säulen wurde mit Durchflußphotometer und -zählrohr überwacht. Die Pro­ ben wurden einzeln und vereint gemessen. Die Ergeb­ nisse sind Mittelwerte aus 3 Messungen. Actinomycin D stellte uns Fa. Merck, Sharp u. Dome, New York, zur Verfügung. Die im folgenden be­ schriebenen Tests wurden im Dunkeln in 5 cm Durch­ messer Falcon-Petrischalen durchgeführt; die Antiseren wurden durch Injektion von gereinigtem Adenovirus 14 in Kaninchen gewonnen. Der Agardiffusionstest nach O u c h t e r l o n y wurde ebenfalls in 5 cm-Falcon-Petrischalen angesetzt, wobei 1% Reinagar-„Behringwerke“Gel benutzt wurde. E rgebnisse 1. Versuche m it A ctin o m yc in In einer ersten Versuchsreihe wurden verschie­ dene Konzentrationen von Actinomycin auf infi­ zierte und nicht infizierte Zellen gegeben. Eine Dauerapplikation von nur 0,05 y/ml hemmt die Ver­ mehrung der KB-Zellen. Die gleiche Konzentration verhindert in solchen Zellen die Virus-Synthese, wie auch die Anreicherungen von Virusantigen. Abb. 1 Abb. 1. Agardiffusionstest. Im Zentrum Kaninchen-Antiserum gegen Adenovirus. In den peripheren Löchern Zellhomogenat von infizierten KB-Zellen, die 48 Stdn. in verschiedenen Kon­ zentrationen von Actinomycin belassen worden waren (Ko ohne Actinomycin). 12 J. D. M a n d e l l u. A. D. H e r s h e y , Analyt. Biodiem. [New York] 1, 66 [1963] ; N. S u e o k a u . T.-Y. C h e n g , J. molecu­ lar Biol. 4, 161 [1962]; M . T a k a i , N. K o n d o u . S . O s a w a , Biochim. biophysica Acta [Amsterdam] 55, 416 [1962]. 13 Herrn Dr. M. C esk a verdanke ich Ratschläge bei der Ein­ richtung der Methode. 14 K . K ö h l e r , Z. Naturforsdig. 17 b, 544 [1962]. 333 ZEITPUNKT DER SYNTHESE UND ZUSAMMENSETZUNG DER MESSENGER-RNS nicht infiziert nach 24 Stdn. nach 48 Stdn. tryps. n. 24 Stdn. nach 48 Stdn. + + + + + ± ± — + + + + + + — — + + + + + + — — A ctinom ycin V f 0,0000 0,005 0,01 0,03 0,05 0,1 0,3 1,0 infiziert tryps. n. 24 Stdn. nach 72 Stdn. + + + + ± ± — — nach 24 Stdn. nach 48 Stdn. + + + + + + ± — CPE CPE CPE CPE tryps. 24 Std. n. Infektion nach nach 48 Stdn. 72 Stdn. + + — — CPE CPE CPE CPE CPE ± CPE CPE CPE CPE CPE ± — ± — — Tab. 1. Einwirkung von verschiedenen Konzentrationen Actinomycin auf infizierte und nicht infizierte KB-Zellen. Zustand zu verschiedenen Zeiten nach Zugabe des Inhibitors. + : Gesunde, festsitzende Zellen (Vermehrungsrate nicht bestimmt). CPE: Zellen abgelöst, traubig verklumpt, cytopathogener Effekt. — : Tote, freischwebende Zellen oder spindlig festsitzend. 2. B asen an alyse p u lsm a rk ie rte r R N S In einer Reihe von weiteren Versuchen sollte ge­ klärt werden, ob eine rasch synthetisierte RNS k ü r­ zerer Lebensdauer existiert und ob ihre Basen- 0 - 2 2 - 4 4 - 6 6 - 8 8 -1 0 1 0 -1 2 1 2 -1 4 1 4 -1 6 1 6 -1 8 1 8 -2 0 2 0 -2 2 2 2 -2 4 K ontrolle Tab. 2. Banden im O u c h te r ­ lo n y plaques pro ml — 0 — 0 — — 0 — — — + + + + + 0** Zugabe von Actinom ycin nach Infektion [Stdn.] 00 00 zeigt einen O u c h t e r l o n y - Agardiffusionstest, bei dem bereits bei 0,03 y j ml die Banden schwächer werden, bei 0,05 7/ ml gelingt der Nachweis von Virusantigen nicht mehr. In einem weiteren Versuch wurden verschiedene Konzentrationen Actinomycin auf normale und in­ fizierte KB-Zellen in kleinen Petrischalen gegeben und diese 24 Stdn. inkubiert. Danach wurde die Hälfte der Schalen trypsiniert, neu ausgesät und wei­ tere 48 Stdn. beobachtet. Da sich infizierte Zellen nach eigenen Versuchen nicht mehr am Polystyrol (Schalenmaterial) festsetzen, konnte man sicher her­ ausfinden, welche Zellen erfolgreich infiziert waren. Tab. 1 zeigt, daß bei 0,03 7/m l die KB-Zellen in der Beobachtungszeit ungeschädigt bleiben und Virus synthetisieren. Bei 0,05 7/m l zeigen die trypsinierten infizierten Zellen, daß sie zwar infiziert sind, aber offenbar kein V irus produzieren, da sie sich nicht mehr festsetzen. Um den Zeitpunkt der Synthese von m-RNS im Zeitraum zwischen dem Eindringen des infizierten Virus und der Fertigstellung des neuen Virusmate­ rials zu erfahren, wurde in 2-Stdn.-Intervallen eine höhere Konzentration Actinomycin (4 7 /ml) verab­ folgt und nach Waschen das gewöhnliche K ultur­ medium für insgesamt 48 Stdn. belassen (Tab. 2 ). Es ergibt sich, daß die w ährend der ersten 16 Stdn. wichtige durch Actinomycin hemmbaren Vorgänge ablaufen, die für die Synthese von infektiösem Virus und Antigen benötigt werden. 2 • 107 4 • 107 Zugabe von Actinomycin zu infizierten KB-Zellen zu verschiedenen Zeiten. Zusammensetzung auf eine Beziehung zu einer DNS hinweist. Um diese Frage zu klären, wurden die in­ fizierten Zellen (wie unter Material und Methoden angegeben) mit 32P pulsm arkiert und die Nucleinsäurefraktion auf einer methylierten Albumin-Kieselgursäule aufgetrennt. Das Elutionsschema ist für infizierte wie für nicht infizierte Zellen gleich (Abb. 2.) Der markierte Gipfel pulsm arkierter RNS folgt der Ribosomen-RNS und hat daher eine Sedimenta­ tionskonstante von mehr als 28 S 10. Da bei der Länge der Pulse die Möglichkeit einer RibosomenRNS-Synthese nicht ausgeschlossen werden kann, wurde der Gipfel im Maximum in 2 Teile zerlegt und jede Schulter für sich hydrolysiert. Die Basen­ verhältnisse der (Ribosomen)-Schulter (a) und des Gipfels im Bereich der s-RNS bleiben während der 334 K. KÖHLER UND T. ODAKA Radio­ aktivität Abb. 2. Elutionsschema fiir Nucleinsäuren aus KB-Zellen 18 Stdn. nach Infektion mit Adenovirus. ganzen Zeit nach Infektion gleich (Tab. 3, Zeile 6 und 7 ). Dagegen ändern sich in der Schulter (b) die Basenverhältnisse mit einer charakteristischen Tendenz. Die Adenylsäure (A) und U ridylsäure (U) nehmen im Verlauf der Virussynthese ab, Guanyl(G ) und Cytidylsäure (C) steigen an. Etwa ab 18 Stdn. reflektiert das Basenverhältnis angenähert dasjenige der Virus-DNS (Abb. 3 ). Der Anteil von Guanylsäure und Cytidylsäure in der normalen KBZelle fällt daher von ca. 1,2 auf ca. 0,8 für die in­ fizierte Zelle ab. Das entsprechende Verhältnis für normale HeLa-, bzw. KB-DNS liegt bei 1,3 (G r e e n i , S c h e r r e r 8), für Adenovirus-DNS bei 0,8 1 (Abb. 4 ). In Gegenwart von Actinomycin (10 7/ml) wird keine m arkierte RNS gebildet. Die Region, in der normalerweise diese RNS von der Säule eluiert wird, zeigt nach Hydrolyse keine m eßbare R adio­ aktivität für Nucleotide. FUDR (1 0 ~ 4-/n.), das die Stdn. nach Infektion ■ Abb. 3. Verschiebung der Basenverhältnisse für pulsmarkierte RNS der Schulter (b) im Verlauf der Infektion. 15 R . R . R ueckert u . G. C. M u eller, [I960]. 16 M . G r e e n , Virology 18, 601 [1962]. Cancer Res. 20, 1584 Stdn. nach Infektion ■ Abb. 4. Verschiebung des Quotienten für pulsmarkierte RNS für Schulter (a) und (b) im Verlauf der Infektion. Zell- und Virus-DNS-Synthese ab sto p p t 15,16 hat in unseren Versuchen keinen Einfluß auf die Zusam­ mensetzung dieser RNS. Es wird also auch dann neue RNS gebildet, wenn keine neue Virus-DNS ge­ macht wird. Es darf daher angenommen werden, daß neu synthetisierte Virus-DNS mehr als ein Molekül m-RNS produziert. D isk u sio n Es konnte gezeigt werden, daß im Verlauf der Infektion von KB-Zellen mit Adenovirus dauernd pulsmarkierte RNS gebildet w ird; in Gegenwart von Actinomycin findet diese Synthese nicht statt. Ac­ tinomycin im Kulturmedium verhindert auch die Produktion von Virus in Zellkulturen. W ir vermu­ ten daher, daß zwischen den beiden Vorgängen ein ursächlicher Zusammenhang besteht. Da Actinomy­ cin die Synthese von m-RNS durch Reaktion mit dem Guanin der Mutter-DNS blockiert17, sollte diese RNS den messenger des Adenovirus darstel­ len. Die Verschiebung der Basenverhältnisse ist ein zusätzlicher Hinweis dafür. Wenn nun während des ganzen Zeitraumes der Virusproduktion in der Zelle m-RNS gebildet und benötigt wird, würde das bedeuten, daß wichtige Proteine schon innerhalb der ersten Stdn. syntheti­ siert werden. Solche Proteine sind bereits für die Entwicklung von DNS- und RNS-Viren bekanntge17 I. H. G o l d b e r g , M. R a b in o w it z Acad. Sei. USA 48. 2094 [1962]. u . E. R e i c h ,, Proc. nat. ZEITPUNKT DER SYNTHESE UND ZUSAMMENSETZUNG DER MESSENGER-RNS 335 worden, wo sie als „early-proteins“ bezeichnet wer­ den 18. Unter diesen early proteins wird man En­ zyme vermuten dürfen, so wie z. B. für das Adeno­ virus eine DNS-polymerase ( G r e e n 19) und even­ tuell eine RNS-polymerase für m-RNS. Die Synthese solcher Proteine beginnt nach 16 Stdn. entbehrlich zu werden; das ist die gleiche Zeit, ab der V iruspar­ tikel zusammengebaut werden, während die Synthe­ sen der DNS 16, sowie auch die der m-RNS, noch einige Stdn. andauern. Den Einfluß von Actinomycin auf ein anderes DNS-Virus-Zellsystem (Vaccinevirus) haben R e ich und M itarbb. 4 untersucht. Konzentrationen von 0,1 y/ml drücken dort die Virusausbeute auf 1/100 herab. Mengo- und Poliovirussynthese wird dagegen selbst von einer Konzentration 10 y/ml nicht beein­ flußt 4. Es ist zu vermuten, daß ein Teil der RNSViren RNS unabhängig von DNS bildet, während die DNS-Viren, entsprechend dem genetischen Ma­ terial der Zellen selber, für ihre „A usprägung“ eine m-RNS benötigen. Man findet allerdings, daß auch die Verm ehrung einiger RNS-Viren durch Actino­ mycin verhindert wird. So zeigten B a r r y und M it­ arbb., daß bei der Infektion mit Influenzavirus in Gegenwart des Inhibitors kein Hämagglutinin gebil­ det wird. R o tt und S choltissek verfolgten das P ro ­ blem weiter und fanden, daß in Gegenwart von Ac­ tinomycin die Synthese aller virusspezifischen Kom­ ponenten unterb leib t20. In diesem Zusammenhang ist interessant, daß auch die Vermehrung des Reovirus, das eine Doppelstrang-RNS besitzt, unter Ac­ tinomycin gehemmt wird 21. Für das Roux-SarcomaVirus konnte Temin 22 zeigen, daß die V irusproduk­ tion bei mehr als 0,1 y Actinomycin im ml K ultur­ flüssigkeit unterbleibt. Er fordert daher, daß hier auch eine DNS, und das müßte offenbar die der Zelle sein, für die Synthese eine Rolle spiele. Das Basenverhältnis der m-RNS nach AdenovirusInfektion verschiebt sich während der ersten 18 Stdn. in Richtung der Basenzusammensetzung der VirusDNS. Zum Verständnis dieses „Überganges“ muß beachtet werden, daß die Zellkulturen nicht synchro­ nisiert worden sind und daß der eigene Zellstoff­ wechsel wahrscheinlich nicht sofort radikal auf die Adenovirussynthese umgeschaltet wird. Eine weitere Möglichkeit ist die, daß zunächst nur an kurzen Teilstücken der Virus-DNS messenger gemacht wird, die von der durchschnittlichen Zusammensetzung ab­ weichen, bis dann nach 15 oder 18 Stdn. die ganze Länge der DNS m-RNS liefert. Die folgende Tabelle (Tab. 3, Zeile 1 —24) stellt einige Werte für Basenverhältnisse von Nucleinsäuren einiger Säugetierzellen zusammen. Allgemein gilt, daß die DNS dieser Zellen einen hohen Anteil an A und T (> 5 0 % ) hat (Zeile 1, 8, 13, 17, 22). Die RNS der Kernribosomen und der Ribosomen im Cytoplasma besitzt dagegen einen höheren P ro ­ zentsatz an G und C (Zeile 12, 14, 15, 18 —2 1 ). Die abgetrennte Schulter (a) des markierten Gipfels (Abb. 2) in den oben beschriebenen Experimenten läßt sich auf Grund ihrer Lage im Elutionsschema und der Basenzusammensetzung als r-RNS deuten (Zeile 6 ). S cherrer und D arnell 8,23 haben mit vergleichbaren Methoden HeLa-Zellen m arkiert und die Basenverhältnisse der m arkierten Gipfel be­ stimmt. Der größte Anteil dieser neugebildeten RNS scheint r-RNS zu sein (Zeile 23 —2 4 ), wenig da­ gegen m-RNS mit niedrigem G + C-Gehalt. Wenn bei unseren Experimenten eine neue RNS [Schulter (b) des Gipfels in Abb. 2] mit niedrigem G + C in viel größerer Menge gefunden wurde, so ist dies darauf zurückzuführen, daß S cherrer und D arnell logarithmisch wachsende Suspensionskulturen ver­ wendet haben, während hier bei KB-Zellen geschlos­ sene Monolayer-Kulturen, deren Zellen nicht mehr logarithmisch weiter wachsen, zugrunde liegen. Die sich teilende Zelle wird daher — im Gegensatz auch zur infizierten Zelle — eine starke Synthese an Ribosomen zeigen. W ir haben den Vorteil der „stepdown-“-Kultur 28 genutzt, mit Zellen zu arbeiten, die vorwiegend messenger m arkieren würden. Trotzdem weichen die Brutto-Basenverhältnisse zwischen KB —DNS und ihrer m-RNS voneinander ab, so daß man daraus schließen darf, daß wiederum nur ein Teil des Genoms unter den gewählten Bedingun­ gen aktiv ist. Der von uns chromatographisch angetrennte Gip­ fel radiom arkierter RNS ist nicht einheitlich; des­ halb wurde er in die Schultern (a) und (b) zerlegt. 18 z . 20 R . J. B. Z i m m e r m a n n , S . R . K o r n b e r g u . Proc. nat. Acad. Sei. USA 45, 772 [1959] ; C. S c h o l t i s s e k , R . R o t t , P . u. H . H a u s e n u . W. S c h ä f e r , Cold Spring Harbor Sympos. quantitat. Biol. 27, 245 [1962], M. G r e e n u. M. P in a , Virology 17, 603 [1962]. J. 19 B. A. K o rn b e rg , J o sse, 21 22 D. B a r r y , D. R . I v e s u . J. G . C r u i c k s h a n k , Nature [Lon­ don] 194, 1139 [1962] ; R . R o t t u. C . S c h o l t i s s e k , im Drude. P. J. G o m a to s , I . T am m , S . D a l e s u . R . M. F r a n k l i n , Viro­ logy 17, 441 [1962]. H. T e m in , Virology 20, 577 [1963], ZEITPUNKT DER SYNTHESE UND ZUSAMMENSETZUNG DER MESSENGER-RNS 336 Zeile Nr. Autor 1 2 3 Gr e e n 1 Gr e e n 1 Gr e e n 1 4 5 K öhler K öhler 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 K öhler K öhler S ibata n i 24 S ibatani S ibatani S ibatani S ibatani Chargaff 25 G eo r g iev 1 G eorgiev G eorgiev H arris 26 H arris H arris A t t a r d i, u . S mith 27 A t t a r d i. u . Sm ith S cherrer u. D arnell 23 Sch errer u . D a r n e ll Scherrer u . D a r n e ll Gewebe, Methode NS G C A U /T 21 28 29,1 21 28 29.7 28 23 20 30 21 20.6 25 27 22 27 23 21 28 24 29 27 19,8 19,9 19.2 19.8 28,2 21,5 28,7 27,7 23,6 20,2 34,2 31,0 31,1 19 17 29.3 26,8 16,3 29,3 20,4 28,7 20,2 21,0 27,2 28,4 19,0 20,2 16,9 23 22 28,4 29,9 28,7 28,4 18,6 28,4 19,7 22,1 28,8 32,7 16,4 17,3 18,0 K B-Zellen, chem. Adenovirus, chem. K B inf. m. Adenovirus 32P-Einbau 10—22 Stdn. n. Infektion K B-Zellen, 32P-Einbau K B-Zellen, inf. m. Adenovirus 24 Stdn. n. Infektion K B-Zellen, Schulter A peak I (9 Stdn. p. J.) Thym us Thym us, Nueleolen Fraktion II m -R N S m -RN S Thym us, Kernribisomen R atte, Leber R atte, Leber R atte, Leber Kerne R atte, Leber Kerne H eLa H eLa Kerne H eLa Cytoplasm a H eLa, chem. r-R N S DNS r-RNS r-RNS m -R N S DNS r-RNS r-R N S r-R N S 29 34 22.5 23,2 25,8 22,5 32,7 21,4 31,4 29.2 20,4 18,7 30,4 31,4 34,0 r-R N S 27,6 29,9 19,6 22,8 DNS 22,0 21,4 29,1 27,5 H eLa 45 s 32P-Einbau m -R N S 29,3 29,8 19,8 20,1 H eLa 35 s 32P -Einbau m -R N S 28,8 30,4 19,9 20,7 H eLa, 32P-Einbau HeLa DNS DNS RNS r-RNS ? DNS m -R N S Tab. 3. Basenverhältnisse von Nucleinsäuren aus Säugetier zellen (Auswahl). s-RNS (vermutlich). m-RNS (vermutlich), r-RNS (vermutlich), Es gelang uns bisher keine bessere Trennung zwi­ schen r-RNS und m-RNS ebenso wie eine U nter­ scheidung von Zell- und Virus-m-RNS durch Auf­ trennung von Gemischen von 3H und 14C m arkier­ ter Nucleinsäure aus infizierten Zellen. Auf Grund von Arbeiten von K u b i n s k i und M itarbb. und K a n o S u e o k a und S p i e g e l m a n 29 hatten wir uns solche Hoffnungen gemacht. Die Versuche haben Hinweise für die Existenz einer m-RNS des Adenovirus gebracht. Das ent­ scheidende Kriterium, daß die von uns gefundene m-RNS für die Synthese eines spezifischen Proteins (z.B . der Capsomeren = gruppenspez. A ntigen2) verantwortlich sei, muß aber unbedingt erbracht werden. R. de K lo e t , V. G. A l l f r e y u . A . E. M ir s k y , Proc. nat. Acad. Sei. USA 48, 471 [1962]. 25 E. C h a r g a f f , The Nucleic Acids, Vol. 1, Academic Press Inc., S . 307, New York 1955. 26 H . H a r r is u. H . W a t t s , Proc. Roy. Soc. [London], Ser. B. 156. 109 [1962]. 27 G. A t t a r d i u . J. S m it h , Cold Spring Harbor Sympos. quan­ titat. Biol. 27, 271 [1962]. 28 M. H a y a s h i u . S . S p ie g e lm a n , P r o c . n a t . A c a d . S e i. U S A 47, 1564 [1961]. 29 T. K a n o - S u e o k a u . S . S p ie g e lm a n , Proc. nat. Acad. Sei. U S A 48, 1942 [1962]; H . K u b in s k i, G. K o c h u . B. H i e r o nym i, Experientia [Basel] 19,311 [1963]. 30 W . B . W o o d u . P. B e r g , Proc. nat. Acad. Sei. USA 48. 94 [1962]. 24 A . S ib a t a n i , S . Frau L. G r o h und Frau J. K a h l danken wir für die Bereitstellung der Zellkulturen und für die Mithilfe bei einigen Versuchen. Das B u n d e s m i n i s t e r i u m f ü r w i s s e n ­ s c h a f t l i c h e F o r s c h u n g förderte in dankens­ werter Weise die Untersuchungen durch Gewährung von Sachbeihilfen.