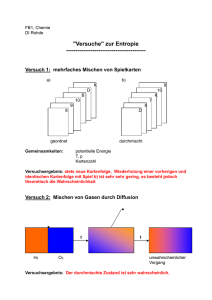
Zusätzliche Mischungsaufgaben zum Üben
Werbung

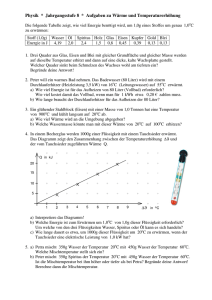
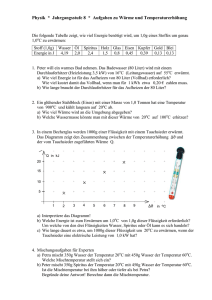
Physik * Jahrgangsstufe 8 * Übungsaufgaben zur spezifischen Wärmekapazität Die folgende Tabelle zeigt, wie viel Energie benötigt wird, um 1,0g eines Stoffes um genau 1,0oC zu erwärmen: Stoff (1,0g) Wasser Öl Spiritus Holz Glas Eisen Kupfer Gold Blei Energie in J 4,19 2,0 2,4 1,5 0,8 0,45 0,39 0,13 0,13 Führt man die so genannte spezifische Wärmekapazität c für einen Stoff wie Wasser ein, so kann man die Wärme Q bzw. die Zunahme der inneren Energie <E i mit einer einfachen Formel berechnen. Um eine Masse m an Wasser um die Temperatur ∆ϑ zu erwärmen, benötigt man die Wärme J Q = ∆E i = c ⋅ m ⋅ ∆ϑ mit c = c Wasser = 4,19 o g⋅ C 1. Mischungsaufgaben In Wasser der Masse m1 und der Temperatur ϑ 1 wird Wasser der Masse m2 und der Temperatur ϑ 2 gegossen. m2 ϑ 2 Es stellt sich eine Mischtemperatur ϑ M ein. Schätze zuerst und berechne dann diese Mischtemperatur für die folgenden Fälle: a) m1 = m2 ; ϑ 1 = 20o C und ϑ 2 = 80o C b) m1 = 2 m2 ; ϑ 1 = 20o C und ϑ 2 = 80o C c) m1 = 5 m2 ; ϑ 1 = 20o C und ϑ 2 = 80o C m1 ϑ1 Becher 2 Becher 1 Wie lauten die Ergebnisse bei a) und b), wenn sich bei sonst unveränderten Daten im Becher 2 nicht Wasser sondern Spiritus befindet? 2. a) In ein Glas mit 600g Wasser der Temperatur 20oC wird ein in einer Flamme erhitztes Kupferstück der Masse 150g geworfen. Dabei stellt sich eine Mischtemperatur von 32oC ein. Welche Temperatur hatte das Kupfer vor dem Wurf ins Wasser? b) In ein Glas mit 600g Wasser der Temperatur 20oC wird ein Kupferstück der Masse 150g und der Temperatur 100oC geworfen. Welche Mischtemperatur stellt sich ein. 3. Zum Schmelzen von 1,0g Wassereis der Temperatur 0oC benötigt man 334J an Energie. a) In ein Gefäß mit 700g Wasser der Temperatur 20oC gibt man 300g Wassereis der Temperatur 0oC. Zeige, dass nur ein Teil des Eises schmilzt und berechne dessen Masse. Welche Temperatur hat anschließend die Wasser-Eis-Mischung? b) In ein Gefäß mit 700g Wasser der Temperatur 20oC gibt man 100g Wassereis der Temperatur 0oC. Zeige, dass das Eis vollständig schmilzt und berechne die sich ergebende Mischtemperatur. Physik * Jahrgangsstufe 8 * Übungsaufgaben zur spezifischen Wärmekapazität * Lösungen 1. Wasser mit Wasser gemischt: a) Die vom warmen Wasser abgegebene Wärme entspricht genau der vom kalten Wasser aufgenommenen Wärme: Q1 = Q 2 ⇔ c W ⋅ m1 ⋅ ∆ϑ1 = c W ⋅ m 2 ⋅ ∆ϑ2 wegen m1 = m 2 also ∆ϑ1 = ∆ϑ2 1 ⋅ (20o C + 80o C) = 50o C 2 wegen m1 = 2m 2 also 2∆ϑ1 = ∆ϑ2 also ϑM − ϑ1 = ϑ2 − ϑM ⇒ 2ϑM = ϑ1 + ϑ2 ⇒ ϑM = b) Q1 = Q 2 ⇔ c W ⋅ m1 ⋅ ∆ϑ1 = c W ⋅ m 2 ⋅ ∆ϑ2 1 ⋅ (2 ⋅ 20o C + 80o C) = 40o C 3 wegen m1 = 5m 2 also 5∆ϑ1 = ∆ϑ2 also 2ϑM − 2ϑ1 = ϑ2 − ϑM ⇒ 3ϑM = 2ϑ1 + ϑ2 ⇒ ϑM = c) Q1 = Q 2 ⇔ c W ⋅ m1 ⋅ ∆ϑ1 = c W ⋅ m 2 ⋅ ∆ϑ2 also 5ϑM − 5ϑ1 = ϑ2 − ϑM ⇒ 6ϑM = 5ϑ1 + ϑ2 ⇒ ϑM = Wasser mit Spiritus gemischt: a) Q1 = Q 2 ⇔ c W ⋅ m1 ⋅ ∆ϑ1 = cS ⋅ m 2 ⋅ ∆ϑ2 1 ⋅ (5 ⋅ 20o C + 80o C) = 30o C 6 wegen m1 = m 2 also c W ∆ϑ1 = cS ∆ϑ2 also c W (ϑM − ϑ1 ) = cS (ϑ2 − ϑM ) ⇒ (c W + cS )ϑM = c W ϑ1 + cSϑ2 ⇒ c W ϑ1 + cSϑ2 4,19 ⋅ 20o C + 2, 4 ⋅ 80o C 275,8o C ϑM = = = = 42o C c W + cS 4,19 + 2, 4 6,59 a) Q1 = Q 2 ⇔ c W ⋅ m1 ⋅ ∆ϑ1 = cS ⋅ m 2 ⋅ ∆ϑ2 wegen m1 = 2m 2 also 2 ⋅ c W ∆ϑ1 = cS ∆ϑ2 also 2 ⋅ c W (ϑM − ϑ1 ) = cS (ϑ2 − ϑM ) ⇒ (2 ⋅ c W + cS )ϑM = 2 ⋅ c W ϑ1 + cSϑ2 ⇒ ϑM = 2. 2 ⋅ c W ϑ1 + cSϑ2 2 ⋅ 4,19 ⋅ 20o C + 2, 4 ⋅ 80o C 359, 6o C = = = 33o C 2 ⋅ c W + cS 2 ⋅ 4,19 + 2, 4 10, 78 a) Vom Wasser aufgenommene Wärme QW wird vom Kupfer als QKu abgegeben. J Q W = c W ⋅ m W ⋅ ∆ϑW = 4,19 o ⋅ 600g ⋅ (32 − 20)o C = 30168J = 30kJ g⋅ C 30168J 30168J = Q Ku = cKu ⋅ m Ku ⋅ ∆ϑKu ⇒ ∆ϑKu = = 516 o C J 0, 39 o ⋅150g g⋅ C ϑKu,vorher = 32 o C + 516 o C = 548 o C b) Q W = Q Ku ⇔ c W ⋅ m W ⋅ ∆ϑW = c Ku ⋅ m Ku ⋅ ∆ϑKu ⇔ (2514 + 58,5) ⋅ ϑM = 58,5 ⋅ ϑKu + 2514 ⋅ ϑW ⇒ ϑM = 3. 58,5 ⋅100 o C + 2514 ⋅ 20 o C = 22o C 2514 + 58,5 a) Das Wasser kann sich bis 0oC abkühlen und gibt dabei die Wärme QW ab: J Q W = c W ⋅ m W ⋅ ∆ϑW = 4,19 o ⋅ 700g ⋅ 20o C = 58660 J = 59 kJ g⋅ C 58660 J Damit kann man nur g = 176 g Wassereis schmelzen. Resteis: 124g 334 J b) Zum Schmelzen von 100g Wassereis benötigt man 100 ⋅ 334 J = 33400 J Wärme, die vom Wasser geliefert werden, das sich dabei abkühlt um ∆ϑW . J 33400 o 33400 J = c W ⋅ m W ⋅ ∆ϑW = 4,19 o ⋅ 700g ⋅ ∆ϑW ⇒ ∆ϑW = C = 11 o C g⋅ C 4,19 ⋅ 700 Nun stellt sich noch von den 700g Wasser der Temperatur 11oC und den 100g Schmelzwasser der Temperatur 0oC die Mischtemperatur ϑM ein: c W ⋅ 700g ⋅ (11o C − ϑM ) = c W ⋅100g ⋅ϑM ⇒ 77 o C − 7ϑM = ϑM ⇒ ϑM = 77 o C: 8 = 9, 6o C