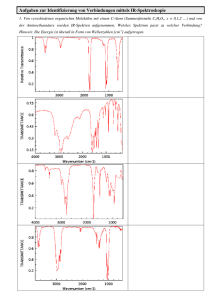
Funktionelle und strukturelle FT
Werbung

Funktionelle und strukturelle FT-IR spektroskopische Untersuchungen an der Ubichinol Oxidase Cytochrom bo3 von Escherichia coli Dissertation zur Erlangung des Grades eines Doktors der Naturwissenschaften der Fakultät für Biologie der Ruhr-Universität Bochum angefertigt im Lehrstuhl für Biophysik/ Projektgruppe Cytochrom Oxidasen vorgelegt von: Alexander Prutsch aus Mannheim Bochum (2002) Danksagung Ganz besonderer Dank gilt meinem Betreuer Herrn PD Dr. Mathias Lübben für sein Interesse an meiner Arbeit und seine ständige Diskussionsbereitschaft. Herrn Prof. Dr. W. Hengstenberg danke ich für die bereitwillige Übernahme des Korreferats. Bei Herrn Prof. Dr. Klaus Gerwert bedanke ich mich für die Bereitstellung des Arbeitsplatzes an seinem Lehrstuhl. Großer Dank gilt Herrn Dr. Benedikt Heßling für die Einweisung in die Methodik der FT-IR Messung an Proteinen, seinen vielen guten Tipps und Anregungen, sowie für die Korrektur des FT-IR-spektroskopischen Teils dieser Arbeit. Weiterhin danke ich den Mitarbeitern der Feinmechanischen Werkstatt des Lehrstuhls für Biophysik, insbesondere Herrn H. Lehky, der mir mit seinen Lehrlingen bei der Verwirklichung von Gerätschaften immer mit Rat und Tat zur Seite stand. Bei Herrn J. Rotzing von der Glasbläserei der Fakultät für Chemie möchte ich mich für die guten Lösungsvorschläge und die schnelle Realisierung dieser Vorschläge bedanken. Allen Mitarbeitern des Lehrstuhls danke ich für die gute und wissenschaftlich fruchtbare Zusammenarbeit, sowie die sehr angenehme Arbeitsatmosphäre. Den technischen Mitarbeitern des Lehrstuhls gilt ebenfalls mein Dank, ohne die eine Arbeit im Labor kaum möglich gewesen wäre. Bei Herrn Axel Martin möchte ich mich für seine Geduld und seine guten Ratschlägen bei Fragen „rund um den Computer“ bedanken. Ganz speziell möchte ich mich bei den Mitarbeitern der Projektgruppe „Cytochrom Oxidase“ bedanken, die einen großen Anteil am Gelingen dieser Arbeit hatten. Besonders sei Iris Schönhaar erwähnt, die immer ein freundliches Wort übrig hatte und von deren technischen Erfahrungen ich im Laboralltag viel profitieren konnte. Herrn Dipl. Biochem. Karsten Vogtt möchte ich für seine Diskussionsbereitschaft und für die Übernahme der Korrektur dieser Arbeit danken. Mein besonderer Dank gilt Herrn Dr. Jürgen Kurzeck, der mich seit Studienbeginn an der RUB freundschaftlich begleitete und mit mir viele Jahre zu Mittag die abwechslungsreiche und delikate Mensakost genoß. Zudem hat er bei der Durchsicht dieser Arbeit viele hilfreiche Anregungen gegeben. Meinem Vater Friedrich Prutsch danke ich für den Rückhalt und seine liebevolle Unterstützung, die erst mein Studium und meine Dissertation ermöglicht haben. Abkürzungen und Schreibweisen Schreibweisen In der Regel werden Deutsche Wörter im Text dieser Arbeit bevorzugt und Ausdrücke aus anderen Sprachen, wie z.B. aus dem Englischen nur verwendet, wenn es sich um feststehende Fachbegriffe handelt oder keine treffende Übersetzung möglich ist. Im Text sind diese Ausdrücke durch Kursivschrift hervorgehoben. Der Text berücksichtigt weiterhin die Regeln der z-, k- und c-Schreibweise, ohne diese Regeln zwangsläufig auf die aus dem Lateinischen und Englischen übernommenen termini technici anzuwenden. Die „neuen Rechtschreibregeln“ werden als Orthografiegrundlage benutzt. Bei der Bezeichnung von (bio-)chemischen Substanzen wird meist eine Abkürzung verwendet und organische Säuren werden meist in ihrer dissozierten Form abgebildet und bezeichnet. Die im Periodensystem verwendeten Elementsymbole werden bei Atomen und den Summenformeln von chemischen Verbindungen benutzt und sind hier nicht aufgelistet. Abkürzungen 1. Aminosäuren Im Text werden die Aminosäuren in der Regel mit ihrer Dreibuchstabenbezeichnung abgekürzt, in den Graphiken und bei Mutantenproteinen wird gewöhnlich ihre Einbuchstabenbezeichnung verwendet. Ala Arg Asn Asp Cys Gln Glu Gly His Ile A R N D C Q E G H I Alanin Arginin Asparagin Aspartat Cystein Glutamin Glutamat Glycin Histidin Isoleucin Leu Lys Met Phe Pro Ser Thr Trp Tyr Val L K M F P S T W Y V Leucin Lysin Methionin Phenylalanin Prolin Serin Threonin Tryptophan Tyrosin Valin 2. Bezeichnungen der Spektren Absolutspektrum APR-Differenzspektrum COFR-Absolutspektrum CO-Differenzspektrum CO-Rekombinationsspektrum Extinktionsspektrum der Probe minus Pufferreferenz Auto-photoreduktions-induziertes FT-IR Redox-Differenzspektrum von Cyt bo3 Absolutspektrum des Kohlenmonoxid gebundenen, vollständig reduzierten Cyt bo3 Differenzspektrum des reduzierten Kohlenmonoxid gebundenen minus reduzierten Cyt bo3 Photolysespektrum des COFR- Komplexes des Cyt bo3 Abkürzungen und Schreibweisen ____________________________________________________________________________________________________________________________________________________ Differenzspektrum Einkanalspektrum FT-IR Spektrum 77 K-Differenzspektrum PR-Differenzspektrum Redox-Differenzspektren VIS-Spektrum Die aus dem reduzierten Absolutspektrum minus oxidierten Absolutspektrum von Cyt bo3 resultierende Differenz FT-IR Emissionsspektrum der Infrarotquelle, nach Lichtdurchgang durch die Cyt bo3 IR-Probe Fourier-transformiertes Spektrum im mittleren Infrarot Reduziertes minus oxidiertes Cyt bo3 Differenzspektrum bei 77 K Mit caged electrons photoreduktions-induziertes FT-IR Differenzspektrum von Cyt bo3 Reduziertes minus oxidiertes Cyt bo3 Differenzspektrum bei Raumtemperatur Extinktionsspektrum im sichtbaren Spektralbereich 3. Sonstige Abkürzungen (alphabetisch geordnet) Å Abb. A.d. ADP ALV Amp. ATP BCA bp bzw. °C ca. CO COFR COMV cm-1 CoA C-Terminus Cyt ∆ 3d d.h. DNA DQ/DQH2 E E. coli EDTA FMN FT-IR His-tag IR K kDa kJ Ångström Abbildung Aqua dest Adenosindiphosphat δ-Aminolävulinat Ampicillin Adenosintriphosphat Bicinchoninsäure Basenpaare beziehungsweise Temperatur in Grad Celsius zirka Kohlenmonoxid CO gebundenes, vollständig reduziertes Cyt bo3 mixed-valence CO gebundenes Cyt bo3 Wellenzahl Coenzym A Carboxy-Terminus Cytochrom Differenz Dreidimensional das heißt Desoxyribonukleinsäure Durochinon/Durochinol Energie oder Extinktion Escherichia coli Ethylendiamintetraessigsäure Flavinmononukleotid Fourier-Transform Infrarot Oligohistidinmodifikation Infrarot Temperatur in Kelvin Kilodalton Kilojoule KPi K2 HPO4 / KH2 PO4 M Molar mA Milliamper mg Milligramm µg Mikrogramm mL Milliliter µL Mikroliter mM Millimolar ms Millisekunde N-Terminus Amino-Terminus nm Nanometer ν? Wellenzahl OD Optische Dichte PCR Polymerase chain reaction QL Low-affinity-quinol oxidation site QH High-affinity-quinone binding site RSA Rinder Serum Albumin RT Raumtemperatur s. siehe SDS Natriumdodecylsulfat SDS-PAGE SDS-Polyacrylamidgelelektrophorese Tab. Tabelle TEMED N, N, N, N´-Tetramethylethylendiamin Tris Tris(hydroxymethylaminomethan) ü.N. über Nacht UpM Umdrehungen pro Minute V Volt vgl. vergleiche v/v Volumen pro Volumen v/w Volumen pro Gewicht VIS sichtbarer Spektralbereich Inhaltsverzeichnis 1. Einleitung Seite 1.1 Aerobe Atmungskette.................................................................................................... 1 1.2 Cytochrom Oxidasen..................................................................................................... 1.2.1 Reaktionsmechanismus 1.2.2 Häm-Kofaktoren 2 5 6 1.3 Cytochrom bo3 von Escherichia coli............................................................................. 8 1.4 VIS-Spektroskopie......................................................................................................... 10 1.5 Infrarotspektroskopie................................................................................................... 1.5.1 Fourier-Transform-Infrarotspektroskopie 1.5.2 Reaktionsinduzierte Redox-FT-IR-Differenzspektroskopie 1.5.3 Allgemeine Hinweise zur FT-IR Spektroskopie an Cytochrom bo3 11 12 14 17 1.6 Zielsetzung...................................................................................................................... 19 2. Material und Methoden 2.1 Biologisches Material..................................................................................................... 2.1.1 Antikörper 2.1.2 Bakterienstämme 2.1.3 Plasmide 2.1.4 Oxidasen und Mutanten 20 20 20 20 21 2.2 Chemikalien................................................................................................................... 22 2.3 Geräte............................................................................................................................. 23 2.4 Computersoftware......................................................................................................... 23 2.5 Nährmedien.................................................................................................................... 24 2.6 Arbeiten mit Bakterien................................................................................................. 2.6.1 Antibiotika 2.6.2 Stammkulturen 24 24 24 2.6.3 DNA-Transformation 2.6.3.1 Kompetente Zellen 2.6.3.2 Elektroporation 24 24 25 2.6.4 Bakterienanzucht 2.6.4.1 Nährboden 2.6.4.2 Flüssigkultur 2.6.4.3 Aerobe Bakterienfermentation des E. coli Stamms BL21 ∆cyo recA2.6.4.4 Aerobe Bakterienfermentation des E. coli Stamms S730 25 25 25 25 26 2.7 Präparation von Proteinen........................................................................................... 2.7.1 Bakterienfermentation 2.7.2 Präparation der cytoplasmatischen Membranen 2.7.3 Solubilisierung der Oxidase 2.7.4 Immobilisierte Metallaffinitätschromatographie 2.7.5 Ultrafiltration der Oxidase 26 27 27 27 28 28 Inhaltsverzeichnis ____________________________________________________________________________________________________________________________________________________ Seite 2.8 Proteinchemische Methoden......................................................................................... 2.8.1 Proteinfällung mit Trichloressigsäure 2.8.2 Proteinbestimmung mit Bicinchoninsäure 2.8.3 Proteinbestimmung mit SDS-Lowry 2.8.4 SDS-Polyacrylamid-Gelelektrophorese 28 28 29 29 29 2.8.5 Elektrotransfer und Nachweis von Proteinen auf Nitrocellulosemembranen 2.8.5.1 Nachweis der Oligohistidinmodifikation 2.8.5.2 Immunoblot 31 31 31 2.8.6 Durochinol-Oxidase-Aktivität 32 2.8.7 Häm-Analyse 2.8.7.1 Häm-Extraktion 2.8.7.2 HPLC-Analyse 32 32 33 2.9 VIS-Spektroskopie......................................................................................................... 33 2.9.1 Absolutspektren 2.9.2 Kohlenmonoxid-Rekombinationsspektren 2.9.3 Reduziertes minus oxidiertes Cyt bo3 Raumtemperatur (RT)-Differenzspektrum 2.9.4 Reduziertes minus oxidiertes Cyt bo3 Tieftemperatur-Differenzspektrum 33 34 34 35 2.10 FT-IR Spektroskopie 2.10.1 Probenpräparation 2.10.2 Messparameter 35 36 37 2.10.3 Probenmessung 2.10.3.1 Vorarbeiten 2.10.3.2 Einkanalspektren 2.10.3.3 Differenzspektren 2.10.3.4 Datenauswertung 38 38 39 40 40 3. Ergebnisse 3.1 Erstellung eines C-terminal von Untereinheit II nicht prozessierten Wildtyps von Cyt bo3 ..................................................................................................... 41 3.1.1 C-terminale Proteolyse 41 3.1.2 Fermentation, Proteinreinigung und biochemische Charakterisierung 3.1.2.1 Fermentation und Reinigung 3.1.2.2 VIS-spektroskopische Charakterisierung und Häm-Analytik 3.1.2.3 Aktivitäten 44 44 47 55 3.1.3 Anwendungsbeispiele 56 3.2 Biochemische und VIS-spektroskopische Charakterisierung von Cyt bo3 und dessen Mutanten............................................................................................................ 3.2.1 Absolutspektren 3.2.2 Raumtemperatur-Differenzspektren 3.2.3 Kohlenmonoxid-Rekombinationsspektren 3.2.4 Aktivitäten 58 58 61 64 66 Inhaltsverzeichnis ____________________________________________________________________________________________________________________________________________________ Seite 3.3 FT-IR Probenpräparation und der Lösungsmittelaustausch von H2 O zu D2 O....... 3.3.1 Gasaustauschzelle 3.3.2 H2 O/D2 O-Austausch 3.3.3 Anwendungsbeispiele 3.4 Auto-photoreduktions-induzierte FT-IR Differenz-Spektroskopie am Cyt bo3 ....................................................................................................................... 3.4.1 Vorbedingungen zur Reproduzierbarkeit der auto-photoreduktions-induzierten FT-IR Redox-Differenzspektren 3.4.2 Spektrale Änderungen des Wildtyps in Abhängigkeit vom pH-Wert 3.4.3 Carbonylschwingungen der Hämpropionate 3.4.4 Auto-photoreduktions-induzierte FT-IR Redox-Differenzspektren von ortsspezifischen Cyt bo3 -Mutanten 67 67 69 73 75 76 81 86 95 4. Diskussion 4.1 Erstellung eines C-terminal von Untereinheit II nicht prozessierten Wildtyps von Cyt bo3 ..................................................................................................... 4.1.1 Motivation zur Erstellung eines neuen, mit verbesserten Reinigungseigenschaften versehenen Cyt bo3 Wildtyps 4.1.2 Untereinheit II der Ubichinol Oxidase Cyt bo3 4.1.3 Biochemische und VIS-spektroskopische Charakterisierung des pIN-Wildtyps 99 99 101 106 4.2 IR-Probenerstellung mit der Gasaustauschzelle......................................................... 108 4.2.1 Redox-induzierter konformativer Wechsel des Glutamat-286 von Cyt bo3 in Abhängigkeit vom H2 O/D2 O-Lösungsmittelaustausch 108 4.2.2 Der konformative Wechsel der Seitenkette des Glutamat-286 von Cyt bo3 ist an die Reduktion des Häm B gekoppelt 111 4.3 Auto-photoreduktions-induzierte FT-IR Differenz-Spektroskopie an Cyt bo3 ........................................................................................................................ 113 4.3.1 Allgemeine Hinweise zur auto-photoreduktions-induzierten FT-IR RedoxDifferenzspektroskopie 113 4.3.2 Spektrale Änderungen von ortsspezifischen Cyt bo3 Mutanten 115 4.3.3 Carbonylschwingungen der Hämpropionsäuren des Cyt bo3 4.3.3.1 Carbonyl- und Carboxylatschwingungen des low-spin Häms 4.3.3.2 Carbonyl- und Carboxylatschwingungen des high-spin Häms 4.3.3.3 Modell der Protonenleitung an den Hämpropionaten 117 123 125 128 5. Zusammenfassung ........................................................................................................ 131 6. Literaturverzeichnis .....................................................................................................134 1. Einleitung Alle Lebewesen sind auf Energie zur Erhaltung ihrer Lebensfunktionen angewiesen. Nach ihrer Ernährungsweise können Organismen in autotrophe und heterotrophe Lebensformen eingeteilt werden. Zur Energieerzeugung tragen u.a. drei Hauptprozesse bei: Die Glykolyse, die Atmung und die Photosynthese. Der Prozess der Photosynthese wandelt Sonnenlicht in chemische Energie um. Bei Pflanzen und Cyanobakterien fällt dabei molekularer Sauerstoff als „Abfallprodukt“ an. Die Glykolyse wird in fast allen biologischen Systemen beschritten. Sie ist eine Folge von chemischen Reaktionen, in denen Kohlenhydrate zu Pyruvat oxidiert werden unter gleichzeitiger Bildung von ATP und Reduktionsäquivalenten. Sie findet im Cytoplasma von Pro- und Eukaryonten, sowohl unter anaeroben, als auch aeroben Bedingungen statt. Unter aeroben Bedingungen schließt sich an die Glykolyse der Citratzyklus in der Matrix der Mitochondrien bzw. dem Cytoplasma der aeroben Prokaryonten an. Die dabei freigesetzten Reduktionsäquivalente werden in der Atmungskette verbraucht. Die übertragenen Elektronen werden letztlich, unter Bildung von Wasser, auf molekularen Sauerstoff transferiert. 1.1 Aerobe Atmungskette Die Hauptfunktion der aeroben Atmungskette ist die Erzeugung eines elektrochemischen Protonengradienten. Dieser Gradient kann nach der chemiosmotischen Theorie von Mitchell zur Energiegewinnung der Zelle genutzt werden [1]. Er treibt z.B. die ATP Synthese aus ADP und Phosphat an oder kann direkt für Transportprozesse oder die Bewegung der Flagellen bei Bakterien verwendet werden. In der Atmungskette werden die Elektronen, die ursprüglich von z.B. Kohlenhydraten oder Fettsäuren stammen über eine Elektronentransferkette auf Sauerstoff übertragen. Der molekulare Sauerstoff wird dabei zu Wasser reduziert. Die daran beteiligten Multienzymkomplexe sind bei Eukaryonten in der inneren Mitochondrienmembran, bei Prokaryonten in der Cytoplasmamembran lokalisiert. Die Protonen werden von den transmembranen Komplexen von der Cytoplasma- bzw. Matrixseite der Membran auf die gegenüberliegende Seite transloziert, die u.a. bei der Synthese von ATP wieder zurückfließen. In Abb. 1.1.1 ist die Cytochrom c (Cyt c)abhängige oxidative Phosphorylierung von Pro- und Eukaryonten gezeigt. Die Oxidation der Substrate, z.B. NADH + H+, ist an die Phosphorylierung des ADP gekoppelt. Cyt c überträgt Elektronen auf die danach benannten Cytochrom c Oxidasen (Cyt c Oxidasen). Cytochrom Oxidasen stellen die terminalen Enzymen der Atmungskette dar. 1 Einleitung ____________________________________________________________________________________________________________________________________________________ Abb. 1.1.1: Schematisches Modell der an der oxidativen Phosphorylierung beteiligten Enzymkomplexe. Die membrandurchspannenden Enzyme der Atmungskette (blau), wie sie z.B. in Mitochondrien der Eukaryonten oder beim Cyt c abhängigen Zweig der Atmungskette bei Prokaryonten vorkommen, erzeugen einen elektrochemischen Protonengradienten über der Membran. Dieser kann die ATP-Synthese vermittelt durch die FO /F1 -ATP-Synthase (violett) antreiben. Zeichenerklärung: QH2 = Chinolpool. Hier soll die bakterielle Atmungskette von Escherichia coli (E. coli) etwas genauer betrachtet werden. Diesem Bakterium stehen verschiedene Dehydrogenasen (z.B. NADH Dehydrogenase, Succinat-Dehydrogenase) zur Verfügung (zur Übersicht s. z.B. [2; 3]), die organische Substrate oxidieren und Ubichinon-8 reduzieren. E. coli besitzt keinen Cyt c abhängigen Zweig der Atmungskette, folglich auch keinen b/c1 Komplex [4]. Ubichinol-8 wird direkt von den Ubichinol Oxidasen Cytochrom bo3 (Cyt bo3 ) oder Cytochrom bd (Cyt bd) oxidiert. Die dabei freigesetzten Protonen werden ans Periplasma abgegeben und die zwei Elektronen an die Ubichinol Oxidasen transferiert. Im katalytischen Zentrum der Oxidasen, dem sogenannten binuklearen Zentrum, wird molekularer Sauerstoff gebunden. Dieser wird unter Verbrauch von vier Elektronen und 4 Protonen zu Wasser reduziert (skalare H+; H+s) [5; 6]. Während dieser Reaktion werden Protonen über die Membran transloziert (vektorielle H+; H+v ). 1.2 Cytochrom Oxidasen Für 90% der gesamten biologischen Sauerstoffreduktion und für fast die Hälfte der in der zellulären Atmung umgesetzten Redoxenergie sind Oxidasen vom Häm-Kupfer-Typ verantwortlich [7; 5]. Häm-Kupfer-Oxidasen bilden eine genetische Superfamilie [8-10], die in zwei substratspezifische Gruppen unterschieden wird, den Cyt c- und den Chinoloxidasen (Abb. 1.2.1). Sie weisen vornehmlich in Untereinheit I einen hohen Grad an Aminosäure-Sequenzidentität zueinander auf (zur Übersicht s. z.B. [11]). Definiert ist die Superfamilie durch den Besitz eines sechsfach koordinierten low-spin Häms und das binukleare Zentrum, das aus einem fünffach 2 Einleitung ____________________________________________________________________________________________________________________________________________________ koordinierten high-spin Häm und einem Kupfer Ion, CuB besteht. Das low-spin Häm stellt den intermediären Elektronendonor zum binuklearen Zentrum dar, an dem die Sauerstoffanbindung und -reduktion stattfindet. Generell scheinen alle Mitglieder dieser Superfamilie Protonen über die Membran zu pumpen [5; 12; 13]. Die Anzahl der am Aufbau des Multienzymkomplexes beteiligten Untereinheiten variiert bei verschiedenen Organismen von drei bei Rhodobacter sphaeroides [14], bis dreizehn bei der mitochondriellen Cyt c Oxidase aus Rinderherzen [15]. Alle Häm-Kupfer Oxidasen bestehen mindestens aus drei Untereinheiten, wobei für die Substratbindung, den Elektronentransfer, die Sauerstoffreduktion und die translozierten Protonen nur Untereinheit I und II essentiell wichtig zu sein scheinen [16]. Abb. 1.2.1: Schematische Modelle der Topologien bei Ubichinol Oxidasen (links) und Cyt c Oxidasen (rechts) von Prokaryonten. Die Elektronen der Donorsubstrate werden über redoxaktive Zentren (hellblau) in das binukleare Zentrum (grün) geleitet. Die bei den Redoxreaktionen verbrauchten Protonen (H+s ) bzw. über die Membran translozierten Protonen (H+v ) werden durch Kanäle (dunkelbau) transportiert. Zeichenerklärung: H+s = skalare Protonen; H+v = vektorielle Protonen; QH2 = Chinolpool; Q = Chinonpool; UE = Untereinheit. Die Abb. wurde nach M. Lübben modifiziert. Die Nomenklatur der Oxidasen richtet sich nach den im Apoprotein eingebauten HämKofaktoren (z. B. Häm A, B oder O). Zuerst wird das low-spin Häm genannt, dann das highspin Häm, dem der Index „3“ hinzugefügt wird (z. B. Cyt aa3 oder Cyt bo3 ). An der Substratbindung (Chinol oder Cyt c) ist Untereinheit II beteiligt. Diese Untereinheit besteht aus einer N-terminalen transmembranen Domäne, die aus ein bis zwei α-Helices besteht und einer C-terminalen zur periplasmatischen Seite hin orientierten, globulären Domäne [8]. In dieser Domäne befindet sich in Cyt c Oxidasen ein weiteres redoxaktives Zentrum (CuA), das aus zwei CuAtomen besteht. Es stellt den primären Akzeptor für das Elektron des Cyt c dar [17]. Bei der Ubichinol Oxidase Cyt bo3 fehlt dieses redoxaktive Zentrum und es werden stattdessen bis zu zwei Chinolbindestellen in Untereinheit II postuliert. Es handelt sich dabei um die sogenannte low-affinity quinol oxidation site (Q L) und die high affinity quinone binding site (Q H), die vermutlich am Elektronentransport beteiligt sind [18-21]. In anderen Untersuchungen wird für das Cyt bo3 die Ubichinonbindestelle alternativ in Untereinheit I postuliert [22]. 3 Einleitung ____________________________________________________________________________________________________________________________________________________ Seit der 3d-Röntgenkristallstruktur-Aufklärung der Cyt c Oxidasen aus Paracoccus denitrificans [23; 24] und der mitochondrialen Rinderherz-Oxidase [15] ist das Wissen um die molekularen Vorgänge innerhalb der Oxidase-Komplexe stark angestiegen. Die bovine Oxidasestruktur konnte in neueren Arbeiten mit 2,3 Å im oxidierten- und mit 2,35 Å im reduzierten Zustand aufgelöst werden [25]. Eine im oxidierten Zustand vorliegende Cyt bo3 -Struktur mit 3,5 Å Auflösung ist seit Ende 2000 vorhanden [22]. Untereinheit I aus Cyt bo3 weist 40% Sequenzidentität mit der Cyt c Oxidase aus Rinderherzmitochondrien auf [26]. Somit können die 3dStrukturen dieser Cyt c Oxidase auch als Grundlage zum Aufbau eines Strukturmodells des Cyt bo3 herangezogen werden [5; 9]. In Anlehnung an die 3d-Strukturen von der Rinderherz Oxidase und der P. denitrificans Oxidase wurden zwei Protonenkanäle postuliert. Über diese gelangen einerseits die skalaren Protonen zum binuklearen Zentrum zur Bildung von Wasser und andererseits werden die vektoriellen Protonen über die Membran transloziert. Die Kanäle werden nach einem hochkonserviertem Lysin- bzw. Aspartatrest als K- und D-Kanal bezeichnet. Man nimmt an, dass die Protonen über ein Netzwerk (proton wire) [27] von protonierbaren Aminosäureresten und/oder fest gebundenen Wassermolekülen transportiert werden [28; 29]. Abb. 1.2.2: Anordnung vom low-spin Häm B, dem binuklearem Reaktionszentrum und Aminosäuren des D- und K-Kanals in der Membran. Die Darstellung wurde ausgehend von der Röntgenkristallstrukur des oxidierten Cyt bo 3 erstellt. Die Abb. wurde nach M. Lübben modifiziert. Abb. 1.2.2 zeigt die auf der Kristallstruktur von Cyt bo3 basierenden wesentlichen funktionalen Elemente der katalytischen Untereinheit I. Am Protonentransfer im K-Kanal scheint außer4 Einleitung ____________________________________________________________________________________________________________________________________________________ dem Glu-89 aus Untereinheit II beteiligt zu sein [30]: Das high- und low-spin Häm befinden sich im membrandurchspannenden Teil von Untereinheit I. Die Elektronen gelangen vermutlich vom „schwach“ gebundenen Chinol über das „fest“ gebundene Chinon der Untereinheit II (beide nicht dargestellt) zum low-spin Häm [21]. Dieses leitet sie zum binuklearen Zentrum weiter. Dort wird der gebundene molekulare Sauerstoff aktiviert und über eine Reihe von Zwischenzuständen zu Wasser reduziert (Abb. 1.2.3). Die Protonen gelangen von der cytoplasmatischen Seite über die Kanäle zum binuklearen Zentrum [31; 32]. Eine Verbindung vom binuklearen Zentrum zur gegenüberliegenden Seite der Membran in Form eines „starren“ Kanals aus definierten Aminosäureresten konnte bei Cyt c Oxidasen nicht nachgewiesen werden [28]. Man geht davon aus, dass vom binuklearen Zentrum ein ausgedehntes Netz von Wasserstoffbrücken zum Periplasma führt. 1.2.1 Reaktionsmechanismus Abb. 1.2.3 zeigt ein vereinfachtes Schema des Reaktionszyklus am Beispiel von Cyt c Oxidasen. Wurde zunächst angenommen, daß die vektoriellen Protonen über den D-, die skalaren Protonen dagegen über den K-Kanal transloziert werden [23], geht man nunmehr davon aus, dass die Kanäle zu unterschiedlichen Phasen des Reaktionszyklus aktiv sind [28]: Molekularer Sauerstoff bindet an das voll reduzierte Enzym R, wodurch das Intermediat A entsteht. Die Übertragung von Elektronen vom low- und high-spin Häm auf den Sauerstoff führt zur Aktivierung des Sauerstoffs und Bildung des Peroxy-Intermediats P. An den bisherigen Reaktionen ist kein Transport von Protonen gekoppelt. Erst mit der Spaltung der Sauerstoffbindung geht der Transport eines vektoriellen Protons und die Aufnahme eines skalaren Protons über den D-Kanal einher. Es entsteht das Ferryl-Intermediat F, welches durch Umsatz je eines weiteren skalaren und vektoriellen Protons zum vollständig oxidierten Komplex O reagiert. Durch Aufnahme von vier Elektronen und zwei Protonen durch den K-Kanal kann der oxidierte Komplex wieder in den vollständig reduzierten Zustand überführt werden. Bei diesem Mechanismus der Sauerstoffreduktion sind Elektronentransfer und skalarer und vektorieller Protonentransport aneinander gekoppelt [6; 33; 34]. Die Formulierung des Reaktionsschemas basiert im Wesentlichen auf Daten, die an der Cyt cOxidase aus Rinderherzmitochondrien gewonnen wurden [28]. Für das Cyt bo3 wurde ein ähnlicher Mechanismus aufgestellt [35], der sich nur im Detail von dem hier dargestellten unterscheidet. Während des Zyklus werden vier Protonen und vier Elektronen auf molekularen Sauerstoff übertragen und zwei Protonen über die Membran gepumpt. Netto werden also unter Oxidation von vier Molekülen Cyt c sechs Protonen aus dem Cytoplasma bzw. der Mitochondrienmatrix 5 Einleitung ____________________________________________________________________________________________________________________________________________________ entfernt, von denen zwei in den periplasmatischen Raum bzw. in das Lumen der Mitochondrien gepumpt werden. Abb. 1.2.3: Vereinfachter Mechanismus der Sauerstoffreduktion bei Cyt c Oxidasen. Zeichenerklärung: „R“ = vollständig reduzierte Form; „A“ = ferro-oxy Form; „“P“ = peroxy Form; „F“ = ferryl- und „O“ = vollständig oxidierte Form; „H+s “ = skalare Protonen; „H+v “ = vektorielle Protonen. Die Abbildung wurde nach Brzezinski & Ädelroth, 1998 erstellt [28]. 1.2.2 Häm-Kofaktoren Cytochrome sind elektronenübertragende Proteine, die Häme als prosthetische Gruppen oder Kofaktoren enthalten. Im Cyt c liegt das Häm kovalent am Apoprotein gebunden vor. In den Cytochrom Oxidasen sind die Häme hingegen nicht kovalent gebunden. In Abb. 1.2.4 sind die Strukturformeln einiger Häme gezeigt. Ein Häm setzt sich aus einem Tetrapyrrolsystem und einem Eisenatom zusammen (Abb. 1.2.4). In biologischen Systemen leiten sich alle Häme vom Eisen-Protoporphyrin IX ab. Das Zentralatom ist durch vier Stickstoffe des Porphyrins gebunden. Es kann darüber hinaus zwei weitere Bindungen eingehen (fünfte und sechste Koordinationstelle), die beidseitig senkrecht zur Hämebene stehen. Je nachdem, ob diese Koordinationsstellen besetzt sind, ergeben sich in der Electron-Spin-Resonance- (ESR) Spektroskopie unterschiedliche ESR-Signale, wodurch die Bezeichnung der Häme als low-spin bzw. high-spin Häm herrührt. Das low-spin Häm in Cytochrom Oxidasen liegt sechsfach koordiniert mit zwei Histidinen als axialen Liganden vor. Das high-spin Häm ist an der fünften Koordinationsstelle mit einem Histidin ligandiert, die sechste, freie Koordinationsstelle stellt u.a. den Bindungsort für molekularen Sauerstoff und andere externe Liganden, wie z.B. Cyanid und Kohlenmonoxid dar. Die Eisenatome der Häme können in der Oxidationsstufe +2 (Ferroform) und +3 (Ferriform) vorliegen. In der Spektroskopie im 6 Einleitung ____________________________________________________________________________________________________________________________________________________ sichtbaren Bereich (VIS-Spektroskopie) lässt sich dieser Redoxwechsel der beiden Häme bei Cytochrom Oxidasen gut voneinander unterscheiden (1.4). Abb. 1.2.4: Strukturformeln von Hämen. Oben ist die Struktur des Eisen-Tetrapyrrolsystems unter Angabe der Ringbezeichnung der Heterocyclen (A, B, C und D) wiedergegeben. Zusätzlich sind in rot einige Atome markiert, um einige wichtige IR-aktive Schwingungen der Häme hervorzuheben. Die Propionsäuren können im Protein sowohl protoniert als auch deprotoniert vorliegen. Unten sind die Modifikationen für die Reste R1 und R2 wiedergegeben. Je nach Modifikation ergibt sich dann die Bezeichnung des vorliegenden Häm-Typs. Das Häm O des Cyt bo3 unterscheidet sich hierbei durch die Hydroxyethylfarnesylgruppe vom Häm B. Diese Modifikation wird durch eine Protohäm IX-Farnesyltransferase (CyoE) katalysiert (Abb. 1.2.5) [36]. Abb. 1.2.5: Hämbiosyntheseweg in E. coli. Die beteiligten Gene und deren Genprodukte sind links bzw. rechts vom Biosytheseweg angegeben. Die Hämpropionate sind in rot, die Modifikationen in denen sich Häm B und Häm O unterscheiden sind in blau dargestellt. Sonstige Erklärungen s. Text. Die Abb. wurde nach Mogi et al., 1994 [36] und Verderber et al., 1997 modifiziert [37]. 7 Einleitung ____________________________________________________________________________________________________________________________________________________ In Abb. 1.2.5 ist der Häm-Biosyntheseweg von E. coli für Häm B und Häm O dargestellt. Die wichtige Vorstufe δ-Aminolävulinat (ALV) kann auf zwei unterschiedlichen Wegen synthetisiert werden. In vielen Eu- und Prokaryonten, z.B. bei Mammalia und Rhodospirillacaen, wird ALV durch Kondensation von Glycin und Succinyl-CoA erhalten (grauer Kasten in Abb. 1.2.5). Diese einzelne enzymatische Reaktion (C4 -Weg) wird von der ALV-Synthase katalysiert [38]. Bei E. coli wird ein alternativer Biosyntheseweg beschritten. ALV wird hierbei in drei Reaktionsschritten ausgehend vom fünf Kohlenstoffatom-Gerüst des Glutamats (C 5 -Weg) erhalten [39; 40]. Bei Inaktivierung des hemA-Gens (die GTR-Reduktase wird von hemA und hemB kodiert) kann kein ALV in E. coli synthetisiert werden. Diese Auxotrophie lässt sich durch externe Zugabe von ALV zum Fermentationsmedium kompensieren (roter Kasten in Abb. 1.2.5). Da ALV käuflich auch in der [1- 13 C]-markierten Form erhältlich ist, ist eine spezifische Isotopenmarkierung der C1 -Atome der Hämpropionate möglich. Diese Markierung stellt eine wichtige IR-spektroskopische Identifikationsmöglichkeit von Carbonyl- und Carboxylatschwingungen der Hämpropionate dar (1.5.3). 1.3 Cytochrom bo3 von Escherichia coli E. coli besitzt mindestens zwei alternative Ubichinol Oxidasen Cyt bo3 und Cyt bd. Sie oxidieren und reduzieren die gleichen Substrate, unterscheiden sich jedoch grundlegend in ihrem Aufbau. Cyt bd ist ein Heterodimer [4; 41], dessen Untereinheiten I und II vom cyd-Operon kodiert werden [42]. Dieses Enzym wird bei niedrigen Sauerstoffpartialdrücken von E. coli exprimiert [43] und stellt keine Protonenpumpe dar [6]. Es weist ein low-spin Häm B558 und ein binukleares Zentrum auf, das aus zwei Hämen, Häm B595 und Häm D, besteht [44]. Die Untereinheiten des Cyt bd weisen weder Sequenzhomologien zu Cyt bo3 noch zu anderen Häm-Kupfer Oxidasen auf. Somit gehört es nicht in die Superfamilie der Häm-Kupfer Oxidasen und soll in dieser Arbeit nicht weiter beschrieben werden. Eine dritte Chinoloxidase, die sogenannte Ubichinol Oxidase III (Cyx) die von appBC- (cyxAB) kodiert werden könnte, kann aus der E. coli Datenbank (EcoMap7 und EcoSeq7, ncbi.nlm.nih.gov/repository/Eco/EcoMap7) entnommen werden. Sie soll hier ebenfalls nicht weiter vorgestellt werden. Cyt bo3 hingegen gehört zur Superfamilie der Häm-Kupfer-Oxidasen [9; 12]. Das cyo-Operon dieser Ubichinol Oxidase weist fünf offene Leserahmen, cyoABCDE, auf [26]. Die ersten vier kodieren für die Untereinheiten II, I, III und IV [45], der fünfte für die Protohäm IX-Farnesyltransferase (Häm O Synthase) [46-48]. Die Expression dominiert bei hohen Sauerstoffpartialdrücken [4; 43]. Die vier Untereinheiten bestehen aus ca. 1250 Aminosäuren, weisen ein Mole8 Einleitung ____________________________________________________________________________________________________________________________________________________ kulargewicht von ca. 142 kDa auf [49] und besitzen alle transmembrane α-Helices [50]. Dabei werden Untereinheit I fünfzehn, Untereinheit II zwei, Untereinheit III fünf und Untereinheit IV drei membrandurchspannende α-Helices zugeschrieben. Das Enzym ist durch KCN [51] und andere Inhibitoren hemmbar (zur Übersicht s. [52]). Cyt bo3 katalysiert die zwei Elektronen Oxidation des Ubichinol-8 und die vier Elektronen Reduktion des molekularen Sauerstoffs zu Wasser [4]. Diese Redox-Reaktionen sind an der Erzeugung eines elektrochemischen Protonengradienten über der cytoplasmatischen Membran beteiligt, einerseits durch die skalare protolytische Reaktion und andererseits durch den redoxgekoppelten Protonenpump Mechanismus [53; 54]. In Untereinheit I ist das low-spin Häm B, das high-spin Häm O und das Kupfer Atom (CuB) lokalisiert (Abb. 1.2.2). An der Komplexbildung der drei Metallatome sind ein oder mehrere Histidine beteiligt [55-57]. Substitution eines dieser Metalliganden führt zu inaktiven, jedoch meist in der Membran assemblierten Enzymen. Häm O und CuB bilden das binukleare Reaktionszentrum, den Ort der Sauerstoffaktivierung und -reduktion [58]. Häm B ist am Elektronentransfer in das Reaktionszentrum beteiligt. Am Elektronentransfer ist vermutlich auch ein festgebundenes Ubichinon-8 in QH beteiligt, das in unmittelbarer Nähe zu Häm B liegt [19; 20]. Dieses „fest“-gebundene Chinon geht jedoch bei Detergenzsolubilisierung mit Triton-X 100 [59] bzw. n-Octyl-β-D-Glucosid [22] verloren. In Abramson et al., 2000 [22] wird aus der Elektronendichtekarte abgeleitet, dass für dieses Chinon an der postulierten Bindestelle kein Platz vorhanden ist. Stattdessen wird eine Chinonbindestelle in Untereinheit I postuliert. Hierbei ist jedoch anzumerken, dass die zur Strukturaufklärung benutzten Cyt bo3 -Kristalle aufgrund der Kristallisationsbedingungen mit n-Octyl-β-D-Glucosid kein festgebundenes Chinon aufweisen. Untereinheit II weist neben den zwei N-terminal gelegenen, durch eine kurze cytoplasmatische Schleife verbundenen transmembraneren Helices eine große, hydrophile, periplasmatische C-terminale Domäne auf [50]. Es ist kein CuA vorhanden und Cyt c kann nicht gebunden werden. Stattdessen bindet und oxidiert Untereinheit II das Substrat Ubichinol-8 an der sog. low affinity quinol oxidation site (Q L) und transferiert die Elektronen über QH und Häm B an das binukleare Reaktionszentrum [20; 21; 35]. Untereinheit III und -IV des Cyt bo3 sind für die Assemblierung des binuklearen Zentrums in Untereinheit I notwendig [48], aber nicht in die katalytischen Funktion involviert [51]. 9 Einleitung ____________________________________________________________________________________________________________________________________________________ 1.4 VIS-Spektroskopie Bei der Absorption von elektromagnetischer Strahlung im sichtbaren Wellenlängenbereich (VIS; ca. 400-800 nm, ∆E ≈ 400 kJ/mol) werden elektronische Übergänge des angeregten Moleküls beobachtet. Die Häm-Gruppen der Cytochrome bestimmen die Absorptionseigenschaften in diesem Spektralbereich und geben dieser Proteinklasse ihre charakteristische Farbe. Die spektralen Eigenschaften der Cytochrome sind einerseits vom Häm-Typ abhängig (z.B. Häm B, Häm O) und andererseits von der sie umgebenden Polypeptidkette, d.h. chemisch identische Häme können unterschiedliche Absorptionsmaxima im Cytochrom aufweisen. Die Nomenklatur folgt dann ihren Absoptionseigenschaften, z.B. Häm B562 bzw. Cyt b562 . Durch Einstrahlung von Licht der geeigneten Wellenlänge können bei Cytochromen vier verschiedene elektronische Übergänge angeregt werden [60]. Man unterscheidet: a) Elektronische Anregungen innerhalb der Eisen-d-Orbitale. Diese Übergänge sind in der Regel im Spektrum nicht sichtbar. b) π−π* Übergänge der aromatischen Aminosäuren. c) Charged Transfer Übergänge. Sie finden zwischen Orbitalen des Porphyrins und Eisenorbitalen bzw. zwischen den Orbitalen axialer Liganden und Eisenorbitalen statt. Für das high-spin Häm werden sie in der Regel im Bereich von 600-650 nm gefunden. d) π−π* Übergänge des Häms. Diese Übergänge können mit einem Vier-Orbital-Modell beschrieben werden, das den Grundzustand S0 und die drei angeregten Zustände S1 , S2 und S3 umfasst. Die Übergangsdipolmomente liegen in der Ebene des Moleküls entlang der beiden Moleküldiagonalen durch die N-Atome. Der energetisch höchste Übergang S0 ? S3 liegt zwischen 390 und 450 nm und wird als Soret-Bande bezeichnet, auch γ-Bande genannt. Bei Reduktion verschiebt sie zum Längerwelligen (bathochrome Verschiebung). Zwischen 500 und 600 nm liegt im oxidierten Zustand eine breite Absorptionsbande vor. Reduziertes Cyt bo3 zeigt um 530 nm die β-Bande (S0 ? S2 ) und bei 560 nm die α-Bande (S0 ? S1 ), die zur Charakterisierung der Cytochrome herangezogen wird [61] und als vibronische Übergänge bezeichnet werden. Elektronenziehende Substituenden oder eine höhere Polarität der Umgebung bewirken eine Verschiebung zum Kürzerwelligen (hypsochrome Verschiebung). In Abb. 1.4.1 sind die oxidierten und reduzierten VIS-Absolutspektren des Cyt bo3 dargestellt (links) [51]. Aus messtechnischen Gründen wird zumeist das reduzierte minus oxidierte Differenzspektrum (Redox-Differenzspektrum) gezeigt (rechts). Die Redox-Änderungen der α-Bande werden im Wesentlichen vom sechsfach koordinierten low-spin Häm bestimmt [62-64]. An der Soret-Bande sind low-spin und high-spin Häm etwa gleichermaßen beteiligt [62; 63; 65]. Tief10 Einleitung ____________________________________________________________________________________________________________________________________________________ temperatur-Redoxdifferenzspektren bei 77 K (77 K-Differenzspektrum) führen zu einer α-Bande mit zwei Maxima bei 555 nm und 562 nm (Vergrößerung innerhalb der rechten Spektrendarstellung) [58; 66]. Diese Signalaufspaltung kann zur präzisen Einordnung der HämSpezies, die in der low-spin Hämbindetasche eingebaut ist, benutzt werden. Abb. 1.4.1: Oxidierte und reduzierte VIS-Absolutspektren (links) und reduziertes minus oxidiertes RedoxDifferenzspektrum (rechts) von Cyt bo 3 bei Raumtemperatur. Zusätzlich ist das Tieftemperatur-Differenzspektrum bei 77 K im Bereich der β- und α-Bande dargestellt. Die Abb. wurde nach Kita et al., 1984 modifiziert [51]. 1.5 Infrarotspektroskopie Bei der Absorption von elektromagnetischer Strahlung im mittleren Infrarot (mittleres IR; 4000 cm-1 -100 cm-1 , ∆E ≈ 40 kJ/mol) werden Molekülschwingungen und -rotationen angeregt. Für niedrige Schwingungsniveaus kann das Modell des harmonischen Oszillators herangezogen werden, bei dem sich die Energien der Schwingungszustände En und die Schwingungsfrequenz ν ergeben als (Gleichung 1.1): En = hν (n + ½) n = 0,1,2,3,... (1.1) Hierbei ist n die Schwingungsquantenzahl. Ein solcher Oszillator schwingt harmonisch mit der Frequenz (Gleichung 1.2): ν= 1 2p k µ mit µ= m1 ∗ m2 m 1 + m2 (1.2) Hierin ist k die Kraftkonstante des harmonischen Oszillators und µ die reduzierte Masse. Genauer werden Molekülschwingungen durch anharmonische Morse-Potentiale beschrieben, die den Bruch der schwingenden Bindung bei großen Energien wiedergeben. Ein nicht-lineares Molekül aus N Atomen hat 3N minus 6 Schwingungsfreiheitsgrade, die als Normalmoden bezeichnet werden. Sie ergeben sich aus der Bewegungsgleichung als voneinander unabhängige 11 Einleitung ____________________________________________________________________________________________________________________________________________________ Schwingungen bei der Behandlung in massengewichteten kartesischen Auslenkungskoordinaten. Ihre Frequenzen können bei Kenntnis des Schwingungs-Kraftfelds und der Geometrie des Moleküls berechnet werden. Eine Normalschwingung kann IR-Strahlung absorbieren, wenn sich während der Schwingung mindestens eine Komponente des Dipolmoments ändert. Sie wird dann als „IR-aktiv“ bezeichnet. Die Größe der Dipolmomentsänderung bestimmt den Extintionskoeffizienten der Absorption. Für die Darstellung von IR-Spektren wird meist auf der Abszisse nicht die Wellenlänge (λ, nm), sondern von rechts nach links steigend deren Reziprokwert, die Wellenzahl (ν?, cm-1 ) aufgetragen. Der Vorteil besteht darin, dass die Angabe somit proportional zur Energie der absorbierten IR-Strahlung ist. 1.5.1 Fourier-Transform-Infrarotspektroskopie Für die Absorptionsspektroskopie im mittleren-IR werden drei verschiedene Techniken genutzt. In dispersiven Spektrometern wird das Licht mit einem Prisma oder Gitter in seine Wellenlängen aufgespalten und diese einzeln detektiert. In der Laser-IR-Spektroskopie ist die Lichtquelle von sich aus monochromatisch und keine Auflösung in ein Lichtspektrum notwendig. Bei der Fourier-Transform-Infrarotspektroskopie (FT-IR Spektroskopie) wird die spektrale Information polychromatischer Strahlung über die Modulation der Intensität unter Erhalt der Frequenzinformation in ein Interferogramm umgewandelt. Dazu verwendet man in der Regel ein MichelsonInterferometer (Abb. 1.5.1). Abb. 1.5.1: Schema eines Michelson-Interferometers. Zeichenerklärung: „x“ bezeichnet die Auslenkung des beweglichen Spiegels. Dies ist das entscheidene Element in einem FT-IR-Spektrometer: Ein halbdurchlässiger Strahlteiler spaltet die polychromatische Strahlung in zwei Teilstrahlen auf. Ein Teil wird am festen Spiegel, der andere am beweglichen Spiegel reflektiert, so dass sie am Strahlteiler wieder aufeinander treffen und interferieren. Ein Teil der interferierenden Strahlen fällt auf den Detektor. 12 Einleitung ____________________________________________________________________________________________________________________________________________________ Die interferierenden Teilstrahlen haben einen unterschiedlich langen Weg zurückgelegt, wobei der Gangunterschied von der variablen Position des beweglichen Spiegels abhängt. Es wird ein Interferogramm erhalten. Gegenüber einem dispersiven Spektrometer hat ein FT-IR-Spektrometer drei Vorteile [67; 68]: a) Multiplexvorteil: Der gesamte Spektralbereich wird gleichzeitig detektiert. Dies führt zu deutlich verkürzten Spektrenaufnahmezeiten. Das Interferogramm enthält das spektrale Rauschen vom Detektor nur einmal. Dadurch erhöht sich das Signal-Rausch-Verhältnis. b) Jaquinotvorteil: Da ein Interferometer im Gegensatz zu einem Monochromator keinen Eintritts- und Austrittsspalt benötigt, besitzen FT-Spektrometer einen erheblich höheren Lichtdurchsatz. Dies führt zu einem verbesserten Signal-Rausch-Verhältnis. c) Connesvorteil: Zur internen Kontrolle der Spiegelbewegung wird ein Helium-Neon-Laser eingesetzt und damit eine hohe Wellenzahlengenauigkeit erreicht. Dies ermöglicht die präzise Spektrenaddition und somit ein hohes Signal-Rausch-Verhältnis. Mit der Fourier-Transformation wird aus dem Interferogramm das Spektrum berechnet. Das Interferogramm beschreibt die Abhängigkeit der Intensität von der Wegdifferenz x der Teilstrahlen. Für eine monochromatische Lichtquelle wird es als eine Cosinusfunktion beschrieben, wobei I0 die Teilintensität bezeichnet (Gleichung 1.3). I(x) = I0 [1+cos(2πν?x)] (1.3) Für eine nicht monochromatische Strahlungsquelle ergibt sich das Interferogramm als Integral über alle Einzelbeiträge (Gleichung 1.4). ∞ ∫ I(x) ~ S(ν?) e-2iπν?x dν? (1.4) 0 Aus diesem Interferogramm kann das Spektrum S(ν?), auch Einkanal- oder Absolutspektrum genannt, durch Fourier-Rücktransformation berechnet werden (Gleichung 1.5). ∞ S(ν?) ~ ∫ I(x) e-2iπν?x dx (1.5) −∞ Das FT-IR Spektrometer misst die Interferogramme nicht kontinuierlich, sondern an diskreten Punkten n∆x mit dem maximalen Wegunterschied der Teilstrahlen N∆x. Das Interferogramm besteht daher aus N diskreten Punkten mit dem Abstand ∆x. Die spektrale Auflösung ∆ν?ist der Kehrwert des Produkts aus dem Punktabstand ∆x und der Punktanzahl N (Gleichung 1.6). ∆ν?= 1 (N∆x) (1.6) 13 Einleitung ____________________________________________________________________________________________________________________________________________________ Zur Berechnung des Spektrums aus dem Interferogramm wird dann die diskrete Fouriertransformation verwendet (Gleichung 1.7). S(k ∆ν?) ~ N −1 ∑ I(n∆x) e(2iπ nk ) N (1.7) n =0 Die Verwendung der diskreten Fourier-Transformation kann zu Artefakten im Spektrum führen. Eine genaue Beschreibung dieser Effekte ist bei Gronholz und Herres, 1984 [69-71] oder Griffith und deHaseth, 1986 [67] aufgeführt. 1.5.2 Reaktionsinduzierte Redox-FT-IR-Differenzspektroskopie Die IR-Spektroskopie kann sowohl Informationen mit hoher Zeitauflösung von beispielweise den Peptidrückgrad-Änderungen während der Proteinreaktion geben als auch Änderungen der Konformation und Umgebung von Seitenketten auf der Ebene von individuellen chemischen Gruppen liefern [72-76]. Um Proteinreaktionen mit hoher Zeitauflösung und hohem Signal-Rausch-Verhältnis IRspektroskopisch verfolgen zu können, muss diese Reaktion jedoch mindestens einige Dutzend bis Hundertmal ausgelöst werden können. Dies erfordert in der Regel zyklisch-arbeitende, durch Licht immer wieder anregbare Proteine, wie z.B. die lichtgetriebene Protonenpumpe Bakteriorhodopsin aus Halobacterium salinarum. Um statische Informationen über individuelle chemische Gruppen zu erhalten, die an der Proteinreaktion beteiligt sind, kann ein einmaliges Auslösen der Proteinreaktion genügen. In dieser Arbeit werden die Methoden der statischen photoreduktions-induzierten Redox-FT-IR-Differenzspektroskopie (PR-Differenzspektroskopie) mit caged electrons und der statischen auto-photoreduktions-induzierten Redox-FT-IR-Differenzspektroskopie (APR-Differenzspektroskopie) ohne caged compound an Cyt bo3 verwendet. Die photo-induzierte Differenzspektroskopie [74] mit caged compounds ist in Abb. 1.5.2 am Beispiel des Cyt bo3 gezeigt: Das oxidierte Cyt bo3 wird mit einer photolabilen Substanz versetzt (caged electrons), die bei Einstrahlung mit Licht einer geeigneten Wellenlänge (< 450 nm) photolysiert und dabei ein Substrat (Elektronen in Form des Flavinsemichinon-Radikals, F*) freisetzt, das zur Bildung des vollständig reduzierten Cyt bo3 führt. Wählt man das Spektrum der Probe vor dem Belichten als Referenzspektrum (vollständig oxidiert), so erhält man durch Messung des Spektrums nach Belichtung (vollständig reduziert) und Berechnung der Extinktion nach dem Lambert-Beer´schenGesetz direkt das entsprechende Differenzspektrum (reduziert minus oxidiert). Das Differenzspektrum beinhaltet nur die aus dem Redoxübergang resultierenden Änderungen. Banden, welche in beiden Spektren unverändert vorhanden sind, heben sich bei der Subtraktion gegenseitig 14 Einleitung ____________________________________________________________________________________________________________________________________________________ auf und nur das Hintergrundrauschen der Probe und des Detektors sind im Differenzspektrum untergelagert. Abb. 1.5.2: Prinzip der PR- bzw. APR-Differenzspektroskopie am Beispiel von Cyt bo 3 . Zeichenerklärung: „hν“ = Licht geeigneter Energie, das die Reaktion auslöst. Für weiterführende Erklärungen s. Text. In dem in Abb. 1.5.2 dargestellten Differenzspektrum entsprechen positive Banden (rot) dem reduzierten, negative Banden (blau) dem oxidierten Zustand des Cyt bo3 . Die photolabilen Substanzen nennt man caged Verbindungen. Beispielsweise redet man von caged phosphate, wenn durch die Lichtbestrahlung Phosphat freigesetzt wird [77]. Ein vereinfachtes Reaktionsschema für die Photoreduktion an Cyt bo3 mit caged electrons ist in Abb. 1.5.3 dargestellt (links) [78]. Die APR-Differenzspektroskopie an Cyt bo3 benötigt keine caged-Verbindung, da in diesem Falle die Elektronen zur Reduktion vermutlich vom Protein selbst oder von Wasser stammen. Ansonsten läuft diese Meßmethode nach demselben Prinzip ab. Ein hypothetisches Reaktionsschema der Auto-Photoreduktion für Cyt bo3 ist in Abb. 1.5.3 dargestellt (rechts). Bei der PR bzw. APR-Differenzspektroskopie sind die Extinktionsänderungen sehr klein und können in den Absolutspektren visuell nicht wahrgenommen werden (Abb. 1.5.2). Sie können erst bei Bildung des Differenzspektrums identifiziert werden. Im Falle des Cyt bo3 müssen die größten Differenzextinktionen um ca. das 250-500fache gegenüber den größten Extinktionen der Absolutspektren vergrößert werden. Dies macht eine hohe Probenstabilität und Probenreproduzierbarkeit, sowie ein gutes Signal-Rausch-Verhältnis (1.5.1) unabdingbar. Bei beiden Methoden wird in dieser Arbeit nur der vollständig oxidierte und vollständig reduzierte Zustand des 15 Einleitung ____________________________________________________________________________________________________________________________________________________ Cyt bo3 im Reaktionszyklus (Abb. 1.2.3) betrachtet. Banden von am Reaktionszyklus beteiligten funktionellen Gruppen des Proteins können nur dann im Differenzspektrum erscheinen, wenn sie eine Dipolmomentsänderung zwischen der vollständig reduzierten und oxidierten Form der Oxidase erfahren, d.h. am Zyklus beteiligte chemische Gruppen von Aminosäuren oder Kofaktoren müssen nicht zwangsläufig als Bande im Differenzspektrum vorhanden sein. Abb. 1.5.3: Vereinfachtes Modell zum Mechanismus der Photoreduktion mit caged electrons (links) und dem hypothetischen Reaktionsschema bei der Auto-Photoreduktion (rechts). Zeichenerklärung: „F“ = FMN, „F*“ stellt die entsprechende photoaktivierte Spezies dar; „F -“ = Ein-Elektron reduzierte Form des FMN. Die Abb. für den Photoreduktionsmechanismus wurde nach Lübben & Gerwert, 1996 [81] erstellt. Für weiterführende Erklärungen s. Text. Bei IR-Proben, die mit der PR-Differenzspektroskopie vermessen werden sollen, werden caged electrons (FMN-EDTA-Lösung) zugesetzt. Details zum Mechanismus sind [78; 79] zu entnehmen. Dabei kann das FMN (F) bei Lichtabsorption in den aktivierten Zustand (F*) übergehen und in Anwesenheit von EDTA kann das Flavinsemichinon (F*), ein starker Reduktant, gebildet werden. Das F* kann letztlich Proteinkofaktoren, wie z.B. die Häme der Cytochrom Oxidasen reduzieren. Der sogenannte „opfernde“ Elektronendonor EDTA wird bei diesem Prozess irreversibel oxidiert und dessen Redoxprodukte überlagern die Differenzbanden des Cyt bo3 in einem großen Wellenzahlenbereich (< ca. 1630 cm-1 ). Als weitere caged Verbindung steht caged dioxygen in Ergänzung zu den caged electrons zur Verfügung, mit dem reduziertes Cyt bo3 sauerstoffabhängig oxidiert werden kann [80]. Auto-Photoreduktion in Abwesenheit externer Elektronendonoren wurde bereits an den verschiedensten Hämproteinen beschrieben [82-84]. Das Phänomen beschreibt die Reduktion der redoxaktiven Kofaktoren im Protein als Folge von Lichteinstrahlung aus dem nahen UVBereich. Bei geeigneter Lichtintensität kommt es zur vollständigen Reduktion des Cyt bo3 , das nach (Re-)Oxidation nahezu unveränderte Durochinol-Oxidaseaktivität zeigt [85]. Bei hoher Lichtintensität kommt es neben dem Prozess der Auto-Photoreduktion auch zur Degradation und 16 Einleitung ____________________________________________________________________________________________________________________________________________________ Inaktivierung des Proteins unter gleichzeitiger CO-Freisetzung. Der genaue Mechanismus dieser Prozesse ist unbekannt. In Abb. 1.5.3 (rechts) ist das hypothetische Reaktionsschema angegeben. Es wird angenommen, dass sich als Intermediat ein Porphyrylradikal (Redoxpotential E0 = +1,2-1,4 V; [86; 87]) bildet, während das Elektronen das Häm-Eisen reduziert [83; 84]. Die Reaktion ist prinzipiell reversibel. Die (Re-)Oxidation kann jedoch unter Sauerstoffausschluss weitgehend unterbunden werden [82], wie z.B. in gasdicht-verschlossenen IR-Küvetten. Das Cyt bo3 kann praktisch vollständig reduziert werden [85]. Hierfür sind drei Elektronen nötig, die somit einen „opfernden“ Elektronendonor bedingen. Es kommen beispielsweise aromatische Aminosäuren aus den Protonenkanälen der Oxidase, wie z.B Trp und Tyr (E0 = +1,05 V bzw. +0,94 V) oder Wasser, das eine Reaktion über Wasserstoffperoxid eingeht (E0 (H2 O/H2 O2 ) = 1,35 V) in Frage. Die einzige Möglichkeit, um IR-Spektren ohne Überlagerungsbanden eines externen Elektronendonors zu erstellen, bestand bisher darin, eine elektrochemische Zelle [88] zu verwenden. Die APR-Differenzspektroskopie eröffnet erstmalig die Möglichkeit auch in diese spektralen Bereiche unter Verwendung von IR-Küvetten vorzudringen. 1.5.3 Allgemeine Hinweise zur FT-IR Spektroskopie an Cytochrom bo3 Proteine bereiten als makromolekulare Substanzen, welche zur vollen Funktionalität eine Hydrathülle benötigen, bei IR-spektroskopischen Untersuchungen in dreifacher Hinsicht Probleme: (I) Die große Anzahl IR-aktiver Gruppen, deren Moden untereinander koppeln und deren Banden überlappen, lassen ein komplexes Spektrum entstehen, deren Signale nur schwer zu separieren und zuzuordnen sind. (II) Die Peptidbindung als repetitives Motiv der Proteine dominiert das Spektrum mit der sogenannten Amid I- (um 1650 cm-1 , vornehmlich C=O-Streckschwingung) und Amid II-Bande (um 1550 cm-1 , N-H Beugeschwingung und C-N Streckschwingung), neben denen schwächere Signale kaum noch aufzulösen sind. (III) Das Wasser besitzt breite und starke Banden um 1650 cm-1 und 3400 cm-1 . Proteinproben, die IR-spektroskopisch untersucht werden sollen, müssen daher hochkonzentriert sein, einen geringen Wasseranteil und eine geringe Schichtdicke besitzen. Um Banden von individuellen Proteingruppen dennoch zuordnen zu können werden in der Regel drei, auch untereinander kombinierbare Methoden angewendet: (I) Erstellung von nicht invasiven ortsspezifischen Mutanten. (II) Erstellung von spezifisch isotopenmarkierten chemischen Gruppen. (III) Austausch des Lösungsmittels H2 O zu D2 O (H/D-Austausch). In allen drei Fällen können die veränderten individuellen Proteingruppen zur Verschiebung von Banden führen, die somit der chemischen Gruppe selbst oder deren Umgebungsänderungen zugeordnet werden können. 17 Einleitung ____________________________________________________________________________________________________________________________________________________ Abschließend werden zwei Tabellen aufgezeigt, die einige für diese Arbeit wichtige Gruppenschwingungsarten und deren typische Spektralbereiche, in denen sie zu finden sind beinhalten. Tab. 1.5.1 gibt typische in Hämen gefundene Gruppenschwingungen wieder [89; 90]. Die bezeichneten C-Atome können Abb. 1.2.4 entnommen werden. Tab. 1.5.1: Häm-Schwingungena a Schwingung ν(C=O) ν as(COO-) ν s(COO-) ν(C aCm) ν(C bCb) ν s(C aCm) ν(C aCb) ν(C aN) δ(C mH) gekoppelte Schwingung ? ? ? δ(C aCmH), δ(C mX) ν(C aCm), ν(C aN), ν(C bX), δ(C bX) ν(C aN), ν(C bCb), ν(C aCm) δ(C bX), ν(C aN), δ(C aCbCb) ν(C aCb), δ(C bX), δ(C aCbCb) δ(C bX), ν(C aN), ν(C aCb) typischer Spektralbereich / cm-1 1700-1665 1620-1540 1420-1300 1560-1625 1535-1570 1450-1490 1435-1450 1360-1395 1220-1270 Der genaue spektrale Bereich in dem die Häm-Moden zu finden sind, hängt stark vom Häm-Typ, dem Redoxzustand und der Umgebung ab. Die Bezeichnungen der Häm-Moden folgt Spiro & Li, 1988 [91]. In Tab. 1.5.2 sind neben den Schwingungen der Amid Banden, auch Gruppenschwingungen von einigen ausgewählten Aminosäuren aufgeführt. Tab. 1.5.2: Einige Amid- und Aminosäure-Schwingungsbandena Zuordnung (Name) Amid A Asp, ν(C=O) Glu, ν(C=O) Amid I ν(C=O) β-Faltblatt ungeordnete Strukturen α-Helix Schleifen β-Faltblatt Amid II δ(N-H), ν(C-N) Asp ν as(COO-) Glu ν as(COO-) Asp ν s(COO-) Glu ν s(COO-) Glu δ(COH) Glu ν(C-O) Amid III δ(N-H), ν(C-N) Bandenposition/cm-1 ; Bandenposition/cm-1 ; (ε/M-1 cm-1 ) in H2 O (ε/M-1 cm-1 ) in D2 O 3250-3300 3250-3300 1716-1788 (280) 1713-1775 (290) 1712-1788 (220) 1706-1775 (280) 1600-1700 1620-1640 1640-1650 1650-1658 1660-1690 1670-1680 1480-1575 <1100, 1490-1460 1574-1579 (290-380) 1584 (820) 1556-1560 (450-470) 1567 (830) 1402 (256) 1404 (~450) 1404 (316) 1406 (~450) 1264-1450 955-1058 1120-1253 (100-200) 1270-1322 1230-1330 Referenz [92] [93] [93] [92] [92] [92] [92] [92] [92] [92] [93] [93] [93] [93] [93] [93] [92] a Der genaue spektrale Bereich in dem die angegebenen Moden zu finden sind, hängt stark vom Redoxzustand des Cyt bo 3 und der Umgebung ab. 18 Einleitung ____________________________________________________________________________________________________________________________________________________ 1.6 Zielsetzung Cytochrom Oxidasen sind die terminalen Enzyme der aeroben Atmungskette. Die membrangebundene Ubichinoloxidase Cytochrom bo3 von Escherichia coli ist Thema dieser Arbeit. Sie katalysiert die Oxidation von Ubichinol-8 und die Reduktion von molekularem Sauerstoff zu Wasser. Bei den dabei induzierten Redoxübergängen der beteiligten Kofaktoren werden Protonen über die Cytoplasmamembran transloziert. Die Redoxreaktionen des Enzyms sind an die Erzeugung eines elektrochemischen Protonengradienten gekoppelt. Ziel dieser Arbeit ist es die an dieser Kopplung beteiligten atomaren Gruppen des Cytochrom bo3 zu untersuchen. Im Rahmen dieser Arbeit sollen folgende Punkte ausgearbeitet werden: ? Es soll eine neue Cyt bo3 Wildtypvariante kloniert, homolog in E. coli überexprimiert und gereinigt werden, die keine C-terminale Proteolyse an Untereinheit II und somit keinen Verlust der zur Proteinreinigung genutzten Oligohistidinmodifikation aufweist. Anschließend soll diese Wildtypvariante auf ihre biochemischen, VIS- und IR-spektroskopischen Eigenschaften untersucht werden. Weiterhin soll die Tauglichkeit dieses Wildtypkonstrukts zur Cyt bo3 Mutantenerstellung mittels ortsspezifischer Mutagenese getestet werden. ? Um reproduzierbare Cyt bo3 IR-Spektren zu erhalten, ist eine IR-Probenpräparation unter definierten Bedingungen die Grundvoraussetzung. Zu diesem Zweck soll eine Probenpräparationskammer, die sogenannte Gasaustauschzelle, angefertigt werden. An diesen IR-Proben soll der Lösungsmittelaustausch von H2 O zu D2 O auf Vollständigkeit geprüft werden, um die postulierte Schalterfunktion an der hydrophoben Barriere der Aminosäure Glutamat-286 bei vollständigem H/D-Austausch zu untersuchen. Weiterhin sollen grundlegende Untersuchungen für eine Korrelation zwischen dem konformativen Wechsel des Glu-286 und dem Redoxübergang des Häm B aus den FT-IR-Differenzspektren abgeleitet werden. ? Mit dem Einsatz der APR-Differenzspektroskopie, die keine caged-Verbindung zum Initiieren der Proteinreaktion benötigt, sollen Cyt bo3 Wildtyp- und Mutanten-Differenzspektren erstmalig auch mit IR-Proben zwischen Calciumfluorid-Fenstern unterhalb der Amid-Regionen ausgewertet werden. Dazu sollen Kriterien erarbeitet werden, die reproduzierbare APR-Differenzspektren über einen großen Wellenzahlenbereich ermöglichen. Anschließend sollen die Carbonyl- und Carboxylatschwingungen der Hämpropionate dem APR-Differenzspektrum zugeordnet werden. Hierzu soll eine spezifische [1- 13 C]-Markierung der Hämpropionate durchgeführt werden, deren Differenzsignale im Vergleich zum ∆cyoE-Mutanten APR-Differenzspektrum dem low-spin bzw. high-spin Häm zugeordnet werden sollen. 19 2. Material und Methoden 2.1 Biologisches Material 2.1.1 Antikörper Als primärer Antikörper für den Immunoblot wird ein polyklonales Kaninchen-Antiserum gegen CyoA (Untereinheit II) verwendet [49]. Dieses wurde von Saraste und Lappalainen, EMBL, Heidelberg zur Verfügung gestellt. Als sekundärer Antikörper kommt ein mit Alkalischer Phosphatase konjungiertes Ziege-antiKaninchen-Immunglobulin (Sigma Chemie, München) zum Einsatz. 2.1.2 Bakterienstämme Eine Übersicht der verwendeten Escherichia coli-Stämme gibt Tab. 2.1.1. BL21 ∆cyo recA-, JM107 ∆cyo recA- und JM107 ∆cyo ∆cyd wurden von C. Ludovici, RUB, Bochum mittels P1Transduktion, ausgehend von BL21(DE3) (New England Biolabs, UK) und JM107 (New England Biolabs, UK) hergestellt. S730 wurde vom E. coli Genetic Stock Center, New Haven (USA) bezogen. Tab. 2.1.1: Die zur Plasmidpräparation bzw. Expression von Cyt bo 3 verwendeten E. coli Stämme. Stamm BL21 ∆cyo recA- JM107 ∆cyo recAJM107 ∆cyo ∆cyd S730 Genotyp F , ompT, gal [dcm] [lon] hsdSB (rB- mB-; ein E. coli B Stamm) mit DE3, ein λ Prophage trägt das T7 RNA Polymerase Gen; ∆cyoBCD::kanR, recAF´ traD36, lacIq, ∆(lacZ)M15, proA+B+ /e14-(McrA-), ∆(lac-proAB), thi, gyrA96, (Nalr) endA1 hsdR17(r-K m+K), relA1, supE44, ∆cyoBCD::kanR ; recAwie JM107 ∆cyo recA- jedoch: recA+ ; cydAB::cmR fhuA2, lacY1, tsx-70, glnV44(AS), gal-6, λ-, purB51, hemA30, trpC45, pabB5, his-68, rfbD1, tyrA2, galP63, rspL125 (strR), malT1(λR), xylA7, mtlA2, thi-1, pyr65 - Referenz [29; 94] [29; 95] [29; 95] [96; 97] 2.1.3 Plasmide Die zur Überexpression von Cyt bo3 verwendeten Plasmide, Derivate des Vektors pBR322, basieren auf dem Plasmid pMC39, das von R. Gennis, Urbana (USA), bezogen wurde. Dieses Plasmid weist eine Größe von ca. 10 kb auf, trägt ein Ampicillin-Resistenzgen und beinhaltet das cyo-Operon, welches cyoA (Untereinheit II), cyoB (Untereinheit I), cyoC (Untereinheit III), cyoD (Untereinheit IV) und cyoE (Protohäm IX Farnesyltransferase) exprimiert (Abb. 2.1.1). 20 Material & Methoden ____________________________________________________________________________________________________________________________________________________ Die Addition von sieben Histidinen am C-Terminus von Untereinheit IV der Oxidase wurde von M. Lübben, RUB, Bochum durch overlap extension PCR erreicht [98; 99]. Dieses Konstrukt wurde als pHTAG bezeichnet. Das Plasmid pHCL exprimiert ein Cyt bo3 , das C-terminal an Untereinheit II um neun Histidine und ein Arginin verlängert ist. Es wurde von A. Puustinen, Helsinki (Finnland) bezogen. Abb. 2.1.1: Genkarte des cyo-Operons und dessen Plasmidderivate. Es ist nur die DNA-Region des pBR322Plasmids gezeigt, die die Strukturgene des Cyt bo 3 beinhaltet. Kurze Pfeile weisen auf Restriktionsschnittstellen, lange auf die zu überexprimierenden Genprodukte hin. „His -tag“ = Oligohistidinmodifikation, „*“ = modifizierte Untereinheit; Weiterführende Erklärungen im Text. Die Abbildung wurde nach Prutsch et al., 2000 [49] modifiziert. Das Plasmid pIN exprimiert ebenfalls eine am C-Terminus von Untereinheit II mit Histidinen modifizierte Oxidase. In diesem Falle handelt es sich jedoch um sechs Histidine, die bei gleichzeitiger Deletion der drei C-terminal gelegenen Aminosäuren Met, Glu und Met mittels UniqueSite-Elimination (U.S.E. Mutagenesis Kit, Pharmacia, Freiburg) eingefügt wurden. 2.1.4 Oxidasen und Mutanten Eine Übersicht der verwendeten Konstrukte, die Cyt bo3 überexprimieren, vermittelt Tab. 2.1.2. Die ortsspezifischen Mutanten wurden durch U.S.E. Mutagenese von I. Schönhaar bzw. B. Mamat, LS für Biophysik, RUB erstellt. Bei den aufgeführten Mutanten handelt es sich, wenn nicht anders vermerkt, um Mutationen in Untereinheit I und II. 21 Material & Methoden ____________________________________________________________________________________________________________________________________________________ Tab. 2.1.2: Übersicht über die untersuchten Wildtyp-Konstrukte und ortsspezifischen Mutanten des Cyt bo 3 . Mutation Plasmid Expressionsstamm 1 1 1 1, 2 1, 2 Wildtyp ∅ Wildtyp ∅ Wildtyp ∅ Wildtyp ∆Bgl II pMC39 pHCL pHTAG pIN pSTAG ∆cyoE pHCL 1 II E89C II E89D II E89Q II H310A II S309A II S309/H310A E286D E286Q F391Q T352S T359S Y288F Y288F/ E286D pHCL pHCL pHCL pHCL pHCL pHCL pHCL pHCL pHCL pIN pIN pHCL pHCL 1 1 1 1 1 1 1 1 1 1 1 1 1 Position Referenz keine Modifikation [55] UE II His-tag [29; 59] UE IV His-tag [49] UE II His-tag diese Arbeit Deletion des Bgl II-Fragments [49] in UE I Deletion von UE V; Häm O [100] defizient UE II diese Arbeit UE II [30] UE II [30] UE II diese Arbeit UE II diese Arbeit UE II diese Arbeit + H -Leitung; D-Kanal [29; 101] H+-Leitung; D-Kanal [29; 101] K-Kanal [102] K-Kanal [103]; diese Arbeit H+-Leitung; K-Kanal [103]; diese Arbeit CuB-Ligand [104] CuB-Ligand [105] Zeichenerklärung: ∅ = keine „echte“ Mutation, jedoch eine Oligohistidinmodifikation; 1 = BL21 ∆cyo recA -; 2 = S730, „UE“ = Untereinheit, „His -tag“ = Oligohistidinmodifikation, Komplementation = die vom Expressionsvektor kodierte Oxidase wird in dem doppelt respiratorisch defizienten E. coli Stamm JM107 ∆cyo ∆cyd auf ihre physiologische in vivo Aktivität untersucht. 2.2 Chemikalien Allgemeine Laborchemikalien, wenn nicht anders vermerkt, werden von den Firmen Baker Chemikalien (Groß-Gerau), Fluka Chemie (Neu-Ulm), Merck AG (Darmstadt), Riedel-de Haen AG (Seelze), Serva Feinbiochemika (Heidelberg) und Sigma Chemie (München,) bezogen. Befindet sich der Hersteller bzw. eine Filiale in Deutschland, so wurde auf eine Landesangabe verzichtet. δ-Aminolävulinat (12 C) [1- 13 C]-δ-Aminolävulinat Asolectin (α-Phosphatidylcholin) BCIP (30 mg*mL in 70% (w/v) DMF) Casein-Hydrolysat (Pepton Nr. 140) β-D-Decyl-Maltosid Hefeextrakt Magermilchpulver NBT (75 mg*mL in 70% (w/v) DMF) SDS-PAGE Standards Sigma Chemie, München CDN-Isotopes, Point-Claire, Kanada Sigma Chemie, München La Roche, Mannheim Gibco BRL, Eggenstein Biomol Feinchemikalien, Hamburg Gibco BRL, Eggenstein Glücksklee (Nestle), Frankfurt a. M. La Roche, Mannheim BioRad, München 22 Material & Methoden ____________________________________________________________________________________________________________________________________________________ 2.3 Geräte Es werden nur häufig verwendete Geräte genannt. Spezielle Laborgeräte werden bei den Beschreibungen der einzelnen Methoden erwähnt. Autoklav Brucheisbereiter Brutschrank Elektrophoresegeräte Inkubationsschüttler Inkubationstaumler Magnetrührgeräte pH-Meter Rotoren Sterilbank UV/VIS Spektrometer Ultraschall-Sonifier Vakuumpumpe Vortexer Wasseraufbereitung Zentrifugen Modell C, Webeco, Bad Schwartau Af-10, Scotsman kelvitron t, Heraeus Instruments, Bad Oeynhausen Powersupply PPS200-1D, MWG-Biotech, Ebersberg Elec. Power Supply-EPS 600, Pharmacia, Freibug Scientific Model G25, New Brunswick, USA Heidolph-Instruments, Schwabach Assistent RM5, Heidolph-Instruments, Schwabach IKA Combimag RCT; IKA-Labortechnik, Staufen 761 Calimatic, Knick, Berlin SS34, SLA1000, SLA3000, SLA12, Sorvall, Bad Homburg v.d.H. 45 Ti, 70 Ti, Beckmann, München NoNu-425-400-E, Nuaire, Plymouth, UK DW-2aT M UV-VIS, Aminco, USA Uvikon 810, Biotek-Kontron, Neufahrn Einstrahlphotometer, Eppendorf, Köln Photodiodenarray, Eigenbau von Dipl. Ing. H. Chorogiewski (LS für Biophysik, RUB) Branson Sonifier-250, Heinemann, Schwäbisch-Gmünd Membranpumpe CVC2, MZ2, Vakuubrand, Wertheim, REAX 2000, Heidolph-Instruments, Schwabach Milli-Q Plus, Millipore, Eschborn RC-5B Plus, Sorvall, Bad Homburg v.d.H. Ultrazentrifuge XL-70, Beckmann, München Biofuge pico, Heraeus-Christ, Bad Oeynhausen 2.4 Computersoftware Adobe Photoshop 5.0 Corel Draw 9.0 Corel OCR-Trace 9.0 Origin 6.0 Word 2000 OPUS 3.0 Adobe, San Jose, USA Corel Corporation Corel Corporation Microcal Software, Northampton, USA Microsoft Bruker, Karlsruhe 23 Material & Methoden ____________________________________________________________________________________________________________________________________________________ 2.5 Nährmedien Luria-Bertani-Medium (LB) [106]: 10 g NaCl, 10 g Pepton Nr. 140 und 5 g Hefeextrakt wird in 1 L VE-Wasser gelöst und mit 1 M NaOH auf pH 7,5 titriert. Anschließend wird bei 121°C, 1 bar Überdruck und 20 Minuten autoklaviert. LB-Agarplatten 1,5% (w/v) Agar-Agar (GibcoBRL, Eggenstein) werden in LB-Medium gegeben und bei 121°C, 1 bar Überdruck und 20 Minuten autoklaviert. Nach Zugabe der jeweiligen Antibiotika (ab ca. 50°C) wird der noch flüssige Nährboden in die Petrischalen gegossen. 2.6 Arbeiten mit Bakterien Es werden nur keimfreie Arbeitsgeräte und Materialien verwendet, die je nach Beschaffenheit zuvor autoklaviert (121°C, 20 Minuten, 1 bar Überdruck), sterilisiert (trockene Hitze 180°C, 4 Stunden) oder im Falle der Elektroporationsküvetten durch 0,3%ige (v/v) H2 O2 - Behandlung und UV-Licht keimfrei gemacht werden. 2.6.1 Antibiotika Die Antibiotika Ampicillin (Amp.), Kanamycin (Kan.) und Streptomycin (Strep.) werden je nach vorhandenen Resistenzen zu 100 mg/L (Amp.) und 50 mg/L eingesetzt. 2.6.2 Stammkulturen Übernacht-Flüssigkulturen (2.6.4.2) von E. coli-Stämmen werden im Verhältnis 1:1 mit Glycerinstock (65% (w/v) Glycerin, 0,1 M MgSO4 , 25 mM Tris-HCl, pH 8,0) gemischt, in flüssigem Stickstoff schockgefroren und bei -80°C gelagert. 2.6.3 DNA-Transformation 2.6.3.1 Kompetente Zellen Alle Arbeitsschritte nach dem Zellwachstum finden unter Kühlung statt. Die Zentrifugationsbedingungen sind bei jedem Schritt gleich. Von einer frischen LB-Agarplatte wird eine Kolonie des plasmidfreien E. coli-Stamms in LBMedium überführt und eine Flüssigkultur aerob herangezogen (2.6.4.2). Diese wird zu gleichen Teilen auf je 500 mL LB-Medium in zwei 2L Erlenmeyerkolben verteilt und bis zu einer OD578 von 0,4-0,5 inkubiert. 24 Material & Methoden ____________________________________________________________________________________________________________________________________________________ Die Zellen werden bei 4°C, 5000 UpM, 12 Minuten im SLA1000-Rotor sedimentiert, sofort in eiskaltem A.d. (ca. 200 mL) resuspendiert und erneut zentrifugiert. Anschließend wird mit A.d. zweimal gewaschen, zentrifugiert und das Sediment in 30 mL 20% (v/v) Glycerin resuspendiert. Nach der Zentrifugation im SS34-Rotor werden die Zellen in 2 mL 10% Glycerin aufgenommen, in Aliquote von je 50 µL in Eppendorfgefäße verteilt und in flüssigem Stickstoff schockgefroren. Die Lagerung erfolgt bei -80°C. Die kompetenten Zellen sind ca. 6 Monate haltbar. 2.6.3.2 Elektroporation 1-2 µg Plasmid-DNA (Midipräparation) werden mit 10 µL 10% (v/v) Glycerin versetzt, mit 50 µL kompetenten Zellen vermischt und in die Elektroporationsküvette pipettiert. Die DNA-Transformation mittels Elektroporation findet mit einem Gene Pulser II (BioRad, München) bei 2,5 kV, 600 Ω und 25 µFarad statt. Anschließend werden die Zellen mit 1 mL auf RT vorgewärmten LB-Medium versetzt und 1 Stunde bei 37°C im Inkubationsschüttler (250 UpM) inkubiert. Danach werden 50-100 µl Aliquote auf LB-Agarplatten ausgestrichen und bei 37°C ü.N. inkubiert. 2.6.4 Bakterienanzucht 2.6.4.1 Nährboden Es werden LB-Agarplatten (2.5) verwendet. Ausgehend von einer Stammkultur, bzw. einem Transformationsansatz wird ein Abstrich oder Aliquot auf dem Nährboden verteilt und ü.N. bei 37°C im Brutschrank inkubiert. 2.6.4.2 Flüssigkultur Eine Einzelkolonie von einer Agarplatte wird mit der Impföse auf ca. 10 mL LB-Medium in einem 100 mL Erlenmeyerkolben überimpft und ü.N. im Inkubationsschüttler bei 37°C, 250 UpM inkubiert. Diese Zellkultur dient als Vorkultur für die weitere Bakterienanzucht. 2.6.4.3 Aerobe Bakterienfermentation des E. coli Stamms BL21 ∆cyo recAEin dem Versuchsansatz entsprechendes Volumen LB-Medium wird mit der Flüssigkultur versetzt und ü.N. bei 30°C, 250 UpM (100 UpM für Schikane-Kolben) im Inkubationsschüttler inkubiert. 25 Material & Methoden ____________________________________________________________________________________________________________________________________________________ 2.6.4.4 Aerobe Bakterienfermentation des E. coli Stamms S730 Der Stamm S730 ist u.a. bezüglich der Hämbiosynthese defizient; supplementiert wird diese Auxotrophie durch den Zusatz von δ-Aminolävulinat. Dieses ist neben seiner unmarkierten Form, ebenfalls als spezifisch 13 12 C- C-markiertes [1- 13 C]- δ-Aminolävulinat erhältlich. Hierdurch wird es möglich, spezifisch die Carboxylat-Kohlenstoffatome der Hämpropionate zu markieren. Der Stamm S730 ist plasmidinstabil, d. h. Cyt bo3 wird nur überexprimiert, wenn von stets frisch transformierten Zellen ausgegangen wird. Bei der Zellanzucht auf LB-Nährboden sollten alle vorhandenen Auxotrophien zusätzlich supplementiert werden. Bei der Zellanzucht in LBMedium genügt es jedoch, neben den Antibiotika, δ-Aminolävulinat, Thiamin, Adenosin, sowie Uridin zuzugeben. Ein 100 µL Aliquot des Transformationsansatzes (2.6.3.2) wird auf dem LB-Nährboden (2.5) ausplattiert. Der Nährboden enthält neben Strep. und Amp., zusätzlich δ-Aminolävulinat (17 µg/mL), Thiamin (100 µg/mL), die Aminosäuren Tyrosin (200 µg/mL), Phenylalanin (130 µg/mL) und Trypthophan (25 µg/mL). Außerdem werden Uridin (100 µg/mL) und Adenosin (100 µg/mL) zugesetzt. Die Platte wird für mindestens 36 Stunden bei 37°C im Brutschrank inkubiert. Danach ist sie für 3-4 Tage bei RT haltbar. Soll 13 C-markiertes Häm in der Oxidase eingebaut werden, wird [1- 13 C]- δ-Aminolävulinat in die Flüssigkultur zugesetzt. Von einer Einzelkolonie ausgehend wird eine 50 mL LB-Flüssigkultur im 500 mL Kolben (2.6.4.2) angesetzt und bei 37°C, 250 UpM ü.N. inkubiert. Anschließend werden 10 ml dieser Kultur im SE12 Rotor bei 7000 UpM, 5 Minuten, 4°C sedimentiert und auf ihre Farbe hin untersucht. Als Negativkontrolle (weißlich/gräuliche Zellen ohne überexrimiertes Cyt bo3 ) dient BL21 ∆cyo recA- pSTAG, als Positivkontrolle BL21 ∆cyo recA- pIN. Nur wenn das Zellsediment rötlich erscheint, wurde Cyt bo3 überexprimiert. Die restliche Vorkultur wird gleichmäßig auf zwei 5L Kolben mit Schikanen, in denen sich je 1L LB-Medium befindet verteilt und bei 30°C, 100 UpM für ca. 36 Stunden bis zu einer OD578 von ca. 1,8 inkubiert. Die Konzentration an δ-Aminolävulinat beträgt bei der 2L-Kultur jedoch nur 12,5 µg/mL. Die Reinigung des Cyt bo3 wird wie unter 2.7 beschrieben durchgeführt. 2.7 Präparation von Proteinen Proteine können durch Immobilisierte-Metallaffinitätschromatographie (IMAC) gereinigt werden [107]. Das hier verwendete Verfahren, die Cyt bo3 Oxidase mittels Nickel-nitrilotriacetic acid (NTA)-Agarose (Ni2+-NTA Agarose, Qiagen, Hilden) zu reinigen, ist nach Rumbley et al., 1995 [59] modifiziert. Das nachfolgende Protokoll ist für eine vier Liter Kolben-Flüssigkultur geschrieben. 26 Material & Methoden ____________________________________________________________________________________________________________________________________________________ 2.7.1 Bakterienfermentation Von dem betreffenden E. coli-Stamm mit Expressionsvektor wird eine 300 mL Vorkultur im 2L Erlenmeyerkolben aerob angezogen. Die Vorkultur wird auf 4 sterile 5L Erlenmeyerkolben, in denen sich je 1 L LB-Medium befindet, gleichmäßig verteilt und ü.N. bei 30°C und 100 UpM aerob bis zu einer OD578 von ca. 4,0 inkubiert. 2.7.2 Präparation der cytoplasmatischen Membranen Alle Arbeitsschritte erfolgen unter Kühlung. Die Zellen werden direkt nach dem Wachstum im SLA3000-Rotor bei 5000 UpM für 15 Minuten bei 4°C zentrifugiert. Anschließend wird der Überstand dekantiert, erneut mit Bakteriensuspension aufgefüllt und die Sedimentationsschritte so lange wiederholt, bis die gesamte Zellkultur aufgearbeitet ist. Die Zellsedimente werden mit je 5 mL eiskaltem TE-Puffer (10 mM Tris-HCl, 1 mM EDTA, pH 8,0) resuspendiert, mit ca. 500 mL TE-Puffer gewaschen und erneut sedimentiert. Nach wiederholter Resuspension erfolgt der Zellaufbruch mit Ultraschall. Hierzu wird die Zellsuspension in ca. 300 mL TE-Puffer aufgenommen und im Eisbad für ca 1 Stunde 30 Minuten bei output level 8, 50% duty cycle mit dem Ultraschall-Sonifier beschallt. Die zweimalige Zentrifugation des Zellysats bei 11.500 UpM, 4°C und 10 Minuten wird mit jeweils frischen Zentrifugenbechern im SS34-Rotor durchgeführt. Die Überstände werden auf 4-6 Ti 45-Zentrifugenbecher verteilt, falls notwendig mit TEPuffer aufgefüllt und bei 40.000 UpM, 4°C für 1 1/2 Stunden in der Ultrazentrifuge zentrifugiert. Das rotbraune Membranlipidsediment wird mit 20 mL TE-Puffer im Glashomogenisator homogenisiert und anschließend in sechs Ti 45-Zentrifugenbecher einer weiteren Ultrazentrifugation für 40 Minuten unterzogen. Das Lipidsediment wird abschließend in 4-6 mL 10 mM Tris-Cl, pH 8,0 homogenisiert und bei -20°C eingefroren. 2.7.3 Solubilisierung der Oxidase 50 mg Gesamtmembranprotein (ca. 1 mL der Membranlipidsuspension; nach BCA- Proteinbestimmung (2.8.2)) werden mit dem Solubilisierungsansatz (1,0 mL 0,5 M KPi, pH 8,0, 1,0 mL 10% Triton-X 100, 2.5 mL 10% n-Octyl-β−D-Glucosid (Bachem Biochemika, Heidelberg), 0,75 mL 4 M NaCl, 2,75 mL A.d.) im Ti 70-Zentrifugenbechern vermischt und für 30 Minuten bei RT auf dem Inkubationstaumler inkubiert. Die Zentrifugation findet bei 40.000 UpM bei 4°C für 30 Minuten statt. Die solubilisierte Oxidase befindet sich im Überstand. 27 Material & Methoden ____________________________________________________________________________________________________________________________________________________ 2.7.4 Immobilisierte Metallaffinitätschromatographie Pro Solubilisierungsansatz werden 3 mL Ni2+-NTA-Agarose aus dem Vorratsbehälter entnommen, mit ca. 30 mL Waschpuffer (50 mM KPi, pH 8,0, 300 mM NaCl, 1% (w/v) Natriumcholat) versetzt und ü.N. bei 4°C äquilibriert. Anschließend wird mit der gleichen Mengen W-Puffer zweimal gewaschen und die Säule gefüllt. Der oxidasehaltige Überstand wird bei einer sehr niedrigen Durchflußrate auf die Säule aufgetragen (bei 10 mL Überstand ca. 20 Minuten) und mit 6 mL W-Puffer pro aufgetragenem Solubilisierungsansatz gewaschen. Die Proteine, die keine Oligohistidinmodifikation tragen, werden mit einem Imidazolstufengradienten (6 mL 10 mM Imidazol in W-Puffer; 3 mL 20 mM Imidazol in W-Puffer pro Solubilisierungsansatz; im Falle der Reinigung von pIN-Konstrukten erfolgt ein weiterer Waschritt mit 6 mL 40 mM Imidazol in W-Puffer pro Solubilisierungsansatz) von der Säule verdrängt. Anschließend wird mit 50 mL 0,3% (w/v) β-DM in W-Puffer das Detergenz von Cholat auf ß-DM gewechselt. Die Elution der Oxidase erfolgt mit einer 100 mM Imidazollösung in β-DM-haltigem W-Puffer bzw. bei Oxidasen, die auf pIN basieren mit 150 mM Imidazol. 2.7.5 Ultrafiltration der Oxidase Die Elutionsfraktion wird in 2,5-5 mL Portionen in Microsep 30 (Pall Filtron, Dreieich) bei 6000 UpM, 4°C im SS34-Rotor für ca. 2 h konzentriert (Restvolumen ca. 50 µL), dann mit 1 mL 20 mM Tris-Cl, 50 mM NaCl, 0.3% (w/v) β-DM, pH 8.0 (Lagerungspuffer) 1:20 verdünnt und den gleichen Zentrifugationsbedingungen für etwa 2 ½ Stunden ausgesetzt. Um Messungen bei unterschiedlichen pH-Werten zu ermöglichen kann der Verdünnungsschritt zweimal mit je 1 mL für den gewünschten pH-Bereich geeigneten Puffersubstanzen durchgeführt werden. Hierbei kommen für pH 4-5 Natriumcitrat, pH 5,5-6,5 MES, pH 7-7,5 NaPi und pH 8-9 Tris-Cl zum Einsatz. Die Konzentration der Oxidase wird durch ein reduziertes minus oxidiertes Cyt bo3 Differenzspektrum bestimmt (2.9.3). Anschließend wird die Konzentration mit Lagerungspuffer, der den gewünschten pH-Wert aufweist, auf 15 µg/mL oder 30 µg/mL eingestellt. Die Oxidase wird bei –20°C gelagert. 2.8 Proteinchemische Methoden 2.8.1 Proteinfällung mit Trichloressigsäure Die zu fällenden Proteinproben werden im Verhältnis 1:10 mit 10% (w/v) TCA vermischt, 1 Minute „gevortext“ und 5 Minuten auf Eis gefällt. Nach Zentrifugation in der Tischzentrifuge 28 Material & Methoden ____________________________________________________________________________________________________________________________________________________ (10 Minuten, 13000 UpM) wird der Überstand vollständig abgenommen, so dass keine Restflüssigkeit mehr im Reaktionsgefäß erkennbar ist. 2.8.2 Proteinbestimmung mit Bicinchoninsäure Die BCA-Lösung stammt von Sigma Chemie, München. Es handelt sich um ein modifiziertes Protokoll nach Smith et al., 1985 [108]. Für die Proteinbestimmung werden maximal 50 µg TCA (2.8.1) gefälltes Protein pro Ansatz mit A.d. auf 50 µL Gesamtvolumen gebracht. Nach Zugabe von 20 µL 4% (w/v) Kupfer(II)sulfat-Lösung wird 1 mL BCA-Lösung zupipettiert, gemischt und 30 Minuten bei 37°C unter mehrmaligem Schütteln der Reaktionsgefäße inkubiert. Aus den Extinktionen bei 562 nm wird im Vergleich zu einer RSA-Eichreihe (0 µg, 10 µg, 20 µg, 30 µg, 40 µg und 50 µg Protein) der Proteingehalt ermittelt. 2.8.3 Proteinbestimmung mit SDS-Lowry Das Protokoll ist nach Peterson, 1977 [109] modifiziert. Für die Proteinbestimmung werden 2,5-20 µg Protein pro Ansatz mit A.d. auf 1 mL Gesamtvolumen gebracht. Dann werden 0,1 mL 0,15% (w/v) Natriumdeoxycholat zugegeben, geschüttelt und 10 Minuten, unter gelegentlichem kippen inkubiert. Es werden 0,1 mL 72%ige (w/v) TCA zum Ansatz zupipettiert, geschüttelt und das gefällte Protein wird 10 Minuten bei 13.000 UpM in der Tischzentrifuge sedimentiert. Der Überstand wird entfernt, das Eppendorfreaktionsgefäß kurz anzentrifugiert und die Restflüssigkeit vollständig entfernt. Der Niederschlag wird in 0,5 mL A.d. und 0,5 mL Reagenz A aufgenommen und 10 Minuten unter gelegentlichem Vortexen inkubiert. Anschließend wird 0,1 mL Reagenz B zugesetzt, sofort geschüttelt und 30 Minuten bei RT inkubiert. Aus den Extinktionen bei 750 nm wird im Vergleich zu einer RSA-Eichreihe (0, 2,5 µg, 5,0 µg, 7,5 µg, 10,0 µg, 15,0 µg, 20,0 µg Protein) der Proteingehalt der Proben ermittelt. Reagenz A: 1 Teil CTC (0,1% (w/v) CuSO4 x5H2 O, 0,2% (w/v) K+Na+-Tatrat, 10% (w/v) NaCO3 ) werden mit 1 Teil 0,8 N NaOH, 1 Teil 10% (w/v) SDS und 1Teil A.d. frisch angesetzt. Reagenz B: 1 Teil Folin-Ciocalteus-Phenol-Reagenz wird in 1 Teil A.d. aufgenommen. 2.8.4 SDS-Polyacrylamid-Gelelektrophorese Die gelelektrophoretische Auftrennung der Proteine erfolgt in 15%igen diskontinuierlichen, reduzierenden SDS-Polyacrylamidgelen nach der Methode von Laemmli [110]. Es wird in einem Probengesamtvolumen von 10-20 µL gearbeitet. Die Proteinprobe wird, falls notwendig 29 Material & Methoden ____________________________________________________________________________________________________________________________________________________ mit 10%iger SDS-Lösung auf 5-10 µL aufgefüllt und mit dem selben Volumen LaemmliProbenpuffer versetzt. Abgesehen vom low-range Marker entfiel eine 5 minütige Hitzedenaturierung bei 95°C (65°C beim prestained Marker), da die Oxidase im hitzedenaturierten Zustand nicht mehr ins Trenngel eindringt. Die Gelelektrophorese wird in einem von der Feinmechaniker-Werkstatt (Lehrstuhl für Biophysik, RUB) hergestellten Elektrophoresestand bei 80 V (Sammelgel), 100 V (Trenngel) und 200 mA für ca. 3 ½ Stunden durchgeführt. Wenn ganze Bakterienzellen mittels SDS-PAGE analysiert werden sollen, wird die Bakterienkultur wie unter 2.6.3.2 angezogen, die OD bei 578nm bestimmt und soviel Kulturvolumen entnommen, dass eine Bakterienmenge resultiert, die einer OD578 von 3,0 entspricht. Nach Sedimentation in der Tischzentrifuge (13.000 UpM, 1 Minute) werden die Zellen in 50 µL A.d. resuspendiert, mit 50 µL 20% (w/v) SDS lysiert und für 15 Minuten gevortext. Ein 10 µL Aliquot wird für die weitere Analyse entnommen. Geldimensionen: Sammelgel: 7 x 3 x 0,12 cm, Trenngel: 7 x 7 x 0,12 cm Gelzusammensetzung: Sammelgel: 3,1 mL 1,25 mL 25 µL 0,65 mL 25*µL 5* µL A.d. 0,5 M Tris-Cl pH 6,8 20% SDS 30% Acryl/-acrylamid-Stock 10% Ammonium-Persulfat (APS) TEMED 2,4 mL 2,5 mL 50 µL 5,0 mL 25*µL 5* µL A.d. 1,5 M Tris-Cl pH 8,8 20% SDS 30% Acryl/-acrylamid-Stock 10% Ammonium-Persulfat (APS) TEMED * Trenngel: * erst unmittelbar vor dem Gießen zugeben erst unmittelbar vor dem Gießen zugeben Acrylamid/-acrylamid-Stock: 30 g Acrylamid, 0,8 g N, N-Methylenacrylamid (ad 100 mL A.d.). Laemmli-Probenpuffer: 20 mL Glycerin, 10 mL 20% SDS, 12,5 mL 0,5 M Tris-Cl pH 6,8, 0,2 mL 0,5% (w/v) Bromphenolblau, 5 mL β−Mercaptoethanol (ad 100 mL A.d.). Elektrophorese-Puffer 10x: 144 g Glycin (MW 75,07), 30 g Tris, 10 g SDS (ad 1,0 L A.d.), mit 1 M HCl auf pH 8,8. Nach erfolgter Elektrophorese wird das Trenngel mit einer Coomassie-Färbelösung für 45 Minuten gefärbt und anschließend der Hintergrund mit Entfärbelösung entfärbt. Coomassie-Färbelösung: 0,25% (w/v) Coomassie Brillant Blau G 250, 50% (v/v) Methanol, 10% (v/v) Essigsäure Entfärbelösung: 10% (v/v) Methanol, 10% (v/v) Essigsäure 30 Material & Methoden ____________________________________________________________________________________________________________________________________________________ Die Gele werden zur Dokumentation auf Whatmanpapier (3MM Chr) mit dem Geltrockner (Biometra, , Göttingen; Minidry) bei 85°C und bei einem Unterdruck von ca. 60 mbar für ca. 1 Stunde getrocknet. 2.8.5 Elektrotransfer und Nachweis von Proteinen auf Nitrozellulosemembranen Die Proteine werden wie unter 2.8.4 beschrieben aufgetrennt. Als Größenstandard wird prestained Marker verwendet. Vom ungefärbten Trenngel werden die Proteine mit einer fast blotApparatur (Biometra, Göttingen) im sogenannten semi-dry-Verfahren [111], bei einer Stromstärke von 4,0 mA/cm2 und 600 V über einen Zeitraum von 30 Minuten auf Nitrozellulosemembran (Schleicher & Schuell, Dassel) übertragen. Hierzu werden alle verwendeten Bestandteile (drei Lagen Whatmanpapier (3MM Chr), Nitrozellulosemembran, Gel, drei Lagen Whatmanpapier) in Transfer-Puffer (25 mM Tris/HCl pH 8,5, 150 mM Glycin, 10% (v/v) Methanol) getränkt. 2.8.5.1 Nachweis der Oligohistidinmodifikation Zum Nachweis der Oligohistidinmodifikation wird ein Ni2+-NTA-Meerrettich-PeroxydaseKonjugat eingesetzt (Ni2+-NTA-HRP, Qiagen, Hilden). Die Durchführung des Protokolls erfolgt nach Herstellerangaben. Die Nitrozellulosemembran wird nach Durchführung des His-tag Nachweises, in digitalisierter Form dokumentiert und kann unmittelbar danach für den Immunoblot gegen CyoA eingesetzt werden, wobei eine Blockierzeit von 1 Stunde ausreicht (vergleiche hierzu 2.8.5.2). 2.8.5.2 Immunoblot Die Nitrocellulosemembran wird nach dem Transfer ü.N. in 40 mL Blocking (BP-) Puffer (10 mM KPi, pH 7,4, 150 mM NaCl, 0,2% (w/v) Triton-X 100, 5,0% (w/v) Magermilchpulver, 0,02% (w/v) NaN 3 ) blockiert. Anschließend erfolgt die immunochemische Identifizierung. Der primäre Antikörper wird in einer Verdünnung von 1:10.000 in 10 mL BP-Puffer für 1 Stunde zugegeben. Nach viermaligem Waschen mit ca. 30 mL BP-Puffer für je 5 Minuten erfolgt die Zugabe des sekundären Antikörpers (1:20.000 in 10 mL BP-Puffer) für 45 Minuten. Der Waschschritt mit BP-Puffer wird zweimal wiederholt und anschließend zweimal für 2 Minuten mit Alkalische Phosphatase (AP-) Puffer (0,1 M Tris/HCl, pH 9,5, 0,1 M NaCl, 0,05 M MgCl2 ) wiederholt. Nun folgt die Zugabe des Farbreaktionsgemisches (30 µL BCIP, 45 µL NBT pro 5 mL APPuffer). Sobald die Banden deutlich erkennbar sind, wird die Farbreaktion wird mit A.d. gestoppt. 31 Material & Methoden ____________________________________________________________________________________________________________________________________________________ 2.8.6 Durochinol-Oxidase-Aktivität Das Durochinol (2, 3, 5, 6-Tetramethyl-Benzochinol; DQH2 ) wird modifiziert nach Rothery et al., 1998 [112] hergestellt. Für die 20 mM DQH2 -Stocklösung wird die entsprechende Masse Durochinon eingewogen und mit dem entsprechenden Volumen 100 mM HCl in EtOH versetzt. Durch Zugabe einer Spatelspitze gepulvertem, elementarem Zink wird das Durochinon zu DQH2 reduziert. Nachdem die schwach gelbliche Lösung vollständig farblos ist (ca. 2 Minuten), wird bei 13.000 UpM für 1 Minute bei RT in der Tischzentrifuge das verbliebene Zinkpulver sedimentiert und der Überstand lichtgeschützt auf Eis verwahrt. Die Aktivitätsmessungen werden im Photometer der Fa. Aminco bei RT im ZweiWellenlängen-Modus in Quarzküvetten durchgeführt. Die eingestellten unveränderten Parameter sind: 3,0 nm Bandbreite, eine Zeitkonstante von 50 s*inch-1 , Monochromator 1 = 270 nm, Monochromator 2 = 285 nm und response = medium. Der Oxidationsprozess des DQH2 wird als Extinktionsänderung bei 270 nm minus 285 nm (oxidiert minus reduziert) verfolgt. Zur Datenauswertung wird der differenzielle Extinktionskoeffizient ∆ε 270-285 = 19,4 mM -1 zugrunde gelegt [113]. Das Cyt bo3 wird hierbei aus der oxidierten Referenzprobe, deren Konzentration über das Redox-Differenzspektrum (2.9.3) bestimmt ist entnommen. Die Endkonzentrationen in der zur Aktivitätsbestimmung eingesetzten Substanzen betragen: 0,25 µg/mL Oxidase, 200 µg/mL α-Phosphatidylcholin und 200 µM DQH2 . Als Puffer wird 50 mM KPi, 1 mM EDTA und 0.3% (w/v) β-DM, pH 7,0 verwendet. 2.8.7 Häm-Analyse Durch die Häm-Analyse soll qualitativ das Verhältnis von Häm B zu Häm O in den verschiedenen Wildtypkonstrukten und deren Mutanten nachgewiesen werden. 2.8.7.1 Häm-Extraktion Die Häm-Extraktion wird nach Lübben & Morand, 1994 [114] durchgeführt. Hierzu werden 2,5-5 µL der gereinigten Oxidase (2.7.5) in einem 1.5 mL Eppendorfreaktionsgefäß mit 450 µl 95% (v/v) Aceton/konz. HCl versetzt und für 20 Minuten gevortext. Das denaturierte Protein wird durch Zentrifugation in der Tischzentrifuge (13.000 UpM, RT, 5 Minuten) abgetrennt und der chromophorhaltige Überstand in ein 2 mL Eppendorfreaktionsgefäß überführt. Nach Zugabe von 1 ml eiskaltem A.d. und 300 µL Ethylacetat, wird gut durchmischt und erneut unter gleichen Bedingungen zentrifugiert. Die Ethylacetatphase wird vorsichtig, ohne wässrigen Anteil 32 Material & Methoden ____________________________________________________________________________________________________________________________________________________ abgenommen und eingetrocknet. Die Häme werden anschließend in 1:1 (v/v) Ethylacetat/Acetonitril gelöst und können in dieser Form auf die HPLC-Säule aufgetragen werden. 2.8.7.2 HPLC-Analyse Zur Analyse wird eine HPLC-Anlage (Beckmann, München, System-Gold) mit einer HypersilSäule (Millipore-Waters, Eschborn; Delta Pack 18, 5 µm, 100 Å, 3.9*150 mm) verwendet. Die Elution der Häme wird bei einer Wellenlänge von 406 nm detektiert. Es wird bei RT und einer Durchflussrate von 0,3 mL/Minute gearbeitet. Das Absorptionsverhalten wird mit einem Schreiber über 50 Minuten nach Probenauftragung aufgezeichnet. Der zur Analyse verwendete Gradient ist wie folgt programmiert: Gradient von Gradient von Gradient von Gradient von 0% bis 30% Acetonitril 30% bis 70% Acetonitril 70% bis 100% Acetonitril 100% Acetonitril 100% bis 0% Acetonitril 0% Acetonitril 10 Minuten 10 Minuten 25 Minuten 5 Minuten 10 Minuten 5 Minuten 2.9 VIS-Spektroskopie 2.9.1 Absolutspektren Die Aufnahme der Absolutspektren dient einerseits zur Ermittlung des Absorptionsverhaltens von Cyt bo3 -Proben für die VIS-spektroskopische Charakterisierung und wird hierbei am Photometer der Fa. Aminco durchgeführt. Andererseits wird sie zur Verifizierung der vollständigen Reduktion der Oxidasenprobe nach abgeschlossener FT-IR Messung benötigt und wird in diesem Falle am Diodenarray ermittelt. Die Spektrenaufzeichnung am Doppelstrahl-Photometer der Fa. Aminco findet im EinWellenlängen-Modus statt. Die am Photometer eingestellten unveränderten Parameter sind: 3,0 nm Bandbreite, 1 nm/Sekunde Schreibervorschub und response = medium. Die Messungen erfolgen bei RT. Der gewählte Wellenlängenbereich liegt zwischen 400-650 nm. Etwa 150 µg oxidierte und gereinigte Oxidase (2.7.5) wird mit Puffer (50 mM KPi, pH 7,0, 1 mM EDTA, 0,3% (w/v) β-DM) auf 1,0 mL Gesamtvolumen gebracht und in eine Quarzküvette pipettiert. Als Referenz wird eine Quarzküvette mit Puffer gefüllt. Anschließend beginnt die Spektrenaufnahme der oxidierten Probe. Danach werden einige Körnchen Natriumdithionit zur Probe gegeben. Das reduzierte Cyt bo3 Absolutspektrum wird nach 10 Minuten aufgezeichnet. Zur Aufnahme des CO-Absolutspektrums wird die reduzierte Probe, wie unter 2.9.2 beschrieben mit CO begast und anschließend ein Spektrum erstellt. 33 Material & Methoden ____________________________________________________________________________________________________________________________________________________ Die Messungen der Absolutspektren der FT-IR Proben erfolgen am Diodenarray (EG&GReticon, Olching). Die Datenaufzeichnung und -auswertung wird mit Hilfe des von H. Chorogniewski geschriebenen Programm „Spektro“ ermöglicht. Es können Spektren zeitgleich im Bereich von 380-1000 nm mit einer Auflösung von ca. 2,5 nm und im Abstand von maximal 1 ms aufgenommen werden. Als Lichtquelle dient eine Halogenlampe (Farnell Electronic Components GmbH, Deisendorf). Die Messungen erfolgen bei RT. Der gewählte Wellenlängenbereich liegt zwischen 400-650 nm. Die Probe wird, wie unter 2.10.1 beschrieben präpariert und ein Absolutspektrum sowohl vor (oxidiert), als auch nach (reduziert) der FT-IR Messung aufgenommen. Als Referenz wird ein Spektrum der IR-Küvette ohne Proteinprobe aufgezeichnet. Zur Spektrenaufnahme werden 100 Spektren im Abstand von 100 ms aufgenommen und gemittelt. Darüber hinaus wird ein CO-Rekombinationsspektrum angefertigt (2.9.2), um eine etwaige, ungewünschte CO- Freisetzung während der (Auto-) Photoreduktions-reaktion zu dokumentieren. 2.9.2 Kohlenmonoxid-Rekombinationsspektren Ca. 150 µg gereinigte Oxidase (2.7.5) wird mit Puffer (50 mM KPi, pH 7,0, 1 mM EDTA, 0,3% (w/v) β-DM) auf 1,0 mL Gesamtvolumen gebracht, einige Körnchen Natriumdithionit zugegeben und für 10 Minuten reduziert. Die Probe wird in einer gasdicht verschließbaren Quarzküvette mit Kohlenmonoxid für 2,5 Minuten begast. Anschließend beginnt die Spektrenaufnahme. Die Messungen erfolgen am Diodenarray (2.9.1). Zur Photolyse des Kohlenmonoxids wird ein intensiver Lichtblitz einer Blitzlichtlampe (Farnell Electronic Components GmbH, Deisendorf) verwendet. Bei den CO-Relaxationsspektren werden 100 Spektren nach einem intensiven Lichtblitz im Abstand von einer 1 ms aufgenommen. Um das Signal-Rausch-Verhältnis zu verbessern wird diese Messung im zeitlichen Abstand von ca. 2 Sekunden 100fach wiederholt und gemittelt. Der erste Datensatz (vor dem Lichtblitz) dient als Referenz, der von den übrigen Datensätzen abgezogen wird. Das erste resultierende gemittelte Differenzspektrum kann nicht ausgewertet werden, da die Dioden des Diodenarrays durch die intensive Lichteinstrahlung des Blitzes noch übersättigt sind. 2.9.3 Reduziertes minus oxidiertes Cyt bo3 Raumtemperatur (RT)-Differenzspektrum Die Messungen erfolgen im Doppelstrahl-Photometer der Fa. Aminco im Ein-WellenlängenModus. Die am Photometer eingestellten unveränderten Parameter sind: 3,0 nm Bandbreite, 1 nm*s-1 Schreibervorschub und response = medium. Die Messungen erfolgen bei RT. Der gewählte Wellenlängenbereich liegt zwischen 400-700 nm, die Vergrößerung schließt 515-590 nm ein. Die Konzentrationsbestimmung der Oxidase 34 Material & Methoden ____________________________________________________________________________________________________________________________________________________ beruht auf dem differenziellen Extinktionskoeffizienten von ∆ε 560−580 = 18,7 mM -1 [51]. Das hierbei zugrunde gelegte Molekulargewicht des Cyt bo3 liegt bei 142.000 Da [49]. Zwei bis fünf µL oxidierte, konzentrierte und gereinigte Oxidase (2.7.5) werden mit Puffer (50 mM KPi, pH 7,0, 1 mM EDTA, 0,3% (w/v) β-DM) auf 2,0 mL Gesamtvolumen gebracht und auf zwei Quarzküvetten verteilt. Zu der einen Probe werden einige Körnchen Natriumdithionit gegeben und für 10 Minuten reduziert, die unbehandelte Probe dient als Referenz. Anschließend beginnt die Spektrenaufnahme. 2.9.4 Reduziertes minus oxidiertes Cyt bo3 Tieftemperatur-Differenzspektrum Die Messungen erfolgen im Spektrometer der Fa. Aminco bei gleichen Messparametern wie unter 2.9.3 beschrieben. Im Unterschied zu diesen wird bei 77 Kelvin (K) gemessen. Hierzu wird eine spezielle Küvette, die in flüssigen Stickstoff getaucht wird verwendet. Acht µL oxidierte, konzentrierte und gereinigte Oxidase (2.7.5) wird mit Puffer (50 mM KPi, 1 mM EDTA, 0,3% (w/v) β-DM, pH 7,0) auf 1,0 mL Gesamtvolumen gebracht und zu je 500 µL Portionen in die Tieftemperaturküvette gefüllt. Zu der einen Probe werden zuvor einige Körnchen Natriumdithionit gegeben und für 10 Minuten bei RT reduziert. Anschließend beginnt die Spektrenaufnahme. 2.10 FT-IR Spektroskopie Für die FT-IR Spektroskopie wird ein Infrarot-Spektrometer (IFS) (Bruker, Karlsruhe, IFS 66vs) mit stickstoffgekühltem, hochempfindlichem HgCdTe (MCT) Detektor verwendet. Um den einwandfreien Betrieb, sowie ein hohes Maß an Reproduzierbarkeit der Probenmessungen zu gewährleisten, befindet sich der gesamte Spektrometeraufbau im klimatisiertem Raum. Da die Aufnahme von Differenzspektren sehr erschütterungs-empfindlich ist, ruht das Spektrometer auf einer Marmorplatte in einem Sandbett. Der tragende Tisch ist speziell von Schwingungen des Estrichs entkoppelt. Der für die Oxidasemessung besonders interessante Wellenzahlbereich liegt zwischen 2600-900 cm-1 . Um möglichst hohe IR-Intensitäten zu gewährleisten, d. h. mit weit geöffneter Blende arbeiten zu können wird daher ein dielektrisch beschichteter Kantenfilter (OCLI) für 2600 cm-1 mit 2 cm-1 Auflösung vor den Detektor gesetzt. Ebenfalls kam ein 1950 cm-1 Kantenfilter mit 2 cm-1 Auflösung zum Einsatz. Die Probenkammer (Eigenanfertigung am Lehrstuhl) des Spektrometers wird, um Rauschsignale der Wasserdampf-, sowie der CO2 Banden der Luft zu unterdrücken, mit vorgetrockneter und mit einem CO2 -Abscheider aufbereiteten Luft durchspült. Die gesamte restliche Optik ist durch eine Öldiffusionspumpe bis zu 5 mbar evakuierbar. 35 Material & Methoden ____________________________________________________________________________________________________________________________________________________ Ein wassergekühlter Globar aus Siliziumcarbid dient als Strahlungsquelle im mittleren Infrarot. Der Strahlteiler besteht aus einem KBr-Kristall. Der bewegliche Spiegel erlaubt Modulationsfrequenzen von 1,6-320 kHz. Bei den Oxidasemessungen wird dieser über die Modulationsfrequenzen des HeNe-Lasers standardisiert bei 100 kHz betrieben. Die IR-Proben befinden sich zwischen zwei runden Calciumfluorid-Fenstern mit einem Durchmesser von 20 mm und einer Dicke von 2 mm (Korth-Kristalle. Kiel), die in einer in der Lehrstuhlwerkstatt gefertigten IR-Küvette (Messinggehäuse) eingepasst werden. Die IR-Küvette wird in den Messingprobenhalter des Spektrometers, der über einen Kryostaten R-6 (Lauda, Königshofen) bis zu –30°C ±0.1°C temperierbar ist, gestellt. Die Temperatur des Probenhalter kann mittels eines Thermoelements abgegriffen werden. Zur Photolyse der caged electrons (FMN-EDTA-Lösung) [81] wird das vom IR-Anteil reduzierte Licht einer Halogenlampe benutzt. Zur Auto-Photoreduktion der Oxidase wird IRreduziertes Licht einer Xenon-Bogenlampe (L21195 super quiet, Fa. Hamamatsu; 66001 Gehäuse und 68805 Netzgerät, Fa. Oriel) verwendet. Die Datenaufnahme und -verarbeitung erfolgt mittels eines PC mit der Spektoskopie-Software OPUS (Bruker, Karlsruhe). Über den PC wird ebenfalls die Lichtquelle gesteuert, die zur Photolyse bzw. Auto-Photoreduktion benutzt wird. 2.10.1 Probenpräparation Zur Probenpräparation wird eine in der Glasbläserei und Lehrstuhlwerkstatt der RUB hergestellte Gasaustauschzelle verwendet (Abb. 3.3.1). 37,5-75 µg gereinigter Oxidase (2.7.5) werden auf ein am Rand mit Apiezonfett (Bayer, Leverkusen) bestrichenes Calciumfluorid-Fenster, zur besseren Probenplatzierung mit zentrischen Nut (∅ 8 mm), aufgebracht und zu einem Film von 4-5 mm verteilt. Dabei ist darauf zu achten, dass weniger als 2,5 µL Oxidase kaum ausreichen um diese Fläche zu erreichen. Bei Probenvolumina die größer als 5,0 µL sind kommt es gewöhnlich bei angelegtem Vakuum zur irreversiblen Blasenbildung, die einen homogenen Probenfilm zerstört. Da bei deuterierten Proben die zusätzliche Absorption der γ(H2 O) Scherschwingung des Wassers (um 1645 cm-1 , additiv zur Amid I-Bande; siehe 2.10.3.2) fehlt, kann ca. 1/3 mehr Protein bei gleichbleibender Transmission der Amid I-Bande eingesetzt werden. Bei Verwendung von caged electrons als Reduktionsmittel, wird 0,5 µL 0,5 mM Flavinmononukleotid (FMN), 100 mM EDTA - pH-Wert entsprechend der Probe - zum Protein beigemischt. Hierbei sollte, um eine vorzeitige Photolyse des caged compounds, zu vermeiden unter Rotlicht gearbeitet werden. Im Falle der AutoPhotoreduktionsproben werden keine caged compounds benötigt [85]. 36 Material & Methoden ____________________________________________________________________________________________________________________________________________________ Das Calciumfluorid-Fenster wird in den Probenhalter, der zuvor mit entgastem Wasser bzw. Deuteriumoxid befüllt wurde, eingelegt. Der Deckel der Gasaustauschzelle, in dessen Stempelkonstruktion sich das zweite Calciumfluorid-Fenster befindet, wird luftdicht verschlossen. Die Probe wird bei einem Unterdruck von ca. 50 mbar für 3-5 Minuten vollständig eingetrocknet und zum Rehydrieren, bei geschlossenen Auslasshahn für 1,5-3 Minuten in der Zelle belassen. Wenn deuterierte Proben erstellt werden, wird diese Prozedur ein weiteres Mal wiederholt. Nachdem das zweite Calciumfluorid-Fenster aufgebracht ist, ist die Probe gasdicht verschlossen und kann in die IR-Küvette eingebaut werden. Die zwischen den beiden Fenstern entstandene homogene Probe ist ca. 5 µm dick [81]. Die Lagerung findet unter Lichtausschluss bei 4°C statt. Erfahrungsgemäß sollte die Probe mindestens 48 Stunden vor der Messung präpariert werden. 2.10.2 Messparameter Für die IR-Messungen wird eine Auflösung von 2 cm-1 und eine Scannergeschwindigkeit von 11 (100 kHz) gewählt. Die eingestellte Blende, in Abhängigkeit vom gewählten Kantenfilter und Probe, liegt zwischen 2-3,5 mm, d. h. die angegebenen Signalintensitäten (ADC-Counts) liegen zwischen 20.000 und 27.000. Die Probenmessungen erfolgen im Rapid-Scan-Modus, d. h. um eine hohe Zeitauflösung zu erreichen, werden die Interferogramme zuerst im Paket aufgenommen und anschließend berechnet. Zu den Details des FT-IR Messprogramms siehe Tab. 2.10.1. Tab. 2.10.1: Übersicht der zur (Auto-)Photoreduktion verwendeten FT-IR Messprogramme. Messbefehl Messen, Puffer #1 Schleife 1 Schleife 2 E/A-Bit setzten (1. Impuls: Lampe ein) Warten E/A-Bit setzten Warten E/A-Bit setzten (2. Impuls: Lampe aus) Warten E/A-Bit setzten Warten Schleife 2 Warten (Abkühlen der Lampe) Messen Schleife 1 Halogenlampe (Photoreduktion) 1200 scans beginnen 20 3 oben 1 ms 3 unten 20.000 ms 3 oben 1 ms 3 unten 1000 ms 400 scans beenden Xenon-Bogenlampe (Auto-Photoreduktion) 1200 scans beginnen 20 beginnen 8 3 oben 1 ms 3 unten 20.000 ms 3 oben 1 ms 3 unten 4000 ms Beenden 6000 ms 400 scans beenden Als Akquisitionsmodus wird Single Sided, Forward-Backward gewählt. Die Phasen-korrektur wird mit der Mertz-Funktion durchgeführt, wobei die Phasenauflösung 32 cm-1 beträgt. Die Beckmann-Harris-3-Term-Funktion wird als Apodisationsfunktion verwendet. Faktor zwei wird 37 Material & Methoden ____________________________________________________________________________________________________________________________________________________ beim Zerofilling benutzt. Um Rückfaltungen von Intensitäten im Spektrum zu vermeiden, wird die maximale Faltungsgrenze 15.000-800 cm-1 gewählt. 2.10.3 Probenmessung 2.10.3.1 Vorarbeiten Der MCT-Detektor wird mit flüssigem Stickstoff befüllt und weist ca. 2 Stunden danach keine Basisliniendrift mehr auf. Er kann für ca. 18 Stunden, bis zum erneuten Nachfüllen, genutzt werden. Ist nach ca. einer Woche ununterbrochner Kühlung keine stabile Basislinie mehr zu erreichen, so muss der Detektor „aufgetaut“ werden (vermutlich wird die Temperaturdrift des Detektors durch die Diffusion und Anreicherung von O2 im flüssigen Stickstoff ausgelöst). Nachdem die Probe in den Probenhalter des FT-IR Spektrometers eingebracht ist, wird sie zur weiteren Äquilibrierung für mindestens 7 Stunden erschütterungsfrei in diesem belassen. Am Kryostaten wird eine Temperatur von 0,7°C eingestellt. Dies entspricht einer ProbenhalterTemperatur von 2°C (Thermoelement) und 4°C an den Calciumfluorid-Fenstern der Probe (die genannten Werte haben sich als erfolgreich erwiesen und sind als Anhaltspunkte zu verstehen). Um die Halogenlampe (Abstand vom Lichteinlass am Spektrometer 30 cm), als auch die Blende (Eigenbau am Lehrstuhl für Biophysik) für die Xenon-Bogenlampe entsprechend dem Messprogramm auszulösen, müssen diese extern durch ein BNC-Kabel mit dem Spektrometer und damit mit dem PC verbunden werden. Die Halogenlampe und die Blende werden durch einen Spannungsgeber bei 11 V bzw. 20 V betrieben. Der IR-Anteil des emittierten Lichts der Halogenlampe wird durch zwei Kaltglasfilter-50 reduziert. Die Xenon-Bogenlampe benötigt einen Spannungsgeber, der 5 A Stromstärke zur Verfügung stellt. Der Messaufbau zur lichtinduzierten Reduktion der Oxidase mittels Xenon-Bogenlampe ist in Abb. 2.10.1 dargestellt. Abb. 2.10.1: Schematischer Aufbau zur Auto-Photoreduktion mittels Xenon-Bogenlampe. Die Abb. wurde nach K. Bettinger modifiziert. 38 Material & Methoden ____________________________________________________________________________________________________________________________________________________ Das emittierte Licht der Xenon-Bogenlampe wird über ein Quarzprisma im 90° Winkel in die Probenkammer geleitet. Der Lichtstrahl kann direkt an der Lampe fokussiert werden. Er wird dabei so eingestellt, dass das Quarzprisma vollständig ausgeleuchtet ist. Der IR-Anteil wird hierbei durch einen in der Lehrstuhlwerkstatt gefertigten Wasserfilter reduziert. 2.10.3.2 Einkanalspektren Der Durchmesser des vom Globar emittierten IR-Strahls kann über (Loch-) Blenden gewählt werden und muss kleiner als der Durchmesser der IR-Probe sein, um die tatsächlich absorbierte Strahlung der Probe zu ermitteln. Hierzu werden unterschiedliche Blenden, deren Signalintensitäten unterhalb von 27.000 ADC-Counts liegen, um eine Übersättigung des Detektors zu vermeiden, benutzt und Einkanalspektren erstellt. (Das Einkanalspektrum ist nach Abzug des Emissionsspektrum der IR-Quelle auch als Transmissionsspektrum zu interpretieren. Daher kann von Transmissionsbanden im Einkanalspektrum gesprochen werden.) Diese werden auf eine Signalintensität eines der Spektren vergrößert bzw. verkleinert. Nur bei vollständiger Deckung der Spektren kann die größtmögliche Blende für die weitere Messung verwendet werden. Abweichungen hiervon werden als Inhomogenität der belichteten Probenfläche interpretiert. Für die Übersichtsspektren werden 100 Interferogramme aufgenommen und gemittelt. Sie werden bei wässrigen Proben von 2600-800 cm-1 , im Falle der deuterierten Proben ohne Filter im Bereich von 4000-800 cm-1 aufgenommen. Das Verhältnis der ν(H2 O) OH- Streckschwingung der Wasserbande (um 3400 nm-1 ) zur ν(D2 O) OD-Streckschwingung der Bande des Deuteriumoxids (um 2500 nm-1 ) dient hierbei als Qualitätskontrolle für den erfolgten H2 O/D2 O Austausch (H/D Austausch). In Abhängigkeit des zu analysierenden Wellenzahlenbereichs, 1900-1680 cm-1 für caged electron-Proben und 2200-1100 cm-1 für Auto-Photoreduktionsproben, wird als Qualitätskontrolle der Probe die Resttransmission (IR-Durchlässigkeit) der Amid I-Bande in Prozent genutzt. Diese berechnet sich nach der höchsten Transmission (100%, um 1950 cm-1 ) und der Amid IBanden Transmission (um 1650 cm-1 ). Die hier als Amid I bezeichnete Bande setzt sich bei wässrigen Proben im Wesentlichen aus der Absorption der C=O Streckschwingung der Peptidbindung und der γ(H2 O) Scherschwingung des Wassers zusammen. Bei deuterierten Proben liegt die γ(D2 O) Scherschwinung des Deuteriumoxids um 1215 cm-1 und trägt nicht zur Absorption um 1650 cm-1 bei. Bei den FMN-EDTA-Proben sollte die Resttransmission mindestens zwischen 1% und 2% liegen, im Falle der Auto-Photoreduktionsproben müssen Werte von 4%-8% erreicht werden. 39 Material & Methoden ____________________________________________________________________________________________________________________________________________________ 2.10.3.3 Differenzspektren Da selbst die größten gemessenen Extinktionsänderungen (um 4,5 mOD) in den Differenzspektren sehr klein -gemessen an den Absolutabsorptionen des Proteins (Abb. 1.5.2)- sind, ist eine größtmögliche Probenstabilität unabdingbar. Um diese zu überprüfen, werden 6 Basislinien aus je 400 gemittelten Interferogrammen im Abstand von 5 Minuten aufgenommen. Von diesen wird jeweils dasselbe Leerkanalspektrum subtrahiert, das sich ebenfalls aus 400 gemittelten Interferogrammen zusammensetzt. Bei einer eingestellten Gesamtextinktion von ±0,5 mOD im Bereich von 1900-1200 cm-1 dürfen nur geringe Basislinienveränderungen erkennbar sein. Diese aufgezeichneten Basislinien dienen ebenfalls als Referenz für das Hintergrundrauschen der Differenzspektren. Das jeweils zur Spektrenaufnahme benutzte Rapid-Scan-Messprogramm, abhängig von der zur (Auto-) Photoreduktion verwendeten Lichtquelle, ist in Tab. 2.10.1 unter 2.10.2 dargestellt. Die Aufnahme der reduzierten minus oxidierten (nach Belichtung minus vor Belichtung) Differenzspektren erfolgt zwischen 2600 cm-1 bzw. 1950 cm-1 -900 cm-1 . Es werden 20 Differenzspektren bei allen Proben erstellt und die letzten fünf Spektren gemittelt. In allen Fällen entspricht dies einer vollständigen Reduktion der Oxidase. Diese wurde zusätzlich durch VISAbsolutspektren vor und nach der IR-Messung am Diodenarray verifiziert (2.9.1). Ob es ebenfalls zu einer CO-Freisetzung während der Reduktion gekommen ist, wird durch ein CORekombinationsspektrum (2.9.2) zusätzlich bestimmt. 2.10.3.4 Datenauswertung Bei den caged electron Proben dauert die Aufnahme des Gesamtdatensatzes ca. 30 Minuten und stellt kein Problem in Bezug auf Basislinienverschiebungen dar. Die Messung mit der XenonBogenlampe hingegen benötigt ca. 2 Stunden. Über einen so langen Zeitraum weisen die Spektren eine unterschiedlich starke Basisliniendrift auf. Da sich diese jedoch nahezu linear verhält, kann sie durch manuelle Subtraktion einer Ausgleichsgeraden aus den Spektren entfernt werden. Um diese innerhalb des Spektrums festzulegen werden 3 Datenpunkte bei 2000 cm-1 , 1760 cm-1 und 1250 cm-1 gesetzt [85]. Trotz hoher Sorgfalt und akribisch genauer Durchführung der Probenpräparation, ist es nicht möglich, dass eine FT-IR Probe der anderen aufs Haar gleicht. Hierdurch kommt es zu leichten Varianzen der Differenz-/Signalintensitäten. Diese müssen, um die Spektren untereinander vergleichen zu können aufeinander skaliert werden. Als Bezugspunkt wird hierbei die Differenzbande bei 1696/1691 cm-1 benutzt. Sie wird in der Regel auf eine Gesamtextinktion von 0,75 mOD berechnet. 40 3. Ergebnisse 3.1 Erstellung eines C-terminal von Untereinheit II nicht prozessierten Wildtyps von Cyt bo3 In diesem Unterpunkt wird die Erstellung einer neuen Cyt bo3 Wildtypvariante vorgestellt. Die als pIN-Wildtyp bezeichnet Oxidase wird auf ihre biochemischen und VIS-spektroskopischen Eigenschaften untersucht. Die Neukonstruktion dieser Wildtypvariante ist aus dreierlei Hinsicht notwendig: (I) Der bisher verwendete Wildtyp (pHCL-Wildtyp) weist am C-Terminus von Untereinheit II eine Oligohistidinmodifikation zur Proteinreinigung auf. Diese wird posttranslational mit weiteren C-terminalen Aminosäuren in hohem Ausmaß proteolytisch in E. coli abgespalten. Hierdurch treten Proteinverluste und/oder Fremdproteinverunreinigungen der Oxidase bei der Reinigung auf. (II) Durch diese Instabilität des C-Terminus kann eine Überexpression vom Plasmid nur in einem sonst Cyt bo3 defizienten E. coli Stamm vorgenommen werden. Somit ist beispielsweise eine spezifische [1- 13 C]-Markierung der Hämpropionate vom Wildtyp bzw. Cyt bo3 -Mutanten ohne vorherige Deletion des genomischen cyo-Operons nicht möglich. (III) Cyt bo3 -Mutanten, die eine niedrige Expressionsrate aufweisen, können in nur sehr begrenzter Ausbeute bei Verlust der Oligohistidinmodifikation erhalten werden. 3.1.1 C-terminale Proteolyse Das Cyt bo3 von E. coli wird posttranslational vielfach modifiziert [49; 115]. Bei dem Protein handelt sich um einen Enzymkomplex, der aus vier Untereinheiten (MW: UE I 74 kDa; UE II 33 kDa; UE III 22.5 kDa; UE IV 13 kDa) besteht. Untereinheit II (CyoA) der Oxidase erscheint bei der elektrophoretischen Auftrennung in SDS-Gelen zumeist als Doppelbande (z. B. Abb. 3.1.3, Spur 1 und 3). Es konnte gezeigt werden, dass sich diese beiden Polypeptidketten C-terminal durch die proteolytische Abspaltung eines Hexapeptids unterscheiden [49]. Zur homologen Überexpression des Cyt bo3 in E. coli wird u.a. ein als pHCL bezeichnetes Plasmid verwendet1 [59]. Dieses Konstrukt kodiert für ein wildtypisches Cyt bo3 , das C-terminal an Untereinheit II um acht Histidine (His-tag) und ein Arginin verlängert ist. Hierdurch ist es möglich, die Oxidase mittels Ni2+-NTA-Agarose zu reinigen [59]. Darüber hinaus ist es möglich das Cyt bo3 auch in Abwesenheit des His-tag durch eine Metallaffinitätschromatographie zu reinigen [49; 116]. Somit kann sowohl das C-terminal an Unterein1 Die zur Überexpression in E. coli benutzten Plasmid-Konstrukte (Derivate des pBR322-Vektors) tragen dieselbe Abkürzung wie die Wildtyp- und Mutantenproteine. Daher wird im Folgenden in „Plasmid“, z. B. pIN-Plasmid und in die vom Plasmid kodierten „Wildtyp-“ bzw. „Mutanten“-Proteine, z.B. pIN-Wildtyp unterschieden. 41 Ergebnisse ____________________________________________________________________________________________________________________________________________________ heit II prozessierte Protein des pHCL-Wildtyps, als auch ein Cyt bo3 ohne His-tag Modifikation (kodiert vom pMC39-Plasmid) erhalten werden. In diesen Fällen müssen jedoch Fremdproteinverunreinigungen und Oxidaseverluste während des 20 mM Imidazol-Waschschritts in Kauf genommen werden (Abb. 3.1.4 und Abb. 3.1.5). Das Ausmaß der C-terminalen Proteolyse ist abhängig von den Wachstumsbedingungen und Alterungsprozessen der Bakterienzellen. Je nach gewählter Temperatur kann der Verlust des C-Terminus teilweise oder vollständig sein (Abb. 3.1.1). Da die Zellausbeuten bei einer Temperatur von 42°C drastisch sinken, werden die Bakterien im Weiteren, wenn nicht anders vermerkt, bei 30°C, ü.N. bei 100 UpM fermentiert. Durch die lange Inkubationszeit von 15-17 Stunden weist der pHCL-Wildtyp meist keine Oligohistidinmodifikation mehr auf. Um Oxidasemoleküle zu erhalten, die den His-tag zumindest zum Teil besitzen, werden Inkubationszeiten von 7-8 Stunden benötigt (vergleiche Abb. 3.1.3 Spur 1 mit Abb. 3.1.5 Spur 4), d.h. die Zellen befinden sich in der mittleren-logarithmischen Wachstumsphase. Dies führt jedoch zu erniedrigten Zell- und damit zu geringeren Proteinausbeuten. Darüber hinaus kann der C-Terminus während des Zellaufbruchs mit Ultraschall abgespalten werden (Daten nicht gezeigt) [59]. Abb. 3.1.1: Immunoblot gegen CyoA (2.8.5.2) zur temperaturabhängigen C-terminalen Proteolyse von Untereinheit II. Es wurden ganze Zellen auf das zum Proteintransfer verwendete 15% SDS-Gel aufgetragen. Cyt bo 3 wurde ausgehend vom pHCL-Plasmid in BL21 ∆cyo recA - überexprimiert. Die Bakterien wurden bei unterschiedlichen Temperaturen und 100 UpM ü.N. fermentiert. Die dominierenden Banden weisen keine Oligohistidinmodifikation mehr auf. Spur 1: 30°C, Spur 2: 37°C, Spur 3: 42°C. Da die Spaltungsstelle der C-terminalen Proteolyse in Untereinheit II genau bekannt ist, werden die unmittelbar benachbarten Aminosäuren mittels ortsspezifischer Mutagenese ausgetauscht und das resultierende Protein untersucht. Als template-DNA für die Mutagenese wird das pHCL-Plasmid verwendet. In Abb. 3.1.2 sind diese Ergebnisse in Form eines Immunoblots gegen CyoA (2.8.5.2) dargestellt. Es stellt sich heraus, dass ein Aminosäureaustausch des Ser-309 zu Ala, des His-310 zu Arg und die entsprechende Doppelmutante zu einem Abbau der Untereinheit II und damit zu keiner 42 Ergebnisse ____________________________________________________________________________________________________________________________________________________ Überexpression der Oxidase führen (Abb. 3.1.2, Spur 3, 4 und 5). Durch die proteolytische Degradation der II H310N-, II S309A- und II S309A/H310N-Mutanten zeigt sich, dass der Aminosäuresequenz am C-Terminus von Untereinheit II eine wichtige regulative und physiologische Bedeutung zukommen könnte.2 Abb. 3.1.2: Immunoblot zur Mutationsanalyse der C-terminalen Proteolyse an Untereinheit II. Es wurden ganze Zellen auf das zum Proteintransfer verwendete 15% SDS-Gel aufgetragen. Spur 1: pIN-Wildtyp, Spur 2: pHCLWildtyp, Spur 3: II S309A-Mutante, Spur 4: II H310N-Mutante, Spur 5: II S309A/H310N-Mutante. Bei einem weiteren Mutationsexperiment werden sechs Histidine, bei gleichzeitiger Deletion der drei zur Spaltungsstelle benachbarten Aminosäuren Met, Asp und Met inseriert. Als templateDNA für die Mutagenese dient das Plasmid pMC39. Der erhaltene Expressionsvektor wird als pIN-Plasmid bezeichnet. Nach Transformation vom pIN-Plasmid in E. coli wird Cyt bo3 ohne C-terminale Proteolyse an Untereinheit II überexprimiert, d.h. es kann eine Oxidase mit His-tag gereinigt werden (Abb. 3.1.3 Spur 2). Eine Abspaltung des C-Terminus ist im Gegensatz zum pHCL-Wildtyp beim Zellaufbruch mit Ultraschall nicht zu beobachten. In der Abbildung ist deutlich zu sehen, dass der pIN-Wildtyp (Spur 2) eine Untereinheit II aufweist, die nur aus einer Proteinbande besteht. Diese Bande zeigt ebenfalls durch das positive Signal beim His-tag Nachweis (2.8.5.1, Abb. 3.1.3 rechte Darstellung), dass eine Oligohistidinmodifikation am Protein vorhanden ist. Der pHCL-Wildtyp (Spur 1) weist im Gegensatz dazu im SDS-Gel und im Immunoblot eine Doppelbande auf. Beim His-tag Nachweis reagiert jedoch nur die schwerere Bande mit den Farbreaktionssubstanzen. Somit kann die untere Bande immunochemisch CyoA zugeordnet werden, bei fehlendem His-tag [49]. Im Vergleich zur unteren Bande der Untereinheit II vom pMC39-Wildtyp (Spur 3) weisen beide die gleiche Laufhöhe auf. 2 Bei ortsspezifischen Mutanten wird die ausgetauschte Aminosäure unter Positionsangabe der Cyt bo 3 Aminosäuresequenz bezeichnet, z.B. II H309A (pHCL). Die Ziffer „II“ bezeichnet hierbei die Untereinheit in der die Mutation eingefügt wurde. Die Angabe in Klammern ist auf das zugrundeliegende Plasmid-Konstrukt bezogen und wird nur beim erstmaligen Erwähnen oder wenn eine Unterscheidung notwendig ist, gemacht. Bei Mutanten in der katalytischen Untereinheit I wird auf die Darstellung der Ziffer „I“ verzichtet. 43 Ergebnisse ____________________________________________________________________________________________________________________________________________________ Der unteren Bande vom pHCL-Wildtyp fehlen also zusätzlich die letzten sechs C-terminalen Aminosäuren von Untereinheit II. Abb. 3.1.3: Bandenzuordnung von Untereinheit II der verschiedenen Cyt bo 3 -Wildtypen. Es wurden gereinigte Oxidasen auf das 15% SDS-Gel aufgetragen. Für den Gelteil der Coomassie-gefärbt (SDS-Gel) wurde, wurden je 10 µg gereinigtes Protein, für den anderen (His -tag Nachweis und Immunoblot) je 2.5 µg Enzym aufgetragen. Spur 1: pHCL-Wildtyp (Zellen wurden für 7h fermentiert), Spur 2: pIN-Wildtyp, Spur 3: pMC39-Wildtyp. Der pMC39-Wildtyp, der keine Oligohistidinmodifikation trägt, erscheint im SDS-Gel und im Immunoblot ebenfalls als Doppelbande und zeigt kein Signal beim His-tag Nachweis. 3.1.2 Fermentation, Proteinreinigung und biochemische Charakterisierung Der pHCL-Wildtyp und der Genom-Wildtyp zeigen große Ähnlichkeit bei der biochemischen und VIS-spektroskopischen Charakterisierung [49; 59]. Der pIN-Wildtyp soll nun damit verglichen werden. Im Folgenden werden das Fermentations- und Reinigungsverhalten der Oxidase, die VIS-spektroskopischen Eigenschaften des Cyt bo3 und die Zusammensetzung der Häme und die in vivo und in vitro Aktivitäten betrachtet. 3.1.2.1 Fermentation und Reinigung Von BL21 ∆cyo recA- pHCL bzw. pIN werden je drei Liter Bakterienkultur parallel angesetzt und die Oxidase präpariert (2.7). Der pHCL-Wildtyp dient als Referenz. Die Flüssigkulturen weisen eine OD578 von 4,0 bzw. 3,94 nach dem Zellwachstum auf. Dies entspricht in beiden Fällen einer Zellausbeute von rund 8 g Bakterienfeuchtgewicht pro Liter Medium. Von den einzelnen Reinigungsschritten wird das Volumen bestimmt, ein Aliquot entnommen und der Gesamtprotein- bzw. Cyt b-Gehalt bestimmt. Da der verwendete Expressionsstamm zwar hinsichtlich des Cyt bo3 defizient ist, aber das Alternative Cyt bd bilden kann, setzt sich der berechnete 44 Ergebnisse ____________________________________________________________________________________________________________________________________________________ Cyt b-Gehalt maßgeblich aus beiden zusammen. In Tab. 3.1.1 sind die ermittelten Daten der Reinigungsschritte und die Anreicherung der Oxidase zusammenfassend dargestellt. Tab. 3.1.1: Reinigung von Cyt bo 3 exprimiert von BL21 ∆cyo recA - pHCL bzw. pIN. Probe c ÜS nach Zellaufbruch ÜSc nach UZd Membranen nach UZd nach Solubilisierung Säulene Duchlauf Säulene Waschfraktion Säulene Elution konz. Cyt bo3 f Cyt ba (nmol) pHCL 840 280 462 212 63 29 91 46 pIN 900 310 475 208 65 32 89 44 Gesamtprotein (mg)b pHCL pIN 4150 4300 3150 3250 408 512 200 238 98 117 71 77 15.1 14.8 6.76 6.66 nmol Cyt b/mg Gesamtprotein pHCL pIN 0.2 0.2 0.1 0.1 1.1 0.9 1.1 0.9 0.6 0.55 0.4 0.4 6.0 6.0 6.9 6.7 Anreicherungs-faktor pHCL pIN 1.0 1.0 0.5 0.5 5.5 4.5 5.5 4.5 3.0 2.8 2.0 2.0 30 30 34.5 33.5 Zeichenerklärung: a Der Cyt b Gehalt wurde nach dem differenziellen Extinktionskoeffizienten von Cyt bo 3 (2.9.3) bestimmt; bGesamtproteingehalt nach SDS-Lowry Proteinbestimmung (2.8.3); cÜS = Überstand; dUZ = Ultrazentrifugation; eNi2+-NTA-Agarose wird als Säulenmaterial verwendet; f Proteinbestimmung über die RedoxDifferenzspektren (2.9.3). Im Resultat verhält sich sowohl das vom pHCL-, als auch das vom pIN-Plasmid homolog in E. coli überproduzierte Cyt bo3 hinsichtlich der Fermentation, der Proteinausbeute und der Anreicherung nahezu gleich. Um die optimalen Konzentrationen des Imidazolstufengradienten für die Metallaffini- tätschromatographie zu ermitteln, wird 1/3 der erhaltenen Gesamtmembranen zur Solubilisierung eingesetzt. Abb. 3.1.4 zeigt das Elutionsverhalten bei der Chromatographie des pHCLbzw. pIN-Wildtyps in Abhängigkeit von der Imidazolkonzentration. Abb. 3.1.4: Elutionsverhalten der von BL21 ∆cyo recA - pHCL bzw. pIN überexprimierten Oxidasen auf der Ni2+NTA-Agarose Säule in Abhängigkeit von der Imidazolkonzentration. Der Cyt bo 3 Gehalt wurde VIS-spektroskopisch bestimmt (2.9.3). Der hohe Cyt b Anteil beim 0 mM Imidazolwaschschritt ist durch die Proteinreste auf der Säule der Cyt bd Oxidase zu erklären und wird daher schraffiert dargestellt. 45 Ergebnisse ____________________________________________________________________________________________________________________________________________________ Bei diesem Vergleich ist erkennbar, dass der pHCL-Wildtyp bei weit geringeren Imidazolkonzentrationen von der Säule verdrängt wird. Diese Oxidase besitzt eine geringere Affinität zum Säulenmaterial, da die Oligohistidinmodifikation nahezu vollständig fehlt (Abb. 3.1.5). Bei einer Imidazolkonzentration von 20 mM beginnt das Protein bereits zu eluieren. Somit muss dieser Reinigungsschritt beim pHCL-Wildtyp zwar durchgeführt werden, um Fremdproteine von der Säule zu verdrängen, das Volumen des Waschschritts muss jedoch entsprechend klein gehalten werden. Der pIN-Wildtyp wird bei Imidazolkonzentrationen, die kleiner als 40 mM sind, praktisch nicht von der Säule verdrängt, d.h. eine Abspaltung des C-Terminus während des Zellaufbruchs mit Ultraschall hat nicht stattgefunden. Mit den verbliebenen 2/3 der Membranen werden die Reinigungen der Oxidasen mittels Ni2+NTA-Agarose durchgeführt. In Tab. 3.1.1 ist dies berücksichtigt, indem die erhaltenen Werte entsprechend auf die Masse der Gesamtmembranen bezogen sind. Der pIN-Wildtyp wird im Unterschied zur Referenz zusätzlich durch einen 40 mM Imidazolschritt gewaschen und mit 150 mM Imidazol eluiert. Abb. 3.1.5: 15% SDS-Gel zum Reinigungsverlauf des Cyt bo 3 . Spur 1-4 zeigt die Genprodukte von BL21 ∆cyo recA - pHCL, Spur 5-8 die von BL21 ∆cyo recA - pIN. In allen Spuren wurde 20 µg Gesamtprotein aufgetragen. Spur 1 und 8: Bakterienmembranen, Spur 2 und 7: Überstand der solubilisierten Membranen, Spur 3 und 6: Durchlauf nach Säulenauftrag, Spur 4 und 5: gereinigte Oxidasen. Das Gel ist auf der rechten Seite beim Trocknen leicht deformiert worden. Der Reinigungsverlauf des Cyt bo3 wird durch ein 15% SDS-Gel, indem die wesentlichen Reinigungsschritte dargestellt sind, dokumentiert (Abb. 3.1.5). Die aus dem SDS-Gel ermittelten apparenten Molekulargewichte der Referenz bzw. des pIN-Wildtyps (Spur 4 bzw. 5) betragen für Untereinheit I ca. 60 kDa, für Untereinheit II 31 kDa bzw. 32 kDa, für Untereinheit III 20 kDa und für Untereinheit IV ca. 14 kDa. Die gereinigten pHCL- bzw. pIN-Wildtypen sind zum Vergleich unmittelbar nebeneinander gesetzt. Die beiden Spuren sind mit etwa doppelt soviel Protein beladen, als zur Coomassie-Anfärbung der Untereinheiten notwendig ist. Hierdurch 46 Ergebnisse ____________________________________________________________________________________________________________________________________________________ sind etwaige Unterschiede, wie z. B das nahezu vollständige Fehlen der Proteinbande unterhalb von Untereinheit II, beim pIN-Wildtyp hervorgehoben. Untereinheit IV ist aufgrund seiner stark hydrophoben Aminosäurezusammensetzung, wenn überhaupt (z. B. Abb. 3.1.3), nur als diffuse Bande erkennbar. 3.1.2.2 VIS-spektroskopische Charakterisierung und Häm-Analytik Um auf eine wiederholte Darstellung von Ergebnissen zu verzichten, sind einige der hier beschriebenen Resultate der Wildtypvarianten und der auf ihnen basierenden Mutanten des Cyt bo3 unter 3.2 tabellarisch und graphisch zusammengefasst. Weiterhin variieren die zur Verdeutlichung der Ergebnisse benötigten Referenzen stark innerhalb der Abbildungen. Die Konstruktion des pHCL-Plasmids und das davon kodierte Cyt bo3 wird in Rumbley et al., 1997 [59] beschrieben. Da jedoch nicht alle hier durchgeführten Untersuchungen darin enthalten sind, werden diese, soweit in dieser Publikation vorhanden, mit Kita et al. 1984 [51] verglichen. Ein Hauptproblem bei der Plasmidexpression von Cyt bo3 besteht darin, dass sich im cyoOperon neben den Strukturgenen, die für die vier Untereinheiten der Oxidase kodieren, ebenfalls das Gen der Protohäm IX-Farnesyltransferase (Genprodukt von cyoE) befindet (2.1.3, Abb. 2.1.1). Folglich kommt es bei der Transskription und Translation des cyo-Operons ebenfalls zur Überexpression von CyoE. Die Farnesyltransferase, auch als Häm O-Synthase bezeichnet, ist verantwortlich für die Häm O-Synthese ausgehend von Häm B (Abb. 1.2.5) [36; 47]. Da das Häm O jedoch ebenso an die Stelle des low-spin Häm B eingebaut werden kann, kann es neben der Expression von Cyt bo3 , zur Expression des inaktiveren Cyt oo3 kommen [65]. Dies ist nicht nur bei dem unmodifizierten pMC39-Wildtyp zu beobachten [65], sondern besonders stark beim pHTAG-Wildtyp ausgeprägt, der eine oligohistidinmodifizierte Untereinheit IV besitzt [49]. Befinden sich der kodierende Bereich des His-tag, wie im Falle vom pHCL-Plasmid, jedoch an Untereinheit II, so wird aus ungeklärten Gründen nur Cyt bo3 synthetisiert [49; 59]. Um den korrekten Einbau der Häme und das Verhältnis von Häm B zu Häm O innerhalb des pIN-Wildtyps zu überprüfen, wird einerseits ein reduziertes minus oxidiertes Cyt bo3 RedoxTieftemperatur-Spektrum (77 K-Differenzspektrum) von dem gereinigtem Enzym (2.9.4) und andererseits ein HPLC-Elutionsprofil der extrahierten Häme (2.9) angefertigt. In Abb. 3.1.6 sind auf der linken Seite die 77 K-Differenzspektren, auf der rechten Seite die HPLC-Elutionsprofile der Häm-Extrakte der gereinigten Wildtypen und der ∆cyoE- Mutante gezeigt. Da der ∆cyoE (pHCL)-Mutante das Strukturgen zur Expression der Farnesyltransferase fehlt, kann in dem E. coli Stamm BL21 ∆cyo recA- kein Häm O synthetisiert werden (unterstes Spektrum bzw. Elutionsprofil in Abb. 3.1.6) [100]. Diese Mutante besitzt anstelle des Häm O ein 47 Ergebnisse ____________________________________________________________________________________________________________________________________________________ Häm B in der high-spin Hämbindetasche, weist aber gegenüber dem Wildtyp einen vergleichbaren CuB-Gehalt auf [100]. Es wird ein physiologisch und bezüglich der Durochinolaktivität inaktives Cyt bb3 exprimiert (Tab. 3.2.6), das in seinen VIS-spektroskopischen und kinetischen Eigenschaften gegenüber der Referenz stark verändert ist (Abb. 3.2.1, Abb. 3.2.2 und Tab. 3.2.5). Da diese Mutante als Kofaktor nur Häm B besitzt, kann sie als Referenz für ein reines Cyt bb3 Spektrum bzw. Cyt b (bezüglich der α-Bande) Spektrum herangezogen werden. Abb. 3.1.6: Analyse der Häm-Zusammensetzung der gereinigten Cyt bo 3 -Wildtypen bzw. der ∆cyoE-Mutante. Links: 77 K-Differenzspektren der gereinigten Oxidasen (100 µg/mL) im Bereich von 400-700 nm unter Angabe der Extinktionsmaxima und –minima; Rechts: HPLC-Elutionsprofile der extrahierten Häme detektiert bei 406 nm und ganz oben ist das Schema des zur Elution benutzten Acetonitril-Gradienten dargestellt. Die Retentionszeiten sind an den Extinktionsmaxima angegeben. Weitere Erläuterungen siehe Text. Im Gegensatz hierzu resultiert beim pHTAG-Wildtyp ein 77 K-Differenzspektrum bzw. ein HPLC-Elutionsprofil der Häm-Extrakte, das von Cyt oo3 dominiert wird (erstes Spektrum bzw. Elutionsprofil von oben in Abb. 3.1.6) und dient als Cyt oo3 überproduzierte Referenz [49]. Die pHCL- bzw. pIN-Wildtypen (zweite bzw. dritte Darstellungen von oben) besitzen in den 77 K-Differenzspektren bezüglich der α-Bande zwei Extinktionsmaxima bei 555,5 nm und 562,5 nm bei nahezu gleicher Signalintensität und weisen somit ein Extintionsverhalten auf, das dem von Cyt b entspricht. Die β-Bande zeigt ebenfalls ein gespaltenes Signal bei 528 nm und 536 nm. Das Maximum der Soret-Bande liegt bei 427,5 nm. Die ermittelten Extinktionsmaxima und -intensitäten sind mit den für die 77 K-Differenzspektren beschriebenen vergleichbar (Abb. 1.4.1) [51; 57]. Das Extinktionsspektrum vom Häm B ist gegenüber dem von Häm O leicht zum längerwelligen Bereich (bathochrom) verschoben [59]. In dieser Publikation konnte gezeigt werden, dass die Häm-Extrakte vom pHCL-Wildtyp, detektiert bei 402 nm, ein Flächenverhältnis der Elutionsbanden von Häm B zu Häm O von 60:40 aufweisen. Dies entspricht einem 1:1 Gemisch 48 Ergebnisse ____________________________________________________________________________________________________________________________________________________ der beiden Häme [59; 62]. Auf die hier durchgeführte Häm-Analyse bezogen, entspricht ein 1:1 Gemisch von Häm B zu Häm O einem Verhältnis der beiden Flächen der Elutionsbanden von 77:23. Die Extinktionen der Häme werden bei 406 nm detektiert, wodurch dieser Unterschied der ermittelten Verhältnisse verständlich wird. Die Hämextrakte des pHCL- bzw. pIN-Wildtyps weisen ein Flächenverhältnis der Elutionsbanden von Häm B zu Häm O von 75:25 bzw. 77:23 auf und besitzen somit einen 1:1 Hämgehalt. Die ermittelten Retentionszeiten liegen bei ca. 29 Minuten für Häm B und ca. 43 Minuten für Häm O und decken sich nahezu mit den bei Lübben und Morand, 1994 [114] beschriebenen Werten. Das Ergebnis der HPLC-Analytik sagt nur etwas über das Verhältnis von Häm B zu Häm O aus, nicht aber über die korrekte Bindung der Häme innerhalb der Oxidase, d.h. dass Häm B in der low-spin- und Häm O in der high-spin Hämbindetasche vorliegen. Da sich das Differenzsignal der α-Bande nahezu nur aus der Absorption des low-spin Häms in den VIS-Spektren zusammensetzt [45; 62], kann aus dem 77 K-Differenzspektrum unmittelbar auf den korrekten Einbau des Häm B in der Oxidase zurückgeschlossen werden. In Verbindung mit dem ermittelten Verhältnis der beiden Häme aus der HPLC-Analytik, resultiert dann der korrekte bzw. falsche Einbau der Häme innerhalb der untersuchten Oxidasemoleküle. Als Resultat lässt sich zusammenfassen, dass die vom pIN-Plasmid kodierte Oxidase ein Häm B in der low-spin Hämbindetasche aufweist und ein Häm B zu Häm O Verhältnis von 1:1 besitzt. Es handelt sich bei der exprimierten Oxidase also um Cyt bo3 . Die im Folgenden dieser Arbeit dargestellten VIS-Spektren sind, wenn nicht anders vermerkt, auf eine Konzentration von 150 µg/mL Cyt bo3 bezogen (3.2.2). Diese Angabe wird aus den reduzierten minus oxidierten Raumtemperatur-Redox-Differenzspektren (Redox-Differenz- spektren) unter Zuhilfenahme des differenziellen Extinktionskoeffizienten ∆ε = 18,700 M-1 •cm-1 [51] berechnet (Abb. 3.2.2). Die Original-Extinktionswerte der gemessenen Absolut- und CORekombinationsspektren werden im Anschluss mit dem sich ergebenden Umrechnungsfaktor multipliziert. Hierdurch sind die erhaltenen VIS-Spektren nicht nur innerhalb einer Abbildung, sondern auch von Abbildung zu Abbildung unmittelbar vergleichbar. Erst zum Schluss dieses Unterpunktes wird eine kurze Zusammenfassung der Ergebnisse vorgenommen. Zur weiteren Analyse des pIN-Wildtyps werden Absolutspektren vergleichend zum pHCLWildtyp angefertigt. In Abbildung 3.1.7 sind neben den (Luft-) oxidierten und (Natriumdithionit) reduzierten Absolutspektren, auch Spektren im Kohlenmomoxid- (CO) (obere Darstellun- 49 Ergebnisse ____________________________________________________________________________________________________________________________________________________ gen) und Cyanid-gebundenem Zustand (untere Darstellungen) gezeigt. Die von pHCL überproduzierte Oxidase dient hierbei als Referenz. Abb. 3.1.7: Absolutspektren der gereinigten pHCL- bzw. pIN-Wildtypen. Die Spektren sind auf 150 µg/mL, berechnet aus den Redox-Differenzspektren (3.2.2), bezogen. Die Wellenlängen der Extinktionsmaxima sind als Zahlenwert angegeben. Oben: (Luft-) oxidierte, (Natriumdithionit-) reduzierte und CO-gebundene reduzierte (COFR-) Absolutspektren im Bereich von 400-650 nm; Unten: (Luft-) oxidierte und Cyanid-gebundene oxidierte Absolutspektren im Bereich von 400-650 nm. Die 10fache Vergrößerung schließt den Wellenlängenbereich von 500-670 nm ein. Um sicherzustellen, dass ein intaktes binukleares Zentrum im pIN-Wildtyp vorhanden ist, können verschiedene Liganden an das high-spin Häm bzw. CuB angebunden werden. Da die Oxidase in einem natriumchloridhaltigen Puffer gereinigt und gelagert wird, liegt das oxidierte Cyt bo3 bereits Chlorid-gebunden vor. Dieser Zustand wird als Anbindung von Chloridionen an CuB beschrieben [113; 117] und als sechster Ligand für das Fe(III) des high-spin Häms O wird Wasser postuliert [118]. Die sechste Koordinationsstelle des high-spin Häm von Cytochrom Oxidasen ist neben Sauerstoff ebenfalls für andere exogene Liganden wie Kohlenmonoxid [119] und Cyanid [120] zugänglich. Das CO bindet im reduzierten Zustand der Oxidase an das Fe(II) des high spin Häm O und ist photolysierbar [63]. Es bildet sich der sogenannte CO-gebundene fully reduced-Komplex (COFR-Komplex). Cyanid kann eine „Brücke“ zwischen Häm O und CuB bilden [118; 121]. Die sogenannte charged transfer- (CT-) Bande, die im oxidierten Absolutspektrum bei intaktem binuklearem Zentrum sichtbar ist, fehlt im oxidierten Absolutspektrum bei gebundenem Cyanid. Die Extinktionsmaxima für den oxidierten und reduzierten Zustand, sowie für den COFRKomplex der untersuchten Wildtypen und deren Mutanten sind unter 3.2 tabellarisch zusammengefasst (Tab. 3.2.1). 50 Ergebnisse ____________________________________________________________________________________________________________________________________________________ Bei der Betrachtung von Abb. 3.1.7 weisen die Soret-Banden der oxidierten Absolutspektren der pHCL- bzw. pIN-Wildtypen Extinktionsmaxima bei 409 nm bzw. 410 nm auf. Im vergrößerten Wellenlängenbereich von 500-670 nm sind drei weitere Maxima bei 535 nm, 562 nm und um 630 nm erkennbar. Für den Chlorid-gebunden Zustand des oxidierten Cyt bo3 wird ein Maximum bei 408,5 nm für die Soret-Bande [113] und eines um 630 nm für das breite Extinktionssignal der CT-Bande [122] beschrieben. Bezüglich der Extinktionsmaxima für den vollständig reduzierten Zustand der Oxidasen werden für die Soret-Bande 427 nm, die α-Bande 560,5 nm bzw. 560 nm und die β-Bande 531 nm bzw. 530,5 nm bestimmt, d.h. es sind nur geringste Unterschiede zwischen pHCL- und pINWildtyp erkennbar. Im Vergleich zu Kita et al. 1984 (Abb. 1.4.1) [51] ist eine hohe Übereinstimmung der ermittelten Werte festzustellen. Im COFR-Komplex tritt am Extinktionsmaximum der Soret-Bande ein deutlicher Unterschied auf. Das Spektrum der Referenz zeigt ein schmalbandiges Maximum bei 419 nm und weist darüber hinaus eine Schulter um 426 nm auf. Die ermittelten Werte sind mit [57] vergleichbar. Das Spektrum des pIN-Wildtyps zeigt jedoch ein breitbandiges Maximum bei 420 nm, bei gleichzeitigem Fehlen der Schulter. Die Extinktionsmaxima des Cyanid-gebunden Zustands unterscheiden sich nicht bei den verglichenen Oxidasen. Sie liegen bei 415 nm, 535 nm und 562 nm. Die Extinktionen der CTBanden sind praktisch nicht vorhanden, d.h. Cyanid „verbrückt“ im hohen Maße die redoxaktiven Gruppen des binuklearen Zentrums. Die Soret-Banden sind gegenüber den oxidierten Spektren um 6 nm bzw. 5 nm bathochrom verschoben. Cyanid bindet an der freien sechsten Koordinationsstelle des high-spin Häm O und an CuB [121]. Dabei induziert es den Wechsel vom highspin Zustand zum low-spin Zustand des Häm O [113]. Im Spektrum drückt sich dies durch eine bathochrome Verschiebung der Soret-Bande (bei gleichzeitiger Extinktionszunahme der Soret-, β- und α-Bande) und dem Verlust der CT-Bande aus. Die redoxaktiven binuklearen Zentren des pIN-Wildtyps sind folglich nahezu vollständig für Cyanid zugänglich. Die Absolutextinktionen der beiden dargestellten Oxidasen unterscheiden sich. Das Referenzspektrum weist im Cyanid-gebundenen Zustand eine deutlich höhere Extinktion der SoretBande gegenüber der des oxidierten Spektrums auf. Die Signalintensitäten der Soret-Banden des pIN-Wildtyps hingegen sind in diesen Spektren nahezu gleich. Die Extinktionen im Bereich der β- und α-Bande zeigen gegenüber dem pHCL-Wildtypspektrum eine deutlich kleinere Differenz zwischen oxidiertem und Cyanid-gebundenem Zustand. Die Cyanid-Anbindung findet folglich an weniger high-spin Häm-Molekülen statt, als zur Gesamtextinktion beitragen. Betrachtet man unter diesem Aspekt die Gesamtextinktionen der oxidierten und reduzierten Soret-Banden in den Absolutspektren, so fallen zwei Punkte auf: Erstens der pIN-Wildtyp weist 51 Ergebnisse ____________________________________________________________________________________________________________________________________________________ eine Extinktion des oxidierten Spektrums bei E410 von 0,217 auf und sie fällt somit höher aus, als die bei der Referenz (E409 = 0,206) ermittelte Extinktion. Zweitens findet sich ein dazu konträres Verhalten bei den reduzierten Spektren. Hierbei zeigt das Referenzspektrum eine leicht höhere Extinktion (E427 von 0,263) gegenüber dem pIN-Wildtypspektrum (E427 von 0,260). Um dieses Verhalten näher zu untersuchen, wird der Reduktionsgrad des pIN-Wildtyps relativ zur Extinktion des oxidierten Absolutspektrums der Referenz bestimmt. Die Berechnung des Reduktionsgrades R der Cyt bo3 Probe folgt nachstehenden Formeln (Gleichung 3.1 und 3.2). EMax (red) (berechnet ) = EMax (ox) (Referenz) * EMax (red) (Probe) EMax (ox) (Probe) EMax (red) (berechnet ) - EMax (ox) (Referenz) Reduktions grad in % : R = EMax (red) (Referenz) - EMax (ox) (Referenz) (3.1) *100% (3.2) Dabei wird zuerst die Gesamtextinktion des Maximums der oxidierten Soret-Bande der Probe, EMax (ox) (Probe), an die Referenz, EMax (ox) (Referenz), angepasst und anschließend das Maximum der Extinktion des reduzierten Spektrums, EMax (red) (Probe), mit dem sich ergebenden Umrech- nungsfaktor multipliziert (Gleichung 3.1). Es ergibt sich die berechnete Extinktion, EMax (red) (berechnet), die somit auf das oxidierte Spektrum des pHCL-Wildtyps bezogen ist. Anschließend wird diese berechnete Extinktion in Gleichung (3.2) eingesetzt und der prozentuale Reduktionsgrad im Vergleich zur Referenzoxidase bestimmt. Die nach den Gleichungen (3.1) und (3.2) ermittelten Ergebnisse sind für die Wildtyp-Proteine und deren Mutanten in Tab. 3.2.2 zusammengefasst. Der errechnete Reduktionsgrad für den pIN-Wildtyp beträgt 72% gegenüber der Referenz. Analog zum Reduktionsgrad kann ebenfalls der CO-Anbindungsgrad C aus den COFRAbsolutspektren im Vergleich zur Referenz des pHCL-Wildtyps berechnet werden. Hierbei wird die Gesamtextinktion der CO-gebundenen Probe, EMax (COFR) be) in Gleichung (3.1) eingesetzt. Es ergibt sich EMax ßend anstelle von EMax entsprechend zu EMax (red) (COFR) (Probe) anstelle von EMax (red) (Pro- (COFR) (berechnet). Dieses wird anschlie- (berechnet) in Gleichung (3.2) eingesetzt. Der Nenner verändert sich (Referenz) minus EMax (ox) (Referenz). Die sich ergebenden Werte sind in Tab. 3.2.2 zusammengefasst. Der aus dem COFR-Absolutspektrum berechnete COAnbindungsgrad des pIN-Wildtyps beträgt 77% gegenüber der Referenz. Aus den in Abb. 3.1.7 dargestellten Proben werden die Redox-Differenz- und die reduzierten, CO-gebundenen minus reduzierten Cyt bo3 Differenzspektren (CO-Differenzspektren), wie unter 2.9 beschrieben erstellt. In Abb. 3.2.2 sind neben den Wildtypen auch einige Cyt bo3 Mutanten Differenzspektren gezeigt. Die pHCL- und pIN-Wildtypen unterscheiden sich in den Redox-Differenzspektren bezüglich ihrer Extinktionsminima nur im Soret-Bereich um 1 nm 52 Ergebnisse ____________________________________________________________________________________________________________________________________________________ (Tab. 3.2.3). Die Minima bzw. Maxima betragen für die Soret-Bande 408 nm bzw. 409 nm und 428,5 nm, für die β-Bande 531 nm und für die α-Bande 561 nm. In beiden Fällen erscheint die α-Bande symmetrisch. Für das CO-Differenzspektrum wird ein Maximum bei 416 nm und ein Minimum bei 430 nm ermittelt. Im Vergleich zu Kita et al., 1984 [51] und Rumbley et al. 1997 [59] decken sich die ermittelten Werte nahezu, mit der Ausnahme, dass das Maximum der Soret-Bande bei den Redox-Differenzspektren um 1,5 nm bzw. 2 nm bathochrom verschoben ist. Die beiden verglichenen Oxidasen unterscheiden sich jedoch im Grad der CO-Anbindung in den CO-Differenzspektren. Aus der Extinktionsdifferenz E416-430 ergibt sich, dass das vom pINPlasmid kodierte Cyt bo3 nur 70% CO-Anbindung gegenüber der Referenzoxidase zeigt (Tab. 3.2.4). In weiterführenden Experimenten, die hier nicht graphisch abgebildet werden, wird über die Natriumdithionit-Reduktionskinetik abgeschätzt, wieviel Prozent der Cyt bo3 -Molekülpopulation in der fast- und in der slow-Form vorliegen. Hierbei wird nach Moody et al., 1995 [123] vorgegangen. Für den pHCL-Wildtyp ergibt sich, dass ca. 65% des Cyt bo3 in der fast-Form vorliegen. Im Vergleich hierzu weist der pIN-Wildtyp ca. 73% auf. Die Reduktion der gereinigten Proteine ist nach ca. 5 Minuten nahezu abgeschlossen. In der Literaturreferenz stellte sich für die wildtypische Oxidase heraus, dass sich die als „slow-Form“ bezeichnete Spezies zu ca. 70% aus der fast- und zu ca. 30% aus der slow-Form zusammensetzt [123]. Als letzter Abschnitt zur VIS-spektroskopischen Charakterisierung des pIN-Wildtyps sollen die CO-Rekombinations-Differenzspektren (CO-Rekombinationsspektren) des Cyt bo3 betrachtet werden. Die Proben werden entsprechend 2.9.2 vorbereitet und vermessen. Die CO-Anbindung findet an dem reduzierten binuklearen Zentrum der Oxidase statt und es bildet sich der COFR-Komplex. Dieser ist photolysierbar. Dabei wird die Fe-CO-Bindung gelöst, Kohlenmonoxid dissoziert vom high-spin Häm ab und bindet transient an das CuB. Die CORekombination, d.h. die Wiederanbindung des Kohlenmonoxids an das high-spin Häm, kann VIS-spektroskopisch im Soret-Bereich in der Größenordnung von ca. 70-100 Millisekunden bei Raumtemperatur verfolgt werden (z.B. [124]). Liegt kein CuB im binuklearen Zentrum vor, so kann CO vom Häm zwar gebunden werden, die CO-Rekombination (CO-Relaxation) findet jedoch innerhalb von nur wenigen Millisekunden statt [125]. Aus technischen Gründen des hier verwendeten Aufbaus, kann jedoch erst nach der 2 Millisekunden nach Applikation des Lichtblitzes ein auswertbares Spektrum erhalten werden. Da nur das Häm des binuklearen Zentrums an der CO-Relaxation beteiligt ist, gehen die Extinktionsänderungen im Soretbereich praktisch nur auf das high-spin Häm zurück. Somit liefert der COFR-Komplex im CO-Differenzspektrum ein Maß für die CO-Anbindung am high-spin Häm. 53 Ergebnisse ____________________________________________________________________________________________________________________________________________________ Abb. 3.2.3 zeigt exemplarisch am pIN-Wildtyp die zeitabhängigen Änderungen im VIS-Spektrum bei Photolyse des COFR-Komplexes. Eine weiterführende Beschreibung der Vorgänge während der Photolyse wird in dem Begleittext zu Abb. 3.2.3 gegeben. Das CO-Rekombinationsspektrum wird von der positiven Extinktionsbande bei 430 nm und der negativen bei 415 nm dominiert. Die Extinktionsänderungen der Bande bei 430 nm werden zur Beschreibung der CO-Rückbindekinetik am high-spin Häm O herangezogen. In Abb. 3.1.8 sind die Kinetiken der pHCL- bzw. pIN-Wildtypen vergleichend zur Y288FMutante gezeigt, bei der die CuB Ligandenbindekapazität selektiv entfernt ist [104; 105]. Abb. 3.1.8: CO-Rekombinationskinetik der Extinktionsänderungen bei 430 nm. Zur Photolyse des CO wurden die gereinigten, COFR-Komplex-Oxidasen des pHCL- (g) und pIN-Wildtyps (n) und der Y288F-Mutante (♦) eingesetzt. Die ermittelten Werte (durch Symbole dargestellt) wurden mit einem logarithmischen Zerfall erster Ordnung angepasst (durchgezogene Linie). Zeichenerklärung: A = Amplitude; τ = Zeitkonstante. Die Geschwindigkeit der CO-Rekombination ist von der Kohlenmonoxidkonzentration im Außenmedium abhängig [125]. Da bei der Kohlenmonoxidbegasung der Flüssigproben unter dem Laborabzug die Probe erst nach Entfernen der Kanüle gasdicht verschlossen werden kann, ist eine definierte Kohlenmonoxid-Konzentration innerhalb der Küvette nicht möglich. Die ermittelten Zeitkonstanten variieren daher leicht von Probe zu Probe. Die grundsätzliche Aussage, ob CuB an der CO-Rekombination beteiligt ist, kann jedoch über diese Zeitkonstanten und den Verlauf der Rekombinationskinetik gemacht werden. Die Kinetiken können mit einem logarithmischen Zerfall erster Ordnung angepasst werden. Die nach der Anpassung erhaltenen Amplitudenwerte der pHCL- bzw. pIN-Wildtypen weisen 33,4 mOD bzw. 22,4 mOD bei 430 nm auf und die Zeitkonstanten betragen hierbei 12,4 ms bzw. 11,4 ms. Wenn der pHCL-Wildtyp als Referenz für die CO-Anbindung herangezogen wird, weist der pIN-Wildtyp nur einen CO-Anbindungsgrad von 67% (Tab. 3.2.5) auf. Dieses 54 Ergebnisse ____________________________________________________________________________________________________________________________________________________ Ergebnis steht im Einklang mit der 70%igen CO-Anbindung ermittelt aus dem CODifferenzspektrum, d.h. dass praktisch das gesamte gebundene CO photolysierbar ist. Die Cyt bo3 -Mutante Y288F weicht von diesen Werten stark ab. Das COFR-Absolutspektrum (Abb. 3.2.1) und das CO-Differenzspektrum (Abb. 3.2.2) belegen, dass CO am high-spin Häm dieser Mutante gebunden ist. Dennoch ist die ermittelte Amplitude mit 1,1 mOD gering (Tab. 3.2.5). Die Wiederanbindung an das high-spin Häm läuft folglich schneller ab, als mit dem hier verwendeten Versuchsaufbau untersucht werden kann. Die ermittelte Zeitkonstante von 29,2 ms und die aus der Anpassung ermittelte CO-Anbindung am high-spin Häm daher nicht aussagekräftig. Aus diesen Gründen kann diese Cyt bo3 -Mutante jedoch als Referenz für eine CORekombination ohne die zwischenzeitliche CO-Anbindung an CuB herangezogen werden [105]. Die CO-Rekombinationskinetik des pIN-Wildtyps läßt kein Verhalten wie bei dem Spektrum der Y288F-Mutante erkennen, CuB liegt also im binuklearen Zentrum korrekt gebunden vor. Zusammenfassend lässt sich für den pIN-Wildtyp feststellen: Bezüglich der Lage der Extinktionsminima bzw. –maxima in den VIS-Spektren sind keine oder nur geringe Unterschiede zu dem pHCL-Wildtyp feststellbar. Aus den Absolutspektren (Abb. 3.1.7) lässt sich ermitteln, dass nur etwa 72% der vorhandenen Häme der Oxidase mit Natriumdithionit reduziert werden können, also redoxaktiv sind. Eine CO-Anbindung gegenüber dem Absolutspektrum der Referenz findet zu etwa 77% statt. Für den pIN-Wildtyp werden vergleichbare Werte von 70% COAnbindung bei den CO-Differenzspektren und 67% bei der berechneten Amplitude der COKinetik gefunden. Dies bedeutet, dass das high-spin Häm O nur zu rund 70% redoxaktiv ist. Die aus den CO-Relaxationen gewonnen Zeitkonstanten der verglichenen Wildtypen sind sehr ähnlich, d.h., dass die redoxaktiven binuklearen Zentren beim pIN-Wildtyp intakt sind. Dies wird ebenfalls durch das Fehlen der CT-Bande im Cyanid-gebundenen Zustand bestätigt. 3.1.2.3 Aktivitäten Erläuterungen zu den Aktivitätstests sind unter 3.2.4 und in Tab. 3.2.6 gegeben. Das vom pIN-Plasmid kodierte Cyt bo3 weist vergleichend zur pHCL-Referenz im in vivo Komplementationstest gleiches Bakterienwachstumsverhalten auf, d.h. die fehlende oxidative Respiration des E. coli Stamms JM107 ∆cyo ∆cyd kann durch die Plasmidexpression des Cyt bo3 in E. coli ausgeglichen werden. Im in vitro Aktivitätstest zeigt sich jedoch ein abweichendes Ergebnis, es werden nur 64% Durochinol-Oxidase-Aktivität vom pIN-Wildtyp im Vergleich zum pHCL-Wildtyp gemessen. Dieser Wert weist eine annähernde Übereinstimmung mit den rund 70% redoxaktiven high-spin Hämen auf. 55 Ergebnisse ____________________________________________________________________________________________________________________________________________________ 3.1.3 Anwendungsbeispiele Es wird untersucht, ob ortsspezifische Mutanten des Cyt bo3 ausgehend vom pIN-Plasmid, erhalten werden können. Um auf eine wiederholte Darstellung von Abbildungen zu verzichten, sind die Ergebnisse hier stichpunktartig aufgeführt. Weiterhin soll geklärt werden, ob sich das Expressions- bzw. Reinigungsverhalten einer auf dem pIN-Plasmid basierenden Mutante ändert, die ausgehend vom pHCL-Plasmid nicht exprimiert bzw. gereinigt werden konnte. Basierend auf dem pIN-Plasmid konnten die ortsspezifischen Cyt bo3 -Mutanten T352S, T359S sowie T369S auf DNA-Ebene erstellt werden. Zum Vergleich werden ebenfalls die gleichen Mutanten mit der template-DNA von pHCL erstellt, wobei auf eine anschließende Proteinreinigung verzichtet wird. Der Vergleich der Ergebnisse von den auf dem pIN-Plasmid basierenden Mutanten erfolgt über die in der Literatur beschriebenen Mutanten. Die T369S-Mutante konnte in beiden Fällen in E. coli BL21 ∆cyo recA- nicht überexprimiert werden, da nur proteolytisch degradiertes Protein in den Bakterienzellen zu finden ist. Die beiden anderen Mutanten können überexprimiert, gereinigt und biochemisch analysiert werden. In Abb. 3.1.9 ist ein 15%-SDS Gel gezeigt, dass den Reinigungsverlauf der T352S (pIN)-Mutante exemplarisch wiederspiegelt. Die Proteinisolierung erfolgt gemäß dem Reinigungsprotokoll, das für den pIN-Wildtyp erhalten wurde, d.h. es ist ein His-tag an Untereinheit II vorhanden. Abb. 3.1.9: 15% SDS-Gel zum Proteinreinigungsverlauf der Cyt bo 3 -Mutante T352S (pIN). Die Bakterienzellen wurden in BL21 ∆cyo recA - angezogen. Spur 1: Bakterienmembranen, Spur 2: Überstand der solubilisierten Membranen, Spur 3: Durchlauf nach Säulenauftrag, Spur 4: gesammelte Waschfraktionen, Spur 5: gereinigte T352SMutante (10 µg), Spur 6: gereinigter pIN-Wildtyp (10 µg). Die beiden Mutantenproteine weisen bezüglich der α-Bande in den hier nicht zusätzlich dargestellten 77 K-Differenzspektren ein Extinktionsverhalten auf, das auf einen Häm B Einbau in der low-spin-Hämbindetasche zurückschließen lässt. Aus der HPLC-Analytik der Hämextrakte 56 Ergebnisse ____________________________________________________________________________________________________________________________________________________ ergibt sich ein 1:1 Verhältnis von Häm B zu Häm O. Die Cyt bo3 Molekülpopulationen sind daher homogen zusammengesetzt. Die Cyt bo3 -Mutante T352S weist in den oxidierten und reduzierten Absolutspektren (Abb. 3.2.1 und Tab. 3.2.1), sowie den Redox-Differenzspektren (Abb. 3.2.2) keine wesentlichen Unterschiede zur Lage der Extinktionsminima und -maxima gegenüber dem pIN-Wildtyp auf. Der Reduktionsgrad beträgt 90%. In dem COFR-Absolutspektrum weicht sie jedoch ab. Sie zeigt ein spitzzulaufendes Extinktionsmaximum in der Soret-Bande bei 418,5 nm. Die Schulter bei 426 nm ist jedoch wiederum nicht vorhanden. Die Maxima der β- und α-Bande liegen bei 532,5 nm bzw. 562 nm. Diese Mutante besitzt einen hohen CO-Anbindungsgrad von 103%, berechnet aus dem COFR-Absolutspektrum (Tab. 3.2.2) bzw. 93%, ermittelt aus dem CO-Differenzspektrum (Tab. 3.2.4). Die aus der Anpassung der CO-Rekombinationskinetik ermittelte Amplitude ist ebenfalls mit 31,4 mOD vergleichsweise hoch und zeugt von einer nahezu kompletten COAnbindung (Tab. 3.2.5). Die Zeitkonstante von 14,7 ms lässt auf ein intaktes binukleares Zen trum zurückschließen. Die Cyt bo3 -Mutante T359S weist gegenüber dem pIN-Wildtyp im oxidierten Absolutspektrum ein um 2 nm auf 412 nm verschobenes Extinktionmaximum auf (Abb. 3.2.1). Dies spiegelt sich ebenfalls im Extinktionsminimum der Soret-Bande des Redox-Differenzspektrums wieder, das bei 410 nm liegt (Tab. 3.2.3). Der Reduktionsgrad beträgt 96%. Das COFRAbsolutspektrum zeigt ein Maximum bei 424 nm und weist somit auf eine unvollständige COAnbindung hin. Der hierbei ermittelte CO-Anbindungsgrad von 87% ist folglich nicht aussagekräftig. Aus dem CO-Differenzspektrum konnte ein CO-Anbindunggrad von 59% ermittelt werden (Tab 3.2.4). Entsprechend kleiner fällt die Amplitude von 18,4 mOD bei 430 nm der CORekombinationskinetik aus. Die Zeitkonstante beträgt 11,4 ms (Tab. 3.2.5). Im Folgenden werden die in vitro und in vivo Aktivitäten dieser beiden Mutanten untersucht, die Ergebnisse sind in Tabelle 3.2.6 wiedergegeben. Die T352S-Mutante, basierend auf pIN bzw. pHCL weist eine eingeschränkte Komplementation im in vivo Aktivitätstest auf. Im in vitro Aktivitätstest lässt sich bei dieser Mutante (T352S (pIN)) eine Aktivität von 26% im Vergleich mit dem pHCL-Wildtyp feststellen. Die Durochi- nolaktivität gegenüber dem pIN-Wildtyp liegt entsprechend bei 41%. In Thomas et al. 1993 [103] wurde für diese Mutante eine Ubichinol-Oxidase-Restaktivität von 58% festgestellt. Die T359S-Mutante, basierend auf pIN bzw. pHCL weist Komplementation im in vivo Aktivitätstest auf. Im in vitro Aktivitätstest konnte bei der auf pIN aufbauenden Mutante ein Substratumsatz von 57% gegenüber dem gereinigtem pHCL-Wildtyp festgestellt werden. Dies entspricht 90% Durochinolaktivität gegenüber dem pIN-Wildtyp. In Thomas et al. 1993 [103] wurde für diese Mutante eine Ubichinol-Oxidase-Restaktivität von 95% festgestellt. 57 Ergebnisse ____________________________________________________________________________________________________________________________________________________ Die pHCL-Mutante Y288A konnte nicht in BL21 ∆cyo recA- überexprimiert und gereinigt werden. Zu Versuchszwecken wird ausprobiert, ob sich das Expressionsverhalten dieser Mutante, basierend auf dem pIN-Plasmid ändert bzw. sich das Protein bei geringer Expression durch den vorhandenen His-tag reinigen lässt. Eine Expression ist in diesem Falle ebenfalls nicht vorhanden, es kann kein Cyt bo3 gereinigt werden. Die Erstellung eines Wildtyp-Konstruktes, das C-Terminal nicht proteolysiert wird und somit die Oligohistidinmodifikation trägt, ist jedoch für die Reinigung von Cyt bo3 überproduziert im E. coli-Stamm S730, der zur 13 C -Isotopenmarkierung der Häme eingesetzt wird notwendig. Die Ergebnisse dieser Überexpression sind unter 3.4.3 dargestellt. Zusammenfassend lässt sich feststellen: Eine Überexpression, Reinigung und die sich anschließende biochemische Charakterisierung von Cyt bo3 -Mutanten, basierend auf dem pIN-Plasmid, ist möglich. Ein Mutantenprotein, das auf dem pHCL-Plasmid basierend nicht erhalten werden konnte, kann ebenfalls nicht mit Hilfe des pIN-Plasmids gereinigt werden. 3.2 Biochemische und VIS-spektroskopische Charakterisierung von Cyt bo3 und dessen Mutanten Die verwendeten Wildtyp-Konstrukte von Cyt bo3 und die auf ihnen basierenden Mutanten werden in verschiedenen Unterpunkten dieser Arbeit vorgestellt. Um nicht in den einzelnen Abschnitten die biochemischen und VIS-spektroskopischen Eigenschaften dieser Konstrukte darstellen zu müssen, werden sie hier zur besseren Übersicht zusammengefasst. Es handelt sich um rein empirisch ermittelte Daten, die erst an anderer Stelle, wie z.B. unter 3.1 geschehen, in den Gesamtkontext eingebettet werden. Die ermittelten Daten der Cyt bo3 -Mutanten in den Abbildungen und Tabellen sind in der Regel nur dann gezeigt, wenn ein abweichendes Verhalten zu den jeweiligen Wildtypen vorliegt, die unter 3.1.2.2 beschrieben sind und zum besseren Verständnis eine Darstellung notwendig ist. 3.2.1 Absolutspektren Die Proben werden entsprechend 2.9.1 angefertigt und vermessen. Bei den in Abb. 3.2.1 gezeigten Extinktionsspektren handelt es sich um die oxidierten, reduzierten und COFR-Absolutspektren von Cyt bo3 -Mutanten, die auf dem pHCL- bzw. pIN-Plasmid basieren (s. Tab. 3.2.6). Die Absolutspektren der zugrundeliegenden Wildtypen sind in Abb. 3.1.7 wiedergegeben. Tab. 3.2.1 fasst die Lage der Extinktionsmaxima der hier untersuchten Cyt bo3 -Wildtypen und 58 Ergebnisse ____________________________________________________________________________________________________________________________________________________ Mutanten zusammen. Zusätzlich zu den Maxima der Soret-Banden sind auch die der β- und α-Banden aufgeführt. Tab. 3.2.2 gibt eine Übersicht zu den aus den Absolutspektren ermittelten Gesamtextinktionen und des Reduktions- bzw. CO-Anbindungsgrades. Abb. 3.2.1: VIS-Absolutspektren der gereinigten Cyt bo 3 -Mutanten, die auf dem pHCL- bzw. pIN-Plasmid (Angabe in Klammern) basieren. Die Spektren sind, mit Ausnahme des pHTAG-Wildtyps, durch die Position und die Art des Aminosäureaustausches der ortsspezifischen Mutante bezeichnet. Die Signalintensitäten sind auf 150 µg/mL, berechnet aus den Redox-Differenzspektren (3.2.2), bezogen. Die Wellenlängen der Extinktionsmaxima der SoretBande sind als Zahlenwert angegeben. Die Spektren sind im Bereich von 400-650 nm dargestellt. Die (Luft-) oxidierten Spektren sind durch eine gestrichelte Linie, die (Natriumdithionit-) reduzierten durch eine schwarze durchgezogene und die COFR-Absolutspektren durch eine rote durchgezogene Linie wiedergegeben. Die F391Q (pHCL)-Mutante zeigt in dem oxidierten Absolutspektrum ein Extinktionmaximum, das um 4 nm zu höheren Wellenlängen verschoben sind. Die zu großen Teilen übereinstimmende Form mit dem reduzierten Spektrum, die Lage und das breitbandige Maximum des COFR-Absolutspektrums weisen auf eine unvollständige CO-Anbindung hin. Somit liefert der CO-Anbindungsgrad ermittelt durch die unter 3.1.2.2 angegebenen Gleichungen keinen aussagekräftigen Wert (Tab. 3.2.2). Der ∆cyoE-Mutante fehlt das Gen zur Expression der Farnesyltransferase. Die gemessenen Extinktionen zeigen folglich Spektren, die auf Cyt bb3 zurückzuführen sind [100]. Das Extinktionsmaximum vom isolierten Häm B ist gegenüber dem von Häm O leicht bathochrom verschoben [59]. Die Maxima der oxidierten und der CO-Absolutspektren befinden sich folglich bei 415 nm bzw. 425 nm. Bei dem reduzierten Spektrum ist eine Verschiebung von 1,5 nm gegenüber dem Wildtyp festzustellen. Weiterhin ist ein erhöhter CO-Anbindungsgrad um ca. das 1,5fache gegenüber dem Wildtyp feststellbar (Tab. 3.2.2), der sich durch eine höhere Gesamtextinktion gegenüber dem reduzierten Absolutspektrum ausdrückt. 59 Ergebnisse ____________________________________________________________________________________________________________________________________________________ Das Expressionsprodukt von pHTAG liefert neben Cyt bo3 ebenfalls Cyt oo3 (Abb. 3.1.6). Die Lage des Maximums des reduzierten Spektrums ist zu 423 nm verschoben. Tab. 3.2.1: Wellenlängenangaben der Extinktionsmaxima der Absolutspektren von gereinigtem wildtypischem und mutagenisiertem Cyt bo 3 . Plasmida pHCL pHTAG pIN pMC39 ∆cyoE E286D E286Q F391Q T352S (pIN) T359S (pIN) Y288F oxidiert / nm Soret-Bande 409 409 410 409 415 409 409 413 410 412 410,5 Soret-, 427 423 427 424 428,5 427 425 428 427 427,5 426 reduziert / nm β-, α-Bande 531 560,5 527,5 555,5 530,5 560 529 558 531 560 531,5 560,5 531 560 532 561 530,5 560 532 560,5 530 559 Soret-, 419 419 420 419 425 419 419 425 418,5 424 419 COFR /nm β-, α-Bande 532 563 529 556,5 531,5 561,5 531 559,5 532,5 563 532 563 532,5 562 533,5 563,5 532,5 562 533 561,5 532 560,5 Zeichenerklärung: a Die vom Plasmid-Konstrukt kodierte Oxidase. Die Punktmutanten in Untereinheit I werden nach der Position und der Art der ausgetauschten Aminosäure bezeichnet, sie beziehen sich alle bis auf T352S und T359S, auf das Plasmid pHCL. Die Mutanten E286Q (pHCL) bzw. Y288F (pHCL) weisen in den hier nicht zusätzlich aufgeführten 77 K-Differenzspektren ein Häm B in der low-spin Häm-Bindetasche auf. Hierbei ist bei der Y288F-Mutante die charakteristische Aufspaltung der α-Bande um 563 nm geringer als bei der Referenz ausgeprägt [104]. Die Auswertung der HPLC-Elutionsprofilen der Häm-Extrakte zeigen ein 1:1 Verhältnis von Häm B zu Häm O (Daten nicht gezeigt). Die Extinktionsmaxima der reduzierten Absolutspektren liegen bei 425 nm bzw. 426 nm und sind gegenüber dem Wildtyp um 2 nm bzw. 1 nm zu kürzeren Wellenlängen (hypsochrom) verschoben. Die Y288FMutante zeigt darüber hinaus ein um 1,5 nm, auf 410,5 nm bathochrom verschobenes Maximum im oxidierten Absolutspektrum. Die Reduktionsgrade beider Proteine sind deutlich herabgesetzt (Tab. 3.2.2). Die hypsochrom verschobenen Maxima der reduzierten Spektren deuten darauf hin, dass die high-spin Häme reduziert vorliegen, die low-spin Häme demnach jedoch nur zum Teil reduziert sind. Dies wird ebenfalls durch die ca. 1,5-2fach erhöhten Gesamtextinktionen gegenüber dem pHCL-Wildtyp Spektrum bekräftigt (Tab. 3.2.2). Diese sind auf die Differenzsignale der α-Bande der Redox-Differenzspektren bezogen und somit praktisch nur auf den Reduktionsgrad des low-spin Häms (3.2.2). Darüber hinaus werden überproportional erhöhte Extinktionen bei den COFR-Absolutspektren gegenüber den reduzierten Spektren erreicht. Da die CO-Anbindung im binuklearen Zentrum stattfindet, fließen entsprechend stark die Extinktionsänderungen des high-spin Häms in die Gesamtsignalintensität ein. Der CO-Anbindungsgrad bei den E286Q- bzw. Y288F-Mutanten beträgt demnach 96% bzw. 196%. 60 Ergebnisse ____________________________________________________________________________________________________________________________________________________ Die Extinktionswerte der Absolutspektren in Tab. 3.2.2, EMax (ox) , EMax (red) und EMax (COFR) , wer- den nach Skalierung auf die Redox-Differenzspektren (3.2.2) ermittelt. Die berechneten Extinktionen und die sich daraus ergebenden Reduktions- bzw. CO-Anbindungsgrade werden nach den unter 3.1.2.2 beschriebenen Gleichungen (3.1) und (3.2) berechnet. Tab. 3.2.2: Ermittelte und berechnete Gesamtextinktionen am Maximum der Absolutspektren von gereinigtem wildtypischem und mutagenisiertem Cyt bo 3 und der sich ergebende Reduktions- bzw. CO-Anbindungsgrad. Plasmida EMax(ox) pHCL pHTAG pIN pMC39 DcyoE E286D E286Q F391Q T352S T359S Y288F 0,206 0,235 0,217 0,249 0,223 0,248 0,434 0,194 0,212 0,223 0,440 EMax(red) EMax(COFR) EMax(red) (berechnet) 0,263 0,254 0,263 0,267 0,285 0,234 0,260 0,255 0,247 0,273 0,287 0,226 0,283 0,304 0,261 0,298 0,304 0,248 0,415 0,531 0,197 0,249 0,229 0,264 0,265 0,263 0,244 0,282 0,269 0,261 0,462 0,640 0,216 EMax(COFR) Reduktions- CO-Anbin(berechnet) grad R /% dung C /% 0,254 100 100 0,250 49 92 0,242 72 75 0,237 35 65 0,281 96 156 0,253 74 98 0,252 -19 96 0,243 102 (77)b 0,256 90 103 0,248 96 (87)b 0,3 18 196 Zeichenerklärung: a wie bei Tab. 3.2.1; bder CO-Anbindungsgrad ist nicht aussagekräftig, da das COFRAbsolutspektrum (Abb. 3.2.1) weitestgehend dem reduzierten entspricht. 3.2.2. Raumtemperatur-Differenzspektren Die Proben werden entsprechend 2.9.3 angefertigt und vermessen. In Abb. 3.2.2 sind neben den Redox- die dazugehörigen CO-Differenzspektren gezeigt. Die Konzentrationsbestimmung der Oxidasen und die Normierung der VIS-Spektren zueinander erfolgt über die differenziellen Extinktionen der α-Bande bei 560 nm minus 580 nm (siehe auch Text zur Abb. 3.2.2) der RedoxDifferenzspektren. Diese Signalintensitäten dienen als Grundlage zur Berechnung des Umrechnungsfaktors, mit dem die Extinktionen der Absolutspektren (Abb. 3.1.7 und Abb. 3.2.1, sowie Tab. 3.2.2), der CO-Differenzspektren (Tab. 3.1.4) und der CO-Rekombinationskinetiken (Abb. 3.1.8 und Tab. 3.2.5) skaliert werden. In Tab. 3.2.3 sind die Wellenlängen der Extinktionsminima- bzw. maxima der Redox-Differenzspektren der untersuchten Wildtypen und Mutanten wiedergegeben. Bei Spektrendeckung mit dem jeweiligen Wildtyp wird auf eine gesonderte Beschreibung verzichtet. Bei dem Redox-Differenzspektrum werden positive Banden dem reduzierten, negative dem oxidierten Zustand der Oxidase zugeordnet. Zur Extinktion der Soret-Bande, bei ca. 400-450 nm, tragen sowohl das low-spin, als auch das high-spin Häm etwa im Verhältnis 1:1 bei [65]. Das Differenzsignal der α-Bande, bei ca. 540-580 nm, setzt sich hingegen nahezu nur aus der Absorption des low-spin Häms zusammen [45; 62] (1.4). Die resultierende α-Bande kann auch als Kriterium zur Bestimmung der Häm-Spezies, die in der low-spin Hämbindetasche eingebaut 61 Ergebnisse ____________________________________________________________________________________________________________________________________________________ ist, herangezogen werden [59]. Ein nahezu symmetrischer Aufbau dieser Bande deutet auf Häm B als low-spin Häm hin. Abb. 3.2.2: Redox-Differenzspektren (schwarz) und CO-Differenzspektren (rot) der Cyt bo 3 Wildtypen und Mutanten bei Raumtemperatur. Zur Spektrenaufzeichnung wurde gereinigtes wildtypisches und mutagenisiertes Cyt bo 3 eingesetzt. Die Punktmutanten sind durch die Position und die Art des Aminosäureaustauschs gekennzeichnet. Die Spektren sind auf 150 µg/mL bezüglich der Signalintensität der α-Bande mittels des differenziellen Extinktionskoeffizienten ∆ε = 18.700 M-1 *cm-1 [51] bei 560 nm minus 580 nm berechnet. Die Wellenlängen der Extinktionsminima und -maxima sind als Zahlenwert angegeben. Die Spektren sind im Bereich von 400-650 nm dargestellt. Die fünffache Vergrößerung schließt 515-590 nm ein. Bei den CO-Differenzspektren werden positive Banden dem reduzierten, mit am high-spin Häm gebundenem CO, negative dem reduzierten Zustand der Oxidase zugeordnet. Dominiert werden die Spektren von positiven Banden bei 416 nm und negativen Banden bei 430 nm. Im Falle von der ∆cyoE-Mutant ist die Differenzbande auf 420/433 nm verschoben. Das Redox-Differenzspektrum des pHTAG-Wildtyps weist eine asymmetrisch verlaufende α-Bande auf, die ein Extinktionsmaximum bei 556,5 nm und eine Schulter um 563 nm besitzt, d.h., dass neben Häm B ebenfalls Häm O in der low-spin-Hämbindetasche eingelagert ist (vergleiche Abb. 3.1.6). Das hier nicht aufgeführte Spektrum vom pMC39-Wildtyp zeigt einen ähnlichen Verlauf dieser Bande. Das Maximum kommt hierbei bei 558 nm und die Schulter ebenfalls um 563 nm zu liegen. Demgegenüber zeigen die pIN- und pHCL-Wildtypen bzw. die auf ihnen basierenden Mutantenproteine einen nahezu symmetrischen Verlauf der α-Bande mit einem Maximum bei 561 nm, d.h. Häm B liegt in der low-spin Hämbindetasche vor. Die Extinktionsminima der ∆cyoE-, F391Q-, T359S- und Y288F-Mutanten sind im SoretBereich um 1-3 nm bathochrom verschoben, wie es aus den Absolutspektren (Abb. 3.2.1) zu erwarten war. Betrachtet man die Extinktionsdifferenzen der dargestellten Cyt bo3 -Proteine zwischen Minimum und Maximum im Soret-Bereich, so fällt auf, dass mehr oder minder große Extinkti62 Ergebnisse ____________________________________________________________________________________________________________________________________________________ onsschwankungen auftreten, d. h. entweder der Reduktionsgrad eines oder beider Häme variiert oder, wie beispielsweise bei der Mutante ∆cyoE, ein anderes Absorptionsverhalten, bedingt durch Häm B in der high-spin Häm Position, vorliegt. Diese Unterschiede sind in Tab. 3.2.4 als Extinktionsänderung bei ∆EMax.red–Min.ox zusammenfassend dargestellt. Auf eine Auswertung bezüglich des Reduktionsgrads, ähnlich wie unter 3.2.1 beschrieben, wird hierbei verzichtet, da im Differenzspektrum nicht zwischen einem unterschiedlichen Absorptionsverhalten der HämSpezies und der Häm-Reduktion unterschieden werden kann. Tab. 3.2.3: Wellenlängenangabe der Extinktionsminima und -maxima der Redox-Differenzspektren von gereinigtem wildtypischem und mutagenisiertem Cyt bo 3 . Plasmida pHCL pHTAG pIN pMC39 ∆cyoE F391Q T359S Y288F Soret-Bande Minimum Maximum 408 428,5 409 427 409 428,5 409 427 410,5 428,5 411 428,5 410 428,5 410,5 428,5 β -Bande α -Bande 531 528 531 529 531 531 531 531 561 556,5 561 558 561 561 561 561 Zeichenerklärung: a wie bei Tab. 3.2.1 . Extinktionsschwankungen findet sich ebenfalls im Vergleich zu den aus den CO- Differenzspektren (Abb. 3.2.2 rote Spektren und Tab. 3.2.4). Da die hier betrachteten Extinktionen bei ∆E416-430 nur auf die Absorptionsänderung des reduzierten high-spin Häms im COgebundenen Zustand zurückgehen, kann unmittelbar auf den CO-Anbindungsgrad geschlossen werden. Die differenzielle Extinktion des pHCL-Wildtyp Spektrums (∆E416-430 = 0,142) wird im Vergleich zu den anderen Oxidasen gleich 100% gesetzt. Diese Oxidase liegt jedoch ebenfalls nicht ganz vollständig in der CO-gebundenen Form vor (Tab. 3.2.4 letzte Spalte). Dies ergibt sich aus der Berechnung der Oxidasenkonzentration unter Berücksichtigung des differenziellen Extinktionskoeffizienten ∆ε 415-430 = 145.000 M-1 *cm-1 [51]. Im Vergleich zu dem aus dem COFR-Absolutspektrum ermittelten CO-Anbindungsgrad zeigen die Oxidasen mit nicht wildtypischem Häm-Gehalt, z.B. ∆cyoE und pHTAG erwartungsgemäß große Schwankungen. Die zur Berechnungsgrundlage benutzten Extinktionskoeffizienten können diese Proteine nur ungenügend beschreiben bzw. ein direkter Vergleich zwischen Referenz und diesen Mutanten ist durch das veränderte Extinktionsverhalten strenggenommen nicht möglich. Die E286Q-Mutante weist ebenfalls eine große Differenz zwischen der CO-Anbindung von 96% ermittelt aus dem COFR-Absolutspektrum und dem entsprechend aus dem CO63 Ergebnisse ____________________________________________________________________________________________________________________________________________________ Differenzspektrum gewonnen Wert von 156% auf. Bei der Auswertung des Absolutspektrums konnte gezeigt werden, dass das high-spin Häm reduziert, das low-spin Häm jedoch nur teilweise reduziert vorliegt, d.h. im COFR-Komplex trägt das low-spin Häm ebenfalls nur zum Teil zur Gesamtextinktion bei. Da die bei den CO-Differenzspektren betrachtete Extinktionsänderung nur auf das CO-gebundene high-spin Häm zurückzuführen ist, wird dieser Unterschied verständlich. Bei der Y288F-Mutante fällt dieser Unterschied nicht so hoch aus, da das low-spin Häm stärker reduziert vorliegt. Tab. 3.2.4: Die aus den Redox-Differenzspektren ermittelten differenziellen Extinktionen und die prozentuale COAnbindung an das high spin Häm der jeweiligen Oxidase. Plasmida pHCL pHTAGd pIN pMC39d ∆cyoEd, e II E89D II E89Q E286D E286Q F391Q T352S (pIN) T359S (pIN) Y288F red minus ox / ∆EMax.red-Min.ox 0,298 0,234 0,251 0,231 0,221 0,266 0,255 0,256 0,305 0,229 0,242 0,236 0,226 COFR minus red / ∆E416-430 0,142 0,093 0,099 0,084 0,093 0,145 0,150 0,125 0,207 0,077 0,131 0,084 0,253 CO gebunden ermitteltb / % 100 65 70 59 65 102 106 88 146 54 93 59 179 CO gebunden berechnetc / % 93 61 65 55 61 95 99 82 136 51 87 55 167 Zeichenerklärung: a wie bei Tab. 3.2.1; bDie aus den COFR- minus reduzierten Spektren ermittelten CO-Anbindung an das high spin Häm in Prozent, bezogen auf die von pHCL exprimierte Oxidase. cDie aus dem Literaturwert für die COFR- minus reduzierten Spektren berechnete CO-Anbindungen an das high spin Häm in Prozent, bezogen auf den differenziellen Extinktionskoeffizienten ∆ε415-430 = 145.000 M-1 *cm-1 [51]. dIn diesen Oxidasen liegen andere Häm B zu Häm O Verhältnisse als 1:1 vor und die sich daraus ergebenden unterschiedlichen Extinktionkoeffizienten werden nicht berücksichtigt. eDas zur Extinktionsdifferenzberechnung benutzte Minimum bzw. Maximum liegt bei 420 nm bzw. 433 nm. Der aus den nur unvollständig CO-gebundenen T359S- bzw. F391Q-Mutanten ermittelte COAnbindungsgrad von 59% bzw. 54% ist jedoch bei den CO-Differenzspektren im Gegensatz zu den aus den COFR-Absolutspektren ermittelten Werten aussagekräftig, da nur die Extinktionsänderungen zwischen reduziert, CO-gebunden minus reduziert betrachtet werden. 3.2.3 Kohlenmonoxid-Rekombinationsspektren Die Proben des COFR-Komplexes werden entsprechend 2.9.2 angefertigt und vermessen. Abb. 3.2.3 zeigt exemplarisch am pIN-Wildtyp die zeitabhängigen Änderungen im VIS-Spektrum der COFR-Probe, welche mit der Photolyse des Komplexes bei Raumtemperatur einhergehen. Es handelt sich um ein Differenzspektrum, das aus der Subtraktion des Spektrums vor Belichtung minus dem Spektrum nach Belichtung gebildet wird. Positive Banden sind folglich dem belichteten, negative dem unbelichteten Zustand zuzuordnen. Das Spektrum ist von einer negativen 64 Ergebnisse ____________________________________________________________________________________________________________________________________________________ Bande bei 415 nm und einer positiven bei 430 nm dominiert. Die Differenzbanden werden zeitabhängig immer kleiner, d.h. CO bindet wieder an das high-spin Häm an. Nach ca. 100 Millisekunden ist die Rückbindung nahezu abgeklungen. Da hier die Rückbindung des CO an das Fe(II) gezeigt ist, kommt es zur Invertierung der positiven und negativen Extinktionsbanden gegenüber den CO-Differenzspektren. Die Kinetiken der Extinktionsänderungen bei 430 nm sind bereits in Abb. 3.1.8. für verschiedene Cyt bo3 -Proteine gezeigt worden. Abb. 3.2.3: Differenzspektren des COFR-Komplexes von Cyt bo 3 , exprimiert von pIN, 2, 10, 30 und 100 Millis ekunden nach Applikation des Lichtblitzes. Die CO-Rekombinations-Kinetik kann mit Hilfe eines logarithmischen Zerfalls erster Ordnung angepasst werden. Die gewonnen Ergebnisse und die daraus ermittelten CO- Anbindungsgrade sind in Tab. 3.2.5 aufgeführt. Die ermittelten Werte für die von Y288F und ∆cyoE exprimierten Oxidasen sind nicht aussagekräftig, da beide eine CO-Relaxation aufzeigen, die mit dem hier verwendeten Versuchsaufbau nicht zeitlich aufgelöst werden können (vergleiche Begleittext zur Abb. 3.1.8). Tab. 3.2.5: Wellenlängenangaben der Extinktionsmaxima der Absolutspektren von gereinigtem wildtypischem und mutagenisiertem Cyt bo 3 . Plasmida pHCL pHTAG pIN PMC39 ∆cyoE E286D E286Q F391Q T352S (pIN) T359S (pIN) Y288F Amplitude / mOD430 33,4 17,1 22,4 15,5 5,2 31,2 10,4 8,4 31,4 18,4 1,1 Zeichenerklärung: a wie bei Tab. 3.2.1 . Zeitkonstante τ / ms 12,6 11,7 11,4 11,1 23,0 12,9 12,7 10,5 14,7 11,4 29,2 CO-Anbindung / % 100 51 67 46 16 93 31 25 94 55 3 65 Ergebnisse ____________________________________________________________________________________________________________________________________________________ 3.2.4 Aktivitäten Ein in vitro Aktivitätstest mit dem artifiziellen Substrat Durochinol konnte entwickelt werden [49]. Die Reaktion des Durochinols mit dem Cyt bo3 zum Durochinon kann zeitabhängig durch Messung der Extinktionsdifferenz bei 270 nm minus 285 nm VIS-spektroskopisch verfolgt werden. Der Aktivitätstest wird entsprechend 2.8.6 durchgeführt. In vivo kann die physiologische Aktivität des vom Plasmid kodierten Cyt bo3 durch einen Komplementationtest überprüft werden, d.h. das Plasmid wird in den respirationsdefizienten E. coli Stamm JM107 ∆cyo ∆cyd transformiert und anschließend, nach Inkubation, auf vorhandenes, eingeschränktes oder nicht auftretendes aerobes Bakterienwachstum untersucht. In Tab. 3.2.6 sind diese Ergebnisse dargestellt. Tab 3.2.6: Durochinol-Oxidase-Aktivität und oxidative respiratorische Komplementation von Cyt bo 3 Konstrukten. Plasmida pHCL (pMC39) pHTAG (pMC39) pIN (pMC39) pMC39 Mutation Komplementationb kodiert für eine C-terminal an CyoA oligohistidinmodifizierte Oxidase kodiert für eine C-terminal an CyoD oligohistidinmodifizierte Oxidase kodiert für eine C-terminal an CyoA oligohistidinmodifizierte Oxidase keine Modifikation + DQH2 Oxidase Aktivitätc /% 100 + 48 + 64 (100) + 45 Deletion von cyoE, kodiert für ein Cyt bb3 H+-Eingang; K-Kanal H+-Eingang; K-Kanal H+-Leitung; D-Kanal H+-Leitung; D-Kanal K-Kanal H+-Leitung; K-Kanal H+-Leitung; K-Kanal Kovalente Bindung zu H284; CuBLigand Teildeletion von cyoB durch BglII Restriktion - 0 + + ± + - 69 0 98 16d 0 26 (41) 57 (90) 0d - n.b. (pBR322) ∆cyoE (pHCL) II E89D (pHCL) II E89Q (pHCL) E286D (pHCL) E286Q (pHCL) F391Q (pHCL) T352S (pIN) T359S (pIN) Y288F (pHCL) pSTAG (pHCL) Zeichenerklärung: a Das vom Plasmid-Konstukt überexprimierte Cyt bo 3 bzw. Cyt bb 3 /oo 3 , mit Ausnahme von pSTAG, das keine Oxidase hervorbringt. Angaben in Klammern sind auf das jeweilige Ursprungsplasmid, auf der das Plasmid-Konstrukt basiert, bezogen. bDie Komplementation wurde getestet, indem das jeweilige Plasmid in den respirationsdefizienten E. coli Stamm JM107 ∆cyo ∆cyd transformiert wurde und anschließend auf LB-Agarose Platten, die 100 µg/mL Ampicillin, 50 µg/mL Kanamycin und 50 µg/mL Chloramphenicol enthielten, ausgestrichen wurde. „+“ bedeutet, dass relativ große, sichtbare Bakterienkolonien ü.N. bei 37°C gewachsen sind. „±“ bedeutet, dass relativ kleine, sichtbare Bakterienkolonien ü.N. bei 37°C gewachsen sind, „-„ steht für nahezu nicht sichtbare Kolonien. cDie Durochinol-Oxidase-Aktivität vom pHCL-Wildtyp wurde als Referenz benutzt. 100 % entspricht 88 ± 2 (n=3) Elektronen pro Sekunde.Die angegebenen Prozentwerte schwanken maximal um ± 7%. Angaben in Klammer sind entsprechend auf den pIN-Wildtyp als Referenz bezogen. dDa das low-spin Häm in diesen Mutanten nicht vollständig reduziert vorliegt (Abb. 3.2.1), sich die Konzentrationsbestimmung jedoch auf die α-Bande des Redox-Differenzspektrums bezieht, wurde zuviel Oxidase im Aktivitätstest eingesetzt. 66 Ergebnisse ____________________________________________________________________________________________________________________________________________________ 3.3 FT-IR Probenpräparation und der Lösungsmittelaustausch von H2O zu D2O Um FT-IR-spektroskopisch auswertbare Proben erstellen zu können, ist es notwendig, dass der Wasseranteil der Proteinprobe gering, die Schichtdicke dünn, der Proteinanteil jedoch hoch sein muss. Der Austausch des Lösungsmittels von Wasser (H2 O) zu Deuteriumoxid (D2 O) stellt zusätzlich zu der Erstellung von ortsspezifischen und/oder isotopenmarkierten Mutanten eines Proteins eine wichtige Methode zur Bandenzuordnung von Aminosäureresten und deren Wechselwirkungen mit deren Umgebung innerhalb der FT-IR Spektroskopie dar (1.5.3). Um die Parameter der Probenpräparation und des Lösungsmittel- (H2 O/D2 O-) Austauschs möglichst hochreproduktiv einhalten zu können, wird eine Probenpräparationskammer, im weiteren Gasaustauschzelle genannt, benötigt. Die Konstruktion dieser Gasaustauschzelle wurde in Anlehnung an die von B. Mamat [126] erstellte Kammer verbessert und vielfach modifiziert, sodass eine erneute Darstellung nötig ist. Die Gasaustauschzelle ist in dieser Form bereits von K. Vogtt und K. Bettinger während der Erstellung Ihrer Diplomarbeiten verwendet worden [85; 127] und kam ebenfalls bei der IR-Probenerstellung für den konformativen Wechsels des Glu286 gekoppelt an den Elektronentransferschritt des low spin Häm B zum Einsatz [105]. 3.3.1 Gasaustauschzelle Die an die Präparation von Cyt bo3 -Proben für die FT-IR Spektroskopie gestellten Anforderungen sind vielfältig. Eine Grundvoraussetzung für ein reproduzierbares FT-IR Spektrum ist eine homogene IR-Probe, die von Probe zu Probe u.a. möglichst geringe Schwankungen bezüglich ihres H2 O- bzw. D2 O-Gehalts, der Schichtdicke und der Protein- und Additivkonzentrationen, wie z.B. caged electrons oder caged dioxygen aufweist. Darüber hinaus werden z.B. Kohlenmonoxid-mixed valence (COMV) Proben erstellt, die eine sauerstofffreie CO-Atmosphäre während der Präparation benötigen [127]. Um diesen Anforderungen gerecht zu werden, müssen Eigenschaften der verwendeten Substanzen wie z.B. die Konzentration der Oxidase oder die Pufferzusammensetzung, vor allem hinsichtlich der Wahl der Detergenzien, genau bekannt sein. Da Wasser einen starken IRAbsorber darstellt, muss der Feuchtigkeitsanteil der Probe reduziert werden. Dies kann beispielsweise im Exsikkator durch Anlegen von Unterdruck geschehen. Da ein natives, physiologisch aktives Protein eine Hydrathülle benötigt, darf die Proteinprobe entweder nicht zur Gänze eingeengt werden oder die Probe muss nach dem Eintrocknen rehydriert werden, z.B. durch Anhauchen. Sollen jedoch deuterierte Proben erstellt werden, versagen beide Methoden. Die zuvor mit D2 O versetzte und eingeengte Probe kommt beim Druckausgleich bzw. Öffnen des 67 Ergebnisse ____________________________________________________________________________________________________________________________________________________ Exsikkatordeckels immer mit der wasserdampfdurchsetzten Luft in Berührung und kann in nur wenigen Sekunden wieder einen H2 O-Anteil von bis zu 50% anreichern. Für manche Fragestellungen kann es nötig sein, dass die Oxidase unter einer bestimmten anaeroben Atmosphäre, wie z. B. Schutzgas (Argon), wie im Falle des bovinen Cyt aa3 oder Kohlenmonoxid präpariert werden muss. Für all diese Anwendungen wird eine Konstruktion benötigt, die einerseits das Eintrocknen und das Rehydrieren der Probe unter definierten Bedingungen und andererseits den Austausch des Gases ermöglicht, das die Probe umgibt. Ein unmittelbarer Kontakt der Probe mit der Außenluft muss verhindert werden. Die Calciumfluorid-Fenster können durch Apiezonfett gasdicht verschlossen werden, d. h. die beiden Fenster müssen vor Kontakt mit dem Exsikkatoraußenmedium bereits abgedichtet vorliegen. Die Erstellung der Gasaustauschzelle erfüllt diese Anforderungen. In Abb. 3.3.1 ist der schematische Querschnitt (links) und eine Fotografie (rechts) der Gasaustauschzelle gezeigt. Auf die Darstellung der Zu- und Ableitungen, sowie die Membranpumpe und die Gasflaschen wurde verzichtet. B A Beweglicher Stempel Deckel Auslass zur Vakuumpumpe CaF2 -Fenster Rinne für H 2O / D 2O CaF2 -Fenster mit Probe Einlass CO Exsikkator Probenhalter Abb. 3.3.1: Schematischer Aufbau (A) und Fotografie (B) der Gasaustauschzelle. Die Querschnittszeichnung wurde ausgehend von der von K. Vogtt erstellten Abb. leicht modifiziert. Die Probenbereitung erfolgt wie unter 2.10.1 beschrieben. Die Oxidaseprobe sollte sich in β-Decylmaltosid-haltigem Puffer befinden. Dieses Detergenz zeigt aus Erfahrungen die bisher besten Eigenschaften während der Probenpräparation. Beim Einengen der Probe durch Unterdruck entsteht bei entsprechend kleinem Volumen (2,5-5,0 µL) ein homogener blasenfreier Proteinfilm auf dem Calciumfluorid-Fenster. Zum Rehydrieren wird die Rinne des Probenhalters zuvor mit Wasser gefüllt. Sollen deuterierte Proben erstellt werden, wird sie entsprechend mit 68 Ergebnisse ____________________________________________________________________________________________________________________________________________________ D2 O befüllt. Die Membranpumpe erzeugt einen Unterdruck, der zum vollständigen Eintrocknen der Probe genutzt wird. Pro Mikroliter Flüssigkeit wird mit einer Minute angelegtem Unterdruck gerechnet. Nachdem der Auslasshahn geschlossen ist, gehen H2 O- bzw. D2 O-Moleküle aus der Rinne des Probenhalter in den gasförmigen Aggregatzustand über, sättigen die Exsikkatorinnenraum-Atmosphäre ab und befeuchten somit die hygroskopische Probe erneut. Dieser Befeuchtungssvorgang verläuft in der zeitlichen Größenordnung von Minuten und ist abhängig von der Konzentration an hygroskopischen Substanzen, wie z.B. der Natriumchlorid-, der Protein- oder auch der Detergenzkonzentration der Probe. Es stellt sich heraus, dass beispielsweise eine Erhöhung der NaCl-Konzentration um 50 mM, bei gleichem Probenvolumen, die notwendige Verweildauer der Probe in der H2 O bzw. D2 O gesättigten Atmosphäre um ca. 30-60 Sekunden verringert. Nach eineinhalb bis drei Minuten ist dieser Vorgang abgeschlossen und das zweite Calciumfluorid-Fenster wird mit dem beweglichen Stempel auf das am Rand dünn eingefettete Probenfenster gedrückt. Die Gasaustauschzelle wird belüftet, die verschlossenen Calciumfluorid-Fenster aus dem Probenhalter entnommen und in die FT-IR Küvette eingelegt. Das Deckplättchen der Küvette wird mit drei Schrauben so fest verschraubt, dass ein homogener, ca. 5 µm dicker und im Durchmesser ca. 4-5 mm großer Probenfilm entsteht. Es werden somit Cyt bo3 -IR-Proben erhalten, die ein hohes Maß an Reproduzierbarkeit besitzen. 3.3.2. H2 O/D 2 O Austausch Bislang war es nicht möglich, alle protonierbaren Gruppen einer Cyt bo3 -Probe, die in FT-IRKüvetten photochemisch einem Redoxwechsel unterzogen werden sollen, quantitativ zu deuterieren. Mit dem Einsatz von IR-Proben, die mittels der Gasaustauschzelle erstellt werden, soll nun einerseits dieser 1 H/2 H-Austausch, auch H/D-Austausch genannt, auf Vollständigkeit ge- prüft werden, andererseits soll die postulierte Schalterfunktion an der hydrophoben Barriere der Aminosäure Glu-286 [29] bei vollständigem H/D-Austausch untersucht werden. Bei der photoreduktions-induzierten Redoxdifferenz FT-IR-Spektroskopie (PR Differenzspektroskopie) wird ein Redoxwechsel der Oxidase durch Photolyse einer caged Verbindung, in diesem Falle eine FMN-EDTA Lösung (caged electrons) erzielt [81]. Caged Verbindungen werden bei biologischen Systemen verwendet, um eine Reaktion zu einem definierten Zeitpunkt zu initiieren. Zum Mechanismus der Photoreduktion von caged electrons siehe 1.5.2 und Abb. 1.5.3. Bei der IR-Messung wird ein Spektrum vor Belichtung (oxidiert) und eines nach Belichtung (reduziert) aufgenommen und anschließend das reduzierte minus oxidierte Cyt bo3 -Photoreduktions-Differenzspektrum (PR-Differenzspektrum) gebildet, d.h. positive Differenzbanden entsprechen dem reduzierten-, negative dem oxidierten Zustand des Cyt bo3 (Abb. 1.5.2). 69 Ergebnisse ____________________________________________________________________________________________________________________________________________________ In der Veröffentlichung Lübben et al., 1999 [29], konnte gezeigt werden, dass das FT-IRRedoxdifferenzsignal bei 1745/1735 Wellenzahlen (cm-1 ) auf Glu-286 zurückgeht. Dieser Aminosäurerest liegt sowohl im reduzierten als auch oxidierten Zustand des Cyt bo3 protoniert an der Carboxylgruppe der Seitenkette vor. Die Streckschwingung der C=O-Bindung (ν(C=O)) der Carbonylgruppen von Carboxylresten der isolierten Aminosäuren Asp und Glu können im Wellenzahlenbereich von 1710-1790 cm-1 beobachtet werden. Die ν(C=O)-Schwingung ist sensitiv gegenüber Wasserstoffbrücken, die bei starker H-Bindung Verschiebungen von bis zu 50 cm-1 hervorrufen können [93]. Dabei gilt als generelle Regel, dass H-Brücken die Frequenz dieser Streckschwingung erniedrigen [128]. Die positive Differenzbande des Glu-286 bei 1735 cm-1 wird dem vollständig reduzierten Zustand des Cyt bo3 zugeschrieben, der sich in einer hydrophileren Umgebung gegenüber dem oxidierten Zustand bei 1745 cm-1 befindet [29]. Nach dem Lösungsmittelaustausch von H2 O zu D2 O des Cyt bo3 im Exsikkator wurde in dieser Veröffentlichung eine Bandenverschiebung der positiven Differenzbande um 8 cm-1 zu kleineren Wellenzahlen auf 1727 cm-1 beobachtet. Das Minimum des negativen Signals verschob dabei nicht. Dieser Befund wurde so gedeutet, dass sich die Carbonylgruppe des Glu-286 im Falle der reduzierten Oxidase in einer wasserzugänglichen-, im Falle des oxidierten Cyt bo3 in einer wasserunzugänglichen Position innerhalb des Proteins befindet, d.h. eine H-Brückenbindung konnte nicht direkt nachgewiesen werden. Somit wird der Aminosäure Glu-286 eine Schalterfunktion beim Protonentransports im D-Kanal in Form einer hydrophoben Barriere beim Redoxwechsel zugeordnet. Bei vollständigem H/DAustausch, ermöglicht durch die Gasaustauschzelle soll diese Zuordnung bestätigt werden. Bevor die Schalterfunktion von Glu-286 untersucht werden kann, muss eine Technik entwickelt werden, die einen nahezu vollständigen Austausch des Lösungsmittels H2 O zu D2 O ermöglicht. Hierzu werden Cyt bo3 -Proben mit caged electron-Lösung auf dem Calciumchloridfenster vermischt und in der Gasaustauschzelle präpariert. Die Rinne des Probenhalters wird von Probe zu Probe mit prozentual unterschiedlich zusammengesetzten Lösungen von H2 O und D2 O befüllt. In Abb. 3.3.2 sind die Einkanalspektren dieser Proben gezeigt. Wenn im Folgenden von der 0% H2 O-Probe geschrieben wird, so ist dies auf die Wiederbefeuchtung des Cyt bo3 während der Probenpräparation mit nahezu reinem D2 O (99,8%) zu beziehen und nicht auf den tatsächlichen H2 O-Gehalt der Probe. Dies gilt ebenfalls für die restlichen Proben, mit Ausnahme der 100% H2 O-Probe, die nur den natürlich vorkommenden Isotopengehalt an Deuteriumoxid (0,015%) aufweist [129]. Das Verhältnis der ν(H2 O)-OH-Streckschwingung der Wasserbande (um 3400 cm-1 ) zur ν(D2 O) OD-Streckschwingung der Bande des Deuteriumoxids (um 2500 cm-1 ) dient hierbei 70 Ergebnisse ____________________________________________________________________________________________________________________________________________________ qualitativ als Kontrolle für den erfolgten H/D-Austausch. Deutlich ist bei der nahezu komplett ausgetauschten D2 O-Probe (in Abb. 3.3.2 schwarzes Spektrum) die hervortretende N-HStreckschwingung, in Resonanz mit dem Amid II-Oberton, der Amid A Bande (um 3300 cm-1 ) zu erkennen. Die Absorption der ν(H2 O) OH-Streckschwingung trägt nur noch zu einem sehr kleinen Teil zur Transmission in diesem Bereich bei. In dem für Proteine besonders interessanten Wellenzahlenbereich von 2600-900 cm-1 dominieren zwei Transmissionsbanden, Amid I und Amid II genannt, die auf die Rückgratschwingungen der Peptidbindungen zurückzuführen sind (Tab. 1.5.2). Im Folgenden werden diese Peptid-Schwingungen häufig erwähnt. Um sprachlich zwischen dem Einkanal- und dem PR-Differenzspektrum zu unterscheiden wird von der „Amid (I bzw. II)-Transmissionsregion“ und von der „Amid (I bzw. II)-Region“ geschrieben. Ist ganz allgemein von diesen Schwingungen die Rede, so wird sie als Amid (I bzw. II)-Bande bezeichnet. Die Amid I Bande setzt sich im Wesentlichen aus der C=O-Streckschwingung der Peptidbindung (1600-1700 cm-1 ) und additiv bei wässrigen Proben aus der breiten γ(H2 O)Scherschwingung des Wassers (um 1645 cm-1 ) zusammen. Die Amid II Bande absorbiert im Bereich von 1480-1575 cm-1 und ist durch die N-H-Biegeschwingung und die C-NStreckschwingung der Peptidbindungen geprägt (alle Wellenlängenangaben aus [92]). In den Einkanalspektren der Cyt bo3 -Proben weisen diese Transmissionsbanden Minima um 1657 cm-1 bzw. 1547 cm-1 bei wässrigen Proben auf. Abb. 3.3.2: FT-IR Einkanalspektren vom gereinigtem pHCL-Wildtyp, präpariert in unterschiedlichen H2 O/D2 O Verhältnissen des zum Wiederbefeuchten der Probe verwendeten Lösungsmittels. Für die Übersichtsspektren wurden 100 Interferogramme im Bereich von 4000-800 cm-1 ohne Filter und mit 2cm-1 Auflösung aufgenommen und gemittelt. Sie werden von 4000-1000 cm-1 dargestellt. Die hier vermessenen Cyt bo3 -Proben sollen Aufschluss über die Lage der ν(C=O) Streckschwingung der Carbonylgruppe des Glu-286 in deuteriertem Milieu geben. Diese Schwingun71 Ergebnisse ____________________________________________________________________________________________________________________________________________________ gen können im Bereich von 1710-1790 cm-1 gefunden werden. Eine Auswertung der Redox-FTIR-Spektren unterhalb von 1630 cm-1 ist nicht möglich, da dieser spektrale Bereich stark von den Banden der Photolyseprodukte der caged Verbindung überlagert ist (Abb. 3.4.1). In Abb. 3.3.3 sind einerseits die PR-Differenzspektren (oben) der in Abhängigkeit zum H2 O/D2 O Verhältnis erstellten Cyt bo3 -Proben gezeigt, andererseits die sich daraus ergebenden PR-Doppeldifferenzspektren (unten), wobei das Differenzspektrum der 100% H2 O-Probe als Minuend dient. Abb. 3.3.3: PR-Differenzspektren vom pHCL-Wildtyp, präpariert in Abhängigkeit vom H2 O/D2 O-Verhältnis der zum Wiederbeuchten der Proben verwendeten Lösungsmittels (oben) und die sich daraus ergebenden Doppeldifferenzspektren (unten). Beide Darstellungen werden von 1780-1690 cm-1 gezeigt. Die Doppeldifferenzen sind ca. 1,5fach gegenüber den Differenzspektren vergrößert dargestellt. Die Differenzbande bei 1696/1691 cm-1 in der oberen Darstellung bewahrt ihre Lage unabhängig vom Reduktionsgrad und dem D2 O-Gehalt der Probe. Sie kann daher zur Skalierung der Einzelspektren zueinander herangezogen werden [29]. Eine genaue Zuordnung dieser Bande auf eine bzw. mehrere funktionelle Gruppen, auf die das Differenzsignal zurückzuführen ist, ist bisher nicht getroffen worden. In der Abb. 3.3.3 sind die Spektren mit einer Gesamtextinktion von 1 mOD auf diese Bande bezogen. Bei dem 100% H2 O-Differenzspektrum ist ein deutliches Signal, mit einer negativen Extinktionsbande bei 1745 cm-1 und einer positiven bei 1735 cm-1 erkennbar. Diese Differenzbande kann dem Glu-286 des Cyt bo3 zugeordnet werden (Abb. 3.3.4). Eine breite Schulter mit positiver Extinktion kann im Bereich von ca. 1730-1704 cm-1 aufgelöst werden. 72 Ergebnisse ____________________________________________________________________________________________________________________________________________________ Das 75% H2 O-Spektrum weist bereits ein zusätzliches Extinktionsmaximum bei 1727 cm-1 auf, das bei weiter sinkendem Wassergehalt an Intensität gewinnt. Die Intensität des Extinktionsmaximums bei 1735 cm-1 nimmt in Korrelation dazu ab, bis es schließlich bei dem Differenzspektrum der 0% H2 O-Probe nicht mehr erkennbar ist. Es handelt sich hierbei um die Carbonylgruppen der Glu-286 γ-Carbonsäurefunktion, die in Abhängigkeit zum steigenden D2 OGehalt der Probe einen immer weiter sinkenden Anteil an Wasserstoff- bzw. im selben Maße wachsenden Anteil an Deuteriumbrücken erhalten. Bei der Betrachtung der negativen Bande bei 1745 cm-1 fällt auf, dass sich die Lage des Extinktionsminimums, bis zum 50% H2 O-Differenzspektrum praktisch nicht ändert und nur die Signalintensität abnimmt. Erst bei dem 25% H2 O-Spektrum ist eine Verschiebung des Minimums zu beobachten, die bei dem 0% H2 O-Spektrum bei ca. 1737 cm-1 nahezu abgeschlossen ist. Das Extinktionsminimum der oxidierten Bande in deuterierter Umgebung fällt also mit dem Maximum der reduzierten Bande bei wässrigen Proben bei 1735 cm-1 nahezu zusammen. Zwei isosbestische Punkte bei 1741 cm-1 und 1730 cm-1 sind vorhanden, die bei den Doppeldifferenzspektren die Nulldurchgänge charakterisieren. Im Gegensatz zu [29], zeigen die Doppeldifferenzspektren einen nahezu symmetrischen Aufbau im Bereich von 1770-1700 cm-1 , d.h. der Austausch von H-Brücken zu D-Brücken findet sowohl bei der reduzierten, als auch der oxidierten Bande des Glu-286 im selben Maße statt. Diese Korrelation wird in den Differenzspektren durch das annähernde Zusammenfallen des Extinktionsmaximums der wässrigen- und des Extinktionsminimums der deuterierten Proben um 1735 cm-1 überlagert und tritt erst bei hohem H/D-Austausch sichtbar und deutlich hervor. Als Resultat lässt sich festhalten: Da das negative Signal bei 1745 cm-1 beim gasförmigen Lösungsmittelaustausch von H2 O zu D2 O nach 1737 cm-1 verschiebt, muss die Carbonylgruppe des Glu-286 im oxidierten Zustand ebenfalls in Wasserstoffbrückenvernetzung vorliegen. 3.3.3 Anwendungsbeispiele An einigen ausgewählten Cyt bo3 -Mutanten, die auf pHCL basieren, wird der H/D-Austausch auf annähernde Vollständigkeit überprüft (Abb. 3.3.4). Der konformative Wechsel des Glu-286 ist an die Oxidation bzw. die Reduktion des Cyt bo3 gekoppelt. Die dargestellten Mutantenproteine werden ausgesucht, um nachzuweisen, dass dieser konformative Wechsel des Glu-286 mit dem Redoxübergang des low-spin Häms einhergeht und nicht an den des high-spin Häms bzw. des CuB gekoppelt ist. Die eingesetzten IR-Proben sind mit caged electrons versetzt und weisen 75 µg gereinigte Oxidase auf. Zur Photoreduktion wird Halogenlicht verwendet. Vor und nach der FT-IR Messung werden VIS-Spektren zur Kontrolle des Reduktionsgrades der Proben aufgenommen. Sie 73 Ergebnisse ____________________________________________________________________________________________________________________________________________________ liegen demnach alle nach abgeschlossener Messung vollständig reduziert vor (Daten nicht gezeigt, vergleiche hierzu Abb. 3.4.4). Auf eine zusätzliche Darstellung der Einkanalspektren, die einen nahezu kompletten H/D-Austausch zeigen, wird verzichtet. Abb. 3.3.4: PR-Differenzspektren vom gereinigtem pHCL-Wildtyp und Cyt bo 3 (pHCL)-Mutanten, präpariert in H2 O- (schwarz) bzw. D2 O- (rot) Atmosphäre. Die Darstellungen werden von 1780-1690 cm-1 gezeigt und sind auf eine Gesamtextinktion von 0,75 mOD bezüglich der 1696/1691 cm-1 -Differenzbande skaliert. Der pHCL-Wiltyp, die ∆cyoE- und Y288F-Mutante weisen in ihren H2 O-Spektren in Abb. 3.3.4 alle eine Differenzbande bei 1745/1735 cm-1 auf, die bei H/D-Austausch zu 1737/1727 cm-1 verschiebt, d.h. es handelt sich um einen nahezu kompletten Austausch. Bei der Cyt bo3 Mutante E286D und der Doppelmutante E286D/Y288F fehlt dieses Signal in den PRDifferenzspektren. Stattdessen erscheint in den H2 O-Spektren eine schwach erkennbare negative Bande um 1763 cm-1 . In den D2 O-Spektren befinden sich Differenzbanden bei 1760 cm-1 und 1755 cm-1 . In den hier dargestellten Spektren lässt sich die positive Bande bei wässrigen Proben nur erahnen, sie tritt jedoch bei den APR-Proben bei 1767 cm-1 hervor (Abb. 3.4.12). Diese Differenzsignale der E286D- bzw. der Doppelmutante E286D/Y288F sind gegenüber dem Wildtypspektrum invertiert, d.h. die reduzierte Bande ist zu höheren, die oxidierte zu niedrigeren Wellenzahlen verschoben. Die Signalintensitäten der Differenzbanden sind stark erniedrigt, wobei die Signalstärke bei den D2 O-haltigen Proben zunimmt. Auch diese beiden Mutanten lassen einen Lösungsmittelaustausch durch die Präparation in der Gasaustauschzelle zu. Die Cyt bo3 Mutante Y288F weist eine eingeschränkte Reduktion mit Natriumdithionit bezüglich des low-spin Häms auf (3.2.1). Dieser Befund ist ebenfalls mit den zur Photoreduktion eingesetzten caged electrons zu beobachten. Da die Reduktion des low-spin Häms mit dem konformativen Wechsel des Glu-286 einhergeht [105], muss etwa die zweifache Menge an Protein 74 Ergebnisse ____________________________________________________________________________________________________________________________________________________ zur Probenpräparation eingesetzt werden, um ähnliche Signalintensitäten der 1745/1735 cm–1 Differenzbande zu erreichen. Dies führt jedoch bezüglich der Amid I-Transmissionsbande zu einer für Infrarotlicht nahezu undurchlässigen Probe. Das Signal-zu-Rausch Verhältnis sinkt entsprechend in diesem Bereich ab. Somit wirken sich bereits kleine Basislinienschwankungen in den PR-Differenzspektren bis in den ν(C=O)-Streckschwingungsbereich aus. Im Spektrum der Y288F bzw. E286D/Y288F-Mutante lässt sich dies durch die negative Drift im Bereich unterhalb von 1725 cm-1 erkennen. Ob der konformative Wechsel des Glu-286 durch die Reduktion des low-spin Häms ausgelöst wird, soll nun überprüft werden. Das Protein der CuB defizienten Mutante Y288F [104; 105] zeigt bezüglich der Glu-286 Bande bei 1745/1735 cm-1 wildtypisches Verhalten. Zur genaueren Identifikation der Differenzbande, wird ein Spektrum der Doppelmutante E286D/Y288F aufgenommen. Die zugehörige Carbonylextinktion der Glu-286 Bande fehlt und das Spektrum ist in dem dargestellten Wellenzahlenbereich nahezu gleich mit dem Spektrum der E286D-Mutante. Hieraus kann abgeleitet werden, dass der konformative Wechsel des Glu-286 auch in Abwesenheit von CuB stattfindet. Die Häm O defiziente Mutante ∆cyoE ist vornehmlich zur Darstellung des erfolgten H/DAustauschs gezeigt. Im FT-IR Spektrum ist die dem Glu-286 zugeordnete Bande ebenfalls vorhanden, d.h. auch bei Austausch von Häm O zu Häm B in der high-spin Häm-Bindetasche, der bezüglich des in vivo und in vitro Aktivitätstest zu einem inaktiven Cyt bb3 führt, findet der konformative Wechsel des Glu-286 bei Reduktion statt. Aus hier nicht weiter gezeigten Daten, in denen das high-spin Häm selektiv durch Cyanid blockiert ist, findet dennoch der konformative Wechsel des Glu-286 bei Reduktion statt [29]. Dies zeigt deutlich, dass der konformative Wechsel des Glu-286 nicht mit dem high-spin Häm und dem CuB einhergeht. Es deutet also alles darauf hin, dass das low-spin Häm den Wechsel induziert. Einen direkten Nachweis, dass der konformativen Wechsels des Glu-286 an die Reduktion des low-spin Häms gekoppelt ist, konnte durch FT-IR Messungen des Cyt bo3 COMVKomplexes in Verbindung mit caged dioxygen und caged electrons erbracht werden [105]. Die weiterführenden Erläuterungen werden unter 4.2.2 wieder aufgenommen. 3.4 Auto-photoreduktions-induzierte FT-IR Differenz-Spektroskopie am Cyt bo3 Die PR-Differenzspektroskopie mittels caged electrons (FMN-EDTA Lösung) konnte erfolgreich an Cytochrom Oxidasen, wie z. B. der aa3 Oxidase von Rhodobacter sphaeroides und der bo3 -, sowie der bd Oxidase von E. coli durchgeführt werden [29; 81; 130; 131]. 75 Ergebnisse ____________________________________________________________________________________________________________________________________________________ Alle erhaltenen PR-Differenzspektren besitzen eine gemeinsame Grundproblematik. Die Reduktion der Cytochrom Oxidasen ist durch die lichtinduzierte Freisetzung von Elektronen (caged electrons) initiiert (1.5.2). Der sogenannte „opfernde“ Elektronendonor EDTA wird bei Lichtanregung und Reaktion des FMN irreversibel oxidiert. Hierbei entstehen unterhalb von ca. 1630 cm-1 Redoxbanden, die die Differenzsignale des Proteins überlagern (Abb. 3.4.1). Da in Abwesenheit des Proteins keine Reaktion mit F* stattfindet, entstehen keine EDTARedoxprodukte [81]. Somit können diese Redoxbanden nicht vom PR-Differenzspektrum der Cytochrom Oxidasen abgezogen werden. Eine Zuordnung von Redox-Differenzsignalen des Proteins ist bei dieser Messmethode im Bereich unterhalb von 1630 cm-1 daher nicht möglich. K. Bettinger konnte in ihrer Diplomarbeit [85] die Grundlagen für eine nicht invasive, APRMessmethode an Cytochrom Oxidasen entwickeln, die keinen Einsatz von caged compounds benötigt. Dabei konnte die als Nebenreaktion auftretende Kohlenmonoxidbildung von der APRReaktion der Oxidase separiert und unterdrückt werden. Die IR-Proben wiesen nach Belichtung mehr als 90% Gesamtreduktion auf. Die ersten erhaltenen APR-Differenzspektren zeigen nur noch die Redox-Differenzsignale des Proteins auf, die an dieser Reaktion beteiligt sind. In diesem Unterpunkt werden nun die Grundlagen und erste Anwendungen an Cyt bo3 Mutanten erarbeitet, die reproduzierbare APR-Differenzspektren liefern. Die erhaltenen Differenzspektren sind komplex zusammengesetzt. Daher müssen die Ergebnisse bereits zum Teil interpretiert werden, um verständlich zu bleiben. 3.4.1 Vorbedingungen zur Reproduzierbarkeit der auto-photoreduktions- induzierten FTIR Redox-Differenzspektren Zunächst werden die Bedingungen ermittelt, die reproduzierbare APR-Differenzspektren ermöglichen. Hierzu werden einerseits von den APR-Proben Einkanalspektren zur Qualitätskontrolle angefertigt und andererseits die erhaltenen, untereinander skalierten APR-Differenzspektren auf Signaldeckung verglichen. Als zusätzliches Qualitätskriterium werden die APR-Proben vor und nach erfolgter IR-Messung VIS-spektroskopisch untersucht. Hierbei wird ein Absolutspektrum vor Belichtung (oxidiert) und eines nach Belichtung (auto-photoreduziert) aufgezeichnet und auf Reduktionsvollständigkeit überprüft. Darüber hinaus wird ein CO-Rekombinationsspektrum angefertigt, um eine etwaige ungewünschte CO-Freisetzung zu dokumentieren. Vor Ausarbeitung der Qualitätskriterien wird zunächst die Grundproblematik verdeutlicht, dass nur ein sehr begrenzter Wellenzahlenbereich bei den PR-Differenzspektren auswertbar ist. In Abb. 3.4.1 ist die Entstehung der Differenzspektren in Abhängigkeit von der Belichtungsdauer (lichtinduzierte Differenzspektren-Entwicklung) der PR- und APR-Proben am Beispiel des pINWildtyps gezeigt. 76 Ergebnisse ____________________________________________________________________________________________________________________________________________________ Positive Extinktionsbanden entsprechen dem reduzierten, negative dem oxidierten Zustand der Oxidase. Im Graphen sind die Extinktions-Nullinien dargestellt. Beide Proben liegen nach erfolgter IR-Messung reduziert vor. Für die APR-Probe bei pH 8,0 ist dies exemplarisch in Abb. 3.4.4 aufgezeigt. Das jeweils zuletzt aufgenommene PR- bzw. APR-Differenzspektrum wird über die 1696/1691 cm-1 Bande auf 0,75 mOD skaliert. Die kürzer belichteten Spektren der lichtinduzierten Differenzspektren-Entwicklung werden entsprechend mit dem daraus ermittelten Umrechnungsfaktor multipliziert. Da bei der PR-Probe die doppelte Proteinmenge gegenüber der APR-Probe eingesetzt wird, ist bei dem PR-Differenzspektrum die Signalintensität gegenüber dem Rauschen entsprechend erhöht. Abb. 3.4.1: PR- und APR-Differenzspektren des pIN-Wildtyps bei pH 8,0. Oben: 75µg Oxidase wurden mit caged electrons vermischt und mit dem Licht einer Halogenlampe bei 4°C photoreduziert. Unten: 37 µg Oxidase wurden ohne caged compound mit dem Licht einer Xenon-Bogenlampe bei 4°C auto-photoreduziert. Bei der lichtinduzierten Differenzspektren-Entwicklung ist nur das zweite und ab dann jedes dritte Differenzspektrum der insgesamt 20 aufgezeichneten Spektren gezeigt. Die Skalierung zueinander erfolgt über die 1696/1691 cm-1 (0,75 mOD) Differenzbande. Auf die Beschriftung mit Wellenzahlen der dominierenden Extinktionsminima und –maxima wird hierbei verzichtet, wobei einige exemplarische Banden hervorgehoben wurden, die in beiden Spektrenverläufen gemeinsam vorhanden sind. Beide Spektren werden von Differenzsignalen im Bereich von ca. 1700-1520 cm-1 dominiert. Die größten gemessenen Differenzextinktionen der Originalspektren liegen für die PR-Proben um 4,5 mOD, für die APR-Proben um 2 mOD. Dies entspricht einer Vergrößerung der Differenzspektren um etwa das 250-500fache gegenüber den Absolutspektren (1.5.2, Abb. 1.5.2). Die größten Extinktionsdifferenzen werden im Bereich der Amid I Region (1680-1620 cm-1 ) und der Amid II Region (1560-1520 cm-1 ) gefunden. Diese Differenzen gehen auf konformative Änderungen des Cyt bo3 während des Redoxwechsels zurück [81]. Die Bande bei 1696/1691 cm-1 liegt in einem Bereich, in dem die Häm-Kofaktoren absorbieren können [132]. 77 Ergebnisse ____________________________________________________________________________________________________________________________________________________ Im Bereich unterhalb von ca. 1630 cm-1 weisen die verglichenen Spektren deutliche Unterschiede auf. Das PR-Differenzspektrum wird hierbei von den Photolysebanden des caged compounds stark beeinflusst. Trotzdem lassen beide Spektrenverläufe auch gemeinsame Banden erkennen (gepunktete Linien), d.h. beide Spektrenverläufe weisen auf ein ähnliches bzw. gleiches Reduktionsverhalten des Cyt bo3 hin. Da für die PR-Differenzspektren keine Vergleiche ohne caged compound vorliegen, ist eine Differenzierung zwischen Banden, die auf den Redoxwechsel des Proteins bzw. der FMN-EDTA-Lösung zurückgehen, nicht möglich. Um über einen möglichst großen Wellenzahlenbereich auswertbare Spektren zu erhalten, müssen verschiedene Parameter eingehalten werden. Einige dieser Parameter, wie z.B. der Wassergehalt der Probe wurden bereits unter 3.3.1 vorgestellt. Nun müssen Kriterien entwickelt werden, die möglichst große Redox-Differenzsignale des Proteins bei möglichst geringem Hintergrund-Rauschen ermöglichen. Hierbei sind zwei konträr zueinander verlaufende Aspekte zu beachten. Zum einen weist die Amid I Transmissionsbande in den Einkanalspektren die kleinsten Resttransmissionen im Bereich von 2000-1150 cm-1 auf und es besteht die Gefahr, dass im Amid I Bereich eine für IR-Strahlung nahezu undurchlässige Probe erhalten wird. Zum anderen sind die Differenzsignale außerhalb der Amid Regionen meist deutlich kleiner, so dass bei einer zu geringen Proteinkonzentration eine Auswertung der Differenzbanden durch den geringen Unterschied zum Hintergrund-Rauschen nicht möglich ist. Um die Qualität der zur IR-Messung eingesetzten APR-Proben zu überprüfen, werden u.a. Einkanalspektren erstellt. In Abb. 3.4.2 sind die Übersichtsspektren des pIN-Wildtyps in H2 Obzw. D2 O-haltiger Umgebung gezeigt. Abb. 3.4.2: FT-IR Einkanalspektren des pIN-Wildtyps bei pH 8.0 und pD 8.0. Bei der pH-Probe wurden 37 µg, bei der pD-Probe 50 µg Oxidase eingesetzt. Für die Übersichtsspektren wurden 100 Interferogramme mit 2 cm-1 Auflösung aufgenommen und gemittelt. Sie werden von 2000-800 cm-1 dargestellt. Zur leichteren Abschätzung der prozentualen Transmission der Banden wurden die Spektren bei ca. 1850 cm-1 auf 1,0 (100%) skaliert. Der grau unterlegte Bereich stellt Transmissionen dar, die kleiner als 10% sind. 78 Ergebnisse ____________________________________________________________________________________________________________________________________________________ Nach dem Lambert-Beer´schen Gesetz entspricht eine Transmission von 10% einer Extinktion von 1,0. Die Anwendung dieser mathematischen Beziehung ist jedoch auf Extinktionwerte beschränkt, die maximal eine Extinktion von 1,0 erreichen. Größere Extinktionswerte können also nur ungenügend mit dem Gesetz beschrieben werden und quantitative Auswertungen sind dann nicht mehr möglich. In der Abb. 3.4.2 zeigt der grau unterlegte Bereich Transmissionen die kleiner als 10% sind. Neben der Amid I Transmissionsbande werden ebenfalls kleinere Transmissionen unterhalb von ca. 1100 cm-1 gefunden, wobei ab ca. 950 cm-1 die CaF2 -Fenster der IR-Küvette ebenfalls IR-Strahlung absorbieren. Eine Auswertung der APR-Differenzspektren unterhalb von ca. 1100 cm-1 ist daher nicht möglich. Die vier Untereinheiten des Cyt bo3 bestehen aus rund 1250 Aminosäuren. Entsprechend hoch ist die Anzahl der Peptidbindungen. Zur Transmission der Amid I Bande tragen alle Peptidbindungen eines Proteins bei. Eine Amid I Resttransmission bei Cyt bo3 IR-Proben, die größer als 10% ist, ist bei einem solchen Multienzym-Komplex nicht sinnvoll, da hierbei das HintergrundRauschen die Differenzsignale außerhalb der Amid Regionen stark beeinflusst. Somit ist eine unabhängige Skalierung dieser Regionen nicht gewährleistet. Bei einer Resttransmission unterhalb von 10% sind nur qualitative Zuordnungen innerhalb der Amid I Region aus dem oben genannten Grund möglich. Auch bei dem Verzicht auf eine quantitative Auswertung der Amid I Bande kann die IR-Probe nicht beliebig hoch konzentriert werden. Bei Resttransmissionen unterhalb von ca. 1-2% treten mehr oder minder starke BasisLinienverschiebungen im Differenzspektrum flankierend zur Amid I Region (ca 1720-1560 cm-1 ) auf. Die Extinktionen können hierbei nach „oben“ oder „unten“ verschoben werden, ohne dass die beobachteten Extinktionsunterschiede auf einer Signal- oder Extinktionskoeffizienten- Änderung basieren (vergleiche Text zur Abb. 3.3.4). Dennoch ist es möglich einen Kompromiss zu finden, der auswertbare Differenzspektren über einen Großteil des Wellenzahlenbereichs von 2000-1150 (1100) cm-1 liefert, wenn die APR-Proben Resttransmissionen der Amid I Bande von 4-8% (Extinktion = 1,1-1,4) in den Übersichtsspektren aufweisen (Abb. 3.4.2). Ist dieses Kriterium erfüllt, dann können auch jenseits der Amid-Banden Differenzsignale mit einem relativ guten Signal/Rausch Verhältnis erzielt werden. In Abb. 3.4.3 sind die APR-Differenzspektren des pHCL- und pIN-Wildtyps, unter Angabe des Hintergrund-Rauschens verglichen. Bei den beiden dargestellten APR-Differenzspektren der Wildtypen handelt es sich um den Mittelwert der letzten fünf aufgezeichneten Spektren. Diese sind alle nahezu vollständig reduziert (Abb. 3.4.1). Die Spektren werden mit einer Auflösung von 2 cm-1 angefertigt. Es wird keine Datenglättung oder Datendekonvolution benötigt. Aufgrund der langen Messzeit zur Spektrenaufnahme (ca. zwei Stunden), kommt es jedoch zu einer annährend linearen Basislinienverschiebung. Diese muss im Anschluss korrigiert werden. Hierzu werden bei dem gemittel79 Ergebnisse ____________________________________________________________________________________________________________________________________________________ ten APR-Differenzspektrum Korrekturpunkte bei 2000 cm-1 , 1760 cm-1 und bei 1250 cm-1 gesetzt. Diese Korrektur liefert im Bereich der beiden Amid-Regionen bezüglich der Signalintensitäten häufig eine ungenügende Deckung der verglichenen Wildtypen und Mutanten. Daher wird auf eine detailliertere Darstellung und Erläuterung des Bereichs von ca. 1670-1500 cm-1 verzichtet. Hier sollen nur kurz die typischerweise gefundenen Extinktionsminima und -maxima wiedergegeben werden. Es sind Differenzbanden (Minimum/Maximum) bei 1668/1662 cm-1 , 1657/1553 cm-1 , 1648/1635 cm-1 , 1621/1613 cm-1 und 1572/1545 cm-1 vorhanden. Weiterhin ist ein Differenzsignal bei 1260/1243 cm-1 gekennzeichnet. Es liegt im Bereich der Amid III Region bzw. der δ(C mH) Beugeschwingung von Hämen (Tab. 1.5.1 und Tab. 1.5.2). Eine nahezu unveränderte Bandenlage kann im Vergleich zu den FT-IR-Daten ermittelt mit der elektrochemischen Zelle gefunden werden [90]. Abb. 3.4.3: APR-Differenzspektren der pHCL- bzw. pIN-Wildtypen bei pH 8,0, unter Angabe des HintergrundRauschens. Es wurden je 37 µg Oxidase eingesetzt, die in den Übersichtspektren eine Resttransmission der Amid IBande von 6,3% bzw. 6,5% aufwiesen. Zur Skalierung auf die 1696/1691 cm-1 Bande wurden die Originalspektren mit den Faktor 1,6 bzw. 1,75 multipliziert. Die grau unterlegten Vergrößerungen stellen die Wellenzahlbereiche von 1780-1690 cm-1 und 1500-1100 cm-1 dar. Die Differenzextinktionen sind dabei um das Eineinhalb- bzw. Zweieinhalbfache vergrößert worden. Wenn der Carbonyl-Bereich (1780-1665 cm-1 ) zweier Differenzspektren untereinander verglichen werden soll, wird eine zusätzliche Basislinienfeinkorrektur vorgenommen. Hierbei werden Korrekturpunkte bei 1800 cm-1 und 1760 cm-1 gewählt, um die Nulllinie der Differenzspektren festzulegen. In dieser Region sind keine absorbierenden Proteingruppen vorhanden. Der dritte Korrekturpunkt bei 1670 cm-1 wird dabei so in Ordinatenrichtung gesetzt, dass sich die Nulllinien und die Differenzbanden (Skalierungsbanden) bei 1696/1691 cm-1 mit den verglichenen Differenzspektren decken. 80 Ergebnisse ____________________________________________________________________________________________________________________________________________________ Das (thermische) Hintergrundrauschen des Detektors kann im Bereich von 1950-1760 cm-1 eingeschätzt werden, da hier keine Signale vom Protein erscheinen. Das Rauschen liegt um 2-4 * 10-5 Extinktionseinheiten. In der Amid I-Region sind die größten Rauschsignale erkennbar. Da die Redoxsignale des Proteins im Bereich unterhalb von 1500 cm-1 vom Rauschen beeinträchtigt werden könnten, wird im Folgenden der Mittelwert aus zwei unabhängig voneinander gemessenen APR-Differenzspektren gebildet und in dieser spektralen Region dargestellt. Abgesehen von der Amid I-Region sind nur geringe Unterschiede zwischen pHCL- und pINWildtyp in den Spektren erkennbar. Somit können auch Proteinmutanten, die auf pHCL basieren, mit dem pIN-Wildtyp verglichen werden. Dies ist ebenfalls in den hier nicht zusätzlich dargestellten D2 O-APR-Differenzspektren der Fall. 3.4.2 Spektrale Änderungen des Wildtyps in Abhängigkeit vom pH-Wert In diesem Unterpunkt werden die spektralen Änderungen bei den APR-Differenzspektren des pIN-Wildtyps in Abhängigkeit vom pH-Wert untersucht. Einerseits wird der pH-Bereich getestet, in dem die APR-Differenzspektroskopie zum Einsatz kommen kann und andererseits ist es im Hinblick auf eine weitere Datenauswertung notwendig, Banden einordnen zu können, die in Abhängigkeit vom pH- bzw. pD-Wert spektrale Änderungen aufweisen, wie z.B. die Bandenlage oder Intensitätsunterschiede. Hierzu werden Proteinproben erstellt, die einen pH- bzw. pDBereich von 4.0 bis 9.0 umfassen. Zur Darstellung werden jedoch nur die Messungen der Proben gezeigt, die einen pH- bzw. pD-Wert von 5,0 und 8,0 aufweisen. Bei pH 5,0 ist eine DurochinolOxidase-Restaktivität (2.8.6) von ca. 15% gegenüber dem pH-Optimum (um pH 7,5) festzustellen. Bei pH-Werten oberhalb von 8,5 ist keine Messung mit Durochinol möglich [133]. Abb. 3.4.4 zeigt exemplarisch die Absolutspektren vor und nach der Belichtung der APRProben für die pH-Werte 8,0 und 5,0. Über den gesamten pH- bzw. pD-Bereich kann ein hoher Reduktionsgrad des Cyt bo3 erreicht werden. Die CO-Freisetzung wird bei geeigneter Lichtintensität nahezu vollständig unterdrückt (eingefügter Graph in Abb. 3.4.4). Eine Denaturierung des Cyt bo3 ist in den VIS-Spektren nicht zu erkennen. In Abb. 3.4.5 sind die APR-Differenzspektren des pIN-Wildtyps bei pH 8.0 und pH 5.0, sowie die von pD 8.0 und pD 5.0 miteinander verglichen (pH- bzw. pD-APR-Differenzspektren). In den grau unterlegten Bereichen sind die Vergrößerungen der Carbonyl-Regionen von 1780-1665 cm-1 bzw. der Bereich unterhalb der Amid-Regionen von 1500-1150 cm-1 gezeigt. Es lässt sich eine große Anzahl an spektralen Veränderungen finden. Die schwarz gekennzeichneten Extinktionsmaxima bzw. -minima beziehen sich auf das pIN-Wildtyp Differenzspektrum bei pH 8,0 bzw. pD 8,0. Ist demgegenüber eine Änderung eines Signals vorhanden, dann wird sie in der jeweiligen Farbe des Spektrums auf das sie bezogen ist, angegeben. Hierbei ist anzumerken, 81 Ergebnisse ____________________________________________________________________________________________________________________________________________________ dass bei deuterierten Proben die Basislinienschwankungen im Bereich von 1500-1100 cm-1 unterschiedlich ausfallen können. Bei 1460 cm-1 absorbiert die breite Scherwingung γ(HOD) bei unvollständigem H/D-Austausch und bei 1215 cm-1 die Scherschwingung γ(D2 O) des Deuteriumoxids. Außerdem kann der H/D-Austausch die Verschiebung der Amid II C-N- und N-HSchwingungen verursachen. Sie kommen ungekoppelt bei 1490-1460 cm-1 für die C-NStreckschwingungen und unterhalb von 1100 cm-1 für die N-D-Beugeschwingungen zu liegen. Somit steht dieser Bereich nur begrenzt zur Auswertung zur Verfügung. Abb. 3.4.4: Absolutspektren vor (oxidiert) und nach (auto-photoreduziert) der IR-Messung des pIN-Wildtyps in Abhängigkeit vom pH-Wert. Der eingefügte Graph zeigt die CO-Rekombinationsspektren 2 Millisekunden nach Applikation des Lichtblitzes. Als Referenz sind die Natriumdithionit-reduzierten, COFR-Rekombinationsspektren (gepunktete Linie; vergleiche 3.2.3) den auto-photoreduzierten Spektren bei pH 5,0 (gestrichelte Linie) und pH 8,0 (durchgezogene Linie) gegenüber gestellt. Die Spektren sind im Wellenlängenbereich von 400-650 nm gezeigt. Der vergrößerte Wellenzahlenbereich von 1500-1150 cm-1 in Abb. 3.4.5 zeigt eine Region, in der Signale von allen am Redoxwechsel des Cyt bo3 beteiligten Aminosäuren und Kofaktoren erwartet werden. Dieser Bereich setzt sich daher aus komplex überlagerten Differenzsignalen des Gesamtproteins zusammen. Veränderungen in diesem Bereich können daher vorerst nur ohne weiterführende Interpretation beschrieben werden. Eine Signalzuordnung von veränderten Banden zu funktionellen Gruppen des Cyt bo3 wird erst im anschließenden Diskussionsteil (4.3.3) vorgenommen. Daher werden nur an einigen exemplarisch gekennzeichneten Banden die Signaländerungen vorgestellt. Das Extinktionsmaximum bei 1297 cm-1 verschiebt in Abhängigkeit vom pH-Wert um 13 cm-1 auf 1310 cm-1 und zeigt keine zusätzliche Verschiebung beim H/D-Austausch. Die Intensität der Differenzbande bei 1260/1243 cm-1 nimmt mit sinkendem pH- bzw. pD-Wert zu und verändert dabei in den H2 O-Differenzspektren ihre Lage nicht. Ein Extinktionsmaximum bei 1198 cm-1 findet sich bei den pH-APR-Differenzspektren. In den entsprechenden pD-Spektren ist es nicht mehr vorhanden und kann als verschobenes Einzelsignal in den angrenzenden Spektralbereichen nicht wiedergefunden werden. 82 Ergebnisse ____________________________________________________________________________________________________________________________________________________ Abb. 3.4.5: APR-Differenzspektren des pIN-Wildtyps bei pH 8,0 und pH 5,0 (oben, schwarze und blaue Spektren) bzw. pD 8,0 und pD 5,0 (unten, rote und grüne Spektren). Es wurden je 37 µg Oxidase bei den pH-Proben und 50 µg Oxidase bei den pD-Proben eingesetzt, deren Resttransmissionen der Amid I-Banden zwischen 4,0% und 6,5% lagen. Die grau unterlegten Vergrößerungen stellen die Wellenzahlbereiche von 1780-1665 cm-1 und 1500-1150 cm-1 dar. Der vergrößerte, grau unterlegte Carbonyl-Bereich (1780-1665 cm-1 ) in Abb. 3.4.5 umfasst die Regionen, in denen die Carbonylgruppen von den Seitenketten der Aminosäuren Asp und Glu (1790-1710 cm-1 ) und die der Häme (1700-1665 cm-1 ) absorbieren können [89; 132]. Bereiche unterhalb von ca. 1680 cm-1 liegen bereits im Einflussbereich der Amid I Region. Daher sind die Differenzsignale dieses Bereichs überlagert. In unabhängig voneinander gemessenen APRDifferenzspektren eines Proteins können folglich kleine Extinktionsschwankungen auftreten. Die Redox-Differenzbanden des protonierten Glu-286 (1745/1735 cm-1 ) und des deuterierten Glu-286 (1737/1727 cm-1 ) sind über den gesamten untersuchten pH- bzw. pD-Bereich praktisch unverändert vorhanden. Dies gilt auch für das Signal bei 1696/1691 cm-1 und es kann wiederum zur Skalierung der Spektren herangezogen werden. In der bereits bei Abb. 3.3.3 erwähnten breiten, positiven Extinktionsbande im Bereich von ca. 1730-1704 cm-1 treten deutliche Signaländerungen auf. Zum einen verschiebt bei sinkendem pH-Wert das Extinktionsmaximum von 1722 cm-1 (pH 8,0) auf 1727 cm-1 (pH 5,0). Zum anderen finden sich diese beiden Maxima nach H/DAustausch bei 1714 cm-1 (pD 8,0) bzw. 1718 cm-1 (pD 5,0) wieder. Es handelt sich folglich um mindestens ein weiteres Cyt bo3 -Carbonylsignal. 83 Ergebnisse ____________________________________________________________________________________________________________________________________________________ In Abb. 3.4.6 ist nochmals die Carbonylregion der oben gezeigten APR-Differenzspektren des pIN-Wildtyps dargestellt. Im Unterschied zu Abb. 3.4.5 sind hierbei jedoch die Spektren von pH 8,0 und pD 8,0 bzw. pH 5.0 und pD 5,0 verglichen (Abb. 3.4.6, oben). Es kann keine Basislinienfeinkorrektur vorgenommen werden, da die H2 O Extinktionssignale der Amid I Region bei den D2 O-Spektren fehlen (3.3.2) und sich Extinktionskoeffizienten-Änderungen in Abhängigkeit vom Lösungsmittel ergeben können. Zusätzlich sind die Doppeldifferenzen von pH 8,0 minus pD 8,0 bzw. pH 5,0 minus pD 5,0 gezeigt (Abb. 3.4.6, unten). Positive Banden entsprechen hierbei den wässrigen Proben (schwarze Flächen = pH 8,0; blaue Flächen = pH 5,0), negative Banden den D2 O-haltigen Proben (rote Flächen = pD 8,0; grüne Flächen = pD 5,0). Abb. 3.4.6: Carbonylbereich der APR-Differenz- und Doppeldifferenzspektren des pIN-Wildtyps bei unterschiedlichen pH und pD-Werten. Oben: pH 8,0- (schwarz) und pH D 8,0-(rot) bzw. pH 5,0- (blau) und pD 5,0- (grün) Differenzspektren. Unten: Die resultierenden Doppeldifferenspektren von den pH 8,0- minus pD 8,0- bzw. pH 5,0minus pD 5,0-Spektren. Diese sind nur bis 1670 cm-1 dargestellt. Die bereits bei Abb. 3.4.5 angesprochenen Änderungen im Bereich von 1730-1704 cm-1 sind hier wiederzufinden. Das Maximum der positiven Extinktionsbande bei 1722 cm-1 (pH 8,0) verschiebt beim H/D-Austausch nach 1714 cm-1 (pD 8,0). In der entsprechenden Doppeldifferenz sind beide Signale vorhanden. Das Maximum der positiven Extinktionsbande bei 1727 cm-1 (pH 5,0) verschiebt beim H/D-Austausch nach 1718 cm-1 (pD 5,0). In der entsprechenden Doppeldifferenz findet sich nur das Signal bei 1718 cm-1 wieder, da das Extinkzionsmaximum der Bande bei 1727 cm-1 mit dem Maximum des deuterierten Carbonylsignals des Glu-286 zusammenfällt. Im Bereich unterhalb von ca. 1690 cm-1 finden sich weitere spektrale Änderungen in Abhängigkeit vom H/D-Austausch. Es sei nochmals darauf hingewiesen, dass Banden im Bereich unterhalb von ca. 1680 cm-1 von Extinktionssignalen der Amid I Region beeinflusst werden können. Daher treten mehr oder minder kleine Änderungen bezüglich der Lage der Extinktionsmaxima bzw. -minima und der Signalintensitäten auf, wie z.B. das verschobene Maximum bei 84 Ergebnisse ____________________________________________________________________________________________________________________________________________________ 1673 cm-1 (pD 8,0)3 . Eine quantitative Differenzierung zwischen Signalen der Amid I Region und der möglichen Häm-Banden kann nicht durchgeführt werden. Dennoch sind die hier aufgezeigten Extinktionsänderungen qualitativ reproduzierbar. Die positive Bande bei 1685 cm-1 zeigt bei den pH-Differenzspektren ein Maximum, dessen Intensität deutlich höher ist als bei der positiven Bande bei 1691 cm-1 . Demgegenüber weist das Maximum der Bande bei 1675 cm-1 eine relativ geringe Intensität auf. Bei den pD-Spektren ist die positive Bande um 1685 cm-1 deutlich schwächer ausgeprägt, aber ebenfalls vorhanden. Das Maximum der pD-Spektren bei 1685 cm-1 ist deutlich niedriger als bei der positiven Bande bei 1691 cm-1 . Demgegenüber ist das Maximum der Bande um 1675 cm-1 deutlich und intensiver ausgeprägt. Der Abstand dieser beiden Maxima beträgt 10 cm-1 , d.h. es kann sich um ein oder mehrere Carbonylsignale von Hämen handeln, die bei Isotopenaustausch von 2 1 HOOC nach HOOC zu kürzeren Wellenzahlen verschieben. In den Doppeldifferenzspektren ist entspre- chend eine positive Bande um 1685 cm-1 vorhanden. Die negative Bande um 1673 cm-1 tritt im pH 5,0 minus pD 5,0-Doppeldifferenzspektrum deutlich hervor. Da bei den pD-Spektren ein Maximum bei 1685 cm-1 bestehen bleibt, kann es sich um ein Carbonylsignal einer Einzelgruppe handeln, die nicht komplett beim H/D-Austausch deuteriert wird oder es liegt ein Signal einer zweiten, unterlagerten Carbonylschwingung vor, deren Carboxylgruppe dem H/D-Austausch vermutlich nicht zugänglich ist und nun hervortritt. Darüber hinaus kann es ein zweites Differenzsignal einer atomaren Gruppe sein, die nicht protoniert vorliegt und entsprechend vom Lösungsmittel unbeeinflusst bleibt. Allen Spektren gemeinsam sind Minima um 1678 cm-1 . Da bei dem hier vorgenommenen Vergleich von pH- und pD-Spektren keine Basislinienfeinkorrektur vorgenommen werden kann, ist eine Beurteilung, ob sich die Minima ebenfalls nach H/D-Austausch in ihren Signalintensitäten verändern nicht eindeutig. Das Differenzspektrum bei pD 8,0 weist gegenüber dem pH 8,0Spektrum über den Bereich von ca. 1690-1675 cm-1 eine negativere Extinktion auf. Dies bedeutet, dass es sich um ein Differenzsignal einer Carbonylgruppe mit einem positiven Maximum bei 1685 cm-1 und einem Minimum bei 1678 cm-1 handeln kann. Das Minimum müsste demzufolge bei H/D-Austausch nach ca. 1668 cm-1 verschieben. Es liegt demnach in der stark negativen Bande um 1668 cm-1 und kann hier nicht als Einzelsignal identifiziert werden. Als Resultat lässt sich festhalten: Über den gesamten untersuchten pH- bzw. pD-Bereich (pH bzw. pD 4,0-9,0) können APR-Differenzspektren mit einem hohen (> 90%) Reduktionsgrad erhalten werden. Der gesamte betrachtete Wellenzahlenbereich weist dabei eine Vielzahl an spektralen Veränderungen auf. Im Bereich von 1780-1665 cm-1 kann mindestens ein noch nicht 3 Mit Ausnahme des pD 8,0 APR-Differenzspektrums weisen alle anderen pD-Spektren (pD 4,0-9,0) ein Maximum um 1675 cm-1 auf. Daher wird im Folgenden nur noch von der Bande bei 1675 cm-1 geschrieben. 85 Ergebnisse ____________________________________________________________________________________________________________________________________________________ detailliert beschriebenes Carbonylsignal mit einem Maximum bei 1722 cm-1 (pH 8,0) gefunden werden, das im entsprechenden D2 O-Spektrum um 8 cm-1 nach 1714 cm-1 verschiebt. Mit sinkendem pH-Wert findet eine Verschiebung des Maximums zu größeren Wellenzahlen um bis zu 5 cm-1 statt. Weitere Änderungen finden sich im Bereich von 1688-1675 cm-1 . Das Extinktionsmaximum bei 1685 cm-1 verliert deutlich an Intensität bei H/D-Austausch. Das Maximum bei 1675 cm-1 nimmt bei den pD-Spektren in Korrelation dazu an Intensität gegenüber den pHSpektren zu. Jedoch bleibt ein Maximum bei 1685 cm-1 auch in den pD-Spektren erhalten. Die D2 O-abhängige Verschiebung beträgt 10 cm-1 und weist somit einen typischerweise für Carbonylsignale gefundenen Wert auf. Ob es sich hierbei um ein oder mehrere Carbonylsignale von Hämen handelt, soll im Folgenden untersucht werden. 3.4.3 Carbonylschwingungen der Hämpropionate In diesem Unterpunkt wird die 13 C-Isotopenmarkierung der C1 -Atome der Hämpropionate4 vor- genommen, um ihre Carbonylschwingungen in den APR-Differenzspektren nachzuweisen (Abb. 1.2.4). Diese Spektren werden mit den APR-Differenzspektren der Häm O defizienten Cyt bo3 Mutante ∆cyoE verglichen, um diese Schwingungen dem low- bzw. high-spin Häm zuzuordnen. Eine spezifische 13 C-Isotopenmarkierung der C1 -Atome der Hämpropionate der Cyt c Oxidase (Cyt aa3 ) aus P. denitrificans wurde bereits erfolgreich durchgeführt und mittels elektrochemisch induzierter Redoxdifferenz FT-IR-Spektroskopie untersucht [89; 132; 134]. An dem Cyt bo3 von E. coli sind diese Experimente bisher nicht durchgeführt worden. Die Grundvoraussetzung für eine solche spezifische Isotopenmarkierung ist ein E. coli Stamm, der bezüglich der δAminolävulinat-Synthese defizient ist (Abb. 1.2.5). Somit können ohne den Zusatz von ALV bzw. spezifisch markiertem [1- 13 C]-ALV keine Häme produziert werden. Die Wahl fiel dabei auf den E. coli Stamm S730, der zusätzlich in den Aminosäure-Biosynthesewegen von Trp, His und Tyr defekt ist (Tab. 2.1.1). Somit besteht die Möglichkeit, dass neben 13 C-markierten Hämpropionaten auch isotopenmarkierte Tyrosine in Cyt bo3 eingebaut werden können. In Vorexperimenten zur Wahl des Fermentationsmediums stellt sich heraus, dass dieser Stamm trotz Ausgleich der Auxotrophien in Minimalmedien maximal eine OD578 von ca. eins erreicht, also nur rund ein 1/5 der Zelldichte des sonst eingesetzten Cyt bo3 -Expressionsstamms BL21 ∆cyo recA-. Darüber hinaus weist dieser Stamm Plasmidinstabilität auf. Bei der Fermentation von S730 pIN in LB-Medium mit ALV kann die Zelldichte auf eine OD578 von ca. 1,8 gesteigert werden. Es werden nach Zellwachstum und Zellaufbruch Cy4 Der Begriff Hämpropionat wird in dieser Arbeit stellvertretend sowohl für die protonierte Carboxyl-Form als auch für die deprotonierte Carboxylat-Form der Hämpropionate verwendet. Nur wenn eine Unterscheidung notwendig ist, wird auch der Bergriff Hämpropionsäure benutzt. 86 Ergebnisse ____________________________________________________________________________________________________________________________________________________ toplasmamembranen erhalten, die einen deutlichen Anteil an Cytochromen aufweisen (Abb. 3.4.7 links). Im Kontrollexperiment ohne den Zusatz an ALV weisen die Zellmembranen nur rund 11% des Cytochrom Gehalts gegenüber den Zellmembranen mit ALV auf. Abb. 3.4.7: Redox-Differenzspektren von S730 pIN Cytoplasmamembranen mit und ohne Aminolävulinat-(ALV) Zusatz (links) und der gereinigte pIN-13 C-Wildtyp (rechts). Linke Darstellung: Die Bakterien wurden in LBMedium fermentiert und nach Zellwachstum wurde die OD bei 578 nm bestimmt. Von diesem Wert ausgehend wurden entsprechende Volumina entnommen und die Zellen sedimentiert, d.h. zur Präparation der Cytoplasmamembranen wurden dieselbe Zellmasse eingesetzt. Die Spektren sind im Bereich von 400-700 nm dargestellt. Rechte Darstellung: Der gereinigte pIN-13 C-Wildtyp exprimiert in S730 weist dieselben Extinktionsmaxima und – minima wie der gereinigte pIN-Wildtyp exprimiert in BL21 ∆cyo recA - auf (Abb. 3.2.2). Das Spektrum ist im Bereich von 400-650 nm dargestellt. Die Proteinausbeuten von Cyt bo3 sinken jedoch auch bei der Fermentation in LB-Medium mit ALV drastisch. Es können nur rund 10% gereinigtes Protein gegenüber der Überexpression in BL21 ∆cyo recA- erzielt werden. Diese geringe Proteinmenge birgt Schwierigkeiten in der Konzentrierung des Proteins, da während der Anreicherung in Ultrakonzentratoren neben dem Protein ebenfalls das Detergenz angereichert wird (die Micellen des Detergenz werden von der Cellulosemembran zum Teil zurückgehalten). Die Gefahr, dass es aufgrund der hohen Detergenzkonzentration dabei zu reversiblen Teildenaturierungen des Cyt bo3 kommen kann, ist groß. Das gereinigte, an den C1 -Atomen der Hämpropionate 13 C- isotopenmarkierte pIN-Wildtyp- protein, exprimiert in S730 weist in den oxidierten und reduzierten Absolutspektren (Daten nicht gezeigt), sowie im Redox-Differenzspektrum keine Unterschiede zum pIN-Wildtyp, exprimiert in BL21 ∆cyo recA- auf (Abb. 3.4.7 rechts). Im in vitro Aktivitätstest zeigt der isotopenmarkierte pIN-Wildtyp gegenüber der unmarkierten Referenz 88% Durochinol-Oxidase-Aktivität. Somit sind bei diesen Untersuchungen keine gravierenden Unterschiede beim 12 COOH/13 COOH- Isotopenaustausch (12 C/13 C-Austausch) der C1 -Atome der Hämpropionate festzustellen. Bedingt durch die niedrigen Proteinausbeuten des isotopenmarkierten pIN-Wildtyps können lediglich APR-Differenzspektren bei pH 8,0 bzw. pD 8,0 erstellt werden. Aufgrund der hohen Detergenzanreicherung weisen die APR-Differenzspektren innerhalb und unterhalb der AmidRegionen zum Teil mehr oder minder große Abweichungen zueinander auf. Daher kann in die87 Ergebnisse ____________________________________________________________________________________________________________________________________________________ sem Bereich nur die grundsätzliche Tendenz der spektralen Änderungen beschrieben werden. Ein Vergleich der Extinktionsintensitäten ist häufig nicht möglich. Der Carbonylbereich scheint hiervon nicht betroffen zu sein, da alle markanten nicht auf die Hämpropionsäuren zurückzuführenden Banden bezüglich der Intensität und der Position erhalten bleiben. In Abb. 3.4.8 sind die APR-Differenzspektren des unmarkierten (exprimiert in BL21 ∆cyo recA-) und des isotopenmarkierten (exprimiert in S730) pIN-Wildtyps gezeigt. Der unmarkierte pIN-Wildtyp, exprimiert in S730, zeigt wie der isotopenmarkierte eine unbefriedigende Spektrenqualität (Detergenzeinfluss) im Wellenzahlenbereich innerhalb und unterhalb der AmidRegionen. Auf die Darstellung dieser Spektren wird daher verzichtet. Im -1 13 C-pIN-Wildtyp- -1 spektrum weisen die Amid I- (1680-1620 cm ), die Amid II- (1560-1520 cm ) und die Amid III- (1330-1230 cm-1 ) Regionen zum Teil deutlich verschobene Bandenpositionen zum Referenzspektrum auf. Zur Orientierung sind einige Maxima bzw. Minima exemplarisch gekennzeichnet. Die hohe Detergenzkonzentration wirkt sich folglich leicht auf die Proteinstruktur aus. Diese Detergenzeinwirkung ist jedoch nach Proteinverdünnung reversibel (VIS-Spektren, Durochinolaktivität). Da jedoch eine große Anzahl an Banden bezüglich ihrer Position unverändert bleiben, kann das erhaltene Spektrum zum Teil ausgewertet werden. Abb. 3.4.8: APR-Differenzspektren des pIN-Wildtyps (schwarz), exprimiert in BL21 ∆cyo recA - und des isotopenmarkierten pIN-Wildtyps (rot), exprimiert in S730. Es wurden je 37 µg Oxidase eingesetzt, die in den Übersichtspektren eine Resttransmission der Amid I-Bande von 6,3% bzw. 4,8% aufwiesen. Die grau unterlegten Ve rgrößerungen stellen die Wellenzahlbereiche von 1780-1665 cm-1 und 1500-1200 cm-1 dar. Zusätzlich sind im Bereich von 1500-1200 cm-1 die APR-Differenzspektren nach H/D-Austausch gezeigt (ganz oben). In dem vergrößerten, grau unterlegten Wellenzahlenbereich von 1500-1300 cm-1 (Abb. 3.4.8) sind zusätzlich zu den pH-8,0-Differenzspektren die pD-8,0-Spektren des isotopenmarkierten Wildtyps mit dem entsprechenden Referenzspektren aufgeführt. Einige veränderte Banden sind 88 Ergebnisse ____________________________________________________________________________________________________________________________________________________ exemplarisch gekennzeichnet, die erst im entsprechenden Diskussionsteil interpretiert werden (4.3.3). Typischerweise werden Carboxylatschwingungen von Hämpropionaten im Bereich von 1620-1540 cm-1 für die unsymmetrischen ν as(COO-) Streckschwingungen und von 1420-1300 cm-1 für die symmetrischen ν s(COO-) Streckschwingungen gefunden [89]. Über den Bereich der ν as(COO-) Streckschwingungen können hier keine Aussagen gemacht werden (3.4.1). Für die symmetrischen ν s(COO-) Streckschwingungen wird aus den berechneten reduzierten Massen eine Verschiebung zu kürzeren Wellezahlen von ca. 35 cm-1 bei Isotopenaustausch von zu 13 12 COO- COO- erwartet [135]. Nach H/D-Austausch wird eine Verschiebung um maximal 2 cm-1 zu größeren Wellenzahlen erwartet. Beim Referenzspektrum sind zwei positive Banden mit Maxima um 1467 cm-1 und 1367 cm-1 gekennzeichnet, die nach H/D-Austausch nahezu nicht verschieben. In den entsprechenden isotopenmarkierten Wildtyp-Differenzspektren fehlen diese Signale, sowohl im pH- als auch im pD-Spektrum. Intensivere Extinktionsbanden finden sich jedoch bei 1443 cm-1 und 1336 cm-1 . Es kann demnach eine Verschiebung zu kleineren Wellenzahlen um 24 cm-1 bzw. 31 cm-1 stattgefunden haben. Wenn es sich bei der Bande bei 1467 cm-1 um Signale der symmetrischen ν s(COO-) Streckschwingungen von Hämpropionaten handelt, dann liegt sie etwas außerhalb des charakteristischerweise für diesen Schwingungstyp gefundenen Spektralbereich. Negative Banden, die gegenüber dem Referenzspektrum verschieben, lassen sich bei dieser Spektrenqualität nicht eindeutig zuordnen. In der Vergrößerung der Carbonylregion von Abb. 3.4.8 sind Veränderungen nach 12 C/13 C- Austausch feststellbar. Das breite positive ν(12 C=O) Signal um 1730-1704 cm-1 mit einem Maximum bei 1722 cm-1 ist nach Isotopenaustausch (ν(13 C=O)) nicht mehr erkennbar. Das Maximum bei 1685 cm-1 verliert an Intensität und das Minimum bei 1678 cm-1 tritt stärker im Spektrum des isotopenmarkierten Wildtyps hervor, bei nahezu gleichbleibender Intensität des Maximums um 1675 cm-1 . Danach kann es sich um Carbonylsignale von Hämpropionaten handeln. Für die Carbonylregion wird bei der Berechnung der reduzierten Massen mit einer Verschiebung zu kleineren Wellenzahlen von ca. 38 cm-1 bei Austausch von 12 COOH nach 13 COOH ge- rechnet [89]. Somit würde das Maximum bei 1722 cm-1 nach 1684 cm-1 verschieben. Die Differenzbande bei 1685-1678 cm-1 würde entsprechend nach 1647-1640 cm-1 , also unmittelbar in die Amid I Region verschieben und kann hier nicht mehr identifiziert werden. Die Carbonylsignale bei 1730-1704 cm-1 und 1690-1675 cm-1 sollen nun näher untersucht werden. In Abb. 3.4.9 sind die pH 8,0- und pD 8,0-APR-Differenzspektren im Carbonylbereich der verglichenen pIN-Wildtypen gezeigt (oben). Zusätzlich sind die Doppeldifferenzen des pINWildtyps (pH 8,0) minus des isotopenmarkierten pIN-Wildtyp (pH 8,0) und die entsprechenden 89 Ergebnisse ____________________________________________________________________________________________________________________________________________________ pD-Spektren dargestellt (Abb. 3.4.9, unten). Es ist deutlich ist zu erkennen, dass in dem isotopenmarkierten pH 8,0-Wildtypspektrum Extinktionsbanden im Bereich von ca. 1730-1704 cm-1 und von ca. 1690-1675 cm-1 fehlen. Unter Einbeziehung der Verschiebung durch den H/DAustausch lässt sich Entsprechendes ebenfalls für die Spektren deuterierten Wildtyp feststellen. Die Doppeldifferenzen werden von positiven Banden dominiert, d.h. dem isotopenmarkierten pIN-Wildtyp fehlen Extinktionsbanden gegenüber dem unmarkierten. Ein Teil der Signale um 1730-1704 cm-1 und 1690-1675 cm-1 gehen folglich auf Carbonylschwingungen von Hämpropionsäuren zurück. Abb. 3.4.9: Carbonylbereich der APR-Differenz- und Doppeldifferenzspektren des pIN-Wildtyps (schwarz und blau) und des isotopenmarkierten pIN-Wildtyps (rot und grün) bei pH 8,0 und pD 8,0 (oben). Unten: Die resultierenden Doppeldifferenspektren vom pIN-Wildtyp pH 8,0- minus dem isotopenmarkierten pIN-Wildtyp pH 8,0bzw. den entsprechenden PD 8,0-Spektren. Sie sind nur bis 1670 cm-1 dargestellt. Unter der Annahme, dass das Maximum der H2 O-Spektren bei 1722 cm-1 nach 12 C/13 C- Austausch um 38 cm-1 zu 1684 cm-1 und die Differenzbande bei 1685/1678 cm-1 in die Amid IRegion verschiebt, müsste das Maximum bei 1685 cm-1 einerseits an Intensität zunehmen (1722 cm-1 nach 1684 cm-1 ) und andererseits an Intensität verlieren (1685 cm-1 nach 1647 cm-1 ). Das Minimum bei 1678 cm-1 sollte jedoch nur an Intensität verlieren. Im Spektrum drückt sich dies dann durch einen asymmetrischen (nicht parallelen) Verlauf zwischen 1685 cm-1 und 1678 cm-1 aus. Dies ist der Fall. Nach erfolgtem H/D- und 12 C/13 C-Austausch sollte das Maximum bei 1722 cm-1 nach 1676 cm-1 verschieben (8 cm-1 vom H/D- plus 38 cm-1 vom 12 C/13 C-Austausch). Die Bande bei 1685/1678 cm-1 sollte entsprechend in die Amid I Region nach 1637-1630 cm-1 (10 cm-1 vom H/D- plus 38 cm-1 vom 12 C/13 C-Austausch) verschieben. Das letztgenannte Signal lässt sich in der Amid I Region nicht wiederfinden. Für das entstehende Spektrum bedeutet dies, dass das Signal bei 1675 cm-1 an Intensität zunimmt, der sonstige Verlauf des isotopenmarkierten Diffe90 Ergebnisse ____________________________________________________________________________________________________________________________________________________ renzspektrums sich jedoch mit dem unmarkierten pD-Spektrum im Bereich von ca. 1690-1675 cm-1 decken sollte. Die Intensitätszunahme ist erkennbar, jedoch nicht die Spektrendeckung. Das bereits bei Abb. 3.4.6 beschriebene Maximum bei 1685 cm-1 , das in den pD-Spektren erniedrigt, aber vorhanden ist, ist nach H/D- und 12 C/13 C-Austausch nicht mehr zu finden. Es lässt sich höchstens eine leichte Schulter um 1685 cm-1 erkennen. Die weitergehende Interpretation dieser Daten wird unter 4.3.3 wieder aufgenommen. Es wird nun versucht, die neu beschriebenen Carbonylsignale den beiden im Cyt bo3 vorhanden Hämen zuzuordnen. Da bei dem Isotopenaustausch alle vier vorhandenen Propionate der beiden Häme am C1 -Atom markiert sind, kann bei den erhaltenen Hämcarbonylsignalen keine Differenzierung zwischen low-spin und high-spin Häm getroffen werden. Die ∆cyoE-Mutante weist anstelle des Häm O ein Häm B in der high-spin Hämbindetasche auf. Es liegt ein in seinen VISspektroskopischen und kinetischen Eigenschaften stark verändertes binukleares Zentrum vor (Abb. 3.1.6; Abb. 3.2.1; Abb. 3.2.2; Tab. 3.2.5). Unter der Annahme, dass nur das falsch eingebaute high-spin Häm B in den VIS-Spektren zur beobachteten Minima- bzw. MaximaVerschiebung beiträgt, wird dies als grundsätzliche Überlegung nun auf die IR-Spektroskopie übertragen. Ändert sich die Lage des Maximums bzw. des Minimums der betrachteten Bande nicht, so wird sie dem low-spin Häm zugeschrieben (eine Intensitätsveränderung darf eintreten). Bei Verschiebung wird sie dem high-spin Häm zugeordnet. In Abb. 3.4.10 ist das pIN-Wildtyp APR-Differenzspektrum mit dem ∆cyoE-Mutanten Spektrum bei pH 8,0 verglichen. Im Unterschied zum isotopenmarkierten Wildtyp lassen sich die erhaltenen Differenzsignale auch innerhalb und unterhalb der Amid Regionen im hohen Maße reproduzieren. Dennoch sind die spektralen Änderungen in diesen Regionen sehr vielfältig. Da bei der Expression dieser Mutante in BL21 ∆cyo recA- kein Häm O synthetisiert werden kann, wird ein Häm B in der high-spin Häm-Bindetasche eingebaut, das zur physiologischen Inaktivierung der Oxidase führt [100]. Dem Häm B fehlt der Hydroxyethylfarnesylrest (Abb. 1.2.4 und Abb. 1.2.5). Dieser ist im Cyt bo3 durch zumeist hydrophobe Aminosäuren in die Proteinstruktur eingebettet. Da die ∆cyoE-Mutante keine Durochinol-Oxidase-Aktivität aufweist (Tab. 3.2.6), kann daraus nicht beurteilt werden, inwieweit sich das Fehlen des Hydroxyethylfarnesylrestes auf die Cyt bo3 -Struktur auswirkt. Auswirkungen, nicht nur auf Differenzsignale der highspin Hämcarboxylate im Bereich von 1500-1100 cm-1 sind daher möglich. Eine Bandenzuordnung hinsichtlich der Signalintensitäten kann auch in diesem Falle nicht vorgenommen werden. Somit können Veränderungen im Bereich von 1500-1150 cm-1 nur abgeschätzt werden. Im vergrößerten, grau unterlegten Wellenzahlenbereich von 1500-1150 cm-1 (Abb. 3.4.10) sind neben den verglichenen pH 8,0-Differenzspektren auch die pD 8,0-Differenzspektren ge91 Ergebnisse ____________________________________________________________________________________________________________________________________________________ zeigt (ganz oben). Es sollen die symmetrischen ν s(COO-) Streckschwingungen betrachtet werden, die sich typischerweise im Bereich von 1420-1300 cm-1 befinden. Bei dem pH-APRDifferenzspektrum der ∆cyoE-Mutante lässt sich gegenüber dem pIN-Wildtypspektrum eine deutliche Extinktionszunahme der positiven Bande um 1467 cm-1 feststellen. Im pD-Spektrum ist dies ebenfalls vorhanden, jedoch liegt das Maximum etwas zu kleineren Wellenzahlen verschoben vor. Um 1410 cm-1 tritt in den Mutantenspektren eine negative Bande auf, die keine Verschiebung bei H/D-Austausch zeigt. Weiterhin erscheint eine bei den Wildtypspektren nicht vorhandene Differenzbande mit einem Minimum bei 1325 cm-1 und einem Maximum bei 1317 cm-1 . Demgegenüber fehlen den Mutantenspektren positive Banden bei 1356 cm-1 . Entsprechende negative Banden sind nicht erkennbar. Als letzte hervorgehobene Änderungen werden hier die negativen Banden bei 1262 cm-1 aufgegriffen. Diese Banden weisen gegenüber den Referenzspektren deutlich negativere Extinktionen mit Minima um 1262 cm-1 auf. Die kleinen, positiven Schultern bei 1253 cm-1 sind ebenfalls vorhanden. Die positiven Banden bei 1243 cm-1 zeigen keine Verschiebung der Maxima. Die Signalintensitäten ändern sich ebenfalls nicht. Diese Differenzsignale befinden sich in der Amid III Region. Abb. 3.4.10: APR-Differenzspektren des pIN-Wildtyps (schwarz) und der ∆cyoE (pHCL)-Mutante (rot). Es wurden je 37 µg Oxidase eingesetzt, die in den Übersichtspektren eine Resttransmission der Amid I-Bande von 6,3% bzw. 3,8% aufwiesen. Die grau unterlegten Vergrößerungen stellen die Wellenzahlbereiche von 1780-1665 cm-1 und 1500-1150 cm-1 dar. Im Bereich von 1500-1150 sind zusätzlich ganz oben die APR-Differenzspektren bei pD 8,0 dargestellt. In der Vergrößerung der Carbonylregion von Abb. 3.4.10 sind ebenfalls Veränderungen im ∆cyoE-Mutanten Differenzspektrum vorhanden. Jedoch treten die markanten Differenzbanden des Glu-286 und der Skalierungsbande bei 1696/1691 cm-1 unverändert auf. Die Carbonylregion kann somit ausgewertet werden. Das breite positive ν(C=O) Signal um 1730-1704 cm-1 mit ei92 Ergebnisse ____________________________________________________________________________________________________________________________________________________ nem Maximum bei 1722 cm-1 nimmt deutlich an Intensität gegenüber dem Referenzspektrum zu. Das Maximum des Referenzspektrum bei 1685 cm-1 verschiebt nach 1680 cm-1 im Mutantenspektrum, wobei eine Schulter bei 1685 cm-1 erhalten bleibt. Die Signalintensität des Maximums bei 1680 cm-1 ist gegenüber dem Maximum bei 1685 cm-1 des Referenzspektrums etwas abgeschwächt. Diese Signalveränderungen sollen nun näher untersucht werden. In Abb. 3.4.11 sind die pH 8,0- und pD 8,0-APR-Differenzspektren im Carbonylbereich des pIN-Wildtyps und der ∆cyoE-Mutante gezeigt (oben). Zusätzlich sind die Doppeldifferenzen des pIN-Wildtyps (pH 8,0) minus der ∆cyoE-Mutante (pH 8,0) und die entsprechenden pDDoppeldifferenzspektren dargestellt (Abb. 3.4.11, unten). Abb. 3.4.11: Carbonylbereich der APR-Differenz- und Doppeldifferenzspektren des pIN-Wildtyps (schwarz und blau) und der ∆cyoE (pHCL)-Mutante (rot und grün) bei pH 8,0 und pD 8,0 (oben). Unten: Die resultierenden Doppeldifferenzspektren von den pH 8,0- minus pD 8,0- bzw. pH 5,0- minus pD 5,0-Spektren. Sie sind nur bis 1670 cm-1 dargestellt. In der Abb. ist deutlich zu erkennen, dass in den verglichenen pH-Spektren eine Extinktionszunahme des Mutantenspektrums im Bereich von ca. 1730-1704 cm-1 erfolgt. Unter Einbeziehung der Verschiebung, bedingt durch den H/D-Austausch, lässt sich entsprechendes ebenfalls für die Spektren der deuterierten ∆cyoE-Mutante finden. Im Bereich von 1690-1675 cm-1 lassen sich Verschiebungen der Extinktionsmaxima erkennen. Wie bereits angesprochen, verschiebt das Maximum gegenüber dem pH-Referenzspektrum von 1685 cm-1 auf 1680 cm-1 . Die Intensität des Signals bei 1680 cm-1 ist dabei verglichen zum Wildtypspektrum bei 1685 cm-1 erniedrigt. Eine positive Bande bei 1685 cm-1 bleibt im Mutantenspektrum als Schulter erhalten. Dies spricht für zwei unabhängige Extintionssignale und kann den beobachteten Intensitätsverlust bei 1680 cm-1 erklären. In den verglichenen pD-Differenzspektren fehlt das Maximum bei 1685 cm-1 im Mutantenspektrum, und es tritt stattdessen ein Minimum an dieser Position auf. Ab die93 Ergebnisse ____________________________________________________________________________________________________________________________________________________ sem Minimum zeigt sich jedoch eine kontinuierliche Extinktionzunahme bis ca. 1674 cm-1 . Dieses Maximum liegt deutlich oberhalb des Maximums des Referenzspektrums. Eine Verschiebung in Abhängigkeit von der Deuterierung findet also statt. Die Doppeldifferenzen werden von negativen Banden dominiert, d.h. bei dem pIN-Wildtypspektrum sind Extinktionsbanden schwächer ausgeprägt bzw. die Positionen der Maxima sind gegenüber dem Mutantenspektrum verschoben. Die Lage der Maxima im Bereich von 17301704 cm-1 ändert sich nicht, d.h. diese Signale werden dem low-spin Häm zugeschrieben. Bei den Positionen der Maxima und Minima im Bereich von 1690-1675 cm-1 finden Verschiebungen statt, sie gehen folglich zum Teil auf das high-spin Häm zurück. Zusammenfassend lässt sich festhalten: Eine spezifische Hämpropionate ist erfolgt (deutliche Änderungen 13 in C-Markierung der C1 -Atome der der Carbonylregion der APR- Differenzspektren). Dabei sind keine bzw. geringfügige Unterschiede des isotopenmarkierten pIN-Wildtyps gegenüber der unmarkierten Referenz bei den VIS-Spektren und der DurochinolOxidaseaktivität vorhanden. Aufgrund der stark erniedrigten Cyt bo3 -Ausbeuten bei der Überexpression der Oxidase im E. coli Stamm S730, kommt es im Anschluss bei der Proteinkonzentration ebenfalls zur Anreicherung des Detergenzes. Dies führt zu einer reversiblen Proteindestabilisierung und damit zu einer verminderten Spektrenqualität bei den APR-Differenzspektren innerhalb und unterhalb der Amid-Regionen. Somit lassen sich in diesem spektralen Bereich keine umfassenden Zuordnungen der ν(COO-)-Streckschwingungen zu den Hämpropionaten erreichen. Dennoch sind mindestens zwei deutliche Veränderungen im Bereich von 1500-1300 cm-1 vorhanden. Zwei positive Banden mit Maxima um 1467 cm-1 und 1367 cm-1 fehlen nach 12 C/13 C-Austausch gegenüber der Referenz. Demgegenüber finden sich Extinktionszunahmen um 1443 cm-1 und 1367 cm-1 . Die beobachteten Signale verschieben nach H/D-Austausch nur geringfügig. Es könnte sich demnach um ν s(COO-) Streckschwingungen von Hämpropionaten handeln. Verschobene bzw. fehlende negative Banden sind nicht deutlich zuzuordnen. Für den Bereich innerhalb und unterhalb der Amid-Regionen weicht das ∆cyoE-Mutanten Differenzspektrum ebenfalls gegenüber dem Referenzspektrum vielfältig ab. Die fehlende Hydroxyethylfarnesylgruppe in der high-spin Häm-Bindetasche scheint für die Struktur des Cyt bo3 deutliche Auswirkungen im Wellenzahlenbereich von 1500-1150 cm-1 zu besitzen. Eine eindeutige Signalzuordnung von ν s(COO-) Streckschwingungen ist hierbei wiederum nicht möglich. Bei dem ∆cyoE-Mutantenspektrum, das zur Unterscheidung von Häm-Signalen des low-spin und high-spin Häms herangezogen wird, ist die Intensität der Bande um 1467 cm-1 erhöht. Weiterhin lässt sich eine negative Bande mit einem Minimum um 1410 cm-1 erkennen. Ein zusätzliches Differenzsignal erscheint im Mutantenspektrum im Bereich von 1325-1317 cm-1 , das in abge94 Ergebnisse ____________________________________________________________________________________________________________________________________________________ schwächter Form, aber an gleicher Position, ebenfalls im entsprechenden pD-Spektrum vorhanden ist. Es kann sich demnach um ein ν s(COO-) Streckschwingungssignal eines Hämpropionates des high-spin Häms handeln. Die Carbonylregion des isotopenmarkierten-Wildtyp Differenzspektrums scheint vom Detergenzeinfluss nicht betroffen zu sein. Das ∆cyoE-Differenzspektrum zeigt ebenfalls die markanten Differenzbanden bei 1745/1735 cm-1 und bei 1696/1691 cm-1 in unveränderter Intensität und Position. In dieser spektralen Region können in beiden Fällen reproduzierbare, auswertbare Differenzspektren erhalten werden. Es sind mindestens zwei weitere auf die Hämpropionsäuren zurückzuführende Carbonylsignale in der Region von ca. 1730-1675 cm-1 vorhanden. Die positive Bande mit einem Maximum bei 1722 cm-1 (pH 8,0) verschiebt bei 12 C/13 C- Austausch um ca. 38 cm-1 nach ca. 1684 cm-1 . Eine zusätzliche Verschiebung um ca. 10 cm-1 nach H/D-Austausch kann anhand des Maximums verfolgt werden, das sich von 1685 cm-1 nach ca. 1675 cm-1 verlagert. Beim ∆cyoE-Differenzspektrum ist das Maximum bei 1722 cm-1 intensiver ausgeprägt, jedoch an der selben Position vorhanden. Es findet nach H/D-Austausch eine Verschiebung des Maximums um 8 cm-1 nach 1714 cm-1 statt. Es wird daher einem der beiden Hämpropionate des low-spin Häms zugeordnet. Das Differenzsignal mit einem Maximum bei 1685 cm-1 und einem Minimum bei 1678 cm-1 verschiebt ebenfalls beim 12 C/13 C-Austausch. Das vermutlich in die Amid I-Region verschobene Signal kann dort nicht mehr identifiziert werden. Im Spektrum der ∆cyoE-Mutante findet sich das Maximum der Differenzbande bei 1680 cm-1 wieder. Eine vom H/D-Austausch abhängige Verschiebung ist ebenfalls zu beobachten. Somit wird dieses Carbonylsignal einem der beiden Hämpropionate des high-spin Häms zugeordnet. 3.4.4 Auto-photoreduktions-induzierte FT-IR Redox-Differenzspektren von ortsspezifischen Cyt bo3 -Mutanten In diesem Unterpunkt werden nun ortsspezifische Cyt bo3 -Mutanten mittels der APRDifferenzspektroskopie untersucht, um etwaige Unterschiede in den APR-Differenzspektren der Mutanten gegenüber den pIN-Wildtyp-Referenzspektren aufzuzeigen. Fehlt eine Bande im Mutantenspektrum, oder ist sie verschoben, kann die betreffende Bande möglicherweise der ausgetauschten Aminosäure zugeordnet werden. Tritt ein deutlicher Intensitätsverlust bzw. Intensitätsanstieg einer Differenzbande auf, so kann es sich um eine mit der ausgetauschten Aminosäure wechselwirkende benachbarte chemische Gruppe handeln. Die Cyt bo3 -Mutanten E286Q und Y288F erfüllen nicht die unter 3.4.1 geforderten Qualitätskriterien der APR-Proben. Sie können nicht mit der hier verwendeten Methode ausgewertet wer95 Ergebnisse ____________________________________________________________________________________________________________________________________________________ den. Unter 3.2 (Abb. 3.2.1; Abb. 3.2.2) wurde dargelegt, dass die low-spin Häme dieser Mutantenproteine nur unvollständig reduzierbar sind. Um dennoch vergleichbare Signalintensitäten in der Carbonylregion zu erreichen, muss daher mindestens das Doppelte an Cyt bo3 Mutantenprotein zur Probenpräparation eingesetzt werden. Somit liegen die Amid I Resttransmissionen jedoch unterhalb von 1% und ein unmittelbarer Vergleich zum Referenzspektrum ist nicht mehr gewährleistet. Bei den Differenzspektren der Mutanten II E89D, II E89Q, T352S und T359S konnten nur geringste Unterschiede gegenüber den Referenzspektren festgestellt werden. Sie werden daher nicht weiter dargestellt und behandelt. In Abb. 3.4.12 ist das Differenzspektrum der E286D-Mutante bei pH 8,0 im Vergleich zum pINWildtyp-Referenzspektrum dargestellt. In den grau unterlegten Bereichen sind zusätzlich die APR-Differenzspektren bei pD 8,0 verglichen (oberste Spektren). Abb. 3.4.12: APR-Differenzspektren des pIN-Wildtyps (schwarz) und der E286D (pHCL)-Mutante (rot). Es wurden je 37 µg Oxidase eingesetzt, die in den Übersichtspektren eine Resttransmission der Amid I-Bande von 4,0%6,3% aufwiesen. Die grau unterlegten Vergrößerungen stellen die Wellenzahlbereiche von 1780-1690 cm-1 und 1500-1150 cm-1 dar. Zusätzlich sind ganz oben die APR-Differenzspektren bei pD 8,0 gezeigt. Abgesehen von geringen Basislinienschwankungen decken sich die verglichenen Spektren über große Bereiche. Es sind jedoch auch Unterschiede vorhanden, die vermutlich auf den Austausch der Aminosäure zurückzuführen sind. Der Carbonylbereich wird hierbei lediglich von 1780-1690 cm-1 dargestellt, da unterhalb von 1690 cm-1 keine nennenswerten Änderungen gegenüber dem Wildtypspektrum feststellbar sind. In dieser Region fehlt dem E286D96 Ergebnisse ____________________________________________________________________________________________________________________________________________________ Mutantenspektrum das bereits dem Glu-286 zugeordnete ν(C=O)-Streckschwingungs-Signal bei 1745/1735 cm-1 (3.3) [29]. Stattdessen findet sich ein in seiner Intensität stark erniedrigtes, invertiertes Differenzsignal bei 1767/1762 cm-1 , das bei H/D-Austausch nach 1760/1755 cm-1 verschiebt und intensiver hervortritt. Es kann somit der ν(C=O) Streckschwingungssignale vom Asp-286 zugeordnet werden. Im Bereich von 1500-1150 cm-1 fehlen zwei weitere positive Banden bei 1367 cm-1 bzw. 1198 cm-1 . In der Region von 1450-1264 cm-1 finden sich die δ(COH)-Beugeschwingungen von Glu und Asp wieder. Diese verschieben bei H/D-Austausch nach 1058-955 cm-1 (Angaben nach [93]). Im Mutantenspektrum kann die fehlende Bande bei 1367 cm-1 diesem Schwingungstyp potentiell zugeordnet werden. Da das entsprechende Asp-286 ν(C=O)-Signal in der Carbonylregion deutlich an Intensität verloren hat, lässt sich das δ(COH)-Signal in dieser komplex überlagerten Region des Differenzspektrums nicht wiederfinden. Im entsprechenden D2 O-Spektrum lassen sich keine Unterschiede zum Wildtypspektrum feststellen. Es hat folglich eine lösungsmittelabhängige Verschiebung stattgefunden. Der Bereich unterhalb von ca. 1100 cm-1 steht einer Auswertung nicht zur Verfügung (3.4.1). Somit kann das Fehlen der δ(COD)Beugeschwingung im E286D-Mutantenspektrum nicht nachgewiesen werden. Im Wellenzahlenbereich von 1253-1120 cm-1 finden sich die ν(C-O)-Streckschwingungen von Glu und Asp. Diese Schwingungen verschieben bei H/D-Austausch um +88 cm-1 und liegen dann zwischen 1322-1270 cm-1 [93]. Die Bande bei 1198 cm-1 kann potentiell den ν(C-O)-Streckschwingungen des Glu-286 zugeordnet werden. Die entsprechenden Asp-286 Schwingungen können aufgrund des kleinen zu erwartenden Signals nicht identifiziert werden. In den verglichenen pD-Spektren ist das positive Signal bei 1198 cm-1 nicht mehr vorhanden. Die verschobene Bande, die um 1286 cm-1 liegen sollte, kann nicht mehr im Spektrum wiedergefunden werden, da diese Region von einer relativ intensiven negativen Bande mit einem Minimum bei 1283 cm-1 überlagert wird. Zuletzt soll das APR-Differenzspektrum der F391Q-Mutante betrachtet werden (Abb. 3.4.13). Die Ergebnisse werden in dieser Arbeit nur beschrieben, da die Ursachen für den Signalrückgang an der Differenzbande bei 1696/1691 cm-1 und die Schwingungstypen von den beteiligten Atomgruppen an diesen Wellenzahlenpositionen unklar bleiben. Da diese Differenzbande keine pH- bzw. pD-Wert abhängigen Veränderungen aufweist, konnte sie bisher zur Skalierung der hier gezeigten FT-IR-Spektren des Cyt bo3 eingesetzt werden und ist somit von großer Bedeutung. Daher werden auch ohne weitergehende Interpretationen diese Ergebnisse vorgestellt, um Anhaltspunkte für zukünftige Untersuchungen zu liefern. 97 Ergebnisse ____________________________________________________________________________________________________________________________________________________ Die F391Q-Mutante weist weder eine in vivo, noch in vitro Aktivität auf (Tab. 3.2.6). Sie zeigt eine verlangsamte Auto-Photoreduktion und liegt nach erfolgter IR-Messung nur zu ca. 70-80% reduziert vor (Daten nicht gezeigt). Die Differenzbande bei 1696/1691 cm-1 ist nur noch in verminderter Intensität vorhanden. Daher wird das in Abb. 3.4.13 dargestellte Mutantenspektrum mittels der Amid II Bande des Referenzspektrums skaliert (aus Ermangelung an Banden gleicher Intensität zwischen pH- und pD-Spektren wird die Amid II-Bande gewählt). Eine hohe Signaldeckung wird mit Ausnahme zweier hervorgehobener Banden bei 1696/1691 cm-1 und 1262/1243 cm-1 über den gesamten Wellenzahlenbereich erzielt. Das Minimum bei 1262 cm-1 ist stark erniedrigt, wie dies bereits beim Differenzspektrum der ∆cyoE-Mutante der Fall war. Abb. 3.4.13: APR-Differenzspektren des pIN-Wildtyps (schwarz) und der F391Q (pHCL)-Mutante (rot). Es wurden je 37 µg Oxidase eingesetzt, die in den Übersichtspektren eine Resttransmission der Amid I-Bande von 6,3% bzw. 4,8% aufwiesen. Die grau unterlegten Vergrößerungen stellen die Wellenzahlbereiche von 1780-1690 cm-1 und 1500-1150 cm-1 dar. Die Signalintensitäten der 1696/1691 cm-1 Differenzbande gehen bei den F391Q-Spektren auf etwa die Hälfte im pH 8,0-Spektum bis Eindrittel im nicht dargestellten pD 8,0-Spektrum zurück, wobei die Bandenposition erhalten bleibt. Die Differenzsignale des Glu-286 und die positiven Häm-Carbonylextinktionen des low-spin Häms sind demgegenüber unverändert. Ebenso wirkt sich der Intensitätsverlust bei 1696/1691 cm-1 nicht auf die Positionen der Maxima und Minima im Bereich von 1690-1675 cm-1 aus. 98 4. Diskussion 4.1 Erstellung eines C-terminal von Untereinheit II nicht prozessierten Wildtyps von Cyt bo3 4.1.1 Motivation zur Erstellung eines neuen, mit verbesserten Reinigungseigenschaften versehenen Cyt bo3 Wildtyps Einen neuen Cyt bo3 Wildtyp zu erstellen, der weder eine C-terminale Proteolyse noch eine Abspaltung des C-Terminus während des Zellaufbruchs mit Ultraschall an Untereinheit II zeigt, ist aus mehreren Gründen notwendig: Proteinreinigung Der bisher verwendete Cyt bo3 Wildtyp, kodiert vom pHCL-Plasmid zeigt posttranslational eine Proteolyse des C-Terminus an Untereinheit II und somit den Verlust der Oligohistidinmodifikation in Abhängigkeit von den Fermentationsbedingungen (Abb. 3.1.1). Der Verlust der Modifikation wird während des Zellaufbruchs mit Ultraschall noch erhöht [59]. Bisher mussten zwei unterschiedliche Strategien zur Überexpression und Proteinreinigung verfolgt werden, je nachdem ob (I) hochreines und bezüglich Untereinheit II homogen zusammengesetztes Cyt bo3 benötigt wurde [59] oder ob (II) die Proteinausbeute hoch sein sollte [49]: Ad (I) - Die E. coli Zellen werden in der mittleren logarithmischen Wachstumsphase geerntet und der Zellaufbruch schonend, d.h. kurz und bei niedrigen Ultraschallenergien durchgeführt, um die Oligohistidinmodifikation zumindest zum Teil zu erhalten. Durch einen entsprechenden Imidazolwaschschritt kann unmodifiziertes von modifiziertem Cyt bo3 auf der Säule getrennt werden. Dies führt zu deutlich verminderten, jedoch hochreinen und bezüglich Untereinheit II homogenen Proteinausbeuten. Ad (II) - Die auftretende C-terminale Proteolyse bzw. Abspaltung beim Zellaufbruch an Untereinheit II wird nicht beachtet und die Fermentations- sowie die Ultraschallbedingungen so gewählt, dass eine hohe Proteinausbeute zu erwarten ist. Zur Reinigung des im hohen Maße unmodifizierten Cyt bo3 wird dessen geringere, aber vorhandene „endogene“ Affinität zu Metallaffinitätschromatographie-Säulenmaterialien, wie z.B. Ni2+-NTA-Agarose genutzt (Abb. 3.1.4) [49; 116]. Es resultiert eine deutlich erhöhte Proteinausbeute, die jedoch Fremdproteinverunreinigungen (Abb. 3.1.3 und Abb. 3.1.5) aufweist und Oxidaseverluste während des 20 mM Imidazolwaschschritts beinhaltet. Die erhaltene Cyt bo3 -Molekülpopulation kann bezüglich Untereinheit II heterogen zusammengesetzt sein, da die Stärke des Verlusts des C-Terminus und somit der Oligohistidinmodifikation hoch variabel ist [59]. 99 Diskussion ____________________________________________________________________________________________________________________________________________________ Mit der Erstellung des pIN-Plasmids, der Überexpression in BL21 ∆cyo recA- und der anschließenden Proteinreinigung kann ein Cyt bo3 erhalten werden, das keine C-terminale Proteolyse an Untereinheit II und somit keinen Verlust der Oligohistidinmodifikation zeigt (Abb. 3.1.3 und Abb. 3.1.5). Bei dem Protein konnte keine Abspaltung des C-Terminus während des Zellaufbruchs beobachtet werden (Abb. 3.1.4). Somit kann ein schnell und einfach durchzuführendes Proteinreinigungsprotokoll mit hohen Oxidaseausbeuten realisiert werden (Tab. 3.1.1), das unabhängig von den verschiedenen bisherigen Fermentations- und Ultraschallbedingungen ist. Es kann eine bezüglich Untereinheit II homogene Cyt bo3 -Molekülpopulation erhalten werden. Isotopenmarkierung der Hämpropionate An dieser Stelle soll die Notwendigkeit für den Einsatz des pIN-Wildtyps für die Isotopenmarkierung der Hämpropionate im Vordergrund stehen und nicht die Diskussion der Ergebnisse der Markierung, die unter 4.3.3 durchgeführt wird. Die low-spin Häm-Bindestelle ist nicht nur für Häm B, sondern auch für Häm O zugänglich [65]. Es können Oxidase-Molekülpopulationen entstehen, die heterogen in ihren eingebauten Häm-Kofaktoren zusammengesetzt sind, d.h. es kann nicht nur Cyt bo3 , sondern auch das inaktivere Cyt oo3 in E. coli überexprimiert werden (Abb. 3.1.6). Die Tendenz, Häm O anstelle des Häm B zu inkorporieren könnte abhängig von der Kopieanzahl des zur Überexpression benutzten Plasmids und vom eingesetzten Expressionsstamm sein [59; 65]. Die tatsächlichen Gründe hierfür sind jedoch unklar. Diese Heterogenität führt zu Komplikationen bei der spektroskopischen und kinetischen Charakterisierung des Enzyms [136]. Die Oligohistidinmodifikation an Untereinheit II ist aus unbekannten Gründen für den korrekten Häm-Einbau notwendig [59]. Der pIN-Wildtyp weist ein Häm B in der low-spin- bzw. ein Häm O in der high-spin HämBindetasche und ein 1:1 Verhältnis der beiden Häme auf (3.1.2.2, Abb. 3.1.6). Eine weitergehende Diskussion zum Häm-Fehleinbau bei Cyt bo3 wird im anschließenden Unterpunkt (4.1.2) wieder aufgenommen. Zur spezifischen Isotopenmarkierung von z.B. den Hämpropionaten sind E. coli Stämme mit entsprechenden Defekten in den Biosynthesewegen, wie z.B. E. coli S730 (Abb. 1.2.5 und Tab. 2.1.1) notwendig. In diesem E. coli Stamm ist das genomische cyo-Operon intakt. Das cyoAGen weist entsprechend keine kodierenden Sequenzen für eine Oligohistidinmodifikation auf und der Genom-Wildtyp kann potentiell bei einem Überangebot an Häm O diesen Häm-Typ in der low-spin Hämbindetasche einbauen. Nach Transformation eines Expressionsvektors, der das cyo-Operon beinhaltet (z.B. pIN, Abb. 2.1.1), kommt es neben der Expression der vier Strukturgene des Cyt bo3 ebenfalls zur Überexpression der Protohäm IX-Farnesyltransferase (CyoE). Somit kann der Genom-Wildtyp bezüglich der Häm-Kofaktoren heterogen exprimiert werden. 100 Diskussion ____________________________________________________________________________________________________________________________________________________ Bei dem Redox-Differenzspektrum der S730 pIN-Cytoplasmamebranen unter Zugabe von ALV (Abb. 3.4.7 links) ist dies deutlich an dem asymmetrischen Verlauf der α-Bande und dem hypsochrom verschobenen Extinktionsmaximum der Soret-Bande zu erkennen. Um eindeutige spektrale Zuordnungen machen zu können, muss folglich eine bezüglich der Häm-Kofaktoren homogene Cyt bo3 Molekülpopulation vorliegen, d.h. bei der Proteinreinigung muss der GenomWildtyp vom pIN-Wildtyp trennbar sein. Dies ist nur bei intakter Oligohistidinmodifikation möglich. Nach der Reinigung weist der 13 C-isotopenmarkierte pIN-Wildtyp im Redox- Differenzspektrum eine symmetrisch verlaufende α-Bande (Abb. 3.4.7 rechts), also nur vom Plasmid exprimiertes Enzym auf. Erst mit dem Einsatz des pIN-Plasmids, dessen Expressionsprodukte den His-tag an Untereinheit II tragen, ist eine homogene Cyt bo3 Molekülpopulation bei der 13 C-Isotopenmarkierung im E. coli Stamm S730 zu erreichen. Reinigung von ortsspezifischen Cyt bo3 -Mutanten Ortsspezifische Cyt bo3 Mutanten können bisher bei hohen Proteinausbeuten nur in einem Expressionsystem überproduziert werden, das einen E. coli Stamm aufweist, der Inaktivierungen des genomischen cyo-Operons und des RecA-Proteins, einen Bestandteil der homologen Rekombination (z.B. [137]) beinhaltet, wie z.B. BL21 ∆cyo recA-. Da es nunmehr möglich ist, auf dem pIN-Plasmid basierende Mutanten zu reinigen, die keine Proteolyse bzw. Abspaltung der Oligohistidinmodifikation zeigen (3.1.3), können E. coli Stämme unabhängig von der Inaktivierung des genomischen cyo-Operons eingesetzt werden. Die Einschränkung, dass der verwendete E. coli Stamm hierbei nicht zur homologen Rekombination befähigt ist, bleibt erhalten, da ansonsten bei einer homologen Expression des Cyt bo3 die eingefügte Mutation im Expressionsvektor reversibel sein kann. Somit besteht für zukünftige Untersuchungen, wie z.B. die Isotopenmarkierung von spezifischen Aminosäuren in entsprechend defizienten E. coli Stämmen die Möglichkeit diese Experimente zu verwirklichen. 4.1.2 Untereinheit II der Ubichinol Oxidase Cyt bo3 An allen vier Strukturgenen des Cyt bo3 wurden für Oligohistin-Modifikationen kodierende Sequenzen C-terminal inseriert [49; 59]. Der His-tag an Untereinheit III führte zu instabilen, nicht in der cytoplasmatischen Membran assemblierten Enzymen [59]. Sowohl bei dem unmodifizierten pMC39-Wildtyp, als auch bei den Oxidasen, die den His-tag an Untereinheit I und Untereinheit IV tragen, werden funktionelle, in der Membran assemblierte Oxidasen erhalten. Diese weisen jedoch bezüglich der Häm-Inkorporation heterogene Cyt bo3 /Cyt oo3 Molekülpopulationen auf [49; 59; 65]. Eine Oligohistidinmodifikation am C-Terminus von Untereinheit II führt jedoch zu einer homogenen Cyt bo3 Molekülpopulation [49; 59]. Die letzten sechs Aminosäuren 101 Diskussion ____________________________________________________________________________________________________________________________________________________ des C-Terminus können in vivo proteolytisch verschieden stark, in Abhängigkeit von den Fermentationsbedingungen (Abb. 3.1.1) und -zeiten abgespalten werden [49]. Die Proteolyse des C-Terminus wirkt sich nicht auf die katalytische Funktion des Cyt bo3 aus [59]. In Abb. 4.1.1 sind die Ergebnisse der Mutationsanalysen (Abb. 3.1.2) des C-Terminus von Untereinheit II nochmals zusammenfassend in einer schematischen Darstellung wiedergegeben. Abb. 4.1.1: Schematische Darstellung der C-Termini von Untereinheit II der Wildtyp- und Mutantenproteine von Cyt bo 3 hinsichtlich ihres C-terminalen Proteolyseverhaltens. Ein Aminosäureaustausch des Ser-309 zu Ala, des His-310 zu Arg und die entsprechende Doppelmutante führen zu einem Abbau der Untereinheit II und damit zu keiner Assemblierung des Cyt bo3 in der cytoplasmatischen Membran. Diese Proteindegradationen können darauf hinweisen, dass der Aminosäuresequenz am C-Terminus von Untereinheit II eine wichtige regulative und physiologische Bedeutung im Hinblick auf die Assemblierung des Cyt bo3 zukommt. Bei der Inserierung von sechs Histidinen, bei gleichzeitiger Deletion der drei zur Spaltungsstelle benachbarten Aminosäuren Met, Asp und Met wird ein funktionelles und in der Membran assembliertes Cyt bo3 erhalten. Der pIN-Wildtyp zeigt weder eine C-terminale Proteolyse der letzten sechs Aminosäu noch den Verlust der Oligohistidinmodifikation (Abb. 3.1.3). Eine Abspaltung während des Zellaufbruchs mit Ultraschall ist ebenfalls nicht festzustellen (Abb. 3.1.4). Es kann ein hochreines Cyt bo3 mittels Ni2+-NTA-Agarose gereinigt werden (Abb. 3.1.5). Die gereinigte Oxidase weist ein Häm B in der low-spin Hämbindetasche auf und besitzt ein 1:1 Verhältnis von Häm B zu Häm O (Abb. 3.1.6). Ein Cyt oo3 Anteil ist nicht nachweisbar. Es handelt sich folglich bezüglich der Häm-Inkorporation und bezüglich Untereinheit II um eine homogen zusammengesetzte Cyt bo3 -Molekülpopulation. Diese Ergebnisse deuten darauf hin, dass der C-Terminus von Untereinheit II an der Häm-Bindung, der Häm-Weiterleitung und somit der korrekten Häm-Inkorporation in Untereinheit I beteiligt sein könnte. 102 Diskussion ____________________________________________________________________________________________________________________________________________________ Neben der katalytischen Untereinheit I ist Untereinheit II essentiell für die Funktion der HämKupfer Oxidasen [16]. Hier sollen kurz einige wichtige Aspekte zur physiologischen Bedeutung dieser Untereinheit in Cytochrom Oxidasen im Allgemeinen und Cyt bo3 im Speziellen beschrieben werden. An der Substratbindung (Ubichinol oder Cyt c) bei Häm-Kupfer Oxidasen ist Untereinheit II beteiligt (1.2). Im Cyt bo3 weist sie bis zu zwei postulierte Chinolbindestellen auf, die am Elektronentransfer zum binuklearen Zentrum beteiligt sind (1.3). Diese Untereinheit scheint darüber hinaus für die initiale Assemblierung des Cyt bo3 wichtig zu sein: Intrinsische Proteine der cytoplasmatischen Membran werden bei E. coli gewöhnlich nicht als eine Vorstufe mit abspaltbarer N-terminaler Signalsequenz synthetisiert [115]. CyoA stellt eine Ausnahme dar (Abb. 4.1.2). Es weist eine 24 Aminosäuren lange Signalsequenz auf, die eine sogenannte „Lipobox“ beinhaltet. Es gehört somit zu den Lipoproteinen [115; 138; 139]. Die posttranslationalen Modifikationen am N-Terminus von Untereinheit II werden hier nicht detaillierter beschrieben. Bei Deletion der Signalsequenzaminosäuren zwei bis neun (∆R2S9) wird eine Inkorporation der Oxidase in der Membran verhindert [115]. Beim Austausch der vier potentiell positiv geladenen Aminosäuren zu neutralen Aminosäuren (II R2S, II R4S, II K5N und II K8N) der Signalsequenz ist eine gegenüber dem Wildtyp zu ca. 50% verminderte Assemblierung des Cyt bo3 festzustellen [115]. Die für intrinsische Proteine der Cytoplasmamembran ungewöhnliche Signalsequenz des CyoA könnte einen unmittelbaren Transport von Untereinheit II durch die Membran zur Folge haben und somit die extrinsische Domäne der Untereinheit II in das Periplasma transferieren. Dabei würden die beiden transmembranen α-Helices eine vollständige Sekretion des CyoA verhindern und eine Art „Anker“ in der Cytoplasmamembran darstellen, um den sich die weiteren Untereinheiten des Cyt bo3 formieren. Dies würde auf eine frühe Beteiligung von Untereinheit II an der Assemblierungsreaktion des Cyt bo3 in der cytoplasmatischen Membran hindeuten. Interessanterweise besitzen einige Cyt c Oxidasen neben dem CuA-Zentrum ein Häm-Zentrum (Cytochrom Domäne) in ihrem C-Terminus von Untereinheit II. Sie werden entsprechend als caa3 Oxidasen bezeichnet (zur Übersicht s. z.B. [11; 140]). Diese extrinsische Cytochrom Domäne weist ein Sequenzmotiv -CXXCH- zur Anbindung von Hämen auf [11]. Bei pro- und eukaryontischen P-Typ ATPasen findet sich N-terminal ein Sequenzmotiv -GMTCXXC- zur Schwermetallbindung [141]. Dieses Motiv kann variieren, jedoch beinhaltet es immer die Sequenz -CXXC-. Darüber hinaus wird bei den sogenannten „Cpx“-Typ ATPasen ein weiteres Metallbindemotiv -H/MXXMDHS/GXM- gefunden, das N-terminal ein- bis sechsfach wiederholt vorliegt [141-143]. Der C-Terminus des Cyt bo3 von Untereinheit II weist in der Primärsequenz ein sehr ähnliches Motiv an den Aminosäurepositionen 303-311 auf -MEGMDMSHA103 Diskussion ____________________________________________________________________________________________________________________________________________________ (Abb. 4.1.1 und Abb. 4.1.2), wobei die Aminosäuren Ser und His den Ort der posttranslationalen C-terminalen Proteolyse darstellen. Alle sechs im ATPase Motiv beschriebenen konservierten Aminosäuren sind vollständig wiederzufinden, wenn auch zum Teil in leicht variierter Position. Eine übereinstimmende Position lässt sich für 2/3 der Aminosäuren finden (MXXMDMSHX). An den Aminosäurepositionen 281-290 dieser Untereinheit findet sich nochmals eine Sequenz mit sehr ähnlicher Aminosäurezusammensetzung -MAHGKSMDM(Abb. 1.4.2). In diesem Falle finden sich jedoch nicht die beiden Aminosäuren Ser und His in unmittelbarer Reihenfolge. Eine Proteolyse innerhalb dieser Sequenz ist bisher nicht nachgewiesen. Ansonsten sind wiederum alle sechs konservierten Aminosäuren des ATPase-Motivs vorhanden, wenn auch die Konsensussequenz nicht mehr eindeutig zuzuordnen ist. In beiden Fällen könnte es sich demnach um Aminosäuresequenzen handeln, die ähnlich wie in caa3 Oxidasen Häme binden können. Im Unterschied zu den caa3 Oxidasen liegt in Untereinheit II des Cyt bo3 jedoch keine Cytochrom-Domäne vor und stattdessen könnten über diesen C-Terminus die Häm-Bindung und Häm-Weiterleitung zu Untereinheit I erfolgen. Abb. 4.1.2: Schematische Darstellung von Untereinheit II des pMC39-Wildtyps und des C-Terminus des pINWildtyps. Die Signalpeptidabspaltung (•) und die anschließende Palmitoyl-Dipalmitoylglycerid-Modifikation (‚) ist hier nur zur Vollständigkeit gezeigt. Eine genauere Beschreibung der postranslationalen Prozessierungen kann Prutsch et al., 2000 [49] entnommen werden. Die Kristallstrukuren der Cyt c Oxidasen [15; 23-25] und des Cyt bo3 [22] weisen bezüglich der Lokalisation von Untereinheit II im Enzymkomplex eine vergleichbare Lage auf. Hierbei liegt die globuläre extrinsische C-terminale Domäne über den Häm-Bindestellen in Untereinheit I. Da Untereinheit II sowohl N- als auch C-terminal an der initialen Assemblierung des Cyt bo3 beteiligt sein könnte, ist eine Häm-Weiterleitung zur Inkorporation in der sich assemblieren104 Diskussion ____________________________________________________________________________________________________________________________________________________ den Untereinheit I durchaus denkbar. Ein Sequenzvergleich von diversen Cytochrom Oxidasen kann z.B. [11] entnommen werden. Die C-terminalen Aminosäuren des Cyt bo3 weisen von ca. Position 140-315 jedoch nur eine konservierte Aminosäure zu anderen Häm-Kupfer Oxidasen auf [11]. Da caa3 - und aa3 -Typ Cyt c Oxidasen nur Häm A inkorporieren, ist eine Unterscheidung in die verschiedenen Häm-Spezies nicht erforderlich und demnach ist ein C-Terminus nicht notwendig wie er in E. coli realisiert ist. Die Häm B Synthese in E. coli (Abb. 1.2.5) ist unabhängig von der Transkription und Translation des cyo-Operons und somit auch von der Protohäm IX-Farnesyltransferase. Häm B wird in unterschiedlichsten Proteinen, wie z.B. dem Cyt bd in E. coli benötigt. Entsprechend könnte die intrazelluläre Häm B-Konzentration gegenüber der Häm O-Konzentration erhöht sein. Dies wiederum hat zur Folge, dass die Affinität eines der beiden putativen C-terminalen HämBindemotive von Untereinheit II zu Häm O erhöht sein müsste, um eine 1:1 Inkorporation der Häme innerhalb des Cyt bo3 zu gewährleisten. Bei einem Überangebot von Häm O, wie bei der Überexpression von CyoE vom Plasmid, kehren sich diese Häm-Konzentrationsverhältnisse jedoch um. Da demnach häufig nur Häm O am C-Terminus gebunden vorliegen müsste, würde es vermehrt zum Fehleinbau von Häm O in der low-spin Hämbindetasche kommen. Dies würde eine plausible Erklärung für die heterogenen Cyt bo3 /Cyt oo3 Molekülpopulationen liefern, wie sie z.B. im pMC39-Wildtyp oder den Oxidaseproteinen zu finden sind, die den His-tag an Untereinheit I bzw. Untereinheit IV tragen. Nach der hier vorgestellten Hypothese könnte die Oligohistidinmodifikation an Untereinheit II die Affinität zu Häm O erniedrigen. Ein ähnliches Postulat wurde bereits in Rumbley et al. 1997 [59] aufgeführt, wobei der Oligohistidinmodifikation am C-Terminus von CyoA nur eine allgemeine Beteiligung am Häm-Einbau in Untereinheit I zugeschrieben wurde. Der Stickstoff des Imidazolrings des Histidins weist zu divalenten Kationen eine hohe Affinität auf. Entsprechend könnte die Affinität des nativen BindesequenzMotivs seine erhöhte Selektivität für Häm O verlieren, da eine unselektive Wechselwirkung der Eisenzentralatome der Häme mit dem His-tag stattfinden könnte. Häm B würde aufgrund seiner „Passgenauigkeit“ demnach wieder verstärkt in die low-spin Häm-Bindetasche eingebaut. Dieser Gedanke kann jedoch noch weiter ausgeführt werden. Betrachtet man unter diesem Aspekt nochmals Abb. 4.1.2, so fallen neben den postulierten Häm-Bindemotiven (rot dargestellt) zwei weitere sich nahezu wiederholende Aminosäuresequenzen mit einem hohen Histidinanteil auf (grün dargestellt), die im Übrigen für die natürliche Affinität des Cyt bo3 für Metallaffinitätschromatographie-Säulenmaterialien verantwortlich sein könnten. Die möglichen HämBindemotive könnten sich entsprechend auf -MAHGKSMDMXXXXXEHSAH- und -MEGMDMSHAESAH- ausweiten. Dem ganz C-terminal gelegenem Häm-Bindemotiv könnte eine erhöhte Affinität zu Häm O und damit die initiale Bindung zugeschrieben werden, dem 105 Diskussion ____________________________________________________________________________________________________________________________________________________ zweiten Häm-Bindemotiv die vorübergehende Anbindung eines Häm B oder die gerichtete Weiterleitung der Häme zu Untereinheit I. Den zur Spaltungsstelle unmittelbar benachbarten Aminosäuren Ser und His könnte hierbei eine Schlüsselrolle zur Häm bzw. Häm O Bindung zukommen. Dies würde erklären, weshalb ein Aminosäureaustausch an diesen beiden Positionen zu einer Degradation des Cyt bo3 führt, da die wesentliche Funktion, die Häme zu binden und in Untereinheit I weiterzuleiten nicht erfolgen kann. Dementsprechend kann sich Untereinheit I nicht korrekt in der cytoplasmatischen Membran assemblieren und die überexprimierten Polypeptidketten sind einem proteolytischen Abbau in E. coli zugänglich. Beim pIN-Wildtyp fehlen zwar die Aminosäuren Met, Asp und Met im Metallbinde-Motiv, dieser Verlust könnte jedoch durch den ebenfalls potentiell metallbindenen His-tag kompensiert werden. Die Aminosäuren Ser und His sind von dieser Deletion und Insertion nicht betroffen. Weshalb die C-terminale Proteolyse der letzten sechs Aminosäuren stattfindet bzw. im pINWildtyp ausbleibt, bleibt nach wie vor unklar. Die hier ermittelten Daten erweitern die These, dass an der Assemblierung des Cyt bo3 nicht nur der N-Terminus, sondern auch der C-Terminus von Untereinheit II beteiligt sein könnte. Darüber hinaus könnte der C-Terminus über Häm-Bindemotive verfügen, die ähnlich dem Metallbindemotiv -MXXMDHSXM- sind, das bei Cpx-Typ ATPasen beschrieben ist. Somit könnte der C-Terminus an der Häm-Bindung und Häm-Weiterleitung in Untereinheit I beteiligt sein. Für zukünftige Untersuchungen, wie z.B. ortsspezifische Mutantenerstellungen innerhalb der potentiellen Bindemotive stellt diese Hypothese einen vielversprechenden Ausgangspunkt dar. Hierbei wären die vordringlichen Ziele: (I) dass es sich bei den beschriebenen Motiven um Häm-Bindemotive handelt und, (II) dass eine unterschiedliche Affinität der Häm-Bindemotive zu Häm B und Häm O besteht. 4.1.3 Biochemische und VIS-spektroskopische Charakterisierung des pIN-Wildtyps Der pIN-Wildtyp zeigt Unterschiede gegenüber dem pHCL-Wildtyp, sowohl in der VISspektroskopischen Charakterisierung (3.1.2.2), als auch in der Durochinol-Oxidaseaktivität (3.1.2.3). Das Cyt bo3 kann nur zu ca. 72% mit Natriumdithionit reduziert werden (Abb. 3.1.7). Der externe Ligand Cyanid bindet am oxidierten binuklearen Zentrum des Cyt bo3 . Die Bindung ist also unabhängig von der Reduktion des Enzyms. Dennoch wird, im Vergleich zum pHCLWildtyp, Cyanid vom pIN-Wildtyp in geringerem Ausmaß gebunden (Abb. 3.1.7). Dies deutet auf eine unvollständige Zugänglichkeit des high-spin Häm O hin, wobei die fehlende CT-Bande auf ein ansonsten redoxaktives binukleares Zentrum hinweist [118; 121]. Da das reduzierte Cyt bo3 nach CO-Begasung ebenfalls nur einen CO-Anbindungsgrad von ca. 70% in den Redox106 Diskussion ____________________________________________________________________________________________________________________________________________________ Differenzspektren aufweist (Abb. 3.2.2), kann hieraus gefolgert werden, dass nur das high-spin Häm O unvollständig reduziert wird. Die reduzierten und CO-gebundenen high-spin Häme sind jedoch vollständig redoxaktiv, bei intaktem binuklearen Zentrum (Abb. 3.1.8). Unabhängig von den VIS-spektroskopischen Ergebnissen weist der pIN-Wildtyp nur 64% DurochinoloxidaseAktivität gegenüber dem Referenzenzym auf (Tab. 3.2.6). Eine unvollständige Häm-Bindung in den Häm-Bindetaschen beim pIN-Wildtyp kann aus zwei Gründen nahezu ausgeschlossen werden. (I) Die HPLC-Analytik der Hämextrakte weist auf ein 1:1 Verhältnis von Häm B zu Häm O hin (Abb. 3.1.6). (II) Das oxidierte Absolutspektrum weist einen höheren Extinktionswert am Soret-Bandenmaximum (410 nm) auf als das pHCL-Referenzspektrum (Tab. 3.2.2). Im Cyanid- (Abb. 3.1.7) bzw. reduzierten Absolutspektrum werden jedoch niedrigere Extinktionen gegenüber der Referenz erhalten, d.h. dass sowohl die Cyanid-Anbindung als auch die Reduktion an weniger high-spin Häm-Molekülen stattfindet, als Häme zur Gesamtextinktion im oxidierten Absolutspektrum beitragen. Trotz der Vielzahl an durchgeführten Experimenten lässt keine der Untersuchungen einen plausiblen Rückschluss auf das veränderte Verhalten der high-spin Häme im pIN-Wildtyp zu. Es kann daher nur spekuliert werden. Der pIN-Wildtyp unterscheidet sich bezüglich der Positionen von den Extinktionsmaxima bzw. -minima bei allen hier durchgeführten VIS-spektroskopischen Untersuchungen nicht bzw. nur sehr geringfügig vom pHCL-Wildtyp (Abb. 3.1.7, Tab. 3.2.1, Tab 3.2.3) -die Unterschiede im CO-gebundenen Zustand sind auf die unvollständige Reduktion des high-spin Häm O zurückzuführen-. Wenn ein Unterschied der beiden Oxidasen vorhanden ist, dann könnte das Maximum der Soret-Bande im oxidierten Absolutspektrum einen Hinweis geben, das von 409 nm auf 410 nm bathochrom verschoben ist. Das Extinktionsminimum im Redox-Differenzspektrum vom pIN-Wildtyp ist ebenfalls um 1 nm bathochrom verschoben. Diese Befunde können darauf hindeuten, dass ein externer, „elektronendrückender“ Ligand irreversibel am high-spin Häm bzw. am binuklearen Zentrum gebunden ist (1.4) oder ein Wechsel in der Konformation der Oxidase ausgelöst wird, der auch in Abwesenheit des Liganden erhalten bleibt. Bei der bovinen mitochondrialen Cyt c Oxidase ist ein solcher konformativer Wechsel beschrieben, der durch Kohlendioxid (CO2 ) ausgelöst wird [144; 145]. Dies führt zu einer Oxidase, die zu einem großen Teil in der slow-form vorliegt und Schwierigkeiten sowohl bei der Reduktion als auch bei der Ligandenbindung von Cyanid und CO mit sich bringt [146; 147] Häufiges Einfrieren bzw. Auftauen des Enzyms ohne entsprechende Schutzgasatmosphäre fördert die CO2 -Anbindung. Für Cyt bo3 ist jedoch eine solche CO2 -Ligandierung bislang nicht beschrieben und im Alltagsgebrauch des pIN-Wildtyps wurden keine entsprechenden Schutzmassnahmen getroffen. Für eine mögliche CO2 -Anbindung am pIN-Wildtyp spricht der höhere Reduktionsgrad der beiden auf dem pIN-Plasmid basierenden Mutanten T352S und T359S. Sie 107 Diskussion ____________________________________________________________________________________________________________________________________________________ weisen 90% bzw. 96% Reduktion auf (Tab. 3.2.2). Da beiden Mutanten nur für einige wenige Messungen aufgetaut bzw. eingefroren wurden, könnte dies den erhöhten Reduktionsgrad gegenüber dem pIN-Wildtyp erklären. Die beobachtete unvollständige Zugänglichkeit des highspin Häms im pIN-Wildtyp ginge somit auf eine Art „Alterungsprozess“ des Proteins zurück. 4.2 IR-Probenerstellung mit der Gasaustauschzelle Erst die Konstruktion und die Ausarbeitung von Parametern der Probenpräparation mit der Gasaustauschzelle (Abb. 3.3.1) ermöglicht es Cyt bo3 -Proben für die IR-Spektroskopie mit Calciumfluorid-Fenstern zu erhalten, die definierte H2 O/D2 O Lösungsmittelverhältnisse bzw. den nahezu kompletten H/D-Austausch zulassen (Abb. 3.3.2, Abb. 3.3.3 und Abb. 3.3.4). Darüber hinaus konnte K. Vogtt mit der Gasaustauschzelle IR-Proben des Cyt bo3 erstellen, die (I) mit caged dioxygen [80] photooxidiert werden konnten und (II) die im sogenannten mixed-valence Zustand des Cyt bo3 vorlagen (4.2.2) [105]. 4.2.1 Redox-induzierter konformativer Wechsel des Glutamat-286 von Cyt bo3 in Abhängigkeit vom H2 O/D 2 O-Lösungsmittelaustausch Mit dem Einsatz von IR-Proben, die mittels der Gasaustauschzelle erstellt werden, wird die postulierte Schalterfunktion an der hydrophoben Barriere der Aminosäure Glu-286 [29] bei vollständigem H/D-Austausch untersucht. Bevor die postulierte Schalterfunktion des Glu-286 diskutiert wird, sollen an dieser Stelle einige wichtige Angaben zu dieser Aminosäure und zur FT-IR Messung am Cyt bo3 im Allgemeinen gemacht werden: Das in dieser Arbeit benutzte Cyt bo3 wird mit Triton X-100 und n-Octyl-β-D-Glucosid solubilisiert. Hierdurch kommt es -ohne feststellbare Enzym-Denaturierungserscheinungen- zum Verlust des festgebundenen Ubichinon-8 in der QH-Bindestelle (1.3) [22; 59]. Jedoch hat die Anwesenheit des Chinons in Oxidasepräparationen, die nur mit Dodecylmaltosid durchgeführt werden, einen deutlichen Einfluss auf die Einzelumsatz- (single-turnover) Oxidationskinetik der vollständig reduzierten Oxidase erbracht [148]. Das festgebundene Chinon könnte als „Zwischenspeicher“ für das zweite Elektron, das vom Ubichinol-8 übertragen wird, in Form eines Semichinon-Radikals dienen [19; 20; 149]. Bei Abwesenheit des Chinons könnten nur drei Elektronen zur Reduktion des Sauerstoffs zur Verfügung stehen und das Cyt bo3 würde im Zustand des Ferryl-Intermediats des Katalysezyklus stehen bleiben („F“ in Abb. 1.2.3) [148]. Gegen diese Annahme, dass das Cyt bo3 nach der Photo- und Auto-Photoreduktion ebenfalls im 108 Diskussion ____________________________________________________________________________________________________________________________________________________ Zustand des Ferryl-Intermediats vorliegt, sprechen die VIS-spektroskopischen Ergebnisse. Hierbei findet eine Reduktion des Cyt bo3 statt, die deutliche Übereinstimmungen zwischen Natriumdithionit reduzierten (Abb. 3.1.7), caged electron reduzierten (s. Begleittext zu 3.4.1) [29] und auto-photoreduzierten VIS-Spektren (Abb. 3.4.4) aufweist. Im Falle der caged electrons überträgt das Flavinsemichinon (F* in Abb. 1.5.3) solange Elektronen an das Cyt bo3 , bis dieses vollständig reduziert ist. Da das PR- und APR-Differenzspektrum (Abb. 3.4.1) ebenfalls deutliche Übereinstimmungen erkennen lässt, kann ebenfalls für die Auto-Photoreduktion, die im nächsten Unterpunkt (4.3) behandelt wird, von einem vollständig reduzierten Cyt bo3 nach Belichtung ausgegangen werden. Jedoch scheint das fehlende Ubichinon-8 möglicherweise einen Einfluss auf die Bandenposition der ν(C=O)-Schwingungen des Glu-286 im FT-IR- Differenzspektrum zu besitzen. In Puustinen et al., 1997 [150] wird für diese Aminosäure eine Differenzbande bei 1731/1724 cm-1 aus dem CO-Differenzspektrum, bei Hellwig et al., 1999 [90] eine Differenzbande bei 1746/1720 cm-1 aus dem elektrochemisch induzierten Differenzspektrum gefunden. Das Glu-286 bzw. das homologe Gegenstück in verwandten Enzymen ist eine hoch konservierte Aminosäuren innerhalb der Familie der Häm-Kupfer Oxidasen. Sie befindet sich im D-Kanal des Cyt bo3 (Abb. 1.2.2) und spielt eine wichtige Rolle im katalytischen Mechanismus des Enzyms, sowohl bei der Sauerstoffreaktion [151] als auch beim Protonentransport [102]. Das Glu286 liegt sowohl im oxidierten als auch im reduzierten Zustand des Cyt bo3 protoniert vor [29; 150]. Der beim Redoxübergang des Cyt bo3 beobachtete konformative Wechsel der Seitenkette des Glu-286 konnte in den PR-Differenzspektren der Differenzbande mit einem Minimum bei 1745 cm-1 und einem Maximum bei 1735 cm-1 zugeordnet werden [29]. Die positive Bande wird dem vollständig reduzierten Zustand des Cyt bo3 zugeschrieben, die negative Bande dem vollständig oxidierten Zustand. Dabei befindet sich die Seitenkette im reduzierten Zustand in einer hydrophileren Umgebung als im oxidierten Zustand [29]. Der Isotopenaustausch an protonierbaren Gruppen des Cyt bo3 von 1 H nach 2 H wurde in dieser Veröffentlichung [29] durch den Austausch von H2 O- auf D2 O-haltigen Puffer und anschließender Konzentrierung durch Ultrakonzentratoren erreicht. Bei den anschließenden flüssigphasen IR-Probenpräparationen im Exsikkator, wurden die Oxidasenproben nicht zur Gänze eingetrocknet und einmal 5h nach Fertigstellung, im anderen Falle 2 Tage nach Lagerung bei –20°C vermessen. Dabei wurde eine Bandenverschiebungen der positiven Differenzbande um 8 cm-1 zu kleineren Wellenzahlen auf 1727 cm-1 beobachtet. Weder bei kurzer noch bei langer Lagerung der IR-Proben konnte eine deutliche Verschiebung des Minimums bei 1745 cm-1 beobachtet werden. Der Isotopenaustausch nach längerer Probenlagerung hatte jedoch eine Signalintensivierung bei 1727 cm-1 zur Folge, bei 109 Diskussion ____________________________________________________________________________________________________________________________________________________ gleichzeitigem nahezu vollständigem Signalrückgang der 1735 cm-1 Bande (Abb. 4.2.1, obere Darstellungen). Das Doppeldifferenzspektrum wies dabei einen asymmetrischen Verlauf auf. Die fehlende Verschiebung der 1745 cm-1 Bande wurde so interpretiert, dass eine unterschiedliche Wasserzugänglichkeit zum Glu-286 im oxidierten und reduzierten Zustand des Cyt bo3 vorliegt. Somit könnte dieser Aminosäure beim Redoxwechsel des Cyt bo3 eine Schalterfunktion beim Protonentransport im D-Kanal in Form einer hydrophoben Barriere zukommen. Abb. 4.2.1: PR-Differenzspektren vom pHCL-Wildtyp vor und nach Flüssigphasen- (oben, 4 cm-1 Auflösung) bzw. Gasphasen- (unten, 2 cm-1 Auflösung) H/D-Austausch und die daraus resultierenden H2 O minus D2 O Doppeldifferenzspektren (blau). Die Differenzspektren sind von 1780 cm-1 bis 1690 cm-1 dargestellt. Die oben gezeigten Flüssigphasen H/D-Austauschspektren sind nach Lübben et al., 1999 ([29]) modifiziert. Mit nahezu vollständig deuterierten IR-Proben (Abb. 3.3.2), die mit der Gasaustauschzelle hergestellt wurden, konnte das Postulat der unterschiedliche Wasserzugänglichkeit am Glu-286 beim Redoxwechsel des Cyt bo3 nicht bestätigt werden. Das Glu-286 liegt nach dem Gasphasen H/D-Austausch auch im oxidierten Zustand des Cyt bo3 in Wasserstoffbrücken- bzw. Deuteriumbrückenbindung vor, da die negative Bande bei 1745 cm-1 um 8 cm-1 nach 1737 cm-1 verschiebt (Abb. 3.3.3; Abb. 4.2.1, untere Spektren). Das Doppeldifferenzspektrum zeigt hierbei einen symmetrischen Verlauf, der somit keine unterschiedliche Wasserzugänglichkeit belegt. Der Gasphasen H/D-Austausch stellt eine gegenüber dem Flüssigphasen H/D-Austausch drastische Probenpräparationsmethode dar, da das Cyt bo3 im Unterdruck vollständig eingetrocknet wird und erst anschließend die Wiederbefeuchtung mit D2 O erfolgt. Ein 1 H nach 2 H Austausch wird also förmlich „erzwungen“. Der asymmetrische Bandenverlauf des flüssigphasen PRDoppeldifferenzspektrums und die fehlende, wässrige reduzierte Bande bei 1735 cm-1 im D2 O110 Diskussion ____________________________________________________________________________________________________________________________________________________ Differenzspektrum deuten bei der schonenderen Flüssigphasen H/D-Austauschmethode jedoch eindeutig auf eine unterschiedliche Wasserzugänglichkeit des Glu-286 im oxidierten und im reduzierten Zustand des Cyt bo3 hin. Unter nativen Bedingungen, d.h. die Wassermoleküle werden nicht vollständig aus der Cyt bo3 Probe entfernt, lässt sich das Postulat der hydrophoben Barriere des Glu-286 beim Protonentransport im D-Kanal folglich aufrecht erhalten. 4.2.2 Der konformative Wechsel der Seitenkette des Glutamat-286 von Cyt bo3 ist an die Reduktion des Häm B gekoppelt Es wird nun nachgewiesen, dass der konformative Wechsel des Glu-286 mit dem Redoxübergang des low-spin Häms einhergeht und nicht an den Redoxübergang des high-spin Häms bzw. des CuB gekoppelt ist. Den Ubichinol Oxidasen, wie z.B. Cyt bo3 fehlt das CuA-Zentrum in Untereinheit II (1.2, 1.3). Somit kann CuA nicht am konformativen Wechsel des Glu-286 beteiligt sein. Das PRDifferenzspektrum der CuB defizienten Y288F- Mutante [104; 105] weist die ν(C=O)-Differenzbande des Glu-286 bei 1745/1735 cm-1 auf (Abb. 3.3.4). Somit ist ebenfalls CuB nicht am konformativen Wechsel des Glu-286 beteiligt. Das high-spin Häm kann weiterhin als Ursache für diesen Wechsel ausgeschlossen werden. Wenn Cyanid als externer Ligand für das binukleare Zentrum zum Cyt bo3 zugesetzt wird, dann ist das high-spin Häm selektiv für einen Redoxübergang blockiert. Dennoch findet sich das Carbonyl-Differenzsignal des Glu-286 im PRDifferenzspektrum wieder (Daten nicht gezeigt) [29]. Den direkten Nachweis für die Beteiligung des low-spin Häms am konformativen Wechsel des Glu-286 konnte durch den Einsatz von mixed-valence Cyt bo3 -Proben erbracht werden [105]. Unter dem mixed-valence Zustand versteht man einen Redoxzustand bei Cytochrom Oxidasen, bei dem das binukleare Zentrum reduziert und CO-gebunden, das low-spin Häm jedoch oxidiert vorliegt. Dieser Zustand ist bei der Probenpräparation durch eine CO-Atmosphäre unter Sauerstoffausschluss zu erhalten. Der mixed-valence Redoxzustand liegt folglich zwischen der vollständig oxidierten Form und vollständig reduzierten Form bei Cytochrom Oxidasen. Bei Zugabe von caged electrons zu einer mixed-valence Probe kann nur noch das low-spin Häm des Cyt bo3 reduziert werden, da das binukleare Zentrum bereits reduziert vorliegt. Wird nun eine solche Probe belichtet, dann erscheint im PR-Differenzspektrum die Carbonyl-Differenzbande des Glu286 in ihrer typischen Signalintensität und Position. Der Redoxübergang des low-spin Häms ist folglich dierkt für den konformativen Wechsel des Glu-286 verantwortlich. Die unter 3.3.3 erhaltenen Ergebnisse und die in diesem Unterpunkt gegebenen Interpretationen werden in einem Modell zusammengefasst (Abb. 4.2.2). Hierbei kommt der konservierten Car111 Diskussion ____________________________________________________________________________________________________________________________________________________ bonylgruppe des Glu-286 eine wichtige Rolle beim Protonentransport innerhalb des Cyt bo3 zu. Anzumerken ist jedoch, dass diese Aminosäure nur in Häm-Kupfer Oxidasen von mesophilen Bakterien strikt konserviert ist. In einigen Häm-Kupfer Oxidasen von thermophilen Bakterien, wie z.B. Sulfolobus acidocaldarius (CoxB) und Thermus thermophilus fehlt diese Aminosäure, dennoch werden Protonen bei der Atmung über die Cytoplasmamembran transloziert [155; 156]. Dies ist qualitativ ebenfalls bei mesophilen ortsspezifischen Oxidasemutanten an dieser Position, wie z.B. E286Q zu beobachten. Jedoch geht der quantitative Protonentransport drastisch zurück [157; 158]. In der Regel muss bei dem Protonentransfer eine Aktivierungsbarriere überwunden werden, die bei den thermophilen Bakterien aufgrund der hohen Temperatur ihrer Umgebung erreicht werden könnte. Bei niedrigeren Temperaturen könnte sich diese thermische Überwindung der Aktivierungsbarriere als ineffektiv erweisen und würde einen zusätzlichen „Beschleuniger“ erfordern. Beispielweise wäre eine protonierte Carboxylatgruppe, die einen konformativen Wechsel beim Redoxübergang des Proteins durchläuft, dazu geeignet. Abb. 4.2.2: Mögliches schematisches Model, das die Rolle des protonierten Glu-286 beim Protonentransport im DKanal des Cyt bo 3 erklären könnte. Der Elektronentransfer zur Reduktion des low-spin Häm B leitet die Umorientierung der Carboxylatgruppe ein, wodurch die beiden dargestellten Halbkanäle des D-Kanals überbrückt werden. Die Abb. ist nach Lübben et al., 1999 [29] modifiziert. Wenn die Carboxylatgruppe des Glu-286 in den Protonentransport involviert ist, dann müssten sich hieraus definierte redox-abhängige Umgebungsänderungen ergeben, wie sie hier beobachtet wurden. Aus molekulardynamischen Berechnungen wurden für Glu-286 zwei strukturell unterschiedliche, energetisch jedoch äquivalente Konformationen postuliert [159; 160]. Somit könnte die Elektronenaufnahme des low-spin Häms die Umorientierung der Seitenkette von Glu-286 steuern und die Energie zur Überwindung der Aktivierungbarriere liefern. Im Cyt bo3 könnte dem Glu-286 damit eine Schalterfunktion zukommen, die den Protonentransfer beschleunigt. Dieser Protonentransfer ist an die Elektronenaufnahme des low-spin Häm B gekoppelt. 112 Diskussion ____________________________________________________________________________________________________________________________________________________ 4.3 Auto-photoreduktions-induzierte FT-IR Differenz-Spektroskopie an Cyt bo3 In diesem Unterpunkt werden die Ergebnisse interpretiert, die unter 3.4 beschrieben sind. Da die erhaltenen APR-Differenzspektren sehr komplex zusammengesetzt sind und sich dadurch für die einzelnen Banden häufig mehrere Interpretationsmöglichkeiten ergeben, ist es schwierig eine konkrete und einfache Modellvorstellung der beobachteten spektralen Änderungen zu entwickeln. Zusätzlich werden diese Modellvorstellungen dadurch erschwert, dass von Extinktionsbanden eines zweidimensionalen Spektrums auf die räumliche Veränderung der betrachteten individuellen Atomgruppen innerhalb des Proteins zurückgeschlossen werden soll. Daher werden die Ergebnisse im diesem Diskussionsteil in drei weitere Unterpunkte unterteilt: (I) Allgemeine Hinweise zur auto-photoreduktions-induzierten FT-IR Redox-Differenzspektroskopie (4.3.1). In diesem Unterpunkt wird zusätzlich auf Problematiken bei der Expression von 13 C- isotopenmarkierten Hämpropionaten des Cyt bo3 im E. coli Stamm S730 eingegangen. (II) Spektrale Änderungen von ortsspezifischen Cyt bo3 Mutanten (4.3.2). Da sich mit der neu eingeführten APR-Differenzspektroskopie im Vergleich zur PR-Differenzspektroskopie umfangreichere Wellenzahlenbereiche erschließen, war es zunächst das vorrangige Ziel, eine umfassende Spektrensammlung von den bereits in der Arbeitsgruppe vorhandenen Cyt bo3 Mutanten zu erstellen. Die beobachteten spektralen Änderungen werden daher, wie z.B. bei der F391QMutante, relativ isoliert und kurz vorgestellt. (III) Carbonylschwingungen der Hämpropionsäuren des Cyt bo3 (4.3.3). 4.3.1 Allgemeine Hinweise zur auto-photoreduktions-induzierten FT-IR Redox-Differenzspektroskopie Die in diesem Unterpunkt vorgestellte APR-Differenzspektroskopie ist nicht in der Literatur beschrieben und die erhaltenen APR-Differenzspektren können mit Literaturspektren, die bei ihrer Erstellung auf caged compounds angewiesen sind (z.B. [29; 81; 130]), nur bedingt verglichen werden (Abb. 3.4.1). Die Cyt bo3 Differenzspektren, die mit der elektrochemischen Zelle erhalten wurden, zeigen jedoch im Bereich von 1800-1200 cm-1 häufig eine nahezu unveränderte Bandenposition zu den hier ermittelten APR-Differenzspektren (Abb. 3.4.3) [90]. Aus den in Abb. 3.4.1 verglichen lichtinduzierten PREntwicklungen können drei Schlussfolgerungen getroffen und APR-Differenzspektrenwerden: (I) Die APR- Differenzspektroskopie ermöglicht es das Cyt bo3 in spektralen Bereichen auch unterhalb von 1630 cm-1 zu untersuchen. (II) Da beide verglichenen Differenzspektren-Entwicklungen auch eine Vielzahl gemeinsamer Bandenpositionen aufzeigen, liegt ein ähnliches bzw. gleiches Re113 Diskussion ____________________________________________________________________________________________________________________________________________________ doxverhalten des Cyt bo3 vor. Die erhaltenen Differenzspektren können unmittelbar in den nicht von den EDTA-Oxidationsprodukten überlagerten Wellenzahlenbereichen verglichen werden. (III) Nach den in Abb. 3.4.4 dargestellten Absolutspektren des Cyt bo3 ist die Oxidase nach Auto-Photoreduktion über einen pH-Bereich von 4,0-9,0 nahezu vollständig reduzierbar und der Reduktionsprozess bleibt weder in einem Intermediat des Reaktionszyklus stehen (vergleiche 4.2.1), noch ist es dabei zu einer relevanten CO-Freisetzung und damit verbundenen Proteindenaturierungen gekommen. Das primäre Ziel, sowohl Probenpräparations- als auch Messbedingungen zu finden, die reproduzierbare, über große Wellenzahlenbereiche (2000-1100 cm-1 ) auswertbare APR-Differenzspektren ermöglichen, konnte erfüllt werden (Abb. 3.4.2). Hierbei sind zwischen den pHCLund pIN-Differenzspektren nur unwesentliche Unterschiede festzustellen, die es somit erlauben, die Spektren von Cyt bo3 Mutanten, die auf pHCL basieren, auch mit dem pIN-Wildtyp Differenzspektrum und umgekehrt zu vergleichen (3.4.3). Die vier Untereinheiten des Cyt bo3 bestehen aus rund 1250 Aminosäuren und entsprechend hoch ist die Anzahl der Peptidbindungen. Diese Tatsache führt letztendlich zu IR-Spektren, die nur eine qualitative Auswertung der Amid I-Region zulassen (s. Begleittext zu Abb. 3.4.2). Eine quantitative Auswertung, wie z.B. für konformative Wechsel bei Sekundärstrukturmotiven, für die die Amid I-Region indikativ sein kann, können auch zukünftig nicht getroffen werden. Da in der PR-Differenzspektroskopie bislang im Wesentlichen nur der Spektralbereich oberhalb von ca. 1690 cm-1 zur Auswertung zur Verfügung stand, mussten sich die zur APR-Differenzspektroskopie erarbeiteten Qualitätskriterien an diesen PR-Spektren orientieren. Da nunmehr die Anwendbarkeit der APR-Spektroskopie für die Cyt bo3 Wildtypen und deren Mutantenproteine belegt ist, können für weitere Untersuchungen ebenfalls Qualitätskriterien für die in dieser Arbeit ausgeschlossene Amid II-Region ausgearbeitet werden. Dabei sollte darauf geachtet werden, dass der Bereich unterhalb der Amid-Regionen ebenfalls hohe Resttransmissionen aufweist (Abb. 3.4.2), so dass eine erhöhte Proteinmenge unter Umständen wieder eingesetzt werden kann. Dies könnte das Signal zu Rausch Verhältnis in diesem Bereich entscheidend verbessern, wobei eine Auswertung der Carbonylregion dann wieder nur bedingt möglich ist. Bei der Expression des pIN-Plasmids im E. coli Stamm S730 (Tab. 2.1.1) können bei Zusatz von [1- 13 C]-ALV die C1 -Atome der Hämpropionate des Cyt bo3 isotopenmarkiert werden. Dabei zeigen die VIS-Spektren keine, die Durochinolaktivitäten des isotopenmarkierten pIN-Wildtyps nur geringe Abweichungen im Vergleich zur unmarkierten Referenz (Abb. 3.4.7). Es konnten bei gleichen Fermentationsbedingungen jedoch nur rund 10% Cyt bo3 im Vergleich zum pINWildtyp erhalten werden, der in BL21 ∆cyo recA- exprimiert wurde. Da bereits ein Dutzend 114 Diskussion ____________________________________________________________________________________________________________________________________________________ Milligramm des [1- 13 C]-ALV mehrere hundert Euro kosten, ist jeglicher Verlust von dem spezifisch markiertem Cyt bo3 bedauernswert. E. coli S730 pIN weist nur rund 1/5 der Zellausbeute und damit eine niedrigere Cyt bo3 Proteinausbeute pro Liter LB-Medium gegenüber BL21 ∆cyo recA- pIN auf (3.4.3). Die Cyt bo3 -Ausbeute wird zusätzlich durch die Plasmidinstabiltät dieses Bakterienstamms erniedrigt und die vom genomischen cyo-Operon kodierte Oxidase muss bei der Proteinreinigung ebenfalls verworfen werden (Abb. 3.4.7 und 4.1.1). Ursprünglich sollte mit diesem E. coli Stamm auch eine 13 C-Isotopenmarkierung der Cyt bo3 Tyrosine vorgenommen werden, die dann beispielsweise mit der ebenso isotopenmarkierten Y288F-Mutante verglichen werden sollten. Diese Mutante weist, wie bei anderen Cyt bo3 -Mutanten ebenfalls zu beobachten ist, eine geringere Proteinexpressionsrate gegenüber dem Wildtyp auf (Daten nicht gezeigt). Dies würde wiederum zu einer noch geringeren Proteinausbeute bei gleichem Anzuchtvolumen führen. Da zusätzlich reversible Teildenaturierungen aufgrund der Detergenzanreicherung während der Proteinreinigung des pIN-Wildtyps auftreten (Abb. 3.4.8), sollte dieser Bakterienstamm nicht mehr weiter verwendet werden. Stattdessen sollte der bereits zur Cyt bo3 Expression benutzte Stamm BL21 ∆cyo (recA-) weiter gentechnisch verändert werden, z.B. durch Phagentransduktion (P1 -Transduktion). Um das hemA30-Gen [37] bzw. die entsprechenden Gene für die Aminosäurebiosynthesewege von z.B. Tyrosinen (tyrA2) [96] im Genom zu inaktivieren, muss zwar ein relativ großer Aufwand betrieben werden, dieser wäre jedoch prinzipiell ebenfalls zur Inaktivierung des recA-Gens im S730 Stamm notwendig gewesen (vergleiche 4.1.1). Der Vorteil den E. coli Stamm BL21 ∆cyo recA- (mit entsprechenden Defekten in den Biosynthesewegen) auch weiterhin als Grundlage zur homologen Expression des Cyt bo3 und dessen Mutanten zu verwenden, liegt darin, dass der anschließende Aufwand zur Charakterisierung des erhaltenen Proteins deutlich vermindert würde. Die bereits vorliegenden Daten zur Expression, Proteinreinigung, VIS- und FT-IR-spektroskopischen Charakterisierung des Cyt bo3 sowie dessen Mutantenproteine, könnten prinzipiell mit der im neuen Expressionsstammkonstrukt exprimierten Oxidase verglichen werden und eine erneute Datensammlung, wie sie z.B. bei anderen E. coli Expressionsstämmen notwendig wäre, müsste nicht durchgeführt werden. 4.3.2 Spektrale Änderungen von ortsspezifischen Cyt bo3 Mutanten Absorptionsänderungen der E286D-Mutante Bei der Asp-286 Mutante ist in der Seitenkette die Carboxylfunktion erhalten, jedoch im Vergleich zum wildtypischen Glu-286 um eine CH2 -Gruppe verkürzt. Diese Mutante zeigt wildtypische Durochinol-Oxidaseaktivität (Tab. 3.2.6). Im APR-Differenzspektrum fehlt die dem Glu286 zugeordnete Differenzbande der Carbonyl-Streckschwingung bei 1745/1735 cm-1 und statt115 Diskussion ____________________________________________________________________________________________________________________________________________________ dessen findet sich ein invertiertes, in seinen Intensitäten stark erniedrigtes CarbonylStreckschwingungssignal bei 1767/1762 cm-1 wieder (Abb. 3.4.12). Diese Differenzbande verschiebt beim H/D-Austausch um 7 cm-1 zu kürzeren Wellenzahlen (1760/1755 cm-1 ) und kann somit einer ν(C=O)-Schwingung zugeordnet werden. Dies bedeutet, dass das Mutantenprotein im Prinzip den gleichen konformativen Wechsel an dieser Aminosäureposition wie der Wildtyp durchläuft und sich ebenfalls in einer H-Brückenwechselwirkung mit der Umgebung befindet. Hierbei finden sich jedoch bezüglich der H-Brückenbindung die umgekehrten Verhältnisse gegenüber dem Wildtyp, d.h. im oxidierten Zustand (negative Bande bei 1762 cm-1 ) befindet sich die Carboxylgruppe in einer hydrophoberen Umgebung als im reduzierten Zustand (positive Bande bei 1767 cm-1 ). Dieses Verhalten der Asp-Mutante konnte bereits bei den CO-Dissoziationsspektren beobachtet werden [150]. In dem Strukturmodell des Cyt aa3 -Wildtyps aus Rhodobacter sphaeroides ist ein Wassermolekül über eine H-Brücke mit Glu-278 (Glu-286 bei Cyt bo3 ) verbunden [157]. In der energieminimierten berechneten Struktur der E278A/I104E Doppelmutante des Cyt aa3 ist dieses Wassermolekül in den vormals von der Seitenkette des Glu278 besetzten Zwischenraum verschoben [157]. Eine solche Verschiebung eines Wassermoleküls könnte ebenfalls bei der E286D-Mutante von Cyt bo3 vorliegen und die verkürzte Carboxylgruppe der Asp-Mutante würde nicht direkt an der Protonenleitung beteiligt sein. Dies könnte sowohl die erniedrigte Intensität als auch die invertierte Differenzbande erklären. Im Wellenzahlenbereich unterhalb der Amid-Regionen fehlt in dem pH 8,0-APR- Differenzspektrum der E286D-Mutante eine positive Bande bei 1198 cm-1 und es lassen sich Veränderungen um 1367 cm-1 finden (Abb. 3.4.12). Diese sind im entsprechenden pD-Spektrum nicht vorhanden. Demnach könnte es sich um δ(COH)-Beugeschwingungen (1367 cm-1 ) und ν(C-O)-Streckschwingungen (1198 cm-1 ) des Glu-286 handeln. Da die Asp-Mutante nur indirekt an der Protonenleitung beteiligt ist und sich dementsprechend die Signalintensitäten erniedrigen, können die verschobene Signale vom E286D nicht wiedergefunden werden. Absorptionsänderungen der F391Q-Mutante Es wird nur auf die in ihren Signalintensitäten verstärkte negative Bande bei 1262 cm-1 eingegangen (Abb. 3.4.13), da keine plausible Erklärung für den Signalrückgang bei der Skalierungsbande um 1696/1691 cm-1 gefunden werden konnte. Die pIN-Wildtypspektren zeigen in den unterschiedlichen pH-Differenzspektren eine negative Extinktionsbande bei 1260 cm-1 , die nur eine sehr geringe Verschiebung beim H/D-Austausch zeigt (Abb. 3.4.5). Diese Bande ändert ihre Lage nur geringfügig im F391Q- und im ∆cyoEDifferenzspektrum, ihre Intensitäten nehmen jedoch deutlich zu (Abb. 3.4.10 und Abb. 3.4.13). In den isotopenmarkierten Wildtyp-Differenzspektren ist das Signal um 10 cm-1 zu kürzeren 116 Diskussion ____________________________________________________________________________________________________________________________________________________ Wellenzahlen verschoben (Abb. 3.4.8). Diese Verschiebung fällt weniger stark aus als bei einem 13 C-Austausch zu erwarten ist und diese Bande liegt in einem für eine ν s(COO-)- Streckschwingung eher untypischen Bereich. Der isotopenmarkierte pIN-Wildtyp, exprimiert in S730, zeigt eine unbefriedigende Spektrenqualität (Detergenzeinfluss) im Wellenzahlenbereich innerhalb und unterhalb der Amid-Regionen. Im 13 C-pIN-Wildtypspektrum weist die Amid II - Region (1560-1520 cm-1 ) deutlich verschobene Bandenpositionen zum Referenzspektrum auf. Das Extinktionssignal bei 1250 cm-1 liegt im Bereich der Amid III-Region (1330-1230 cm-1 ) und es könnte sich somit um eine Amidbande handeln. Dies könnte ebenfalls die Signalintensivierung der negativen Bande bei 1262 cm-1 sowohl im F391Q- als auch ∆cyoE-Differenzspektrum erklären, da beide Mutanten eine Veränderung am high-spin Häm an annährend gleicher Position in der Cyt bo3 -Struktur aufweisen. Das Phe-391 liegt in unmittelbarer Nachbarschaft zum Hydroxyethylfarnesylrest und der Methylgruppe des B-Rings des high-spin Häms (Abb. 1.2.4). Es ist von den hydrophoben Aminosäuren Ile-385, Trp-366, Phe-295 und Ile-283 und der aliphatischen Aminosäure Thr-359 umgeben. Ein Aminosäureaustausch vom Phe zum hydrophilen Gln könnte in diesem Bereich eine starke Auswirkung auf die Cyt bo3 -Struktur besitzen, ähnlich wie die fehlende Hydroxyethylfarnesylgruppe der ∆cyoE-Mutante. 4.3.3 Carbonylschwingungen der Hämpropionsäuren des Cyt bo3 In Abb. 4.3.1 sind die wesentlichen Ergebnisse aus 3.4.2 und 3.4.3 für den Carbonylbereich der Cyt bo3 APR-Differenzspektren nochmals in einer einzigen Darstellung zusammengefasst. Abb. 4.3.1: APR-Differenzspektren im Carbonylbereich von 1780-1665 cm-1 . Das pD 5,0-Spektrum ist lediglich bis 1670 cm-1 gezeigt. Grau unterlegte Flächen entsprechen Extinktionsdifferenzen zwischen dem pINWildtypspektrum und dem ∆cyoE-Mutantenspektrum bzw. gelb unterlegte Flächen zwischen dem pIN- und dem isotopenmarkiertem pIN-Wildtypspektrum. Zusätzlich sind die Extinktionsnulllinien eingezeichnet. 117 Diskussion ____________________________________________________________________________________________________________________________________________________ Extinktionsänderungen im Wellenzahlenbereich von ca. 1730-1704 cm -1 Im Wellenzahlenbereich von ca. 1730-1704 cm-1 findet sich eine breite, positive Bande, die dem low-spin Häm B zugeordnet wird (Abb. 3.4.9 und Abb. 3.4.11). Dieses schwach ausgeprägte, in seinen Intensitäten leicht variable Carbonylsignal weist bei pH 8,0 ein Extinktionsmaximum um 1722 cm-1 auf und wird von den Signalen der Differenzbande des Glu-286 (1745/1735 cm-1 ) und der Skalierungsbande bei 1696/1691 cm-1 flankiert (Abb. 3.4.6; Abb. 4.3.1, schwarzes Spektrum). Ein vergleichbares FT-IR Differenzsignal konnte bei der P. denitrificans aa3 Oxidase nicht gefunden werden [89; 132; 134]. Im gesamten Carbonylbereich der Cyt bo3 APRDifferenzspektren ist kein entsprechendes negatives Signal einer ν(C=O)-Schwingung zu erkennen. Das Minimum bei 1678 cm-1 kommt als korrelierende Carbonylschwingung nicht in Betracht, da insbesondere das Differenzspektrum der ∆cyoE Mutante statt einer negativen Signalintensivierung an dieser Position eine stark positive, unterlagerte Bande zeigt. Es handelt sich demnach um keine low-spin Hämpropionat-Bande5 . Hieraus kann abgeleitet werden, dass beim Redoxwechsel des Enzyms eines der beiden Hämpropionate des low-spin Häms zumindest zum Teil protoniert wird und folglich im oxidierten Zustand des Cyt bo3 in der Carboxylat-Form (COO-), im reduzierten Zustand in der Carboxyl-Form (COOH) vorliegen müsste. Das Extinktionsmaximum verschiebt in Abhängigkeit vom pH-Wert zu größeren Wellenzahlen auf bis zu 1727 cm-1 bei pH 5,0 (Abb. 3.4.6; Abb. 4.3.1, grünes gestrichelte Spektrum). Diese beiden Maxima verschieben nach dem H/D-Austausch bei entsprechenden pD-Werten um 8-9 cm-1 und finden sich bei 1714 cm-1 (pD 8,0) bzw. 1718 cm-1 (pD 5,0) wieder. Das low-spin HämCarbonylsignal könnte demnach bei höheren pH-Werten in eine hydrophobere Umgebung wechseln oder in einer anderen Kopplung zu einer benachbarten funktionellen Gruppe vorliegen. Eine pKs-Wert Änderung kommt ebenfalls in Betracht, wobei für eine höher gelegene Bandenposition ein höherer pKs-Wert indikativ ist [161]. Diese breite, positive Bande von ca. 1730-1704 cm-1 verschiebt in den isotopenmarkierten pIN-Wildtypspektren zu kürzeren Wellenzahlen und das Maximum kommt bei ca. 1684 cm-1 bei pH 8,0 bzw. vermutlich bei ca. 1676 cm-1 bei pD 8,0 (Abb. 3.4.9; Abb. 4.3.1 rote Spektren) zu liegen. In den entsprechenden Differenzspektren der ∆cyoE-Mutante lassen sich deutliche Intensitätszunahmen bei dem Hämcarbonylsignal feststellen, ohne dass sich die Position des Maximums hierbei ändert (Abb. 3.4.11; Abb. 4.3.1 blaue Linien). Dies wird als grundlegender Ge5 Die ∆cyoE-Mutante weist anstelle des Häm O ein Häm B in der high-spin Hämbindetasche auf (Abb. 3.1.6) [100]. Es liegt ein in seinen VIS-spektroskopischen und kinetischen Eigenschaften stark verändertes binukleares Zentrum vor (Abb. 3.2.1; Abb. 3.2.2; Tab. 3.2.5). Unter der Annahme, dass nur das falsch eingebaute high-spin Häm B in den VIS-Spektren zur beobachteten Minima- bzw. Maxima-Verschiebung beiträgt wird dies, als grundsätzliche Überlegung auf die IR-Spektroskopie übertragen. Ändert sich die Lage des Maximums bzw. des Minimums der betrachteten Bande nicht, so wird sie dem low-spin Häm zugeschrieben (eine Intensitätsveränderung darf eintreten). Bei Verschiebung wird sie dem high-spin Häm zugeordnet. 118 Diskussion ____________________________________________________________________________________________________________________________________________________ danke benutzt, dieses Signal dem low-spin Häm zuzuordnen. Dieses Hämpropionat liegt demnach stärker protoniert vor. Die Hydroxyethylfarnesylgruppe des Häm O bzw. Häm A bei Cyt c Oxidasen (Abb. 1.2.4) spielt vermutlich eine spezifische Rolle beim Protonentransport [62; 162165]. Falls durch den Fehleinbau eines Häm B in der high-spin Hämbindetasche im Cyt bo3 eine Protonenleitung über das high-spin Häm verhindert wird, könnte sich dies ebenfalls auf das lowspin Häm auswirken, dessen Propionate ebenso dem D-Kanal und somit der Protonenleitung zugerechnet werden (Abb. 1.2.2) können. Eine Weiterführung dieser Gedanken wird wieder unter 4.3.2.1 aufgenommen. Extinktionsänderungen im Wellenzahlenbereich von ca. 1690-1670 cm -1 Im Wellenzahlenbereich von ca. 1690-1675 cm-1 findet sich eine Differenzbande, die ein vom pH-Wert unabhängiges Extinktionsmaximum um 1685 cm-1 und ein Extinktionsminimum um 1678 cm-1 aufzeigt. Die Differenzbande wird von Differenzsignalen der Skalierungsbande bei 1696/1691 cm-1 und Banden der Amid I-Region (ca. 1680-1620 cm-1 ) flankiert (Abb. 3.4.6; Abb. 4.3.1, schwarze Spektren). Bei dem Cyt aa3 aus P. denitrificans konnte ein negatives Carbonylsignal bei 1676 cm-1 dem A-Ring Hämpropionat zugeordnet werden [89; 134]. Eine positive Bande war in diesen Spektren nicht zu ermitteln, jedoch befindet sich dieses Signal ebenfalls im Einflussbereich der Amid I-Region und könnte demnach nicht aufgelöst werden. So wird die negative Extinktionsdrift bei den pH- bzw. pD-5,0 Cyt bo3 -Differenzspektren (Abb. 3.4.6; Abb. 4.3.1, grüne Spektren) vermutlich durch pH-abhängige Signaländerungen der Amid I-Region ausgelöst. Da die Gesamtausprägung des Differenzsignals jedoch vergleichend zum pH/pD 8,0 Spektrum im Wesentlichen erhalten bleibt, liegt sehr wahrscheinlich keine Protonierungsänderung der Differenzbande vor. Das Extinktionsmaximum bei 1685 cm-1 verliert deutlich an Intensität beim H/D-Austausch und das Maximum bei 1675 cm-1 nimmt bei den pDSpektren in Korrelation dazu an Intensität gegenüber den pH-Spektren zu. Eine Verschiebung bei Deuterierung findet demnach um 10 cm-1 statt. Die pD-Spektren zeigen jedoch nach wie vor eine kleine, positive Bande mit einem Maximum bei 1685 cm-1 . Die Differenzbande bei 1685/1678 cm-1 verschiebt in den isotopenmarkierten pIN- Wildtypspektren vermutlich in die Amid I-Region und ist dort nicht mehr wiederzufinden (Abb. 3.4.9; Abb. 4.3.1 rote Spektren). Demzufolge handelt es sich um Hämpropionsäure-Signale. Jedoch ist die in den pD-Spektren deutlich erniedrigte, aber vorhandene Bande mit einem Maximum bei 1685 cm-1 nach H/D- und 12 C/13 C-Austausch ebenfalls nicht mehr zu finden. Es lässt sich höchstens eine leichte Schulter um 1685 cm-1 erkennen (Abb. 3.4.11; Abb. 4.3.1 blaue Spektren). Für das Zustandekommen dieses Signals sind mindestens drei Szenarien denkbar. (I) Bei der Differenzbande bei 1685/1678 cm-1 handelt es sich um ein einziges Carbonylsignal, 119 Diskussion ____________________________________________________________________________________________________________________________________________________ das nicht komplett beim H/D-Austausch deuteriert wird. Es bleibt eine „protonierte Restbande“ 12 erhalten, die erst im Zusammenspiel mit dem C/13 C-Austausch nahezu vollständig verschiebt. Gegen diese Annahme sprechen zwei Aspekte, zum einen findet unter den Bedingungen des gasförmigen H/D-Austausches an der Carboxylgruppe des Glu-286 eine nahezu komplette Deuterierung statt (4.2.1), zum anderen zeigt das pH 8,0-Differenzspektrum der ∆cyoE Mutante ebenfalls eine deutlich ausgeprägte Schulter bei 1685 cm-1 und es wäre demnach eine zweite unabhängige Bande. (II) Die Carbonylsignale sind aus zwei unterschiedlichen Banden zusammengesetzt, einer Differenzbande bei 1685/1678 cm-1 und einer positiven Bande mit einem Maximum bei 1685 cm-1 . Die Carbonylgruppen, die die Differenzbande bei 1685/1678 cm-1 erzeugen sind für den H/D-Austausch zugänglich, die Carbonylgruppe, die die zweite, unterlagerte Bande erzeugt jedoch nicht. Es bleibt beim 1 H nach 2 H-Austausch also eine protonierte zweite Bande im Spektrum erhalten, die erst nach 13 C-Isotopenaustausch verschiebt. (III) Die Extinkti- onssignale sind aus einem Carbonylsignal und einem stark verschobenen Carboxylatsignal zusammengesetzt. In solchen „Extremfällen“ ist eine Bandenposition der ν as(COO-) Schwingungen von z.B. Asp und Glu Seitenkettenresten möglich, die eine ähnliche Lage wie die ν(C=O) Schwingungen der COOH-Bande aufweisen [166]. Eine Verschiebung des Signals tritt erst bei 13 C-Isotopenaustausch auf. Der tatsächliche Ursprung dieses Extinktionssignals bleibt aus den ermittelten Daten jedoch unklar und soll hier nicht weiter betrachtet werden. In dem Differenzspektrum der ∆cyoE-Mutante bei pH 8,0 lässt sich eine deutliche Verschiebung des Maximums bei 1685 cm-1 erkennen. Es verschiebt nach 1680 cm-1 . Diese positive Bande kann somit einem der beiden Hämpropionate des high-spin Häm O zugeordnet werden. Bei der negativen Bande, die im pIN-Wildtypspektrum bei 1678 cm-1 liegt, ist eine solche Zuordnung nicht eindeutig, da sich das Signal in unmittelbarer Nähe und somit noch stärker im Einflussbereich der Amid I-Region befindet. Eine Verschiebung des Signals, wie sie z.B. beim H/D-Austausch zu erwarten ist, kann entsprechend nicht nachgewiesen werden. Da jedoch das Maximum bei 1675 cm-1 deutlich an Intensität gewinnt, scheint die negative Bande bei 1678 cm-1 ebenso zu verschieben und es würde sich demnach um ein weiteres high-spin Hämpropionsäure-Signal handeln. Beide Signale werden daher im weiteren dem high-spin Häm zugeordnet. Aus den hier vorgestellten Ergebnissen und Interpretationen können mindestens zwei mögliche Szenarien für die Protonierungszustände der high-spin Hämpropionate abgeleitet werden: (I) Die Differenzbande bei 1685/1678 cm-1 geht auf ein und dieselbe Hämpropionsäure zurück, die sowohl im oxidierten- als auch im reduzierten-Zustand des Cyt bo3 in der Carboxyl-Form (COOH) vorliegt und ähnlich wie Glu-286 Seitenkette einen konformativen Wechsel während 120 Diskussion ____________________________________________________________________________________________________________________________________________________ des Redoxübergangs des Cyt bo3 erfährt. (II) Beide high-spin Hämpropionate sind am Differenzsignal beteiligt, wobei das eine im oxidierten Zustand protoniert ist, das andere nicht. Beim Redoxübergang des Cyt bo3 gibt dann die eine Hämpropionsäure das Proton an die deprotonierte Carboxylatgruppe des zweiten Hämpropionats ab. Es findet somit ein Protonentransfer statt. In beiden Fällen könnte eine Differenzbande entstehen, wie sie in Abb. 4.3.1 zu sehen ist. Die zweite Möglichkeit, dass ein Protonentransfer von einer Hämpropionsäure zu einem benachbarten Hämpropionat erfolgt wird im weiteren bevorzugt, wie unter 4.3.3.2 dargelegt wird. Es soll nun versucht werden, aus den ermittelten Daten eine Modellvorstellung zur Protonenleitung an den Hämpropionaten während des Redoxübergangs des Cyt bo3 herzuleiten. Hierzu werden einerseits die möglichen Carbonyl- und Carboxylatschwingungen des low-spin Häms (4.3.3.1) und andererseits die des high-spin Häms (4.3.3.2) detaillierter betrachtet. In 4.3.3.3 wird dann das resultierende Modell vorgestellt. Um sich die räumliche Anordnung der Häme innerhalb der Cytochrom Oxidasen besser vorstellen zu können, sind in Abb. 4.3.2 die Hämkofaktoren des oxidierten Cyt bo3 und des mitochondrialen, oxidierten Cyt aa3 aus Bos taurus aus verschiedenen Blickwinkeln dargestellt. Die rötlich bzw. blau unterlegten Bereiche stellen Teilansichten des D- bzw. K-Kanals dar, in denen neben den Hämpropionaten einige dazugehörende Aminosäuren aufzeigt sind. In der Abbildung ausgesparte Aminosäuren der Protonenkanäle können durch Abb. 1.2.2 gedanklich ergänzt werden. Die Cyt aa3 -Struktur der bovinen Oxidase wurde aufgrund der höheren Auflösung von 2,3 Å gegenüber 2,7 Å bei der Cyt aa3 -Struktur der P. denitrificans Oxidase bevorzugt. Diese beiden Oxidasen unterscheiden sich in den dargestellten Aminosäuren lediglich darin, dass sich anstelle des Tyr-54 (B. taurus) das Trp-87 (P. denitificans) befindet. Die Angaben in Klammern beziehen sich im Folgenden auf die homologen Aminosäuren des Cyt aa3 aus P. denitrificans. Im Unterschied zu den Cyt aa3 Oxidasen aus B. taurus und P. denitrificans befindet sich anstelle des Asp-369 (Asp-404) das Asn-412 bei Cyt bo3 . Dieses befindet sich in unmittelbarer Nähe zu den Sauerstoffatomen O2A und O1D der high-spin Hämpropionate des A- und D-Rings. Es könnte somit sowohl eine negative Ladung von den Hämpropionaten als auch ein übertragenes Proton stabilisieren. Dem Asp-369 (Asp-404) in den Cyt c Oxidasen wird die Funktion als Mg-Ion-Ligand zugeschrieben (das Mg2+ ist in Abb. 4.3.2 nicht gezeigt) [24; 25]. In der Cyt bo3 -Struktur ist ein solches Mg-Ion nicht gefunden worden [22] und das Asn-412 könnte demnach als Ligand für die Hämpropionate dienen. 121 Diskussion ____________________________________________________________________________________________________________________________________________________ Abb. 4.3.2: Räumliche Anordnung der Häme innerhalb der Cytochrom Oxidasen. Die Strukturdarstellungen sind nach den Röntgenkristalldiffraktions-Koordinatendatensätzen von Cyt bo 3 (1FFT; 2,8 Å Auflösung) nach Abramson et al., 2000 [22] und von Cyt aa 3 (2OCC; 2,3 Å Auflösung) von Bos taurus nach Yoshikawa et al, 1998 [25] erstellt worden. Rötliche Flächen symbolisieren Teile des D-Kanals, blaue Flächen Teile des K-Kanals. Bei der Seitenansicht des low-spin Häms wurde auf die symbolisierte Darstellung der Protonenkanäle verzichtet. Die oben dargestellten Würfel, geben den ungefähren Blickwinkel auf die Darstellungen wieder. Zusätzlich sind die Ringbezeichnungen des Tetrapyrrolsystems und die Sauerstoffbezeichnungen der Hämpropionate eingezeichnet. „Außen“ = Periplasma; „Innen“ = Cytoplasma. Angaben in Klammern beziehen sich auf das Cyt aa 3 aus Paracoccus denitrificans und sind nur in der Aufsicht angegeben. Das low-spin Hämpropionat des D-Rings (Abb. 4.3.3) und das high-spin Hämpropionat des A-Rings (Abb. 4.3.4) werden unter anderem in der B. taurus Oxidase von Arg-438 und Arg-439 (Arg-473 und Arg-474) stabilisiert. Bei den Oxidasemutanten R473K und R474K von P. denitrificans konnte weder ein Verlust bei der Cyt c-Oxidaseaktivität noch ein Verlust bei der Protonenpump-Leistung festgestellt werden [134]. Demgegenüber werden bei den Cyt bo3 -Mutanten R482-N, -L, -Q und R481-N, -L, -Q bis zu 65% weniger Chinol-Oxidaseaktivität gefunden und die Mutanten R481-N und -L, sowie die Doppelmutante R481Q/R482Q zeigen darüber hinaus deutliche Verluste bei der Protonenpump-Leistung [167]. Diese Befunde und die in dieser Dissertation gezeigten zusätzlichen Carbonylschwingungen von den Hämpropionaten deuten darauf hin, dass im Cyt bo3 von E. coli ein anderer Protonentransferweg vorhanden sein könnte, als er in den Cyt c Oxidasen verwirklicht ist. Dies soll nun anhand der ermittelten FT-IR Daten gezeigt werden. 122 Diskussion ____________________________________________________________________________________________________________________________________________________ 4.3.3.1 Carbonyl- und Carboxylatschwingungen des low-spin Häms In Abb. 4.3.3 ist das low-spin Häm des Cyt bo3 und des bovinen Cyt aa3 aus drei räumlichen Perspektiven mit den Aminosäuren, die die Hämpropionate umgeben dargestellt. Abb. 4.3.3: Räumliche Anordnung der low-spin Häme des Cyt bo 3 und der bovinen Cyt c Oxidasen. Zur weiteren Erklärung s. Text von Abb. 4.3.2 . Die Aminosäure-Nummerierung ist, wenn nicht anders angegeben, auf das höher aufgelöste bovine Cyt aa3 bezogen. Das D-Propionat des low-spin Häms ist für die dargestellten Cytochrom Oxidasen durch Ladungswechselwirkungen mit dem Arg-438 (in Abb. 4.3.3 nicht gezeigt) und dem Arg-439 stabilisiert [168]. Weiterhin finden sich Wasserstoffbrücken von der εNHGruppe des Arg-439 und der NH-Gruppe der Peptidbindung von Trp-126 [15; 24] zum D-Propionat. Durch die Verbindung zum Arg-438 könnte das D-Propionat ebenfalls an der Protonenleitung beteiligt sein [167]. Ein Wassermolekül, dass in H-Brückenbindung mit dem D-Propionat des low-spin Häms und den Nε- und NH2 -Stickstoffen des Arg-438 steht ([24]; Abb.1), könnte somit ebenfalls eine Verbindung zum Protonentransportweg des high-spin Häms herstellen, da Arg-438 einen Protonendonor für das high-spin Häm darstellt [167]. Das A-Propionat des low-spin Häms ist seinerseits ebenfalls vom Arg-439 durch vermutlich die NH-Gruppe der Peptidbindung stabilisiert. Diese Aminosäure ist kein Bestandteil einer 123 Diskussion ____________________________________________________________________________________________________________________________________________________ α-Helix und entsprechend könnte sich eine H-Brücke zum Propionat ausbilden. Beim Cyt bo3 ist anstelle des Leu-41 (Leu 57) das Gln-83 vorhanden. Hierdurch kommt die NH-Gruppe der Seitenkette des Gln-83 in unmittelbare Nähe zu den low-spin Häm-Sauertsoffatomen des A-Propionats. Bei den Cyt c Oxidasen wird diese Rolle durch das Arg-38 (Arg-54) übernommen, das bei Cyt bo3 , wenn überhaupt, nur eine untergeordnete Funktion ausübt. In den Cyt c Oxidasen ist das A-Propionat in der Aufsicht rechts und links von den aromatischen Aminosäuren Tyr-54 und Tyr-371 (Trp-87 und Tyr-406) umgeben, und es müsste eine relativ starre Anordung dieses Propionats resultieren. Ein zusätzliches Proton könnte nur unzureichend stabilisiert werden. Beim Cyt bo3 hingegen ist das Tyr-371 (Tyr-406) durch Leu-414 ersetzt, und es resultiert ein Freiraum in der Elektronendichte. Das A-Propionat könnte demnach relativ variabel in seiner räumlichen Anordnung sein, je nachdem ob es in der Carboxylat- oder Carboxylform vorliegt. Die Hämpropionate sind beim Cyt bo3 gegenüber den aa3 Oxidasen versetzt (rote gepunktete Linie in Abb. 4.3.3). Dies könnte ebenso einen Hinweis geben, dass im Cyt bo3 im Vergleich zu den Cyt c Oxidasen ein andersartiger Protonentransferweg realisiert ist. Das A-Propionat des Cyt bo3 könnte ein geeigneter Kandidat zur Erklärung der breiten, positiven Carbonylbande bei 1730-1704 cm-1 sein. Die negative Ladung des Carboxylats könnte im oxidierten Zustand durch Gln-83, Tyr-99 und Arg-482 stabilisiert sein und die Seitenkette wäre „fixiert“. Nachdem die Protonierung beim Redoxwechsel des Cyt bo3 stattgefunden hat, könnte sich die Carboxylgruppe der Propionsäure in den Freiraum schieben und käme hierbei in der Nähe des unpolaren und hydrophoben Leu-414 zu liegen. Diese hydrophobe Umgebung würde die relativ hohe Wellenzahlpostion für eine Häm-Carbonylstreckschwingung erklären. Durch den Freiraum in der Elektronendichte wäre die räumliche Lage der Carboxylgruppe nicht starr „fixiert“ und entsprechend kann ein breitbandiges Signal entstehen. Das beobachtete Carbonylsignal in den Differenzspektren könnte ebenfalls in seinen Signalintensitäten leicht variieren, wie es von Spektrum zu Spektrum immer wieder beobachtet werden kann. Bestätigungen für eine mögliche Protonierungzustandsänderung am A-Propionat des low-spin Häms finden sich im Wellenzahlenbereich um 1420-1300 cm-1 , in dem typischerweise ν s(COO-) -Streckschwingungen von Hämpropionaten gefunden werden. Die pIN-Wildtypspektren zeigen in den unterschiedlichen pH-Differenzspektren eine negative, relativ schmalbandige Extinktionsbande um 1410 cm-1 , die keine Verschiebung beim H/D-Austausch zeigt (Abb. 3.4.5), jedoch bei sinkendem pH-Wert eine geringe Verschiebung des Minimums zu größeren Wellenzahlen zeigt. Dies könnte einer „fixierten“ Carboxylatgruppe des low-spin Häms entsprechen. Diese Bande ändert ihre Lage im ∆cyoE-Differenzspektrum nahezu nicht, ihre Intensität nimmt jedoch in Korrelation zur verstärkten Protonierung der Cabonylbande bei 1722 cm-1 deutlich zu (Abb. 3.4.10). In den isotopenmarkierten Wildtyp-Differenzspektren ist ein Signal an dieser Position 124 Diskussion ____________________________________________________________________________________________________________________________________________________ vorhanden, dieses ist im Vergleich zum Wildtyp jedoch in seinen Intensitäten erniedrigt (Abb. 3.4.8). Eine eindeutige Zuordnung des verschobenen Signals ist bei dieser Spektrenqualität im isotopenmarkierten Wildtyp nicht möglich. Bei der negativen Bande um 1410 cm-1 könnte es sich um das zur 1730-1704 cm-1 -Bande korrelierende Carboxylatsignal handeln. Interessanterweise findet sich eine positive Extinktionsbande bei 1297 cm-1 im pH 8,0Wildtypspektrum, das in Abhängigkeit vom pH-Wert auf 1310 cm-1 verschiebt (Abb. 3.4.5). Es zeigt eine nur geringfügige Verschiebung zu kürzeren Wellenzahlen bei den entsprechenden pDSpektren. Für den Wellenzahlenbereich von 1235-1270 cm-1 sind ν(C-O) und ν(C-C)Schwingungen der Hydroxylgruppe von Tyrosinen beschrieben, die ebenfalls Deformationsschwingungen (δ(COH)) in diesem Bereich aufzeigen. Sie besitzen Extinktionskoeffizienten von ca. 200 M-1 cm-1 [93]. Eine Verschiebung zu kürzeren Wellenzahlen der Streckschwingungen in D2 O ist von 3-11 cm-1 beschrieben und der Extinktionskoeffizient ändert sich nur geringfügig (150 M-1 cm-1 ). Bei dem ∆cyoE-Differenzspektrum findet sich eine negative Bande um 1206 cm-1 , die im Vergleich zum Wildtypspektrum deutlich intensiver ausgeprägt ist. Es könnte sich demnach um Schwingungen des Tyr-99 handeln, das mit dem A-Propionat des low-spin Häms in Wechselwirkung steht. Im oxidierten Zustand des Cyt bo3 könnte eine H-Brücke zwischen beiden bestehen, und die daraus resultierenden Schwingungen sind gekoppelt (1260 cm-1 , ν s(COO-) für das A-Propionat; 1206 cm-1 , ν(C-O) und δ(COH) für Tyr-99). Beim Redoxübergang könnte das A-Propionat protoniert werden und somit zur Auflösung der H-Brückenbindung zum Tyr-99 führen. Das Propionat verlagert sich in den Freiraum zum Leu414 (1722 cm-1 , ν(C=O)) und es entsteht entsprechend Platz für das Tyr-99, das sich ebenfalls verlagern könnte. Dabei erfährt es eine Umgebungsänderung (1297 cm-1 , ν(C-O) und δ(COH)). Der pKs-Wert der A-Hämpropionsäure könnte sich in Abhängigkeit vom pH-Wert des Außenmediums ändern, wenn die Propionsäure eine Verbindung zum Periplasma in Form des D-Kanals besitzt. Die pH-Wertänderung könnte ebenfalls das Tyr-99 beeinflussen und beide positiven Signale könnten eine Verschiebung zu größeren Wellenzahlen bei sinkendem pH-Wert zeigen. Diese Beschreibung ist spekulativ, kann jedoch durch eine Mutation an der Position des Tyr-99 zur Verifikation bzw. Falsifikation überprüft werden. 4.3.3.2 Carbonyl- und Carboxylatschwingungen des high-spin Häms In Abb. 4.3.4 ist das high-spin Häm des Cyt bo3 und des bovinen Cyt aa3 aus drei räumlichen Perspektiven mit den Aminosäuren dargestellt, die die Hämpropionate umgeben. Die Aminosäure-Nummerierung ist ebenfalls, wenn nicht anders angegeben, auf das höher aufgelöste bovine Cyt aa3 bezogen. 125 Diskussion ____________________________________________________________________________________________________________________________________________________ Das A-Propionat des high-spin Häms weist H-Brücken zu His-368, Asp-364 und zu einem Wassermolekül auf [25]. Im Cyt bo3 , das kein Mg2+-Ion aufweist, befindet sich anstelle des Mg2+-Liganden Asp-369 (Asp-404) das Asn-412 (s. Begleittext zur Abb. 4.3.2). Abb. 4.3.4: Räumliche Anordnung der high-spin Häme des Cyt bo 3 und der bovinen Cyt c Oxidase. Zur weiteren Erklärung s. Text von Abb. 4.3.2 . Das D-Propionat des sauerstoffbindenden high-spin Häms ist durch Ladungswechselwirkungen mit Arg-438 und Arg-439 (in Abb. 4.3.4 nicht gezeigt) stabilisiert und weist H-Brücken zu Arg-438 und Trp-126 auf [15]; [23]. Weiterhin könnte eine H-Brücke zu einem H2 O-Molekül bestehen, das sich zwischen dem D-Propionat und dem CuB-Liganden His-291 befindet ([24], Abb.1). Dies trifft jedoch auch für das A-Propionat im Cyt bo3 zu (Abb. 4.3.4). Das A-Propionat des low-spin Häms und das D-Propionat des high-spin Häms besitzen also drei gemeinsame Liganden (Arg-438, Arg-439, Trp-126) und könnten demnach beide in den Protonentransfer involviert sein. Aus den in Behr et al., 1998 [89] und in Behr et al., 2000 [134] durchgeführten FT-IRspektroskopischen Untersuchungen am Cyt aa3 aus P. denitrificans ergab sich, dass das A-Propionat des high-spin Häms im oxidierten Zustand der Oxidase protoniert ist. Aus den Mutationsanalysen von Arg-481 und Arg-482 am Cyt bo3 konnte bei Puustinen & Wikström, 1999 126 Diskussion ____________________________________________________________________________________________________________________________________________________ [167] ermittelt werden, dass das Arg-481 an der Protonentransferreaktion der Ubichinol-Oxidase beteiligt ist. Bei den Untersuchungen von Behr et al., 2000 konnte eine solche Beteiligung des Arg-473 bisher nicht nachgewiesen werden. Bei den hier durchgeführten FT-IR-Messungen konnte ebenso eine negative Carbonylschwingung des high-spin Häms bei 1678 cm-1 nachgewiesen werden. Sie wird in Anlehnung an Behr et al., 2000 dem A-Propionat zugeordnet. Im Unterschied zu dieser Veröffentlichung wird jedoch auch ein positives Carbonylsignal des highspin Häms bei 1685 cm-1 gefunden. In Anlehnung an Puustinen & Wikström, 1999 wird sie dem D-Propionat des high-spin Häms zugeordnet. Es findet vermutlich ein Protonentransport vom A-Propionat zum D-Propionat beim Redoxübergang des Cyt bo3 statt. Für die Beteiligung von zwei unterschiedlichen Carboxylatgruppen an dem Protonentransfer sprechen Carboxy- latschwingungen, die im ∆cyoE-Differenzspektrum gefunden werden (Abb. 3.4.10). Es tritt eine im Wildtypspektrum nicht vorhandene Differenzbande mit einem Minimum bei 1325 cm-1 und einem Maximum bei 1317 cm-1 auf. Diese Differenzbande liegt in einem Bereich, in dem ν s(COO-)-Schwingungen von Hämpropionaten typischerweise absorbieren können (1420-1300 cm-1 ) [89]. Sie ist in dem D2 O-Spektrum schwächer ausgeprägt aber dennoch vorhanden. Die Differenzbande bei 1325/1317 cm-1 ist gegenüber der Carbonyl-Differenzbande im Wildtypspektrum bei 1685/1678 cm-1 invertiert. Dies entspricht genau der Erwartung, wenn die protonierte A-Propionsäure im oxidierten Zustand des Cyt bo3 (1678 cm-1 , ν(C=O) im Wildtypspektrum) beim Redoxübergang deprotoniert wird. Es müsste sich entsprechend eine positive Bande im Carboxylatbereich finden lassen (1317 cm-1 , ν s(COO-) im ∆cyoE-Differenzspektrum). Im Falle des D-Propionats müssten genau die umgekehrten Verhältnisse vorliegen. Das im oxidierten Zustand der Oxidase als Caboxylat vorliegende Propionat (1325 cm-1 , ν s(COO-) im ∆cyoEDifferenzspektrum) liegt im reduzierten Zustand protoniert vor (1685 cm-1 , ν(C=O) im Wildtypspektrum). Dies wird als Hinweis betrachtet, dass beide Hämpropionate an dem Differenzsignal bei 1685/1678 cm-1 beteiligt sind (4.3.3). Bevor das Modell der Protonenleitung an den Hämpropionaten vorgestellt wird, soll hier noch ein sehr wichtiger Aspekt eingebracht werden. Bei den bereits unter 4.2.2 erwähnten mixedvalence PR-Differenzspektren, mit denen der direkte Nachweis der Kopplung zwischen dem konformativen Wechsel des Glu-286 und der Reduktion des low-spin Häms gelang, findet sich sowohl die breite, positive Bande bei 1730-1704 cm-1 als auch die Carbonyl-Differenzbande bei 1685/1678 cm-1 wieder. Dies wiederum bedeutet, dass ebenfalls der Protonentransfer an den Hämpropionaten mit der Reduktion des low-spin Häms einhergeht. Diese Reduktion scheint somit die initiale Reaktion für vielfältige Veränderungen innerhalb des Cyt bo3 zu sein. 127 Diskussion ____________________________________________________________________________________________________________________________________________________ 4.3.3.3 Modell der Protonenleitung an den Hämpropionaten Aus den hier durchgeführten Untersuchungen wird ein hypothetisches Modell zur vektoriellen Protonenleitung an den Hämpropionaten im D-Kanal hergeleitet (Abb. 4.3.5). Vom Cyt bo3 liegt lediglich die Struktur der vollständig oxidierten Oxidase vor. Sie dient sowohl für die rechte als auch für die linke Darstellung als Grundlage zur Graphikerstellung. Inwieweit und ob sich die Positionen der dargestellten Moleküle beim Redoxwechsel des low-spin Häm B ändern, kann der Abbildung nicht entnommen werden. Der gezeigte konformative Wechsel des Glu-286 ist zwischen der oxidierten und reduzierten Kristallstruktur im bovinen Cyt aa3 nicht erkennbar [25]. Die veränderte Lage der Carboxylgruppe an dieser Aminosäure wurde in Abb. 3.4.5 von Hand eingefügt und entspricht somit nicht dem originalen Koordinatendatensatz. Im oxidierten Zustand des Cyt bo3 liegt das high-spin Häm A-Propionat protoniert vor und könnte in dieser Form von Asp-407 über eine H-Brückenbindung stabilisiert sein. Die restlichen Hämpropionate befinden sich in der Carboxylat-Form (Abb. 4.3.5 links). Abb. 4.3.5: Hypothetisches Modell zum vektoriellen Protonentransfer im Cyt bo 3 . Die grünen Pfeile geben mögliche Protonentransferwege zum Periplasma wieder. Der Transport dieser Protonen findet erst nach der erneuten Oxidation des Cyt bo 3 statt. Zur weiteren Erklärung s. Text. Bei der Reduktion des low-spin Häms (Fe3+ nach Fe2+) findet ein Protonentransferschritt vom APropionat auf das D-Propionat des high-spin Häms statt (Abb. 4.3.5 rechts). Die in den Cyt c Oxidasen nicht vorhandene Aminosäure Asn-412 könnte im Zusammenspiel mit His-411 (vergleiche Abb. 4.3.4) an diesem Schritt beteiligt sein und die negative Ladung des Carboxylats am nunmehr deprotonierten A-Propionat stabilisieren. 128 Diskussion ____________________________________________________________________________________________________________________________________________________ Das A-Propionat des low-spin Häms wird ebenfalls zum Teil bei der Reduktion von Häm B protoniert6 . Demzufolge liegen im Cyt bo3 zwei alternative Protonentransferwege zum Periplasma vor (grüne Pfeile). Der eine führt vom D-Propionat des high-spin Häms, der andere vom A-Propionat des low-spin Häms weg. Die Protonenabgabe an das Periplasma findet erst nach der Reoxidation des Cyt bo3 statt, d.h. es müssen zusätzlich Protonentransferwege zum A-Propionat des high-spin Häms und zum A-Propionat des low-spin Häms bestehen, um die abgegebenen Protonen wieder „aufzufüllen“. Der konformative Wechsel des Glu-286 in eine hydrophilere Umgebung ist ebenfalls an die Reduktion des low-spin Häm B gekoppelt (4.2). Nach dem Redoxübergang steht es vermutlich mit einem Protonennetzwerk in Verbindung (angedeutet durch die rote gestrichelte Linie in Abb. 4.3.5). Man nimmt an, dass die Protonen über dieses Netzwerk [27] von protonierbaren Aminosäureresten und/oder fest gebundenen Wassermolekülen transportiert werden [28; 29]. Da sich in unmittelbarer Nähe zum Glu-286 keine protonierbare Aminosäure befindet, ist in der Abb. 4.3.5 stellvertretend für das Protonennetzwerk ein Wassermolekül gezeigt. Über His-334 könnte ein möglicher Protonentransfer zum A-Propionat des high-spin Häms bestehen (4.3.3.2) [167], der im Modell durch den rechten gestrichelten Pfeil angedeutet ist. Da das Propionat jedoch erst wieder bei der Reoxidation des Cyt bo3 protoniert werden muss, hat die Oxidase den Reaktionszyklus bereits vollständig durchlaufen. Dabei sind aus der Reduktion des molekularen Sauerstoffs zwei Wassermoleküle am binuklearen Zentrum und damit in unmittelbarer Nachbarschaft zum A-Propionat entstanden. Eines der beiden neu synthetisierten Wassermoleküle könnte demnach unmittelbar als Protonendonor für das A-Propionat dienen. Das entstandene Hydoxid-Ion könnte durch ein Proton aus dem K-Kanal (in Abb. 4.3.5 nicht gezeigt) wieder neutralisiert werden. Dies würde dem K-Kanal eine größere Gewichtung beim Protonentransport geben und eine sehr effiziente Reprotonierungsreaktion am A-Propionat darstellen. Für die Protonenleitung zum low-spin Häm könnten sich zwei Möglichkeiten ergeben: (I) Das D-Propionat des high-spin Häms steht möglicherweise über Arg-481 mit dem D-Propionat des low-spin Häms in Verbindung (4.3.3.2). Somit könnten zum Teil Protonen vom high-spin Häm an das A-Propionat des low-spin Häms geleitet werden (waagrechter gestrichelter Pfeil in Abb. 4.3.5). Dieser Möglichkeit widersprechen jedoch die Ergebnisse aus dem ∆cyoE- Mutantenspektrum. Da bei dieser Mutante das A-Propionat stärker, möglicherweise nahezu vollständig im Vergleich zum Wildtyp protoniert ist, müsste das zugeordnete positive Extink6 Das A-Propionat des low-spin Häms wird vermutlich im Wildtyp nur zum Teil protoniert, da im APRDifferenzspektrum der ∆cyoE-Mutante eine deutliche Intensivierung der positiven Bande bei 1730-1704 cm-1 stattfindet. Die Carboxylatgruppen dieses Propionats liegen entsprechend stärker protoniert vor. 129 Diskussion ____________________________________________________________________________________________________________________________________________________ tionssignal (1680 cm-1 ) des D-Propionats vom high-spin Häm deutlich an Intensität verlieren bzw. fehlen (Abb. 4.3.1). Dies ist nicht der Fall. Daher ist eine Protonenleitung über das Wasserstoffbrücken-Netzwerk des D-Kanals wahrscheinlicher. (II) Durch den konformativen Wechsel des Glu-286 ausgelöst, könnten Protonen über Arg-481 an das D-Propionat und somit zum A-Propionat des Häm B gelangen (breiter gestrichelter Pfeil in Abb. 4.3.5). Dieser Transferweg ist jedoch nach den hier vorliegenden Ergebnissen nicht nur in Richtung des low-spin Häms möglich, da das A-Propionat im Wildtyp nicht vollständig protoniert wird. Stattdessen könnte ebenfalls eine Protonenleitung vom Arg-481 oder dem D-Propionat in Richtung Periplasma erfolgen (In Abb. 4.3.5 nicht dargestellt). Dieses hier vorgestellte hypothetische Modell des Protonentransfers im Cyt bo3 müsste in zukünftigen Untersuchungen verifiziert werden, es könnte jedoch einige bisher ermittelten Ergebnisse erklären: ? Ein Aminosäureaustausch an hochkonservierten Aminosäuren des D-Kanals, wie z.B. E286A/I112E [157] und R481N bzw. R481L [167] führt zu einem Cyt bo3 , das einen um rund die Hälfte verminderten Protonentransport zeigt. Bei der Cyt c Oxidase aus R. sphaeroides konnte ebenfalls nachgewiesen werden, dass Mutationen an Glu-278 (Glu-286 in Cyt bo3 ) zu einem Rückgang, aber nicht zum Erliegen des Protonentransports innerhalb der Oxidase führen [158]. Wenn eine Protonenleitung zum A-Propionat des Häm O über die neusynthetisierten Wassermoleküle und damit letztlich über den K-Kanal erfolgt, ist die Protonenleitung im D-Kanal hierfür nicht erforderlich. Bei protonenpump-inaktiven Mutanten des D-Kanals würden Oxidasen resultieren, die zwar keine Protonen über den zum Cytoplasma hin orientierten Teil des D-Kanal transportieren, aber dennoch eine Protonenpumpleistung über den K-Kanal erbringen können. ? Eine Protonentranslokation über die Cytoplasmamembran durch den D-Kanal ist sowohl in den Cyt c- als auch Ubichinol Oxidasen realisiert. Im Cyt bo3 erfolgt die Protonenleitung auch über das low-spin Häm, dass in den Cyt c Oxidasen nicht involviert scheint. Hierbei spielen die in den aa3 Oxidasen an diesen Positionen nicht vorhandenen Aminosäuren Gln-83 und Leu-414 eine entscheidende Rolle bei der Protonenstabilisierung (4.3.3.1). 130 5. Zusammenfassung Cytochrom Oxidasen sind nach Schätzungen für rund 90% der molekularen Sauerstoffreduktion innerhalb der Biosphäre und für fast die Hälfte der in der zellulären Atmung umgesetzten Redoxenergie verantwortlich. Sie stellen die terminalen Enzyme der aeroben Atmungskette von Pro- und Eukaryonten dar und katalysieren die Reduktion von molekularem Sauerstoff zu Wasser. Diese Reaktion ist an eine Translokation von Protonen über die Cytoplasma- bzw. die innere Mitochondienmembran gekoppelt. Der so erzeugte elektrochemische Protonengradient kann zur Energiegewinnung der Zelle genutzt werden. Thema dieser Dissertation ist die Ubichinol-8 Oxidase Cytochrom bo3 von Escherichia coli. Dieses Enzym gehört zur Superfamilie der Häm-Kupfer Oxidasen und besteht aus vier Untereinheiten, die ein Molekulargewicht von rund 142 kDa besitzen. Über das low-spin Häm B werden die Elektronen vom Ubichinol-8 an das aus dem high-spin Häm O und CuB bestehende binukleare Zentrum, den Ort der Sauerstoffaktivierung und Sauerstoffreduktion, transferiert. Die dabei translozierten Protonen werden über zwei Kanäle zum binuklearen Zentrum bzw. in den periplasmatischen Raum geleitet. Die Kopplung des Elektonentransfers und die damit einhergehenden Redoxübergänge der Kofaktoren an den Protonentransport im Cyt bo3 bzw. allgemein in den Häm-Kupfer Oxidasen ist eine zentrale Frage dieses Forschungsgebiets. Ziel dieser Arbeit ist es einige, an dieser Kopplung beteiligten atomaren Gruppen zu untersuchen. Bei der homologen Überexpression des Cyt bo3 in E. coli durch einem Expressionsvektor, der das cyo-Operon beinhaltet, kommt es bezüglich der Hämkofaktoren zu einer heterogen zusammengesetzten Oxidase-Molekülpopulation, die aus physiologisch aktivem Cyt bo3 und inaktiverem Cyt oo3 besteht. Wird jedoch eine Oligohistidinmodifikation am C-Terminus von Untereinheit II angefügt, so wird eine homogene Cyt bo3 -Molekülpopulation erhalten. Die letzten sechs C-terminalen Aminosäuren dieser Untereinheit können jedoch in Abhängigkeit von den Fermentationsbedingungen in vivo und während des Zellaufbruchs durch Ultraschall in vitro abgespalten werden. Die Oligohistidinmodifikation geht somit ebenfalls verloren. Im Rahmen dieser Arbeit wird eine neue Cyt bo3 Wildtypvariante kloniert, homolog in E. coli überexprimiert und gereinigt. Die DNA-Sequenz, die für eine Hexahistidin-Modifikation kodiert, wurde bei gleichzeitiger Deletion der drei zur Spaltungsstelle benachbarten Aminosäuren Met, Asp und Met im cyoA-Gen des pIN-Expressionsvektors inseriert. Das nach Expression in E. coli erhaltene Cyt bo3 wird als pIN-Wildtyp bezeichnet und weist eine Oligohistidinmodifikation am C-Terminus von Untereinheit II auf. Das Enzym zeigt erstmalig weder den von den 131 Zusammenfassung ____________________________________________________________________________________________________________________________________________________ Fermentationsbedingungen abhängigen, noch den beim Zellaufbruch durch Ultraschall ausgelösten Verlust des C-Terminus von Untereinheit II. Somit ist es mit einer Metallaffinitätschromatographie möglich, eine hochreine Oxidase durch ein einfaches „Ein-Schritt-Proteinreinigungsverfahren“ zu erhalten und das vom Genom kodierte unmodifizierte Cyt bo3 vom His-tagProtein zu trennen. Folglich können ebenfalls E. coli Stämme zur plasmidkodierten Expression des Cyt bo3 verwendet werden, die keine Inaktivierung des genomischen cyo-Operons beinhalten, wie sie z.B. für die 13 C-Isotopenmarkierungen der Hämpropionate zur Verfügung stehen. Das pIN-Plasmid kann ebenfalls zur ortsspezifischen Mutantenerstellung und deren Überexpression in E. coli genutzt werden. Die erhaltenen Cyt bo3 Mutantenproteine weisen ebenfalls den His-tag auf. Die Cyt bo3 -Molekülpopulationen sind bezüglich der Hämkofaktoren homogen zusammengesetzt. Der pIN-Wildtyp weist bei den Positionen der Extinktionsminima und -maxima bei der VIS- und IR-spektroskopischen Charakterisierung wildtypisches Verhalten auf. Somit können die gereinigten Oxidasen und deren Mutanten auch mit den bisher vom sogenannten pHCL-Expressionsvektor erhaltenen Wildtyp- und Mutantenproteinen verglichen werden. Der pIN-Wildtyp zeigt jedoch aus unbekannten Gründen eine um rund 1/3 erniedrigte Durochinol-Oxidaseaktivität im Vergleich zum pHCL-Wildtyp. Mit der hier konstruierten Gasaustauschzelle können IR-Proben unter definierten Bedingungen zwischen zwei Calcium-Fluoridfenstern präpariert werden. Diese Zelle ermöglicht es, u.a. Cyt bo3 Proben zu erstellen, bei denen ein bislang nicht möglicher, nahezu kompletter Lösungsmittelaustausch von H2 O zu D2 O erreicht wird. Mit diesen deuterierten Cyt bo3 Proben kann an den photoreduktions-induzierten Cyt bo3 Fourier-Transform-Infrarot-Redox- (= PR-) Differenzspektren nachgewiesen werden, dass sich die Carboxylgruppe der Seitenkette des am Protonentransports beteiligten Glu-286 sowohl im oxidierten, als auch im reduzierten Zustand der Oxidase in Wasserstoffbrückenbindung befindet. Beim Redoxübergang des Enzyms erfährt diese Seitenkette einen konformativen Wechsel, ohne ihren Protonierungszustand dabei zu ändern. Im Vergleich zu den bereits vor dieser Arbeit ermittelten PR-Differenzspektren, die an Cyt bo3 -Proben durch den Flüssigphasen H/D-Austausch hergestellt wurden, kann das Postulat der hydrophoben Barriere des Glu-286 aufrecht erhalten werden. Es kann nachgewiesen werden, dass der konformative Wechsel der Seitenkette des Glu286 mit der Reduktion des low-spin Häm B einhergeht. Mit dem Einsatz der auto-photoreduktions-induzierten Cyt bo3 Fourier-Transform-InfrarotRedox- (= APR-) Differenzspektroskopie, die keine caged-Verbindung zum Initiieren der Proteinreaktion benötigt, können Cyt bo3 Wildtyp- und Mutanten-APR-Differenzspektren mit IR132 Zusammenfassung ____________________________________________________________________________________________________________________________________________________ Proben zwischen Calciumfluorid-Fenstern auch erstmalig unterhalb der Amid-Regionen ausgewertet werden. Die hierzu erarbeiteten Qualitätskriterien der IR-Proben ermöglichen es, reproduzierbare APR-Differenzspektren über einen großen Wellenzahlenbereich zu erhalten. Hierbei können jedoch die Amid I- und Amid II-Regionen nicht ausgewertet werden. Da nunmehr die Anwendbarkeit der APR-Differenzspektroskopie für die Cyt bo3 Wildtypen und deren Mutantenproteine belegt ist, können für zukünftige Untersuchungen ebenfalls Qualitätskriterien für die Amid II Region ausgearbeitet werden. Die vier Untereinheiten des Cyt bo3 bestehen aus rund 1250 Aminosäuren und entsprechend hoch ist die Anzahl der Peptidbindungen. Diese Tatsache führt letztendlich zu IR-Spektren, die nur eine qualitative Auswertung der Amid I Region zulassen. Quantitative Auswertungen, wie sie z.B. für konformative Wechsel bei Sekundärstrukturmotiven notwendig wären, sind auch zukünftig nicht möglich. Durch den vorhandenen His-tag am pIN-Wildtyp kann ein an den Hämpropionaten spezifisch [1- 13 C]-isotopenmarkiertes Cyt bo3 gereinigt werden. In den davon angefertigten APRDifferenzspektren lassen sich Carbonylschwingungen von Hämpropionaten nachweisen. Im Vergleich zu den APR-Differenzspektren der ∆cyoE-Mutante können diese Schwingungen dem low-spin bzw. high-spin Häm zugeordnet werden. Die ermittelten Protonierungsänderungen an den Hämpropionaten gehen, wie der konformative Wechsel der Glu-286 Seitenkette, mit der Reduktion des low-spin Häm B einher. Die Carboxylatgruppen eines der beiden Propionate des Häm B, vermutlich die vom A-Propionat, liegen im oxidierten Zustand deprotoniert vor und werden bei der Reduktion des Cyt bo3 zum Teil protoniert. Die entsprechenden Atomgruppenschwingungen können im IR-Spektrum im Bereich von 1730-1704 cm-1 und vermutlich um 1410 cm-1 gefunden werden. Die high-spin Hämpropionate sind ebenfalls am Protonentransport innerhalb des Cyt bo3 beteiligt. Es kann eine Differenzbande bei 1690-1675 cm-1 für die Carbonylschwingungen gefunden werden. Vermutlich liegt das A-Propionat des high-spin Häms im oxidierten Zustand des Cyt bo3 protoniert vor und transferiert ein Proton auf das D-Propionat bei der Reduktion des low-spin Häm B. Eine wahrscheinlich dazu korrelierende Differenzbande im ∆cyoE-Mutantenspektrum kann im Bereich der symmetrischen Carboxylatschwingungen bei 1325/1317 cm-1 diesem Protonentransferschritt zugeordnet werden. Im Rahmen dieser Dissertation konnte nachgewiesen werden, dass die Hämpropionate beider im Cyt bo3 vorhandenen Häme am Protonentransport beteiligt sind und somit zur Erzeugung eines elektrochemischen Protonengradienten über der Cytoplasmamembran beitragen. Dabei gehen die Protonierungszustandsänderungen der Häme, wie der konformative Wechsel des Glu-286 mit der Reduktion des low-spin Häm B einher. Diese Prozesse könnten demnach aneinander gekoppelt sein. 133 6. Literaturverzeichnis [1] [2] [3] [4] [5] [6] [7] [8] [9] [10] [11] [12] [13] [14] [15] [16] [17] Mitchell, P. (1961). Coupling of phosphorylation to electron and hydrogen transfer by a chemi-osmotic type of mechansim. Nature. 191: 144-148 Cronan, J.E., Gennis, R.B. and Maloy, S.R. (1987). in: Escherichia coli and salmonella typhimurium cellular and molekular biology. American Society of Microbiology. Neidhardt, F. C. Ed. Vol. 1: 31-35 Unden, G. and Bongaerts, J. (1997). Alternative respiratory pathways of Escherichia coli: energetics and transcriptional regulation in response to electron acceptors. [Review] [129 refs]. Biochimica et Biophysica Acta. 1320: 217-34 Anraku, Y. and Gennis, R.B. (1987). The aerobic chain of Escherichia coli. Trends in Biochemical Sciences. 12: 262-266 Garcia-Horsman, J.A., Barquera, B., Rumbley, J., Ma, J. and Gennis, R.B. (1994). The superfamily of heme-copper respiratory oxidases. Journal of Bacteriology. 176: 55875600 Trumpower, B.L. and Gennis, R.B. (1994). Energy transduction by cytochrome complexes in mitochondrial and bacterial respiration: the enzymology of coupling electron transfer reactions to transmembrane proton translocation. Annual Review of Biochemistry. 63: 675-716 Chan, S.I. and Li, P.M. (1990). Cytochrome c oxidase: understanding nature's design of a proton pump. Biochemistry. 29: 1-12 Saraste, M. (1990). Structural features of cytochrome oxidase. Q. Rev. Biophys. 23: 331-366 Saraste, M., Holm, L., Lemieux, L., Lübben, M. and van der Oost, J. (1991). The happy family of cytochrome oxidases. Biochemical Society Transactions. 19: 608-612 Calhoun, M.W., Thomas, J.W. and Gennis, R.B. (1994). The cytochrome oxidase superfamily of redox-driven proton pumps. Trends in Biochemical Sciences. 19: 325-30 Pereira, M.M., Santana, M. and Teixeira, M. (2001). A novel scenario for the evolution of haem-copper oxygen reductases. Biochimica et Biophysica Acta. 1505: 185-208 van der Oost, J., de Boer, A.P., de Gier, J.W., Zumft, W.G., Stouthamer, A.H. and van Spanning, R.J. (1994). The heme-copper oxidase family consists of three distinct types of terminal oxidases and is related to nitric oxide reductase. [Review] [34 refs]. FEMS Microbiology Letters. 121: 1-9 Musser, S.M. and Chan, S.I. (1995). Understanding the cytochrome c oxidase proton pump: thermodynamics of redox linkage. Biophysical Journal. 68: 2543-55 Hosler, J.P., Fetter, J., Tecklenburg, M.M., Espe, M., Lerma, C. and Ferguson-Miller, S. (1992). Cytochrome aa3 of Rhodobacter sphaeroides as a model for mitochondrial cytochrome c oxidase. Purification, kinetics, proton pumping, and spectral analysis. Journal of Biological Chemistry. 267: 24264-72 Tsukihara, T., Aoyama, H., Yamashita, E., Tomizaki, T., Yamaguchi, H., ShinzawaItoh, K., Nakashima, R., Yaono, R. and Yoshikawa, S. (1996). The whole structure of the 13-subunit oxidized cytochrome c oxidase at 2.8 A. Science. 272: 1136-1144 Hendler, R.W., Pardhasaradhi, K., Reynafarje, B. and Ludwig, B. (1991). Comparison of energy-transducing capabilities of the two- and three-subunit cytochromes aa3 from Paracoccus denitrificans and the 13-subunit beef heart enzyme. Biophysical Journal. 60: 415-23 Malmström, B.G. and Aasa, R. (1993). The nature of the CuA center in cytochrome c oxidase. FEBS Letters. 325: 49-52 134 Literaturverzeichnis ____________________________________________________________________________________________________________________________________________________ [18] [19] [20] [21] [22] [23] [24] [25] [26] [27] [28] [29] [30] [31] [32] [33] [34] Welter, R., Gu, L.Q., Yu, L., Yu, C.A., Rumbley, J. and Gennis, R.B. (1994). Identification of the ubiquinol-binding site in the cytochrome bo3 -ubiquinol oxidase of Escherichia coli. Journal of Biological Chemistry. 269: 28834-8 Sato-Watanabe, M., Mogi, T., Ogura, T., Kitagawa, T., Miyoshi, H., Iwamura, H. and Anraku, Y. (1994). Identification of a novel quinone-binding site in the cytochrome bo complex from Escherichia coli. Journal of Biological Chemistry. 269: 28908-278912 Sato-Watanabe, M., Mogi, T., Miyoshi, H. and Anraku, Y. (1998). Characterization and functional role of the QH site of bo-type ubiquinol oxidase from Escherichia coli. Biochemistry. 37: 5356-61 Kobayashi, K., Tagawa, S. and Mogi, T. (2000). Transient formation of ubisemiquinone radical and subsequent electron transfer process in the Escherichia coli cytochrome bo. Biochemistry. 39: 15620-5 Abramson, J., Riistama, S., Larsson, G., Jasaitis, A., Svensson-Ek, M., Laakkonen, L., Puustinen, A., Iwata, S. and Wikström, M. (2000). The structure of the ubiquinol oxidase from Escherichia coli and its ubiquinone binding site. Nature Structural Biology. 7: 910917 Iwata, S., Ostermeier, C., Ludwig, B. and Michel, H. (1995). Structure at 2.8 A resolution of cytochrome c oxidase from Paracoccus denitrificans [see comments]. Nature. 376: 660-669 Ostermeier, C., Harrenga, A., Ermler, U. and Michel, H. (1997). Structure at 2.7 A resolution of the Paracoccus denitrificans two-subunit cytochrome c oxidase complexed with an antibody FV fragment. Proceedings of the National Academy of Sciences of the United States of America. 94: 10547-10553 Yoshikawa, S., Shinzawaitoh, K., Nakashima, R., Yaono, R., Yamashita, E., Inoue, N., Yao, M., Fei, M.J., Libeu, C.P., Mizushima, T., Yamaguchi, H., Tomizaki, T. and Tsukihara, T. (1998). Redox-coupled crystal structural changes in bovine heart cytochrome c oxidase. Science. 280: 1723-1729 Chepuri, V., Lemieux, L., Au, D.C. and Gennis, R.B. (1990). The sequence of the cyo operon indicates substantial structural similarities between the cytochrome o ubiquinol oxidase of Escherichia coli and the aa3 -type family of cytochrome c oxidases. Journal of Biological Chemistry. 265: 11185-92 Nagle, J.F. and Morowitz, H.J. (1978). Molecular mechanisms for proton transport in membranes. Proceedings of the National Academy of Sciences of the United States of America. 75: 298-302 Brzezinski, P. and Ädelroth, P. (1998). Pathways of proton transfer in cytochrome c oxidase. Journal of Bioenergetics & Biomembranes. 30: 99-107 Lübben, M., Prutsch, A., Mamat, B. and Gerwert, K. (1999). Electron transfer induces side-chain conformational changes of glutamate-286 from cytochrome bo3 . Biochemistry. 38: 2048-2056 Ma, J.X., Tsatsos, P.H., Zaslavsky, D., Barquera, B., Thomas, J.W., Katsonouri, A., Puustinen, A., Wikström, M., Brzezinski, P., Alben, J.O. and Gennis, R.B. (1999). Glutamate-89 in subunit II of cytochrome bo(3) from Escherichia coli is required for the function of the heme-copper oxidase. Biochemistry. 38: 15150-15156 Michel, H., Behr, J., Harrenga, A. and Kannt, A. (1998). Cytochrome c oxidase: structure and spectroscopy. Annual Review of Biophysics & Biomolecular Structure. 27: 329-56 Michel, H. (1999). Cytochrome c oxidase: Catalytic cycle and mechanisms of proton pumping-A discussion. Biochemistry. 38: 15129-15140 Babcock, G.T. and Wikström, M. (1992). Oxygen activation and the conservation of energy in cell respiration. Nature. 356: 301-309 Ferguson-Miller, S. and Babcock, G.T. (1996). Heme/copper terminal oxidases [Review]. Chemical Reviews. 96: 2889-2907 135 Literaturverzeichnis ____________________________________________________________________________________________________________________________________________________ [35] [36] [37] [38] [39] [40] [41] [42] [43] [44] [45] [46] [47] [48] [49] [50] [51] [52] Svensson-Ek, M. and Brzezinski, P. (1997). Oxidation of ubiquinol by cytochrome bo3 from Escerichia coli: Kinetics of electron and proton transfer. Biochem. 36: 5425-5431 Mogi, T., Saiki, K. and Anraku, Y. (1994). Biosynthesis and functional role of haem O and haem A. Molecular Microbiology 14: 391-398 Verderber, E., Lucast, L.J., Van Dehy, J.A., Cozart, P., Etter, J.B. and Best, E.A. (1997). Role of the hemA gene product and delta-aminolevulinic acid in regulation of Escherichia coli heme synthesis. Journal of Bacteriology. 179: 4583-90 Kikuchi, G., Kumar, A., Talmage, P. and Shemin, D. (1958). The enzymatic synthesis of δ-aminolevulinic acid. Journal of Biological Chemistry 233: 1214-1219 Li, J.M., Russell, C.S. and Cosloy, S.D. (1989). Cloning and structure of the hem A gene of Escherichia coli K-12. Gene. 82: 209-17 Li, J.M., Brathwaite, O., Cosloy, S.D. and Russell, C.S. (1989). 5-Aminolevulinic acid synthesis in Escherichia coli. Journal of Bacteriology. 171: 2547-52 Miller, M.J., Hermodson, M. and Gennis, R.B. (1988). The active form of the cytochrome d terminal oxidase complex of Escherichia coli is a heterodimer containing one copy of each of the two subunits. Journal of Biological Chemistry. 263: 5235-40 Green, G.N., Fang, H., Lin, R.J., Newton, G., Mather, M., Georgiou, C.D. and Gennis, R.B. (1988). The nucleotide sequence of the cyd locus encoding the two subunits of the cytochrome d terminal oxidase complex of Escherichia coli. Journal of Biological Chemistry. 263: 13138-43 Minagawa, J., Nakamura, H., Yamato, I., Mogi, T. and Anraku, Y. (1990). Transcriptional regulation of the cytochrome b562 -o complex in Escherichia coli. Gene expression and molecular characterization of the promoter. Journal of Biological Chemistry. 265: 11198-203 Hill, J.J., Alben, J.O. and Gennis, R.B. (1993). Spectroscopic evidence for a heme-heme binuclear center in the cytochrome bd ubiquinol oxidase from Escherichia coli. Proceedings of the National Academy of Sciences of the United States of America. 90: 5863-7 Minghetti, K.C., Goswitz, V.C., Gabriel, N.E., Hill, J.J., Barassi, C.A., Georgiou, C.D., Chan, S.I. and Gennis, R.B. (1992). Modified, large-scale purification of the cytochrome o complex (bo-type oxidase) of Escherichia coli yields a two heme/one copper terminal oxidase with high specific activity. Biochemistry. 31: 6917-24 Saiki, K., Mogi, T. and Anraku, Y. (1992). Heme O biosynthesis in Escherichia coli: the cyoE gene in the cytochrome bo operon encodes a protoheme IX farnesyltransferase. Biochemical & Biophysical Research Communications. 189: 1491-7 Saiki, K., Mogi, T., Ogura, K. and Anraku, Y. (1993). In vitro heme O synthesis by the cyoE gene product from Escherichia coli. Journal of Biological Chemistry. 268: 26041-4 Saiki, K., Nakamura, H., Mogi, T. and Anraku, Y. (1996). Probing a role of subunit IV of the Escherichia coli bo-type ubiquinol oxidase by deletion and cross-linking analyses. Journal of Biological Chemistry. 271: 15336-40 Prutsch, A., Lohaus, C., Green, B., Meyer, H.E. and Lübben, M. (2000). Multiple posttranslational modifications at distinct sites contribute heterogeneity of the lipoprotein cytochrome bo3. Biochemistry. 39: 6554-6563 Chepuri, V. and Gennis, R.B. (1990). The use of gene fusions to determine the topology of all of the subunits of the cytochrome o terminal oxidase complex of Escherichia coli. Journal of Biological Chemistry. 265: 12978-86 Kita, K., Konishi, K. and Anraku, Y. (1984). Terminal oxidases of Escherichia coli aerobic respiratory chain. I. Purification and properties of cytochrome b562 -o complex from cells in the early exponential phase of aerobic growth. Journal of Biological Chemistry. 259: 3368-74 Meunier, B., Madgwick, S.A., Reil, E., Oettmeier, W. and Rich, P.R. (1995). New inhibitors of the quinol oxidation sites of bacterial cytochromes bo and bd. Biochemistry. 34: 1076-83 136 Literaturverzeichnis ____________________________________________________________________________________________________________________________________________________ [53] [54] [55] [56] [57] [58] [59] [60] [61] [62] [63] [64] [65] [66] [67] [68] [69] [70] Puustinen, A., Finel, M., Virkki, M. and Wikström, M. (1989). Cytochrome o (bo) is a proton pump in Paracoccus denitrificans and Escherichia coli. FEBS Letters. 249: 163167 Puustinen, A., Finel, M., Haltia, T., Gennis, R.B. and Wikström, M. (1991). Properties of the two terminal oxidases of Escherichia coli. Biochemistry. 30: 3936-3942 Lemieux, L.J., Calhoun, M.W., Thomas, J.W., Ingledew, W.J. and Gennis, R.B. (1992). Determination of the ligands of the low spin heme of the cytochrome o ubiquinol oxidase complex using site-directed mutagenesis. Journal of Biological Chemistry. 267: 21052113 Calhoun, M.W., Hill, J.J., Lemieux, L.J., Ingledew, W.J., Alben, J.O. and Gennis, R.B. (1993). Site-directed mutants of the cytochrome bo ubiquinol oxidase of Escherichia coli: amino acid substitutions for two histidines that are putative CuB ligands. Biochemistry. 32: 11524-9 Tsubaki, M., Mogi, T., Hori, H., Hirota, S., Ogura, T., Kitagawa, T. and Anraku, Y. (1994). Molecular structure of redox metal centers of the cytochrome bo complex from Escherichia coli. Spectroscopic characterizations of the subunit I histidine mutant oxidases. Journal of Biological Chemistry. 269: 30861-8 Salerno, J.C., Bolgiano, B., Poole, R.K., Gennis, R.B. and Ingledew, W.J. (1990). Heme-copper and heme-heme interactions in the cytochrome bo-containing quinol oxidase of Escherichia coli. Journal of Biological Chemistry. 265: 4364-8 Rumbley, J.N., Furlong Nickels, E. and Gennis, R.B. (1997). One-step purification of histidine-tagged cytochrome bo3 from Escherichia coli and demonstration that associated quinone is not required for the structural integrity of the oxidase. Biochimica et Biophysica Acta 1340: 131-142 Mauzerall, D. and Dolphin, D. (1978). Electron transfer photoreactions of porphyrins. Academic Press. The Porphyrins Vol. III: 167-209 Voet, D. and Voet, J.G. (1994). Biochemie. VCH Verglagsgesellschaft Weinheim: 539541 Puustinen, A. and Wikström, M. (1991). The heme groups of cytochrome o from Escherichia coli. Proceedings of the National Academy of Sciences of the United States of America. 88: 6122-6126 Bolgiano, B., Salmon, I. and Poole, R.K. (1993). Reactions of the membrane-bound cytochrome bo terminal oxidase of Escherichia coli with carbon monoxide and oxygen. Biochimica et Biophysica Acta. 1141: 95-104 Cheesman, M.R., Watmough, N.J., Pires, C.A., Turner, R., Brittain, T., Gennis, R.B., Greenwood, C. and Thomson, A.J. (1993). Cytochrome bo from Escherichia coli: identification of haem ligands and reaction of the reduced enzyme with carbon monoxide. Biochemical Journal. 289: 709-18 Puustinen, A., Morgan, J.E., Verkhovsky, M., Thomas, J.W., Gennis, R.B. and Wikström, M. (1992). The low-spin heme site of cytochrome o from Escherichia coli is promiscuous with respect to heme type. Biochemistry. 31: 10363-10369 Poole, R.K. and Ingledew, W.J. (1987). in: Escherichia coli and salmonella typhimurium cellular and molekular biology. American Society of Microbiology. Neidhardt, F. C. Ed. Vol. 1 Griffith, P.R. and deHaseth, J.A. (1986). Fourier transform infrared spectroscopy. Chemical Analysis (Elving, P.J. Ed.). 83, Wiley Interscience New York Schrader, B. (1995). Infrared and Raman spectroscopy. VCH Weinheim Gronholz, J. and Herres, W. (1984). Datenverarbeitung in der FTIR-Spektroskopie, Teil 1: Datenaufnahme. Computer Anwendung im Labor. 5: 352-356 Herres, W. and Gronholz, J. (1984). Datenverarbeitung in der FTIR-Spektroskopie, Teil 2: Einzelheiten in der Spektrenberechnung. Computer Anwendung im Labor. 5: 418-425 137 Literaturverzeichnis ____________________________________________________________________________________________________________________________________________________ [71] [72] [73] [74] [75] [76] [77] [78] [79] [80] [81] [82] [83] [84] [85] [86] [87] [88] Gronholz, J. and Herres, W. (1984). Datenverarbeitung in der FTIR-Spektroskopie, Teil 3: Über einige nützliche Operationen im Interferogramm- und Zeitbereich. Computer Anwendung im Labor. 5: 230-240 Siebert, F. (1995). Infrared spectroscopy applied to biochemical and biological problems. Methods in Enzymology. 246: 501-26 Rothschild, K.J. (1992). FTIR difference spectroscopy of bacteriorhodopsin: toward a molecular model. [Review] [146 refs]. Journal of Bioenergetics & Biomembranes. 24: 147-67 Mäntele, W. (1993). Reaction-induced infrared difference spectroscopy for the study of protein function and reaction mechanisms. [Review] [38 refs]. Trends in Biochemical Sciences. 18: 197-202 Slayton, R.M. and Anfinrud, P.A. (1997). Time-resolved mid-infrared spectroscopy: methods and biological applications. [Review] [41 refs]. Current Opinion in Structural Biology. 7: 717-21 Gerwert, K. (1999). Molecular reaction mechanisms of proteins monitored by timeresolved FTIR-spectroscopy. [Review] [29 refs]. Biological Chemistry. 380: 931-5 Corrie, J.E.T. and Trentham, D.R. (1993). Caged nucleotides and neurotransmitters. In: Bioorganic photochemistry; Biological applications of photochemical switches. John Wiley & Sons, New York Tollin, G. (1995). Use of flavin photochemistry to probe intraprotein and interprotein electron transfer mechanisms. Journal of Bioenergetics & Biomembranes. 27: 303-309 Traber, R., Kramer, H.E. and Hemmerich, P. (1982). Mechanism of light-induced reduction of biological redox centers by amino acids. A flash photolysis study of flavin photoreduction by ethylenediaminetetraacetate and nitrilotriacetate. Biochemistry. 21: 1687-93 Ludovici, C., Fröhlich, R., Vogtt, K., Mamat, B. and Lübben, M. (2002). Caged O2: Reaction of cytochrome bo3 oxidase with photochemically released dioxygen from a cobalt peroxo complex. European Journal of Biochemistry: in Druck Lübben, M. and Gerwert, K. (1996). Redox FTIR difference spectroscopy using caged electrons reveals contributions of carboxyl groups to the catalytic mechanism of haemcopper oxidases. FEBS Letters. 397: 303-307 Pierre, J., Bazin, M., Debey, P. and Santus, R. (1982). One-electron photoreduction of bacterial cytochrome P-450 by ultraviolet light. I. Steady-state irradiations. European Journal of Biochemistry. 124: 533-7 Gu, Y., Li, P., Sage, T. and Champion, P.M. (1993). Photoreduction of Heme Proteins: Spectroscopic Studies and Cross-Section Measurements. Journal of the American Chemical Society 115: 4993-5004 Sakai, H., Onuma, H., Umeyama, M., Takeoka, S. and Tsuchida, E. (2000). Photoreduction of methemoglobin by irradiation in the near-ultraviolet region. Biochemistry. 39: 14595-14602 Bettinger, K. (2001). Spektroskopische Untersuchung und Charakterisierung der Photoreduktion von bakterieller und mitochondrialer Cytochrom Oxidase. Diplomarbeit, Ruhr-Universität Bochum Furhop, J.-H., Kadish, K.M. and Davis, D.G. (1973). Redox pot von Porphyrin und so. Journal of the American Chemical Society. 95: 5140-5147 Kadish, K.M. and Morrison, M.M. (1976). Redox potential von Porphyrin-radikalen. Journal of the American Chemical Society. 98: 3226-3328 Moss, D., Nabedryk, E., Breton, J. and Mäntele, W. (1990). Redox-linked conformational changes in proteins detected by a combination of infrared spectroscopy and protein electrochemistry. Evaluation of the technique with cytochrome c. European Journal of Biochemistry. 187: 565-572 138 Literaturverzeichnis ____________________________________________________________________________________________________________________________________________________ [89] [90] [91] [92] [93] [94] [95] [96] [97] [98] [99] [100] [101] [102] [103] [104] [105] Behr, J., Hellwig, P., Mäntele, W. and Michel, H. (1998). Redox dependent changes at the heme propionates in cytochrome c oxidase from Paracoccus denitrificans: direct evidence from FTIR difference spectroscopy in combination with heme propionate 13 C labeling. Biochemistry. 37: 7400-6 Hellwig, P., Mogi, T., Tomson, F.L., Gennis, R.B., Iwata, J., Miyoshi, H. and Mantele, W. (1999). Vibrational modes of ubiquinone in cytochrome bo(3) from Escherichia coli identified by Fourier transform infrared difference spectroscopy and specific (13)C labeling. Biochemistry. 38: 14683-9 Spiro, T.G. and Li, X.-Y. (1988). Resonance raman spectroskopy of metallopophyrins in: Biological applications of resonance Raman spectroskopy. Wiley and Sons. Spiro, T. Ed. Chapter 1 Winter, R. and Noll, F. (1992). Methoden der Biophysikalischen Chemie. Teubner Studienbücher: 357-364 Barth, A. (2000). The infrared absorption of amino acid side chains. [Review] [92 refs]. Progress in Biophysics & Molecular Biology. 74: 141-73 Studier, F.W., Rosenberg, A.H., Dunn, J.J. and Dubendorff, J.W. (1990). Use of T7 RNA polymerase to direct expression of cloned genes. Methods in Enzymology. 185: 6089 Yanisch-Perron, C., Vieira, J. and Messing, J. (1985). Improved M13 phage cloning vectors and host strains: nucleotide sequences of the M13mp18 and pUC19 vectors. Gene. 33: 103-19 Semple, K.S. and Silbert, D.F. (1975). Mapping of the fabD locus for fatty acid biosynthesis in Escherichia coli. Journal of Bacteriology. 121: 1036-46 Guest, J.R. (1969). Biochemical and genetic studies with nitrate reductase C-gene mutants of Escherichia coli. Molecular. Genetics 105: 285-291 Ho, S.N., Hunt, H.D., Horton, R.M., Pullen, J.K. and Pease, L.R. (1989). Site-directed mutagenesis by overlap extension using the polymerase chain reaction. Gene. 77: 51-9 Horton, R.M., Cai, Z.L., Ho, S.N. and Pease, L.R. (1990). Gene splicing by overlap extension: tailor-made genes using the polymerase chain reaction. Biotechniques. 8: 528-35 Saiki, K., Mogi, T., Hori, H., Tsubaki, M. and Anraku, Y. (1993). Identification of the functional domains in heme O synthase. Site-directed mutagenesis studies on the cyoE gene of the cytochrome bo operon in Escherichia coli. Journal of Biological Chemistry. 268: 26927-34 Verkhovskaya, M.L., Garcia-Horsman, A., Puustinen, A., Rigaud, J.L., Morgan, J.E., Verkhovsky, M.I. and Wikstrom, M. (1997). Glutamic acid 286 in subunit I of cytochrome bo3 is involved in proton translocation. Proceedings of the National Academy of Sciences of the United States of America. 94: 10128-10131 Ädelroth, P., Mitchell, D.M., Gennis, R.B. and Brzezinski, P. (1997). Factors determining electron-transfer rates in cytochrome c oxidase: studies of the FQ(I-391) mutant of the Rhodobacter sphaeroides enzyme. Biochemistry. 36: 11787-11796 Thomas, J.W., Lemieux, L.J., Alben, J.O. and Gennis, R.B. (1993). Site-directed mutagenesis of highly conserved residues in helix VIII of subunit I of the cytochrome bo ubiquinol oxidase from Escherichia coli: an amphipathic transmembrane helix that may be important in conveying protons to the binuclear center. Biochemistry. 32: 11173-80 Thomas, J.W., Calhoun, M.W., Lemieux, L.J., Puustinen, A., Wikström, M., Alben, J.O. and Gennis, R.B. (1994). Site-directed mutagenesis of residues within helix VI in subunit I of the cytochrome bo3 ubiquinol oxidase from Escherichia coli suggests that tyrosine 288 may be a CuB ligand. Biochemistry. 33: 13013-21 Prutsch, A., Vogtt, K., Ludovici, C. and Lübben, M. (2002). Electron transfer at the low-spin heme b of cytochrome bo3 induces an environmental change of the catalytic enhancer glutamic acid-286. Biochimica et Biophysica Acta - Bioenergetics: im Druck 139 Literaturverzeichnis ____________________________________________________________________________________________________________________________________________________ [106] Sambrook, T.F., E.F.; Maniatis, T. (1989) Molecular cloning: A laboratory manual, Verlag Cold Spring Harbour, NY. [107] Porath, J., Carlsson, J., Olsson, I. and Belfrage, G. (1975). Metal chelate affinity chromatography, a new approach to protein fractionation. Nature. 258: 598-9 [108] Smith, P.K., Krohn, R.I., Hermanson, G.T., Mallia, A.K., Gartner, F.H., Provenzano, M.D., Fujimoto, E.K., Goeke, N.M., Olson, B.J. and Klenk, D.C. (1985). Measurement of protein using bicinchoninic acid [published erratum appears in Anal Biochem 1987 May 15;163(1):279]. Analytical Biochemistry. 150: 76-85 [109] Peterson, G.L. (1977). A simplification of the protein assay method of Lowry et al. which is more generally applicable. Analytical Biochemistry. 83: 346-56 [110] Laemmli, U.K. (1970). Cleavage of structural proteins during the assembly of the head of bacteriophage T4. Nature. 227: 680-5 [111] Kyhse-Andersen, J. (1984). Electroblotting of multiple gels: a simple apparatus without buffer tank for rapid transfer of proteins from polyacrylamide to nitrocellulose. Journal of Biochemical & Biophysical Methods. 10: 203-9 [112] Rothery, R.A., Chatterjee, I., Kiema, G., McDermott, M.T. and Weiner, J.H. (1998). Hydroxylated naphthoquinones as substrates for Escherichia coli anaerobic reductases. Biochemical Journal. 332: 35-41 [113] Moody, A.J., Mitchell, R., Jeal, A.E. and Rich, P.R. (1997). Comparison of the ligandbinding properties of native and copper-less cytochromes bo from Escherichia coli. Biochemical Journal. 324: 743-52 [114] Lübben, M. and Morand, K. (1994). Novel prenylated hemes as cofactors of cytochrome oxidases. Archaea have modified hemes A and O. Journal of Biological Chemistry. 269: 21473-9 [115] Ma, J., Katsonouri, A. and Gennis, R.B. (1997). Subunit II of the cytochrome bo3 ubiquinol oxidase from Escherichia coli is a lipoprotein. Biochemistry. 36: 11298-303 [116] Warne, A., Wang, D.N. and Saraste, M. (1995). Purification and two-dimensional crystallization of bacterial cytochrome oxidases. European Journal of Biochemistry. 234: 443-51 [117] Butler, C.S., Cheesman, M.R., Greenwood, C., Thomson, A.J. and Watmough, N.J. (1997). Fast cytochrome bo from Escherichia coli reacts with azide and nitric oxide to form a complex analogous to that formed by cytochrome c oxidase. Biochemical Society Transactions. 25: 392S [118] Watmough, N.J., Cheesman, M.R., Butler, C.S., Little, R.H., Greenwood, C. and Thomson, A.J. (1998). The dinuclear center of cytochrome bo3 from Escherichia coli. Journal of Bioenergetics & Biomembranes. 30: 55-62 [119] Moody, A.J., Rumbley, J.N., Gennis, R.B., Ingledew, W.J. and Rich, P.R. (1993). Ligand-binding properties and heterogeneity of cytochrome bo from Escherichia coli. Biochimica et Biophysica Acta. 1141: 321-9 [120] Yoshikawa, S., Mochizuki, M., Zhao, X.J. and Caughey, W.S. (1995). Effects of overall oxidation state on infrared spectra of heme a3 cyanide in bovine heart cytochrome c oxidase. Evidence of novel mechanistic roles for CuB. Journal of Biological Chemistry. 270: 4270-4279 [121] Cheesman, M.R., Watmough, N.J., Gennis, R.B., Greenwood, C. and Thomson, A.J. (1994). Magnetic-circular-dichroism studies of Escherichia coli cytochrome bo. Identification of high-spin ferric, low-spin ferric and ferryl [Fe(IV)] forms of heme o. European Journal of Biochemistry. 219: 595-602 140 Literaturverzeichnis ____________________________________________________________________________________________________________________________________________________ [122] Watmough, N.J., Cheesman, M.R., Gennis, R.B., Greenwood, C. and Thomson, A.J. (1993). Distinct forms of the haem o-Cu binuclear site of oxidised cytochrome bo from Escherichia coli. Evidence from optical and EPR spectroscopy. FEBS Letters. 319: 151154 [123] Moody, A.J., Cooper, C.E., Gennis, R.B., Rumbley, J.N. and Rich, P.R. (1995). Interconversion of fast and slow forms of cytochrome bo from Escherichia coli. Biochemistry. 34: 6838-46 [124] Mitchell, R., Moody, A.J. and Rich, P.R. (1995). Cyanide and carbon monoxide binding to the reduced form of cytochrome bo from Eschericha coli. Biochemistry 34: 7576-7585 [125] Lemon, D.D., Calhoun, M.W., Gennis, R.B. and Woodruff, W.H. (1993). The gateway to the active site of heme-copper oxidases. Biochemistry. 32: 11953-11956 [126] Mamat, B. (1998). Neue Strategien der Infrarot-Spektroskopie an Häm-KupferOxidasen unter Anwendung optischer Trigger. Diplomarbeit, Ruhr-Universität Bochum [127] Vogtt, K. (2000). VIS- und FT-IR-spektroskopische Untersuchungen an der Ubichinoloxidase aus Escherichia coli. Diplomarbeit, Ruhr-Universität Bochum [128] Colthup, N.B., Daly, L.H. and Wiberley, S.E. (1975). Indruduction to infrared and raman spectroscopy. Academic Press, New York. 2nd Ed. [129] Mortimer, C.E. (1987). Chemie. Georg Thieme Verlag Stuttgart. 5. Auflage: 348 [130] Yamazaki, Y., Kandori, H. and Mogi, T. (1999). Effects of subunit I mutations on redoxlinked conformational changes of the Escherichia coli bo-type ubiquinol oxidase revealed by Fourier-transform infrared spectroscopy. Journal of Biochemistry. 126: 194-9 [131] Yamazaki, Y., Kandori, H. and Mogi, T. (1999). Fourier-transform infrared studies on conformation changes in bd-type ubiquinol oxidase from Escherichia coli upon photoreduction of the redox metal centers. Journal of Biochemistry. 125: 1131-1136 [132] Hellwig, P., Rost, B., Kaiser, U., Ostermeier, C., Michel, H. and Mäntele, W. (1996). Carboxyl group protonation upon reduction of the Paracoccus denitrificans cytochrome c oxidase: direct evidence by FTIR spectroscopy. FEBS Letters. 385: 53-57 [133] Prutsch, A. (1998). Biochemische und biophysikalische Untersuchungen an ortsspezifischen Mutanten der Ubichinol cytochrom bo3 Oxidase von Escherichia coli. Diplomarbeit, Ruhr-Universität Bochum [134] Behr, J., Michel, H., Mäntele, W. and Hellwig, P. (2000). Functional properties of the heme propionates in cytochrome c oxidase from Paracoccus denitrificans. Evidence from FTIR difference spectroscopy and site-directed mutagenesis. Biochemistry. 39: 1356-1363 [135] Herzog, G. (1962). Molecular spectra and molecular Structure: II. Infrared and Raman spectra of polyatomic molecules. D.van Nostrad Company, Inc., Princeton, NJ. [136] Morgan, J.E., Verkhovsky, M.I., Puustinen, A. and Wikstrom, M. (1993). Intramolecular electron transfer in cytochrome o of Escherichia coli: events following the photolysis of fully and partially reduced CO-bound forms of the bo3 and oo3 enzymes. Biochemistry. 32: 11413-11418 [137] Chow, S.A., Honigberg, S.M., Bainton, R.J. and Radding, C.M. (1986). Patterns of nuclease protection during strand exchange. recA protein forms heteroduplex DNA by binding to strands of the same polarity. Journal of Biological Chemistry. 261: 6961-71 [138] Braun, V. and Rehn, K. (1969). Chemical characterization, spatial distribution and function of a lipoprotein (murein-lipoprotein) of the E. coli cell wall. The specific effect of trypsin on the membrane structure. European Journal of Biochemistry. 10: 426-38 [139] Hantke, K. and Braun, V. (1973). Covalent Binding of Lipid to Protein. European Journal of Biochemistry 34: 284-296 [140] Musser, S.M. and Chan, S.I. (1998). Evolution of the cytochrome c oxidase proton pump. Journal of Molecular Evolution. 46: 508-20 [141] Bull, P.C. and Cox, D.W. (1994). Wilson disease and Menkes disease: new handles on heavy-metal transport. [Review] [37 refs]. Trends in Genetics. 10: 246-52 141 Literaturverzeichnis ____________________________________________________________________________________________________________________________________________________ [142] Petrukhin, K., Lutsenko, S., Chernov, I., Ross, B.M., Kaplan, J.H. and Gilliam, T.C. (1994). Characterization of the Wilson disease gene encoding a P-type copper transporting ATPase: genomic organization, alternative splicing, and structure/function predictions. Human Molecular Genetics. 3: 1647-56 [143] Lutsenko, S. and Kaplan, J.H. (1995). Organization of P-type ATPases: significance of structural diversity. [Review] [54 refs]. Biochemistry. 34: 15607-13 [144] Moody, A.J., Spencer, J.P. and Rich, P.R. (1993). The effects of bicarbonate/carbon dioxide on the near-UV/visible spectrum and ligand binding properties of fast bovine heart cytochrome c oxidase. Biochemical Society Transactions. 21: 346S [145] Moody, A.J., Richardson, M. and Rich, P.R. (1994). Storage effects on the ligand binding properties of bovine heart cytochrome c oxidase. Biochemical Society Transactions. 22: 286S [146] Baker, G.M., Noguchi, M. and Palmer, G. (1987). The reaction of cytochrome oxidase with cyanide. Preparation of the rapidly reacting form and its conversion to the slowly reacting form. Journal of Biological Chemistry. 262: 595-604 [147] Antonini, G., Brunori, M., Colosimo, A., Malatesta, F. and Sarti, P. (1985). Journal of. Inorganic Biochemistry 23: 289-293 [148] Puustinen, A., Verkhovsky, M.I., Morgan, J.E., Belevich, N.P. and Wikström, M. (1996). Reaction of the Escherichia coli quinol oxidase cytochrome bo3 with dioxygen: the role of a bound ubiquinone molecule. Proceedings of the National Academy of Sciences of the United States of America. 93: 1545-1548 [149] Sato-Watanabe, M., Itoh, S., Mogi, T., Matsuura, K., Miyoshi, H. and Anraku, Y. (1995). Stabilization of a semiquinone radical at the high-affinity quinone-binding site (QH) of the Escherichia coli bo-type ubiquinol oxidase. FEBS Letters. 374: 265-9 [150] Puustinen, A., Bailey, J.A., Dyer, R.B., Mecklenburg, S.L., Wikstrom, M. and Woodruff, W.H. (1997). Fourier transform infrared evidence for connectivity between CuB and glutamic acid 286 in cytochrome bo3 from Escherichia coli. Biochemistry. 36: 13195-13200 [151] Svensson-Ek, M., Thomas, J.W., Gennis, R.B., Nilsson, T. and Brzezinski, P. (1996). Kinetics of electron and proton transfer during the reaction of wild type and helix VI mutants of cytochrome bo3 with oxygen. Biochemistry. 35: 13673-13680 [152] Tsubaki, M., Mogi, T., Hori, H., Sato-Watanabe, M. and Anraku, Y. (1996). Infrared and EPR studies on cyanide binding to the heme-copper binuclear center of cytochrome bo-type ubiquinol oxidase from Escherichia coli. Release of a CuB-cyano complex in the partially reduced state. Journal of Biological Chemistry. 271: 4017-22 [153] Iwase, T., Varotsis, C., Shinzawa-Itoh, K., Yoshikawa, S. and Kitagawa, T. (1999). Infrared evidence for Cu-B ligation of photodissociated CO of cytochrome c oxidase at ambient temperatures and accompanied deprotonation of a carboxyl side chain of protein. Journal of the American Chemical Society. 121: 1415-1416 [154] Tsubaki, M., Mogi, T. and Hori, H. (1999). Fourier-transform infrared studies on azidebinding to the binuclear center of the Escherichia coli bo-type ubiquinol oxidase. FEBS Letters. 449: 191-5 [155] Kannt, A., Soulimane, T., Buse, G., Becker, A., Bamberg, E. and Michel, H. (1998). Electrical current generation and proton pumping catalyzed by the ba3 -type cytochrome c oxidase from Thermus thermophilus. FEBS Letters. 434: 17-22 [156] Gomes, C.M., Bandeiras, T.M. and Teixeira, M. (2001). A new type-II NADH dehydrogenase from the archaeon Acidianus ambivalens: Characterization and in vitro reconstitution of the respiratory chain. Journal of Bioenergetics & Biomembranes. 33: 1-8 [157] Aagaard, A., Gilderson, G., Mills, D.A., Ferguson-Miller, S. and Brzezinski, P. (2000). Redesign of the proton-pumping machinery of cytochrome c oxidase: proton pumping does not require Glu(I-286). Biochemistry. 39: 15847-50 142 Literaturverzeichnis ____________________________________________________________________________________________________________________________________________________ [158] Backgren, C., Hummer, G., Wikström, M. and Puustinen, A. (2000). Proton translocation by cytochrome c oxidase can take place without the conserved glutamic acid in subunit I. Biochemistry. 39: 7863-7867 [159] Pomes, R., Hummer, G. and Wikstrom, M. (1998). Structure and dynamics of a proton shuttle in cytochrome c oxidase. Biochimica et Biophysica Acta - Bioenergetics. 1365: 255-260 [160] Hofacker, I. and Schulten, K. (1998). Oxygen and proton pathways in cytochrome c oxidase. Proteins. 30: 100-107 [161] Wright, W.W., Laberge, M. and Vanderkooi, J.M. (1997). Surface of cytochrome c: infrared spectroscopy of carboxyl groups. Biochemistry. 36: 14724-32 [162] Caughey, W.S., Smythe, G.A., O'Keeffe, D.H., Maskasky, J.E. and Smith, M.I. (1975). Heme A of cytochrome c oxicase. Structure and properties: comparisons with hemes B, C, and S and derivatives. Journal of Biological Chemistry. 250: 7602-22 [163] Mogi, T., Nakamura, H. and Anraku, Y. (1994). Molecular structure of a heme-copper redox center of the Escherichia coli ubiquinol oxidase: evidence and model. Journal of Biochemistry. 116: 471-7 [164] Blomberg, M.R.A., Siegbahn, P.E.M., Babcock, G.T. and Wikström, M. (2000). Modeling cytochrome oxidase: A quantum chemical study of the O-O bond cleavage mechanism. Journal of the American Chemical Society. 122: 12848-12858 [165] Blomberg, M.R.A., Siegbahn, P.E.M., Babcock, G.T. and Wikström, M. (2000). O-O bond splitting mechanism in cytochrome oxidase. Journal of Inorganic Biochemistry. 80: 261-269 [166] Deacon, G.B. and Phillips, R.J. (1980). Relationship between the carbon-oxygen streching frequencies of carboxylate complexes and the type of carboxylate coordination. Coord. Chemical Reviews. 33: 227-250 [167] Puustinen, A. and Wikström, M. (1999). Proton exit from the heme-copper oxidase of Escherichia coli. Proceedings of the National Academy of Sciences of the United States of America. 96: 35-37 [168] Kannt, A., Lancaster, C.R. and Michel, H. (1998). The coupling of electron transfer and proton translocation: electrostatic calculations on Paracoccus denitrificans cytochrome c oxidase. Biophysical Journal. 74: 708-21 143 Lebenslauf Persönliche Daten Name: Geburtstag: Geburtsort: Staatsangehörigkeit: Familienstand: Alexander Walter Prutsch 03.11.1969 Mannheim österreich ledig Schulbildung 1976 bis 1980 1980 bis 1989 Mai 1989 Grundschule Johann Peter Hebel, Mannheim Lessing Gymnasium, Mannheim Allgemeine Hochschulreife Studium Okt.1989 bis Sept.1991 Okt.1991 bis Juli 1998 März 1994 Juli 1997 Aug.1997 bis Juli 1998 Seit Jan. 1999 Studium der Architektur an der Universität Kaiserslautern. Studium der Biologie an der Ruhr-Universität-Bochum. Diplom Vorprüfung. Mündliche Diplom Hauptprüfung. Diplomarbeit bei PD Dr. Mathias Lübben im Lehrstuhl für Biophysik/Projektgruppe Cytochrom Oxidasen an der Ruhr-Universität Bochum. Thema: „Biochemische und biophysikalische Untersuchungen an ortsspezifischen Mutanten der Ubichinol Cytochrom bo3 Oxidase von Escherichia coli“. Promotion bei PD Dr. Mathias Lübben im Lehrstuhl für Biophysik/Projektgruppe Cytochrom Oxidasen an der Ruhr-Universität Bochum. Dortmund im April, 2002 Veröffentlichungen: Lübben, M., Prutsch, A., Mamat, B. and Gerwert, K. (1999). Electron transfer induces sidechain conformational changes of glutamate-286 from cytochrome bo3 . Biochemistry. 38: 2048-2056 Prutsch, A., Lohaus, C., Green, B., Meyer, H.E. and Lübben, M. (2000). Multiple posttranslational modifications at distinct sites contribute heterogeneity of the lipoprotein cytochrome bo3 . Biochemistry. 39: 6554-6563 Prutsch, A., Vogtt, K., Ludovici, C. and Lübben, M. (2002). Electron transfer at the low-spin heme b of cytochrome bo3 induces an environmental change of the catalytic enhancer glutamic acid-286. Biochimica et Biophysica Acta - Bioenergetics. im Druck