ein gemischtes Erdalkalimetallnitrid mit fl#if/-La20 3
Werbung

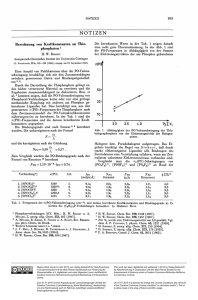
C a M g 2N 2 - ein gemischtes Erdalkalimetallnitrid mit fl#if/-La20 3-Struktur CaMg2N 2 - a Mixed Alkaline-Earth Metal Nitride with anti-La20 3 Structure Verena Schultz-Coulon, Wolfgang Schnick* Laboratorium für Anorganische Chemie, Universität Bayreuth, D-95440 Bayreuth Z. Naturforsch. 50b, 619-622 (1995); eingegangen am 31. August 1994 Alkaline-Earth Metal Nitrides, Preparation, Crystal Structure, Structural Relations CaMg2N 2 (trigonal, P 3 m l (Nr. 164); a = 354.046(1), c = 609.079(2) pm; Z = 1) is isotypic to the anti-La20 3 structure with octahedral and tetrahedral coordination for Ca2+ and M g2+ ions, respectively. The compound has been prepared by the reaction o f the binary nitrides Ca3N 2 and M g3N 2 (molar ratio 1:2) in a tungsten crucible under a pure nitrogen atmosphere at 1050 °C. The formation o f the solid CaM g2N 2 may be interpreted in analogy to reactions o f related oxides as an acid-base reaction between the binary nitrides with different coordina­ tion tendencies o f Ca2+ and M g2+ ions. A n analysis o f the binary aristotype anti-La20 3 indica­ tes that this structure is predisposed for building ternary phases. Einleitung Obwohl binäre Nitride der Alkali- und Erdalka­ limetalle seit langem bekannt sind, bestehen doch große Kenntnislücken bezüglich Struktur und Eigenschaften einiger Vertreter. So bildet unter den Alkalimetallen nur das leichteste Homologe, Lithium, ein stabiles binäres Nitrid der zu erwar­ tenden Zusammensetzung L i3N [1]. Für die Exi­ stenz oder Stabilität analoger Verbindungen der schwereren Alkalimetalle (Na, K, Rb, Cs) liegen keine verläßlichen Hinweise vor. In der zweiten Hauptgruppe kennt man Nitride der Zusammen­ setzung M 3N 2. Hier existieren jedoch bislang ge­ naue Strukturdaten nur für a-Be3N 2, M g3N 2 sowie a-Ca3N 2 [2-4], Die Verbindungen kristallisieren im am/-Mn20 3-Typ, einer Defekt-Fluorit-Variante mit tetraedrisch durch Stickstoff koordinierten Metallionen. Außerdem gibt es Subnitride M 2N (M = Ca, Sr, Ba) [5], und die Existenz von soge­ nannten Pernitriden M 3N 4 ("M = Ca, Sr, Ba) [6] wird ebenfalls gefordert. Über die letzte Verbin­ dungsgruppe sind bislang allerdings nur lücken­ hafte und widersprüchliche Informationen verfüg­ bar. Während es bei den Alkalimetallen eine ganze Reihe gemischter ternärer Oxide gibt, in denen die jeweiligen Metallionen charakteristische Koor­ dinationen durch Sauerstoffionen annehmen [7], wurden bislang keine Hinweise auf die Existenz * Sonderdruckanforderungen an Prof. Dr. W. Schnick. 0932-0776/95/0400 - 0619 $06.00 gemischter Alkali- oder Erdalkalimetallnitride er­ halten [8J. Im Faiie cid Alkahm etallnitride ist die­ ser Kenntnismangel sicherlich dadurch begründet, daß die als Edukte erforderlichen Nitride M 3N (M = Na, K, Rb, Cs) nicht existieren. W ir berichten in dieser Arbeit über das erste gemischte Erdalkalimetallnitrid mit der Zusam­ mensetzung CaMg2N 2, das sich ganz unerwartet durch Reaktion der binären Nitride Ca3N 2 und M g3N 2 bildet [9], Experimentelles Stöchiometrische Mengen der binären Nitride M g3N 2 [hergestellt aus geraspeltem Magnesium­ metall (Reinheit 99,995%, Fa. Ventron) im A m ­ moniakstrom, 950 °C, 5 h, Aufheizrate 315 °C h_1] und Ca3N 2 [hergestellt aus Calciummetall (R ein­ heit 99,997%, Fa. A B C R ) im Stickstoffstrom, 980 °C, 1 h, Aufheizrate 150 °C h_1] werden unter Argon-Schutzgas (Glove-Box, Fa. M B R A U N , Garching, 0 2 < 0,5 ppm, H 20 < 0,1 ppm) in einer Mikrokugelmühle homogenisiert. Die Reaktions­ mischung wird unter reiner N 2-Atmosphäre im Fingertiegel aus Wolfram in Quarzampullen einge­ schmolzen und bei 1050 °C zur Reaktion gebracht (24 h). CaMg2N 2 fällt dabei phasenrein in mikro­ kristalliner Form als farbloses Pulver an. Die Zusammensetzung CaMg2N 2 wurde nach Hydrolyse der Verbindung in verdünnter Schwe­ felsäure durch Elementaranalyse (Calcium und Magnesium komplexometrisch mit E D T A , Stick­ stoff photometrisch als Indophenol) bestätigt. Es wurden folgende Werte (G ew .-% ) ermittelt: 34,8 © 1995 Verlag der Zeitsch rift für Naturforschung. A ll rights reserved. Unauthenticated Download Date | 8/19/17 4:01 AM 620______V. Sch ultz-C oulon-W . Schnick • C a M g 2N 2 - ein gemischtes E rdalkalim etallnitrid mit <3nr/-La20 3-Struktur (Ca), 42,3 (M g ) und 23,3 (N ) (berechnete Werte: 34,35 (Ca), 41,65 (M g ) und 24,00 (N )). Die Kristallstruktur von CaMg2N 2 wurde auf der Basis von Röntgenpulverdaten ermittelt (Siemens-Pulverdiffraktometer D5000, CuKaj-Strah­ lung, Ge-Monochromator, linearer ortsempfind­ licher Detektor, Kapillarmessung). Die Tab. I und II enthalten Angaben zur Messung, Lösung und Verfeinerung der Kristallstruktur sowie kristallographische Daten, Atomkoordinaten und Auslenkungsparameter. Die ermittelten Gitter­ konstanten und Reflexionsbedingungen ließen be­ reits auf Isotypie von CaMg2N 2 zum anti-La20 3Typ [10] schließen. Die Kristallstruktur wurde schließlich auf der Basis der Atomparameter dieses Strukturtyps mit der Rietveld-Methode verfeinert. Ergebnisse und Diskussion In La20 3 liegen zwei ganz unterschiedlich durch La3+-Ionen koordinierte Sauerstoffionen vor. DaTab. I. CaM g2N 2: Kristallographische Daten und Anga­ ben zur Messung und Verfeinerung der Kristallstruktur. Kristallsystem Raumgruppe Gitterkonstanten [pm] V EZ [106 pm3] Z Diffraktometer Strahlung Monochromator Beugungswinkelbereich Anzahl Datenpunkte Anzahl beobachteter Reflexe Anzahl verfeinerter Parameter Strukturverfeinerung /«-Werte CaMg2N 2 trigonal P 3 m l (Nr. 164) a = 354,046(1) c - 609,079(2) 66,118 durch resultiert ein schichtartiger Aufbau aus O L a 4-Tetraedern alternierend mit O La6-Oktaedern, so daß (L a 20 2) 0 als Aristotyp ternärer Verbindungen angesehen werden kann [11]. Die O L a 4-Tetraeder sind über 3 gemeinsame Kan­ ten miteinander verknüpft. Somit ergibt sich gemäß c£[La[7l20 [4120 l6l) eine oktaedrische Koor­ dination der Metallionen durch Sauerstoff mit einem zusätzlichen 0 2-Ion über einer Oktaeder­ fläche. Entsprechend bilden die N 3~-Ionen in ^ [C a [6)M g ^ 2N [7]2] eine nahezu unverzerrte hexa­ gonal-dichte Kugelpackung und sind pseudo-okta­ edrisch durch 3M g2+- und 3Ca2+-Ionen koordi­ niert mit einem zusätzlichen M g2+-Ion über einer Oktaederfläche. Die sich schichtweise abwech­ selnden Tetraeder- und Oktaederlücken sind mit M g2+- bzw. Ca2+-Ionen gefüllt. Somit ist CaMg2N 2 isotyp mit L i2Z rN 2 [12 a] sowie mit C eLi2N 2 [12b], In diesen Verbindungen besetzen die kleineren L i+-Ionen (Ionenradius: 62 pm [13]) ebenfalls die aus Stickstoffatomen gebildeten Tetraederlücken, während die größeren Metallionen Z r4+ (Ionen­ radius: 78 pm [13]) bzw. Ce4+ (Ionenradius: 101 pm [13]) die entsprechenden Oktaederlücken besetzen. Abb. 1 zeigt einen Ausschnitt aus der Kristallstruktur von CaMg2N 2 mit schichtartigem Aufbau aus miteinander verknüpften M gN 4-Tetra- 1 Siemens D5000 CuKct! Germanium 5° < 26 < 105° 12031 29 17 (Profil)/5 (Struktur) modifiziertes Rietveldverfahren [18] Profil: A(p) = 0,087, ^(wP) = 0,118 Struktur: = 0,066, G O F = 0,016 Tab. II. Atomkoordinaten und Temperaturfaktoren von CaM g2N 2 mit Standardabweichungen in Klammern. Der isotrope Temperaturparameter ist definiert als (- 8 jr 2U iso sin2 6/X2). Name Position x/a y/b Ca Mg N lb 2d 2d 0 1/3 1/3 0 2/3 2/3 zJc 1/2 -0.1396(2) 0.2374(7) Uiso 0.04(5) 0.03(4) 0,05(9) Abb. 1. Kristallstruktur von CaM g2N 2 mit schichtarti­ gem Aufbau aus miteinander verknüpften M gN 4-Tetraedern und CaN6-Oktaedern. Die M gN 4-Tetraeder sind als geschlossene Polyeder, die N 3'-Ion en als offene Kreise und die Ca2+-Ionen als schwarze Kugeln darge­ stellt. Unauthenticated Download Date | 8/19/17 4:01 AM V. Sch u ltz-C ou lon-W . Schnick • C a M g 2N 2 - ein gemischtes Erdalkalim etallnitrid mit flrtf/-La2Q 3-Struktur edern und CaN6-Oktaedern. Die ermittelten M g - N - und Ca-N-Abstände, die in Tab. III auf­ geführt sind, entsprechen den jeweiligen Summen der Ionenradien [13]. Während die binären Oxide der Erdalkali­ metalle einschließlich Magnesium im NaCl-Typ kristallisieren (M 2+-Ionen in Oktaederlücken) und untereinander Mischkristalle bilden [14], wird im quasibinären System M g3N 2/Ca3N 2 mit CaMg2N 2 ein von den binären Randphasen abweichender Strukturtyp realisiert. Im Gegensatz zum kri­ stallchemisch identischen Verhalten von M g2+und Ca2+-Ionen in den isotypen Verbindungen a-Ca3N 2 und M g3N 2 wird hier ein unterschiedli­ ches Koordinationsbedürfnis (tetraedrisch bzw. oktaedrisch) beider Metallionen deutlich. In der einzig bislang gut untersuchten Modifikation von Ca3N 2 liegen ausschließlich tetraedrisch durch N 3~-Ionen koordinierte Ca2+-Ionen vor. Die Exi­ stenz weiterer Modifikationen dieser Verbindung wird zwar vermutet, genaue Strukturdaten liegen jedoch nicht vor [15]. Hier wäre eine Variation in der Koordination der Ca2+-Ionen denkbar. Als Triebkraft der Bildung von CaMg2N 2 kann in Erweiterung des Konzeptes von Lux und Flood [16] auf Nitride eine Reaktion zwischen saurem M g3N 2 und basischem Ca3N 2 angenommen wer­ den. Kristallchemisch kommt hier die Zunahme des elektropositiven Charakters beim Übergang von Magnesium zu Calcium zum Ausdruck [17], [1] A . Rabenau, Solid States Ionics 6, 277 (1982). [2] M. von Stackeiberg, R. Paulus, Z. Phys. Chem. B 22, 305 (1933). [3] J. David, Y. Laurent, J. Lang, Bull. Soc. Fr. Mineral. Cristallogr. 94, 340 (1971). [4] J. Jäger, D. Stahl, P. C. Schmidt, R. Kniep, Angew. Chem. 105, 738 (1993). [5] a) E. T. Keve, A. C. Skapski, Inorg. Chem. 7, 1757 (1968); b) N. E. Brese, M. O ’Keeffe, J. Solid State Chem. 87, 134 (1990); c) H.-T. Künzel, Metallreiche Bariumnitride, Disser­ tation, Universität Stuttgart (1980). [6] a) H. Hartmann, H. J. Fröhlich, F. Ebert, Z. Anorg. Allg. Chem. 218, 181 (1934); b) Y. Okamoto, J. C. Goswami, Inorg. Chem. 5 , 1281 (1966); c) K.-H. Linke, H. Lingmann, Z. Anorg. Allg. Chem. 366, 82 (1969). 621 Tab. III. Bindungsabstände [pm] und -winkel [°] in der Kristallstruktur von CaM g2N 2, Standardabweichungen in Klammern. C a -N M g -N C a -M g M g -C a M g -M g N -C a -N N -M g -N 259,5(2) 229,6(4) 212,9(1) 299,9(1) 299,9(1) 265,9(1) 86,00(8) 93,99(8) 180,00(0) 106,2(1) 112,50(7) sechsmal dreimal sechsmal dreimal dreimal sechsmal sechsmal dreimal dreimal dreimal die im Festkörper bei gleichzeitig steigendem Kat­ ionenradius eine Tendenz zu höheren Koordina­ tionszahlen bewirkt. Im Gegensatz zu den intensiv farbigen, binären Nitriden M g3N 2 (gelb) und a-Ca3N 2 (kastanien­ braun) ist CaMg2N 2 farblos. Dieser Befund ist nicht quantitativ erklärbar, denn es liegen bislang keine zuverlässigen Erkenntnisse über die Farbig­ keit einfacher Alkali- oder Erdalkalimetalloxide und -nitride wie L i3N (braunrot), Cs20 (orange), M g3N 2 oder Ca3N 2 vor. Dank Diese Arbeit wurde von der Deutschen For­ schungsgemeinschaft und dem Fonds der Chemi­ schen Industrie gefördert. [7] a) KLiO : H. Sabrowsky, P. Mertens, F. O. Dönhoff, Z. Naturforsch. 40 b, 122 (1985). H. Sabrowsky, P. Mertens, A . Thimm, Z. Kristallogr. 171, 1 (1985); b) LiRbO: H. Sabrowsky, P. Vogt, Z. Anorg. Allg. Chem. 553, 226 (1987); c) KNaO: H. Sabrowsky, U. Schröer, Z. Natur­ forsch. 37b, 818 (1982); d) NaRbO: H. Sabrowsky, A . Thimm, P. Vogt-Mertens, Z. Naturforsch. 40b, 1761 (1985). [8] Allerdings wurde bereits über gemischte Alkali-erdalkalimetallnitride berichtet: z. B. LiM gN mit antiFluorit-Struktur und statischer Verteilung der Kat­ ionen (R. Juza, F. Hund, Z. Anorg. Allg. Chem. 257, 1 (1948)), auch CaLiN leitet sich von der FluoritStruktur ab (G. Cordier, A . Gudat, R. Kniep, A. Rabenau, Angew. Chem. 101, 1689 (1989)). Da­ gegen entspricht LiSrN dem CsCl-Struktur-Typ (G. Cordier, A . Gudat, R. Kniep, A . Rabenau, Angew. Chem. 101, 204 (1989)). Unauthenticated Download Date | 8/19/17 4:01 AM 622______ V. Sch u ltz-C ou lon -W . Schnick • C a M g 2N 2 - ein gemischtes E rdalkalim etallnitrid mit fl/7/7-La2Q 3-Struktur [9] Die in der Literatur geforderte Existenz von Ca3M g3N 4 mit violetter Farbe konnte nicht bestätigt werden (vgl. J. David, J. Lang, C.R. Acad. Sei. Ser. C 269, 771 (1969); J. David. Rev. Chim. Miner. 9, 717 (1972)). Es bestehen jedoch Ähnlichkeiten zwischen dem von diesen Autoren mitgeteilten Beugungsdia­ gramm und demjenigen von CaM g2N 2. [10] R Aldebert, J. R Traverse, Mat. Res. Bull. 14, 303 (1979). [11] Vgl. Ce20 2S; W. FI. Zachariasen, Acta Crystallogr. 1, 265 (1948); 2, 60 (1949). [12] a) Li^ZrN2: R. Juza, A.-R Palisaar, Z. Anorg. Allg. Chem. 384', 1 (1971); b) C eLi2N 2: D. Halot, M. J. Flahaut, C.R. Acad. Sei. Ser. C 272, 465 (1971). M. G. Barker, I. C. Alexan­ der, J. Chem. Soc. Dalton Trans. 3, 2166 (1974). [13] W. H. Baur, Crystallogr. Rev. 1, 59 (1987). [14] a) A. F. Wells, Structural Inorganic Chemistry. S. 537, Clarendon Press, Oxford, (1984); b) W. F. Ford, J. White, Trans. Brit. Ceram. Soc. 48, 417 (1949). [15] a) Y. Laurent. J. David, J. Lang. C.R. Acad. Sei. Ser. C 259, 1132 (1964); b) Y. Laurent, Rev. Chim. Miner. 5, 1019 (1968). [16] a) H. Lux, Z. Elektrochem. Angew. Phys. Chem. 45, 303 (1939); b) H. Flood, T. Förland. Acta Chem. Scand. 1, 592 (1947); c) H. Flood. T. Förland, Acta Chem. Scand. 1, 790 (1947). [17] A . F. Holleman, N. Wiberg, Lehrbuch der Anorga­ nischen Chemie, S. 925, Walter de Gruyter, Berlin. New York (1985). [18] W IN -R IE T V E L D , Vers. 1.01, Fa. Sigma-C GmbH. Ottobrunn. Unauthenticated Download Date | 8/19/17 4:01 AM