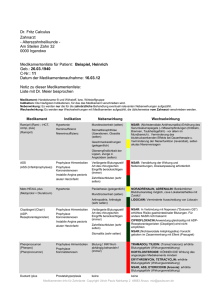
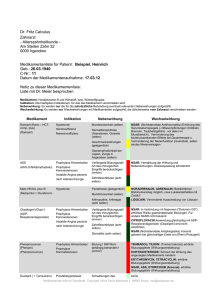
Diplomarbeit SINGER
Werbung

Diplomarbeit Die fünf gefährlichsten Arzneimittelinteraktionen im Alter eingereicht von Singer Markus Geb.Dat.: 17.4.1972 zur Erlangung des akademischen Grades Doktor der gesamten Heilkunde (Dr. med. univ.) an der Medizinischen Universität Graz ausgeführt am Institut für Experimentelle und Klinische Pharmakologie unter der Anleitung von Mag. pharm. Dr. phil. Univ.-Prof. Eckhard Beubler Graz, März 2012 (Unterschrift) Der freie Mensch ist der ohne Zwang wollende. Er glaubt an die Wirklichkeit; das heisst: er glaubt an die reale Verbundenheit der realen Zweiheit Ich und Du. Er glaubt an die Bestimmung und daran, dass sie seiner bedarf: sie gängelt ihn nicht, sie erwartet ihn, er muss auf sie zugehen, und weiss doch nicht, wo sie steht; er muss mit dem ganzen Wesen ausgehen, das weiss er. Es wird nicht so kommen, wie sein Entschluss es meint; aber was kommen will, wird nur kommen, wenn er sich zu dem entschliesst, was er wollen kann. Er muss seinen kleinen Willen, den unfreien, von Dingen und Trieben regierten, seinem grossen opfern, der vom Bestimmtsein weg und auf die Bestimmung zu geht. Da greift er nicht mehr ein, und er lässt doch auch nicht bloss geschehen. Er lauscht dem aus sich Werdenden, dem Weg des Wesens in der Welt; nicht, um von ihm getragen zu werden: um es selber so zu verwirklichen, wie es von ihm, dessen es bedarf, verwirklicht werden will, mit Menschengeist und Menschentat, mit Menschenleben und Menschentod. Er glaubt, sagte ich; damit ist aber gesagt: er begegnet. Martin Buber Eidesstattliche Erklärung Ich erkläre ehrenwörtlich, dass ich die vorliegende Arbeit selbstständig und ohne fremde Hilfe verfasst habe, andere als die angegebenen Quellen nicht verwendet habe und die den benutzten Quellen wörtlich oder inhaltlich entnommenen Stellen als solche kenntlich gemacht habe. Graz, am …… Unterschrift Gleichheitsgrundsatz: Um die Lesbarkeit der vorliegenden Arbeit zu erleichtern, habe ich mich dazu entschlossen, das generische Maskulinum zu verwenden. Jedoch möchte ich ausdrücklich festhalten, dass sowohl männliche als auch weibliche Personen eingeschlossen sind. i Danksagungen Ich danke Herrn Mag. pharm. Dr. phil. Univ.-Prof. Eckhard Beubler, einem Pharmakologen mit Herz, der den leidenden Menschen, dem die Pharmakologie dienlich sein möchte, nie aus den Augen verloren hat und sich darin einen kritischen Blick auf die Ärzteschaft und ihren Umgang mit Arzneimitteln bewahren konnte. Ich danke meiner Familie: Herrn Dir.i.R. Maximilian Blümel Frau Theresia Blümel Herrn Horst Singer Frau Renate Singer So vieles geht auf sie zurück. ii Zusammenfassung Die Polypragmasie, der man im Rahmen der medikamentösen Betreuung des älteren Menschen heute überall begegnet, ist in vielen Fällen kaum vermeidbar, weil die Bedarfsmedikationen für Schmerzen, Depression oder Thrombose aufgrund der häufigeren Erkrankungen im Alter auf ein eingeführtes Therapieschema treffen, mit dem es dann in weiterer Folge zu oft gefährlichen Wechselwirkungen kommt. Die Pharmakokinetik zeigt mit den CYP-Enzymen die wichtigsten Aspekte für Wechselwirkungen: bei gleichzeitiger Kombination eines Wirkstoffes mit anderen Arzneimitteln, aber auch mit Nahrungsmitteln wie z.B. Grapefruitsaft muss an die Möglichkeit der Enzyminduktion oder der Hemmung gedacht werden. NSAR: Ihre vielseitige Einsetzbarkeit als „Schmerzmittel“ macht sie zu einer wichtigen Bedarfsmedikation, auf deren Interaktionsmöglichkeiten geachtet werden muss: es kommt zu vermehrten gastrointestinalen Blutungen, vor allem in Verbindung mit anderen Analgetika und Antidepressiva und die Retention von Natrium und Wasser in der Niere kann eine antihypertensive Therapie erschweren. ASS: Je nach Dosierung zeigt der Wirkstoff eine reine thrombozytenaggregationshemmende Wirkung oder zusätzliche analgetische und antiphlogistische Komponenten. Der antithrombotische Effekt kann durch Wechselwirkungen mit anderen NSAR reduziert oder in Kombination mit Antibiotika auch verstärkt werden. ACE-Hemmer: Im Rahmen einer antihypertensiven Therapie hat neben den Änderungen der Lebensführung, die vom Patienten konsequent verfolgt werden müssen, die Beeinflussung des Renin-Angiotensin-Aldosteronsystems einen hohen Stellenwert. ACE-Hemmer dürfen nicht unkritisch mit Substanzen kombiniert werden, die zu einer Kaliumerhöhung beitragen können. Statine: Dem metabolischen Syndrom kann nur in der Gemeinsamkeit von Änderung der Lebensgewohnheiten und pharmakologischer Therapie begegnet werden, wobei der therapeutischen Beziehung eine wichtige Bedeutung zukommt. iii Die pharmakokinetischen Wechselwirkungen der Statine müssen vor allem in Hinblick auf eine mögliche Rhabdomyolyse beobachtet werden. SSRI: Die medikamentöse Therapie der Depression ist äussert erfolgreich und trägt deutlich zu einem positiven Therapieergebnis bei. SSRI sind die am häufigsten verwendeten Arzneimittel und haben sich bei sorgfältiger Beobachtung eventuell auftretender suizidaler Tendenzen als therapeutisch wertvolle Medikamente erwiesen. Interaktionen betreffen vor allem die Möglichkeit von Blutungen, die durch die Wirkung der SSRI als Thrombozytenaggregationshemmer hervorgerufenen werden, insbesondere bei gleichzeitiger Einnahme mit einem NSAR, aber auch alle serotonergen Wirkstoffe, die in Kombination mit den SSRI ein Serotonin-Syndrom auslösen können. iv Abstract Therpeutic intervention consisting of multiple drugs is very often in itself inevitable, especially in the treatment of the elderly patient, who is in need of long term care and, inbetween, may need extra medication for pain, depression or risk of thrombosis. This situation results in various possibilities for the applied drugs to interact with one another, very often with dangerous results for the patient. Pharmakokinetics constitute the centre of attention in this matter: the CYPenzymes and their influcene on the metabolism via induction or inhibition must be thought of when administering any drug within a concommitant therapeutic setting and even alimentary aspects (i.e grapefruite juice, alcohol) must be taken into consideration. NSAID: These „painkillers“ are easily available and therefore used extensively so that drug interactions are bound to happen: gastrointestinal haemorrhages do occur when NSAIDs are used concurrently with other antiinflammatory medication or antidepressants (SSRI) and retained sodium and water in the renal tube system may highten the blood pressure or make antihypertensive medication useless. Aspirin: Acetylsalicylacid inhibits platelett aggregation in a low dose application which is accompanied by analgetic and antiphlogistic components when the dosage is increased. Other NSAIDs can diminish the antithrombotic effect, especially when both drugs are given simultaneously, but in combination with antibiotics the adverse effect is also possible. ACE-inhibitors: Therapeutic intervention has often to be accompanied by changes in the very lifestyle, that ultimately caused the worsened condition: hypertension can be treated very effectively, but only if the individual´s contribution is substantial. ACE-inhibitors interfere with the RAA-system and have to be carefully monitored in combination with any other substance, that might influence the level of potassium in the body. Statines: Obesity as an actual disease can only be treated with a combined effort of both the patient and the treating physician, otherwise nothing will change and the cardiovaskular risk is going to increase even further. Statines have many positive effects on a variety of pathological pathways (including infection as well as v LDL-reduction), but they have to be monitored carefully for any possible interaction causing muscle damage (myositis, rhabdomyolysis). SSRI: Pharmacological treatment of depression is highly successful when administered with diligence and the ever present watchfullness of any sign of suicidal behaviour on behalf of the patient. SSRIs are used extensively today and have shown to contribute in a most postive way to the outcome of the treated disease. Interactions concern the possibility of haemorrhages due to the inhibitory effect of the SSRI on the platelett aggregation, especially when they are used simultaneously with an NSAID and the accumulation of sertononerg substances resulting in serotonin syndrome. vi Inhaltsverzeichnis DANKSAGUNGEN ................................................................................................ II ZUSAMMENFASSUNG ........................................................................................ III ABSTRACT............................................................................................................ V ABBILDUNGSVERZEICHNIS ............................................................................... X TABELLENVERZEICHNIS ................................................................................... XI ABKÜRZUNGSVERZEICHNIS............................................................................ XII 1. EINLEITUNG ................................................................................................. 1 2. ALLGEMEIN.................................................................................................. 4 2.1. Möglichkeiten für Arzneimittelinteraktionen ........................................... 4 2.1.1. Absorption ..................................................................................... 4 2.1.2. Distribution (Verteilung) ................................................................. 6 2.1.3. Metabolismus (Biotransformation)................................................. 7 2.1.4. Elimination (Ausscheidung) ......................................................... 12 3. 2.2. Wechselwirkungen mit Nahrungsmitteln.............................................. 12 2.3. Pharmakodynamische Wechselwirkungen .......................................... 14 2.4. Auswirkungen auf den Elektrolythaushalt ............................................ 14 2.5. Serotonin Syndrom .............................................................................. 15 2.6. Anticholinerges Syndrom..................................................................... 16 2.7. Gefahr der QT-Verlängerung ............................................................... 17 NICHT STEROIDALE ANTIRHEUMATIKA (NSAR) ................................... 19 3.1. Allgemein............................................................................................. 19 3.1.1. Stufenschema der Schmerztherapie (WHO) ............................... 19 3.1.2. Nicht-Opioidanalgetika ................................................................ 21 3.1.3. NSAR: nicht steroidale Antirheumatika ....................................... 22 3.2. Interaktionen ........................................................................................ 26 3.2.1. WW mit Arzneimitteln bei säurebedingten Erkrankungen ........... 26 vii 3.2.2. 3.2.3. 3.2.4. 3.2.5. 3.2.6. 3.2.7. 3.2.8. 3.2.9. 3.2.10. 4. WW mit anderen NSAR............................................................... 26 WW mit systemischen Corticosteroiden ...................................... 27 WW mit Antihypertensiva ............................................................ 27 WW mit Antidepressiva ............................................................... 28 WW mit oralen Antikoagulantien ................................................. 28 WW mit Heparin und Clopidogrel ................................................ 29 WW der Coxibe mit Antimykotika ................................................ 29 WW mit Nahrungsmitteln bzw. Mikronährstoffen......................... 30 WW von Paracetamol.................................................................. 31 ACETYLSALICYLSÄURE (ASS) ................................................................ 32 4.1. Allgemein............................................................................................. 32 4.2. ASS als nicht steroidales Antirheumatikum ......................................... 32 4.3. ASS als Thrombozytenaggregationshemmer ...................................... 34 4.3.1. Arterielle vs. venöse Thromben.................................................. 34 4.3.2. Acetylsalicylsäure........................................................................ 35 4.4. Interaktionen ........................................................................................ 36 4.4.1. WW mit anderen NSAR............................................................... 36 4.4.2. WW mit Antikoagulantien ............................................................ 36 4.4.3. WW mit Antibiotika ...................................................................... 37 4.4.4. WW mit Vitamin C ....................................................................... 37 5. ACE-HEMMER ............................................................................................ 38 5.1. Allgemein: Therapie des arteriellen Hypertonus .................................. 38 5.2. ACE-Hemmer ...................................................................................... 41 5.3. Interaktionen ........................................................................................ 43 5.3.1. WW mit Diuretika......................................................................... 43 5.3.2. WW mit NSAR............................................................................. 44 5.3.3. WW mit Azathioprin..................................................................... 45 5.3.4. WW mit Cotrimoxazol/Trimethoprim............................................ 45 5.3.5. WW mit Insektengift zur Desensibilisierung................................. 45 5.3.6. WW mit Kaliumpräparaten und Zink............................................ 46 6. STATINE...................................................................................................... 47 6.1. Allgemein: Übergewicht und Metabolisches Syndrom ......................... 47 6.2. Statine ................................................................................................. 48 6.3. Interaktionen ........................................................................................ 49 6.3.1. WW mit Azol-Antimykotika .......................................................... 50 6.3.2. WW mit Kalziumantagonisten: Verapamil und Diltiazem............. 50 6.3.3. WW mit Antiarrhythmika: Amiodaron und Dronedaron................ 50 6.3.4. WW mit Makrolid-Antibiotika........................................................ 51 viii 6.3.5. 6.3.6. 7. WW mit Grapefruitsaft ................................................................. 51 WW mit Mikronährstoffen ............................................................ 52 SELEKTIVE SEROTONIN-RÜCKAUFNAHME HEMMER (SSRI) .............. 53 7.1. Allgemein............................................................................................. 53 7.2. SSRI .................................................................................................... 54 7.3. Interaktionen ........................................................................................ 56 7.3.1. WW mit NSAR............................................................................. 56 7.3.2. Serotonin-Syndrom ..................................................................... 56 7.3.3. WW mit Mikronährstoffen ............................................................ 58 ANHANG.............................................................................................................. 59 7.4. Substrate, Induktoren und Hemmer der CYP-Enzyme, geordnet nach Arzneimittelgruppen ......................................................................................... 59 7.5. Literaturverzeichnis.............................................................................. 66 ix Abbildungsverzeichnis Abbildung 1: Verdrängung aus der Plasmaeiweissbindung…………………...6 Abbildung 2: Arzneimittelmetabolismus……………………………………….....7 Abbildung 3: Enzymhemmung bei oraler Aufnahme……………………..........10 Abbildung 4: Enzymindunktion bei oraler Aufnahme.......................................11 Abbildung 5: QT-Intervall und QTc..................................................................17 Abbildung 6: Arachidonsäure Metabolismus....................................................23 Abbildung 7: Therapie des arteriellen Hypertonus...........................................41 Abbildung 8: Renin-Angiotensin-Aldosteron-System.......................................42 x Tabellenverzeichnis Tabelle 1: Prostaglandinbildung durch zwei COX-Isoenzyme........................24 Tabelle 2: Substrate ................................................................59 Tabelle 3: Induktoren des CYP 3A4................................................................60 Tabelle 4: Hemmer .................................................................60 Tabelle 5: Substrate ................................................................61 Tabelle 6: Induktoren des CYP 1A2................................................................61 Tabelle 7: Hemmer ................................................................61 Tabelle 8: Substrate................................................................62 Tabelle 9: Induktoren des CYP 2C19................................................................62 Tabelle 10:Hemmer................................................................62 Tabelle 11: Substrate................................................................63 Tabelle 12: Induktoren des CYP 2C9................................................................63 Tabelle 13: Hemmer................................................................64 Tabelle 14: Substrate................................................................64 Tabelle 15: Hemmer des CYP 2D6 ................................................................65 Tabelle 16: Substrate................................................................65 Tabelle 17: Induktoren des CYP 2E1................................................................65 xi Abkürzungsverzeichnis ACE Angiotensin-Converting-Enzyme ASS Acetylsalicylsäure AUC Area under the curve bzw. beziehungsweise ca. circa CRP C-reaktives Protein CYP Cytochrom P 450 d.h. das heisst DM Diabetes mellitus FADR Fatal adverse drug reaction. unerwünschte Arzneimittelwirkung mit Todesfolge GI-Trakt Gastrointestinaltrakt HDL High density lipoprotein HMG-CoA 3-Hydroxy-3-methyl-glutaryl-Coenzym A HP Helicobacter pylori IDL Intermediate densitiy lipoprotein INN International nonproprietary name, internationaler Freiname i.v. intravenös kg Kilogramm LDL Low density lipoprotein m Meter MAO Monoaminoxidase ms Millisekunden NSAR Nicht steroidales Antirheumatikum NO Stickstoffmonoxyd OTC over the counter, nicht verschreibungspflichtiges Medikament p.o. peroral PPI Protonenpumpeninhibitoren RAAS Renin-Angiotensin-Aldosteron-System sec Sekunden SNRI Selektiver Serotonin und Noradrenalin Reuptake Inhibitor xii SSRI Selektiver Serotonin Reuptake Inhibitor TCA Tricyclische Antidepressiva u.a. und andere v.a. vor allem vs. versus WHO World Health Organisation, Weltgesundheitsorganisation WW Wechselwirkungen z.B. zum Beispiel ZNS Zentralnervensystem % Prozent xiii 1. Einleitung Die beiden Kriterien, die zur Wahl des Themas geführt haben, sind persönlicher und beruflicher Natur: einerseits sollte sich die Arbeit in ihrem Kern mit meiner Grossmutter, Frau Theresia Blümel, beschäftigen, mit der ich lange Zeit gemeinsam gelebt habe und die am 12. Jänner 2012 im Alter von 98 Jahren verstorben ist- kurz, bevor ich mit der Arbeit begonnen habe. Andererseits sollte die Beschäftigung mit dem Thema einen Wissensgewinn ermöglichen, der sich auch praktisch in jenem Umfeld einsetzen lässt, mit dem sich ein Arzt schon zu Beginn seiner Tätigkeit konfrontiert sieht. Der Anteil an Todesfällen auf Grund unerwünschter Arzneimittelwirkungen (FADR: fatal adverse drug reactions) wird im stationären Bereich mit ungefähr 5% angegeben, die Inzidenz in der Gesamtbevölkerung war aber bisher nicht bekannt. In einer schwedischen Studie (Wester et al., 2007) konnte gezeigt werden, dass sie bei 3,1% liegt: somit Arzneimittelwirkungen die ist davon auszugehen, dass unerwünschte siebente Stelle der Todesursachen innerhalb der Bevölkerung einnehmen. Die am häufigsten mit FADR in Verbindung gebrachten Medikamente waren Thrombozytenaggregationshemmer, NSAR, Antidepressiva (vor allem SSRI) und kardiovaskuläre Therapeutika (vor allem ACE-Hemmer). Die zum Tode führenden Ereignisse bestanden zu zwei Drittel aus Blutungen im Rahmen des GI-Traktes und des ZNS, es wurden aber auch Hyperkaliämie als Folge von Nierendysfunktion und kardiovaskuläre Störungen wie Bradykardie, Herzversagen oder Kardiomyopathie als FADR identifiziert. Geriatrie und Polypharmazie: Die Kenntnis der demographischen Entwicklung in den Industrieländern ist mittlerweile in das Allgemeinwissen eingegangen: sie ist kein Zukunftsszenario mehr, sondern gelebte Wirklichkeit, die Wissenschafter aller Disziplinen beschäftigt. In der medikamentösen Therapie des älteren Menschen nimmt die Polypharmakotherapie als Teil der Polypragmasie einen bedeutsamen Stellenwert ein: einerseits bedingen chronisch-degenerative Erkrankungen oftmals den 1 Einsatz mehrerer Arzneimittel, andererseits kommt es aufgrund der Gesamtsituation des Organismus durch Organinsuffizienzen (v.a. Herz-, Leberund Niereninsuffizienz) und einer im Ganzen reduzierte Abwehrlage häufiger zu akuten Erkrankungen (Infekte, Infarktgeschehen), die eine zusätzliche Bedarfsmedikation veranlassen. Auch kann das Entstehen von „Medikamentenkaskaden“ in der Therapie eines Symptoms, z.B. „Schmerz“ nicht immer verhindert werden: der Einsatz eines NSAR zieht einen Magenschutz nach sich, eventuell kommen auch ACE-Hemmer und ein Diuretikum dazu (wenn sich die linksventrikuläre Funktion verschlechtert). Einem Opioid folgen die Gabe eines Antiemetikums und eines Laxans auf den Fuss. Als Grundsatz gilt, dass, je mehr Medikamente bei ein und demselben Patienten zur Anwendung kommen, umso • mehr nimmt die Compliance ab; • mehr nehmen die Nebenwirkungen der einzelnen Arzneimittel zu, wie auch die Wechselwirkungen zwischen den Arzneimitteln untereinander; • öfter kommt es zu funktionellen Störungen (Beubler, 2011, 19). Die Ehrlichkeit (um nicht zu sagen: Wahrhaftigkeit) zu sich selbst und gegenüber dem Patienten, den er behandelt, muss den Arzt zu der Erkenntnis veranlassen, dass die Wechselwirkungen, die im Rahmen der medikamentösen Therapie eines multimorbiden Patienten auftreten können, kaum vorhersehbar bzw. überschaubar sind. Neben der gebotenen Vorsicht, die aus der ärztlichen Sorgfaltspflicht und dem Respekt gegenüber dem Patienten erwachsen sollen, sind es vor allem organisatorische Schritte, die dabei behilflich sein können, sich dem Problem zu stellen: • das Erstellen eines schriftlichen Therapieplanes, der einerseits beim Patienten selbst verbleibt, andererseits auch bei Überweisungen elektronisch vorausgeschickt werden kann: so kann dem Risiko von Doppelverordnungen oder ineffektiven Therapien, die dem Krankheitsverlauf nicht mehr angepasst sind, vorgebeugt werden; • in diesem Therapieplan muss es für den Patienten auch die Möglichkeit geben, seine Selbstmedikation zu dokumentieren; 2 • laufende Evaluierung des Therapieplanes in Bezug auf die Möglichkeit, Medikamente zu pausieren oder abzusetzen; • im Rahmen von Konsultationen muss besonders auf eine Verschlechterung der kognitiven Funktionen und der Mobilität geachtet werden; • zur Optimierung kann eine multidisziplinäre Fallkonferenz (PolypharmazieKonzilium) beitragen: ausgehend von dem behandelnden Hausarzt werden Fachärzte mit geriatrischer Kompetenz aus den Bereichen der Inneren Medizin, der Psychiatrie und der Klinischen Pharmakologie hinzugezogen, die in einem gemeinsamen Ringen um die für den Patienten optimale Therapie vor allem auch Verantwortung gemeinsam tragen können. Es kann nicht das Ziel einer ärztlichen und pharmakologischen Behandlung sein, alle Möglichkeiten der state-of-the-art-medicine auf Biegen und Brechen auszuschöpfen oder eine allein mathematische Reduktion der Medikamentenzahl anzustreben, um Einsparungen zu ermöglichen. Ziel kann und soll es sein, durch klinisch relevante Optimierung der medikamentösen Therapie die Lebensqualität des Patienten deutlich positiv zu beeinflussen und in weiterer Folge durch eine wissenschaftliche Datensammlung, die auf die Reduktion der Arzneimittelnebenwirkungen, das längere Verbleiben in einem mobilen Zustand und die verringerte Morbidität Bezug nimmt, auch zu einer Reduktion sowohl der Medikamenten- als auch der Folgekosten beizutragen (Schippinger, 2011). Im Rahmen der Diplomarbeit werden nach einem allgemeinen Teil, der sich mit den Grundprinzipien der Wechselwirkungen beschäftigt, fünf Arzneimittel in ihren Möglichkeiten für Interaktionen besprochen : 1. Nicht steroidale Antirheumatika (NSAR) 2. Acetylsalicylsäure (ASS) als NSAR und Thrombozytenaggregationshemmer 3. ACE-Hemmer 4. HMG-Co A Reduktase Inhibitoren (Statine) 5. Selektive Serotonin Reuptake Inhibitoren (SSRI) 3 2. Allgemein Interaktionen von Arzneimitteln sind immer unerwünscht. Ob es sich um eine Verstärkung oder eine Abschwächung der Wirkung handelt oder ob es zur Ausprägung von Nebenwirkungen kommt, weil sich ein Konzentrationsspiegel aufbaut, der jenseits des therapeutischen Bereiches liegt, immer stellen die möglichen Wechselwirkungen eines Pharmakons eine Realität dar, die vom behandelnden Arzt mitgedacht werden muss. Einerseits begünstigen Multimorbidität, erhöhtes Alter, eine geringe therapeutische Breite und eine Verabreichung in hohen Dosierungen das Auftreten von Wechselwirkungen, andererseits können Interaktionen auch durch bestimmte Nahrungs- und Genussmittel (Alkohol, Grapefruitsaft, Tabak) und natürlich auch durch eine ungünstige Kombination mehrerer Medikamente zustande kommen: das Serotonin-Syndrom, das Anticholinerge Syndrom und die Verlängerung der QT-Zeit (mit der Gefahr der torsades-de-pointes-Tachykardien) sind dafür typische - und gefürchtete- Beispiele. 2.1. Möglichkeiten für Arzneimittelinteraktionen Wechselwirkungen können alle vier Stufen der Pharmakokinetik eines Arzneimittels betreffen und werden nach dem ADME-Schema der Absorption, der Verteilung (Distribution), der Biotransformation (Metabolismus) oder der Ausscheidung (Elimination) des Therapeutikums zugeordnet (Donnerer, 2011, Teil1). 2.1.1. Absorption Interaktionen in dieser Phase beeinflussen entweder die Aufnahmerate oder die Gesamtmenge der aufgenommenen Substanz und können durch vier Faktoren ausgelöst werden: 4 1. Regulation der Säuresekretion: die Anhebung des gastralen ph-Wertes dient der Therapie säurebedingter Erkrankungen (Refluxösophagitis, Gastritis, gastrale und duodenale Ulcera) und wird auch im Rahmen einer Helicobacter pyloriEradikation angestrebt. Dabei ist allerdings zu bedenken, dass die Resorption anderer Wirkstoffe beeinträchtigt werden kann (Beubler, 2011, 95-98). • Protonenpumpeninhibitoren, wie z.B. Omeprazol („Losec“), Pantoprazol („Pantoloc“) oder Esomeprazol („Nexium“) sind die Mittel der Wahl zur Behandlung säurebedingter Erkrankungen: sie bewirken eine irreversible Hemmung der Protonenpumpe in den Belegzellen der Magenschleimhaut und hemmen sowohl die basale wie auch die stimulierte Säuresekretion. Sie werden in der Leber vom gleichen CYP-Enzym abgebaut, von dem auch SSRI, Benzodiazepine und Cumarine verstoffwechselt werden: daher ist bei einer Kombination dieser Wirkstoffe mit einem PPI auf eine Erhöhung des Blutspiegels mit der daraus resultierenden Verstärkung der Wirkung und der Nebenwirkungen dieser Arzneimittel zu achten. • Histamin H 2- Rezeptor-Antagonisten, wie z.B. Cimetidin („Cimetag“), Ranitidin („Zantac“) oder Famotidin („Ulcusan“) zeichnen sich durch einen schnelleren Wirkungseintritt als PPIs aus und werden daher vor allem bei akuter Symptomatik eingesetzt. Ein Abstand von zwei Stunden zur Einnahme der nächsten Medikamente reicht aus, um Wechselwirkungen zu verhindern. Sie sind schwächer wirksam als die PPIs und werden auch als OTC-Präparate, also ohne ärztliche Verschreibung, in Apotheken verkauft. • Antacida haben durch den Einssatz der PPIs nur mehr eine Indikation bei säurebedingten Erkrankungen in der Schwangerschaft. Das Kombinationspräparat Magaldrat („Riopan“) vereint Magnesiumhydroxid und Aluminiumhydroxid in einer Komplexverbindung, wodurch eine Neutralisierung der Salzsäure erzielt wird. 2. Gabe von Aktivkohle oder Chelatbildnern, wie z.B. Colestyramin („Quantalan“) oder Antacida führt durch Oberflächenbindung oder Komplexbildung mit den Metallionen zur verzögerten Absorption. 3. Hemmung der Motilität des GI-Traktes durch Anticholinergika oder Opioide führt ebenfalls zu einer verzögerten und verminderten Wirkstoffaufnahme. 5 4. Polymorphismen der Transportproteine können einen sehr starken Einfluss auf die Pharmakokinetik eines Arzneimittels haben, was sich vor allem in den unterschiedlichen Wirkstoffkonzentrationen der Statine zeigen kann: abhängig vom jeweils eingesetzten Statin zeigen sich um bis zu 220% erhöhte Plasmakonzentrationen, 2.1.2. Distribution (Verteilung) Im Allgemeinen werden Arzneimittel im Körper transportiert, indem sie an Plasmaproteine gebunden werden, was zugleich auch eine Art Reservoirfunktion darstellt, weil nur der ungebundene Teil des Arzneimittels wirksam ist. Kommt es zu einer Kombination von Wirkstoffen, die alle eine sehr hohe Affinität zu den Transportproteinen aufweisen, können sie einander von den Bindungsstellen verdrängen. Diese Möglichkeit sollte aber nicht überbewertet werden, weil der Anteil an freiem Wirkstoff nur unmittelbar nach der Verdrängung ansteigt (von 10% auf 20%) und sich sehr rasch danach wieder ein neues Gleichgewicht zwischen freier und gebundener Substanz einstellt. Abbildung 1 Verdrängung aus der Plasmaeiweissbindung (Donnerer, 2011, Teil 1, 4) 6 2.1.3. Metabolismus (Biotransformation) Die meisten Arzneimittel werden nicht unverändert ausgeschieden, sondern erfahren eine biochemische Umwandlung im Organismus, in deren Verlauf sie zu wasserlöslichen Verbindungen verstoffwechselt werden, um anschliessend über die Niere oder seltener auch über den GI-Trakt (Galle, Darm), die Haut oder die Lunge ausgeschieden zu werden. Damit ist meist ein Verlust ihrer Wirksamkeit verbunden, wobei es aber auch wichtige Ausnahmen gibt: so wird Codein erst durch seine Biotransformation zum wirksamen Morphin, ein Vorgang, der Bioaktivierung genannt wird. Der Metabolismus eines pharmakologischen Wirkstoffes findet in erster Linie in der Leber und in der Darmmukosa statt und besteht aus zwei Schritten. Abbildung 2 Arzneimittelmetabolismus (Donnerer 2011, Teil 1, 5) 7 Phase 1 Metabolismus und CYP-Enzyme: Die nicht-synthethischen Reaktionen der Phase 1, wie z.B. Oxidation, Reduktion, Hydrolyse oder Desaminierung dienen dazu, jene chemischen Gruppen (Hydroxyl-, Carboxyl- oder Aminogruppen) in die Moleküle einzufügen oder freizulegen, die anschliessend im Rahmen der Phase 2 gebraucht werden. Diese biochemischem Prozesse werden von Cytochrom P 450 (CYP) Enzymen durchgeführt, die sich an der zytoplasmatischen Seite des endoplasmatischen Retikulums der Entero- und der Hepatozyten befinden. Von diesen Enzymen sind heute 18 Familien und 42 Subfamilien bekannt (Beubler, 2011, 12-15), wobei das Enzym CYP 3A4 das für den Arzneimittelmetabolismus wichtigste Enzym darstellt. Es verstoffwechselt: • Kalziumantagonisten vom Nifedipin-Typ, wie z.B.: Amlodipin („Norvasc“), Felodipin („Plendil“), Nifedipin („Adalat“); • Benzodiazepine und „Psychopax“), Antiepileptika, wie z.B.: Diazepam (Valium“, Midazolam („Dormicum“), Triazolam („Halcion“) und Carbamazepin („Tegretol“), aber auch nicht-Benzodiazepin-Tranquilizer wie Buspiron („Buspar“), das klassische Neuroleptikum Pimozid („Orap“), sowie das Hypnotikum Zolpidem („Ivadal“); • Statine, wie z.B.: Atorvastatin („Sortis“), Lovastatin („Mevacor“) und Simvastatin („Zocord“); • Immunsuppressiva, wie z.B.: Ciclosporin („Sandimmun“) und Tacrolimus („Prograf“); • das Makrolidantibiotikum Erythromycin („Erythrocin“); • das sehr starke Opioid Fentanyl („Durogesic“); • Östrogenpräparate, wie z.B.: Estradiol („Estrofem“), die für die medikamentöse Kontrazeption, bei Hormonmangelzuständen und im Rahmen der postmenopausalen Hormonersatztherapie (HET) eingesetzt werden; • Sildenafil („Viagra“): ist in einer niederen Dosis (3 x 20 mg/d) für die Behandlung der pulmonalen Hypertonie zugelassen, in weit höherer Einzeldosis (50- 100 mg) wird es bei der Therapie der erektilen Dysfunktion eingesetzt. 8 Die klinische Bedeutung der CYP-Enzyme ist darin zu sehen, dass es durch eine Hemmung oder eine Stimulation (Induktion) dieser Enzyme zu massgeblichen Veränderungen im Metabolismus der Arzneimittel kommt, die von ihnen umgesetzt werden: die Wirksamkeit dieser Arzneimittel kann abgeschwächt werden oder völlig verloren gehen, es kann aber auch zu einem stark erhöhten Plasmaspiegel des jeweiligen Wirkstoffes kommen, der weit über der Konzentration liegt, die für den therapeutischen Bereich definiert ist. Dadurch wird das Auftreten von Nebenwirkungen massiv begünstigt und sogar toxische Konzentrationen können erreicht werden. Als Regel kann angesehen werden, dass der Metabolismus eines Wirkstoffes bei peroraler Gabe stärker von einer eventuellen Hemmung oder Induktion der CYPEnzyme betroffen sein wird, als bei parenteraler (i.v.), sublingualer oder transdermaler Verabreichung. Enzymhemmung: erfolgt im Gegensatz zur Induktion relativ rasch (innerhalb von zwei bis drei Tagen). Typische Enzymhemmer sind: • Omeprazol („Losec“); • Grapefruitsaft: hemmt CYP 3A4 vor allem in den Enterozyten; • Der H 2-Rezeptorantagonist Cimetidin („Cimetag“), der als OTC-Präparat nicht verschreibungspflichtig ist; • Antiarrhytmika der Klasse IC: Propafenon („Rytmonorma“) Klasse III: Amiodaron („Dilzem“) Klasse IV: Verapamil („Isoptin“), Diltiazem („Dilzem“); • Antidepressiva (SSRIs): Fluoxetin („Fluctine“), Sertralin (“Gladem”), Paroxetin (“Lescol”), Citalopram (“Seropram”); • Antibiotika: Erythromycin („Erythrocin“), Clarithromycin („Klacid“) Metronidazol (“Anaerobex”); • Antimykotika: Fluconazol („Diflucan“), Ketoconazol („Nizoral“), Miconazol (“Daktarin”); • Proteaseinhibitoren: Ritonavir („Norvir“), Saquinavir („Invirase“), Lopinavir („Kaletra”) u.a. 9 Abbildung 3 Enzymhemmung bei oraler Aufnahme (Donnerer, 2011, Teil1, 10) Enzyminduktion: entsteht dadurch, dass sich die Menge des entsprechenden Enzyms erhöht, was durch Interaktion des stimulierenden Agens mit nuklearen Rezeptoren in den Hepatozyten geschieht. Die darauffolgende vermehrte Gentranskription braucht bis zu zwei Wochen, daher ist die Enzyminduktion ein weitaus langsamerer Prozess als die Hemmung. Typische Enzyminduktoren sind: • Tabakrauch; • Alkohol: beschleunigt den Abbau von Paracetamol („Mexalen“, “Perfalgan“) zu einem stark leberschädigenden Metaboliten; • Johanniskraut („Jarsin“): ab 1mg Hypericin täglich (entspricht 300 mg Extrakt); wird als Phytopharmakon in der Behandlung leichter bis mittelschwerer Depression eingesetzt; • Antiepileptika: Phenobarbital („Luminal“), Carbamazepin („Tegretol“), Phenytoin (“Epanutin”); • Antituberkulotika: Rifampicin („Eremfat“) ist der stärkste Enzyminduktor (Herold, 2012, 410), Rifabutin („Mycobutin“), Isoniacid (“INH”); 10 • Barbiturate: zur Einleitung der Narkose werden Thiopental und Methohexital verwendet. Abbildung 4 Enzymindunktion bei oraler Aufnahme (Donnerer, 2011, Teil 1, 10) Phase 2 Metabolismus: Die synthetischen Reaktionen der zweiten Phase des Arzneimittelmetabolismus werden durch andere Glucuronyltransferasen, N-Acetyltransferasen, Enzyme ermöglicht: Sulfotransferasen und Methyltransferasen verbinden ihre jeweiligen biochemischen Gruppen mit den Arzneimittelmetaboliten, die im Rahmen der Phase 1 gebildet wurden. Dadurch entstehen wasserlösliche Verbindungen (Ester, Amide, Glucuronide), die anschliessend ausgeschieden werden können. Auch diese Enzyme können durch die Wirkung von Arzneimitteln stimuliert werden und in weiterer Folge einen beschleunigten Metabolismus eines anderen Wirkstoffes verursachen. 11 2.1.4. Elimination (Ausscheidung) Die meisten Arzneimittel werden über die Niere oder im Rahmen des enterohepatischen Kreislaufes über die Gallenwege ausgeschieden. Die renale Elimination kann durch Veränderungen des ph-Wertes im Tubulussystem beeinflusst werden: in saurem Urin liegt eine schwache Säure, wie z.B. die Salizylsäure in nicht dissoziierter Form vor und kann in weiterer Folge wieder rückresorbiert werden, ein Vorgang, der durch Alkalisierung des Harnes mit Natriumbikarbonat verhindert werden kann. Umgekehrt zeigt sich die Situation im Milieu eines alkalischen Urins: die schwache Säure dissoziiert (gibt also ein Na+ ab und behält ihre funktionelle Gruppe als COO-) und kann in weiterer Folge viel schneller ausgeschieden werden. Durch Ansäuerung des Harnes mit Ammoniumchlorid („Extin“) oder L-Methionin („Acimethin“) kann der pH-Wert in den sauren Bereich verschoben werden (pH 56). Eine weitere Möglichkeit, die renale Elimination eines Arzneimittels zu beeinflussen ist dann gegeben, wenn es mit einem anderen Wirkstoff in Konkurrenz um die tubulären Transportprozesse steht. Die Urikosurika Benzbromaron und Probenecid werden zur Behandlung der Hyperurikämie bzw. der manifesten Gicht als Dauerbehandlung eingesetzt (Herold, 2012, 684): sie hemmen die Rückresorbtion von Harnsäure aus dem Tubuluslumen und führen dadurch zu einer vermehrten Ausscheidung; allerdings verdrängen sie dadurch andere Arzneimittel von den tubulären Sekretionsprozessen und deren Ausscheidung verzögert sich. Die biliäre Elimination ist die Aufgabe des enterohepatischen Kreislaufes: sie kann unterbrochen werden, wenn es im Rahmen einer Behandlung mit Antibiotika zu einer Schädigung der Darmflora kommt. 2.2. Wechselwirkungen mit Nahrungsmitteln Sowohl pharmakologische Wirkstoffe als auch Nahrungsmittel haben durch wechselseitige Interaktionen die Möglichkeit, Einfluss aufeinander auszuüben. 12 Auf der einen Seite können Medikamente die Verfügbarkeit von bestimmten Nahrungsmittelbestandteilen beeinflussen: • so verhindert Orlistat („Xenical“) durch die Hemmung der Pankreaslipase die Aufnahme der fettlöslichen Vitamine A,D,E und K, indem es dafür sorgt, dass ein Teil des mit der Nahrung aufgenommenen Fettes unverdaut wieder ausgeschieden wird; • der Vitamin D Metabolismus und die Absorption von Kalzium werden durch die Interaktion mit den Antiepileptika Phenytoin („Epanutin“) und Phenobarbital („Luminal“) beeinflusst; • im Rahmen der antidepressiven Therapie mit Monoaminoxidase (MAO) Hemmern ist das Einhalten von Diätrichtlinien unabdingbar: Lebensmittel, die reich an Tyramin sind (wie z.B.: Käse, Rotwein, Fischkonserven, Wurst), müssen vermieden werden, weil diese Medikamente auch den Abbau von Monoaminen im Darm verhindern und es durch das vermehrte Tyramin (das ein indirektes Sympathomimetikum ist) im Kreislauf zu krisenhaftem Ansteigen Kopfschmerzen, des Tachykardie, Blutdrucks Herzklopfen, mit Flush-Symptomatik, Schwitzen und Übelkeit kommen kann („cheese disease“) (Donnerer, 2011, Teil 3, 29-30). Andererseits können auch ganz alltägliche Nahrungsmittel, wie Alkohol (Enzyminduktor) oder Grapefruitsaft (Enzymhemmer), durch ihre Wirkung, die sie auf das CYP-Enzymsystem ausüben, beträchtlichen Einfluss auf den Arzneimittelmetabolismus nehmen: • das Risiko einer Rhabdomyolyse im Rahmen der Behandlung mit Statinen kann sich erhöhen; • eine Verstärkung der vasodilatatorische Wirkung der Kalziumantagonisten vom Nifedipin-Typ: Amlodipin („Norvasc“), Felodipin („Plendil“), Isradipin („Lomir“) ist möglich; • die Wirkung des Angiotensin 1-Rezeptorantagonisten Losartan („Cosaar“) kann stark herabgesetzt werden, weil es zu keiner ausreichenden Bildung seines aktiven Metaboliten mehr kommt. 13 2.3. Pharmakodynamische Wechselwirkungen Diese Interaktionen betreffen das Verhalten der Arzneimittel an ihrem Wirkort (z.B. an einem Enzym), ihre Wirkmechanismen, ihre Rezeptorspezifität und Aktivität, Dosis-Wirkungs-Beziehungen und die Bedeutung ihrer möglichen Agonisten und Antagonisten für den Therapieverlauf (Donnerer, 2011, Teil1, 22-23). Additive bzw. synergistische Interaktionen: 1. Verstärkte Sedierung und Benommenheit: verursacht durch Alkohol in Verbindung mit Benzodiazepinen und Opiaten bzw. Opiate mit Sedativa; 2. Verstärkte anticholinerge (atropinartige) Wirkung: bei Kombinationen von Anticholinergika und trizyklischen Antidepressiva (TCA); 3. Erhöhte Blutungsgefahr: orale Antikoagulation zusammen mit NSAR bzw. Thrombozytenaggregationshemmern und NSAR mit SSRI bzw. Heparin. Gefahr der Toxizität durch Synergismen: 1. Nephrotoxizität: Aminoglykoside in Verbindung mit Cyclosporin; 2. Long QT-Syndrom: Antiarrhythmika zusammen mit Neuroleptika; 3. Myopathie: Statine gemeinsam mit Gemfibrozil. Antagonistische Interaktionen: 1. Zufuhr hoher Dosen Vitamin K im Rahmen einer oralen Antikoagulation (mit Vitamin K-Antagonisten); 2. Gabe von Anticholinergika bei gleichzeitiger Therapie eines Mb. Alzheimer mit Cholinesterasehemmern; 3. Beta 2-Agonisten in Verbindung mit Betablockern. 2.4. Auswirkungen auf den Elektrolythaushalt Die Isoionizität ist noch vor dem Plasmavolumen das wichtigste biochemische Prinzip des Körpers und ermöglicht (über die Na-K-ATPase) erst die Entstehung des Membranpotentials einer lebenden Zelle. Kommt es zu Interaktionen, die das 14 Elektrolytgleichgewicht verschieben, kann sich daraus sehr rasch ein lebensbedrohlicher Zustand entwickeln. • Werden ACE-Hemmer bzw. Sartane mit einem kalium-sparenden Diuretikum (wie z.B. Spironolacton, Eplerenon, Amilorid, Trimateren) kombiniert, muss an die Entstehung einer Hyperkaliämie mit der Gefahr der Nierenschädigung und einer Bradykardie bis zum Herzstillstand gedacht werden. • Eine Kombination von Herzglykosiden mit einem Schleifendiuretikum (Furosemid, Torasemid) erhöht durch den vermehrten Kaliumverlust die Toxizität der Herzglykoside. 2.5. Serotonin Syndrom Eine Überstimulation der Serotoninrezeptoren im ZNS löst folgende Symptome aus: 1. Vegetativum: Schwitzen, Durchfall. Fieber, Schüttelfrost („Grippesymptomatik“); 2. ZNS: Unruhe, Gereiztheit, Verwirrung, Manie; 3. Neuromuskuläre Symptome: Muskelrigidität und Krämpfe, Zittern, gesteigerte Reflexe. Medikamente: • Antidepressiva: SSRI, TCA, MAO-Hemmer, Venlafaxin, Mirtazapin, Trazodon, Johanniskraut; • Neuroleptika: Risperidon, Ziprasidon, Aripiprazol; • Analgetika: Tramadol (wird oft mit einem SSRI zusammen gegeben), Fentanyl, Oxycodon; • Migränemittel: Triptane; • Antiemetika: Metoclopramid, Ondansetron, Dolasetron; • Antibiotika: Linezolid. 15 Therapie: Die Dauer des Serotoninsyndroms beschränkt sich auf 12-24 Stunden, wobei die symptomatische Therapie mit Benzodiazepinen oder dem atypischen Neuroleptikum Olanzapin angezeigt ist (Beubler, 2011, 50). Sollte die Therapie mit Antidepressiva beendet werden, muss darauf geachtet werden, sie langsam auszuschleichen, um das Auftreten von Absetzphänomenen vorzubeugen. 2.6. Anticholinerges Syndrom Ein relativer oder absoluter Mangel an Acetylcholin kann durch Arzneimittelwirkstoffe entstehen, die den Neurotransmitter von den cholinergen Rezeptoren verdrängen. Dies ist umso bedenklicher, als die Produktion von Acetylcholin im Alter ohnehin abnimmt und die zerebrale Reserve im Rahmen von dementiellen Zustandsbildern daher besonders gering ist (Anditsch et al., 2009). Anticholinerge (atropinartige) Wirkungen können sich klinisch peripher oder zentral äussern: • Periphere anticholinerge Effekte: Harnverhalt, Obstipation, Tachykardie, Glaukom, Xerostomie (durch die reduzierte Sekretproduktion der Speicheldrüsen); • Zentrale Effekte: Schwindel, Exzitation, Gedächtnisstörungen und kognitive Defizite bis zur Entwicklung eines akuten Verwirrtheitszustandes (Delir). Somit wird eine anticholinerge Medikation zu einem wesentlichen Risikofaktor, vor allem dann, wenn zwei oder mehrere Medikamente miteinander kombiniert werden (neben iatrogener Genese ist auch an die Möglichkeit Suizidversuches mit diesen Wirkstoffen zu denken): 1. Neuroleptika: Clozapin, Olanzapin, Fluphenazin; 2. TCA: Amitriptylin, Clomipramin, Desipramin, Imipramin; 3. Spasmolytika: Butylscopolamin; 4. Analgetika: Opioide; 5. Broncho-Therapeutika: Ipratropium, Tiotropium; 6. Antiparkinsonmittel: Amantadin, Biperiden, L-Dopa (in hoher Dosis); 7. Antibiotika: Gyrasehemmer (Ciprofloxacin); 16 eines 8. Urologika (Therapie der Reizblase bzw. Detrusorschwäche): Tolterodin, Trospium, Solifenacin, Darifenacin. Therapie: Bei schweren Verlaufsformen ist eine intensivmedizinische Überwachung notwendig: eine Therapiemöglichkeit bietet die Anwendung von Physostigmin (mit Bradykardie als Nebenwirkung), eine forcierte Diurese, um die systemische Elimination zu beschleunigen oder die Gabe von Aktivkohle als Adsorbens, das die weitere Aufnahme des Wirkstoffes aus dem Darm verhindert. 2.7. Gefahr der QT-Verlängerung Die QT-Zeit ist Ausdruck der gesamten interventrikulären Erregung und ist von der Herzfrequenz abhängig: je tachykarder der Puls, umso kürzer dauert auch das QT-Intervall (Normalwert: maximal 550ms). Um den Einfluss der Herzfrequenz zu relativieren, wird die frequenzkorrigierte QTZeit (QTc) nach der Bazett-Formel ermittelt, indem der Quotient aus der QT-Zeit (in ms) und der Quadratwurzel des RR-Intervalls (in sec) gebildet wird: der Normalwert für Männer wird mit 0,39 sec angegeben, für Frauen mit 0,44 sec (Schuster et Trappe, 2009, 54). Abbildung 5: QT-Intervall und QTc (Anditsch et al., 2009) 17 Verlängerungen des QT-Intervalls können zum „Long QT-Syndrom“ führen: die Klinik reicht von Schwindel, Präsynkopen und Synkopen bis zu akutem Kreislaufstillstand, Torsade-de-pointes-Tachykardien (Spitzenumkehr- Tachykardien) und Kammerflimmern. An eine Verlängerung der QTc um 45-60 ms bzw der absoluten Dauer auf mehr als 550ms muss dann gedacht werden, wenn bei einem Patienten gewisse Risikofaktoren, vor allem auch iatrogener Genese, vorliegen: • Elektrolytstörungen: Hypokaliämie, Hypomagnesiämie, Hypokalziämie (auch im Rahmen von Mangelernährung, z.B.: bei Alkoholabusus und Anorexie); • Kardiale Erkrankungen: KHK, Myokardinfarkt, Mitralklappenprolaps, Rhythmusstörungen (Bradykardie, Sick-sinus-syndrome, AV-Block Grad II und III). Medikamente: • Antiarrhythmika: Klasse I: Chinidin, Disopyramid, Flecainid; Klasse III: Amiodaron, Sotalol; • Antidepressiva: SSRI: Paroxetin, Sertralin, Fluoxetin; SNRI: Venlafaxin; TCA: Amitriptylin; • Neuroleptika: Klassische: Haloperidol; Atypische: Risperidon, Clozapin, Ziprasidon, Quetiapin; • Antiinfektiva: Antibiotika: Makrolide, Quinolone; Antimykotika: Ketoconazol, Itraconazol, Fluconazol. 18 3. Nicht steroidale Antirheumatika (NSAR) 3.1. Allgemein Durch persönliches Erleben und aus der für ihn sehr frustranen Rolle des Angehörigen heraus, weiss der Autor dieser Arbeit davon zu berichten, dass eine adäquate Schmerztherapie nach wie vor – und das seit vielen Hundert Jahren – dem tiefsten Wesen ärztlichen Handelns und Wirkens entspringt und ihm zugehörig ist. Daher möchte ich den allgemeinen Betrachtungen der NSAR das WHO-Schema der Schmerztherapie voranstellen, in dem vor allem auch die Nicht- Opioidanalgetika auf allen Stufen eine wichtige Rolle spielen, woraus sich der Kontext erschliesst, in dem die nicht steroidalen Antirheumatika stehen. 3.1.1. Stufenschema der Schmerztherapie (WHO) Das Grundprinzip des Stufenaufbaues liegt darin, dass die nächst höhere Stufe gewählt wird, wenn die niedrigere Stufe der Therapie nicht (mehr) ausreicht, um eine Schmerzlinderung zu erzielen, wobei die Basismedikation der Stufe 1 aber immer beibehalten wird. Werden schon die initialen Schmerzen vom Patienten als stark angegeben, können die niederen Stufen auch übersprungen werden: die Medikationen der ausgelassenen Stufe 1 wird trotzdem in die Therapie miteinbezogen. Zusätzlich zu den Analgetika kommen Adjuvantien zum Einsatz: das sind Medikamente, die zur Bekämpfung der Nebenwirkungen der Analgetika der jeweiligen Stufen eingesetzt werden (Herold, 2012, 113). Stufe 1: Nicht-Opioidanalgetika: Paracetamol, Metamizol, ASS, Ibuprofen +Adjuvantien: PPI, Misoprostol; Stufe 2: Schwaches Opioid: Tramadol, Codein, Dihydrocodein, Tilidin + Nicht-Opioidanalgetika 19 + Adjuvantien: Antiemetika (Metoclopramid), Laxantien; Stufe 3: Starkes Opioid: Morphin, Piritramid, Hydromorphon + Nicht-Opioidanalgetika + Adjuvantien: Antiemetika, Laxantien. In Anhängigkeit vom jeweiligen Schmerztyp kommen auch Ko-analgetika zum Einsatz: • Bisphosphonate bei Knochenschmerzen z.B. durch osteolytische Metastasen; • Spasmolytika (z.B.: Butylscopolamin) und Kortikosteroide (abschwellende Wirkung) bei Obstipation, die sich bis zum paralytischen Ileus steigern kann; • Antidepressiva und Antiepileptika bei neuropathischen Schmerzen; • Benzodiazepine, um eine anxiolytische und antikonvulsive Wirkung zu erreichen. Zusätzlich zu diesem Stufenschema hat die WHO auch einige Grundregeln der Schmerztherapie im Rahmen einer Tumorerkrankung festgelegt (WHO,1996): • „by mouth“: eine orale Gabe ist anzustreben, sie hat sich auch in mehr als 90% der Patienten als effektiv erwiesen (wenn p.o. nicht mehr möglich ist, wird auf transdermale, intravenöse oder subkutane Anwendung umgestellt); • „by the clock“: die Einnahme soll regelmässig und nach einem genau festgelegten Zeitplan erfolgen; • „by the ladder“: die Schmerztherapie orientiert sich am Stufenschema; • „for the individual“: es muss die individuelle Dosis erst dadurch herausgefunden werden, dass sie so lange erhöht wird, bis sich eine ausreichende Schmerzlinderung einstellt („the correct dose is the dose that works“); • die Medikation wird antizipierend gegeben: es wird nicht auf das Auftreten von Schmerzen („den Bedarf“) gewartet. 20 3.1.2. Nicht-Opioidanalgetika Die Substanzen der Arzneimittelgruppe der Nicht-Opioidanalgetika gehören weltweit zu den am meisten eingenommenen überhaupt: ihre rasche Verfügbarkeit (viele werden als OTC-Präparate verkauft), die einfache Applikationsart, ein schneller Wirkungseintritt und nicht zuletzt die massive Bewerbung von Seiten der Pharmafirmen bescheren den Herstellern dieser Medikamente einen ungebrochenen Verkaufserfolg. Auch in der Therapie geriatrischer Patienten wird immer wieder gerne auf diese Pharmaka zurückgegriffen, wobei ihre analgetische Wirkung oft überschätzt wird, ihr Nebenwirkungsprofil aber gleichzeitig zu wenig Beachtung erfährt: besonders in der Behandlung von Myopathien, arthrotischen Gelenksbeschwerden und der Therapie der chronischen Polyarthritis werden sie eingesetzt (Wehling et Burkhardt, 2010). Die Nicht –Opioidanalgetika zeichnen sich durch drei Wirkungen aus: • analgetisch: der schmerzlindernde Effekt kommt vor allem durch die Hemmung der beiden Isoenzyme der Cyclooxygenase (COX-1 und COX-2) zustande; • antipyretisch: die Fiebersenkung geschieht ebenfalls über die Hemmung der Prostaglandinsynthese, sodass in weiterer Folge auch keine Pyrogene mehr zur hypothalamischen Sollwertverstellung der Körpertemperatur beitragen; • antiphlogistisch bzw. antiinflammatorisch: der entzündungshemmende Aspekt wird dadurch erreicht, dass die Wirkungen, die von den Prostaglandinen im Rahmen des Entzündungsprozesses ausgehen (Vasodilatation, Erhöhung der Gefässpermeabilität, Sensibilisierung der Nozizeptoren), unterdrückt werden. Einteilung: 1. Nicht saure, antipyretische Analgetika: Paracetamol („Mexalen“, “Perfalgan“) und Metamizol („Novalgin“) sind beide gut analgetisch und 21 antipyretisch, dabei aber nicht antiphlogistisch wirksam, weil es zu keiner Anreicherung des Wirkstoffes im sauren Milieu der Entzündung kommt. Paracetamol kann sowohl mit einem Antiphlogistikum als auch mit einem Opiat gut kombiniert werden, Metamizol zeichnet sich zusätzlich durch eine spasmolytische Wirkung aus. 2. Nicht-Opioidanalgetika ohne antipyretische und antiphlogistische Wirkung: Flupirtin („Katadolon“) ist ein mittelstark wirksames Analgetikum mit einer muskelrelaxierenden Wirkung, das auch mit den NSAR sinnvoll kombiniert werden kann. 3. NSAR: a) unselektive Hemmer der COX-Isoenzyme: saure, antiphlogistisch und antipyretisch wirkende Analgetika der NSAR-Gruppe, z.B.: ASS, Ibuprofen, Diclofenac, Indometacin, Piroxicam; b) selektive COX-2-Hemmer: Celecoxib, Parecoxib. 3.1.3. NSAR: nicht steroidale Antirheumatika Per definitionem gehören der Gruppe der NSAR jene Arzneimittel an, die keine Steroide (d.h. Glucocorticoide) sind und (trotzdem) eine antiphlogistische Wirkung aufweisen: diese Charakteristik ist insofern entscheidend, als die Glucocorticoide alle Phasen der Entzündung hemmen (woraus sich in weiterer Folge eine Schwächung der körpereigenen Abwehr mit konsekutiv erhöhter Infektanfälligkeit ergibt), die NSAR hingegen nur in einen bestimmten Schenkel des Entzündungsgeschehens eingreifen, aber darüber hinaus das defensive Potential des Körpers nicht beeinträchtigen (Lüllmann et al., 2010, 314). Im Zentrum des Wirkmechanismus der nichtsteroidalen Antirheumatika steht das Enzym Cyclooxygenase, das für die Umwandlung der Arachidonsäure in die sogenannten „Eicosanoide“ zuständig ist: • Prostaglandine: vermitteln Schmerz, Fieber, den Aufbau der gastralen Schleimhaut bzw. die verminderte Produktion von Magensäure und eine vermehrte Ausscheidung von Natrium und Wasser in der Niere; • Prostacyclin: Vasodilatation, Hemmung der Thrombozytenaggregation; 22 • Thromboxan: Vasokonstriktion, fördert die Thrombozytenaggregation. Die Arachidonsäure ist aber auch das Substrat der Lipoxygenase: sie bildet die „Leukotriene“, die auch im Rahmen des anaphylaktischen Schocks freigesetzt werden. Sie vermitteln: • allergische Reaktionen (z.B.: Asthma); • Vasodilatation; • Bronchokonstriktion; • Leukotaxis, vermehrte Gefässpermeabilität. Wird der Abbauweg der Arachidonsäure in Richtung der Prostaglandine durch den Einsatz der COX-Hemmer verlegt, wird sie vermehrt über die Lipoxygenase zu Leukotrienen abgebaut, wodurch es, vor allem bei Allergikern, Überempfindlichkeitsreaktionen kommen kann („Analgetikum-Asthma“). Abbildung 6 Arachidonsäure Metabolismus (nach Lüllmann et al., 2010) 23 zu Die Cyclooxygenase liegt im Körper in zwei Isoformen auf, die sich in ihrem Auftreten und ihrer Bedeutung für physiologische und pathologische Prozesse unterscheiden: • COX-1: ist in fast allen Zellen vorhanden und aktiv („konstitutive COX“), wodurch immer wieder Prostaglandine entstehen und ihre physiologischen Wirkungen ermöglicht werden; Thrombozyten enthalten ausschliesslich diese COX-1, die im Fall einer Gefässverletzung die Bildung von Thromboxan initiiert; • COX-2: kommt einerseits im entzündeten Gewebe vor, andererseits ist sie auch in der Niere und im Gefässendothel konstitutiv vorhanden. Prostaglandinbildung durch COX-1 COX-2 GI-Trakt: Aufbau und Schutz der Schleimhaut von Magen und Darm; verminderte HCl-Produktion Entzündung: Fieber, Vasodilatation und gesteigerte Permeabilität, erhöhte Schmerzempfindlichkeit, Wundheilung ( auch von GI-Ulzera) Niere: Durchblutungssteigerung, vermehrte Ausschüttung von NaCl und H2O Niere: Aufrechterhaltung Durchblutung bei Dehydratation Thrombozyten: Förderung der Aggregation Thrombozyten: Aggregationshemmung Endothel: Vasokonstriktion Endothel: Vasodilatation der Tabelle 1 Prostaglandinbildung durch zwei COX-Isoenzyme Einteilung der NSAR : 1. Unselektive COX-Hemmer: Acetylsalicylsäure, Ibuprofen, Diclofenac, Naproxen: sie inhibieren beide Isoformen des Enzyms, woraus sich sowohl die entzündungshemmende Wirkung (durch COX-2 Inhibierung) als auch die Thrombozytenaggregationshemmung Nebenwirkungen (COX-1 Blockade) erklären, 24 und die gastro-intestinalen 2. Selektive COX-2 Hemmer: Celecoxib, Etoricoxib: die höhere Affinität zur COX-2 bewirkt eine geringere Schädigung der Magenschleimhaut, allerdings erhöht sich auch die Neigung zu thrombembolischen Ereignissen, weil die Bildung von Thromboxan (in den Thrombozyten) gefördert und die von Prostacyclin (in den Endothelzellen) gehemmt wird. Daraus resultiert eine vermehrte Blättchenaggregation und das Kriterium der Hyperkoagulabilität als ein Symptom der Virchow´schen Trias wird erfüllt. Nebenwirkungen der NSAR: • Gastrointestinale Nebenwirkungen (ca. 30%): Magen- und Duodenalulcera, eventuell mit okkulter Blutung und der Möglichkeit einer Perforation; das Risiko erhöht sich bei einer Kombination mit Glucocorticoiden (von einem 4fach erhöhten Risiko bei alleiniger NSAR-Therapie, auf das 15fache), Antikoagulanzien und SSRI; daher ist in diesen Fällen eine prophylaktische Therapie mit PPI unbedingt notwendig (Herold, 2012, 648); vor allem bei geriatrischen Patienten darf diese Gefahr nicht unterschätzt werden, auch wenn die Therapie auf die COX-2 Hemmer umgestellt wird (Hippisley-Cox et al., 2005); • NSAR-Enteropathie: Entzündungen, Blutungen, Strikturen und Perforation im Dünndarm; es kommen auch eine Kolitis mit begleitender Diarrhö vor; • NSAR-Zystitis; • Pseudoallergische Reaktionen: vor allem bei schon vorbestehender Allergie kann sich eine Analgetikaintoleranz entwickeln, die dann z.B. mit Bronchospasmen bei bekanntem Asthma einhergeht; es können sich aber auch erst im Rahmen der Therapie mit NSAR allergische Symptome zeigen: Urticaria, Angioödem, Bronchospasmus; • ZNS-Symptome: Cephalea, Vertigo, Verwirrtheitszustände, Hörstörungen; • Leber- und Nierenschäden; • die NSAR-assoziierte Nephropathie geht mit einem verminderten renalen Blutfluss einher und bewirkt die Retention von Wasser und Natrium mit konsekutivem Hypertonus, möglich ist auch eine die Entwicklung einer Herzinsuffizienz; 25 • allen NSAR haftet die Gefahr für ein erhöhtes kardio-vaskuläres Risiko an. Kontraindikationen: 1. Gastritis und Verdacht auf Ulcus ventriculi oder duodeni; 2. Hämorrhagische Diathese, auch im Rahmen einer antithrombotischen Therapie mit Antikoagulantien; 3. Schwangerschaft im 3. Trimenon; 4. Vorsicht bei bekannten Allergien (Heuschnupfen, Urtikaria); 5. Vorsicht bei Patienten mit vorgeschädigter Niere; 3.2. Interaktionen Als OTC-Präparate sind NSAR sehr leicht erhältlich und können in weiterer Folge bei der Verwendung als Bedarfsmedikation plötzlich und kurzfristig auf ein vorhandenes Therapieschema einwirken und Wechselwirkungen verursachen. 3.2.1. WW mit Arzneimitteln bei säurebedingten Erkrankungen Weder in Kombination mit Protonenpumpenhemmern, H2-Antagonisten oder Antacida besteht bei den NSAR die Gefahr für Interaktionen, die die Pharmakokinetik auf Grund des veränderten Säuremilieus beeinflussen würden (Baxter, 2010, 171-172). Das ist umso wichtiger, als vor allem die PPI im Rahmen einer (Dauer-)Therapie mit NSAR eingesetzt werden, um die gastro-intestinalen Nebenwirkungen zu minimieren. 3.2.2. WW mit anderen NSAR Prinzipiell wird der gleichzeitige Einsatz von mehreren NSAR auf Grund der Potenzierung der Nebenwirkungswahrscheinlichkeit nicht empfohlen (Herold, 2012, 684), was aber genauer betrachtet werden sollte. 26 • NSAR und niedrig dosierte ASS (300 mg oder weniger) sollten wegen der additiven gastrointestinalen Nebenwirkungen nur kombiniert werden, wenn es unbedingt notwendig ist (auch die selektiven COX-2 Hemmer bieten keine Verbesserung): PPI als Magenschutz ist auf jeden Fall notwendig (Committee on Safety of Medicines, 2002). • Ibuprofen und „Aspirin“ als „Thrombo-ASS“ müssen zeitlich versetzt eingenommen werden, damit die reversible COX-1 Hemmung des Ibuprofen nicht den antikoagulativen und somit kardio-protektiven Effekt der ASS (durch eine irreversible Hemmung) unmöglich macht: zuerst „Thrombo-ASS“ und anschliessend erst nach 2 Stunden Ibuprofen (Donnerer, 2011, Teil 2, 6). In vitro Studien haben gezeigt, dass die selektiven COX-2 Hemmer diesen Effekt weniger ausgeprägt verursachen (Ouellet et al., 2001). • NSAR und Paracetamol: nachdem für Paracetamol ein zentraler Wirkungsmechanismus postuliert wird (der die gute Magenverträglichkeit und die nur wenig ausgeprägt antiphlogistische Wirkung erklärt), ist eine Kombination mit entzündungshemmenden Wirkstoffen sinnvoll. 3.2.3. WW mit systemischen Corticosteroiden Das Risiko von gastrointestinalen Nebenwirkungen (Blutungen, peptische Ulcerationen) ist in dieser Kombination auf das 15fache erhöht und zwingt zu einer Prophylaxe mit Protonenpumpeninhibitoren. 3.2.4. WW mit Antihypertensiva Alle NSAR (inklusive der Coxibe und ASS in einer Dosis ab 300 mg/die) blockieren die Entstehung von vasodilatatorisch wirksamen Prostaglandinen in der Niere und reduzieren den Erfolg einer antihypertensiven Therapie, indem sie zu einer Retention von Wasser und Natrium beitragen: das betrifft ACE-Hemmer bzw. Sartane in gleicher Weise wie Diuretika. 27 Als Ausweg steht die Möglichkeit der Blutdrucksenkung mit Kalzium- Antagonisten, Betablocker oder Thiazid-Diuretika zur Verfügung. In der Dosierung des „Thrombo-ASS“ kommt es nicht zu dieser Interaktion, sodass die Wirkung der ACE-Hemmer unbeeinträchtigt bleibt. 3.2.5. Neben den WW mit Antidepressiva Interaktionen mit Wirkstoffen der Antikoagulation bzw. der Thrombozytenaggregationshemmung stellen die Wechselwirkungen mit den Psychopharmaka die gefährlichsten dar. Die Rate an Blutungen im GI-Trakt steigt durch die Kombination von SSRI und NSAR um das mehr als 10fache an (von 1,2 auf 12,4): die Reuptake-inhibitoren für Serotonin verhindern auch die Serotoninaufnahme in die kernlosen Thrombozyten, was deren regelrechte Funktion behindert und in einen hemmenden Einfluss auf die Blutgerinnung resultiert (de Jong et al., 2003). Auch die Kombination von trizyklischen Antidepressiva mit NSAR führt dazu, dass sich die Rate an gastrointestinalen Blutungen mehr als verdoppelt (von 1,2 Ereignissen auf 2,5). 3.2.6. WW mit oralen Antikoagulantien Die Therapie mit den Vitamin K-Antagonisten Phenprocoumon („Marcoumar“), Acenocumarol („Sintrom“) oder Warfarin („Coumadin“) wird als Rezidivprophylaxe nach einem Herzinfarkt, Insult oder Thrombose betrieben, aber auch, um bei Vorhofflimmern oder nach einer Herzklappenimplantation die Entstehung von Thromben a priori zu verhindern. Die durch eine Kombination Thrombozytenaggregationshemmung und mit das damit NSAR verbundene gastrointestinaler Blutungen sind allerdings differenziert zu betrachten: 28 erhöhte Risiko • die gleichzeitige Gabe von „Thrombo-ASS“ und Cumarinen bewirkt eine Reduktion thrombembolischer Ereignisse nach einem Herzklappenersatz , was einen positiven Aspekt dieser Interaktion darstellt; • bei allen anderen NSAR (inklusive ASS ab einer Dosierung von 500 mg/die) ergibt sich gegenüber der Monotherapie ein 3-5 mal höheres Blutungsrisiko, weshalb vor allem „Aspirin“ vermieden werde sollte. Als Ausweg bieten sich andere NSAR an, die weniger gefährlich erscheinen: Ibuprofen, Diclofenac, Naproxen oder aber Paracetamol, Meloxicam oder Tramadol. 3.2.7. WW mit Heparin und Clopidogrel Sowohl Heparin („Lovenox“), als auch Clopidogrel („Plavix“) werden zur Thromboseprophylaxe postoperativ, bei längerer Bettlägerigkeit oder Pflegebedürftigkeit eingesetzt und ergeben in Kombination mit den NSAR eine erhöhte Blutungsgefahr gegenüber ihrer Verwendung im Rahmen einer Monotherapie (Delaney et al., 2007): • bei gleichzeitiger Gabe von ASS und Clopidogrel steigt das relative Risiko einer gastrointestinalen Blutung auf das 2fache an (von 2 bei Clopidogrel als Monotherapie auf 4); • NSAR und Clopidogrel erhöhen das Risiko um 50% (von 2 auf 3). Als Ausweg bietet sich zum einen der Einsatz anderer Analgetika an: Paracetamol, Metamizol, Tramadol, Morphin oder auch andere Opioidanalgetika; andererseits kann auch die Verwendung von selektiveren COX-2 Hemmern das Blutungsrisiko minimieren. 3.2.8. WW der Coxibe mit Antimykotika Die Azol-Antimykotika Fluconazol und Voriconazol sind Hemmer des CYP 2C9 Enzyms, währenddessen Ketoconazol die Wirkung eines anderen Enzyms, 29 nämlich CYP 3A4, hemmt: die Coxibe werden von CYP 2C9 metabolisiert, daher zeigen sich in Kombination mit Fluconazol oder Voriconazol erhöhte Blutspiegel. Als Ausweg bietet sich also Ketoconazol an oder es sollte die Dosis der Coxibe geändert werden: entweder wird von vornherein mit der niedrigsten empfohlenen Dosis begonnen oder die Dosis wird halbiert (Baxter, 2010, 161). 3.2.9. WW mit Nahrungsmitteln bzw. Mikronährstoffen Interaktionen der Arzneimittel aus der Gruppe der NSAR mit Auswirkungen auf den Haushalt der Mikronährstoffe betreffen Folsäure gemeinsam mit Vitamin B12, Eisen und N-Acetylcystein (Gröber 2009, 19-24). • Folsäure/Vitamin B12: bei regelmässiger Einnahme von NSAR kann es durch gastrointestinale Läsionen zu einem reduzierten Folsäure- oder auch Vitamin B12-Status kommen, ausserdem kann Folsäure durch ASS aus seiner Plasmaproteinbindung verdrängt werden. Aufgrund der altersbedingt verminderten Resorptionslage (z.B. durch eine atrophische Gastritis) wird daher besonders im Senium eine Supplementierung dieser Mikronährstoffe empfohlen. • Eisen: eine länger dauernde Einnahme von NSAR beeinträchtigt die Eisenabsorption und kann durch okkulte Mikroblutungen zu einem Eisenverlust führen (etwa 70% dieser Patienten verlieren mehr als 2 ml Blut pro Tag, 10% mehr als 10 ml: 1 ml Blut enthält ungefähr 0,5 mg Eisen). Die Symptome der daraus resultierenden hypochromen, mikrozytären Eisenmangelanämie äussern sich in verminderter physischer und psychischer Belastbarkeit (Müdigkeit, Antriebslosigkeit, Konzentrationsschwäche), anämischem Hautkolorit, Haarausfall und Kälteempfindlichkeit. Eine Supplementierung von Eisen sollte nur nach labordiagnostischem Nachweis des erniedrigten Ferritinstatus erfolgen, wobei darauf zu achten ist, dass eine gemeinsame Einnahme von Eisen und NSAR das Risiko für radikal-induzierte Schleimhautläsionen (Gastritis, Ulcerationen) erhöht: daher sollen Eisenpräparate und NSAR in einem Abstand von 2 bis 3 30 Stunden eingenommen werden, wobei Vitamin C oder Orangensaft durch die Reduzierung des 3-wertigen Eisens und die Bildung von Komplexverbidungen die gastrointestinale Verträglichkeit erhöhen. • N-Acetylcystein verringert das hepatotoxische Potential von Paracetamol bzw. Acetaminophen, indem es Synthese von Glutathion in der Leberzelle anregt und dadurch den Schutz der Hepatozyten fördert. Als Antidot findet es im Rahmen einer Paracetamol-Intoxikation Anwendung. 3.2.10. WW von Paracetamol Paracetamol (Acetaminophen) selbst beeinflusst nur selten den Metabolismus anderer Arzneimittel, z.B. vermindert es die Wirkung von Insulin, wodurch die Gefahr einer Hyperglykämie entsteht. Seine analgetische Wirkung kann aber durch die gleichzeitige Gabe von Antiemetika des Typs der 5-HT3-Antagonisten aufgehoben werden (Ondansetron: „Zofran“, Tropisetron: „Navoban“). Eine Gefahr in der Anwendung von Paracetamol ist immer in der Akkumulation seiner hepatotoxischen Metabolite zu sehen, die vor allem bei Kombinationen mit Antiepileptika und anderen Induktoren der CYP-Enzyme durch den vermehrten Umsatz der Wirkstoffe entstehen können (Beubler, 2011, 137). 31 4. Acetylsalicylsäure (ASS) 4.1. Allgemein Die Wirkung der Acetylsalicylsäure („Aspirin“, „Thrombo-ASS“) kommt dadurch zustande, dass sie einen Säurerest abgibt, der sich irreversibel an die COX-1 Isoform der Cyclooxygenase bindet („acetyliert“) und dadurch den Zugang zum aktiven Zentrum des Enzyms blockiert: die Arachidonsäure kann nicht mehr in Prostaglandine, Prostacyclin und Thromboxan umgesetzt werden. Diese spezielle Art der COX-Hemmung ist nur der Acetylsalicylsäure eigen und wird auch schon bei niedriger Dosierung erreicht, wodurch sich für den therapeutischen Wert dieses Wirkstoffes zwei Möglichkeiten ergeben: 1. als Hemmstoff der Thrombozytenaggregation in niedriger Dosierung (30100 mg); 2. bei höherer Dosierung kommen analgetische Wirkung (500-1000 mg) und antiphlogistische Wirkung (mehr als 3000 mg/die) dazu (Lüllmann et al., 2010, 314). Durch die weitaus höhere Affinität zu COX-1 als zur zweiten Isoform des Enzyms werden mit steigender wahrscheinlicher. Im Dosierung Rahmen einer auch lange die Nebenwirkungen andauernden, immer hochdosierten Behandlung, wie z.B.: bei der rheumatoiden Arthritis, ergibt sich ein ungünstiges Verhältnis zwischen dem therapeutischen Nutzen und der Schwere der Nebenwirkungen (geringe therapeutische Breite) (Aktories et al., 2009, 237). Daher ist ASS in der Akuttherapie der Erkrankungen des rheumatoiden Formenkreises durch neuere NSAR abgelöst worden, die gemeinsam mit Glucocorticoiden eingesetzt werden. 4.2. ASS als nicht steroidales Antirheumatikum Die Wirkungsweise und das Nebenwirkungsprofil der Acetylsalicylsäure wurden gemeinsam mit den anderen Vertretern der NSAR besprochen. 32 Hier soll noch einmal auf die Besonderheiten der ASS, die die Pharmakokinetik und die Kontraindikationen betreffen, eingegangen werden. Pharmakokinetik: nach einer sehr schnellen Resorption aus dem Magen und Darm durch Hydrolyse zu Salicylsäure, gehen die weiteren Schritte der Metabolisierung sehr viel langsamer und vor allem dosisabhängig vor sich. Bei normalen Dosen beträgt die Halbwertszeit des Wirkstoffes ungefähr 3 Stunden, nach der Applikation hoher Dosen (eventuell in suizidaler Absicht) verläuft die renale Elimination aufgrund der pH-abhängigen tubulären Rückresorption wesentlich langsamer: die Koppelungsprozesse in der Leber sind überfordert und es bleibt mehr freie Salicylsäure übrig, die die Protonenkonzentration im Urin erhöht und somit den pH-Wert in saures Milieu verschiebt. Das führt in weiterer Konsequenz dazu, dass es immer wieder zu einer Rückresorption der Salicylsäure kommt und die renale Elimination nur sehr langsam verläuft. Kontraindikationen: Neben den Kontraindikationen, die für alle NSAR gelten, ist die Anwendung von hohen Dosen ASS während der gesamten Schwangerschaft verboten, nach der 36.Schwangerschaftswoche auch in niederer Dosierung: ASS kann durch eine Wehenhemmung aufgrund der fehlenden Prostaglandinsynthese den Geburtstermin verzögern, einen frühzeitigen Schluss des Ductus arteriosus herbeiführen und sowohl beim Neugeborenen (intrakraniell), als auch bei der Mutter (peri- und postnatal) Blutungen verursachen (Ammon, 2001, 845). Reye-Syndrom: Kindern und Jugendlichen unter 16 Jahren, die an einem viralen, fieberhaften Infekt erkrankt sind, soll kein ASS verabreicht werden, weil die Möglichkeit der Entwicklung einer akuten Hepatoenzephalopathie besteht (Lüllmann et al., 2010, 316). Das Reye-Syndrom äussert sich anfangs mit Fieber, Kopfschmerz und Übelkeit, zeigt aber dann einen progredienten Verlauf in Richtung der Entwicklung eines Hirnödems mit der Gefahr einer Exazerbation mit Krämpfen und Atemstillstand. Im Frühstadium der Erkrankung ist eine Heilung möglich, kommt es zur Ausprägung des Vollbildes, liegt die Letalität zwischen 20 und 70% (Herold, 2012, 532). 33 4.3. ASS als Thrombozytenaggregationshemmer 4.3.1. Arterielle vs. venöse Thromben Um die therapeutischen Möglichkeiten, die für eine antithrombotische oder fibrinolytische Therapie zur Verfügung stehen, einsetzen zu können, muss man eine strikte Trennung zwischen dem Thrombus im arteriellen System und jenem im venösen Schenkel vornehmen. Arterielle Thromben entstehen dadurch, dass sich nach einer Läsion der Gefässwand Thrombozyten an diese Stelle anlagern und sich in weiterer Folge entsprechend der jeweiligen Flussrichtung des Blutstromes ein Schwanz aus Fibrin bildet. Reisst sich der Thrombus los, kommt es zu einer arteriellen Embolie: Prädilektionsstellen sind sie Gefässaufzweigungen und physiologischen Engen im arteriellen System (Abgänge der Aorta im Arcus, beim Durchtritt durch den Hiatus aorticus des Zwerchfells und an der Aortenbifurkation), die Folgen sind je nach Lokalisation Infarkte des Gehirns, der Nieren, der Milz oder der Eingeweide (Mesenterialinfarkt mit der Klinik des akuten Abdomens) oder auch akute Arterienverschlüsse im Extremitätenbereich (Herold, 2012, 813). Venöse Thromben entstehen überwiegend durch Strömungsverlangsamung und Stauungen (Virchow´sche Trias) und setzten sich fast nur aus Erythrozyten und Fibrin zusammen, Thrombozyten spielen als auslösende Faktoren keine Rolle. Bei einem venösen Thrombus besteht innerhalb der ersten 8 Tage die grösste Emboliegefahr, weil er in dieser Zeit noch nicht durch Granulationsgewebe fixiert ist. Als Prädilektionsstellen sind hier vor allem die tiefen Bein- und Beckenvenen anzusehen, von denen in weiterer Folge auch die akute Gefahr einer Lungenembolie ausgeht. Zusammenfassend ist zu sagen, dass aufgrund der unterschiedlichen Entstehung und Zusammensetzung der Thromben im arteriellen und venösen System auch jeweils andere Therapeutika zu Einsatz kommen: auf arterielle Thromben werden vor allem jene Arzneimittel eine Wirkung ausüben, die die Eigenschaften der Thrombozyten verändern, während venöse Thromben durch Massnahmen der 34 Fibrinolyse bzw. der Verhinderung der Entstehung von Fibrin beeinflusst werden können. 4.3.2. Acetylsalicylsäure Der Prozess der Thrombozytenaggregation wird von 2 antagonistisch wirkenden Faktoren bestimmt: das Thromboxan der Plättchen fördert sie, das Prostacyclin der Endothelzellen wirkt ihr entgegen, beide sind Produkte des Arachidonsäuremetabolismus. Die Acetylierung der COX-1 in den Thrombozyten führt zu einer irreversiblen Inaktivierung: die Synthese von Thromboxan ist nicht mehr möglich und die Hemmung der Blättchenaggregation ist in weiterer Folge für die gesamte Lebensdauer (8-11 Tage) der kernlosen Thrombozyten, die ja keine COX mehr nachbilden können, unterdrückt. In den Endothelzellen hingegen wird die Cyclooxygenase schnell wieder hergestellt und die Synthese von Prostacyclin kann wieder aufgenommen werden. Dadurch, dass prähepatisch eine höhere Konzentration der noch unveränderten Acetylsalicylsäure vorliegt als im systemischen Kreislauf, werden alle Thrombozyten, die das Versorgungsgebiet der Mesenterialarterien passieren, stärker acetyliert, als die Endothelzellen nach der Leberpassage des Wirkstoffes. So kommt es nach oraler Gabe von 50-100 mg/die zu einer Thromboxanhemmung, die stärker ausgeprägt ist, als die (ohnehin unerwünschte) Hemmung der Prostazyklinsynthese. Die Entstehung von venösen (Fibrin-)Thromben kann durch diesen Mechanismus aufgrund der unterschiedlichen Pathogenese nicht verhindert werden. Bei ungefähr 20% der Behandelten ist die antithrombotische Wirkung von ASS nur unzureichend ausgeprägt („non-responder“), 30% müssen die Behandlung wegen gastrointestinaler Nebenwirkungen abbrechen: bei ihnen stellt Clopidogrel („Plavix“) eine Alternative für eine kardiovaskuläre Prophylaxe dar. 35 Indikationen: In der niederen Dosierung wird die ASS zur Verhinderung von arteriellen Thrombosen eingesetzt. 1. Instabile Angina pectoris: ASS reduziert die Infarkthäufigkeit; 2. Transiente ischämische Attacke (TIA) und Insult treten unter ASS-Therapie seltener auf; 3. Sekundärprophylaxe nach Myokardinfarkt; 4. Okklusionsprophylaxe nach Bypass-Operation. 4.4. Interaktionen Die allgemeinen Wechselwirkungen wurden im Rahmen der NSAR-Interaktionen besprochen. 4.4.1. WW mit anderen NSAR Die antithrombotische Wirkung von ASS kann bei gleichzeitiger bzw. vorzeitiger Verabreichung anderer NSAR reduziert sein. Ausweg: Zuerst die Thrombozytenaggregationshemmung mit ASS und erst anschliessend (nach 2 Stunden) ein weiteres NSAR verabreichen. Ausserdem ist damit zu rechnen, dass sich die gastrointestinalen Nebenwirkungen verstärken (auch wenn die Therapie auf die selektiveren COX-2 Hemmer umgestellt wird). Daher ist diese Kombination nur anzuwenden, wenn es unbedingt nötig erscheint, wobei der zwingende Bedarf eines Magenschutzes mittels PPI besteht. 4.4.2. WW mit Antikoagulantien Auf nachvollziehbare Weise ergibt sich eine erhöhte (Spontan-) Blutungsgefahr durch die gegenseitige Wirkungsverstärkung. Therapeutisch kann diese Potenzierung („Thrombo-ASS“ und Cumarine) erwünscht sein, um eine Reduktion von thrombembolischen Ereignissen nach einem Herzklappenersatz zu erreichen. 36 4.4.3. WW mit Antibiotika In Kombination mit Antibiotika aus den Klassen der Penicilline, Cephalosporine, Tetracycline oder Chloramphenicol kann es ebenfalls zu einer verstärkten Wirkung der Thrombozytenaggregationshemmung kommen: durch den Einfluss auf die Darmflora kann sich bei hohen Dosierungen, bei langer Applikation der Antibiotika oder einer Vitamin K armen Ernährung ein verstärkter Einfluss auf die Blutgerinnung bemerkbar machen (Ammon, 2001, 846). 4.4.4. WW mit Vitamin C Acetylsalicylsäure hemmt den Natrium-abhängigen Vitamin C-Transport durch die Darmmukosa, sodass Vitamin C vermehrt mit Harn und Faeces ausgeschieden wird. Als Folge des verminderten Vitamin C-Spiegels findet sich ein erhöhtes Risiko für Mikroblutungen und Schleimhautläsionen durch freie Radikale im GI-Trakt, weil es zu einer Unterdrückung von antioxidativ wirksamen Enzymen, wie der Superoxiddismutase und der Glutathionperoxidase kommt (Gröber, 2009, 21). Ausweg: Eine gemeinsame Verabreichung von ASS und Vitamin C ist sinnvoll, denn sie vermindert die Gefahr für Schleimhautläsionen, die durch freie Radikale verursacht werden und kann in weiterer Folge einem Vitamin C-Verlust vorbeugen. 37 5. ACE-Hemmer 5.1. Allgemein: Therapie des arteriellen Hypertonus Mit zunehmendem Alter steigt in den Industrieländern auch der Blutdruck in der Bevölkerung an, wobei vor allem die Lebensumstände für dieses Entwicklung verantwortlich gemacht werden: Übergewicht, Bewegungsmangel und eine massiv erhöhte Kochsalzzufuhr begünstigen die Pathogenese und bilden auf der Grundlage der Arteriosklerose gleichzeitig die Basis für jene Folgeerkrankungen, die den arteriellen Hypertonus so konsequent therapiewürdig machen: Herzinsuffizienz, Myokardinfarkt, apoplektischer Insult und Nierenversagen. Nach den systolischen und diastolischen Werten findet eine Einteilung in Grad 1 (140-159/90-99), Grad 2 (160-179/100-109) und Grad 3 (über 180/über 90) statt (Herold, 2012, 294). Die Klinik des Bluthochdrucks umfasst manchmal Kopfschmerzen, Schwindel und Sehstörungen, in den meisten Fällen handelt es sich aber um eine symptomarme Erkrankung, was einen negativen Einfluss auf die Krankheitseinsicht ausübt, die die Basis jeder compliance darstellt: die Tatsache, dass bei einem normalisierten Blutdruck die Medikamente auch weiterhin konsequent eingenommen werden müssen, ist vielen Patienten nicht einsichtig. Ausserdem ist die Medikamenteneinnahme in den meisten Fällen eine Dauertherapie, die sich über mehrere Jahre, in vielen Fällen über das ganze weitere Leben erstreckt. Daher kommt der Kooperation zwischen Arzt und Patient in der Therapie dieser Erkrankung ein so hoher Stellenwert zu: Ziel ist es, den Blutdruck mit jenem Arzneimittel zu normalisieren, das bei dem Patienten die wenigsten Nebenwirkungen verursacht, wobei vor allem auch auf Interaktionen mit bereits vorhandenen Therapieschemata und einer eventuellen Bedarfsmedikationen zu achten ist. An dieser therapeutischen Beziehung muss von Seiten des Arztes von Beginn an gearbeitet werden, indem mit aller Klarheit auf die Tatsache hingewiesen wird, dass es, unabhängig vom eingesetzten Antihypertensivum, am Anfang der 38 Behandlung zu Müdigkeit, Abgeschlagenheit, Konzentrationsschwäche und Antriebslosigkeit kommen kann, die aber wieder verschwinden, nachdem sich der Blutdruck normalisiert hat. Trotz – oder in manchen Fällen vielleicht auch aufgrund- der beziehungsintensiven Arbeit, die eine wirksame Hypertoniebehandlung von Anfang an und auch in ihrem weiteren Verlauf konsequenterweise braucht, zeigen sich schlechte Werte in der compliance: in Abhängigkeit von der Verträglichkeit des Medikaments kann sie bis auf 20% und auch noch darunter sinken, wie es z.B. bei Diuretika der Fall ist (Lüllmann, 2010, 175). Obwohl es also im Rahmen der antihypertensiven Therapie sehr gute Arzneimittel mit gesichertem prognostischem Nutzen gibt, gelingt eine dauerhafte Senkung des Blutdrucks nur bei etwa einem Drittel der Patienten. Ätiologie: 1. Essentieller Hypertonus: dieser primäre oder idiopathische Hypertonus ist die bei weitem häufigste Form (ca. 90%) und als Ausschlussdiagnose definiert als jene Form des Hochdrucks, bei der es keine sekundären Ursachen gibt; 2. Sekundäre Hypertonieformen: es liegen bekannte Ursache für den Hochdruck vor, wie z.B. renoparenchymatöse (Glomerulonephritis, diabetische Glomerulonephrose) oder renovaskuläre Erkrankungen (Nierenarterienstenose); endokrinologische Ursachen (Hyperthyreose, Hyperaldosteronismus: primär (Mb.Cushing) oder sekundär, Phäochromozytom) oder andere Pathologien, wie eine Aortenisthmusstenose. Auch medikamentöse Ursachen müssen abgeklärt werden: NSAR, Ovulationshemmer, Cyclosporin, Steroide und Erythropoetin kommen in Frage. Kochsalzrestriktion: In den Änderungen der Lebensgewohnheiten, die einer medikamentösen Therapie des Bluthochdrucks immer vorausgehen bzw. diese in weiterer Folge dann begleiten sollen (Gewichtsabnahme durch mehr Bewegung: optimal wäre ein aerobes Körpertraining, bewusste Ernährung, eingeschränkter Alkohol- und völlig sistierter Tabakkonsum), nimmt die möglichst konsequente, aber leider frustrane Vermeidung von Kochsalz einen zentralen Stellenwert ein. Es liegt eine eindeutige Korrelation zwischen der täglichen Aufnahme von Kochsalz und der Höhe des Blutdrucks vor: in den Industrieländern werden 39 anstelle der empfohlenen 4 Gramm Salz pro Tag 10-15 Gramm konsumiert (1g NaCl entspricht 17mmol Natrium). Für diese Dauerbelastung mit Kochsalz ist der Organismus nicht ausgestattet, daher scheidet er das überzählige NaCl durch eine leichte Erhöhung des Blutdrucks vermehrt aus: ein subtiler Prozess, der sich aber im Laufe der Jahre zu einer manifesten Hypertonie verdichtet. Es ist festzuhalten, dass es sich bei einer salzarmen Kost nicht um eine Diät handelt, sondern um die ursprüngliche Form der Ernährung, für die sämtliche Regelmechanismen des Körpers ausgelegt sind. Diese angemessene Ernährung ist nur schwer zu verwirklichen, weil Fertiggerichte, Konserven, geräucherte Lebensmittel, Salzgebäck, Hartkäse, Schwarzbrot und alle Wurstsorten von Seiten des Salzgehaltes als ungeeignet angesehen werden müssen (Österr. Hochdruckliga, 2009, 14). Jede Hypertoniebehandlung sollte daher mit einer Gleichzeitigkeit beginnen: der konsequenten Kochsalzrestriktion wird ein Diuretikum zur Seite gestellt, das durch eine vermehrte Ausscheiddung den Kochsalzbestand des Körpers reduziert. Dafür eignet sich ein Thiazid-Diuretikum (z.B. Chlortalidon, Hydrochlorothiazid), das auch in Kombination mit einem kalium-sparenden Diuretikum (z.B. Amilorid oder Triamteren) angewendet werden kann, um eine sequentielle Nephronblockade zu bewirken (Herold et al., 2012, 211). Antihypertensiva der ersten Wahl: für folgende Therapeutika konnte eine lebensverlängernde Wirkung in der Therapie des arteriellem Hypertonus nachgewiesen werden: 1. Diuretika (in Verbindung mit einer reduzierten Kochsalzaufnahme); 2. Beta-Blocker: nicht kombinieren mit Kalziumantagonisten vom Verapamiloder Diltiazem-Typ (Gefahr der Bradykardie bzw. des AV-Blocks); 3. ACE-Hemmer bzw. Angiotensin II-Antagonisten (Sartane); 4. Kalziumantagonisten: nur lang wirkende, z.B.: Amlodipin, Felodipin, Nitrendipin. Meistens ist für eine effektive Therapie mehr als ein Wirkstoff erforderlich: in den Zweier- und Dreierkombinationen erweisen sich die Antihypertensiva der ersten 40 Wahl als prinzipiell gut miteinander zu kombinieren, es hat sich aber gezeigt, dass sich die Zusammenstellungen nach dem ABCD-Schema besonders bewähren. Abbildung 7 Therapie des arteriellen Hypertonus (Österr. Hochdruckliga, 2009) 5.2. ACE-Hemmer Das Renin-Angiotensin-Aldosteron-System nimmt in der Kreislaufregulation eine zentrale Rolle ein, indem es sowohl auf den Tonus der Gefässe, als auch auf das Blutvolumen Einfluss ausübt. In diesem Kreislauf verhindern ACE-Hemmer (Captopril, Enalapril, Lisinopril) durch eine reversible Bindung an das AngiotensinConverting-Enzyme die Umwandlung des biologisch unwirksamen Angiotensin I in Angiotensin II, einen der potentesten Vasokonstriktoren des Körpers, der im arteriellen Schenkel den peripheren Widerstand (also die Nachlast) hebt und gleichzeitig durch die Vasokonstriktion im venösen Schenkel den venösen Rückstrom zum Herzen fördert und dadurch die Vorlast erhöht. Der Anteil, den ACE-Hemmer an einer Senkung des Blutdrucks haben, hängt vom Aktivitätsgrad des RAA-Systems bei Behandlungsbeginn ab: bei einem Natriumund Wassermangel, z.B. im Rahmen einer Therapie mit Diuretika oder einer chronischen Herzinsuffizienz, ist die Aktivität hoch und ein ACE-Hemmer kann 41 einen massiven Blutdruckabfall bewirken - bis hin zu kardialen und cerebralen Durchblutungsstörungen. Ist der Körper im Gegensatz dazu mit Natrium und Wasser überladen, wird auch kein Renin aus dem juxtaglomerulären Apparat ausgeschüttet. Abbildung 8 Renin-Angiotensin-Aldosteron System (nach Herold G. et al., 2012) Trotzdem senken die ACE-Hemmer auch bei Patienten mit einem essentiellen Hypertonus (also bei normalen Reninwerten) den Blutdruck (Herold, 2012, 302): • es entsteht weniger Angiotensin II, der periphere Widerstand nimmt ab; • der Sympathikus wird weniger stark durch Angiotensin II stimuliert; • weniger Aldosteron und ADH werden ausgeschüttet: die Retention von Wasser und Natrium nimmt ab, das Volumen sinkt; • die von Aldosteron induzierte Myokardfibrose wird gehemmt; • das „remodelling“ des Myokards, also der Umbau des Herzmuskelgefüges, wird reduziert und dadurch die Progression der Linksherzhypertrophie verhindert; • der Abbau des Vasodilatators Bradykinin wird gehemmt. 42 Indikationen: 1. Arterieller Hypertonus 2. Herzinsuffizienz 3. Sekundärprophylaxe bei Myokardinfarkt 5.3. Interaktionen 5.3.1. WW mit Diuretika In dieser Kombination gibt es zwei Aspekte zu berücksichtigen: • wird ein ACE-Hemmer zu einem Diuretikum (im Rahmen der Therapie der Herzinsuffizienz oder Nierenarterienstenose und am Beginn des Stufenschemas der Hypertoniebehandlung) gegeben, kann es zu einer Überstimulation des ohnehin aktiven RAAS kommen, was zu einem massiven Blutdruckabfall mit konsekutiver Minderdurchblutung des Gehirns und des Herzens führen kann. Ausweg: Diuretikum 3 Tage lang pausieren, eventuelle Flüssigkeitsverluste kompensieren; niedrige Anfangsdosis des ACE-Hemmers wählen. • ACE-Hemmer dürfen nicht mit kalium-sparenden Diuretika (Spironolacton, Amilorid, Triamteren, Eplerenon) kombiniert werden, weil es durch die verminderte Aldosteronproduktion zu einer Kaliumretention kommt, die durch den additiven Aspekt dieser Diuretika zu einer Hyperkaliämie führt; dieser Mechanismus wird auch von zusätzlichen Risikofaktoren getriggert, wie einer Einschränkung der Nierenfunktion (Palmer, 2004), höheres Alter (Vanpee et Swine, 2000) und beiden Formen des Diabetes (Wrenger et al., 2003). Ausweg: andere Diuretika, z.B.: Hydrochlorothiazid, Indapamid, Xipamid, Chlortalidon. 43 5.3.2. WW mit NSAR ACE-Hemmer und NSAR besitzen zwei Eigenheiten, an die man bei einer Kombination denken muss: • auch NSAR können zu einer Retention von Kalium führen (Beubler, 2011, 66), sodass wieder bei gleichzeitiger Einnahme mit ACE-Hemmern die Gefahr einer Hyperkaliämie besteht; • die ACE-Hemmer verhindernden den Abbau von Kininen (z.B.: Bradykinin), die über die Bildung von Prostaglandinen und NO zu einer Vasodilatation und dadurch zu einer Reduktion der Nachlast führen; NSAR behindern durch die Hemmung der Cyclooxygenase diesen Mechanismus (Johnson et al., 1994) und zwar unabhängig von ihrer Selektivität in Bezug auf die COXHemmung (Aspirin erst ab einer Tagesdosis von über 300 mg); in der Niere werden keine vasodilatatorischen Prostaglandine mehr gebildet und der antihypertensive Effekt der ACE-Hemmer wird reduziert oder sogar vollständig aufgehoben (Mahé et al., 2001 und Massi et Teerlink, 2001). Ausweg: Antihypertensivum mit anderem Wirkprinzip, z.B.: Kalziumantagonisten. Bei einer Kombination aus ACE-Hemmer und NSAR ist also vor allem an mögliche renale Komplikationen zu denken: • NSAR führen über die Hemmung der Prostaglandinsynthese zu einer Vasodilatation und tragen dadurch zur Senkung des präglomerulären Widerstandes bei: dieser Effekt kann zur Minderperfusion bis zur glomerulären Ischämie mit konsekutiver Nekrose des Tubulus führen; • ACE-Hemmer reduzieren im Bereich des Vas efferens die durch Angiotensin II vermittelte Vasokonstriktion, wodurch der glomeruläre Filtrationsdruck sinkt: so erwünscht dieser Effekt auch sein kann, so kann er doch bei gleichzeitigem Vorliegen einer Herzinsuffizienz, eines Volumenmangels oder einer Nierenarterienstenose zu einem akuten Nierenversagen führen (Gröschl et al., 2007). 44 5.3.3. WW mit Azathioprin In der Kombination mit dem Immunsuppressivum kommt es bei einer Therapie mit ACE-Hemmern zu Anämie und Leukopenie bei dialysepflichtigen Patienten und solchen, die eine Nierentransplantation erhalten haben (Gossman et al., 1993 und Elijovisch et Krakoff, 1980). Ausweg: Ciclosporin zeigt diese Interaktion nicht. 5.3.4. WW mit Cotrimoxazol/Trimethoprim Schon im Rahmen einer Monotherapie mit Cotrimoxazol kann es zu Hyperkaliämie kommen, weil der Wirkstoff einen kaliumsparenden Effekt auf den distalen Tubulus ausübt. Kommt es zusätzlich durch einen ACE-Hemmer zu einer verminderten Aldosteronsekretion, wird durch den additiven Effekt noch weniger Kalium über die Niere ausgeschieden und die Gefahr einer Hyperkaliämie steht wieder im Raum (Baxter, 2010, 21). 5.3.5. WW mit Insektengift zur Desensibilisierung Im Rahmen der spezifischen Immuntherapie wird Bienen- oder Wespengift subkutan appliziert, um durch eine schrittweise Desensibilisierung eine Toleranzentwicklung gegenüber dem Allergen zu erzielen. Bei Patienten, die eine antihypertensive Therapie mit ACE-Hemmern erhalten, kann es durch die Potenzierung der hypotensiven Reaktion auf das Allergen zu anaphylaktischen Reaktionen mit generalisiertem Juckreiz und Blutdruckabfall bis in den Schock kommen (Stumpf et al., 2006). Ausweg: ACE-Hemmer für die Dauer der Immuntherapie pausieren oder durch Nifedipin ersetzen. 45 5.3.6. WW mit Kaliumpräparaten und Zink Der Mikronährstoffhaushalt kann ebenfalls mit ACE-Hemmern interagieren: • eine Selbstmedikation mit Kaliumpräparaten führt zu einer additiven Kaliumretention durch die Abnahme der renalen Kaliumausscheidung: es kann zu den Symptomen einer Hyperkaliämie kommen, wie z.B.: Parästhesien an Armen und Beinen, Muskelschwäche, Bradykardie und Arrhythmie. • Zink wird im Rahmen einer Therapie mit Captopril und Enalapril durch Komplexbildung vermehrt renal ausgeschieden: klinisch können sich eine Verminderung oder auch der völlige Verlust der Geschmacksempfindung, Appetitlosigkeit und Exantheme als Symptome eines Zinkmangels zeigen (Gröber, 2009, 55). Ausweg: Supplementierung von Zink (täglich 10 mg p.o.). 46 6. Statine 6.1. Allgemein: Übergewicht und Metabolisches Syndrom Übergewicht und Fettleibigkeit (Adipositas) nehmen in der Bevölkerung der Industrieländer kontinuierlich zu: sie verkürzen nicht nur nachweislich die Lebenserwartung, sondern gehören neben dem Rauchen und dem Alkoholismus auch zu den drei wichtigsten Ursachen für vermeidbare Erkrankungen und Todesfälle (Herold et al., 2012, 695). In Europa und den USA werden die Gewichtsklassifikationen mit Hilfe des Body mass index (BMI) erstellt, der sich aus dem Quotienten zwischen Körpergewicht (in kg) und dem Quadrat der Körpergrösse (in m) errechnet: • Normalgewicht: BMI 18-25 • Übergewicht (Präadipositas): BMI 25-30 • Adipositas Grad1: BMI 30-35 • Adipositas Grad 2: BMI 35-40 • Adipositas Grad 3: BMI 40 oder mehr Auch die waist-to-hip ratio, also der Quotient aus Taillen- zu Hüftumfang kann für eine Risikobestimmung herangezogen werden, weil er besonders die intraabdominelle Fettverteilung berücksichtigt: bei Werten von mehr als 94 cm für Männer und 80 cm für Frauen besteht ein erhöhtes Risiko für kardiovaskuläre und orthopädische Erkrankungen, Diabetes mellitus Typ 2 und auch die Häufigkeit für Malignome nimmt zu (bei Männern im Kolon und Pankreas, bei Frauen treten vermehrt Endometriumkarzinome und Non-Hodgkin-Lymphome auf) (Lüllmann et al., 2010, 261). Das metabolische Syndrom ist eine Konstellation von mindestens drei von fünf Risikofaktoren: 1. Stammbetonte Adipositas ab BMI 30 (Grad 1); 2. Essentieller arterieller Hypertonus; 3. DM Typ 2; 4. Dyslipidämie: erhöhte Triglyzeride, erniedrigtes HDL-Cholesterin; 5. Hyperurikämie. 47 Für den Patienten bedeutet das in weiterer Folge, ernsthaft erkrankt zu sein, eine Tatsache, die an sich schon sehr schwer zu kommunizieren ist, wenn die Einsicht, überhaupt an einer Krankheit zu leiden, von Seiten des Patienten her nicht vorhanden ist. Die Basistherapie des metabolischen Syndroms, die aber auf genau dieser Einsicht aufbaut, ist ein aktiver, eventuell lebenslang andauernder Prozess der Bewusstwerdung und Veränderung des Lebensstils: Umstellung der Ernährung auf eine fett- und kochsalzreduzierte Kost, körperliches Ausdauertraining in (beinahe) jedem Alter und eine Änderung des Verhaltens (neues Körpergefühl, alternativer Umgang mit Stress- und Frustrationserlebnissen ohne Nahrungsaufnahme, Selbstwert- und Selbstsicherheitstraining) (Herold et al., 2012, 696). Therapie: eine medikamentöse Therapie der Adipositas kann eine Änderung des Lebensstils nicht ersetzten, im Gegenteil: erst nach einer erfolgten Gewichtsabnahme im Rahmen einer cholesterinsenkenden Diät kommen Arzneimittel, wie z.B. Statine zum Therapieschema dazu, das dann als eine Langzeitbehandlung konzipiert wird, in deren Rahmen die Basistherapie auch weiterhin beibehalten werden muss. 6.2. Statine Statine sind jene Arzneimittel, die die Konzentration LDL-Cholesterins am wirksamsten senken: sie werden sowohl in der Primärprävention zur Senkung des Herzinfarktrisikos und der kardiovaskulären Ereignisse, als auch im Rahmen der Sekundärprävention eingesetzt und werden für alle Erkrankungen, die mit Atherosklerose in Verbindung stehen, empfohlen (Herold et al., 2012, 692). Die Vertreter dieser Arzneimittelgruppe, wie z.B. Atorvastatin, Simvastatin, Fluvastatin oder Pravastatin sind Hemmer der HMG-CoA-Reduktase, des Schlüsselenzyms der Cholesterinsynthese, das im glatten endoplasmatischen Retikulum der Hepatozyten vorkommt und dort den geschwindigkeitsbestimmenden Schritt katalysiert. Die Statine bewirken also eine 48 reduzierte Cholesterinaufnahme in die Leberzellen, woraufhin diese vermehrt LDL-Rezeptoren an ihrer Zelloberfläche exprimieren, um wieder mehr Cholesterin aufnehmen zu können: nicht nur LDL-Cholesterin wird vermehrt in die Zellen transportiert, auch die Vorstufen dazu, die IDL-Partikel, werden aufgenommen, sodass die Reduktion von LDL in Summe bis zu 40% ausmachen kann. Die HDLKonzentration steigt leicht an (bis 15%), die Triglyzeride fallen um bis zu 25% (Lüllman et al., 2010, 257). Interessant ist, dass die maximale Wirkung eines Statins bei niedriger Dosierung erreicht wird: jede weitere Verdoppelung der Dosis bringt nur mehr eine Senkung des LDL-Cholesterins um 6% (6%- Regel). Ausserdem senken die Statine zusätzlich auch die Konzentration des CRP, was dabei hilft, die Häufigkeit kardiovaskulärer Ereignisse zu vermindern. 6.3. Interaktionen Alle Wechselwirkungen der Statine haben ihre Ursprung darin, dass sie Substrate des CYP 3A4- Enzyms sind: kommt es zu einer Hemmung des Enzyms, steigt der Wirkstoffspiegel des jeweiligen Statins um das bis zu 10fache an und es kommt öfter zu teilweise schwerwiegenden Nebenwirkungen: vor allem an die Gefahr einer Rhabdomyolyse ist zu denken. Ausweg: die Behandlung mit Statinen ganz aussetzen, die Dosis reduzieren (z.B. nur 20 mg Simvastatin) oder jene Statine wählen, die weniger stark von den Wechselwirkungen betroffen sind. Polymorphismen der Transportproteine können ebenfalls eine signifikante Auswirkung auf die Pharmakokinetik und mögliche Toxizität von Statinen haben: alle HMG-CoA-Reduktase-Inhibitoren werden erst durch den Transporter „SLCO1B1“ in die Hepatozyten aufgenommen, sodass es bei den häufig anzutreffenden genetischen Varianten dieser Proteine zu einem fast vollständigen Verlust der Transportfunktion kommen kann, wodurch die Plasmaspiegel (AUC: area under the curve) massiv ansteigen können und sich die Gefahr für Myopathien bis hin zur Rhabdomyolyse drastisch erhöht. Dieser Effekt ist bei Simvastatin am ausgeprägtesten: die AUC kann bei Trägern des Polymorphismus um bis zu 221% ansteigen (Niemi, 2010). 49 Daraus ergibt sich die Möglichkeit einer individuellen Statintherapie durch eine Genanalyse auf einen Polymorphismus des SLCO1B1 Transporters noch vor einer hochdosierten Statintherapie bzw. im Rahmen einer Abklärung von Muskelbeschwerden unter laufender Therapie: diese Analyse ist kostengünstig und ohne hohen Aufwand mittels EDTA-Blut zu bewerkstelligen. 6.3.1. WW mit Azol-Antimykotika Fluconazol und Miconazol hemmen das CP 3A4-Enzym weniger stark als Ketoconazol und Itraconazol, die sehr potente Hemmer sind. In weiterer Folge hängt die Ausprägung der Interaktionen also auch davon ab, welche Azol- Antimykotika mit welchem Statin kombiniert werden: Fluvastatin zeigt einen starken Anstieg des Wirkstoffspiegel, die Konzentration von Pravastatin wird weniger stark beeinflusst (Jacobson, 2004 und Kivistö et al., 1998). Um die Gefahr einer Rhabdomyolyse zu verhindern, sollten Statine im Rahmen einer antimykotischen Therapie mit Azol-Präparaten abgesetzt werden (Kahri et al., 2005). 6.3.2. WW mit Kalziumantagonisten: Verapamil und Diltiazem Obwohl die beiden Antihypertensiva Hemmer des CYP 3A4 Enzyms sind, kommt es im Rahmen einer Kombination mit einem Statin (vor allem Simvastatin) nur sehr selten zu gravierenden Nebenwirkungen wie einer Rhabdomyolyse, vor allem dann, wenn bewusst nur die niedrigste Dosis des Statins appliziert wird. Rosuvastatin, Fluvastatin und Pravastatin zeigen deutlich weniger Interaktionen mit Verapamil und Diltiazem. 6.3.3. WW mit Antiarrhythmika: Amiodaron und Dronedaron Amiodaron ist ein Hemmstoff für eine ganze Reihe von CYP-Enzymen: durch die beeinträchtige Metabolisierung steigt die AUC, die ein Mass derjenigen 50 Wirkstoffmenge ist, die sich nach der Leberpassage im Systemkreislauf befindet, von z.B. Simvastatin um bis zu 73%. Wiederum zeigt sich eine höhere Inzidenz für eine Muskelschädigung (Myositis, Rhabdomyolyse) bei Simvastatin und Atorvastatin im Gegensatz zu Pravastatin – jeweils in Kombination mit Amiodaron (Ponte et Wratchford, 2003 und Ricuarte et al., 2006). Ausweg: Die Dosis des Statins (vor allem von Simvastatin und Lovastatin) soll in dieser Kombination 20 mg nicht überschreiten. 6.3.4. WW mit Makrolid-Antibiotika Die meisten Makrolide hemmen CYP 3A4 und führen in weiterer Folge zu einem starken Anstieg des Blutspiegels der kombinierten Statine, wenn diese auch durch das Enzym verstoffwechselt werden. • Simvastatin und Lovastatin sollen nicht mit gleichzeitig mit Erythromycin, Clarithromycin oder Telithromycin verabreicht werden, sondern während der antibiotischen Therapie abgesetzt werden (Kahri et al., 2004 und Bucher et al., 2002). • Pravastatin, Rosuvastatin und Fluvastatin werden nur zu einem geringeren Teil von CYP 3A4 umgesetzt und sollten daher weniger gefährlich für mögliche Wechselwirkungen im Sinne einer Rhabdomyolyse sein (Baxter, 2010, 1338). Trotzdem sollen Patienten, die mit diesen Statinen in Kombination mit einem Makrolid behandelt werden, sofort auf eventuelle Anzeichen eines Muskelschadens aufmerksam machen: rasche muskuläre Ermüdung, Muskelschmerzen, dunkel verfärbter Urin. 6.3.5. WW mit Grapefruitsaft Hohe Dosen von Grapefruitsaft (5 mal 200 ml pro Tag), aber auch schon durchaus vorstellbarere Mengen (3 mal 250 ml pro Tag) bis hin zu Berichten über eine einzelne Dosis von 240 ml Grapefruitsaft in der Früh, führen über die Hemmung 51 des CYP 3A4 in der Darmmukosa zu einer erhöhen Konzentration von unverändert in den Körper kommenden Wirkstoffen. Diese Wirkung ist zwar zeitlich begrenzt, kann aber auch noch nach 24 Stunden eine um 10% erhöhte AUC der Statine verursachen (Fukazawa et al., 2004 und Lilja et al., 2000). Ausweg: Information des Patienten über die Interaktion des Fruchtsaftes mit seiner Therapie, eventuell Statinwechsel auf Fluvastatin oder Rosuvastatin, die nicht von CYP 3A4 umgesetzt werden. 6.3.6. WW mit Mikronährstoffen Omega-3-Fettssäuren: erweitern das kardioprotektive Potential der Statine, indem sie zur Senkung der Triglyceridämie, des CRP und des Blutdrucks beitragen, aber auch den Anteil an HDL-Cholesterin erhöhen. Sie wirken auch als NO-Synthasen und tragen durch einen positiven Aspekt auf die Gerinnung zur Vorbeugung der Thrombenbildung bei. Eine adjuvante Einnahme von Omega-3-Fettsäuren, wie z.B. Eicosapentaensäure (EPA) oder Docosahexaensäure (DHA), ist im Rahmen einer cholesterinsenkenden Statintherapie durchaus zu empfehlen, weil es durch die beiden Elemente zu einer additiven Verringerung der kardiovaskulären Risikofaktoren kommt (Gröber, 2009, 97). Nicotinsäure: trägt ebenfall zu einer Verbesserung der Dyslipidämie bei und unterstützt daher in weiterer Folge die kardioprotektive Wirkung der Statine, indem sie zusammen das Gesamtcholesterin, LDL- und Triglyceridwerte weiter senken. Auch dieser Mikronährstoff zeigt durch seine additive Lipidmodulation in Zusammenhang mit einer Statintherapie den benefit einer weiteren Reduktion kardiovaskulärer Ereignisse. Vor einer Kombinationstherapie (z.B. Lovastatin mit Nicotinsäure) muss die Serum-Kreatininkinase (CK) normal sein, um eine Myopathie auszuschliessen (Taylor et al., 2004). 52 7. Selektive Serotonin-Rückaufnahme Hemmer (SSRI) 7.1. Allgemein Die Depression hat in ihrer Geschichte viele Namen, Klassifizierungen und schematisierte Einteilungen auf sich vereint. Heute spricht man nicht mehr von der endogenen, psychogenen (reaktiven, neurotischen) und somatogenen Depression, sondern verwendet den deskriptiven Begriff der depressiven Episode bzw. der Major Depression und ordnet sie den affektiven Störungen zu. Eine weitere Unterteilung erfolgt nach klinischen Gesichtspunkten, wie Schweregrad und Verlauf, wobei es immer wieder fliessende Übergänge zwischen Angststörungen und Depressionen gibt (Möller et al., 2009, 78-80). Depressionen gehören zu den häufigsten psychischen Erkrankungen überhaupt und nehmen auch unter den affektiven Störungen den zahlenmässig grössten Anteil ein: 5-10% der Bevölkerung leidet an einer behandlungsbedürftigen Depression, wobei anzumerken ist, dass es vor allem zuerst Allgemeinmediziner und Internisten sind, an die sich die Patienten mit ihren, auf den ersten Blick nicht mit der Diagnose einer Depression korrelierenden Symptomen, wenden: Lumbago, Kopf- und Nackenschmerzen, ein Cervikalsyndrom, sowie diffuse Bauchschmerzen und Einschränkungen des Bewegungsapparates werden häufig angegeben. Symptomatik: Leitsymptom der depressiven Episode sind Schlafstörungen, eine gedrückte Stimmung, Störungen der Konzentrationsfähigkeit, Suizidgedanken und ein gehemmtes Denken, das sich häufig in einer Grübelneigung erschöpft. Die Depression wird auch als die „Losigkeits-erkrankung“ bezeichnet, weil die Patienten über Zustände der Freudlosigkeit, Lustlosigkeit, Antriebslosigkeit und Hoffnungslosigkeit berichten, sodass es nicht verwundert, dass das Suizidrisiko bei depressiven Patienten ungefähr 30 mal höher ist als in der Durchschnittsbevölkerung und bis zu 80% über Suizidgedanken als ein Symptom ihrer Erkrankung berichten (Möller et al., 2009, 85-87). 53 7.2. SSRI Die Schwierigkeiten, die sich auf der Basis der Komplexität des Gehirns auch weiter auf die pharmakologischen Möglichkeiten der Einflussnahme ausdehnen, machen eine wissenschaftliche Prüfung der tatsächlichen Wirksamkeit einzelner Medikamente zu einer Herausforderung (Lüllmann et al., 2010, 348): • der Begriff der „Depression“ umfasst mehrere, zum Teil stark unterschiedlich verlaufende Zustände; • Art und Schweregrad einer depressiven Episode sind (auch mit psychologischer Testung) nur schwer zu objektivieren; • bei phasenhaften Verläufen kommt es immer wieder zu völlig (symptom-) freien Intervallen, in denen es vorübergehend zu einer scheinbaren Spontanheilung kommt; • eine Besserung der Symptomatik kann sich auch aufgrund psychischer Anteilnahme und Betreuung einstellen und nicht auf Basis der Medikation. Das Ziel einer pharmakologischen, antidepressiven bzw. thymoleptischen Behandlung besteht (einfach formuliert) darin, die herabgesetzte Grundstimmung wieder anzuheben. Darin öffnen sich auch in anderen Disziplinen neben der Psychiatrie Anwendungsgebiete für diese Arzneimittel, nämlich überall dort, wo depressive Zustände im Rahmen von Erkrankungen auftreten und die Klinik beeinflussen oder aber sogar selbst die Ursache dieser Erkrankungen ausmachen. Meistens suchen daher Patienten, die an einer depressiven Episode erkrankt sind, nicht den Psychiater, sondern den Hausarzt oder Internisten auf. Die Pathogenese der Depression wird heute in einem Ungleichgewicht im System der Neurotransmitter gesehen, in das durch den pharmakologischen Mechanismus der reuptake-Hemmung eingegriffen werden kann: durch eine Hemmung der Wiederaufnahme von Neurotransmitter verbleibt die Überträgersubstanz länger im synaptischen Spalt, ohne gleich nach ihrer Ausschüttung wieder inaktiviert zu werden. Das ist der akute Effekt der Medikamente, der aber nicht ihre antidepressive Wirkung, die oft erst nach einigen Wochen auftritt, erklärt: diese Latenz entsteht durch den Aufbau eines neuen 54 Gleichgewichtes zwischen der Konzentration der Neurotransmitter und der Empfindlichkeit der jeweiligen Rezeptoren. Die modernen (pharmakologischen) Behandlungskonzepte haben sich in vielen Fällen als sehr erfolgreich erwiesen, sie sind aber stark von der compliance des Patienten abhängig: vor allem das Beibehalten der Medikation noch weit über den Zeitpunkt einer erlebten Verbesserung oder gar Genesung hinaus stellt hohe Anforderungen an die Therapietreue – eine ähnliche Herausforderung, wie sie Arzt und Patient auch im Rahmen der Therapie des arteriellen Hypertonus erleben. Die SSRI sind die am häufigsten verwendeten Antidepressiva: Citalopram („Seropram“), Fluoxetin („Fluctine“), Fluvoxamin („Floxyfral“), Paroxetin („Seroxat“) und Sertralin („Gladem“). Sie hemmen die Rückspeicherung von Serotonin in die präsynaptischen Nervenendigungen des ZNS und erhöhen dadurch die Konzentration des Transmitters an den Rezeptoren und in weiterer Folge den biologischen Effekt. Sie werden bei leichter bis mittelschwerer Depression eingesetzt und benötigen eine Latenzzeit von ein bis zwei Wochen, bis ihre antidepressive Wirkung spürbar wird, wobei als erstes Anzeichen einer Besserung oft eine Normalisierung des Schlafverhaltens zu beobachten ist. Dadurch, dass sie keine Affinität zu den Alpha- und Muscarinrezeptoren aufweisen, fehlen den SSRI die typischen Nebenwirkungen der trizyklischen Antidepressiva, wie z.B.: Hypotension mit der Gefahr eines orthostatischen Kollaps, (Reflex-)Tachykardie, Xerostomie (staubtrockener Mund), Blasenentleerungsstörungen. Das Nebenwirkungsprofil der SSRI umfasst Appetitlosigkeit, Nausea und Emesis, Diarrhoe, Störungen der Sexualfunktion (Anorgasmie) und vor allem bei Jungendlichen ein gesteigertes aggressives Potential, das auch mit einer erhöhten Suizidalität einhergeht (Lüllmann et al., 2010, 350 und Beubler, 2011, 127). Insgesamt ist den Wiederaufnahme-Hemmern ein antriebssteigernder Effekt zuzuschreiben, der vor allem am Beginn der Therapie berücksichtigt werden muss: im Akutstadium der Depression sollte zusätzlich ein Tranquilizer gegeben 55 werden, um dem stark erhöhten Suizidrisiko zu begegnen, das durch die aktivierende Wirkung der SSRI eine erweiterte Aktualität bekommt. 7.3. Interaktionen In der Therapie mit SSRI muss auf eine erhöhte Blutungsgefahr bei gleichzeitiger Einnahme von NSAR und auf die Möglichkeit eines Serotonin-Syndroms geachtet werden. 7.3.1. WW mit NSAR Thrombozyten können Serotonin nicht selbst herstellen, sondern nehmen es über einen reuptake-Mechanismus aus dem Blut auf und geben es auch wieder direkt ins Blut ab, was einen wichtigen Faktor im System der regulierten Hämostase darstellt, weil Serotonin eine massive Förderung der Thrombozytenaggregation nach einer Verletzung bewirkt. Wird die Aufnahme durch den pharmakologischen Mechanismus der SSRI behindert, kommt es durch den Wegfall der hämostatischen Wirkung des Serotonins der Thrombozyten zu einer erhöhten hämorrhagischen Diathese, die in der Kombination mit einem NSAR noch weiter steigt und das Risiko für eine gastrointestinale Blutung erhöht (Wessinger et al., 2006). Ausweg: Einerseits stellen die für den GI-Trakt weniger toxischen NSAR wie Paracetamol, Metamizol oder auch Ibuprofen eine (vorsichtige) Alternative dar, andererseits muss vor allem in der Therapie älterer Patienten ein PPI oder H 2Rezeptorantagonist zusätzlich verabreicht werden. 7.3.2. Serotonin-Syndrom Die exzessive Stimulation der Serotoninrezeptoren kann unterschiedliche Gründe haben: 56 • ein serotonerger Wirkstoff wird erstmals verabreicht oder in seiner Dosis gesteigert; • bei einer Kombination mehrerer Arzneimittel dieser Gruppe kommt es zu einer additive Wirkstoffverstärkung (pharmakodynamische Interaktion); • der Abbau des Wirkstoffes wird verhindert, z.B. durch Blockade des dafür zuständigen CYP-Enzyms (pharmakokinetische Interaktion). Klinik: 1. autonom-vegetative Hypertonie; Tachypnoe, Symptomatik: „Grippegefühl“: Schwitzen, Tachykardie, Übelkeit, Durchfall, Kopfschmerzen; 2. zentral-nervöse Exzitation: Unruhe, Akathisie (Sitz-unruhe), Koordinationsstörungen, hypomanes Zustandsbild, Halluzinationen; 3. neuromuskuläre Symptomatik: Hyperreflexie, auch mit pathologischen Reflexen, Tremor, Myoklonie, Krämpfe. Arzneimittel mit serotonergem Mechanismus: 1. Psychopharmaka: a) SSRI: Citalopram, Fluoxetin, Sertralin, Paroxetin; b) SNRI: Venlafaxin, Duloxetin; c) TCA: Imipramin, Desipramin; d) MAO-Hemmer: Moclobemid; e) Andere Antidepressiva: Trazodon, Johanniskraut (Izzo, 2004); f) Atypische Neuroleptika: Risperidon, Olanzapin, Aripiprazol; g) Lithium; 2. Antikonvulsiva: Carbamazepin; 3. Antiemetika: Metoclopramid (Fischer et al., 2002), Ondansetron; 4. Analgetika: Tramadol, Fentanyl, Oxycodon (Mahlberg et al., 2004); 5. Migränemittel: Triptane; 6. andere: Ecstasy, Kokain, LSD. Ausweg: Eine Kombination mehrerer Wirkstoffe, die den Serotoninhaushalt beeinflussen, sollte vermieden werden, wobei die Gefahr des Serotonin Syndroms noch 2-5 Wochen nach Absetzen des serotonergen Arzneimittels gegeben ist. 57 7.3.3. WW mit Mikronährstoffen Ein Folsäuremangel reduziert die Verfügbarkeit von Serotonin im ZNS und führt auch zu Störungen in der Synthese der Neurotransmitter selbst: depressive Patienten zeigen oft einen Mangel an Vitamin B 12 und Folsäure (Gröber, 2009, 115) und in weiterer Konsequenz eine niedere Ansprechrate auf die Therapie mit SSRI (non-responder). Um dem entgegen zu wirken, sollte der Vitamin B12 Status und der Folsäurehaushalt im Rahmen einer Therapie mit SSRI auch berücksichtigt werden (und zwar von Beginn der Diagnosestellung an): eine konstante Ergänzung der psychopharmakologischen Therapie mit diesen Mikronährstoffen kann den Therapieerfolg positiv beeinflussen und sollte daher nicht aus der Hand gegeben werden. 58 Anhang 7.4. Substrate, Induktoren und Hemmer der CYP-Enzyme, geordnet nach Arzneimittelgruppen (nach Beubler, 2011) CYP 3A4 - Substrate AM-Gruppe INN A D CH Antihypertensiva: Amlodipin Norvasc Norvasc Norvasc Kalziumantagonisten Felodipin Nifedipin Plendil Adalat Munobal Adalat Plendil Adalat Hemmer Sildenafil Viagra Viagra Viagra Psychopharmaka: Diazepam Valium Valium Valium Benzodiazepine Klass.Neuroleptika Midazolam Triazolam Pimozid Dormicum Halcion Orap Dormicum Orap Dormicum Halcion Orap Andere Tranquilizer Zolpidem Ivadal Bikalm Stilnox Antiepileptika Buspiron Carbamazepin Buspar Tegretol Bespar Tegretal Buspar Tegretol Atorvastatin Sortis Sortis Sortis Lovastatin Simvastatin Mevacor Zocord Mevinacor Zocor Zocor Makrolide Erythromycin Erythrocin Erythrocin Erythrocin Immunsuppressiva Ciclosporin Sandimmun Sandimmun Sandimmun Analgetika Tacrolimus Fentanyl Prograf Durogesic Prograf Durogesic Prograf Durogesic Sonst: Estradiol Ovestin Ovestin Ovestin Phosphodiesterase-5 Statine Antiinfektiva: Tabelle 2 59 CYP 3A4 - Induktoren NN A AM-Gruppe Psychopharmaka: Antidepressiva Johanniskraut Antiepileptika Carbamazepin Phenobarbital Antiinfektiva: Rifabutin Antituberkulotika Rifampicin Jarsin Tegretol Mycobutin Eremfat D CH Jarsin Tegretal Luminal Alfacid Eremfat Jarsin Tegretol Luminal Mycobutin Rifampicin Tabelle 3 CYP 3A4 - Hemmer AM-Gruppe INN A D CH PPI Omeprazol Losec Antra Antra Cimetidin Limetag Cimlich - Kalzium-Antagonisten Verapamil Isoptin Isoptin Isoptin Antiarrhythmika Klasse III Klasse IV Antiinfektiva: Amiodaron Diltiazem Clarithromycin Sedacoron Dilzem Klacid Cordarex Dilzem Klacid Cordarone Dilzem Klacid Telithromycin Fluconazol Ketoconazol Itraconazol Miconazol Ciclosporin Ketek Diflucan Nizoral Sporanox Daktarin Sandimmun Ketek Diflucan Nizoral Sempera Daktar Sandimmun Diflucan Nizoral Sporanox Daktarin Sandimmun Danokrin - Danatrol Antagonist am H2Rezeptor Antihypertensiva: Makrolide Antimykotika Immunsuppressiva Sonst: Grapefruitsaft Anabolika Danazol Tabelle 4 60 AM-Gruppe Antihypertensiva Antiarrhythmika Klasse IB Broncho-Dilatator Psychopharmaka: SSRI Neuroleptika CYP 1A2 - Substrate INN A Propranolol Inderal D Dociton CH Inderal Mexiletin Theophyllin Theospirex Mexitil Solosin Theolair Fluvoxamin Pimozid Clozapin Olanzapin Floxyfral Orap Leponex Zyprexa Fevarin Orap Leponex Zyprexa Floxyfral Orap Leponex Zyprexa Tabelle 5 AM-Gruppe Antiepileptika Antiinfektiva: Antituberkulotika Sonst: Tabak CYP 1A2 - Induktoren INN A D Carbamazepin Tegretol Tegretal Phenobarbital Luminal Rifampicin Eremfat CH Tegretol Luminal Eremfat Rifampicin D CH Tabelle 6 AM-Gruppe Antiarrhythmika Klasse IB Klasse III Klasse IV ThrombozytenAggreg.hemmer Psychopharmaka: SSRI Antiinfektiva: Makrolid Gyrasehemmer CYP 1A2 - Hemmer INN A Mexiletin Amiodaron Diltiazem Sedacoron Dilzem Mexitil Cordarex Dilzem Cordarone Dilzem Ticlopidin Tiklid Tiklyd - Citalopram Fluvoxamin Seropram Floxyfral Cipramil Fevarin Seropram Floxyfral Erythromycin Ciprofloxacin Ofloxacin Erythrocin Ciprocin Tarivid Erythrocin Ciprobay Tarivid Erythrocin Ciproxin Tarivid Tabelle 7 61 CYP 2C19 - Substrate AM-Gruppe INN A PPI Omeprazol Losec Lansoprazol Agopton OAK Phenprocoumon Marcoumar Psychopharmaka: Amitriptylin Saroten TCA Clomipramin Anafranil SSRI Citalopram Seropram Benzodiazepine Diazepam Valium Antiepileptikum Phenytoin Epanutin Immunsuppressiva Cyclophosphamid Endoxan D Antra Agopton Marcumar Saroten Anafranil Cipramil Valium Phenhydan Endoxan CH Losec Agopton Marcoumar Saroten Anafranil Seropram Valium Phenhydan Endoxan Tabelle 8 AM-Gruppe Antiepileptika Antiinfektiva: Antituberkulotika CYP 2C19 - Induktoren INN A D Carbamazepin Tegretol Tegretal Phenytoin Epanutin Phenhydan Rifampicin Eremfat CH Tegretol Phenhydan Eremfat Rifampicin CYP 2C19 - Hemmer INN A Omeprazol Losec Lansoprazol Agopton D Antra Agopton CH Losec Agopton Ticlopidin Paroxetin Fluoxetin Fluvoxamin Felbamat Tiklid Seroxat Fluctine Floxyfral Taloxa Tiklyd Seroxat Fluctin Fevarin Taloxa Deroxat Fluctine Floxyfral Taloxa Ketoconazol Isoniazid Nizoral INH Nizoral Isozid Nizoral Rimifon Tabelle 9 AM-Gruppe PPI ThrombozytenAggr.hemmer Psychopharmaka: SSRI Antiepileptika Antiinfektiva: Antimykotika Antituberkulotika Tabelle 10 62 AM-Gruppe NSAR Antihypertensiva: Betablocker AT1-Antagonisten CYP 2C9 - Substrate INN A Diclofenac Voltaren Ibuprofen Seractil Naproxen Proxen Piroxicam Felden Celecoxib Celebrex D Voltaren Deltaran Proxen Piroxicam Celebrex CH Voltaren Seractil Proxen Felden Celebrex Carvedilol Losartan Irbesartan Dilatrend Cosaar Aprovel Dilatrend Lorzaar Aprovel Dilatrend Cosaar Aprovel Glibenese - - Saroten Epanutin Saroten Phenhydan Saroten Phenhydan Bactrim Eusaprim Bactrim Antidiabetika: Sulfonylharnstoffe Glipizid Psychopharmaka: TCA Amitriptylin Antiepileptika Phenytoin Antiinfektiva: Sulfamethoxazol Sulfonamide (+Trimethoprim =Cotrimoxazol) Tabelle 11 Am-Gruppe Antiepileptika Antiinfektiva: Antituberkulotika CYP 2C9- Induktoren INN A D Phenobarbital Luminal Phenytoin Epanutin Phenhydan Rifampicin Eremfat Tabelle 12 63 Eremfat CH Luminal Phenhydan Rifampicin AM-Gruppe Antiarrhythmika: Klasse III ThrombozytenAggr.hemmer Psychopharmaka: SSRI Statine Antiinfektiva: Nucleinsäurehemmer CYP 2C9 - Hemmer INN A D CH Amiodaron Sedacoron Cordarex Cordarone Ticlopidin Fluoxetin Paroxetin Fluvostatin Ticlid Fluctine Seroxat Lescol Tiklyd Fluctin Seroxat Locol Fluctine Seroxat Lescol Metronidazol Anaerobex Clont Perilox Sulfonamide Cotrimoxazol Bactrim Eusaprim Bactrim Antimykotika Fluconazol Voriconazol Diflucan Vfend Diflucan Vfend Diflucan Vfend Antituberkulotika Isoniazid INH Isozid Rimifon D Beloc Arutimol CH Beloc Timoptic Tabelle 13 AM-Gruppe Antihypertensiva: Betablocker Antiarrhythmika: Klasse IC Psychopharmaka: TCA SSRI SNRI Klass.Neuroleptika Atyp.Neuroleptika Analgetika: Mittelst.Opioide Starke Opioide Sonst: Antitussiva CYP 2D6 - Substrate INN A Metoprolol Beloc Timolol Betimol Propafenon Amitriptylin Clomipramin Paroxetin Venlafaxin Haloperidol Risperidon Tramadol Codein Rytmonorma Rytmonorm Saroten Saroten Anafranil Anafranil Seroxat Seroxat Efectin Trevilor Haldol Haldol Risperdal Risperdal Tramal ret Tramundin Codilol rt. DHC OxyContin Oxygesic Oxycodon Dextromethorphan Wick Tabelle 14 64 Wick Rytmonorm Saroten Anafranil Deroxat Efexor Haldol Risperdal Tramal ret Codicontin OxyContin Vicks AM-Gruppe ThrombozytenAggr.hemmer Antiarrhythmika: Klasse IC Klasse III Psychopharmaka: SSRI Klass.Neuroleptika CYP 2D6 - Hemmer INN A D CH Ticlopidin Tiklid Tiklyd - Profafenon Amiodaron Paroxetin Fluoxetin Sertralin Haloperidol Sedocaron Rytmonorma Seroxat Fluctine Gladem Haldol Cordarex Rytmonorm Seroxat Fluctin Gladem Haldol Cordarone Rytmonorm Deroxat Fluctine Gladem Haldol Tabelle 15 AM-Gruppe Analgetika Antiinfektiva: Antituberkulotika Inhalationsnarkotika Sonst: Alkohol CYP 2E1 - Substrate INN A Paracetamol Mexalen Isoniazid Isofluran Enfluran Ethanol:C2H6OH Methanol INH Forane Ethrane D Benuron CH Panadol Isozid Forene - Rimifon Forene - Tabelle 16 CYP 2E1 - Induktoren INN A AM-Gruppe Antiinfektiva: Antituberkulotika Isoniazid Sonst: Alkohol Tabak INH Isozid Tabelle 17 65 D CH Rimifon 7.5. Literaturverzeichnis Aktories K., Förstermann U., Hofmann F., Starke K., 2009, Allgemeine und spezielle Pharmakologie und Toxikologie, Urban und Fischer Verlag, München, 10.Auflage Ammon H.P.T., 2001, Arzneimittelnebenund Wissenschaftliche Verlagsgesellschaft Stuttgart, 4.Auflage -wechselwirkungen, Anditsch M., Fasching P., Psota G., Rainer M., Walter A., 2009, Psychopharmaka Austria 2010, Interdisziplinäres Forum für Psychopharmako-Therapie im Alter (IFPA), Wien Baxter K. (ed), Stockley’s Drug Interactions, 2010, Pharmaceutical Press London, 9.Auflage Beubler E., 2011, Kompendium der Pharmakologie, Springer Verlag, Wien, 3.Auflage Buber M., 1997, Ich und Du, Lambert Schneider Verlag, Heidelberg, 13.Auflage Bucher M., Mair G., Kees F., 2002, Effect of roxithromycin on the pharmacokinetics of lovastatin in volunteers, Eur J Clin Pharmacol (2002) 57, 78791 Committee on Safety of Medicines/Medicines Control Agency, 2002, Non-steroidal anti-inflammatory drugs (NSAIDs) and gastrointestinal safety, Current Problems (2002) 28,5 De Jong JC., Van den Berg PB., Tobi H., De Jong-van den Berg LT., 2003, Combined use of SSRIs and NSAIDs increases the risk of gastrointestinal adverse effects, Br J Clin Pharmacol., 2003 Jun; 55(6): 591-5 Delaney J.A., Opatrny L., Brophy J.M., Suissa S., 2007, Drug–drug interactions between antithrombotic medications and the risk of gastrointestinal bleeding, CMAJ 2007; 177: 347 Donnerer J., 2011, Arzneimittelinteraktionen, Vorlesung 409.103, Teil 1: Arzneimittelinteraktionen allgemein, Teil 2: Arzneimittelinteraktionen 1, Teil 3: Arzneimittelinteraktionen 2, www.medunigraz.at/pharma/0082103.htm Elijovisch F., Krakoff LR., 1980, Captopril associated granulocytopenia in hypertension after renal transplantation, Lancet (1981), i, 927-8 Fischer AA., Davies MW., 2002, Serotonin syndrome caused by selective serotonin reuptake inhibitors-metoclopramide interaction. Ann Pharmacother (2002) 36, 67-71 66 Fukazawa I., Uchida N., Uchida E., Yasuhara H., 2004, Effects of grapefruit juice on pharmacokinetics of atorvastatin and pravastatin in Japanese. Br J Clin Pharmakol (2004) 57, 448-55 Gossmann J., Kachel H-G., Schoeppe W., Scheuermann E-H., 1993, Anemia in renal transplant recipients caused by concomitant therapy with azathioprine and agiotensin-converting enzyme inhibitors, Transplantation (1993) 56, 585-9 Gröber U., 2009, Interaktionen Arzneimittel Wissenschaftliche Verlagsgesellschaft, Stuttgart und Mikronährstoffe, Gröschl I., Mayr M., Schifferli J., 2007, Iatrogene Angriffe auf die Niere, Schweiz Med Forum (2007) 7, 719-23 Herold G., und Mitarbeiter, 2012, Innere Medizin: Eine vorlesungsorientierte Darstellung, Gerd Herold, Köln Hippisley-Cox J., Coupland C., Logan R., 2005, Risk of adverse gastrointestinal outcomes in patients taking cyclo-oxygenase-2 inhibitors or conventional nonsteroidal anti-inflammatory drugs: population based nested case-control analysis, BMJ 2005; 331:1310 Izzo AA. (2004), Drug interactions with St. John´s wort (Hypericum perforatum): a rewiew of the clinical evidence. Int J Clin Pharmacol Ther (2004) 42, 139-48 Jacobson TA., 2004, Comparative pharmacokinetic interaction profiles of pravastatin, simvastatin and atorvastatin when administered with cytochrome P450 inhibitors. Am J Cardiol (2004) 94, 1140-6 Johnson AG., Ngyen TV., Day RO., 1994, Do nonsteroidal anti-imflammatory drugs affect blood pressure? A meta-analysis. Ann Intern Med (1994) 121, 289300 Kahri J., Valkonen M., Bäcklund T., Vuoristo M., Kivistö KT., Rhabdomyolysis in a patient receiving atorvastatin and fluconazole, Eur J Clin Phaarmakol (2005) 60, 905-7 Kahri J., Valkonen M., Vuoristo M., Pentikäinen PJ., 2004, Rhabdomyolysis associated with concomitant use of simvastatin and clarithromycin, Ann Pharmakother (2004) 38, 719 Kivistö KT., Kantola T., Neuvonen PJ., 1998, Different effects of itraconazole on the pharmacokinetics of fluvastatin and lovastatin. Br J Pharmakol (1998) 46, 4953 Lilja JJ., Kivistö KT., Neuvonen PJ., 2000, Duration of effect of grapefruit juice on the pharmacokinetics of the CYP 3A4 substrate simvastatin. Clin Pharmacol Ther (2000) 68, 384-90 67 Lüllmann H., Mohr K., Hein L., 2010, Pharmakologie und Toxikologie, Georg Thieme Verlag, Stuttgart, 17.Auflage Mahé I., Meune C., Diemer M., Caulin C., Bergmann J-F., 2001, Interaction between aspirin and ACE-inhibitors in patients with heart failure. Drug Safety (2001) 24, 167-82 Mahlberg ., Kunz D., Sasse J., Kirchheiner J., 2004, Serotonin syndrome with tramadol and citalopram. Am J Psychiatry (2004) 161, 1129 Massie BM., Teerlink JR., 2000, Interaction between aspirin and angiotensinconverting enzyme inhibitors: real or immagined. Am J Med (2000) 109, 431-3 Möller HJ., Laux G., Deister A., 2009, Psychiatrie und Psychotherapie, Georg Thieme Verlag, Stuttgart, 4.Auflage Niemi M., 2010, Transporter pharmacogenetics and Statin Toxicity, Clin Pharmacol Ther (2010) 87:130-3 Österreichische Hochdruckliga, Hochdruckbroschüre und Blutdruckpass, 2009, 2.Auflage Ouellet M., Riendeau D., Percival MD., 2001, A high level of cyclooxygenase-2 inhibitor selectivity is associated with a reduced inference of platelet cyclooxygenase-1 inactivation by aspirin, Proc Natl Acad Sci USA (2001) 98, 14583-8 Palmer BF., 2004, Managing hyperkalemia caused by inhibitors of the reninangiotensin-aldosterone system, N Engl J Med (2004) 351, 585-92 Ponte CD., Wratchford P., 2003, Amiodarone´s role in simvastaine-associated rhabdomyolysis. Am J Health-Syst Pharm (2003) 60, 1791-2 Ricuarte B., Guirguis A., Taylor HC., Zabriskie D., 2006, Simvastatine-amiodarone interaction resulting in rhabdomyolysis, azotemia and possible hepatotoxity. Ann Pharmakother (2006) 40, 753-7 Schippinger W., 2011, Vortrag „Initiative Polypharmazie in der Geriatrie“, Polypharmaziekongress am 5/10/2011 im Hörsaal der der Geriatrischen Gesundheitszentren, Albert-Schweitzer Gasse 36, 8020 Graz Schuster H-P., Trappe H-J, 2009, EKG-Kurs für Isabel, Georg Thieme Verlag, Stuttgart, 5.Auflage Stumpf JL., Shehab N., Patel AC., 2006, Safety of angiotensin-converting enzyme inhibitors in patients with insect venom allergies. Ann Pharmakother (2006) 40, 699-703 Taylor AJ., Sullenberger LE., Lee HJ., Lee JK., Grace KA., 2004, Arterial biology for the investigation of the treatment effects of reducing cholesterol (ARBITER) 2: 68 a double-blind, placebo-controlled study of extended-release niacin on atheriosclerosis progression in secondary prevention patients treated with statins. Circulation 2004; 110:35123517 Vanpee D., Swine C., 2000, Elderly heart failure patients with drug-induced serious hyperkalemia, Aging Clin Exp Res (2000) 12, 315-19 Wehling M., Burkhardt H., 2010, Arzneitherapie für Ältere, Springer Verlag, Heidelberg, 182-197 Wessinger S., Kaplan M., Choi L., Williams M., Lau C., Sharp L., Crowell MD., Keshavarzian A., Jones MP (2006), Increased use of selective serotonin reuptake inhibitors in patients admitted with gastrointestinal haemorrhage: a multicentre retrospective analysis. Aliment Pharmacol Ther (2006) 23, 937-44 Wester K., Jönsson A.K., Spigset O., et al., 2007, Incidence of fatal drug reactions: a population based study, Br J Clin Pharmacol, 65(4), 573-579 Wrenger E., Müller R., Moesenthin M., Welte T., Fröhlich JC., Neumann KH., 2003, Interaction of spironolactone with ACE inhibitors or angiotensin receptor blockers: analysis of 44 cases, BMJ (2003) 327, 147-9 WHO,1996,CancerPainRelief,2.Auflage, http://www.who.int/medicines/areas/quality_safety/Impaired_Access/en/ 69