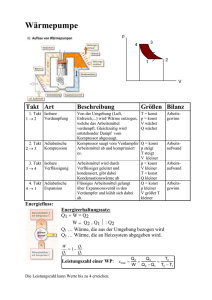
F p fl AF = F p È AF = F + p fl A p È = RT
Werbung

Systeme Systemgrenze Bei jeder Bilanzierung: 1. Bilanzgebiet abgrenzen durch Wahl der Systemgrenze Massenbilanz; Bilanzierung der Massenströme Energiebilanz; Bilanzierung der Energieströme 2. 3. 1 ! m ! w2 2 [kJ/s] [kg/s] EIN - AUS = zeitliche Veränderung im Bilanzgebiet • • • • HK• + HL• + HW• − HRG − HS• − HD• − Eelektr − Qstr − QVerlust = Qi* [kW] beliebig beliebig =0 #0 =0 Beispiel Fön Kühlschrank, Pneu Thermoskanne Pfanne, Radiator gibts kaum Konvention: Dem System zugeführt = positiv vom System abgeführt = negativ Beispiel KVA: d Kehricht + Luft + Wasser - Rauchgas - Schlacke - Dampf = Bilanzgebiet dt dm • mK• + mL• + mW• − mRG − mS• − mD• = Stoffüsse dt Bilanzgebiet dE dt Bilanzgebiet Energieüsse Wi* [kW] beliebig beliebig beliebig beliebig =0 stationär: zugeführt = abgeführt (d/dt = 0) instationär: zugeführt # abgeführt (d/dt # 0) Systembezeichnungen: mi* [kg/s] #0 =0 beliebig beliebig =0 T! g! H! R! v! n! M! !! E E+H prozentualer Anteil Energie (kin, pot) zur Gesamtenergie mi ! Vtot mtot Thermo- / Fluiddynamik Zustandsgrössen V! = T in °K T! # V" T " Aufheizfvorgang: p=konst., m=konst. p" M z" #" T f ! R!T 2 f=3 f=5 f=5 Kapitel 1 Systeme, Zustandsgrössen u, h sind druckunabhängig. H und U sind aber druckabhängig. Oszillationen (Schwingungen der Moleküle) zählen bei den Freiheitsgraden doppelt! & #f h = u + p ! " = % + 1( ! R ! T $2 ' 1-atomig! 2-atomig! mehr-atomig! kalorische (h, u) u= Helium! Sauerstoff! Luft! cp-Wert in Tabellen cv-Wert in Tabellen Achtung: Bei verschiedenen Temperaturen können die Moleküle auch höhere Freiheitsgrade besitzen (stärkere Oszillationen). Enthalpie bei idealem Gas z =1 bei realem Gas siehe Bohl S. 453 != R~ = 8314.51 J/kmol · °K R~ = 8.31451 J/mol · °K 1 mol = 6.02 * 1023 Teilchen 1 kmol = 6.02 * 1026 Teilchen RLuft = 287 J/kg°K p ! V = m ! R !T thermische (p, v, T) ideale Gasgleichung mit spez. Gaskonstante R p ! " = R !T universelle Gaskonstante != M"R p!V = n ! "! T reale Gasgleichung W =J/s [J/kg] 0°C = 273.15°K [-] [kJ/kg°K] (V = konst.) (Tab.16) [kJ/kg°K] (p = konst.) (Tab. 16) [J/kg] [J] [J] mi Druck p !U tot -- Temperatur T mtot massenunabhängig (intensiv) Stickstoff Ammoniak Sauerstoff z(p,T) = Realgasfaktor (mit Berücksichtigung externer Einüsse) N2! NH3! O2! Ui = spezische Zustandsgrössen massenabhängig (extensiv) Vi = spez. innere Energie! angereg. Freiheitsgr.! spezif. Wärmekapaz.! spezif. Wärmekapaz! Enthalpie! innere Energie! Energie! mi ! H tot mtot u! f! cv! cp! h! U! E! Hi = [°K] [m/s2] [J] [J/kg°K] [m3/kg] [mol] [g/mol] [J/mol °K] +++ © 2007 by René Sigrist +++ V1.0 +++ Fehler bitte melden an: [email protected] +++ Tabellenangaben beziehen sich auf: Taschenbuch der Physik, ISBN 3-446-22883-7 +++ Temperatur! Erdbeschl. (9.81)! Enthalpiestrom! spez. Gaskonst. (Tab.14)! spezisches Volumen! Anzahl Mole! Molmasse! universelle Gaskonst.! E pot = m ! g ! "z Ekin = abgeleitete Zustandsgrössen (nicht direkt messbar) Beschreibung Beispiel einheitliche Zusammensetzung und Rauchgas im Kamin Phase räumlich unterscheidbare Kondensattropfen in Luft Zusammensetzung und/ oder Phase Systembezeichnung offen geschlossen adiabat ($ klein) diabat/diatherm ($ gross) abgeschlossen System homogenes System heterogenes System Zustandsgrössen [N/mm2] [kg/m3] [m3] [kg] [N] [N] [N] [N] natürliche Zustandsgrössen (direkt messbar) F = p! A i Fa = !Fi = ! p " A Druck! Dichte! Volumen! Masse! Stangenkraft! Umgebungskraft! Kraft ausserhalb! Kraft innen! Fa = FSta + pu ! A p! "! V! m! FSta! Fu! Fa! Fi! Druck! spez. Volumen! Volumen! Masse! Auftriebskraft! Wärmemenge! Temperatur! p-V-T-Diagramm p! "! V! m! FA! Q! T! Druck Volume n [N/mm2] [m3/kg] [m3] [kg] [N] [J] [°K] g! cv! cp! U! A! d! b! r tu ra pe m Te Auftrieb T V tot Bei Gasen: c = cv wenn V = konst. c = cp wenn p = konst. i !y i yi = =1 ni i = "! i =1 y1 z y2 p V y= w z z ! x + y2 " x2 ! w w x1 p = konst. T Isobare V wi = mi ni " M i i = yi " Mi MGemisch = " y i ! M i Molmasse im Gasgemisch Isotherm = i i i ! m ! (n " M ) ! ( y " M ) i Massenteile in Molteile wi: 20% = 0.2 RGemisch = " w i ! Ri Gaskonstante im Gasgemisch wi Mi mtot mGemisch wi Mi n tot = Einheiten in Diagrammen: !! °C "! kg/m3 h! kJ/kg s! kJ/kg°K cp,cv! kJ/kg°K Kapitel 1 p-V-T-Diagramm, Auftrieb, Volumen, Wärmeenergie x2 Isobar mi Mi n i = y i ! n tot mi Mi ! n !( ) !( ) = m !R !T p = tot Gemisch Vtot V = konst. Isochore Gasgleichung i Massenteile in Molteile p !V = n ! "! T tot m !m i Massenanteil wi i i Anteile im Gas p p Isochor Wärmeenergie Thermo- / Fluiddynamik Flächen/Volumen Kreis Zylinder Pyramide Kugel Kegel wi = n !n i Molanteil yi yi = i "V Vi Volumenanteil #i !i = =1 Molanteil yi = Volumenanteil #i i [m2] [m2] [%] [%] [%] !w Oberäche! Manteläche! Molanteil (80% = 0.8)! Massenanteil (80% = 0.8)! Volumenanteil (80% = 0.8)! Kreisringäche AO! AM! ni ! wi! #i ! Hohlzylinder Erdbeschl. (9.81)! [m/s2] spezif. Wärmekapaz.! [kJ/kg°K] (V = konst.) (Tab.16) spezif. Wärmekapaz! [kJ/kg°K] (p = konst.) (Tab. 16) Umfang! [m] Fläche! [m2] Durchmesser! [m] Breite! [m] +++ © 2007 by René Sigrist +++ V1.0 +++ Fehler bitte melden an: [email protected] +++ Tabellenangaben beziehen sich auf: Taschenbuch der Physik, ISBN 3-446-22883-7 +++ Kontinuitätsgleichung m = ! " A " w V = A ! w m = V! " wenn p=konst. 1. Hauptsatz für geschlossene Systeme (Energieerhaltungssatz) 1. Hauptsatz für offene Systeme (Energieerhaltungssatz) Geschwindigkeit! Rohrreibungszahl! Rohrlänge! Rohrdurchmesser! anger. Freiheitsgrade! Drucksverlustbeiwert! Arbeit! '-( [m/s] [-] (Bohl S. 475) [m] [m [-] [-] [J] Einschiebe- und Ausschiebeleistung w! %! L! d! f! &! W! 6 diabat: T( = T' adiabat, reibungsfrei: Isentrop 1 2 3 4 5 1: ist im stationären Fall immer 0! (stationär = keine Durchussänderung) 2: Kolbenarbeit (wenn keine Kolben = 0) 3: Wellenarbeit (wenn keine Wellen = 0) 4: Feldenergie/Gravitation (wenn horizontale Röhre = 0) 5: Wärmeströme (wenn adiabat = 0) 6: konvektiver Energieuss (Massenuss vom Eingang bis Ausgang) [m/s] [kg/m3] [W] [J] [J] [-] [m/s] Kompression: WSystem > 0 Expansion: WSystem < 0 Leistung von Normalkräften oder Druckkräften Geschwindigkeit! Dichte (Tab. 1)! Pumpleistung! Pumpenergie! Verlustenergie! Wirkungsgrad (<1)! mittlere Geschwind.! Einschiebe- und Ausschiebearbeit w! "! Pp! #ep! #ev! $! w! Thermo- / Fluiddynamik 1 Anwendung Bernoulli-Gleichung !p " ' 0 Aususs aus Gefäss pU pU ( Druckwasserleitung ' 1. Grundgleichung pU 0 1 3 2 1 ' 0 0 8829 8829 9810 epot [Nm/kg] 100 9296.8 467.8 467.8 100 edruck [Nm/kg] 9810 613.2 613.2 613.2 0 ekin [Nm/kg] 0 Kapitel 2 Massen- und Energieerhaltung 0 A' = ... A1 = A2 = A3 A( = 0.25 · A3 "w = 1000 kg/m3 3. w1 = w2 = w3 (gleicher Querschnitt) 2. Werte bei ( berechnen z' = 1000 m! z1 = z2 = 900m! z3 = z( = 0 m! pu = 1 bar! w' = 0 (A' >> A() p( = pu (Freistrahl) = p' u' = u( " = konstant 3 w( ( Summe pro Zeilen immer 9910! 2 wS = wF auf horizontaler Ebene uS = uF Freistrahl !e = Einlauf Rohr Armaturen Düsen Auslauf Indizes: S = Stromröhre F = Freistrahl Energieform !p = " # $2 # w 2 # dL !p = !e " # Eindimensionale Bernoulli-Gleichung w!2 1 w2 1 + # p! + g # z! + $e p = % + # p% + g # z% + $ev 2 " 2 " #ev können durch z.B. Reibung entstehen. Druckform ! 2 ! " w# + p# + ! " g " z# + $p p = " w%2 + p% + ! " g " z% + $pv 2 2 Höhenform Pp = m ! "e p 1 p 1 p ! w"2 + " + z" + $H p = ! w%2 + % + z% + $H v 2! g 2! g #! g #! g # m ! ("ev + "e p ) Pumpleistung Pp = ) gerade Rohrstücke Pumpleistung mit Druckverlust und Wirkungsgrad " 2 Druckverlust ( # w2 Druckverluste !p !p = f - [J] [J/s, W] [kg/m3] [J] [mm] (Bohl S. 478) [m/s] [ m /s] Bei Verlusten: % = f(Stoff, Rauhigkeit) von 0.01 bis 0.08 (siehe Tafel 30 S. 478 im Bohl) & aus Bohl S. 180 Formstücke, Armaturen, Ein-, Ausläufe !p = " # $2 # w 2 3.6 [km /h] = Diagramm „Sättigungszustand“ v)! gesättigte Flüssigkeit! [m3/kg] v))! gesättigter Dampf! [m3/kg] "))! Dichte Dampf! [kg/m3] h)! Enthalpie Flüssigkeit! [kJ/kg] h))! Enthalpie Dampf! [kJ/kg] r! Verdampfungsenthalpie! [kJ/kg] (h))-h)) ) = Flüssigkeit )) = Dampf 1[ mm Wassersäule] = 9.81[ Pa] Wärmemenge! Wärmeuss! Dichte (Tab. 1)! Energie! Rauigkeit! Leitungsgeschwind.! Bei Wärmetauscher ist p = konst. Q! Q! "! e! k! wL! +++ © 2007 by René Sigrist +++ V1.0 +++ Fehler bitte melden an: [email protected] +++ Tabellenangaben beziehen sich auf: Taschenbuch der Physik, ISBN 3-446-22883-7 +++ Quergleichung Quergleichung Quergleichung gerades Rohrstück Bei Rohrkrümmungen entstehen verschiedene Druckvektoren. Grenzschicht turbulent = Re > 2320 siehe Bohl S.477 Als Grenzschicht wird eine dünne Schicht um einen umströmten Körper bezeichnet. Durch die Zähigkeit des Fluids werden Schubkräfte übertragen. Das Fluid hat an einer Wand die Wandgeschwindigkeit w = 0. Reibungskräfte %lam Dicke turbulente Grenzschicht Dicke laminare Grenzschicht %turb Werte aus VDI-Tabellen übernehmen. (Bohl S. 459) Newton)sches Fluid: # = konst. Ebene Platte w* x la y Rekrit + 3.2 * 105 bis 3 * 106 Re-Werte: Bohl S. 475 Rekrit" &" l" dh" A" U" d" k" Thermo- / Fluiddynamik Kräfte umströmter Körper Grenzschicht und Ablösung 0° ist der vordere Staupunkt, 180° ist der hintere Staupunkt F = m ! w , (Bohl S. 472/473) T in °K 2 ! "1 1.6666 3 1.4 5 1.333 6 1-atomig 2-atomig - 3-atomig f = s= konst, ds = 0 Kapitel 3 Strömung, Quergleichung, Isentrope Zustandsänderungen Isentrope Zustandsänderungen thermische Zustandsgrössen (ideales Gas): spezische Arbeit w!->" geschlossenes System (ideales Gas, # = konst.) Wasserdampf Freiheitsgrad f [m/s2] [-] [-] [-] (Bohl S. 472/473) [N] [W] [m/s] Isentropenexponent , Erdbeschleunigung (9.81)" Renoldszahl" Archimedeszahl" Isentropenexponent" Leistungskraft" Leistung" Leitungsgeschw." Sinkgeschwindigkeit g" Re" Ar" ," FL" P" wL" Isentropenexponent # spezische Arbeit w!->" offenes System (ideales Gas, # = konst.) mittlere Geschwind." [m/s] turb. Druckdifferenz" [Pa] turb. Winderstandsbeiwert" [-] (Bohl S. 164/165) Reibungskraft" [N] Widerstandsb. Oberäche" [-] (Bohl S. 272) Widerstandsb. Form" [-] Widerstandsb. Gesamt" [-] (Bohl S. 486/487) Oberächenleistung" [W] Re Widerstandskraft Wenn bei ReBestimmung w unbekannt ist, w=2 m/s annehmen und am Ende überprüfen. md = Festkörper mk = Fluid Bsp. Flügel Reibungskräfte an Grenzschichten von umströmten Flächen Widerstandskräfte an umströmten Körpern p !" wm" 'pturb" (turb" FR" cF" cD" cW" PO" Auftriebskraft ASpant = Projektion des Körpers quer zur Hauptrichtung. FL = Sinkgeschwindigkeit [-] [] [m] [m] [m2] [m] [m] [mm] Gewichtskraft cW Reynoldszahl" Scherung" Rohrlänge" hydr. Durchmesser" Querschnittsäche" Querschnittsumfang" Durchmesser" Rauigkeitswert" +++ © 2007 by René Sigrist +++ V1.0 +++ Fehler bitte melden an: [email protected] +++ Tabellenangaben beziehen sich auf: Taschenbuch der Physik, ISBN 3-446-22883-7 +++ [kg/m3] [m] [m/s] [Pa] [m2/s] (Bohl S. 495ff) [m] [m] [m] hydr. Durchmesser verschiedener Querschnitte: Bohl S. 174 Rohrströmung Bei nicht runden Rohren bildet man ein Ersatzrohr-Modell mit kreisförmigen Querschnitt, welches pro Kanallänge den selben Druckabfall aufweist wie das originale Rohr. ErsatzRohr Dichte" Rohrkrümmung" Geschwindigkeit" dyn. Viskosität" kin. Viskosität" Umschlagsstelle" lam. Grenzschichtdicke" turb. Grenzschichtdicke" A (Querschnittsäche) U (Querschnittsumfang) unrundes Rohr !" r" w" #" $" la" %lam" %turb" Impulssatz Reversible und irreversible Vorgänge (Zustandsgrösse Entropie) Ein reversibler Vorgang ist ein Vorgang, der sich vollständig rückführen lässt, ohne dass in der Umgebung eine Veränderung zurückbleibt. Ein irreversibler Vorgang lässt sich nur rückführen, wenn in der Umgebung bleibende Veränderungen gemacht werden. Gibb!sche Hauptgleichung Die Entropie S ist eine Zustandsgrösse, die Reversibilität bzw. Irreversibilität anzeigen kann. geschlossenes System offenes System nur für f = konst. Für s = konst. wird mit der Isentropengleichung gerechnet Für s " konst. wird mit der idealen Gasgleichung gerechnet Kreisprozesse Ein geeignetes Medium durchläuft eine Serie von Zustandsänderungen, so dass schlussendlich wieder der gleiche Zustand erreicht wird wie am Anfang. Wirkungsgrad <1" Volumen" innere Energie" spez. Volumen" Freiheitsgrade" Volumen" Druckverhältnis" [-] [m3] [J] [m3/kg] [-] [m3] [-] T" s" p" R" $" h" u" Temperatur" spez. Entropie" Druck" spez. Gaskonstante" Isentropenexponent" spez. Enthalpie" spez. innere Energie" • Wärmekraft-Maschinen produzieren als Nutzen Wellenenergie. Dazu benötigt werden zwei Wärmereservoire. • Kältemaschinen und Wärmepumpen produzieren ein Wärmeresevoir (bei Wärmepumpe Nutzwärme, bei Kältemaschinen Nutzkälte). Sie benötigen mechanische Antriebsenergie und ein zweites Wärmereservoir. !" V" U" v" f" V" #" Der 2. Hauptsatz Thermo- / Fluiddynamik d# ist die Wärme, die im Inneren des Systems durch Reibungseffekte entstanden ist, also dem System zugeführt wurde. Sie wird auch als Reibungswärme bezeichnet. Die Grösse d# hat also die gleiche Wirkung im System wie eine Wärmemenge dq, die von aussen über die Systemwand transportiert wird. Das T-s-Diagramm Der 3. Hauptsatz Nernst!sches Wärmetheorem Im 2. Hauptsatz interessieren vor allem die Entropieunterschiede zwischen 2 Zuständen interessieren und der absolute Wert der Entropie eines Zustandes weniger interessiert. Erst wenn durch chemische Reaktionen die Substanzen in einem System von einem Anfangszustand % in einen Endzustand & ihre Zusammensetzung ändern, muss man eine gemeinsame Entropieskala anwenden. Daraus entstand der 3. Hauptsatz: Die (absolute) Entropie eines homogenen festen Körpers, der sich in ungehemmtem thermischen Gleichgewicht bendet, nähert sich dem Wert Null, wenn sich die Temperatur dem absoluten Nullpunkt nähert. Kreisprozesse Prozessanalyse Zustandsänderungen in geeigneten Diagrammen einzeichnen Involvierte Energiemengen (Arbeit und Wärme) identizieren Apparativer Aufbau studieren Nutzen und Aufwand bestimmen Wirkungsgrad berechnen • • • • • Wirkungsgrad w" Geschwindigkeit" [m/s] Wärmemengen können im T-s-Diagramm sichtbar gemacht werden Arbeitsmengen können im p-v-Diagramm sichtbar gemacht werden [°K] [J/kg°K] [Pa] [J/kgK°] [-] (Bohl S. 472/473) [J/kg] [J/kg] Kreisprozesse Kapitel 3 Reversible Vorgänge, 2./3. Hauptsatz, Kreisprozesse Wirkungsgrad Joule-Prozess • Je grösser der Druckunterschied, desto besser der Wirkungsgrad • Der theoretische thermische Wirkungsgrad hängt nur von der 1. Kompression ab, und nicht etwa von T3 Für gute Wirkungsgrade: • 1-atomige Gase (jedoch in Praxis problematisch) • grosse Druckverluste +++ © 2007 by René Sigrist +++ V1.0 +++ Fehler bitte melden an: [email protected] +++ Tabellenangaben beziehen sich auf: Taschenbuch der Physik, ISBN 3-446-22883-7 +++ Realer Kreisprozess am Beispiel Gasturbine Bei realem Verdichter und Turbine gilt: d! > 0 ⇒ ds > 0 Temperatur" spez. Entropie" Druck" spez. Gaskonstante" Isentropenexponent" spez. Enthalpie" spez. innere Energie" ⇒ Die Entropie nimmt immer zu, auch bei Entspannung! [-] [m3] [J] [m3/kg] [-] [m3] [-] T" s" p" R" $" h" u" Totalenthalpie-Zustände im Gasturbinen-Prozess Wirkungsgrad <1" Volumen" innere Energie" spez. Volumen" Freiheitsgrade" Volumen" Druckverhältnis" Beim Begriff Totalenthalpie geht man von der Modellvorstellung aus, dass die in einem Strömungszustand vorhandene kinetische Energie isentrop in thermische Energie umgewandelt wird, indem die Strömungsgeschwindigkeit auf 0 reduziert wird. Damit kann sie auch in den relevanten Diagrammen eingezeichnet werden. !" V" U" v" f" V" #" [°K] [J/kg°K] [Pa] [J/kgK°] [-] (Bohl S. 472/473) [J/kg] [J/kg] [m/s] Isotherm spezische Wärme Geschwindigkeit" Isotherm Isochor geschlossenes System: siehe Kuchling S. 296 offenes System: spezische Arbeit Thermo- / Fluiddynamik w" Isotrop Isobar +++ © 2007 by René Sigrist +++ V1.0 +++ Fehler bitte melden an: [email protected] +++ Tabellenangaben beziehen sich auf: Taschenbuch der Physik, ISBN 3-446-22883-7 +++ Isobar Kapitel 3 Kreisprozesse