Document
Werbung

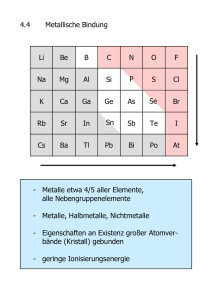
METALLE – CHEMIE 21.1.2014 ALLGEMEINES Elektronen sind locker zum Atomrumpf gebunden. Je lockerer sie gebunden sind, desto metallischer ist der Charakter. Gegen unten und nach links nimmt der metallische Charakter zu. o Gegen unten: Mehr Schalen, Abstand zum Atomrumpf ist grösser. o Gegen links: Atomrumpf hat kleinere Ladung. Metallgitter besteht aus Atomrümpfen und Elektronengas. EIGENSCHAFTEN Verformbarkeit Metall könne durch Hämmern, Ziehen oder wiederholtes Biegen gehärtet werden. Das liegt daran, dass dadurch die wenigen, grossen Kristallite zu vielen kleinen gemacht werden. Dadurch werden die Gleitvorgänge viel stärker gestört. Elektrische Leitfähigkeit Wird mit steigender Temperatur erniedrigt. Mit steigender Temperatur steigt, steigt die Wärmebewegung der Atomrümpfe. Dadurch sinkt die Beweglichkeit der Elektronen und der Stromtransport wird behindert (die Anzahl der Zusammenstösse der Elektronen mit den Atomrümpfen steigt proportional zur Temperatur). Leiter 1. Klasse: Leitung des Stroms erfolgt ohne gleichzeitigen Transport von Materie. Differiert stark zwischen den einzelnen Metallen. Manche Metalle zeigen unterhalb des kritischen Punkts eine Supraleitfähigkeit (Elektrischer Widerstand sinkt auf 0). Gute Wärmeleitfähigkeit Führt auch auf die Beweglichkeit der Elektronen zurück. Die Wärmebewegung der Atomrümpfe wird auf die leichter beweglichen Elektronen übertragen und so schnell abgeleitet (deswegen fühlen sich Metalle auch meistens so kalt an; sie leiten die Wärme gut und schnell ab). Metall mit hoher elektrischer Leitfähigkeit weisen auch ein hohe Wärmeleitfähigkeit auf. Metallischer Glanz Nicht alle Stoffe die metallischen Glanz zeigen, sind auch metallisch! Das einfallende Licht absorbiert Energie. Dadurch werden die locker gebundenen Valenzelektronen energetisch angeregt. Wenn die Elektronen später dann wieder auf ihr ursprüngliches Energieniveau sinken, geben sie Energie frei; meistens in Form von Licht (erzeugt den Glanz), manchmal aber auch in Form von Wärme (dann verfärbt sich das Metall). Hoher Schmelzpunkt 1 Die meisten Metalle haben einen hohen Schmelzpunkt, der Schmelzpunkt kann aber je nach Metall stark variieren. Löslichkeit Manche Metalle lassen sich in Metallschmelzen (flüssiges Quecksilber) lösen. Metall lassen sich nicht in Wasser, Säuren, Basen oder organischen Lösungsmitteln lösen. Kationenbildung Metalle haben locker gebundene Elektronen, die sehr leicht und mit niedrigem Energieaufwand entreissbar sind (niedrige Ionisierungsenergie). Deswegen bilden Metalle in chemischen Reaktionen ausschliesslich positiv geladene Kationen. Ferromagnetismus Manche Metalle kann man durch das Anlegen eines Magnetes magnetisieren (denk an den coolsten Geocache der Welt). Dieser Ferromagnetismus kann allerdings oberhalb einer gewissen Temperatur (Currie Temperatur) verloren werden. METALLISCHE BINDUNG Metalle ordnen sich in einem Gitter an Da alle Bausteine des Gitters die gleiche Grösse und gleiche Ladung haben, ist eine Anordnung mit hohen Koordinationszahlen (Anzahl direkter Nachbarn) und einer hohen Packungsdichte verwirklicht werden. Die abgegebenen Valenzelektronen sind jetzt nicht mehr einem Atomrumpf zuzuordnen sondern verteilen sich zwischen den Rümpfen. Die Gesamtheit der freien Valenzelektronen bezeichnet man als Elektronengas. Die Leitung des elektrischen Stroms stellt man sich so vor: Durch das angelegte Feld wird ein Elektron beschleunigt. Das Elektron überträgt dann seine Energie auf das nächste usw. Diese Energie wird auch auf die Atomrümpfe übertragen und dadurch erhöht sich deren kinetische Energie. STRUKTUR DER METALLE Metalle besitzen Körner, sogenannte Kristallite. Diese hängen über die Korngrenzen hinweg gut zusammen (Denk an Ruthers Raschel). Sie haben im Durchschnitt einen Durchmesser von 0.1 – 0.01 mm. Durch die Anwendung spezieller Züchtungsmethoden ist es möglich, Metalle herzustellen, die nur aus einem einzigen Kristallit entstehen. Dieses Metallstück (das nur aus einem einzigen Kristallit besteht) zeichnet sich dann durch Eigenschaften wie einer grösseren Elastizität und einer besseren elektrische Leitfähigkeit aus. 2 M E TA L L G I TT E R Alle Metalle sind in der Hauptsache in drei verschiedenen Kristallgittern aufgebaut. Diese sind alle relativ kompakt. Der Grund für das Kompaktsein liegt in den Gitterbausteinen. Diese haben nämlich schwach gebundene Valenzelektronen. [Weiteres unter 5.2, Seite 5] Die Koordinationszahlen betragen 8 bzw. 12 (je nach Gitter) Kubisch Flächenzentriert und hexagonales Gitter Zunächst einmal ordnen sich alle Kugeln in einer Ebene möglichst dicht aneinander. Jede Kugel hat 6 direkte Nachbarn (ausser die am Rand). Die verschieden Gitter unterscheiden sich also lediglich darin, wie die Ebenen aufeinander gestapelt sind. Diese Schicht bildet die Ebene A. Auf die Ebene A folgt eine Ebene B. In die Mulden der Ebene A lagern sich die Kugeln der Ebene B. Lagern sich die Kugeln der ritten Kugel wieder über den Mulden der ersten Schicht ein, entsteht eine ABA Struktur. Diese bildet das hexagonal dichteste Gitter. Deswegen heisst es auch hexagonales dichtestes Gitter. Folgt auf die B Schicht allerdings eine C Schicht, so erhält man ein kubisch flächenzentriertes Metallgitter. Die C Schicht lagert sich in den Mulden der 2. Ebene ein. Falls dies der Fall ist, erhält man eine ABC Struktur. Diesen Gittertyp nennt man ein kubisch flächenzentriertes Gitter. Aber man sagt ja s schön: Bilder sagen mehr als tausend Worte, deswegen: Die A Schicht würde in den Dreiecksmulden liegen, die C Schicht in den Punktmulden. Die Koordination in diesen beiden Gittern beträgt 12. 3 Kubisch raumzentriertes Gitter Dieses Gitter ist etwas lockerer und weniger kompakt. Die Koordinationszahl des Gitters beträgt gerademal 8. Die Mulden der Ebenen werden nicht mehr aus Dreiecken, sondern aus Quadraten gebildet. Und auch hier: Schaut euch das Bild an, dann versteht ihr’s sofort: LEGIERUNGEN In die Gitter der Reinmetalle können auch noch Fremdatome eingebaut werden. Dies erhöht in der Regel die Härte, da zusätzliche Bindungskräfte auftreten und die Gleitvorgänge gestört werden (wie Sand im Getriebe). Legierungen entstehen in Metallschmelzen (in Metallschmelze rein und dann abkühlen; denk an den Stahlproduktionsfilm). Die Leitfähigkeit von Legierungen ist im Allgemeinen kleiner als die von den reinen Metallen. Haben meist auch metallischen Glanz, besitzen allerdings oft eine andere Farbe als das Reinmetall. L E G I E R U N G S TY P E N Interstitielle Legierung Eine Atomart besetzt unregelmässig die Lücken des Wirtsgitters. Substitionslegierung Einige Atome des Hauptatomes (Atomsorte von der es am meisten hat) werden unregelmässig durch Atome des Legierungspartners ersetzt. Vorrausetzungen zur Bildung einer solchen Struktur: Etwa gleiche Grösse und Kristallstruktur der beteiligten Atomsorten. Intermetallische Phase Wenn die Besetzung von Wirtsgitterplätzen nicht statistisch (zufällig) erfolgt, sondern nach einem bestimmten Muster, spricht man von einer intermetallischen Legierung. Eutektische Gemische Stoffe in flüssigem Zustand ein homogenes (einheitliches) Gemisch bilden, in festem Zustand sich allerding gegenseitig ausschliessen (bilden Kristallite, greifen nicht wirklich in einander über; sieht so aus wie Öl im Wasser). So bilden sie ein Gemenge. Das Gemenge mit dem tiefsten Schmelzpunkt und definierter Zusammensetzung nennt man Eutektikum. 4