14. Stereochemie Bereits am Anfang der Vorlesung einige
Werbung

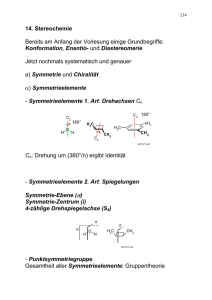
195 14. Stereochemie Bereits am Anfang der Vorlesung einige Grundbegriffe: Konformation, Enantio- und Diastereomerie Jetzt nochmals systematisch und genauer a) Symmetrie und Chiralität α) Symmetrieelemente - Symmetrieelemente 1. Art: Drehachsen Cn C2 H O C3 120° 180° H3C CH3 H3C H C2 CH3 CH3 ad15-01.cw2 Cn: Drehung um (360°/n) ergibt Identität - Symmetrieelemente 2. Art: Spiegelungen Symmetrie-Ebene (σ) Symmetrie-Zentrum (i) 4-zählige Drehspiegelachse (S4) σ σ H O H σ H3C CH3 ad15-01.cw2 - Punktsymmetriegruppe Gesamtheit aller Symmetrieelemente: Gruppentheorie 196 β) Chiralität • Chiralität (chiral) Händigkeit (händig) Nicht-Deckbarkeit von Bild und Spiegelbild • Chirale Objekte: Hand Schuh Schnecke Schraube Aminosäure-Molekül (z.B. Alanin) Propeller Bedingung für Chiralität Objekt darf keine Spiegelebene Symmetriezentrum S4-Achse besitzen Achtung: Objekt darf Drehachsen besitzen (Propeller sind Chiral) asymetrisch ≠ chiral ! Objekt ist asymetrisch, wenn kein Symmetrieelement vorhanden ist. • achiral = nicht chiral achirale Objekte: Würfel (ohne Augen !) Methan-Molekül Mensch idealisiert • Chiralitätszentrum tetraedrisches Atom mit 4 materiell oder geometrisch verschiedenen Liganden H H3C C COOH Cl Chiral.CW3 197 γ) Enantiomere, Helizität - Moleküle mit Chiralitätszentrum Chiralitätszentrum: Atom mit vier verschiedenen Substituenten H COOH H C H H C H H H achiral achiral COOH H C H CH3 achiral (prochiral) COOH H C OH COOH HO C H CH3 CH3 chiral ! ad15-01.cw2 - Moleküle ohne Chiralitätszentrum Allene Cl H Cl Cl C C C Cl C C C H H H Biphenyle A A A A ≠ Sp.-B. B B B B Helices (Schrauben) Hexahelicen ad15-01.cw2 198 b) Stereoisomerie, Unterscheidung von Enantiomeren α) Übersicht Klassifizierung von Isomeren Isomere Konstitutionsisomere Stereoisomere Konstitutionsisomere gleiche Bruttoformel, unterschiedliche Verbundenheit (=Topologie) Stereoisomere gleiche Konstitution, unterschiedlicher räumlicher Aufbau Stereoisomere werden nach zwei verschiedenen Kriterien subklassifiziert: Stereoisomere Symmetrie Enantiomere (Bild Spiegelbild) Umwandlungsart Umwandlung durch: Diastereo(iso)mere (sonstige) Stereoisomere Konformationsisomere Konfigurationsisomere (Drehung um Einfachbindungen) (Sonstiges, z.B. Bindungsbruch Org06-07.CW3 Diese Klassifizierungen sind nicht abhängig von der Energie ! 199 β) Diastereomere Alle Eigenschaften verschieden (Schmelzpunkt, Siedepunkt, Löslichkeit) Grund: Interne Atomabstände verschieden. Cl Cl Cl Cl γ) Enantiomere - Achirale Umgebung Alle Eigenschaften gleich (Schmelzpunkt, Siedepunkt, Löslichkeit) Grund: Interne Atomabstände gleich σ Cl Cl Cl Cl Konsequenz: Synthese 1:1-Gemisch (racemisches Gemisch) σ Ph O H3C ad15.cw2 NaBH4 Ph H3C H OH Ph + H3C 1 : 1 Racemisches Gemisch OH H 200 - Chirale Umgebung Enantiomere verschieden, Beispiel: σ L-Hand R-Hand Enantiomere σ R-Hand R-Handschuh L-Hand R-Handschuh Diastereomere ad15.cw2 Konsequenzen: Linkshänder: Warum haben Linkshänder Probleme im täglichen Leben? Physiolog. Eigenschaften Geruch, Beispiele Carvon und Limonen: σ σ O O R S Minze Kümmel R S Orange Zitrone ad15-02.cw2 Biosynthese, Stereoselektivität COOH C O CH3 achiral "H " Enzym NADH COOH HO C H CH3 nur ! ad15-02.cw2 201 Optische Drehung gew. Licht lin.-pol. Licht Pol.-Filter ad15-02.cw2 = rac. Gem. R S circ.-pol. Licht Konsequenz: 1 Enantiomer XS bildet unterschiedliche WW: XS CS Dia XS CR .... ad15-02.cw2 Nicol-Prisma Lichtquelle Meßröhre Nicol-Prisma Polarisator Analysator mit Teilkreis Okular => unterschiedlicher Brechungsindex für Scirc v. Rcirc = Drehung Polarisations-Ebene = optische Aktivität α = f (Temp., λ, c, d) T [α] λ = α c·d α [° ] c [g/ml] d [dm] ad15-02.cw2 Org15_00.cw2 202 c) Absolute Konfiguration: R/S- und D/L-Nomenklatur (ein Chiralitätszentrum) α) R/S-Nomenklatur 1 H 6 H H3C C F 9 F C CH3 Cl Cl 17 Ad15-03.cw2 • Priorität Ligand nach Ordnungszahl: Cl > F > C > H • Blick: vom Zentrum zum niedrigster Ligand (H) • Sinn verbleibender Liganden Uhrzeigersinn: R (rectus) Antiuhrzeigersinn: S (sinister) H H3C F C S R / S = absolute K. Cl Ad15-03.cw2 β) Fischer-Projektion, D/L-Nomenklatur Fischer-Projektion Projektion eines Tetraeders in folgender Weise auf die Papierebene: COOH COOH H2N H CH3 (Alanin) H2N H CH3 Ad15-03.cw2 203 DL-Nomenklatur • C-Kette vertikal, Gruppe höherer Ordnungszahl oben • Substituenten H u. X (OH, NH2, Hal) horizontal X rechts: D , X links: L Beispiel: H O H3C H OH H O HO H CHO HO H CH3 CH3 L Ad15-03.cw2 d) Verbindungen mit mehreren Chiralitätszentren α) Konstitutionell verschiedene Zentren COOH CH(OH) 2 Möglichk. 2 Möglichk. CH2OH 2 · 2 = 22 = 4 CH(OH) Ad15-03.cw2 Möglichkeiten: (S,S) en (R,R) dia dia dia (R,S) en (S,R) Ad15-03.cw2 Allg.: bei n Zentren: 2n Stereoisomere paarweise enantiomer 204 Verbindungen mit mehreren Chiralitätszentren, die nicht konstitutionsäquivalent sind • Allgemein Verbindungen mit n nicht konstitutionsäquivalenten Zentren: 2n Stereoisomere • Dieses gilt für zyklische und offenkettige Verbindungen CH3 H C OH H C OH n 2 2 = 2 = 4 Stereoisomere CH3 H C OH H C OH 4 2 = 16 Stereoisomere 8 Enantiomerenpaare H C OH H C OH H C OH HOH2C O CH2OH HO OH HO OH 5 2 = 32 Stereoisomere Org15_03.cw2 • Die relative und absolute Konfiguration wird durch Drehung um Einfachbindungen nicht geändert, daher unabhängig von der Konformation definiert • Alle Stereoisomeren sind chiral 205 Verbindungen mit konstitutionsäquivalenten Chiralitätszentren Atome sind konstitutionsäquivalent, wenn sie identisch verbunden sind (bildlich: sie sind ununterscheidbar in einem Molekülmodell, das aus farbigen Kugeln [= Atome, Farbe = Ordnungszahl] und Bindfäden besteht) Konsequenzen: • Die Zahl der Stereoisomeren ist kleiner als 2n (n = Zahl Chiralitätszentren) • Es treten chirale und achirale Stereoisomere auf • Mesoform = achirale Verbindung mit mehreren Chiralitätszentren Beispiel: H Br C-1/C-2 konstitutionsäquivalent 1 2 + Br2 H mögliche Stereoisomere: 3! Br H (meso) Br (R,S) u H Br Br Br Br Br (R,R) l (S,S) l Org15_04.cw2 HO CH3 OH HO OH H OH H OH H O CH3 CH3 H COOH H 4 2 2 2 konstitutions-äquiv. Z ? ? ? ? Stereoisomere H O Org15_04.cw2 206 β) Konstitutionell gleiche Zentren Bekanntestes Beispiel Weinsäuren: COOH CH(OH) CH(OH) konstit. Äquiv. H H Cl Cl COOH Ad15-03.cw2 Wieviele Stereoisomere? Alle Möglichkeiten durchgehen: COOH σ COOH H C OH HO C H H C OH HO C H COOH COOH meso-W. achiral, Fp. 170 °C Ad15-03.cw2 COOH HO C H H C OH COOH H C OH HO C H COOH D(S,S) COOH L-W. (R,R) Fp. 139 °C [α] D = +12 −12 Analog Dichlor-Cyclopentan, 3 Isomere: meso, (R,R), (S,S) e) Trennung von Enantiomeren Prinzip: wie Handschuhe / Hände es müssen Diastereomere gebildet, diese getrennt, dann wieder gespalten werden besonders günstig: Salze 207 Beispiel Trennung Enantiomere der Mandelsäure: COOH COOH H C OH Ph HO C H Ph (R) (S) rac-Mandelsäure CH3 H C NH2 Ph (S)-Phenylethylamin Durchführung: EN RR COOH RS R S' RR COO R S' NH3 COOH NH2 RS COO R S' NH3 leicht löslich schwer löslich 1. Umkrist. R S' 2. HCl aus Kristallisat: RR COOH aus Mutterlauge: RS COOH NH3 Ad15-03.cw2 208 z.B.: H OH CO2H H 2N + HO2 C 3-Butin-2-amin racemisch, beide Enantiomere 1:1 H OH CO 2HO 2C . H 3N H H OH (+)-Weinsäure + H OH CO2 - H3 N H . HO2 C H OH H OH diastereomere Salze kristallisiert aus und kann dann abf iltriert werden K2CO3 H 2N H (R)-(+)-3-Butin-2-amin bleibt in Lösung K2CO3 H 2N H (S)-(-)-3-Butin-2-amin 209 Trennung von Enantiomeren a. In einigen wenigen Fällen findet sog. „spontane Racematspaltung“ statt: Enantiomere kristalliesieren in getrennten Kristallen aus (Konglomerat). Die einzelnen Kristalle sind enantiomorph und können manuell getrennt werden (mühsam !) Historisches Beispiel: L. Pasteur 1848 Trennung des racemischen Salzes Natrium-Ammonium-tartrat (Salz der Weinsäure) b. Allgemeiner ist die Bildung diastereomerer Derivate, deren Trennung und Rückspaltung. Beispiel: DIA O H H OH CH2OH (R) O H HO H CH2OH (S) CH3 H NH2 Ph (S) CH3 CH3 H H N Ph H OH Ph HO CH2OH H CH2OH (S,R) (S,S) 1. Umkrist. oder Chromatographie 2. H2O / H Glycerinaldehyd EN O H H OH CH2OH Org15_04.cw2 + N + Amin O H HO H CH2OH + Amin 210 Enzymatische Racematspaltung CO2 CH3 CO2 CH3 PLE H2 O CO2 CH 3 CO2 H > 98.5% dieses Enantiomers < 1.5% des Spiegelbildes => Enantiomeren-Überschuß (enantiomer ic excess) ee [%] = CO2 CH 3 R-S R+S . 100 = 97% CO2 CH 3 + Racemat PLE H2 O CO 2CH3 CO2 H + ee jedes der beiden Produkte (die jetzt keine Stereoisomere sondern völlig verschiedene Verbindungen darstellen) ist > 98% (also mehr als 99% des jeweiligen Enantiomers)

![6.3.1 1-Oxa-spiro[2.5]octan - Institut für Organische Chemie](http://s1.studylibde.com/store/data/001356875_1-96e669e5c88ad586db9f9f199d424d05-300x300.png)