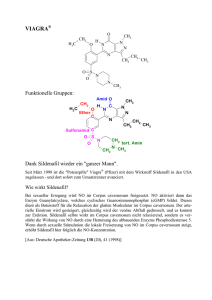
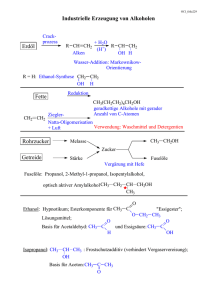
L-Asparaginsäure-beta-allylester - carsten
Werbung
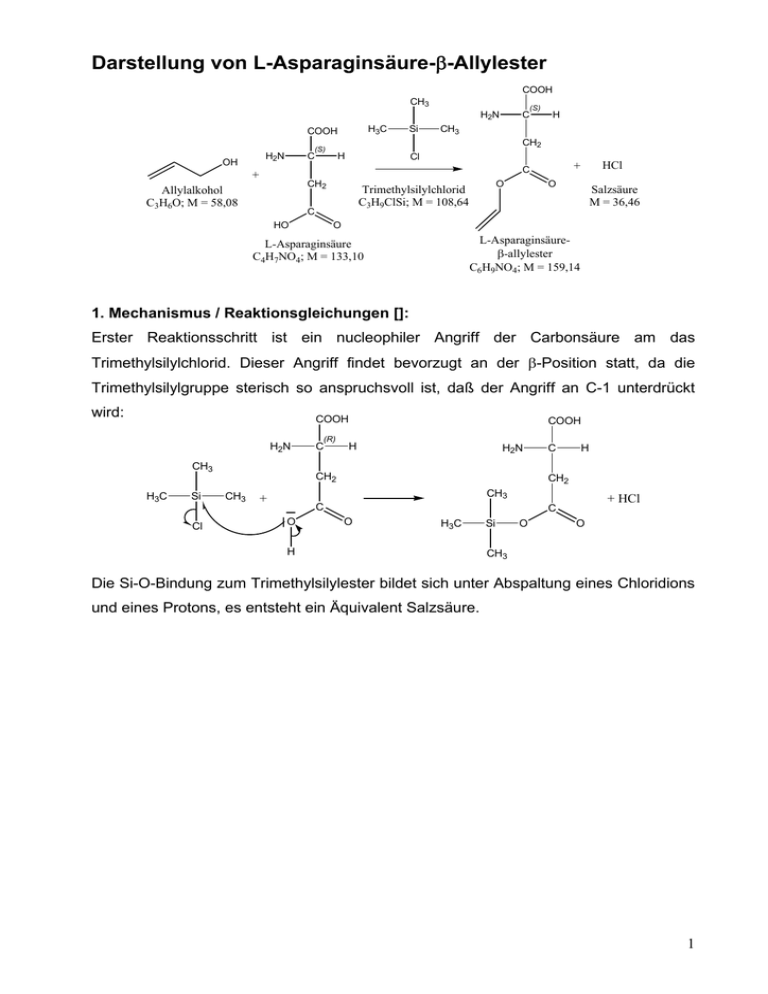
Darstellung von L-Asparaginsäure-β-Allylester COOH CH3 (S) H2N H3C COOH OH H CH3 CH2 (S) H2N Si C C H Cl CH2 Allylalkohol C3H6O; M = 58,08 C HO O Trimethylsilylchlorid C3H9ClSi; M = 108,64 HCl + C + O Salzsäure M = 36,46 O L-Asparaginsäureβ-allylester C6H9NO4; M = 159,14 L-Asparaginsäure C4H7NO4; M = 133,10 1. Mechanismus / Reaktionsgleichungen []: Erster Reaktionsschritt ist ein nucleophiler Angriff der Carbonsäure am das Trimethylsilylchlorid. Dieser Angriff findet bevorzugt an der β-Position statt, da die Trimethylsilylgruppe sterisch so anspruchsvoll ist, daß der Angriff an C-1 unterdrückt wird: COOH H2N CH3 H3C Si Cl (R) C COOH H H2N CH2 CH3 C H CH2 CH3 + C O + HCl C O H3C H Si O O CH3 Die Si-O-Bindung zum Trimethylsilylester bildet sich unter Abspaltung eines Chloridions und eines Protons, es entsteht ein Äquivalent Salzsäure. 1 Im nächsten Schritt greift der Allylalkohol nucleophil den gebildeten Silylester an, es wird ein Silylalkoholat-Anion und das Proton der OH-Gruppe des Allylalkohols abgespalten und so die Ladungen ausgeglichen: COOH H2N H C COOH H H2N CH2 O CH2 H + C O H3C C O O Si H O + H3C Si CH3 C CH3 O CH3 CH3 COOH OH H2N C H + CH2 O H3C Si CH3 CH3 C O Wie aus den Abbildungen ersichtlich, wird das chirale Zentrum bei dieser Reaktion normalerweise nicht nicht angegriffen, erst bei zu langer Reaktionszeit wird auch die andere Säuregruppe verestert und es wird der Diester gebildet. 2. Durchführung: 2.1 Trocknung und Reinigung der Edukte: In einem 1 L-Stickstoffkolben wurden 600 ml Allylalkohol über ca. 10 g Calciumhydrid 24 Stunden vorgetrocknet, anschließend 6 Stunden unter Rückfluß zum Sieden erhitzt und danach abdestilliert. Der absolutierte Allylalkohol wurde im Kühlschrank aufbewahrt. Die L-Asparaginsäure und Trimethylsilylchlorrid wurden ohne weitere Reinigung verwendet. [3] 2.2 Darstellung des β- Allylesters: In einem Rundkolben wurden 4,0 g (30 mmol) L-Asparaginsäure in ca. 150 ml Allylalkohol gelöst. Danach wurden langsam 9,7 ml (8,2 g; 140 mmol) Trimethylsilylchlorid hinzugetropft und die Reaktionsmischung über Nacht bei Raumtemperatur gerührt. Danach wurden 500 ml eiskalter Dietylether langsam zur Reaktionslösung gegossen, wobei ein weißer, kristalliner Niederschlag ausfiel. Zur Vervollständigung der 2 Kristallisation wurde das Gemisch mehrere Stunden im Gefrierschrank aufbewahrt. Die Kristalle wurden anschließend abgesaugt, mit eiskaltem Diethylether gewaschen und im Ölpumpenvakuum getrocknet. [1] 3. Ausbeute: Es wurden 4,3 g ( mmol) L-Asparaginsäure-β-Allylester-HCl erhalten, dies entspricht einer Ausbeute von 73%, die Literaturausbeute beträgt 93%. [1] 4. Charakterisierung [1;4]: Weißer, feinkristalliner Feststoff mit einem Schmelzpunkt von 183 °C (Lit. 183-185 °C) und einem spez. Drehwert von [α]D20 = +19,8° (c=10,3 mg in 1 ml Methanol, Lit: +19,0°). 1 H-NMR (400 MHz, D2O): δ/ppm = 5,91-6,01 (m, 1 H, H-6), 5,27-5,38 (m, 2 H, H-7), 4,67-4,69 (m, 2 H, H-5), 4,33-4,36 (dd, 3JH-2,H-3=6,0 Hz,1 H, H-2), 3,13-3,16 (dd, 3JH-2,H-3=5,4 Hz, 2 H, H-3). 13 C-NMR (400 MHz, D2O): δ/ppm = 171,573 (C-1), 171,569 (C-4), 131,78 (C-6), 119,30 (C-7), 67,07 (C-5), 49,86 (C-2), 34,45 (C-3). 1 COOH H2N 2 (S) C CH2 6 7 O H 3 C 4 O 5 3 5. Gefahrenpotentiale / Entsorgung [6;7]: Substanz Gef.Symb. F+, Xn Diethylether L-Asparaginsäure - Trimethylsilylchlorid F, C Allylalkohol T, N Calciumhydrid F MAKWert 308 mg/m³. R-Sätze S-Sätze 12-19-2266-67 - - 9-16-29- Behälter für 33 halogenfreie organische Lösungsmittel in Wasser lösen, Behälter für halogenfreie organische LM In Diethylether 7/9-16vorsichtig mit Wasser 2636/37/39 umsetzen, Behälter für halogenhaltige -45 organ. LM 36/37/39 Behälter für halogenfreie -38-45organische LM 61 11-14-3537 4,8 mg/m³ 1023/24/2536/37/3850 15 7/824/2543.6 Entsorgung zuerst vorsichtig mit Isopropanol, dann mit Ethanol, zuletzt mit Wasser umsetzen, in Behälter für halogenfreie LM 6.Literatur [1] Belshaw; Synthetic Communications; 1990; 20(20); S. 3157ff. [2] Beyer, Walter; Lehrbuch der Organischen Chemie.; S. Hirzel-Verlag, Stuttgart; 22. Auflage 1991; S. 831. [3] Autorenkollektiv; Organikum; Barth Verlagsges.; 19. Auflage 1993; S. 505. [4] Vollhardt; Organische Chemie;VCH, Weinheim; 1. Aufl. 1990; S.1262ff. [5] Hesse, Meier, Zeeh; Spektroskopische Methoden in der Organischen Chemie; Thieme-Verlag; Stuttgart; 5. überarb. Aufl. 1995; S. 206. [6] Merck ChemDAT Datenbank Chemische Stoffe, Sicherheitsdaten, Stand Jan. 2003. [7] Sigma-Aldrich Chemical Safety Data, www.sigmaaldrich.com. Anlage: - NMR-Spektren 4


![6.3.1 1-Oxa-spiro[2.5]octan - Institut für Organische Chemie](http://s1.studylibde.com/store/data/001356875_1-96e669e5c88ad586db9f9f199d424d05-300x300.png)