Auf Proteinjagd in der T-Zelle - Wiley-VCH
Werbung

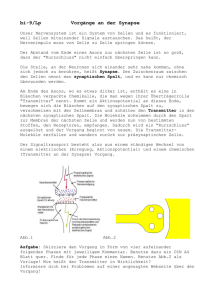
Einzelmolekül-Mikroskopie Auf Proteinjagd in der T-Zelle M ARIO B RAMESHUBER | M ANUEL M ÖRTELMAIER Physik muss sich nicht nur mit toter Materie beschäftigen. Die Biophysik eröffnet zum Beispiel seit kurzem neue Einblicke in Lebensvorgänge auf der Nanometerskala. as menschliche Immunsystem besitzt die Fähigkeit, eine Vielzahl potenzieller Krankheitserreger zu detektieren und zielgerichtet zu zerstören. Die Stärke dieser Immunantwort richtet sich dabei in intelligenter Weise nach der Gefährlichkeit des jeweiligen Eindringlings. Wie die verschiedenen Zellen des Immunsystems diese erstaunliche Erkennungs- und Neutralisierungsleistung im Detail vollbringen, kann man nur verstehen, wenn man ihre biomolekulare Maschinerie genau erforscht. Genau dies machen jetzt die Methoden der ultrasensitiven Einzelmolekül-Mikroskopie möglich: Mit ihr können Forscher biologische Strukturen – und das ist das Novum – in lebenden, aktiven Zellen mit einer Auflösung von weniger als fünfzig Nanometern lokalisieren und verfolgen. Das ermöglicht somit auch neue Einsichten in die Funktionsweise einer besonderen Gruppe von Zellen bei Menschen und Tieren. Es sind die T-Zellen, die bei der Auslösung immunologischer Reaktionen eine Schlüsselrolle spielen. An diesen Zellen forscht unsere Arbeitsgruppe am Institut für Biophysik der Universität Linz. D ABB. 1 | I M M U N O LO G I S C H E S Y N A P S E „Immunologische Synapse“ T Zelle Lebende Nanorechner T Zelle Antigen präsentierende Zelle Antigen präsentierende Zelle Zellmaterial aus der Umgebung Eine T-Zelle begegnet einer Antigen präsentierenden Zelle (APC). Die APC trägt auf ihrer Oberfläche Zellmaterial von körpereigenem Gewebe und gelegentlich solches von Krankheitserregern. Auf dieses reagiert die T-Zelle mit der Formierung eines Saugnapf artigen Kontaktes, der Immunologischen Synapse. 184 | Phys. Unserer Zeit | 35. Jahrgang 2004 Nr. 4 | T-Zellen schützen unseren Körper T-Zellen – ihr Name leitet sich von „Thymusdrüse“, dem Ort ihrer Reifung im Körper ab – sind so etwas wie die Manager des Immunsystems. Diese kleinen, runden Zellen haben einen Durchmesser von etwa fünf Mikrometern, also etwa ein Zehntel des Durchmessers eines menschlichen Haares. Sie durchwandern den Organismus und kommen dabei – zum Beispiel in der Haut – mit so genannten Antigen präsentierenden Zellen (englisch abgekürzt APC) in Kontakt. Die T-Zellen finden an der Oberfläche dieser APCs Fragmente von Zellmaterial, das diese aus der Umgebung aufgesammelt haben und nun dem Immunsystem präsentieren. Die APCs tun dies allerdings wahllos, sind also in einem gewissen Sinne „blind“, und zeigen folglich auf ihrer Oberfläche sowohl gefährliches als auch ungefährliches Material. Hier bringt nun die T-Zelle eine entscheidende Eigenschaft ins Spiel. Dazu schmiegt sie sich eng an die APC und formt eine flache, an einen Saugnapf erinnernde Grenzfläche, die so genannte Immunologische Synapse (Abbildung 1). In dieser Position verharrt die T-Zelle für wenige Minuten bis hin zu einigen Stunden. Über molekulare Mechanismen, die wir erst ansatzweise verstehen, kann sie nun das Ausmaß der Bedrohung durch das präsentierte Material „abschätzen“. Falls die Bedrohung ausreichend hoch ist, beginnt die T-Zelle unverzüglich damit, andere Zellen des Immunsystems über chemische Botenstoffe zu alarmieren, etwa Antikörper produzierende B-Zellen oder Fresszellen. Um die Schlagkraft dieses Signals zu vergrößern, teilt sich die T-Zelle in tausende Kopien ihrer selbst; diese neuen Zellen wachsen dabei auch noch auf das vielfache Volumen der ursprünglichen T-Zelle an. DOI:10.1002/piuz.200401045 T-Zellen kann man sich also gewissermaßen als CPUs des Immunsystems vorstellen. Sie bekämpfen eingedrungene Krankheitserreger nicht direkt, sondern steuern und koordinieren vielmehr andere Zelltypen des Immunsystems. Die verteilte Rechenleistung des so entstehenden Regelsystems ist nicht zu unterschätzen: Einerseits muss das Immunsystem gefährliche Krankheitserreger früh und zuverlässig identifizieren, andererseits muss es aber unbedingt tolerant gegenüber jedem Einzelnen der über 100 000 körpereigenen Proteinen bleiben. Sonst drohen Autoimmunerkrankungen wie Diabetes oder Multiple Sklerose, bei denen das Immunsystem Körpergewebe angreift und abbaut. © 2004 Wiley-VCH Verlag GmbH & Co. KGaA, Weinheim E I N Z E L M O L E K Ü L- M I K R O S K O P I E ABB. 2 Schließlich muss das Immunsystem auch noch angemessen Nachsicht gegenüber den zahlreichen unschädlichen Bakterien, Amöben und Pilzen üben, die wir auf der Haut, an den Schleimhäuten und im Darm mit uns tragen. Diese „Hausgenossen“, beim gesunden Menschen sind es etwa 1014 Stück, sind nämlich nicht zuletzt deswegen für uns von Nutzen, weil ihre Anwesenheit keinen Platz mehr frei lässt für andere, mutmaßlich gefährlichere Einzeller – unser Körper ist sozusagen ständig „voll belegt“. T-Zellen leisten den Hauptteil dieser Klassifizierungsarbeit zwischen Gut und Böse. Doch wie schaffen sie es nun genau, zwischen Freund und Feind zu unterscheiden? Das Geheimnis liegt im koordinierten Zusammenspiel hunderter Proteine im Inneren der Immunologischen Synapse. Diese Proteine sind regelrechte biologische Nanomaschinen: Unter ihnen finden sich zum Beispiel molekulare Äquivalente zu chemischen Sensoren (Rezeptorproteine), Motoren (Motorproteine) und schaltbaren Widerständen (Ionenkanäle). Einblick in die Mikrowelt Verständlicherweise träumen Biologen davon, diese Bausteine bei ihrer Arbeit im lebenden System direkt beobachten zu können. Hier tun sich aber enorme technische Hindernisse auf, weil Proteine nur wenige Nanometer klein sind – ihre Abmessungen liegen also etwa drei Größenordnungen unter der von Zellen. Typische Lichtmikroskope haben dagegen nur ein Auflösungsvermögen, das in etwa der halben Wellenlänge des sichtbaren Lichts entspricht. Das sind nur rund 300 Nanometer und damit viel zu wenig, um einzelne Proteine in der Zelle sichtbar zu machen (Abbildung 2 links oben). Alternative Methoden wie die Elektronen-, Röntgenoder Rastersonden-Mikroskopie können zwar in den Nanometerbereich vordringen, schaffen dies jedoch zumeist nur an speziell vorbehandeltem – und damit totem – Zellmaterial. Bei lebenden Zellen mussten sich Wissenschafter also darauf beschränken, ihre mikroskopischen oder biochemischen Untersuchungen an einer sehr großen Zahl von Proteinen gleichzeitig durchzuführen. Das erhöht zwar die Stärke des messbaren Signals; doch das individuelle Verhalten des einzelnen Proteins geht dabei in der Menge unter (siehe auch „Der Lohn der Mühe“, S. 189). Nun verfügen jedoch seit kurzem eine Hand voll Laboratorien weltweit über eine Technik, einzelne Proteine in lebenden Zellen zu verfolgen: Mit der Methode der optischen Einzelmolekül-Mikroskopie gelingt dies sogar mit einem vergleichsweise moderaten technischen Aufwand [1]. Die Entwickler dieser neuen Technik mussten es allerdings zuerst einmal schaffen, die Proteine überhaupt optisch sichtbar zu machen, denn wegen ihrer geringen Größe treten diese mit Licht nicht sonderlich in Wechselwirkung. Selbst eine komplette Zelle erscheint ja im Lichtmikroskop als praktisch transparentes Stück Gallert, und erst viele Zellschichten übereinander bilden ein undurchsichtiges Gewebe. © 2004 Wiley-VCH Verlag GmbH & Co. KGaA, Weinheim | | B I O PH YS I K PROT E I N E S I C H T BA R G E M AC H T Links Oben: Eine T-Zelle in einer konventionellen lichtmikroskopischen Aufnahme. Sie hat einen Durchmesser von etwa 5 µm, das entspricht etwa einem Zehntel des Durchmessers eines menschlichen Haares. Farbige Bilder: Markiert man bestimmte Moleküle in der Zelle mit Leuchtfarbstoff, so erzeugt eine Bestrahlung mit Laserlicht leuchtende Fluoreszenzmuster. Sie zeigen die Verteilung des markierten Stoffes an. Hier wurden verschiedene Proteine in der Immunologischen Synapse von T-Zellen mit rotem und grünem Farbstoff markiert. Die Synapsen sind dabei jeweils aus der Sicht der APC gesehen, also nach Abbildung 1 „von unten“. Hier bot die Fluoreszenzmikroskopie einen Ausweg. Bei ihr markiert man das jeweils interessante biologische Molekül gezielt mit einem Leuchtfarbstoff (Fluorophor), wie er zum Beispiel in Textmarkern Verwendung findet. Diese Leuchtstoffe besitzen die Eigenschaft, bei Bestrahlung mit Licht einer bestimmten Farbe selbst Licht einer anderen Farbe auszustrahlen. Die Wellenlänge der emittierten Photonen ist dabei immer größer als die der absorbierten Photonen, da ein Teil der Energie im Umwandlungsprozess verloren geht. Bestrahlt man nun im Dunkeln eine derart markierte Zelle mit intensivem Anregungslicht, so zeigen sich leuchtende Flecken einer charakteristischen Farbe, welche die Anwesenheit und die Position des jeweiligen Proteins verraten (Abbildung 2). Das Immunsystem hilft den Forschern Um auf diese Weise Proteine und andere Zellbausteine selektiv zu markieren, nutzt die Wissenschaft wiederum die hohe Leistungsfähigkeit des Immunsystems: Werden nämlich geringe Mengen einer chemisch aufgereinigten Zielsubstanz einem Labortier injiziert, zum Beispiel einem Kaninchen, dann erkennt dessen Körper diese Substanz als INTERNET „fremd“ und beginnt, gegengerichtete Antikörper zu erVideo zur Abbildung 6 zeugen. Diese Antiwww.biophysics.jku.at/bioph/proteinjagd.html körper sind spezielle www.phiuz.de („Zusatzmaterial zu den Heften“) Y-förmige Proteine, die als „intelligenter | Nr. 4 35. Jahrgang. 2004 | | Phys. Unserer Zeit | 185 ABB. 3 | E I N Z E L M O L E K Ü L- M I K ROS KO P Rotes Licht aus einem starken Farbstofflaser (Dye Laser) und grünes Licht aus einem starken Argon-Ionen-Laser (Ar+Laser) mit jeweils mehr als 100 mW Leistung wird auf die Probe in einem Mikroskop mit großer Numerischer Apertur gelenkt. Die mit Leuchtstoffen markierte Probe strahlt daraufhin Fluoreszenzlicht aus. Dieses weist eine hoch empfindliche CCD-Kamera nach. Klebstoff“ nur an dem eingedrungenen Protein haften bleiben – an keinem anderen. Entnimmt man nun diese Antikörper einer Blutprobe des Tieres und färbt sie im Reagenzglas mit dem passenden Leuchtfarbstoff, so erhält man den gewünschten selektiven Marker, der im Experiment selbstständig an die jeweils gesuchten Strukturen der Zelle binden wird. Übrigens haben gentechnische Methoden es mittlerweile ermöglicht, eine Antikörper-produzierende Zelle des Immunsystems beliebig zu vervielfältigen. Damit kann auf den Einsatz von Labortieren zu diesem Zweck weitgehend verzichtet werden. Nun sollte es im Prinzip möglich sein, durch sparsames Markieren der Zelle nur einige wenige Proteine anzufärben: Diese würden sich dann in der mikroskopischen Aufnahme als leuchtende Pünktchen verraten. In der Tat verfolgt die optische Einzelmolekül-Mikroskopie diesen im Prinzip simplen Ansatz. Dazu muss sie aber die enorme Schwierigkeit überwinden, die extrem schwachen Signale einzelner Leuchtstoffmoleküle vor dem optischen Hintergrundrauschen der Zelle nachzuweisen. Die Hardware muss optimiert werden Um in den Extrembereich des Einzelmolekül-Nachweises zu gelangen, mussten die Entwickler die konventionelle Fluoreszenzmikroskopie ans technische Limit treiben. Dabei bot sich ihnen an, drei Komponenten der Messapparatur zu optimieren: 1. die Lichtquelle zur Beleuchtung der Probe, 2. das Mikroskop, welches das Licht der Beleuchtung auf die Zelle fokussiert und das von ihr emittierte Fluoreszenzlicht einfängt und 3. die Kamera, die das Bild der Probe generiert. 186 | Phys. Unserer Zeit | 35. Jahrgang 2004 Nr. 4 | Wollten wir also ein Fluoreszenzmikroskop zu einem Einzelmolekül-Mikroskop umbauen, wie es Abbildung 3 zeigt, so müssen wir als Erstes die konventionelle Lichtquelle durch einen leistungsstarken Laser ersetzen. Dieser sollte auf der Probe eine Lichtintensität von einigen Kilowatt pro Quadratzentimeter bereitstellen können – und das über eine Fläche von etwa zwanzig Mikrometern im Durchmesser. So groß sind nämlich die meisten interessanten Zellen. Hier hilft, dass die Zellen praktisch transparent sind: So können sie diese intensive Bestrahlung, die etwa dem Hunderttausendfachen der Sonnenhelligkeit entspricht, gut überstehen. Um trotz der Verluste durch Spiegel und Filter eine solche Intensität zu erreichen, ist eine Laserleistung von einigen hundert Milliwatt nötig. Leider macht das heute noch den Griff zu einem kostspieligen und stromfressenden Argon- oder Krypton-Ionen-Laser nötig. Die dramatischen Fortschritte der Halbleiterlaser-Technologie werden jedoch vielleicht schon bald zu einer billigeren und einfacher handhabbaren Alternative führen. Als Nächstes wenden wir uns dem Mikroskop zu. Obwohl es das Herzstück der Apparatur darstellt, bleibt hier gegenüber dem Seriengerät wenig zu verändern, denn die jahrhundertelange Verfeinerung hat diese Geräte schon bis an die physikalische Grenze optimiert. Wir begnügen uns damit, ein Objektiv mit höchstmöglicher Numerischer Apertur zu wählen: Mit seinem großen Öffnungswinkel kann es so ein Maximum des kostbaren Fluoreszenzlichts aus der Probe einsammeln. Kameratechnik aus der Astronomie Das Schlüsselelement unserer Modifikationen ist die Kamera. Bei ihr profitiert die Einzelmolekülforschung von leistungsfähigen CCD-Chips, die ursprünglich für die Astronomie entwickelt wurden. Diese Chips werden mit flüssigem Stickstoff auf –196 °C gekühlt und erreichen einen Wirkungsgrad von bis zu 90 %. Sie können also 90 von 100 einzelnen Photonen nachweisen, und wegen der niedrigen Temperatur produzieren sie dabei ein geringes Hintergrundrauschen von nur drei Photonen pro Pixel. Als Lohn für diese Verbesserungen winkt nun ein Signal wie in Abbildung 4. Das Signal der einzelnen Fluorophore ist hier deutlich vor dem Hintergrund auszumachen, obwohl wir pro Molekül in Summe nur etwa hundert Photonen empfangen konnten – und das bei etwa 1014 eingestrahlten Photonen! Die Stärke dieses Signals ließe sich im Prinzip durch eine Verlängerung der Belichtungs- und Aufnahmezeit steigern. In der Praxis versucht man jedoch, die Bestrahlungszeiten möglichst gering zu halten, also im Millisekunden-Bereich oder darunter: Leuchtfarbstoffe neigen nämlich zum Ausbleichen, weil photophysikalische Prozesse sie zerstören. Bei der Einzelmolekül-Mikroskopie stellt das starke Laserlicht eine extreme Belastung dar, weshalb dieser Bleichprozess bereits in Sekundenbruchteilen abläuft. Beschränkt man sich nun pro Aufnahme auf eine geringe Zahl von Pho© 2004 Wiley-VCH Verlag GmbH & Co. KGaA, Weinheim E I N Z E L M O L E K Ü L- M I K R O S K O P I E ABB. 4 tonen, die man dem Fluorophor „abverlangt“, so erhält man die Chance, mehrere Aufnahmen desselben Moleküls hintereinander machen zu können, bevor es ausbleicht: Damit wird es möglich, die Bewegung individueller Moleküle zu verfolgen. Der Pionier dieser Technik, Hans Georg Schindler, verlieh ihr also zu Recht den Namen Single Dye Tracing, SDT (Einzel-Farbstoff-Verfolgung). Schindler war übrigens der Leiter unseres Institutes in Linz und ist 2001 tödlich verunglückt. Die Zeitauflösung, die das Verfahren rein technisch erreichen kann, ist mit über 1000 Bildern pro Sekunde bedeutend höher als etwa die herkömmlicher Videoaufnahmen. Allerdings begrenzt der Zerfall des Fluorophors eine „Filmaufnahme“ auch bei optimaler Parameterwahl auf insgesamt nur etwa 50 Bilder. | | B I O PH YS I K EINZELMOLEKÜLBILD Auflösung im Nanometerbereich Abbildung 4 zeigt, dass ein so aufgenommenes Fluoreszenzsignal eines markierten Proteins ziemlich verrauscht und unscharf wirkt. Trotzdem birgt es doch erstaunlich detaillierte Informationen über den Aufenthaltsort des strahlenden Fluorophors. In der Tat können wir daraus die ursprüngliche Position des Zielmoleküls mit einer Genauigkeit von wenigen Nanometern rekonstruieren. Das ist bedeutend kleiner als die Wellenlänge des ausgestrahlten Lichts – und auch kleiner als das Auflösungsvermögen des verwendeten Mikroskops. Wie funktioniert das? Die optische Theorie besagt, dass das Signal einer punktförmigen Lichtquelle beim Durchgang durch ein optisches Gerät zu einer so genannten Point Spread Function (Impulsantwort) verbreitert wird. Deren Breite und Form hängt vom genauen Aufbau des Gerätes ab, in unserem Fall ist sie näherungsweise durch eine Airy-Funktion mit einer Halbwertsbreite von etwa λ/2 beschreibbar. Ein einzelnes Farbstoffmolekül, das wegen seiner im Vergleich zur Wellenlänge des Lichts viel geringeren Größe als Punktlichtquelle betrachtet werden kann, erscheint in mikroskopischen Aufnahmen daher als „Signalberg“ einer Breite von etwa 250 nm. Entscheidend ist nun, dass wir die Point Spread Function unseres Gerätes genau kennen. Damit können wir nun rückrechnen, welche Position der Fluorophor einnahm, um das gemessene Signal zu erzeugen. Die dabei erzielte Genauigkeit hängt nun im Prinzip nur noch vom Signal-RauschVerhältnis im Bild ab. Die Breite des Signals, also das Auflösungsvermögen des verwendeten Gerätes, spielt keine Rolle mehr (siehe auch „Nanometerauflösung mit Licht?“ auf dieser Seite). Die Technik des SDT versetzt uns somit in der Praxis in die Lage, die Position von Proteinen in der lebenden Zelle innerhalb von wenigen Millisekunden mit einer Genauigkeit von etwa 30 bis 50 nm zu bestimmen, und dies etwa zehnbis fünfzigmal hintereinander. Wir haben uns mit Methoden der optischen Mikroskopie also Zugriff auf die Längen- und Zeitskala verschafft, auf der sich die meisten biologischen © 2004 Wiley-VCH Verlag GmbH & Co. KGaA, Weinheim Falschfarbendarstellung eines typischen Einzelmolekülbildes (links). Obwohl die Signale der einzelnen Moleküle sehr schwach sind, lässt sich aus den Rohdaten (rechts oben) die ursprüngliche Position der Signalquelle recht genau bestimmen (rechts unten). N A N O M E T E R AU F L Ö S U N G M I T L I C H T ? Es mutet zunächst wie ein Widerspruch an, dass mit lichtmikroskopischen Techniken die Position eines Proteins mit einer Genauigkeit von wenigen Nanometern bestimmt werden kann. Zum Verständnis dieses Phänomens muss man genau zwischen dem Auflösungsvermögen des Gerätes und der Positionsgenauigkeit der errechneten Position der Signalquelle unterscheiden. Letztere hängt interessanterweise nicht von der charakteristischen Unschärfe des Mikroskops ab, sondern in der erster Linie von der Stärke des erhaltenen Signals. Eine hilfreiche Analogie bietet die Vorstellung, dass jedes Photon eine Information über den Ort der Signalquelle beinhaltet. Diese Positionsinformation wird aber durch das endliche Auflösungsvermögen des Mikroskops um einen zufälligen Wert gestört. Der Einfluss dieser zufälligen Schwankungen mittelt sich aber bei mehrfachen Messungen zunehmend aus. Zieht man, wie wir es tun, etwa 100 bis 1000 Photonen zur Positionsbestimmung heran, so sinkt dadurch die Ungenauigkeit auf etwa 40 nm. Jüngst durchgeführte Messungen einer amerikanischen Gruppe mit 100 000 Photonen | konnten diesen Wert sogar auf 1 bis 2 nm senken. Wie aber können wir uns sicher sein, dass wir die Positionen der Moleküle so präzise rückrechnen können, wie wir das behaupten? Eine Möglichkeit liefert der Test der Apparatur mit einem Molekül, das in einer genau bekannten Position fixiert ist und dessen Position wiederholt bestimmt wird: Die Schwankung der dabei erhaltenen Ergebnisse entspricht dann dem Messfehler unseres Verfahrens, und ist tatsächlich so gering wie theoretisch vorhergesagt. Die Genauigkeit in der Positionsbestimmung eines Moleküls (rechts) liegt weit unter dem Auflösungsvermögen des Lichtmikroskops (links). Nr. 4 35. Jahrgang. 2004 | | Phys. Unserer Zeit | 187 Prozesse abspielen. Wir können sogar für kurze Zeit einzelne Proteine auf ihrem Weg verfolgen. Nun hindert uns nichts mehr daran, mit dieser Technik verschiedene Fragen aus der Mikrobiologie anzugehen. Wie eingangs beschrieben, konzentriert sich unsere Arbeitsgruppe rund um Gerhard Schütz an der Universität Linz dabei auf die Untersuchung der so faszinierenden und wichtigen T-Zellen. Trotz der schlagkräftigen neuen Methode dürfen wir allerdings nicht hoffen, die komplexen Funktionsprinzipien der T-Zelle umfassend zu entschlüsseln – dieses Ziel würde die Leistungsfähigkeit eines einzelnen Institutes bei Weitem übersteigen. Vielmehr müssen wir uns auf ein Detail konzentrieren, bei dem die Anwendung einzelmolekularer Mikroskopie besonders viel versprechend ABB. 5 | B E W EG L I C H E U N D U N B E W EG L I C H E M O L E K Ü L E Einzelne, rot und grün markierte Exemplare von zwei Proteinsorten in der Immunologischen Synapse. Beide Sorten können sich in der Synapse unterschiedlich gut bewegen, wie das Video zeigt (siehe „Internet“). Die rot markierte Spezies ist größtenteils unbeweglich, vor allem die grün markierte bewegt sich. Die dünnen Pfeile erleichtern es hier, die Bewegung einiger Proteinmoleküle über die Bildsequenzen hinweg zu verfolgen. In beiden Gruppen gibt es allerdings auch einzelne „Ausreißer“, die das Verhalten der jeweils anderen Gruppe zeigen (dicke Pfeile). 188 | Phys. Unserer Zeit | 35. Jahrgang 2004 Nr. 4 | erscheint: Das sind Prozesse, die sich in den ersten Stufen des Kontaktes zwischen einer T-Zelle und einer AntigenPräsentierenden Zelle (APC) abspielen. Dabei treffen wir auf eine zentrale Fragestellung aus der molekularen Immunologie. Sie lautet: Welche Rolle spielen die so genannten Lipid Rafts beim Verhalten der Moleküle in der Synapse? Mysteriöse Plattformen in der Zelle Lipid Rafts sind winzige Inhomogenitäten in der Zellmembran, der „Haut“ der Zelle. Sie unterscheiden sich in ihrer Zusammensetzung von der Umgebung in der Membran, und nach der heutigen Modellvorstellung der Forschung sollten sich in ihnen bestimmte Proteine bevorzugt aufhalten [2]. Obwohl fast alle Biologen annehmen, dass diese kleinen Plattformen für zahlreiche Prozesse – unter anderem auch in der T-Zelle – essenziell wichtig sind, beruht die Annahme ihrer Existenz nur auf indirekten Indizien. Diese immerhin starken Hinweise liefern biochemische Analysen der Proteine in der Zellmembran. Bislang gelang es noch nicht, Lipid Rafts mit mikroskopischen Methoden direkt abzubilden, um ihr Vorhandensein endgültig zu beweisen. Falls sie tatsächlich existieren, muss ihre Größe also deutlich unterhalb des optischen Auflösungslimits von etwa 200 nm liegen. Solche Objekte, die sich einer direkten Beobachtung hartnäckig entziehen, geben natürlich immer Anlass zu heftigen Diskussionen, und in letzter Zeit häufen sich wieder vermehrt Stimmen, Lipid Rafts seien in Wirklichkeit nur Messartefakte durch Störungen der Zellmembran während der biochemischen Analyse. Wir hoffen nun, mit unseren ultrasensitiven Methoden Licht auf dieses interessante Phänomen werfen zu können. Denn zum einen haben wir die technische Möglichkeit, zu der vorhergesagten Längenskala von Lipid Rafts vorzudringen, zum anderen können wir damit erstmals Messungen an lebenden, weitgehend ungestörten Zellen durchführen. Wir markieren dabei diejenigen Proteine der T-Zelle, denen eine Interaktion mit den Lipid Rafts zugeschrieben wird, mit Leuchtstoffmolekülen. Dann verfolgen wir ihr Verhalten während der Ausbildung einer Immunologischen Synapse. Da diese Proteine sich in den Lipid Rafts aufhalten sollten – falls jene existieren – verrät ihr Aufenthaltsort die Position des gesuchten Rafts. Auf diese Weise sollte es so möglich werden, etwas über die Dynamik dieser Strukturen zu lernen. Unsere ersten Untersuchungen an T-Zellen führten wir mit zwei markierten Typen von Proteinmolekülen durch, die sich nach der bisherigen Modellvorstellung in der Synapse an Lipid Rafts binden. Da diese Proteinsorten in biochemischen Tests zur Raft-Bindung recht ähnlich abgeschnitten hatten, erwarteten wir eigentlich, dass der Blick durch unser Mikroskop diese Ähnlichkeit weiter bestätigen würde. Zu unserer Überraschung beobachteten wir jedoch in der Synapse ein sehr unterschiedliches Verhalten (Abbildung 5 und „Internet“ Seite 185): Das eine Protein war außerhalb der Synapse noch weitgehend mobil, fixiert sich © 2004 Wiley-VCH Verlag GmbH & Co. KGaA, Weinheim E I N Z E L M O L E K Ü L- M I K R O S K O P I E nun aber in der Membran, das andere behält dagegen seine Beweglichkeit bei. Falls das bisherige Modell richtig ist und beide Moleküle in Lipid Rafts gebunden sind, würde dies implizieren, dass es mindestens zwei Subtypen von Rafts gibt, die sich wenigstens in ihrer Beweglichkeit unterscheiden. Das könnte ein Hinweis darauf sein, dass die verschiedenen Subtypen unterschiedlich stark mit dem Cytoskelett wechselwirken, dem relativ starren Stützgerüst der Zelle. Da vor allem Proteine solche Wechselwirkungen erzeugen, legt das – beim momentanen Stand unserer Untersuchungen – auch den weitergehenden Schluss nahe, dass die einzelnen Rafts sich auch in ihrer Proteinfracht unterscheiden. Allerdings lassen sich unsere Messergebnisse derzeit auch anders interpretieren. Danach wären die Rafts so winzig, dass sie wie ein Schwimmreifen eng an ein einzelnes Protein gebunden sind. In diesem Fall wären sie weitgehend dem Verhalten des jeweiligen „Trägerproteins“ ausgeliefert. Wir arbeiten daher an unserem Institut derzeit an einer Methode, die Rafts direkt auf der Zelle mit Leuchtfarbstoff zu markieren. Gelingt dies, so beweist das Erstens die Existenz der Lipid Rafts direkt und liefert Zweitens eine genauere Information über deren Größe. Quantenpunkt statt Farbstoff Wie sich die Einzelmolekül-Mikroskopie in den nächsten Jahren weiterentwickeln wird, lässt sich heute schwer vorhersagen: Sie ist ja noch ein junges Forschungsfeld, und die ersten erfolgreichen Messungen an lebenden Zellen liegen erst wenige Jahre zurück [3]. Die große Resonanz, auf die dieses Gebiet in der wissenschaftlichen Community stößt, gibt aber Grund zu großen Hoffnungen: Das Wissenschaftsmagazin Science ordnete die Single Molecule Sciences immerhin unter die zehn „heißesten“ Forschungsgebiete des Jahres 2003 ein [4]. Bei dem hier vorgestellten Verfahren der EinzelmolekülMikroskopie müssen allerdings noch zwei grundlegende Probleme überwunden werden, bevor es breit eingesetzt werden kann: das schnelle Ausbleichen der Fluorophore und die komplizierte Handhabung der technischen Geräte. Das Problem der Instabilität der Leuchtfarbstoffe kann man im Prinzip umgehen, indem man sie durch Quantenpunkte aus Halbleitermaterial ersetzt – deshalb wird dieser Ansatz zurzeit intensiv verfolgt. Diese winzigen „künstlichen Atome“ können für unbegrenzt lange Zeit Licht ausstrahlen (Physik in unserer Zeit 2002, 33(5), 206) und bieten daher das Potenzial, Proteine über einen viel längeren Zeitraum verfolgen zu können. Da die viel versprechenden Q-Dots nun dem Laborstadium entwachsen und seit kurzem für die Biowissenschaft erhältlich sind, wird ihr breiter Einsatz in der biologischen Forschung wohl nicht lange auf sich warten lassen. Bei unserer Technik würde dann die winzige Halbleiterstruktur mit der gleichen Methode wie das Farbstoffmolekül an das Proteinmolekül gebunden werden – via Antikörper. © 2004 Wiley-VCH Verlag GmbH & Co. KGaA, Weinheim D E R LO H N D E R M Ü H E | B I O PH YS I K | Welche Vorteile bieten Messungen an einzelnen Molekülen gegenüber EnsembleMessungen, die die Signale von vielen Molekülen gleichzeitig zusammenfassen? Wir wollen hier drei Vorteile anführen, die uns für biologische Messungen besonders relevant erscheinen. 1. Keine Mittelwertbildung Während sich bei einer Ensemble-Messung die intermolekularen Variationen eines bestimmten Messparameters ausmitteln, wird bei einer Einzelmolekül-Messung die gesamte zugrunde liegende Verteilung sichtbar. Dies ist speziell in Situationen wie in der Abbildung rechts skizziert wesentlich, da dort eine Bestimmung alleine des Mittelwertes irreführende Ergebnisse liefern würde. 2. Variation einzelner Parameter wird sichtbar Misst man am selben Molekül mehrere Parameter gleichzeitig, zum Beispiel Beweglichkeit und Größe, so kann die Einzelmolekül-Messung etwaige Beziehungen zwischen Variationen dieser Parameter aufdecken (Abbildung links). 3. Keine Synchronisation nötig Biologische Prozesse sind inhärent dynamisch. So kann sich zum Beispiel eine Molekülspezies A in eine Spezies B umwandeln – und diese nach einiger Zeit wieder in A zurück. Da solche Prozesse in lebenden Systemen jedoch zumeist nicht synchron ablaufen, befinden sich immer viele Moleküle in jedem der beiden Zustände. Um die Dynamik des Umwandlungsprozesses beobachten zu können, muss man also einzelne Moleküle herauspicken und verfolgen. Das entspricht dem Bild eines Wettrennens, bei dem alle Läufer zu unterschiedlichen, zufälligen Zeiten starten: Eine individuelle Verfolgung mit individueller Zeitmessung erlaubt dann trotzdem eine Ermittlung des Siegers. Nr. 4 35. Jahrgang. 2004 | | Phys. Unserer Zeit | 189 Jenseits des Proof of Principle Die derzeit größte Hürde, die der Verbreitung von Einzelmolekül-Techniken in der biomedizinischen Forschung entgegensteht, ist aber ihre komplexe Handhabung im Labor. In der Vergangenheit verfolgten die Forscher zunächst das Hauptziel, Messungen an lebenden Systemen überhaupt erst technisch möglich zu machen. Deshalb ist heute praktisch jedes neu entwickelte Gerät noch ein individueller Prototyp, in dem Hochleistungshardware friedlich mit Klebeband und Pappe koexistiert. Die zuverlässige Bedienung solcher Maschinen stellt derzeit mitunter eine eigene Wissenschaft dar, weshalb sie für eine routinemäßige biologische Forschung noch ungeeignet sind. Schließlich möchten Biologen oder Immunologen ihre Aufmerksamkeit auf die aktuelle Fragestellung konzentrieren, und nicht auf die Handhabung eines Messapparates, welcher letztendlich nur Mittel zum Zweck sein darf. Daher gilt es nun Mikroskope zu entwickeln, die eine weitgehend serienmäßige Hardware enthalten und damit für Biolabore erschwinglich sind. Zudem müssen sie robust und zuverlässig sein, und ihre Bedienung darf kein Spezialwissen erfordern. Solche kommerziellen Geräte stehen tatsächlich schon in der Entwicklung, auch unsere Arbeitsgruppe beteiligt sich daran. Die Autoren Mario Brameshuber studiert seit 1999 an der Universität Linz Biophysik. Für seine Diplomarbeit forscht er zurzeit an Lipid Rafts. Manuel Mörtelmaier studierte Physik an den Universitäten Linz und Salzburg. Seit 2001 arbeitet er in Linz auf dem Gebiet der EinzelmolekülMikroskopie. Für seine Diplomarbeit „Wenn Moleküle raften gehen“ erhielt er 2003 den Linzer Physik-Oscar. Anschrift Manuel Mörtelmaier, Institut für Biophysik, Johannes-Kepler-Universität Linz, Altenbergstr. 69, A-4040 Linz. [email protected] Zusammenfassung Einzelne Moleküle in lebenden Zellen mit Fluoreszenzmikroskopen zu beobachten, ist derzeit noch eine technische Herausforderung. Sie lohnt sich aber: So können erstmals die molekularen Bausteine des Lebens, etwa Proteine, bei ihren Aktivitäten direkt verfolgt werden. Das erlaubt völlig neue Einblicke in die Funktionsmechanismen biologischer Zellen. Ein interessantes Forschungsobjekt sind die T-Zellen, die das Immunsystem steuern. Die Beobachtung einzelner Proteine kann das Rätsel lösen helfen, wie T-Zellen gefährliche von ungefährlichen Erregern unterscheiden können. Damit Einzelmolekül-Mikroskope routinemäßig in Biolabors eingesetzt werden können, müssen sie noch robuster, billiger und einfacher handhabbar werden. Stichworte Einzelmolekül-Mikroskopie, Fluoreszenz, Farbstoff, Single Dye Tracing, SDT, Laser, CCD-Kamera, Quantenpunkt, Immunsystem, T-Zelle, Immunologische Synapse, Protein, Lipid Raft. Danksagung Die Autoren danken Markus Axmann, Nina Kieberger und Gerhard Schütz für ihre Unterstützung. Literatur [1] J. Uppenbrink und D. Clery, Science 1999, 283, 1667; Spezialausgabe zur Einzelmolekül-Mikroskopie. [2] K. Simons, Nature 1997, 387, 569. [3] G. J. Schütz, EMBO J. 2000, 19, 892. [4] www.sciencemag.org/cgi/content/full/302/5653/2039#molecule 190 | Phys. Unserer Zeit | 35. Jahrgang 2004 Nr. 4 | © 2004 Wiley-VCH Verlag GmbH & Co. KGaA, Weinheim