241 Zika-Virus id Schwangerschaft
Werbung

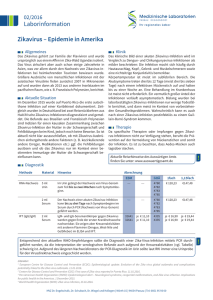
Präsidentin Prof. Dr. med. Birgit Seelbach-Göbel DGGG e.V. • Hausvogteiplatz 12 • 10117 Berlin Herrn Prof. Dr. Klaus Stark Direktorin Geburtshilfe Klinik für Frauenheilkunde und Geburtshilfe Universität Regensburg – St. Hedwig Fachgebiet 35; Abt. Infektionsepidemiologie Robert-Koch-Institut Seestr. 10 13353 Berlin cc/ Frau Prof. A. Geipel, Herrn PD M. Enders, Herrn Prof. I. Mylonas cc/ Frau Prof. Birgit Seelbach-Göbel, Frau Fragale, Frau Nioduschewski cc/ Herr Dr. Mirko Faber Repräsentanz der DGGG und Fachgesellschaften Hausvogteiplatz 12 D – 10117 Berlin Telefon: +49 (0) 30 514883333 Telefax: +49 (0) 30 51488344 [email protected] www.dggg.de DGGG-Stellungnahmensekretariat Frauenklinik Universitätsklinikum Erlangen Universitätsstraße 21-23 91054 Erlangen Telefon: +49 (0) 9131-85-44063 +49 (0) 9131-85-33507 Telefax: +49 (0) 9131-85-33951 E-Mail: [email protected] www.frauenklinik-uk-erlangen.de Erlangen, den 28.11.2016 241. Stellungnahme der Deutschen Gesellschaft für Gynäkologie und Geburtshilfe (DGGG) zum Thema Zika-Virus Infektion während der Schwangerschaft, Auswirkungen auf den Feten und Empfehlungen zur Überwachung und Diagnostik Einleitung Die Datenlage zur Evidenz eines Kausalzusammenhangs zwischen transplazentarer Infektion und angeborenen ZNS Auffälligkeiten hat in den vergangenen Monaten stetig zugenommen [13]. Allerdings ist es weiterhin sehr schwierig, das individuelle Risiko zu benennen. Epidemiologie Seit Oktober 2015 sind in Deutschland über 170 Zikavirus-Infektionen bei Reiserückkehrern, darunter 5 Schwangeren, diagnostiziert worden (RKI, Stand 04.10.2016). Seit Mai 2016 gibt es in Deutschland eine gesetzliche (Labor-) Meldepflicht für den direkten und indirekten Nachweis von Arbovirus-Infektionen (z.B. Zika, Dengue, Chikungunya) nach der InfektionsschutzgesetzMeldepflicht-Anpassungsverordnung (IfSGMeldAnpV). Die Einschätzung des Risikos nach einer Infektion ein Kind mit neurologischen Auffälligkeiten zu gebären ist derzeit überaus schwierig. Anhand der Zikavirus-Epidemie in Französisch Polynesien wurde das Risiko einer Mikrozephalie von Kindern, die von im ersten Trimenon infizierten Müttern geboren wurden, auf ca. 1% (ca. 1:100 pro 10.000 infizierte Schwangere, mit einer normalen Mikrozephalie-Prävalenz von 0,02 %) geschätzt. Hingegen wurden in einer Repräsentanz der DGGG und Fachgesellschaften • Hausvogteiplatz 12 • D – 10117 Berlin Telefon: +49 (0) 30 51488 • 33 40 • Telefax +49 (0) 30 514 88 344 • [email protected] • www.dggg.de \\Nas-Fa0efsfk1.Medads.Uk-Erlangen.De\Fk1-Data$\DGGG-Leitlinien\Neue Archivierung\Stellungsnahmen Und Handlungsempfehlungen\241 Zika-Virus Infektion Während Der Schwangerschaft\241 Zika-Virus I D Schwangerschaft.Docx Kohortenuntersuchung aus Brasilien kindliche Auffälligkeiten (einschließlich Totgeburten, Wachstumsretardierungen und Mikrozephalie) bei 29% der Feten von infizierten Müttern während aller Trimester beobachtet [4, 5]. In einer anderen Berechnung, wo als Grundlage das normale Risiko einer Mikrozephalie in Pernambuco (Brasilien) mit 2 Fällen pro 10 000 Lebendgeburten genutzt wurde, konnte ein relatives Risiko bei 20 bis 200 Fälle (mit der Annahme das 50% der Frauen einer Infektion ausgesetzt waren) oder 100 bis 1000 Fälle (mit der Annahme das 10% der Frauen einer Infektion ausgesetzt waren) errechnet werden [6]. Allerdings hat diese Berechnung zahlreiche diskutierbare bzw. fragliche Variablen [6]. In der Region Bahia (Brasilien) wird das Risiko eines Kinds mit Mikrozephalie nach Infektion im ersten Trimenon auf 1 bis 13 % geschätzt [7]. In einem mathematischen, statistischen Model wurde das Risiko eine Mikrozephalie bei einer Infektion im ersten Trimester mit 46.7 % (95% CI: 9.1-84.2) berechnet (bei einer Übertragungswahrscheinlichkeit des Virus von 30%) [, welches vergleichbar zu einem kongenitalen Rubellasyndrom (CRS) nach Infektion im 1. Trimenon ist [8]. Allerdings variiert das generelle Risiko einer Mikrozephalie zwischen 14 und 100 % [9]. Während das Risiko einer Mikrozephalie bei einer Infektion in dem ersten Trimenon zwischen 1 und 47% errechnet wurde, scheint das entsprechende Risiko bei einer Infektion im zweiten und dritten Trimenon vernachlässigbar zu sein [7]. Dies wird durch eine Untersuchung in Kolumbien bestätigt, wo Schwangere, die sich im 3. Trimenon infiziert hatten, alle gesunde und unauffällige Kinder zur Welt brachten [10]. Übertragung Das Zika-Virus ist genetisch mit dem Dengue-Virus, dem West-Nil-Virus (WNV), dem Gelbfieber-Virus (YFV) und dem Japanischen Enzephalitis-Virus (JEV) verwandt. Neben dem Hauptübertragungsweg durch Moskitos kann das Virus auch von der Mutter auf das Kind (intrauterin, perinatal), sexuell und durch Bluttransfusionen übertragen werden. Theoretisch möglich, aber nicht gesichert, ist auch die Übertragung durch Speichel, Muttermilch oder Organtransplantation. Mückenstiche: Das Virus wird in den meisten Fällen durch den Stich von infizierten Moskitos, vor allem der Gattung Aedes, übertragen. Während die Gelbfiebermücke (Aedes aegypti) der wichtigste Vektor in Südamerika zu sein scheint [11], könnten auch die anderen Moskitoarten (z.B. die asiatische Tigermücke (Aedes albopictus)) [12] zur Übertragung des Virus beitragen. Die Inkubationszeit liegt zwischen drei und zwölf Tagen. Es gibt keine Hinweise, dass Schwangere empfänglicher für Zika-Virus sind oder dass Symptome bei Ihnen ausgeprägter auftreten. Bluttransfusion: Einige Arboviren können auch durch Bluttransfusionen übertragen werden [13], sodass in über einen möglichen solchen Übertragungsweg des Zikavirus, vor allem nach Berichten von zwei Fällen einer solchen Übertragung, nachgedacht wird [13-16]. Aus diesem Grunde wurde empfohlen, dass Reisende erst 28 Tage nach der Rückkehr aus Endemiegebiete Blut spenden sollten [17, 18]. Sexuelle Übertragung: Mittlerweile wurde eine Übertragung durch Geschlechtsverkehr in über zwölf Ländern vermutet [19-23]. Während das Virus im Sperma eines infizierten Patienten in Französisch Polynesien nachgewiesen werden konnte [24], wurde über eine mögliche sexuell übertragene Infektion auch in den USA, Frankreich [23, 25] und in Deutschland berichtet [26]. 2 Bei allen Übertragungen waren symptomatische Männer mit Reiseanamnese in die Endemiegebiete beteiligt. Der Übertragungsweg erfolgte primär durch ungeschützten vaginalen Geschlechtsverkehr, wobei auch einzelne Berichte über eine Übertragung durch oralen [27] bzw. analen [28] Geschlechtsverkehr berichten. Mittlerweile wurde auch in zwei Fällen eine Virusübertragung bei asymptomatischen Partner berichtet [29, 30]. Auch eine Übertragung von Frau zu Mann wurde berichtet [31]. Das Virus wurde in zwei Fällen aus dem Sperma isoliert [24, 25] und das Virusgenom konnte noch 62 Tage nach Beginn der Symptome nachgewiesen werden, länger als bei einer bestehenden Virämie [32, 33]. Eine sexuelle Übertragung ist somit auch nach der virämischen Phase (sieben Tage) mittels sexueller Kontakte möglich. Dies scheint sich durch ein Fallbeispiel zu bestätigen, wo die Partnerin Zeichen einer Infektion 44 Tage nach dem Beginn von Symptomen bei ihrem Partner zeigte [34]. Da eine sexuelle Übertragung trotz der bislang geringen dokumentierten Fallzahl möglich ist [20, 22, 24, 27], müssen noch weitere Untersuchungen erfolgen. Mittlerweile wird allerdings auch die Bedeutung einer sexuellen Übertragung des Virus, vor allem im Hinblick auf Epidemien, kritisch gesehen [35]. Symptome Allgemeine Symptome einer Zika-Virus Infektion können z.B. Hautausschlag, Kopf-, Gelenk-, und Muskelschmerzen, nicht-eitrige Konjunktivitis oder subfebrile Temperaturen sein [1, 36-38]. Die derzeitige Definition des Erkrankungsbildes beinhaltet mindestens zwei dieser vier Symptome [1, 38]. Ein Großteil (ca. 60 % - 80 %) der Infektionen verläuft allerdings asymptomatisch. Es gibt derzeit weder eine Impfung gegen Zikavirus noch eine spezifische antivirale Therapie [39]. Eine Erkrankung wird symptomatisch mit Schmerzmitteln, fiebersenkenden Medikamenten und durch die Zufuhr von reichlich Flüssigkeit behandelt. Eine bereits durchgemachte Zika-Virus Infektion schützt aller Voraussicht nach vor einer weiteren Infektion mit demselben Erreger. Maternofetale Transmission Allgemein Die maternofetale Transmission von Zika-Virus wurde für alle Schwangerschaftstrimester beobachtet. Das volle Spektrum einer kongenitalen Zika-Virusinfektion ist unbekannt, unter den häufigsten Auffälligkeiten, von auf Zika-Virus positiv getesteten Feten/Neugeborenen, sind Mikrozephalie, Hirnatrophie, Ventrikulomegalie und intrakraniale Verkalkungen. Weitere Assoziationen sind Augendefekte, Anomalien des Corpus callosum und des Kleinhirns, Gelenkkontrakturen oder Hautläsionen. Zika-Virus scheint auch im Zusammenhang mit intrauterinem Fruchttod zu stehen [4]. Zika-Virus RNA wurde in der Plazenta und in verschiedenen fetalen Geweben nachgewiesen [40]. Die Häufigkeit einer transplazentaren Übertragung und das Risiko einer kongenitalen Schädigung bei nachgewiesener fetaler Zika-Virus Infektion sind nicht bekannt. Unklar ist auch, ob der Zeitpunkt oder die Ausprägung von Symptomen, die Viruslast oder die maternale Immunantwort Auswirkungen auf die Transmissionsrate oder das Vorkommen kongenitaler Anomalien haben. Eine retrospektive Fallkontrollstudie aus Polynesien legt nahe, dass eine Exposition im 1. oder 2. Trimenon mit einer höheren Wahrscheinlichkeit fetaler Auffälligkeiten assoziiert ist. In dieser Untersuchung wurde die Häufigkeit einer Mikrozephalie nach Infektion im ersten Trimenon mit ca. 1% (95 Mikrozephaliefälle (95%CI 34-191) pro 10.000 infizierte Schwangere) und die allgemeine Neugeborenenprävalenz der Mikrozephalie mit 0,02 % 3 angegeben [5]. Andere Schätzungen gehen von Mikrozephalieraten von bis zu 13% bei Infektion im ersten Trimenon aus [7]. Eine Nachbeobachtung aus Brasilien von 35 Neugeborenen mit Mikrozephalie aber ohne labordiagnostisch gesicherte intrauterine Zika-Virus Infektion zeigte, dass alle Mütter in Gebieten mit aktiver Zika-Virus-Transmission lebten oder diese bereisten. Bei den 35 Neugeborenen wurde in 74% eine schwere Mikrozephalie diagnostiziert, alle Kinder mit einer zusätzlichen Bildgebung (n=27) hatten auch strukturelle Hirnauffälligkeiten [41]. Eine peripartale Mutter-Kind Übertragung wurde bislang in zwei Fällen beschrieben. Ein Neugeborenes war asymptomatisch, im zweiten Fall war am 3. Lebenstag ein diffuses Exanthem aufgetreten [42]. Darüber hinaus wurde vermehrungsfähiges Zika-Virus in Muttermilch nachgewiesen [43]. Die klinische Relevanz dieser Beobachtung ist noch unklar. Mikrozephalie und angeborene Fehlbildungen des Zentralen Nervensystems (ZNS) Ein Anstieg von Mikrozephaliefällen, teilweise in Kombination mit anderen zerebralen Fehlbildungen, wurde insbesondere für Brasilien und Französisch Polynesien berichtet. Zwischen November 2015 und Juni 2016 wurden 7.830 Verdachtsfälle in Brasilien gemeldet (Stand 20.05.2016), während die jährliche Rate zwischen 2001 und 2014 ca. 163 Fälle betrug [39]. Eine Nachuntersuchung von 1.501 Verdachtsfällen ergab allerdings, dass nur in 76 Fällen eine labordiagnostisch gesicherte Zika-Virus Infektion vorlag [44]. Bis jetzt (Stand Oktober 2016) sind 21 Fallberichte mit nachgewiesener konnataler Zika-Virus Infektion veröffentlicht. Virale RNA wurde meist in fetalem Gehirn, Fruchtwasser und Plazenta nachgewiesen. Unter Mikrozephalie versteht man die Verminderung des Kopfumfanges. Die Definition ist uneinheitlich, meist werden 2 oder 3 Standardabweichung (SD) vom Mittelwert oder die 3. bzw. 5. Perzentile des Kopfumfanges als Grenzwert angegeben. Die Gruppe der Mikrozephalien ist sehr heterogen. Sie kann sowohl genetisch bedingt sein als auch infektiöse, toxische oder metabolische Ursachen haben. Als infektiöse Ursachen einer Mikrozephalie kommen in unseren Patientenkollektiven vor allem Zytomegalie oder Toxoplasmose in Betracht. Zerebrale Hinweiszeichen wie intrakraniale Verkalkungen oder Ventrikulomegalie werden auch bei ZikaVirus Infektion beschrieben. Für die Prognose ist sowohl der Grad der Mikrozephalie als auch das Vorliegen weiterer Anomalien bedeutsam. Nachgeburtliche Auffälligkeiten können Krampfanfälle, Hör- oder Sehstörungen und andere neuromotorische Defizite sein. Die meisten Fälle von Zikavirus-assoziierter Mikrozephalie wurden postnatal registriert. In einzelnen Fällen wurde sonographisch zwischen 20 und 30 Schwangerschaftswochen (SSW) eine Mikrozephalie beobachtet. Weitere, pränatal im Zusammenhang mit Zika-Virus Infektionen beschriebene sonographische oder kernspintomographische ZNS-Auffälligkeiten waren Ventrikulomegalie, erweiterte Zisterna magna, Auffälligkeiten des Corpus callosum (hypoplastisch, fehlend), zerebrale Verkalkungen, Gyrierungsstörungen, Anomalien des Kleinhirns (Vermishypoplasie bzw. Agenesie) [4, 45-47]. Bei Infektion im 1. Trimenon wurden Ultraschallauffälligkeiten ab der ca. 20. SSW beschrieben [47]. Weiterhin wurden in Einzelfällen eine intrauterine Wachstumsretardierung und Gelenkkontrakturen beobachtet [4, 46-48]. Empfehlungen zur Überwachung und Diagnostik Labordiagnostik Schwangere, die sich in Gebieten mit aktiver Zika-Virus Transmission (link ECDC: http://ecdc.europa.eu/en/healthtopics/zika_virus_infection/zika-outbreak/pages/zika-countrieswith-transmission.aspx) aufgehalten haben, sollten bezüglich von Symptomen einer Zika-Virus 4 Infektion befragt werden. In Abhängigkeit des zeitlichen Bezuges zum möglichen Infektionsgeschehen sollte eine entsprechende Diagnostik aus Blut und/oder Urin erfolgen (Abbildung 1). Dies gilt auch für Schwangere mit Sexualpartnern und entsprechender Anamnese. Im Akutstadium der Infektion ist der Erregernachweis in Blut oder Urin mittels molekularer Untersuchungsmethoden (z.B. RT-PCR) vorrangig. Liegt die Exposition bereits mehr als 3-4 Wochen zurück so erfolgt die weitere Abklärung mittels Antikörpernachweis. Für diesen stehen mehrere Methoden zur Verfügung (z.B. indirekte Immunfluoreszenztest (IIFT), Enzymimmunoassay (EIA), Neutralisationstest)). Aufgrund der antigenen Verwandtschaft zu anderen Flaviviren (z.B. Dengue-Virus) kann es im IIFT (basiert auf Vollvirusantigen) zu Antikörper-Kreuzreaktionen kommen. Diese Problematik ist bei Anwendung des NS1 EIA (als Antigen wird ein rekombinantes Protein verwendet) aufgrund der hohen Spezifität geringer ausgeprägt [49]. Der negative NS1 Antikörpernachweis schließt eine Zika-Virus-Infektion, die bereits mehr als 3 Wochen zurückliegt, mit großer Wahrscheinlichkeit aus. Bei länger (mehrere Monate) zurückliegender Zika-Virus Infektion ist die Sensitivität des Anti-NS1 IgG Antikörpernachweises unklar. Ein positiver Antikörpernachweis kann mittels Neutralisationstest (nur Speziallaboratorien) weiter abgeklärt werden [50]. Da ca. 80% der Infektionen asymptomatisch verlaufen, sollte allen Schwangeren bzw. deren Sexualpartnern nach Rückkehr aus Gebieten mit aktiver Zika-Virus Transmission eine Diagnostik angeboten werden (Abbildung 1). Ultraschalldiagnostik Schwangere mit Exposition zu Zika-Virus sollten eine Basisultraschalluntersuchung erhalten [51]. Es erscheint sinnvoll diese ca. 3-4 Wochen nach Auftreten der Symptome bzw. nach der Reise durchzuführen. Bei Schwangerschaften > 14+0 SSW sollte diese beinhalten [51, 52]: 1) Allgemeine Beurteilung der fetalen Anatomie 2) Fetale Biometrie: biparietaler Durchmesser (BPD), Kopfumfang (KU), Abdomenumfang (AU), Femurlänge (FL), transzerebellärer Durchmesser (TCD) 3) Gezielte Beurteilung der zerebralen Anatomie: Weite der Seitenventrikel, Suche nach Echogenitätsvermehrung Ist die Labordiagnostik negativ und der Basisultraschall normal, sollte eine weitere sonographische Diagnostik mit Dokumentation des Kopfumfanges im Rahmen der normalen Mutterschaftsvorsorge (2. und 3. Screening) erfolgen. Bei nachgewiesener maternaler ZikaVirus Infektion werden sonographische Kontrollen ca. alle 4 Wochen empfohlen. Eine detaillierte Neurosonografie > 20 SSW und > 28 SSW in einer spezialisierten Einrichtung (z.B. DEGUM II oder III) sollte zusätzlich angeboten werden. Eine invasive pränatale Diagnostik wird nicht generell empfohlen, da ein positives Ergebnis keine Rückschlüsse auf mögliche fetale Fehlbildungen zulässt. Finden sich Auffälligkeiten im Basisultraschall oder bei den Kontrolluntersuchungen sollte die Schwangere zur detaillierten Organdiagnostik inklusive Neurosonografie überwiesen werden. In Abhängigkeit der erhobenen Befunde kann eine weiterführende Diagnostik (TORCH Serologie, ggf. Wiederholung der Zika-Virus Serologie, invasive Diagnostik) erforderlich sein. Eine Amniozentese zur Zika-Virus RT-PCR sollte frühestens ab 20+0 SSW und mindestens 6 Wochen nach Exposition durchgeführt werden [51]. Die Schwangere ist darüber aufzuklären, dass Sensitivität und Spezifität der invasiven 5 Diagnostik bei Zika-Virus Infektion nicht bekannt sind. Es ist ebenfalls unklar, wie hoch die Wahrscheinlichkeit einer fetalen Schädigung bei sonographisch unauffälligen Feten aber positiver Fruchtwasser-PCR ist. Zur weiteren Beurteilung kann bei entsprechender Verfügbarkeit und Expertise eine fetale MRT-Untersuchung, möglichst > 28 SSW in Erwägung gezogen werden [52]). Finden sich typische Hirnauffälligkeiten und eine positive FruchtwasserPCR ist die Wahrscheinlichkeit einer Assoziation hoch. Bei gesicherter pränataler Infektion und schwerwiegenden Ultraschallauffälligkeiten muss der Schwangerschaftskonflikt geklärt werden – auch im Hinblick auf einen möglichen Schwangerschaftsabbruch. Postpartale Diagnostik Eine Testung von Neugeborenen ist bei positiv bzw. unklar getesteten Schwangeren sowie solchen mit typischen ZNS Auffälligkeiten nach Aufenthalt in Gebieten mit aktiver Zika-Virus Transmission indiziert. Empfohlen wird der Erregernachweis mittels PCR in EDTA-Blut, Urin, Plazenta und Nabelschnurgewebe. Zusätzlich sollte eine Untersuchung auf IgM-Antikörper gegen Zika- und Dengue-Virus durchgeführt werden. Insbesondere bei Vorliegen von ZNSAuffälligkeiten muss auch der Liquor untersucht werden. Es wird ferner eine pathologische Untersuchung der Plazenta und der Nabelschnur mit immunhistochemischen bzw. molekularbiologischen Methoden in einem Speziallabor empfohlen [51, 53]. Asymptomatische Neugeborene mit gesicherter pränataler Infektion sollten regelmäßig standardisiert nachuntersucht werden, da Langzeitfolgen derzeit nicht bekannt sind. Bei gesicherter Infektion der Mutter und negativer Diagnostik beim Neugeborenen sollte zum Ausschluss einer intrauterinen Übertragung das Kind solange serologisch nachkontrolliert werden, bis die mütterlichen Leihantikörper nicht mehr nachweisbar sind. Prävention Fast alle nationalen und internationalen Organisationen empfehlen berufliche und private Reisen in Zika-Endemiegebiete während der Schwangerschaft zu vermeiden [1]. Auch das Auswärtige Amt der Bundesrepublik Deutschland [54] die Deutsche Gesellschaft für Tropenmedizin [55] raten Schwangeren von Reisen in Verbreitungsgebiete des Zika-Virus ab. Ist eine Reise in Endemiegebiete nicht vermeidbar, sollten Vorkehrungen zum Schutz vor Mückenstichen getroffen werden. Auch Personen, die gerade eine Zikavirus-Infektion durchmachen oder gerade aus Endemiegebieten zurückkehren, sollten sich vor Mückenstichen schützen, um eine Weiterverbreitung des Virus zu vermeiden [1]. Bei männlichen Reiserückkehrern aus Ausbruchsgebieten mit schwangerer Sexualpartnerin wird zum Kondomgebrauch bis zum Ende der Schwangerschaft bzw. zur Abstinenz geraten. Reiserückkehrern (männlich, weiblich, nicht-schwanger; symptomatisch oder asymptomatisch) werden diese Präventionsmaßnahmen unabhängig von einem Kinderwunsch für den Zeitraum von 6 Monaten (nach Erkrankungsbeginn bzw. letzter möglicher Exposition) empfohlen [56]. Da die zur Verfügung stehenden Testsysteme nach der aktuellen - noch begrenzten - Datenlage eine gute diagnostische Aussagekraft besitzen, könnte nach Ansicht der Autoren in letztgenannter Gruppe bei labordiagnostischem Ausschluss einer akuten/kürzlichen Zika-Virus Infektion auf die Präventionsmaßnahmen verzichtet werden. Von den CDC wird ein solches Vorgehen nicht empfohlen, da die Häufigkeit falscher Testergebnisse nicht sicher geklärt ist [57]. 6 Weiterführende online Informationen • Bernhard-Nocht-Institut für Tropenmedizin: www.bnitm.de • Centers for Disease Control and Prevention (CDC): http://www.cdc.gov • Deutsche Gesellschaft für Tropenmedizin (DTG): www.dtg.org • Europäisches Zentrum für die Prävention und Kontrolle von Krankheiten (ECDC): http://ecdc.europa.eu/en/Pages/home.aspx • Pan American Health Organization: www.paho.org • Robert Koch Institut (RKI): www.rki.de • Weltgesundheitsorganisation (WHO): www.who.int Die Stellungnahme wurde von Frau Prof. Dr. Annegret Geipel, Abteilung für Geburtshilfe und Pränatale Medizin, Universitätsklinikum Bonn, 53105 Bonn Herrn PD Dr. Martin Enders, Labor Prof. G. Enders & Kollegen, MVZ Medizinische Diagnostik Stuttgart; 70173 Stuttgart Herrn Prof. Dr. Ioannis Mylonas, Klinik und Poliklinik für Frauenheilkunde und Geburtshilfe, Universitätsklinikum München, 80337 München erstellt. Prof. Dr. Birgit Seelbach-Göbel Präsidentin der DGGG e.V. Prof. Dr. Matthias W. Beckmann Leitlinienbeauftragter DGGG 7 Literatur 1. 2. 3. 4. 5. 6. 7. 8. 9. 10. 11. 12. 13. 14. 15. Mylonas I, Dieterle S, Hampl M, Hoyme UB, Jückstock J, Mendling W, Neumann G, Friese K. Zika-Virus-Infektion in der Gynäkologie und Geburtshilfe. Der Gynäkologe 2016; 49:786-794. Rasmussen SA, Jamieson DJ, Honein MA, Petersen LR. Zika Virus and Birth Defects-Reviewing the Evidence for Causality. N Engl J Med 2016; 374:1981-1987. Cordeiro MT, Pena LJ, Brito CA, Gil LH, Marques ET. Positive IgM for Zika virus in the cerebrospinal fluid of 30 neonates with microcephaly in Brazil. Lancet 2016; 387:18111812. Brasil P, Pereira JP, Jr., Raja Gabaglia C, Damasceno L, Wakimoto M, Ribeiro Nogueira RM, Carvalho de Sequeira P, Machado Siqueira A, Abreu de Carvalho LM, Cotrim da Cunha D, Calvet GA, Neves ES, et al. Zika Virus Infection in Pregnant Women in Rio de Janeiro - Preliminary Report. N Engl J Med 2016. Cauchemez S, Besnard M, Bompard P, Dub T, Guillemette-Artur P, Eyrolle-Guignot D, Salje H, Van Kerkhove MD, Abadie V, Garel C, Fontanet A, Mallet HP. Association between Zika virus and microcephaly in French Polynesia, 2013-15: a retrospective study. Lancet 2016. Jaenisch T, Rosenberger KD, Brito C, Brady O, Brasil P, Marques ET. Estimating the risk for microcephaly after Zika virus infection in Brazil [Submitted]. . Bull World Health Organ; E-pub: 30 May 2016. doi: http://dx.doi.org/10.2471/BLT.16.178608. Johansson MA, Mier-y-Teran-Romero L, Reefhuis J, Gilboa SM, Hills SL. Zika and the Risk of Microcephaly. N Engl J Med 2016; 375:1-4. Friese K, Mylonas I, Schulze A. Infektionserkrankungen der Schwangeren und des Neugeborenen. Berlin Heidelberg: Springer-Verlag; 2013. Nishiura H, Mizumoto K, Rock KS, Yasuda Y, Kinoshita R, Miyamatsu Y. A theoretical estimate of the risk of microcephaly during pregnancy with Zika virus infection. Epidemics 2016; 15:66-70. Pacheco O, Beltran M, Nelson CA, Valencia D, Tolosa N, Farr SL, Padilla AV, Tong VT, Cuevas EL, Espinosa-Bode A, Pardo L, Rico A, et al. Zika Virus Disease in Colombia Preliminary Report. N Engl J Med 2016. Boorman JP, Porterfield JS. A simple technique for infection of mosquitoes with viruses; transmission of Zika virus. Trans R Soc Trop Med Hyg 1956; 50:238-242. Vega-Rua A, Lourenco-de-Oliveira R, Mousson L, Vazeille M, Fuchs S, Yebakima A, Gustave J, Girod R, Dusfour I, Leparc-Goffart I, Vanlandingham DL, Huang YJ, et al. Chikungunya virus transmission potential by local Aedes mosquitoes in the Americas and Europe. PLoS Negl Trop Dis 2015; 9:e0003780. Petersen LR, Busch MP. Transfusion-transmitted arboviruses. Vox Sang 2010; 98:495503. Musso D, Nhan T, Robin E, Roche C, Bierlaire D, Zisou K, Shan Yan A, Cao-Lormeau VM, Broult J. Potential for Zika virus transmission through blood transfusion demonstrated during an outbreak in French Polynesia, November 2013 to February 2014. Euro Surveill 2014; 19. Marano G, Pupella S, Vaglio S, Liumbruno GM, Grazzini G. Zika virus and the neverending story of emerging pathogens and Transfusion Medicine. Blood Transfus 2016; 14:95-100. 8 16. 17. 18. 19. 20. 21. 22. 23. 24. 25. 26. 27. 28. 29. 30. Musso D, Stramer SL, Committee AT-TD, Busch MP, International Society of Blood Transfusion Working Party on Transfusion-Transmitted Infectious D. Zika virus: a new challenge for blood transfusion. Lancet 2016; 387:1993-1994. Control ECfDPa. Rapid risk assessment. Zika virus infection outbreak, Brazil and the Pacific region 25 May 2015. . http://ecdc.europa.eu/en/publications/Publications/rapidrisk-assessment-Zika%20virus-south-america-Brazil-2015.pdf 2015. European Centre for Disease Prevention and Control (ECDC). Epidemiological update: complications potentially linked to Zika virus outbreak, Brazil and French Polynesia. November 27, 2015. http://ecdc.europa.eu/en/press/news/_layouts/forms/News_DispForm.aspx?ID=1332&Li st=8db7286c-fe2d-476c-913318ff4cb1b568&Source=http%3A%2F%2Fecdc%2Eeuropa%2Eeu%2Fen%2Fpress%2F epidemiological%5Fupdates%2FPages%2Fepidemiological%5Fupdates%2Easpx 2015. World Health Organization (WHO). Zika situation report. 8 Sep 2016. . http://www.who.int/emergencies/zikavirus/situation-report/8-september-2016/en/ : Accessed: 15 Sep 2016. 2016. Hills SL, Russell K, Hennessey M, Williams C, Oster AM, Fischer M, Mead P. Transmission of Zika Virus Through Sexual Contact with Travelers to Areas of Ongoing Transmission - Continental United States, 2016. MMWR Morb Mortal Wkly Rep 2016; 65:215-216. McCarthy M. Zika virus was transmitted by sexual contact in Texas, health officials report. BMJ 2016; 352:i720. Venturi G, Zammarchi L, Fortuna C, Remoli ME, Benedetti E, Fiorentini C, Trotta M, Rizzo C, Mantella A, Rezza G, Bartoloni A. An autochthonous case of Zika due to possible sexual transmission, Florence, Italy, 2014. Euro Surveill 2016; 21. Foy BD, Kobylinski KC, Chilson Foy JL, Blitvich BJ, Travassos da Rosa A, Haddow AD, Lanciotti RS, Tesh RB. Probable non-vector-borne transmission of Zika virus, Colorado, USA. Emerg Infect Dis 2011; 17:880-882. Musso D, Roche C, Robin E, Nhan T, Teissier A, Cao-Lormeau VM. Potential sexual transmission of Zika virus. Emerg Infect Dis 2015; 21:359-361. Mansuy JM, Dutertre M, Mengelle C, Fourcade C, Marchou B, Delobel P, Izopet J, Martin-Blondel G. Zika virus: high infectious viral load in semen, a new sexually transmitted pathogen? Lancet Infect Dis 2016. Frank C, Cadar D, Schlaphof A, Neddersen N, Gunther S, Schmidt-Chanasit J, Tappe D. Sexual transmission of Zika virus in Germany, April 2016. Euro Surveill 2016; 21. D'Ortenzio E, Matheron S, de Lamballerie X, Hubert B, Piorkowski G, Maquart M, Descamps D, Damond F, Yazdanpanah Y, Leparc-Goffart I. Evidence of Sexual Transmission of Zika Virus. N Engl J Med 2016. Deckard DT, Chung WM, Brooks JT, Smith JC, Woldai S, Hennessey M, Kwit N, Mead P. Male-to-Male Sexual Transmission of Zika Virus - Texas, January 2016. MMWR Morb Mortal Wkly Rep 2016; 65:372-374. Freour T, Mirallie S, Hubert B, Splingart C, Barriere P, Maquart M, Leparc-Goffart I. Sexual transmission of Zika virus in an entirely asymptomatic couple returning from a Zika epidemic area, France, April 2016. Euro Surveill 2016; 21. Brooks RB, Carlos MP, Myers RA, White MG, Bobo-Lenoci T, Aplan D, Blythe D, Feldman KA. Likely Sexual Transmission of Zika Virus from a Man with No Symptoms of Infection - Maryland, 2016. MMWR Morb Mortal Wkly Rep 2016; 65:915-916. 9 31. 32. 33. 34. 35. 36. 37. 38. 39. 40. 41. 42. 43. 44. Davidson A, Slavinski S, Komoto K, Rakeman J, Weiss D. Suspected Female-to-Male Sexual Transmission of Zika Virus - New York City, 2016. MMWR Morb Mortal Wkly Rep 2016; 65:716-717. Reusken C, Pas S, GeurtsvanKessel C, Mogling R, van Kampen J, Langerak T, Koopmans M, van der Eijk A, van Gorp E. Longitudinal follow-up of Zika virus RNA in semen of a traveller returning from Barbados to the Netherlands with Zika virus disease, March 2016. Euro Surveill 2016; 21. Atkinson B, Hearn P, Afrough B, Lumley S, Carter D, Aarons EJ, Simpson AJ, Brooks TJ, Hewson R. Detection of Zika Virus in Semen. Emerg Infect Dis 2016; 22:940. Turmel JM, Abgueguen P, Hubert B, Vandamme YM, Maquart M, Le GuillouGuillemette H, Leparc-Goffart I. Late sexual transmission of Zika virus related to persistence in the semen. Lancet 2016. Althaus CL, Low N. How Relevant Is Sexual Transmission of Zika Virus? PLoS Med 2016; 13:e1002157. Shuaib W, Stanazai H, Abazid AG, Mattar AA. The reemergence of Zika virus: a review on pathogenesis, clinical manifestations, diagnosis, and treatment. Am J Med 2016. Paixao ES, Barreto F, Teixeira Mda G, Costa Mda C, Rodrigues LC. History, Epidemiology, and Clinical Manifestations of Zika: A Systematic Review. Am J Public Health 2016; 106:606-612. Oduyebo T, Petersen EE, Rasmussen SA, Mead PS, Meaney-Delman D, Renquist CM, Ellington SR, Fischer M, Staples JE, Powers AM, Villanueva J, Galang RR, et al. Update: Interim Guidelines for Health Care Providers Caring for Pregnant Women and Women of Reproductive Age with Possible Zika Virus Exposure - United States, 2016. MMWR Morb Mortal Wkly Rep 2016; 65:122-127. European Centre for Disease Control and Prevention (ECDC). Rapid risk assessment: Zika virus disease epidemic: potential associa-tion with microcephaly and GuillainBarre syndrome. Available at: http://ecdc.europa.eu/en/publications/Publications/rapidrisk-assessment-zika-virus-sixth-update-May-2016.pdf. Retrieved May 20, 2016. 2016. Martines RB, Bhatnagar J, Keating MK, Silva-Flannery L, Muehlenbachs A, Gary J, Goldsmith C, Hale G, Ritter J, Rollin D, Shieh WJ, Luz KG, et al. Notes from the Field: Evidence of Zika Virus Infection in Brain and Placental Tissues from Two Congenitally Infected Newborns and Two Fetal Losses - Brazil, 2015. MMWR Morb Mortal Wkly Rep 2016; 65:159-160. Schuler-Faccini L, Ribeiro EM, Feitosa IM, Horovitz DD, Cavalcanti DP, Pessoa A, Doriqui MJ, Neri JI, Neto JM, Wanderley HY, Cernach M, El-Husny AS, et al. Possible Association Between Zika Virus Infection and Microcephaly - Brazil, 2015. MMWR Morb Mortal Wkly Rep 2016; 65:59-62. Besnard M, Lastere S, Teissier A, Cao-Lormeau V, Musso D. Evidence of perinatal transmission of Zika virus, French Polynesia, December 2013 and February 2014. Euro Surveill 2014; 19. Dupont-Rouzeyrol M, Biron A, O'Connor O, Huguon E, Descloux E. Infectious Zika viral particles in breastmilk. Lancet 2016. Franca GV, Schuler-Faccini L, Oliveira WK, Henriques CM, Carmo EH, Pedi VD, Nunes ML, Castro MC, Serruya S, Silveira MF, Barros FC, Victora CG. Congenital Zika virus syndrome in Brazil: a case series of the first 1501 livebirths with complete investigation. Lancet 2016; 388:891-897. 10 45. 46. 47. 48. 49. 50. 51. 52. 53. 54. 55. 56. 57. Oliveira Melo AS, Malinger G, Ximenes R, Szejnfeld PO, Alves Sampaio S, Bispo de Filippis AM. Zika virus intrauterine infection causes fetal brain abnormality and microcephaly: tip of the iceberg? Ultrasound Obstet Gynecol 2016; 47:6-7. Mlakar J, Korva M, Tul N, Popovic M, Poljsak-Prijatelj M, Mraz J, Kolenc M, Resman Rus K, Vesnaver Vipotnik T, Fabjan Vodusek V, Vizjak A, Pizem J, et al. Zika Virus Associated with Microcephaly. N Engl J Med 2016; 374:951-958. Jouannic JM, Friszer S, Leparc-Goffart I, Garel C, Eyrolle-Guignot D. Zika virus infection in French Polynesia. Lancet 2016. Cofre F. [Zika virus intrauterine infection causes fetal brain abnormality and microcephaly: tip of the iceberg?]. Rev Chilena Infectol 2016; 33:96. Huzly D, Hanselmann I, Schmidt-Chanasit J, Panning M. High specificity of a novel Zika virus ELISA in European patients after exposure to different flaviviruses. Euro Surveill 2016; 21. Lanciotti RS, Kosoy OL, Laven JJ, Velez JO, Lambert AJ, Johnson AJ, Stanfield SM, Duffy MR. Genetic and serologic properties of Zika virus associated with an epidemic, Yap State, Micronesia, 2007. Emerg Infect Dis 2008; 14:1232-1239. Baud D, Van Mieghem T, Musso D, Truttmann AC, Panchaud A, Vouga M. Clinical management of pregnant women exposed to Zika virus. Lancet Infect Dis 2016. Papageorghiou AT, Thilaganathan B, Bilardo CM, Ngu A, Malinger G, Herrera M, Salomon LJ, Riley LE, Copel JA. ISUOG Interim Guidance on ultrasound for Zika virus infection in pregnancy: information for healthcare professionals. Ultrasound Obstet Gynecol 2016. Staples JE, Dziuban EJ, Fischer M, Cragan JD, Rasmussen SA, Cannon MJ, Frey MT, Renquist CM, Lanciotti RS, Munoz JL, Powers AM, Honein MA, et al. Interim Guidelines for the Evaluation and Testing of Infants with Possible Congenital Zika Virus Infection United States, 2016. MMWR Morb Mortal Wkly Rep 2016; 65:63-67. Auswärtiges Amt (AA). Gesundheitsdienst - 04/16/JS/GB - Merkblatt für Beschäftigte und und Reisendeeisende - Zika-Virus-Infektion. April 2016. www.auswaertigesamt.de/cae/servlet/contentblob/722280/publicationFile/212139/Zika-Virus.pdf 2016. Deutsche Gesellschaft für Tropenmedizin (DGTM). Aktualisierung zu Zika. 14. März 2016. www.dtg.org/24.html?&tx_ttnews[tt_news]=136&cHash=cd8002635595379205e761225 8861c95 2016. World Health Organization (WHO). Interim guidance: Prevention of sexual transmission of Zika virus. http://www.who.int/csr/resources/publications/zika/sexual-transmissionprevention/en/ 2016. Petersen EE, Meaney-Delman D, Neblett-Fanfair R, Havers F, Oduyebo T, Hills SL, Rabe IB, Lambert A, Abercrombie J, Martin SW, Gould CV, Oussayef N, et al. Update: Interim Guidance for Preconception Counseling and Prevention of Sexual Transmission of Zika Virus for Persons with Possible Zika Virus Exposure - United States, September 2016. MMWR Morb Mortal Wkly Rep 2016; 65:1077-1081. 11 Abbildung 1: Empfohlener Algorithmus bei Schwangerschaften mit Zika-Virus-Exposition 12