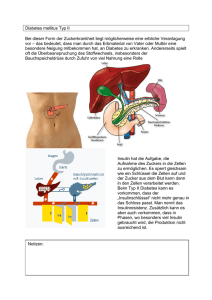
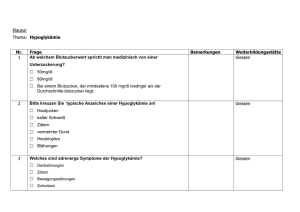
anhang i zusammenfassung der merkmale des arzneimittels
Werbung

ANHANG I ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS 1 1. BEZEICHNUNG DES ARZNEIMITTELS Levemir 100 E/ml Injektionslösung in einer Zylinderampulle 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG 1 ml enthält 100 E Insulindetemir (gentechnisch hergestellt aus rekombinanter DNS in Saccharomyces cerevisiae). 1 Zylinderampulle enthält 3 ml entsprechend 300 E. Eine Einheit von Insulindetemir entspricht 0,142 mg salzfreiem, wasserfreiem Insulindetemir. Eine Einheit (E) von Insulindetemir entspricht einer I.E. von Insulin human. Sonstige Bestandteile siehe unter Abschnitt 6.1. 3. DARREICHUNGSFORM Injektionslösung in einer Zylinderampulle. Penfill Levemir ist eine klare, farblose, neutrale Lösung. 4. KLINISCHE ANGABEN 4.1 Anwendungsgebiete Zur Behandlung des Diabetes mellitus. 4.2 Dosierung, Art und Dauer der Anwendung Levemir ist ein lang wirkendes Insulinanalogon zur Anwendung als Basalinsulin in Kombination mit einem mahlzeitenbezogenen kurz bzw. schnell wirkenden Insulin. Dosierung: Die Dosierung von Levemir muss individuell angepasst werden. Levemir muss je nach Bedarf des Patienten einmal oder zweimal täglich angewendet werden. Bei Patienten, die zur Optimierung der Blutzuckereinstellung täglich eine zweimalige Dosis benötigen, kann die zweite Dosis abends oder vor dem Zubettgehen angewendet werden. Umstellung von anderen Insulinen: Die Umstellung auf Levemir von intermediär oder lang wirkenden Insulinen kann eine Anpassung von Dosis und Zeitpunkt der Gabe erforderlich machen (siehe unter 4.4). Wie bei allen Insulinen wird eine engmaschige Überwachung des Blutzuckers während der Umstellung und in den ersten Wochen danach empfohlen. Eine begleitende antidiabetische Behandlung muss eventuell angepasst werden (Dosis und Zeitpunkt der Gabe gleichzeitig angewendeter kurz wirkender Insuline). Wie bei allen Insulinen muss bei älteren Patienten und bei Patienten mit Nieren- oder Leberfunktionsstörungen die Überwachung des Blutzuckers intensiviert und die Dosierung von Insulindetemir individuell angepasst werden. 2 Die Wirksamkeit und Sicherheit von Levemir wurde bei Kindern und Jugendlichen nicht untersucht. Eine Anpassung der Dosierung kann auch bei verstärkter körperlicher Aktivität, Änderung der Ernährungsgewohnheiten oder während Begleiterkrankungen notwendig sein. Anwendung: Zur subkutanen Anwendung. Levemir wird subkutan in den Oberschenkel, die Bauchdecke oder in den Oberarm injiziert. Wie bei Humaninsulinen können die Geschwindigkeit und das Ausmaß der Resorption von Insulindetemir bei subkutaner Injektion in die Bauchdecke oder in den Oberarm höher sein als bei Gabe in den Oberschenkel. Die Injektionsstelle sollte daher nur innerhalb der gewählten Körperregion gewechselt werden. Levemir Penfill ist eine Packungsbeilage mit detaillierten Anwendungshinweisen beigefügt, die unbedingt befolgt werden müssen. Levemir Penfill ist für die Anwendung mit Injektionssystemen von Novo Nordisk und mit NovoFineKanülen (Injektionsnadeln) vorgesehen. Die dem Injektionssystem beiliegende detaillierte Bedienungsanleitung muss befolgt werden. 4.3 Gegenanzeigen Überempfindlichkeit gegen Insulindetemir oder einen der sonstigen Bestandteile. 4.4 Warnhinweise und Vorsichtsmaßnahmen für die Anwendung Eine unzureichende Dosierung oder das Unterbrechen der Therapie kann, insbesondere beim Typ 1 Diabetes, zu einer Hyperglykämie und zu diabetischer Ketoazidose führen. Die ersten Symptome einer Hyperglykämie treten in der Regel allmählich über Stunden bzw. Tage auf. Zu diesen Symptomen zählen Durstgefühl, verstärkter Harndrang, Übelkeit, Erbrechen, Benommenheit, gerötete trockene Haut, Mundtrockenheit, Appetitverlust sowie nach Aceton riechender Atem. Bei Typ 1 Diabetikern können Hyperglykämien, die nicht behandelt werden, zu einer diabetischen Ketoazidose führen, die tödlich enden kann. Eine Hypoglykämie kann auftreten, wenn die Insulindosis im Verhältnis zum Insulinbedarf zu hoch ist (siehe Abschnitt 4.8 und 4.9). Das Auslassen einer Mahlzeit oder ungeplante, anstrengende körperliche Aktivität können zu einer Hypoglykämie führen. Patienten, deren Blutzuckereinstellung sich beispielsweise durch eine intensivierte Insulintherapie deutlich verbessert hat, können die Warnsymptome einer Hypoglykämie verändert wahrnehmen und sollten dementsprechend beraten werden. Bei schon lange an Diabetes leidenden Patienten verschwinden möglicherweise die üblichen Warnsymptome. Begleiterkrankungen, insbesondere Infektionen und fiebrige Zustände, erhöhen in der Regel den Insulinbedarf des Patienten. Die Umstellung eines Patienten auf einen anderen Insulintyp oder eine andere Insulinmarke muss unter strenger ärztlicher Kontrolle erfolgen. Jede Änderung hinsichtlich Stärke, Marke (Hersteller), Insulintyp, Insulinspezies (tierisches Insulin, Humaninsulin oder Humaninsulin-Analogon) und/oder Herstellungsmethode (rekombinante DNS-Technologie bzw. tierisches Insulin) kann eine Veränderung der Dosierung erforderlich machen. Bei Patienten, die Levemir verwenden, kann eine Veränderung der Dosierung gegenüber der bei ihrem üblichen Insulin angewendeten Dosis 3 erforderlich sein. Falls beim Wechsel eine Dosisanpassung erforderlich ist, kann diese bei der ersten Dosierung oder in den ersten Wochen oder Monaten nach der Umstellung notwendig sein. Levemir darf nicht intravenös gegeben werden, da es zu einer schweren Hypoglykämie führen kann. Eine intramuskuläre Gabe ist zu vermeiden. Wenn Levemir mit anderen Insulinpräparaten gemischt wird, verändert sich das Wirkprofil einer oder beider beteiligter Komponenten. Das Mischen von Levemir mit einem schnell wirkenden Insulinanalogon wie Insulinaspart führt zu einem Wirkprofil mit einer geringeren und verzögerten Maximalwirkung, verglichen mit Einzelinjektionen. Deshalb ist das Mischen von schnell wirkendem Insulin mit Levemir zu vermeiden. Es gibt nur beschränkte Daten zu Patienten mit schwerer Hypalbuminämie. Deshalb wird eine sorgfältige Überwachung dieser Patienten empfohlen. Levemir darf nicht in Insulininfusionspumpen verwendet werden. Levemir enthält m-Cresol, das allergische Reaktionen verursachen kann. 4.5 Wechselwirkungen mit anderen Arzneimitteln und sonstige Wechselwirkungen Der Glucosestoffwechsel wird von einigen Arzneimitteln beeinflusst. Die folgenden Substanzen können den Insulinbedarf senken: Antidiabetika, Monoaminoxidasehemmer (MAO-Hemmer), nichtselektive Betarezeptorenblocker, Angiotensin-Converting-Enzyme (ACE)-Hemmer, Salicylate und Alkohol. Die folgenden Substanzen können den Insulinbedarf erhöhen: Thiazide, Glucocorticoide, Schilddrüsenhormone und Betasympathomimetika, Wachstumshormone und Danazol. Betarezeptorenblocker können die Symptome einer Hypoglykämie verschleiern und die Genesung von einer Hypoglykämie verzögern. Octreotid/Lanreotid kann den Insulinbedarf sowohl senken als auch erhöhen. Alkohol kann die Blutzucker senkende Wirkung von Insulin verstärken und verlängern. 4.6 Schwangerschaft und Stillzeit Schwangerschaft: Es liegen keine klinischen Erfahrungen über die Verwendung von Insulindetemir bei Schwangeren vor. Tierexperimentelle Reproduktionsstudien haben hinsichtlich der Embryotoxizität und Teratogenität keinen Unterschied zwischen Insulindetemir und Humaninsulin gezeigt. Bei der Anwendung in der Schwangerschaft ist Vorsicht geboten. Generell sollten Frauen, die an Diabetes erkrankt sind und eine Schwangerschaft planen bzw. bereits schwanger sind, intensiver überwacht und die Blutzuckerkontrolle intensiviert werden. Im ersten Trimenon fällt gewöhnlich der Insulinbedarf, steigt aber anschließend im Verlauf des zweiten und dritten Trimenon wieder an. Nach der Entbindung geht der Insulinbedarf normalerweise innerhalb kurzer Zeit auf die Werte zurück, wie sie vor der Schwangerschaft bestanden haben. 4 Stillzeit: Es liegen keine klinischen Erfahrungen über die Verwendung von Insulindetemir während der Stillzeit vor. Bei der Anwendung während der Stillzeit ist Vorsicht geboten. Bei stillenden Frauen ist eventuell eine Anpassung der Insulindosis und der Ernährung erforderlich. 4.7 Auswirkungen auf die Verkehrstüchtigkeit und das Bedienen von Maschinen Eine Hypoglykämie kann die Konzentrations- und Reaktionsfähigkeit eines Patienten herabsetzen. Dies kann in Situationen, in denen diese Fähigkeiten von besonderer Bedeutung sind (z. B. beim Fahren eines Autos oder beim Bedienen von Maschinen) ein Risiko darstellen. Den Patienten sollte geraten werden, Vorsichtsmaßnahmen zur Vermeidung von Hypoglykämien beim Führen von Kraftfahrzeugen zu treffen. Dies ist bei Patienten mit häufigen Hypoglykämie-Episoden oder verringerter oder fehlender Wahrnehmung von Warnsymptomen einer Hypoglykämie besonders wichtig. In diesen Fällen sollte überlegt werden, ob das Führen eines Kraftfahrzeugs ratsam ist. 4.8 Nebenwirkungen Unerwünschte Arzneimittelwirkungen, die bei mit Levemir behandelten Patienten beobachtet werden, sind in erster Linie dosisabhängig und auf die pharmakologische Wirkung des Insulins zurückzuführen. Eine häufig auftretende Nebenwirkung ist die Hypoglykämie. Sie kann auftreten, wenn die Insulindosis in Relation zum Insulinbedarf zu hoch ist. Aus klinischen Studien ist bekannt, dass eine schwere Hypoglykämie, das heißt eine Hypoglykämie, bei der medizinische Hilfe durch Dritte erforderlich ist, bei ungefähr 6 % der mit Levemir behandelten Patienten auftritt. Schwere Hypoglykämien können zu Bewusstlosigkeit und/oder Krampfanfällen führen und mit vorübergehenden oder dauerhaften Störungen der Gehirnfunktion und sogar dem Tod enden. Während der Behandlung mit Levemir kommt es relativ häufig, das heißt bei 2 % der Patienten, zu Reaktionen an der Injektionsstelle. Zu diesen Reaktionen zählen Rötungen, Schwellungen und Juckreiz an der Injektionsstelle, die jedoch in der Regel wieder abklingen und im Laufe der Behandlung verschwinden. Der Gesamtanteil der behandelten Patienten, bei denen mit unerwünschten Arzneimittelwirkungen zu rechnen ist, wird auf 12 % geschätzt. Die folgende Liste gibt Auskunft über die in klinischen Studien ermittelte Häufigkeit von unerwünschten Arzneimittelwirkungen , die nach einer Gesamtbeurteilung im Zusammenhang mit Levemir stehen. Stoffwechsel- und Ernährungsstörungen Häufig (>1/100, <1/10) Hypoglykämie: Die Symptome einer Hypoglykämie treten in der Regel plötzlich auf. Diese Symptome sind kalter Schweiß, kalte blasse Haut, Ermattung, Nervosität oder Zittern, Angstgefühle, ungewöhnliche Müdigkeit und Schwäche, Verwirrung, Konzentrationsschwierigkeiten, Benommenheit, großer Hunger, Sehstörungen, Kopfschmerzen, Übelkeit und Herzklopfen. Schwere Hypoglykämien können zu Bewusstlosigkeit und/oder Krampfanfällen führen und mit vorübergehenden oder dauerhaften Störungen der Gehirnfunktion und sogar dem Tod enden. Allgemeine Erkrankungen und Beschwerden am Verabreichungsort 5 Häufig (>1/100, <1/10) Reaktionen an der Injektionsstelle: Während der Insulintherapie können Reaktionen an der Injektionsstelle (Rötungen, Schwellungen und Juckreiz an der Injektionsstelle) auftreten. Diese Reaktionen klingen jedoch in der Regel wieder ab und verschwinden im Laufe der Behandlung. Lipodystrophie: Versäumt der Patient, die Einstichstelle innerhalb des Injektionsbereichs regelmäßig zu wechseln, kann eine Lipodystrophie an der Injektionsstelle auftreten. Ödeme: Zu Beginn einer Insulintherapie können Ödeme auftreten. Diese klingen aber in der Regel wieder ab. Gelegentlich (>1/1.000, <1/100) Erkrankungen des Immunsystems Gelegentlich (>1/1.000, <1/100) Allergische Reaktionen, Urtikaria und Ausschläge: Derartige Symptome sind möglicherweise auf generalisierte Überempfindlichkeitsreaktionen zurückzuführen. Weitere Symptome einer generalisierten Überempfindlichkeitsreaktion sind Juckreiz, Schweißausbrüche, Magenbeschwerden, angioneurotische Ödeme, Atembeschwerden, Herzklopfen und niedriger Blutdruck. Generalisierte Überempfindlichkeitsreaktionen können lebensbedrohlich sein. Augenerkrankungen Gelegentlich (>1/1.000, <1/100) Refraktionsanomalien: Zu Beginn einer Insulintherapie können Refraktionsanomalien auftreten. Diese klingen aber in der Regel wieder ab. Diabetische Retinopathie: Eine langfristige Verbesserung der Blutzuckereinstellung verringert das Risiko des Fortschreitens einer diabetischen Retinopathie. Eine Intensivierung der Insulintherapie mit einer abrupten Verbesserung der Blutzuckereinstellung kann jedoch mit einer vorübergehenden Verschlechterung der diabetischen Retinopathie verbunden sein. Erkrankungen des Nervensystems Selten (> 1/10.000, <1/1.000) 4.9 Periphere Neuropathie: Eine schnelle Verbesserung der Blutzuckereinstellung kann zum Zustand einer „akuten schmerzhaften Neuropathie“ führen, der in der Regel reversibel ist. Überdosierung Für Insulin kann keine spezifische Überdosierung angegeben werden, jedoch kann sich stufenweise eine Hypoglykämie entwickeln, wenn, verglichen mit dem Bedarf des Patienten, zu hohe Dosen gegeben werden: 6 • Leichte Hypoglykämien können durch orale Gabe von Glucose bzw. zuckerhaltigen Lebensmitteln behandelt werden. Ein Diabetiker sollte deshalb immer einige zuckerhaltige Lebensmittel bei sich haben. • Schwere Hypoglykämien mit Bewusstlosigkeit werden mit intramuskulärer bzw. subkutaner Injektion von Glucagon (0,5 bis 1 mg), die von einer geübten Person gegeben wird, oder der intravenösen Gabe von Glucose von einem Arzt behandelt. Spricht der Patient nicht innerhalb von 10 bis 15 Minuten auf Glucagon an, ist Glucose intravenös zu geben. Sobald der Patient wieder bei Bewusstsein ist, empfiehlt sich die Gabe von Kohlenhydraten, um einen Rückfall zu vermeiden. 5. PHARMAKOLOGISCHE EIGENSCHAFTEN 5.1 Pharmakodynamische Eigenschaften Pharmakotherapeutische Gruppe: Antidiabetikum. Insulin und Analoga, lang wirksam. ATC-Code: A10AE [vorgeschlagen: beantragt]. Insulindetemir ist ein lösliches, lang wirkendes basales Insulinanalogon mit einer verlängerten Wirkdauer. Unter dem Gesichtspunkt der intraindividuellen Variationskoeffizienten (CV) für den gesamten und maximalen pharmakodynamischen Effekt (Tabelle 1) ist das Zeit-Wirkprofil von Insulindetemir statistisch signifikant weniger variabel als das von NPH-Insulin. Tabelle 1. Intra-individuelle Variabilität des Zeit-Wirkprofils von Insulindetemir und NPHInsulin Pharmakodynamischer Insulindetemir NPH-Insulin Endpunkt CV (%) CV (%) AUCGIR,0-24h* 27 68 GIRmax** 23 46 *Fläche unter der Kurve (Area under the curve) ** Glucose-Infusionsrate p-Wert < 0,001 für alle Vergleiche mit Insulindetemir Die verlängerte Wirkung von Insulindetemir wird durch die starke Selbstassoziation von Insulindetemir-Molekülen an der Injektionsstelle und die Albuminbindung über die FettsäureSeitenkette vermittelt. Insulindetemir wird im Vergleich zu NPH-Insulin langsamer in das periphere Zielgewebe abgegeben. Die Kombination dieser Verzögerungsmechanismen bewirkt, verglichen mit NPH-Insulin, eine reproduzierbarere Resorption und ein reproduzierbareres Wirkprofil von Insulindetemir. Die Blutzucker senkende Wirkung von Insulindetemir beruht auf der Fähigkeit des Moleküls, durch Bindung an Insulinrezeptoren in Muskel- und Fettzellen die Aufnahme von Glucose zu erhöhen. Gleichzeitig wird die Freisetzung von Glucose aus der Leber inhibiert. 7 Glucose-Infusionsrate (mg/kg/min) P h a r m a k o d y n a m i s c h e P a r a m e t e r f ü r L e v e m ir u n d N P H - In s u lin NPHIn s u li n L e v e m ir 0 ,2 E /k g 0 ,3 E /k g † W i rk d a u e r ( h ) 12 17 G IR m a x ( m g /k g /m in ) 1 ,1 1 ,4 † 0 ,4 E /k g † 0 ,3 I. E ./k g 20 13 1 ,7 1,6 g e s c h ä tz t e W e r te Z e it s e it d e r In s u lin -In je k tio n (i n S t u n d e n ) L e v e m ir … .. 0 , 2 E /k g _ __ ___ 0 ,3 E /k g . . .0 ,4 E /k g Abbildung 1: Wirkprofile von Levemir bei Patienten mit Typ 1 Diabetes. Die Wirkdauer beträgt abhängig von der Dosis bis zu 24 Stunden, sodass die Anwendung einmal oder zweimal täglich erfolgen kann. Bei zweimaliger Gabe pro Tag wird nach 2–3 Dosisgaben ein stabiler Zustand erreicht. Bei Dosierungen im Bereich von 0,2-0,4 E/kg entfaltet Levemir mehr als 50 % seiner maximalen Wirkung (Wirkmaximum) innerhalb von 3 bis 4 Stunden bis maximal ca. 14 Stunden nach Gabe der Dosis. Bei der pharmakodynamischen Antwort (Wirkmaximum, Wirkdauer, Gesamtwirkung) wird nach subkutaner Gabe eine Proportionalität zur Dosis beobachtet. In Langzeitbehandlungsstudien war der Nüchtern-Blutzuckerspiegel im Plasma von Patienten mit Typ 1 Diabetes, die mit einer Basis-Bolus-Therapie behandelt wurden, mit Levemir verbessert im Vergleich mit NPH-Insulin. Die glykämische Einstellung (HbA1c) mit Levemir ist mit NPH-Insulin vergleichbar, wobei das Risiko nächtlicher Hypoglykämien geringer und keine Gewichtszunahme damit verbunden ist. In klinischen Langzeitstudien wurde während der Behandlung mit Levemir, verglichen mit NPHInsulin, eine verringerte Tag-zu-Tag Variabilität der Nüchtern-Plasma-Glucose nachgewiesen. Die Blutzucker senkende Wirkung von Levemir wurde in klinischen Studien außerhalb eines BasisBolusschemas demonstriert. Bezüglich des HbA1c wurde allerdings außerhalb eines BasisBolusschemas Nicht-Inferiorität im Vergleich zu NPH-Insulin nicht gezeigt. In klinischen Studien waren die Hypoglykämie-Gesamtraten mit Levemir und NPH-Insulin ähnlich. Die Analysen nächtlicher Hypoglykämien bei Typ 1 Diabetes ergaben ein signifikant niedrigeres Risiko für leichte nächtliche Hypoglykämien (selbstbehandelbar und bestätigt durch kapilläre Glucosekonzentration unter 2,8 mmol/l bzw. 3,1 mmol/l, wenn als Plasmaglucose angegeben) als bei NPH-Insulin, während bei Typ 2 Diabetes kein Unterschied festgestellt wurde. Im Unterschied zu anderen Insulinen ist die intensivierte Therapie mit Levemir nicht mit einer unerwünschten Gewichtszunahme verbunden. 8 5.2 Pharmakokinetische Eigenschaften Resorption: Die maximale Serumkonzentration wird innerhalb von 6 bis 8 Stunden nach der Gabe erreicht. Bei zweimaliger Gabe pro Tag wird nach 2–3 Dosisgaben ein stabiler Zustand der Serumkonzentration erreicht. Die intraindividuelle Variabilität bei der Resorption ist bei Levemir niedriger als bei anderen Basalinsulinpräparaten. Es liegen keine geschlechtsspezifischen klinisch relevanten Unterschiede bei den pharmakokinetischen Eigenschaften von Insulindetemir vor. Die absolute Bioverfügbarkeit von Insulindetemir liegt bei subkutaner Injektion bei ungefähr 60 %. Verteilung: Ein scheinbares Verteilungsvolumen von ungefähr 0,1 l/kg für Insulindetemir weist darauf hin, dass sich ein hoher Anteil von Insulindetemir im Blutkreislauf befindet. Metabolismus: Der Abbau von Insulindetemir entspricht dem von Humaninsulin; alle gebildeten Metaboliten sind inaktiv. Die Ergebnisse der in-vitro- und in-vivo-Proteinbindungsstudien legen nahe, dass keine klinisch relevante Wechselwirkung zwischen Insulindetemir und Fettsäuren oder anderen proteingebundenen Arzneimitteln vorhanden ist. Elimination: Die terminale Halbwertszeit nach subkutaner Injektion wird durch die Resorptionsrate aus dem subkutanen Gewebe bestimmt. Die terminale Halbwertszeit liegt in Abhängigkeit von der Dosis zwischen 5 und 7 Stunden. Linearität: Bei der Serumkonzentration (maximale Konzentration, Resorptionsgrad) wird nach subkutaner Gabe im therapeutischen Dosierungsbereich eine Proportionalität zur Dosis beobachtet. Spezielle Populationen: Die pharmakokinetischen Eigenschaften von Insulindetemir wurden bei Kindern (im Alter zwischen 6 und 12 Jahren) und Jugendlichen (im Alter zwischen 13 und 17 Jahren) untersucht und mit denen von Erwachsenen mit Typ 1 Diabetes verglichen. Bei den pharmakokinetischen Eigenschaften wurden keine klinisch relevanten Unterschiede festgestellt. Es wurde kein klinisch relevanter Unterschied in der Pharmakokinetik von Insulindetemir zwischen älteren und jungen Probanden oder zwischen Probanden mit Nieren- oder Leberfunktionsstörungen und gesunden Probanden festgestellt. Auf der Grundlage der durchgeführten Studien werden keine klinisch relevanten Unterschiede in der Pharmakokinetik von Insulindetemir zwischen gesunden Probanden und Probanden mit Nieren- oder Leberfunktionsstörungen erwartet. Da bei diesen Populationen keine umfangreichen Studien der Pharmakokinetik von Insulindetemir durchgeführt wurden, wird angeraten, die Plasmaglucosekonzentration bei diesen Populationen genau zu überwachen. 5.3 Präklinische Daten zur Sicherheit Präklinische Daten, die auf konventionellen Studien zur Sicherheitspharmakologie, zur chronischen Toxizität, zur Genotoxizität und zur Reproduktionstoxizität basieren, lassen keine besonderen 9 Gefahren für den Menschen erkennen. Rezeptoraffinitätsdaten und in-vitro-Mitogenitätstests erbrachten keinen Nachweis für ein erhöhtes mitogenes Potenzial im Vergleich zu Humaninsulin. 6. PHARMAZEUTISCHE ANGABEN 6.1 Sonstige Bestandteile Mannitol Phenol m-Cresol Zinkacetat-Dihydrat Natriummonohydrogenphosphat-Dihydrat Natriumchlorid Salzsäure 2N (pH-Einstellung) Natriumhydroxid 2N (pH-Einstellung) Wasser für Injektionszwecke 6.2 Inkompatibilitäten Wenn andere Arzneimittel zu Levemir hinzugefügt werden, kann dies zum Abbau von Insulindetemir führen, z. B. wenn diese Arzneimittel Thiole oder Sulfite enthalten. Levemir sollte nicht mit Infusionslösungen gemischt werden. 6.3 Dauer der Haltbarkeit 2 Jahre. Nach dem ersten Öffnen darf das Arzneimittel für maximal 6 Wochen und nicht über 30°C gelagert werden. 6.4 Besondere Lagerungshinweise Im Kühlschrank lagern (2°C – 8°C), nicht in der Nähe eines Gefrierfachs. Nicht einfrieren. Das Behältnis im Umkarton aufbewahren, um den Inhalt vor Licht zu schützen. Nach Anbruch: Nicht im Kühlschrank lagern. Nicht über 30°C lagern. Levemir muss vor übermäßiger Hitze und Sonnenlicht geschützt werden. 6.5 Art und Inhalt des Behältnisses 3 ml Lösung in einer Zylinderampulle aus Glas (Glasart I), mit einem Kolben (Brombutylgummi) und einem Stopfen (Brombutylgummi/Polyisopren) in einem Umkarton. Packungsgrößen: 1, 5 und 10 Zylinderampullen. Es werden möglicherweise nicht alle Packungsgrößen in den Verkehr gebracht. 6.6 Hinweise für die Handhabung und Entsorgung Levemir Penfill ist für die Anwendung mit Injektionssystemen von Novo Nordisk und mit NovoFineKanülen (Injektionsnadeln) vorgesehen. Die dem Injektionssystem beiliegende detaillierte Bedienungsanleitung muss befolgt werden. Levemir darf nur von einer Person verwendet werden. Die Zylinderampulle darf nicht wieder aufgefüllt werden. 10 Levemir darf nicht verwendet werden, wenn es nicht klar und farblos aussieht. Einmal gefrorenes Levemir darf nicht mehr verwendet werden. Der Patient sollte angewiesen werden, die Injektionsnadel nach jeder Injektion zu entsorgen. Nicht verwendete Arzneimittel oder Abfallmaterial sind entsprechend den nationalen Anforderungen zu entsorgen. 7. PHARMAZEUTISCHER UNTERNEHMER Novo Nordisk A/S DK-2880 Bagsvaerd Dänemark 8. ZULASSUNGSNUMMER(N) 9. DATUM DER ZULASSUNG/VERLÄNGERUNG DER ZULASSUNG 10. STAND DER INFORMATION 11 1. BEZEICHNUNG DES ARZNEIMITTELS Levemir 100 E/ml Injektionslösung in einem Injektor, vorgefüllt 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG 1 ml enthält 100 E Insulindetemir (gentechnisch hergestellt aus rekombinanter DNS in Saccharomyces cerevisiae). 1 vorgefüllter Injektor enthält 3 ml entsprechend 300 E. Eine Einheit von Insulindetemir entspricht 0,142 mg salzfreiem, wasserfreiem Insulindetemir. Eine Einheit (E) von Insulindetemir entspricht einer I.E. von Insulin human. Sonstige Bestandteile siehe unter Abschnitt 6.1. 3. DARREICHUNGSFORM Injektionslösung in einem Injektor, vorgefüllt. FlexPen Levemir ist eine klare, farblose, neutrale Lösung. 4. KLINISCHE ANGABEN 4.1 Anwendungsgebiete Zur Behandlung des Diabetes mellitus. 4.2 Dosierung, Art und Dauer der Anwendung Levemir ist ein lang wirkendes Insulinanalogon zur Anwendung als Basalinsulin in Kombination mit einem mahlzeitenbezogenen kurz bzw. schnell wirkenden Insulin. Dosierung: Die Dosierung von Levemir muss individuell angepasst werden. Levemir muss je nach Bedarf des Patienten einmal oder zweimal täglich angewendet werden. Bei Patienten, die zur Optimierung der Blutzuckereinstellung täglich eine zweimalige Dosis benötigen, kann die zweite Dosis abends oder vor dem Zubettgehen angewendet werden. Umstellung von anderen Insulinen: Die Umstellung auf Levemir von intermediär oder lang wirkenden Insulinen kann eine Anpassung von Dosis und Zeitpunkt der Gabe erforderlich machen (siehe unter 4.4). Wie bei allen Insulinen wird eine engmaschige Überwachung des Blutzuckers während der Umstellung und in den ersten Wochen danach empfohlen. Eine begleitende antidiabetische Behandlung muss eventuell angepasst werden (Dosis und Zeitpunkt der Gabe gleichzeitig angewendeter kurz wirkender Insuline). Wie bei allen Insulinen muss bei älteren Patienten und bei Patienten mit Nieren- oder Leberfunktionsstörungen die Überwachung des Blutzuckers intensiviert und die Dosierung von Insulindetemir individuell angepasst werden. 12 Die Wirksamkeit und Sicherheit von Levemir wurde bei Kindern und Jugendlichen nicht untersucht. Eine Anpassung der Dosierung kann auch bei verstärkter körperlicher Aktivität, Änderung der Ernährungsgewohnheiten oder während Begleiterkrankungen notwendig sein. Anwendung: Zur subkutanen Anwendung. Levemir wird subkutan in den Oberschenkel, die Bauchdecke oder in den Oberarm injiziert. Wie bei Humaninsulinen können die Geschwindigkeit und das Ausmaß der Resorption von Insulindetemir bei subkutaner Injektion in die Bauchdecke oder in den Oberarm höher sein als bei Gabe in den Oberschenkel. Die Injektionsstelle sollte daher nur innerhalb der gewählten Körperregion gewechselt werden. Levemir FlexPen ist eine Packungsbeilage mit detaillierten Anwendungshinweisen beigefügt, die unbedingt befolgt werden müssen. 4.3 Gegenanzeigen Überempfindlichkeit gegen Insulindetemir oder einen der sonstigen Bestandteile. 4.4 Warnhinweise und Vorsichtsmaßnahmen für die Anwendung Eine unzureichende Dosierung oder das Unterbrechen der Therapie kann, insbesondere beim Typ 1 Diabetes, zu einer Hyperglykämie und zu diabetischer Ketoazidose führen. Die ersten Symptome einer Hyperglykämie treten in der Regel allmählich über Stunden bzw. Tage auf. Zu diesen Symptomen zählen Durstgefühl, verstärkter Harndrang, Übelkeit, Erbrechen, Benommenheit, gerötete trockene Haut, Mundtrockenheit, Appetitverlust sowie nach Aceton riechender Atem. Bei Typ 1 Diabetikern können Hyperglykämien, die nicht behandelt werden, zu einer diabetischen Ketoazidose führen, die tödlich enden kann. Eine Hypoglykämie kann auftreten, wenn die Insulindosis im Verhältnis zum Insulinbedarf zu hoch ist (siehe Abschnitt 4.8 und 4.9). Das Auslassen einer Mahlzeit oder ungeplante, anstrengende körperliche Aktivität können zu einer Hypoglykämie führen. Patienten, deren Blutzuckereinstellung sich beispielsweise durch eine intensivierte Insulintherapie deutlich verbessert hat, können die Warnsymptome einer Hypoglykämie verändert wahrnehmen und sollten dementsprechend beraten werden. Bei schon lange an Diabetes leidenden Patienten verschwinden möglicherweise die üblichen Warnsymptome. Begleiterkrankungen, insbesondere Infektionen und fiebrige Zustände, erhöhen in der Regel den Insulinbedarf des Patienten. Die Umstellung eines Patienten auf einen anderen Insulintyp oder eine andere Insulinmarke muss unter strenger ärztlicher Kontrolle erfolgen. Jede Änderung hinsichtlich Stärke, Marke (Hersteller), Insulintyp, Insulinspezies (tierisches Insulin, Humaninsulin oder Humaninsulin-Analogon) und/oder Herstellungsmethode (rekombinante DNS-Technologie bzw. tierisches Insulin) kann eine Veränderung der Dosierung erforderlich machen. Bei Patienten, die Levemir verwenden, kann eine Veränderung der Dosierung gegenüber der bei ihrem üblichen Insulin angewendeten Dosis erforderlich sein. Falls beim Wechsel eine Dosisanpassung erforderlich ist, kann diese bei der ersten Dosierung oder in den ersten Wochen oder Monaten nach der Umstellung notwendig sein. Levemir darf nicht intravenös gegeben werden, da es zu einer schweren Hypoglykämie führen kann. 13 Eine intramuskuläre Gabe ist zu vermeiden. Wenn Levemir mit anderen Insulinpräparaten gemischt wird, verändert sich das Wirkprofil einer oder beider beteiligter Komponenten. Das Mischen von Levemir mit einem schnell wirkenden Insulinanalogon wie Insulinaspart führt zu einem Wirkprofil mit einer geringeren und verzögerten Maximalwirkung, verglichen mit Einzelinjektionen. Deshalb ist das Mischen von schnell wirkendem Insulin mit Levemir zu vermeiden. Es gibt nur beschränkte Daten zu Patienten mit schwerer Hypalbuminämie. Deshalb wird eine sorgfältige Überwachung dieser Patienten empfohlen. Levemir darf nicht in Insulininfusionspumpen verwendet werden. Levemir enthält m-Cresol, das allergische Reaktionen verursachen kann. 4.5 Wechselwirkungen mit anderen Arzneimitteln und sonstige Wechselwirkungen Der Glucosestoffwechsel wird von einigen Arzneimitteln beeinflusst. Die folgenden Substanzen können den Insulinbedarf senken: Antidiabetika, Monoaminoxidasehemmer (MAO-Hemmer), nichtselektive Betarezeptorenblocker, Angiotensin-Converting-Enzyme (ACE)-Hemmer, Salicylate und Alkohol. Die folgenden Substanzen können den Insulinbedarf erhöhen: Thiazide, Glucocorticoide, Schilddrüsenhormone und Betasympathomimetika, Wachstumshormone und Danazol. Betarezeptorenblocker können die Symptome einer Hypoglykämie verschleiern und die Genesung von einer Hypoglykämie verzögern. Octreotid/Lanreotid kann den Insulinbedarf sowohl senken als auch erhöhen. Alkohol kann die Blutzucker senkende Wirkung von Insulin verstärken und verlängern. 4.6 Schwangerschaft und Stillzeit Schwangerschaft: Es liegen keine klinischen Erfahrungen über die Verwendung von Insulindetemir bei Schwangeren vor. Tierexperimentelle Reproduktionsstudien haben hinsichtlich der Embryotoxizität und Teratogenität keinen Unterschied zwischen Insulindetemir und Humaninsulin gezeigt. Bei der Anwendung in der Schwangerschaft ist Vorsicht geboten. Generell sollten Frauen, die an Diabetes erkrankt sind und eine Schwangerschaft planen bzw. bereits schwanger sind, intensiver überwacht und die Blutzuckerkontrolle intensiviert werden. Im ersten Trimenon fällt gewöhnlich der Insulinbedarf, steigt aber anschließend im Verlauf des zweiten und dritten Trimenon wieder an. Nach der Entbindung geht der Insulinbedarf normalerweise innerhalb kurzer Zeit auf die Werte zurück, wie sie vor der Schwangerschaft bestanden haben. Stillzeit: Es liegen keine klinischen Erfahrungen über die Verwendung von Insulindetemir während der Stillzeit vor. Bei der Anwendung während der Stillzeit ist Vorsicht geboten. Bei stillenden Frauen ist eventuell eine Anpassung der Insulindosis und der Ernährung erforderlich. 14 4.7 Auswirkungen auf die Verkehrstüchtigkeit und das Bedienen von Maschinen Eine Hypoglykämie kann die Konzentrations- und Reaktionsfähigkeit eines Patienten herabsetzen. Dies kann in Situationen, in denen diese Fähigkeiten von besonderer Bedeutung sind (z. B. beim Fahren eines Autos oder beim Bedienen von Maschinen) ein Risiko darstellen. Den Patienten sollte geraten werden, Vorsichtsmaßnahmen zur Vermeidung von Hypoglykämien beim Führen von Kraftfahrzeugen zu treffen. Dies ist bei Patienten mit häufigen Hypoglykämie-Episoden oder verringerter oder fehlender Wahrnehmung von Warnsymptomen einer Hypoglykämie besonders wichtig. In diesen Fällen sollte überlegt werden, ob das Führen eines Kraftfahrzeugs ratsam ist. 4.8 Nebenwirkungen Unerwünschte Arzneimittelwirkungen, die bei mit Levemir behandelten Patienten beobachtet werden, sind in erster Linie dosisabhängig und auf die pharmakologische Wirkung des Insulins zurückzuführen. Eine häufig auftretende Nebenwirkung ist die Hypoglykämie. Sie kann auftreten, wenn die Insulindosis in Relation zum Insulinbedarf zu hoch ist. Aus klinischen Studien ist bekannt, dass eine schwere Hypoglykämie, das heißt eine Hypoglykämie, bei der medizinische Hilfe durch Dritte erforderlich ist, bei ungefähr 6 % der mit Levemir behandelten Patienten auftritt. Schwere Hypoglykämien können zu Bewusstlosigkeit und/oder Krampfanfällen führen und mit vorübergehenden oder dauerhaften Störungen der Gehirnfunktion und sogar dem Tod enden. Während der Behandlung mit Levemir kommt es relativ häufig, das heißt bei 2 % der Patienten, zu Reaktionen an der Injektionsstelle. Zu diesen Reaktionen zählen Rötungen, Schwellungen und Juckreiz an der Injektionsstelle, die jedoch in der Regel wieder abklingen und im Laufe der Behandlung verschwinden. Der Gesamtanteil der behandelten Patienten, bei denen mit unerwünschten Arzneimittelwirkungen zu rechnen ist, wird auf 12 % geschätzt. Die folgende Liste gibt Auskunft über die in klinischen Studien ermittelte Häufigkeit von unerwünschten Arzneimittelwirkungen, die nach einer Gesamtbeurteilung im Zusammenhang mit Levemir stehen. Stoffwechsel- und Ernährungsstörungen Häufig (>1/100, <1/10) Hypoglykämie: Die Symptome einer Hypoglykämie treten in der Regel plötzlich auf. Diese Symptome sind kalter Schweiß, kalte blasse Haut, Ermattung, Nervosität oder Zittern, Angstgefühle, ungewöhnliche Müdigkeit und Schwäche, Verwirrung, Konzentrationsschwierigkeiten, Benommenheit, großer Hunger, Sehstörungen, Kopfschmerzen, Übelkeit und Herzklopfen. Schwere Hypoglykämien können zu Bewusstlosigkeit und/oder Krampfanfällen führen und mit vorübergehenden oder dauerhaften Störungen der Gehirnfunktion und sogar dem Tod enden. Allgemeine Erkrankungen und Beschwerden am Verabreichungsort Häufig (>1/100, <1/10) Reaktionen an der Injektionsstelle: Während der Insulintherapie können Reaktionen an der Injektionsstelle (Rötungen, Schwellungen und Juckreiz an der Injektionsstelle) auftreten. Diese Reaktionen klingen jedoch in der Regel wieder ab und verschwinden im Laufe der 15 Gelegentlich (>1/1.000, <1/100) Behandlung. Lipodystrophie: Versäumt der Patient, die Einstichstelle innerhalb des Injektionsbereichs regelmäßig zu wechseln, kann eine Lipodystrophie an der Injektionsstelle auftreten. Ödeme: Zu Beginn einer Insulintherapie können Ödeme auftreten. Diese klingen aber in der Regel wieder ab. Erkrankungen des Immunsystems Gelegentlich (>1/1.000, <1/100) Allergische Reaktionen, Urtikaria und Ausschläge: Derartige Symptome sind möglicherweise auf generalisierte Überempfindlichkeitsreaktionen zurückzuführen. Weitere Symptome einer generalisierten Überempfindlichkeitsreaktion sind Juckreiz, Schweißausbrüche, Magenbeschwerden, angioneurotische Ödeme, Atembeschwerden, Herzklopfen und niedriger Blutdruck. Generalisierte Überempfindlichkeitsreaktionen können lebensbedrohlich sein. Augenerkrankungen Gelegentlich (>1/1.000, <1/100) Refraktionsanomalien: Zu Beginn einer Insulintherapie können Refraktionsanomalien auftreten. Diese klingen aber in der Regel wieder ab. Diabetische Retinopathie: Eine langfristige Verbesserung der Blutzuckereinstellung verringert das Risiko des Fortschreitens einer diabetischen Retinopathie. Eine Intensivierung der Insulintherapie mit einer abrupten Verbesserung der Blutzuckereinstellung kann jedoch mit einer vorübergehenden Verschlechterung der diabetischen Retinopathie verbunden sein. Erkrankungen des Nervensystems Selten (> 1/10.000, <1/1.000) 4.9 Periphere Neuropathie: Eine schnelle Verbesserung der Blutzuckereinstellung kann zum Zustand einer „akuten schmerzhaften Neuropathie“ führen, der in der Regel reversibel ist. Überdosierung Für Insulin kann keine spezifische Überdosierung angegeben werden, jedoch kann sich stufenweise eine Hypoglykämie entwickeln, wenn, verglichen mit dem Bedarf des Patienten, zu hohe Dosen gegeben werden: • Leichte Hypoglykämien können durch orale Gabe von Glucose bzw. zuckerhaltigen Lebensmitteln behandelt werden. Ein Diabetiker sollte deshalb immer einige zuckerhaltige Lebensmittel bei sich haben. • Schwere Hypoglykämien mit Bewusstlosigkeit werden mit intramuskulärer bzw. subkutaner Injektion von Glucagon (0,5 bis 1 mg), die von einer geübten Person gegeben wird, oder der 16 intravenösen Gabe von Glucose von einem Arzt behandelt. Spricht der Patient nicht innerhalb von 10 bis 15 Minuten auf Glucagon an, ist Glucose intravenös zu geben. Sobald der Patient wieder bei Bewusstsein ist, empfiehlt sich die Gabe von Kohlenhydraten, um einen Rückfall zu vermeiden. 5. PHARMAKOLOGISCHE EIGENSCHAFTEN 5.1 Pharmakodynamische Eigenschaften Pharmakotherapeutische Gruppe: Antidiabetikum. Insulin und Analoga, lang wirksam. ATC-Code: A10AE [vorgeschlagen: beantragt]. Insulindetemir ist ein lösliches, lang wirkendes basales Insulinanalogon mit einer verlängerten Wirkdauer. Unter dem Gesichtspunkt der intraindividuellen Variationskoeffizienten (CV) für den gesamten und maximalen pharmakodynamischen Effekt (Tabelle 1) ist das Zeit-Wirkprofil von Insulindetemir statistisch signifikant weniger variabel als das von NPH-Insulin. Tabelle 1. Intra-individuelle Variabilität des Zeit-Wirkprofils von Insulindetemir und NPHInsulin Pharmakodynamischer Insulindetemir NPH-Insulin Endpunkt CV (%) CV (%) AUCGIR,0-24h* 27 68 GIRmax** 23 46 *Fläche unter der Kurve (Area under the curve) ** Glucose-Infusionsrate p-Wert < 0,001 für alle Vergleiche mit Insulindetemir Die verlängerte Wirkung von Insulindetemir wird durch die starke Selbstassoziation von Insulindetemir-Molekülen an der Injektionsstelle und die Albuminbindung über die FettsäureSeitenkette vermittelt. Insulindetemir wird im Vergleich zu NPH-Insulin langsamer in das periphere Zielgewebe abgegeben. Die Kombination dieser Verzögerungsmechanismen bewirkt, verglichen mit NPH-Insulin, eine reproduzierbarere Resorption und ein reproduzierbareres Wirkprofil von Insulindetemir. Die Blutzucker senkende Wirkung von Insulindetemir beruht auf der Fähigkeit des Moleküls, durch Bindung an Insulinrezeptoren in Muskel- und Fettzellen die Aufnahme von Glucose zu erhöhen. Gleichzeitig wird die Freisetzung von Glucose aus der Leber inhibiert. 17 Glucose-Infusionsrate (mg/kg/min) P h a r m a k o d y n a m i s c h e P a r a m e t e r f ü r L e v e m ir u n d N P H - In s u lin NPHIn s u li n L e v e m ir 0 ,2 E /k g 0 ,3 E /k g † W i rk d a u e r ( h ) 12 17 G IR m a x ( m g /k g /m in ) 1 ,1 1 ,4 † † 0 ,4 E /k g 0 ,3 I. E ./k g 20 13 1 ,7 1,6 g e s c h ä tz t e W e r te Z e it s e it d e r In s u lin -In je k tio n (i n S t u n d e n ) L e v e m ir … .. 0 , 2 E /k g _ __ ___ 0 ,3 E /k g . . .0 ,4 E /k g Abbildung 1: Wirkprofile von Levemir bei Patienten mit Typ 1 Diabetes. Die Wirkdauer beträgt abhängig von der Dosis bis zu 24 Stunden, sodass die Anwendung einmal oder zweimal täglich erfolgen kann. Bei zweimaliger Gabe pro Tag wird nach 2–3 Dosisgaben ein stabiler Zustand erreicht. Bei Dosierungen im Bereich von 0,2-0,4 E/kg entfaltet Levemir mehr als 50 % seiner maximalen Wirkung (Wirkmaximum) innerhalb von 3 bis 4 Stunden bis maximal ca. 14 Stunden nach Gabe der Dosis. Bei der pharmakodynamischen Antwort (Wirkmaximum, Wirkdauer, Gesamtwirkung) wird nach subkutaner Gabe eine Proportionalität zur Dosis beobachtet. In Langzeitbehandlungsstudien war der Nüchtern-Blutzuckerspiegel im Plasma von Patienten mit Typ 1 Diabetes, die mit einer Basis-Bolus-Therapie behandelt wurden, mit Levemir verbessert im Vergleich mit NPH-Insulin. Die glykämische Einstellung (HbA1c) mit Levemir ist mit NPH-Insulin vergleichbar, wobei das Risiko nächtlicher Hypoglykämien geringer und keine Gewichtszunahme damit verbunden ist. In klinischen Langzeitstudien wurde während der Behandlung mit Levemir, verglichen mit NPHInsulin, eine verringerte Tag-zu-Tag Variabilität der Nüchtern-Plasma-Glucose nachgewiesen. Die Blutzucker senkende Wirkung von Levemir wurde in klinischen Studien außerhalb eines BasisBolusschemas demonstriert. Bezüglich des HbA1c wurde allerdings außerhalb eines BasisBolusschemas Nicht-Inferiorität im Vergleich zu NPH-Insulin nicht gezeigt. In klinischen Studien waren die Hypoglykämie-Gesamtraten mit Levemir und NPH-Insulin ähnlich. Die Analysen nächtlicher Hypoglykämien bei Typ 1 Diabetes ergaben ein signifikant niedrigeres Risiko für leichte nächtliche Hypoglykämien (selbstbehandelbar und bestätigt durch kapilläre Glucosekonzentration unter 2,8 mmol/l bzw. 3,1 mmol/l, wenn als Plasmaglucose angegeben) als bei NPH-Insulin, während bei Typ 2 Diabetes kein Unterschied festgestellt wurde. Im Unterschied zu anderen Insulinen ist die intensivierte Therapie mit Levemir nicht mit einer unerwünschten Gewichtszunahme verbunden. 5.2 Pharmakokinetische Eigenschaften Resorption: Die maximale Serumkonzentration wird innerhalb von 6 bis 8 Stunden nach der Gabe erreicht. 18 Bei zweimaliger Gabe pro Tag wird nach 2–3 Dosisgaben ein stabiler Zustand der Serumkonzentration erreicht. Die intraindividuelle Variabilität bei der Resorption ist bei Levemir niedriger als bei anderen Basalinsulinpräparaten. Es liegen keine geschlechtsspezifischen klinisch relevanten Unterschiede bei den pharmakokinetischen Eigenschaften von Insulindetemir vor. Die absolute Bioverfügbarkeit von Insulindetemir liegt bei subkutaner Injektion bei ungefähr 60 %. Verteilung: Ein scheinbares Verteilungsvolumen von ungefähr 0,1 l/kg für Insulindetemir weist darauf hin, dass sich ein hoher Anteil von Insulindetemir im Blutkreislauf befindet. Metabolismus: Der Abbau von Insulindetemir entspricht dem von Humaninsulin; alle gebildeten Metaboliten sind inaktiv. Die Ergebnisse der in-vitro- und in-vivo-Proteinbindungsstudien legen nahe, dass keine klinisch relevante Wechselwirkung zwischen Insulindetemir und Fettsäuren oder anderen proteingebundenen Arzneimitteln vorhanden ist. Elimination: Die terminale Halbwertszeit nach subkutaner Injektion wird durch die Resorptionsrate aus dem subkutanen Gewebe bestimmt. Die terminale Halbwertszeit liegt in Abhängigkeit von der Dosis zwischen 5 und 7 Stunden. Linearität: Bei der Serumkonzentration (maximale Konzentration, Resorptionsgrad) wird nach subkutaner Gabe im therapeutischen Dosierungsbereich eine Proportionalität zur Dosis beobachtet. Spezielle Populationen: Die pharmakokinetischen Eigenschaften von Insulindetemir wurden bei Kindern (im Alter zwischen 6 und 12 Jahren) und Jugendlichen (im Alter zwischen 13 und 17 Jahren) untersucht und mit denen von Erwachsenen mit Typ 1 Diabetes verglichen. Bei den pharmakokinetischen Eigenschaften wurden keine klinisch relevanten Unterschiede festgestellt. Es wurde kein klinisch relevanter Unterschied in der Pharmakokinetik von Insulindetemir zwischen älteren und jungen Probanden oder zwischen Probanden mit Nieren- oder Leberfunktionsstörungen und gesunden Probanden festgestellt. Auf der Grundlage der durchgeführten Studien werden keine klinisch relevanten Unterschiede in der Pharmakokinetik von Insulindetemir zwischen gesunden Probanden und Probanden mit Nieren- oder Leberfunktionsstörungen erwartet. Da bei diesen Populationen keine umfangreichen Studien der Pharmakokinetik von Insulindetemir durchgeführt wurden, wird angeraten, die Plasmaglucosekonzentration bei diesen Populationen genau zu überwachen. 5.3 Präklinische Daten zur Sicherheit Präklinische Daten, die auf konventionellen Studien zur Sicherheitspharmakologie, zur chronischen Toxizität, zur Genotoxizität und zur Reproduktionstoxizität basieren, lassen keine besonderen Gefahren für den Menschen erkennen. Rezeptoraffinitätsdaten und in-vitro-Mitogenitätstests erbrachten keinen Nachweis für ein erhöhtes mitogenes Potenzial im Vergleich zu Humaninsulin. 19 6. PHARMAZEUTISCHE ANGABEN 6.1 Sonstige Bestandteile Mannitol Phenol m-Cresol Zinkacetat-Dihydrat Natriummonohydrogenphosphat-Dihydrat Natriumchlorid Salzsäure 2N (pH-Einstellung) Natriumhydroxid 2N (pH-Einstellung) Wasser für Injektionszwecke 6.2 Inkompatibilitäten Wenn andere Arzneimittel zu Levemir hinzugefügt werden, kann dies zum Abbau von Insulindetemir führen, z. B. wenn diese Arzneimittel Thiole oder Sulfite enthalten. Levemir sollte nicht mit Infusionslösungen gemischt werden. 6.3 Dauer der Haltbarkeit 2 Jahre. Nach dem ersten Öffnen darf das Arzneimittel für maximal 6 Wochen und nicht über 30°C gelagert werden. 6.4 Besondere Lagerungshinweise Im Kühlschrank lagern (2°C – 8°C), nicht in der Nähe eines Gefrierfachs. Nicht einfrieren. Die Verschlusskappe aufgesetzt lassen, wenn der Levemir FlexPen nicht verwendet wird, um den Inhalt vor Licht zuschützen,. Nach Anbruch: Nicht im Kühlschrank lagern. Nicht über 30°C lagern. Levemir muss vor übermäßiger Hitze und Sonnenlicht geschützt werden. 6.5 Art und Inhalt des Behältnisses 3 ml Lösung in einer Zylinderampulle aus Glas (Glasart I), mit einem Kolben (Brombutylgummi) und einem Stopfen (Brombutylgummi/Polyisopren) in einem vorgefüllten Injektor (MehrdosenEinwegspritze) (aus Polypropylen). Packungsgrößen: 1, 5 und 10 vorgefüllte Injektoren. Es werden möglicherweise nicht alle Packungsgrößen in den Verkehr gebracht. 6.6 Hinweise für die Handhabung und Entsorgung Levemir darf nur von einer Person verwendet werden. Die Zylinderampulle darf nicht wieder aufgefüllt werden. Levemir darf nicht verwendet werden, wenn es nicht klar und farblos aussieht. Einmal gefrorenes Levemir darf nicht mehr verwendet werden. Der Patient sollte angewiesen werden, die Injektionsnadel nach jeder Injektion zu entsorgen. Nicht verwendete Arzneimittel oder Abfallmaterial sind entsprechend den nationalen Anforderungen zu entsorgen. 20 7. PHARMAZEUTISCHER UNTERNEHMER Novo Nordisk A/S DK-2880 Bagsvaerd Dänemark 8. ZULASSUNGSNUMMER(N) 9. DATUM DER ZULASSUNG/VERLÄNGERUNG DER ZULASSUNG 10. STAND DER INFORMATION 21 1. BEZEICHNUNG DES ARZNEIMITTELS Levemir 100 E/ml Injektionslösung in einem Injektor, vorgefüllt 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG 1 ml enthält 100 E Insulindetemir (gentechnisch hergestellt aus rekombinanter DNS in Saccharomyces cerevisiae). 1 vorgefüllter Injektor enthält 3 ml entsprechend 300 E. Eine Einheit von Insulindetemir entspricht 0,142 mg salzfreiem, wasserfreiem Insulindetemir. Eine Einheit (E) von Insulindetemir entspricht einer I.E. von Insulin human. Sonstige Bestandteile siehe unter Abschnitt 6.1. 3. DARREICHUNGSFORM Injektionslösung in einem Injektor, vorgefüllt. InnoLet Levemir ist eine klare, farblose, neutrale Lösung. 4. KLINISCHE ANGABEN 4.1 Anwendungsgebiete Zur Behandlung des Diabetes mellitus. 4.2 Dosierung, Art und Dauer der Anwendung Levemir ist ein lang wirkendes Insulinanalogon zur Anwendung als Basalinsulin in Kombination mit einem mahlzeitenbezogenen kurz bzw. schnell wirkenden Insulin. Dosierung: Die Dosierung von Levemir muss individuell angepasst werden. Levemir muss je nach Bedarf des Patienten einmal oder zweimal täglich angewendet werden. Bei Patienten, die zur Optimierung der Blutzuckereinstellung täglich eine zweimalige Dosis benötigen, kann die zweite Dosis abends oder vor dem Zubettgehen angewendet werden. Umstellung von anderen Insulinen: Die Umstellung auf Levemir von intermediär oder lang wirkenden Insulinen kann eine Anpassung von Dosis und Zeitpunkt der Gabe erforderlich machen (siehe unter 4.4). Wie bei allen Insulinen wird eine engmaschige Überwachung des Blutzuckers während der Umstellung und in den ersten Wochen danach empfohlen. Eine begleitende antidiabetische Behandlung muss eventuell angepasst werden (Dosis und Zeitpunkt der Gabe gleichzeitig angewendeter kurz wirkender Insuline). Wie bei allen Insulinen muss bei älteren Patienten und bei Patienten mit Nieren- oder Leberfunktionsstörungen die Überwachung des Blutzuckers intensiviert und die Dosierung von Insulindetemir individuell angepasst werden. 22 Die Wirksamkeit und Sicherheit von Levemirwurde bei Kindern und Jugendlichen nicht untersucht. Eine Anpassung der Dosierung kann auch bei verstärkter körperlicher Aktivität, Änderung der Ernährungsgewohnheiten oder während Begleiterkrankungen notwendig sein. Anwendung: Zur subkutanen Anwendung. Levemir wird subkutan in den Oberschenkel, die Bauchdecke oder in den Oberarm injiziert. Wie bei Humaninsulinen können die Geschwindigkeit und das Ausmaß der Resorption von Insulindetemir bei subkutaner Injektion in die Bauchdecke oder in den Oberarm höher sein als bei Gabe in den Oberschenkel. Die Injektionsstelle sollte daher nur innerhalb der gewählten Körperregion gewechselt werden. Levemir InnoLet ist eine Packungsbeilage mit detaillierten Anwendungshinweisen beigefügt, die unbedingt befolgt werden müssen. 4.3 Gegenanzeigen Überempfindlichkeit gegen Insulindetemir oder einen der sonstigen Bestandteile. 4.4 Warnhinweise und Vorsichtsmaßnahmen für die Anwendung Eine unzureichende Dosierung oder das Unterbrechen der Therapie kann, insbesondere beim Typ 1 Diabetes, zu einer Hyperglykämie und zu diabetischer Ketoazidose führen. Die ersten Symptome einer Hyperglykämie treten in der Regel allmählich über Stunden bzw. Tage auf. Zu diesen Symptomen zählen Durstgefühl, verstärkter Harndrang, Übelkeit, Erbrechen, Benommenheit, gerötete trockene Haut, Mundtrockenheit, Appetitverlust sowie nach Aceton riechender Atem. Bei Typ 1 Diabetikern können Hyperglykämien, die nicht behandelt werden, zu einer diabetischen Ketoazidose führen, die tödlich enden kann. Eine Hypoglykämie kann auftreten, wenn die Insulindosis im Verhältnis zum Insulinbedarf zu hoch ist (siehe Abschnitt 4.8 und 4.9). Das Auslassen einer Mahlzeit oder ungeplante, anstrengende körperliche Aktivität können zu einer Hypoglykämie führen. Patienten, deren Blutzuckereinstellung sich beispielsweise durch eine intensivierte Insulintherapie deutlich verbessert hat, können die Warnsymptome einer Hypoglykämie verändert wahrnehmen und sollten dementsprechend beraten werden. Bei schon lange an Diabetes leidenden Patienten verschwinden möglicherweise die üblichen Warnsymptome. Begleiterkrankungen, insbesondere Infektionen und fiebrige Zustände, erhöhen in der Regel den Insulinbedarf des Patienten. Die Umstellung eines Patienten auf einen anderen Insulintyp oder eine andere Insulinmarke muss unter strenger ärztlicher Kontrolle erfolgen. Jede Änderung hinsichtlich Stärke, Marke (Hersteller), Insulintyp, Insulinspezies (tierisches Insulin, Humaninsulin oder Humaninsulin-Analogon) und/oder Herstellungsmethode (rekombinante DNS-Technologie bzw. tierisches Insulin) kann eine Veränderung der Dosierung erforderlich machen. Bei Patienten, die Levemir verwenden, kann eine Veränderung der Dosierung gegenüber der bei ihrem üblichen Insulin angewendeten Dosis erforderlich sein. Falls beim Wechsel eine Dosisanpassung erforderlich ist, kann diese bei der ersten Dosierung oder in den ersten Wochen oder Monaten nach der Umstellung notwendig sein. Levemir darf nicht intravenös gegeben werden, da es zu einer schweren Hypoglykämie führen kann. 23 Eine intramuskuläre Gabe ist zu vermeiden. Wenn Levemir mit anderen Insulinpräparaten gemischt wird, verändert sich das Wirkprofil einer oder beider beteiligter Komponenten. Das Mischen von Levemir mit einem schnell wirkenden Insulinanalogon wie Insulinaspart führt zu einem Wirkprofil mit einer geringeren und verzögerten Maximalwirkung, verglichen mit Einzelinjektionen. Deshalb ist das Mischen von schnell wirkendem Insulin mit Levemir zu vermeiden. Es gibt nur beschränkte Daten zu Patienten mit schwerer Hypalbuminämie. Deshalb wird eine sorgfältige Überwachung dieser Patienten empfohlen. Levemir darf nicht in Insulininfusionspumpen verwendet werden. Levemir enthält m-Cresol, das allergische Reaktionen verursachen kann. 4.5 Wechselwirkungen mit anderen Arzneimitteln und sonstige Wechselwirkungen Der Glucosestoffwechsel wird von einigen Arzneimitteln beeinflusst. Die folgenden Substanzen können den Insulinbedarf senken: Antidiabetika, Monoaminoxidasehemmer (MAO-Hemmer), nichtselektive Betarezeptorenblocker, Angiotensin-Converting-Enzyme (ACE)-Hemmer, Salicylate und Alkohol. Die folgenden Substanzen können den Insulinbedarf erhöhen: Thiazide, Glucocorticoide, Schilddrüsenhormone und Betasympathomimetika, Wachstumshormone und Danazol. Betarezeptorenblocker können die Symptome einer Hypoglykämie verschleiern und die Genesung von einer Hypoglykämie verzögern. Octreotid/Lanreotid kann den Insulinbedarf sowohl senken als auch erhöhen. Alkohol kann die Blutzucker senkende Wirkung von Insulin verstärken und verlängern. 4.6 Schwangerschaft und Stillzeit Schwangerschaft: Es liegen keine klinischen Erfahrungen über die Verwendung von Insulindetemir bei Schwangeren vor. Tierexperimentelle Reproduktionsstudien haben hinsichtlich der Embryotoxizität und Teratogenität keinen Unterschied zwischen Insulindetemir und Humaninsulin gezeigt. Bei der Anwendung in der Schwangerschaft ist Vorsicht geboten. Generell sollten Frauen, die an Diabetes erkrankt sind und eine Schwangerschaft planen bzw. bereits schwanger sind, intensiver überwacht und die Blutzuckerkontrolle intensiviert werden. Im ersten Trimenon fällt gewöhnlich der Insulinbedarf, steigt aber anschließend im Verlauf des zweiten und dritten Trimenon wieder an. Nach der Entbindung geht der Insulinbedarf normalerweise innerhalb kurzer Zeit auf die Werte zurück, wie sie vor der Schwangerschaft bestanden haben. 24 Stillzeit: Es liegen keine klinischen Erfahrungen über die Verwendung von Insulindetemir während der Stillzeit vor. Bei der Anwendung während der Stillzeit ist Vorsicht geboten. Bei stillenden Frauen ist eventuell eine Anpassung der Insulindosis und der Ernährung erforderlich. 4.7 Auswirkungen auf die Verkehrstüchtigkeit und das Bedienen von Maschinen Eine Hypoglykämie kann die Konzentrations- und Reaktionsfähigkeit eines Patienten herabsetzen. Dies kann in Situationen, in denen diese Fähigkeiten von besonderer Bedeutung sind (z. B. beim Fahren eines Autos oder beim Bedienen von Maschinen) ein Risiko darstellen. Den Patienten sollte geraten werden, Vorsichtsmaßnahmen zur Vermeidung von Hypoglykämien beim Führen von Kraftfahrzeugen zu treffen. Dies ist bei Patienten mit häufigen Hypoglykämie-Episoden oder verringerter oder fehlender Wahrnehmung von Warnsymptomen einer Hypoglykämie besonders wichtig. In diesen Fällen sollte überlegt werden, ob das Führen eines Kraftfahrzeugs ratsam ist. 4.8 Nebenwirkungen Unerwünschte Arzneimittelwirkungen, die bei mit Levemir behandelten Patienten beobachtet werden, sind in erster Linie dosisabhängig und auf die pharmakologische Wirkung des Insulins zurückzuführen. Eine häufig auftretende Nebenwirkung ist die Hypoglykämie. Sie kann auftreten, wenn die Insulindosis in Relation zum Insulinbedarf zu hoch ist. Aus klinischen Studien ist bekannt, dass eine schwere Hypoglykämie, das heißt eine Hypoglykämie, bei der medizinische Hilfe durch Dritte erforderlich ist, bei ungefähr 6 % der mit Levemir behandelten Patienten auftritt. Schwere Hypoglykämien können zu Bewusstlosigkeit und/oder Krampfanfällen führen und mit vorübergehenden oder dauerhaften Störungen der Gehirnfunktion und sogar dem Tod enden. Während der Behandlung mit Levemir kommt es relativ häufig, das heißt bei 2 % der Patienten, zu Reaktionen an der Injektionsstelle. Zu diesen Reaktionen zählen Rötungen, Schwellungen und Juckreiz an der Injektionsstelle, die jedoch in der Regel wieder abklingen und im Laufe der Behandlung verschwinden. Der Gesamtanteil der behandelten Patienten, bei denen mit unerwünschten Arzneimittelwirkungen zu rechnen ist, wird auf 12 % geschätzt. Die folgende Liste gibt Auskunft über die in klinischen Studien ermittelte Häufigkeit von unerwünschten Arzneimittelwirkungen, die nach einer Gesamtbeurteilung im Zusammenhang mit Levemir stehen. Stoffwechsel- und Ernährungsstörungen Häufig (>1/100, <1/10) Hypoglykämie: Die Symptome einer Hypoglykämie treten in der Regel plötzlich auf. Diese Symptome sind kalter Schweiß, kalte blasse Haut, Ermattung, Nervosität oder Zittern, Angstgefühle, ungewöhnliche Müdigkeit und Schwäche, Verwirrung, Konzentrationsschwierigkeiten, Benommenheit, großer Hunger, Sehstörungen, Kopfschmerzen, Übelkeit und Herzklopfen. Schwere Hypoglykämien können zu Bewusstlosigkeit und/oder Krampfanfällen führen und mit vorübergehenden oder dauerhaften Störungen der Gehirnfunktion und sogar dem Tod enden. Allgemeine Erkrankungen und Beschwerden am Verabreichungsort 25 Häufig (>1/100, <1/10) Gelegentlich (>1/1.000, <1/100) Reaktionen an der Injektionsstelle: Während der Insulintherapie können Reaktionen an der Injektionsstelle (Rötungen, Schwellungen und Juckreiz an der Injektionsstelle) auftreten. Diese Reaktionen klingen jedoch in der Regel wieder ab und verschwinden im Laufe der Behandlung. Lipodystrophie: Versäumt der Patient, die Einstichstelle innerhalb des Injektionsbereichs regelmäßig zu wechseln, kann eine Lipodystrophie an der Injektionsstelle auftreten. Ödeme: Zu Beginn einer Insulintherapie können Ödeme auftreten. Diese klingen aber in der Regel wieder ab. Erkrankungen des Immunsystems Gelegentlich (>1/1.000, <1/100) Allergische Reaktionen, Urtikaria und Ausschläge: Derartige Symptome sind möglicherweise auf generalisierte Überempfindlichkeitsreaktionen zurückzuführen. Weitere Symptome einer generalisierten Überempfindlichkeitsreaktion sind Juckreiz, Schweißausbrüche, Magenbeschwerden, angioneurotische Ödeme, Atembeschwerden, Herzklopfen und niedriger Blutdruck. Generalisierte Überempfindlichkeitsreaktionen können lebensbedrohlich sein. Augenerkrankungen Gelegentlich (>1/1.000, <1/100) Refraktionsanomalien: Zu Beginn einer Insulintherapie können Refraktionsanomalien auftreten. Diese klingen aber in der Regel wieder ab. Diabetische Retinopathie: Eine langfristige Verbesserung der Blutzuckereinstellung verringert das Risiko des Fortschreitens einer diabetischen Retinopathie. Eine Intensivierung der Insulintherapie mit einer abrupten Verbesserung der Blutzuckereinstellung kann jedoch mit einer vorübergehenden Verschlechterung der diabetischen Retinopathie verbunden sein. Erkrankungen des Nervensystems Selten (> 1/10.000, <1/1.000) Periphere Neuropathie: Eine schnelle Verbesserung der Blutzuckereinstellung kann zum Zustand einer „akuten schmerzhaften Neuropathie“ führen, der in der Regel reversibel ist. 26 4.9 Überdosierung Für Insulin kann keine spezifische Überdosierung angegeben werden, jedoch kann sich stufenweise eine Hypoglykämie entwickeln, wenn, verglichen mit dem Bedarf des Patienten, zu hohe Dosen gegeben werden: • Leichte Hypoglykämien können durch orale Gabe von Glucose bzw. zuckerhaltigen Lebensmitteln behandelt werden. Ein Diabetiker sollte deshalb immer einige zuckerhaltige Lebensmittel bei sich haben. • Schwere Hypoglykämien mit Bewusstlosigkeit werden mit intramuskulärer bzw. subkutaner Injektion von Glucagon (0,5 bis 1 mg), die von einer geübten Person gegeben wird, oder der intravenösen Gabe von Glucose von einem Arzt behandelt. Spricht der Patient nicht innerhalb von 10 bis 15 Minuten auf Glucagon an, ist Glucose intravenös zu geben. Sobald der Patient wieder bei Bewusstsein ist, empfiehlt sich die Gabe von Kohlenhydraten, um einen Rückfall zu vermeiden. 5. PHARMAKOLOGISCHE EIGENSCHAFTEN 5.1 Pharmakodynamische Eigenschaften Pharmakotherapeutische Gruppe: Antidiabetikum. Insulin und Analoga, lang wirksam. ATC-Code: A10AE [vorgeschlagen: beantragt]. Insulindetemir ist ein lösliches, lang wirkendes basales Insulinanalogon mit einer verlängerten Wirkdauer. Unter dem Gesichtspunkt der intraindividuellen Variationskoeffizienten (CV) für den gesamten und maximalen pharmakodynamischen Effekt (Tabelle 1) ist das Zeit-Wirkprofil von Insulindetemir statistisch signifikant weniger variabel als das von NPH-Insulin. Tabelle 1. Intra-individuelle Variabilität des Zeit-Wirkprofils von Insulindetemir und NPHInsulin Pharmakodynamischer Insulindetemir NPH-Insulin Endpunkt CV (%) CV (%) AUCGIR,0-24h* 27 68 GIRmax** 23 46 *Fläche unter der Kurve (Area under the curve) ** Glucose-Infusionsrate p-Wert < 0,001 für alle Vergleiche mit Insulindetemir Die verlängerte Wirkung von Insulindetemir wird durch die starke Selbstassoziation von Insulindetemir-Molekülen an der Injektionsstelle und die Albuminbindung über die FettsäureSeitenkette vermittelt. Insulindetemir wird im Vergleich zu NPH-Insulin langsamer in das periphere Zielgewebe abgegeben. Die Kombination dieser Verzögerungsmechanismen bewirkt, verglichen mit NPH-Insulin, eine reproduzierbarere Resorption und ein reproduzierbareres Wirkprofil von Insulindetemir. Die Blutzucker senkende Wirkung von Insulindetemir beruht auf der Fähigkeit des Moleküls, durch Bindung an Insulinrezeptoren in Muskel- und Fettzellen die Aufnahme von Glucose zu erhöhen. Gleichzeitig wird die Freisetzung von Glucose aus der Leber inhibiert. 27 Glucose-Infusionsrate (mg/kg/min) P h a r m a k o d y n a m i s c h e P a r a m e t e r f ü r L e v e m ir u n d N P H - In s u lin NPHIn s u li n L e v e m ir 0 ,2 E /k g 0 ,3 E /k g † W i rk d a u e r ( h ) 12 17 G IR m a x ( m g /k g /m in ) 1 ,1 1 ,4 † † 0 ,4 E /k g 0 ,3 I. E ./k g 20 13 1 ,7 1,6 g e s c h ä tz t e W e r te Z e it s e it d e r In s u lin -In je k tio n (i n S t u n d e n ) L e v e m ir … .. 0 , 2 E /k g _ __ ___ 0 ,3 E /k g . . .0 ,4 E /k g Abbildung 1: Wirkprofile von Levemir bei Patienten mit Typ 1 Diabetes. Die Wirkdauer beträgt abhängig von der Dosis bis zu 24 Stunden, sodass die Anwendung einmal oder zweimal täglich erfolgen kann. Bei zweimaliger Gabe pro Tag wird nach 2–3 Dosisgaben ein stabiler Zustand erreicht. Bei Dosierungen im Bereich von 0,2-0,4 E/kg entfaltet Levemir mehr als 50 % seiner maximalen Wirkung (Wirkmaximum) innerhalb von 3 bis 4 Stunden bis maximal ca. 14 Stunden nach Gabe der Dosis. Bei der pharmakodynamischen Antwort (Wirkmaximum, Wirkdauer, Gesamtwirkung) wird nach subkutaner Gabe eine Proportionalität zur Dosis beobachtet. In Langzeitbehandlungsstudien war der Nüchtern-Blutzuckerspiegel im Plasma von Patienten mit Typ 1 Diabetes, die mit einer Basis-Bolus-Therapie behandelt wurden, mit Levemir verbessert im Vergleich mit NPH-Insulin. Die glykämische Einstellung (HbA1c) mit Levemir ist mit NPH-Insulin vergleichbar, wobei das Risiko nächtlicher Hypoglykämien geringer und keine Gewichtszunahme damit verbunden ist. In klinischen Langzeitstudien wurde während der Behandlung mit Levemir, verglichen mit NPHInsulin, eine verringerte Tag-zu-Tag Variabilität der Nüchtern-Plasma-Glucose nachgewiesen. Die Blutzucker senkende Wirkung von Levemir wurde in klinischen Studien außerhalb eines BasisBolusschemas demonstriert. Bezüglich des HbA1c wurde allerdings außerhalb eines BasisBolusschemas Nicht-Inferiorität im Vergleich zu NPH-Insulin nicht gezeigt. In klinischen Studien waren die Hypoglykämie-Gesamtraten mit Levemir und NPH-Insulin ähnlich. Die Analysen nächtlicher Hypoglykämien bei Typ 1 Diabetes ergaben ein signifikant niedrigeres Risiko für leichte nächtliche Hypoglykämien (selbstbehandelbar und bestätigt durch kapilläre Glucosekonzentration unter 2,8 mmol/l bzw. 3,1 mmol/l, wenn als Plasmaglucose angegeben) als bei NPH-Insulin, während bei Typ 2 Diabetes kein Unterschied festgestellt wurde. Im Unterschied zu anderen Insulinen ist die intensivierte Therapie mit Levemir nicht mit einer unerwünschten Gewichtszunahme verbunden. 5.2 Pharmakokinetische Eigenschaften Resorption: Die maximale Serumkonzentration wird innerhalb von 6 bis 8 Stunden nach der Gabe erreicht. 28 Bei zweimaliger Gabe pro Tag wird nach 2–3 Dosisgaben ein stabiler Zustand der Serumkonzentration erreicht. Die intraindividuelle Variabilität bei der Resorption ist bei Levemir niedriger als bei anderen Basalinsulinpräparaten. Es liegen keine geschlechtsspezifischen klinisch relevanten Unterschiede bei den pharmakokinetischen Eigenschaften von Insulindetemir vor. Die absolute Bioverfügbarkeit von Insulindetemir liegt bei subkutaner Injektion bei ungefähr 60 %. Verteilung: Ein scheinbares Verteilungsvolumen von ungefähr 0,1 l/kg für Insulindetemir weist darauf hin, dass sich ein hoher Anteil von Insulindetemir im Blutkreislauf befindet. Metabolismus: Der Abbau von Insulindetemir entspricht dem von Humaninsulin; alle gebildeten Metaboliten sind inaktiv. Die Ergebnisse der in-vitro- und in-vivo-Proteinbindungsstudien legen nahe, dass keine klinisch relevante Wechselwirkung zwischen Insulindetemir und Fettsäuren oder anderen proteingebundenen Arzneimitteln vorhanden ist. Elimination: Die terminale Halbwertszeit nach subkutaner Injektion wird durch die Resorptionsrate aus dem subkutanen Gewebe bestimmt. Die terminale Halbwertszeit liegt in Abhängigkeit von der Dosis zwischen 5 und 7 Stunden. Linearität: Bei der Serumkonzentration (maximale Konzentration, Resorptionsgrad) wird nach subkutaner Gabe im therapeutischen Dosierungsbereich eine Proportionalität zur Dosis beobachtet. Spezielle Populationen: Die pharmakokinetischen Eigenschaften von Insulindetemir wurden bei Kindern (im Alter zwischen 6 und 12 Jahren) und Jugendlichen (im Alter zwischen 13 und 17 Jahren) untersucht und mit denen von Erwachsenen mit Typ 1 Diabetes verglichen. Bei den pharmakokinetischen Eigenschaften wurden keine klinisch relevanten Unterschiede festgestellt. Es wurde kein klinisch relevanter Unterschied in der Pharmakokinetik von Insulindetemir zwischen älteren und jungen Probanden oder zwischen Probanden mit Nieren- oder Leberfunktionsstörungen und gesunden Probanden festgestellt. Auf der Grundlage der durchgeführten Studien werden keine klinisch relevanten Unterschiede in der Pharmakokinetik von Insulindetemir zwischen gesunden Probanden und Probanden mit Nieren- oder Leberfunktionsstörungen erwartet. Da bei diesen Populationen keine umfangreichen Studien der Pharmakokinetik von Insulindetemir durchgeführt wurden, wird angeraten, die Plasmaglucosekonzentration bei diesen Populationen genau zu überwachen. 5.3 Präklinische Daten zur Sicherheit Präklinische Daten, die auf konventionellen Studien zur Sicherheitspharmakologie, zur chronischen Toxizität, zur Genotoxizität und zur Reproduktionstoxizität basieren, lassen keine besonderen Gefahren für den Menschen erkennen. Rezeptoraffinitätsdaten und in-vitro-Mitogenitätstests erbrachten keinen Nachweis für ein erhöhtes mitogenes Potenzial im Vergleich zu Humaninsulin. 29 6. PHARMAZEUTISCHE ANGABEN 6.1 Sonstige Bestandteile Mannitol Phenol m-Cresol Zinkacetat-Dihydrat Natriummonohydrogenphosphat-Dihydrat Natriumchlorid Salzsäure 2N (pH-Einstellung) Natriumhydroxid 2N (pH-Einstellung) Wasser für Injektionszwecke 6.2 Inkompatibilitäten Wenn andere Arzneimittel zu Levemir hinzugefügt werden, kann dies zum Abbau von Insulindetemir führen, z. B. wenn diese Arzneimittel Thiole oder Sulfite enthalten. Levemir sollte nicht mit Infusionslösungen gemischt werden. 6.3 Dauer der Haltbarkeit 2 Jahre. Nach dem ersten Öffnen darf das Arzneimittel für maximal 6 Wochen und nicht über 30°C gelagert werden. 6.4 Besondere Lagerungshinweise Im Kühlschrank lagern (2°C – 8°C), nicht in der Nähe eines Gefrierfachs. Nicht einfrieren. DieVerschlusskappe aufgesetzt lassen, wenn der Levemir InnoLet nicht verwendet wird, um den Inhalt vor Lichtzu schützen. Nach Anbruch: Nicht im Kühlschrank lagern. Nicht über 30°C lagern. Levemir muss vor übermäßiger Hitze und Sonnenlicht geschützt werden. 6.5 Art und Inhalt des Behältnisses 3 ml Lösung in einer Zylinderampulle aus Glas (Glasart I), mit einem Kolben (Brombutylgummi) und einem Stopfen (Brombutylgummi/Polyisopren) in einem vorgefüllten Injektor (MehrdosenEinwegspritze aus Polypropylen). Packungsgrößen: 1, 5 und 10 vorgefüllte Injektoren. Es werden möglicherweise nicht alle Packungsgrößen in den Verkehr gebracht. 6.6 Hinweise für die Handhabung und Entsorgung Levemir darf nur von einer Person verwendet werden. Die Zylinderampulle darf nicht wieder aufgefüllt werden. Levemir darf nicht verwendet werden, wenn es nicht klar und farblos aussieht. Einmal gefrorenes Levemir darf nicht mehr verwendet werden. Der Patient sollte angewiesen werden, die Injektionsnadel nach jeder Injektion zu entsorgen. 30 Nicht verwendete Arzneimittel oder Abfallmaterial sind entsprechend den nationalen Anforderungen zu entsorgen. 7. PHARMAZEUTISCHER UNTERNEHMER Novo Nordisk A/S DK-2880 Bagsvaerd Dänemark 8. ZULASSUNGSNUMMER(N) 9. DATUM DER ZULASSUNG/VERLÄNGERUNG DER ZULASSUNG 10. STAND DER INFORMATION 31 ANHANG II A. HERSTELLER DES ARZNEILICH WIRKSAMEN BESTANDTEILS BIOLOGISCHEN URSPRUNGS UND INHABER DER HERSTELLUNGSERLAUBNIS, DER FÜR DIE CHARGENFREIGABE VERANTWORTLICH IST B. BEDINGUNGEN DER GENEHMIGUNG FÜR DAS INVERKEHRBRINGEN 32 A HERSTELLER DES ARZNEILICH WIRKSAMEN BESTANDTEILS BIOLOGISCHEN URSPRUNGS UND INHABER DER HERSTELLUNGSERLAUBNIS, DER FÜR DIE CHARGENFREIGABE VERANTWORTLICH IST Name und Anschrift des Herstellers des arzneilich wirksamen Bestandteils biologischen Ursprungs Novo Nordisk A/S Novo Allé DK-2880 Bagsvaerd Dänemark Name und Anschrift des Herstellers, der für die Chargenfreigabe verantwortlich ist Novo Nordisk A/S Novo Allé DK-2880 Bagsvaerd Dänemark B BEDINGUNGEN DER GENEHMIGUNG FÜR DAS INVERKEHRBRINGEN • BEDINGUNGEN ODER EINSCHRÄNKUNGEN FÜR DIE ABGABE UND DEN GEBRAUCH, DIE DEM INHABER DER GENEHMIGUNG FÜR DAS INVERKEHRBRINGEN AUFERLEGT WERDEN Arzneimittel, das der Verschreibungspflicht unterliegt. • SONSTIGE BEDINGUNGEN Der Inhaber dieser Genehmigung für das Inverkehrbringen muss die Europäische Kommission über die Pläne für das Inverkehrbringen des im Rahmen dieser Entscheidung genehmigten Arzneimittels informieren. 33 ANHANG III ETIKETTIERUNG UND PACKUNGSBEILAGE 34 A. ETIKETTIERUNG 35 ANGABEN AUF DER ÄUSSEREN UMHÜLLUNG BZW. BEI DEREN FEHLEN AUF DEM BEHÄLTNIS UMKARTON 1. BEZEICHNUNG DES ARZNEIMITTELS Levemir 100 E/ml Injektionslösung in einer Zylinderampulle Insulindetemir 2. ARZNEILICH WIRKSAME(R) BESTANDTEIL(E) 1 ml Lösung enthält 100 E (14,2 mg) Insulindetemir, r-DNS 3. SONSTIGE BESTANDTEILE Mannitol, Phenol, m-Cresol, Zinkacetat-Dihydrat, Natriummonohydrogenphosphat-Dihydrat, Natriumchlorid, Salzsäure, Natriumhydroxid und Wasser für Injektionszwecke 4. DARREICHUNGSFORM UND INHALT Injektionslösung in einer Zylinderampulle. Penfill. 1 x 3 ml 5. ART(EN) DER ANWENDUNG Zur subkutanen Anwendung. Levemir Penfill Zylinderampullen sind für die Anwendung mit Insulininjektionsgeräten von Novo Nordisk vorgesehen. Levemir Penfill darf nur von einer Person verwendet werden. Packungsbeilage beachten. 6. KINDERWARNHINWEIS, DASS DAS ARZNEIMITTEL FÜR KINDER UNERREICHBAR UND NICHT SICHTBAR AUFZUBEWAHREN IST Arzneimittel für Kinder unzugänglich aufbewahren. 7. GEGEBENENFALLS WARNHINWEISE, FALLS ERFORDERLICH 8. VERFALLDATUM Verwendbar bis: Nach Anbruch: nicht länger als 6 Wochen anwenden. 36 9. BESONDERE LAGERUNGSHINWEISE Im Kühlschrank lagern (2°C – 8°C). Nicht einfrieren. Das Behältnis im Umkarton aufbewahren. Nach Anbruch: nicht im Kühlschrank oder über 30°C aufbewahren. 10. GEGEBENENFALLS BESONDERE VORSICHTSMASSNAHMEN FÜR DIE BESEITIGUNG VON NICHT VERWENDETEN ARZNEIMITTELN ODER DAVON STAMMENDEN ABFALLMATERIALIEN 11. NAME UND ANSCHRIFT DES PHARMAZEUTISCHEN UNTERNEHMERS Novo Nordisk A/S Novo Allé DK-2880 Bagsvaerd Dänemark 12. ZULASSUNGSNUMMER(N) EU/0/00/000/000 13. CHARGENBEZEICHNUNG Ch.-B.: 14. VERSCHREIBUNGSSTATUS/APOTHEKENPFLICHT Verschreibungspflichtig 15. HINWEISE FÜR DEN GEBRAUCH 37 ANGABEN AUF DER ÄUSSEREN UMHÜLLUNG BZW. BEI DEREN FEHLEN AUF DEM BEHÄLTNIS UMKARTON 1. BEZEICHNUNG DES ARZNEIMITTELS Levemir 100 E/ml Injektionslösung in einer Zylinderampulle Insulindetemir 2. ARZNEILICH WIRKSAME(R) BESTANDTEIL(E) 1 ml Lösung enthält 100 E (14,2 mg) Insulindetemir, r-DNS 3. SONSTIGE BESTANDTEILE Mannitol, Phenol, m-Cresol, Zinkacetat-Dihydrat, Natriummonohydrogenphosphat-Dihydrat, Natriumchlorid, Salzsäure, Natriumhydroxid und Wasser für Injektionszwecke 4. DARREICHUNGSFORM UND INHALT Injektionslösung in einer Zylinderampulle. Penfill. 5 x 3 ml 5. ART(EN) DER ANWENDUNG Zur subkutanen Anwendung. Levemir Penfill Zylinderampullen sind für die Anwendung mit Insulininjektionsgeräten von Novo Nordisk vorgesehen. Levemir Penfill darf nur von einer Person verwendet werden. Packungsbeilage beachten. 6. KINDERWARNHINWEIS, DASS DAS ARZNEIMITTEL FÜR KINDER UNERREICHBAR UND NICHT SICHTBAR AUFZUBEWAHREN IST Arzneimittel für Kinder unzugänglich aufbewahren. 7. GEGEBENENFALLS WARNHINWEISE, FALLS ERFORDERLICH 8. VERFALLDATUM Verwendbar bis: Nach Anbruch: nicht länger als 6 Wochen anwenden. 9. BESONDERE LAGERUNGSHINWEISE 38 Im Kühlschrank lagern (2 C – 8 C). Nicht einfrieren. Das Behältnis im Umkarton aufbewahren. Nach Anbruch: nicht im Kühlschrank oder über 30°C aufbewahren. 10. GEGEBENENFALLS BESONDERE VORSICHTSMASSNAHMEN FÜR DIE BESEITIGUNG VON NICHT VERWENDETEN ARZNEIMITTELN ODER DAVON STAMMENDEN ABFALLMATERIALIEN 11. NAME UND ANSCHRIFT DES PHARMAZEUTISCHEN UNTERNEHMERS Novo Nordisk A/S Novo Allé DK-2880 Bagsvaerd Dänemark 12. ZULASSUNGSNUMMER(N) EU/0/00/000/000 13. CHARGENBEZEICHNUNG Ch.-B.: 14. VERSCHREIBUNGSSTATUS/APOTHEKENPFLICHT Verschreibungspflichtig 15. HINWEISE FÜR DEN GEBRAUCH 39 ANGABEN AUF DER ÄUSSEREN UMHÜLLUNG BZW. BEI DEREN FEHLEN AUF DEM BEHÄLTNIS UMKARTON 1. BEZEICHNUNG DES ARZNEIMITTELS Levemir 100 E/ml Injektionslösung in einer Zylinderampulle Insulindetemir 2. ARZNEILICH WIRKSAME(R) BESTANDTEIL(E) 1 ml Lösung enthält 100 E (14,2 mg) Insulindetemir, r-DNS 3. SONSTIGE BESTANDTEILE Mannitol, Phenol, m-Cresol, Zinkacetat-Dihydrat, Natriummonohydrogenphosphat-Dihydrat, Natriumchlorid, Salzsäure, Natriumhydroxid und Wasser für Injektionszwecke 4. DARREICHUNGSFORM UND INHALT Injektionslösung in einer Zylinderampulle. Penfill 10 x 3 ml 5. ART(EN) DER ANWENDUNG Zur subkutanen Anwendung. Levemir Penfill Zylinderampullen sind für die Anwendung mit Insulininjektionsgeräten von Novo Nordisk vorgesehen. Levemir Penfill darf nur von einer Person verwendet werden. Packungsbeilage beachten. 6. KINDERWARNHINWEIS, DASS DAS ARZNEIMITTEL FÜR KINDER UNERREICHBAR UND NICHT SICHTBAR AUFZUBEWAHREN IST Arzneimittel für Kinder unzugänglich aufbewahren. 7. GEGEBENENFALLS WARNHINWEISE, FALLS ERFORDERLICH 8. VERFALLDATUM Verwendbar bis: Nach Anbruch: nicht länger als 6 Wochen anwenden. 40 9. BESONDERE LAGERUNGSHINWEISE Im Kühlschrank lagern (2°C – 8°C). Nicht einfrieren. Das Behältnis im Umkarton aufbewahren. Nach Anbruch: nicht im Kühlschrank oder über 30°C aufbewahren. 10. GEGEBENENFALLS BESONDERE VORSICHTSMASSNAHMEN FÜR DIE BESEITIGUNG VON NICHT VERWENDETEN ARZNEIMITTELN ODER DAVON STAMMENDEN ABFALLMATERIALIEN 11. NAME UND ANSCHRIFT DES PHARMAZEUTISCHEN UNTERNEHMERS Novo Nordisk A/S Novo Allé DK-2880 Bagsvaerd Dänemark 12. ZULASSUNGSNUMMER(N) EU/0/00/000/000 13. CHARGENBEZEICHNUNG Ch.-B.: 14. VERSCHREIBUNGSSTATUS/APOTHEKENPFLICHT Verschreibungspflichtig 15. HINWEISE FÜR DEN GEBRAUCH 41 MINDESTANGABEN AUF KLEINEN BEHÄLTNISSEN Penfill 1. BEZEICHNUNG DES ARZNEIMITTELS SOWIE ART(EN) DER ANWENDUNG Levemir 100 E/ml Injektionslösung in einer Zylinderampulle 2. ART DER ANWENDUNG s.c. Anwendung Penfill 3. VERFALLDATUM Verwendbar bis: 4. CHARGENBEZEICHNUNG Ch.-B.: 5. INHALT NACH GEWICHT, VOLUMEN ODER EINHEITEN 3 ml 42 ANGABEN AUF DER ÄUSSEREN UMHÜLLUNG BZW. BEI DEREN FEHLEN AUF DEM BEHÄLTNIS UMKARTON 1. BEZEICHNUNG DES ARZNEIMITTELS Levemir 100 E/ml Injektionslösung in einem Injektor, vorgefüllt Insulindetemir 2. ARZNEILICH WIRKSAME(R) BESTANDTEIL(E) 1 ml Lösung enthält 100 E (14,2 mg) Insulindetemir, r-DNS 3. SONSTIGE BESTANDTEILE Mannitol, Phenol, m-Cresol, Zinkacetat-Dihydrat, Natriummonohydrogenphosphat-Dihydrat, Natriumchlorid, Salzsäure, Natriumhydroxid und Wasser für Injektionszwecke 4. DARREICHUNGSFORM UND INHALT Injektionslösung in einem Injektor, vorgefüllt. FlexPen 1 x 3 ml 5. ART(EN) DER ANWENDUNG Zur subkutanen Anwendung. Zur Verwendung mit Levemir FlexPen sind NovoFine S-Kanülen vorgesehen. NovoFine-Kanülen sind nicht in der Packung enthalten. Levemir FlexPen darf nur von einer Person verwendet werden. Packungsbeilage beachten. 6. KINDERWARNHINWEIS, DASS DAS ARZNEIMITTEL FÜR KINDER UNERREICHBAR UND NICHT SICHTBAR AUFZUBEWAHREN IST Arzneimittel für Kinder unzugänglich aufbewahren. 7. GEGEBENENFALLS WARNHINWEISE, FALLS ERFORDERLICH 8. VERFALLDATUM Verwendbar bis: Nach Anbruch: nicht länger als 6 Wochen anwenden. 43 9. BESONDERE LAGERUNGSHINWEISE Im Kühlschrank lagern (2°C – 8°C). Nicht einfrieren. Die Verschlusskappe aufgesetzt lassen, um den Inhalt vor Licht zu schützen. Nach Anbruch: nicht im Kühlschrank oder über 30°C aufbewahren. 10. GEGEBENENFALLS BESONDERE VORSICHTSMASSNAHMEN FÜR DIE BESEITIGUNG VON NICHT VERWENDETEN ARZNEIMITTELN ODER DAVON STAMMENDEN ABFALLMATERIALIEN 11. NAME UND ANSCHRIFT DES PHARMAZEUTISCHEN UNTERNEHMERS Novo Nordisk A/S Novo Allé DK-2880 Bagsvaerd Dänemark 12. ZULASSUNGSNUMMER(N) EU/0/00/000/000 13. CHARGENBEZEICHNUNG Ch.-B.: 14. VERSCHREIBUNGSSTATUS/APOTHEKENPFLICHT Verschreibungspflichtig 15. HINWEISE FÜR DEN GEBRAUCH 44 ANGABEN AUF DER ÄUSSEREN UMHÜLLUNG BZW. BEI DEREN FEHLEN AUF DEM BEHÄLTNIS UMKARTON 1. BEZEICHNUNG DES ARZNEIMITTELS Levemir 100 E/ml Injektionslösung in einem Injektor, vorgefüllt Insulindetemir 2. ARZNEILICH WIRKSAME(R) BESTANDTEIL(E) 1 ml Lösung enthält 100 E (14,2 mg) Insulindetemir, r-DNS 3. SONSTIGE BESTANDTEILE Mannitol, Phenol, m-Cresol, Zinkacetat-Dihydrat, Natriummonohydrogenphosphat-Dihydrat, Natriumchlorid, Salzsäure, Natriumhydroxid und Wasser für Injektionszwecke 4. DARREICHUNGSFORM UND INHALT Injektionslösung in einem Injektor, vorgefüllt. FlexPen 5 x 3 ml 5. ART(EN) DER ANWENDUNG Zur subkutanen Anwendung. Zur Verwendung mit Levemir FlexPen sind NovoFine S-Kanülen vorgesehen. NovoFine-Kanülen sind nicht in der Packung enthalten. Levemir FlexPen darf nur von einer Person verwendet werden. Packungsbeilage beachten. 6. KINDERWARNHINWEIS, DASS DAS ARZNEIMITTEL FÜR KINDER UNERREICHBAR UND NICHT SICHTBAR AUFZUBEWAHREN IST Arzneimittel für Kinder unzugänglich aufbewahren. 7. GEGEBENENFALLS WARNHINWEISE, FALLS ERFORDERLICH 8. VERFALLDATUM Verwendbar bis: Nach Anbruch: nicht länger als 6 Wochen anwenden. 45 9. BESONDERE LAGERUNGSHINWEISE Im Kühlschrank lagern (2°C – 8°C). Nicht einfrieren. Die Verschlusskappe aufgesetzt lassen, um den Inhalt vor Licht zu schützen. Nach Anbruch: nicht im Kühlschrank oder über 30°C aufbewahren. 10. GEGEBENENFALLS BESONDERE VORSICHTSMASSNAHMEN FÜR DIE BESEITIGUNG VON NICHT VERWENDETEN ARZNEIMITTELN ODER DAVON STAMMENDEN ABFALLMATERIALIEN 11. NAME UND ANSCHRIFT DES PHARMAZEUTISCHEN UNTERNEHMERS Novo Nordisk A/S Novo Allé DK-2880 Bagsvaerd Dänemark 12. ZULASSUNGSNUMMER(N) EU/0/00/000/000 13. CHARGENBEZEICHNUNG Ch.-B.: 14. VERSCHREIBUNGSSTATUS/APOTHEKENPFLICHT Verschreibungspflichtig 15. HINWEISE FÜR DEN GEBRAUCH 46 ANGABEN AUF DER ÄUSSEREN UMHÜLLUNG BZW. BEI DEREN FEHLEN AUF DEM BEHÄLTNIS UMKARTON 1. BEZEICHNUNG DES ARZNEIMITTELS Levemir 100 E/ml Injektionslösung in einem Injektor, vorgefüllt Insulindetemir 2. ARZNEILICH WIRKSAME(R) BESTANDTEIL(E) 1 ml Lösung enthält 100 E (14,2 mg) Insulindetemir, r-DNS 3. SONSTIGE BESTANDTEILE Mannitol, Phenol, m-Cresol, Zinkacetat-Dihydrat, Natriummonohydrogenphosphat-Dihydrat, Natriumchlorid, Salzsäure, Natriumhydroxid und Wasser für Injektionszwecke 4. DARREICHUNGSFORM UND INHALT Injektionslösung in einem Injektor, vorgefüllt. FlexPen 10 x 3 ml 5. ART(EN) DER ANWENDUNG Zur subkutanen Anwendung. Zur Verwendung mit Levemir FlexPen sind NovoFine S-Kanülen vorgesehen. NovoFine-Kanülen sind nicht in der Packung enthalten. Levemir FlexPen darf nur von einer Person verwendet werden. Packungsbeilage beachten. 6. KINDERWARNHINWEIS, DASS DAS ARZNEIMITTEL FÜR KINDER UNERREICHBAR UND NICHT SICHTBAR AUFZUBEWAHREN IST Arzneimittel für Kinder unzugänglich aufbewahren. 7. GEGEBENENFALLS WARNHINWEISE, FALLS ERFORDERLICH 8. VERFALLDATUM Verwendbar bis: Nach Anbruch: nicht länger als 6 Wochen anwenden. 47 9. BESONDERE LAGERUNGSHINWEISE Im Kühlschrank lagern (2°C – 8°C). Nicht einfrieren. Die Verschlusskappe aufgesetzt lassen, um den Inhalt vor Licht zu schützen. Nach Anbruch: nicht im Kühlschrank oder über 30°C aufbewahren. 10. GEGEBENENFALLS BESONDERE VORSICHTSMASSNAHMEN FÜR DIE BESEITIGUNG VON NICHT VERWENDETEN ARZNEIMITTELN ODER DAVON STAMMENDEN ABFALLMATERIALIEN 11. NAME UND ANSCHRIFT DES PHARMAZEUTISCHEN UNTERNEHMERS Novo Nordisk A/S Novo Allé DK-2880 Bagsvaerd Dänemark 12. ZULASSUNGSNUMMER(N) EU/0/00/000/000 13. CHARGENBEZEICHNUNG Ch.-B.: 14. VERSCHREIBUNGSSTATUS/APOTHEKENPFLICHT Verschreibungspflichtig 15. HINWEISE FÜR DEN GEBRAUCH 48 MINDESTANGABEN AUF KLEINEN BEHÄLTNISSEN FlexPen 1. BEZEICHNUNG DES ARZNEIMITTELS SOWIE ART(EN) DER ANWENDUNG Levemir 100 E/ml Injektionslösung in einem Injektor, vorgefüllt 2. ART DER ANWENDUNG s.c. Anwendung FlexPen 3. VERFALLDATUM Verwendbar bis: 4. CHARGENBEZEICHNUNG Ch.-B.: 5. INHALT NACH GEWICHT, VOLUMEN ODER EINHEITEN 3 ml 49 ANGABEN AUF DER ÄUSSEREN UMHÜLLUNG BZW. BEI DEREN FEHLEN AUF DEM BEHÄLTNIS UMKARTON 1. BEZEICHNUNG DES ARZNEIMITTELS Levemir 100 E/ml Injektionslösung in einem Injektor, vorgefüllt Insulindetemir 2. ARZNEILICH WIRKSAME(R) BESTANDTEIL(E) 1 ml Lösung enthält 100 E (14,2 mg) Insulindetemir, r-DNS 3. SONSTIGE BESTANDTEILE Mannitol, Phenol, m-Cresol, Zinkacetat-Dihydrat, Natriummonohydrogenphosphat-Dihydrat, Natriumchlorid, Salzsäure, Natriumhydroxid und Wasser für Injektionszwecke 4. DARREICHUNGSFORM UND INHALT Injektionslösung in einem Injektor, vorgefüllt. InnoLet 1 x 3 ml 5. ART(EN) DER ANWENDUNG Zur subkutanen Anwendung. Zur Verwendung mit Levemir InnoLet sind NovoFine S-Kanülen vorgesehen. NovoFine-Kanülen sind nicht in der Packung enthalten. Levemir InnoLet darf nur von einer Person verwendet werden. Packungsbeilage beachten. 6. KINDERWARNHINWEIS, DASS DAS ARZNEIMITTEL FÜR KINDER UNERREICHBAR UND NICHT SICHTBAR AUFZUBEWAHREN IST Arzneimittel für Kinder unzugänglich aufbewahren. 7. GEGEBENENFALLS WARNHINWEISE, FALLS ERFORDERLICH 8. VERFALLDATUM Verwendbar bis: Nach Anbruch: nicht länger als 6 Wochen anwenden. 50 9. BESONDERE LAGERUNGSHINWEISE Im Kühlschrank lagern (2°C – 8°C). Nicht einfrieren. Die Verschlusskappe aufgesetzt lassen, um den Inhalt vor Licht zu schützen. Nach Anbruch: nicht im Kühlschrank oder über 30°C aufbewahren. 10. GEGEBENENFALLS BESONDERE VORSICHTSMASSNAHMEN FÜR DIE BESEITIGUNG VON NICHT VERWENDETEN ARZNEIMITTELN ODER DAVON STAMMENDEN ABFALLMATERIALIEN 11. NAME UND ANSCHRIFT DES PHARMAZEUTISCHEN UNTERNEHMERS Novo Nordisk A/S Novo Allé DK-2880 Bagsvaerd Dänemark 12. ZULASSUNGSNUMMER(N) EU/0/00/000/000 13. CHARGENBEZEICHNUNG Ch.-B.: 14. VERSCHREIBUNGSSTATUS/APOTHEKENPFLICHT Verschreibungspflichtig 15. HINWEISE FÜR DEN GEBRAUCH 51 ANGABEN AUF DER ÄUSSEREN UMHÜLLUNG BZW. BEI DEREN FEHLEN AUF DEM BEHÄLTNIS UMKARTON 1. BEZEICHNUNG DES ARZNEIMITTELS Levemir 100 E/ml Injektionslösung in einem Injektor, vorgefüllt Insulindetemir 2. ARZNEILICH WIRKSAME(R) BESTANDTEIL(E) 1 ml Lösung enthält 100 E (14,2 mg) Insulindetemir, r-DNS 3. SONSTIGE BESTANDTEILE Mannitol, Phenol, m-Cresol, Zinkacetat-Dihydrat, Natriummonohydrogenphosphat-Dihydrat, Natriumchlorid, Salzsäure, Natriumhydroxid und Wasser für Injektionszwecke 4. DARREICHUNGSFORM UND INHALT Injektionslösung in einem Injektor, vorgefüllt. InnoLet 5 x 3 ml 5. ART(EN) DER ANWENDUNG Zur subkutanen Anwendung. Zur Verwendung mit Levemir InnoLet sind NovoFine S-Kanülen vorgesehen. NovoFine-Kanülen sind nicht in der Packung enthalten. Levemir InnoLet darf nur von einer Person verwendet werden. Packungsbeilage beachten. 6. KINDERWARNHINWEIS, DASS DAS ARZNEIMITTEL FÜR KINDER UNERREICHBAR UND NICHT SICHTBAR AUFZUBEWAHREN IST Arzneimittel für Kinder unzugänglich aufbewahren. 7. GEGEBENENFALLS WARNHINWEISE, FALLS ERFORDERLICH 8. VERFALLDATUM Verwendbar bis: Nach Anbruch: nicht länger als 6 Wochen anwenden. 52 9. BESONDERE LAGERUNGSHINWEISE Im Kühlschrank lagern (2°C – 8°C). Nicht einfrieren. Die Verschlusskappe aufgesetzt lassen, um den Inhalt vor Licht zu schützen. Nach Anbruch: nicht im Kühlschrank oder über 30°C aufbewahren. 10. GEGEBENENFALLS BESONDERE VORSICHTSMASSNAHMEN FÜR DIE BESEITIGUNG VON NICHT VERWENDETEN ARZNEIMITTELN ODER DAVON STAMMENDEN ABFALLMATERIALIEN 11. NAME UND ANSCHRIFT DES PHARMAZEUTISCHEN UNTERNEHMERS Novo Nordisk A/S Novo Allé DK-2880 Bagsvaerd Dänemark 12. ZULASSUNGSNUMMER(N) EU/0/00/000/000 13. CHARGENBEZEICHNUNG Ch.-B.: 14. VERSCHREIBUNGSSTATUS/APOTHEKENPFLICHT Verschreibungspflichtig 15. HINWEISE FÜR DEN GEBRAUCH 53 ANGABEN AUF DER ÄUSSEREN UMHÜLLUNG BZW. BEI DEREN FEHLEN AUF DEM BEHÄLTNIS UMKARTON 1. BEZEICHNUNG DES ARZNEIMITTELS Levemir 100 E/ml Injektionslösung in einem Injektor, vorgefüllt Insulindetemir 2. ARZNEILICH WIRKSAME(R) BESTANDTEIL(E) 1 ml Lösung enthält 100 E (14,2 mg) Insulindetemir, r-DNS 3. SONSTIGE BESTANDTEILE Mannitol, Phenol, m-Cresol, Zinkacetat-Dihydrat, Natriummonohydrogenphosphat-Dihydrat, Natriumchlorid, Salzsäure, Natriumhydroxid und Wasser für Injektionszwecke 4. DARREICHUNGSFORM UND INHALT Injektionslösung in einem Injektor, vorgefüllt. InnoLet 10 x 3 ml 5. ART(EN) DER ANWENDUNG Zur subkutanen Anwendung. Zur Verwendung mit Levemir InnoLet sind NovoFine S-Kanülen vorgesehen. NovoFine-Kanülen sind nicht in der Packung enthalten. Levemir InnoLet darf nur von einer Person verwendet werden. Packungsbeilage beachten. 6. KINDERWARNHINWEIS, DASS DAS ARZNEIMITTEL FÜR KINDER UNERREICHBAR UND NICHT SICHTBAR AUFZUBEWAHREN IST Arzneimittel für Kinder unzugänglich aufbewahren. 7. GEGEBENENFALLS WARNHINWEISE, FALLS ERFORDERLICH 8. VERFALLDATUM Verwendbar bis: Nach Anbruch: nicht länger als 6 Wochen anwenden. 54 9. BESONDERE LAGERUNGSHINWEISE Im Kühlschrank lagern (2°C – 8°C). Nicht einfrieren. Die Verschlusskappe aufgesetzt lassen, um den Inhalt vor Licht zu schützen. Nach Anbruch: nicht im Kühlschrank oder über 30°C aufbewahren. 10. GEGEBENENFALLS BESONDERE VORSICHTSMASSNAHMEN FÜR DIE BESEITIGUNG VON NICHT VERWENDETEN ARZNEIMITTELN ODER DAVON STAMMENDEN ABFALLMATERIALIEN 11. NAME UND ANSCHRIFT DES PHARMAZEUTISCHEN UNTERNEHMERS Novo Nordisk A/S Novo Allé DK-2880 Bagsvaerd Dänemark 12. ZULASSUNGSNUMMER(N) EU/0/00/000/000 13. CHARGENBEZEICHNUNG Ch.-B.: 14. VERSCHREIBUNGSSTATUS/APOTHEKENPFLICHT Verschreibungspflichtig 15. HINWEISE FÜR DEN GEBRAUCH 55 MINDESTANGABEN AUF KLEINEN BEHÄLTNISSEN InnoLet 1. BEZEICHNUNG DES ARZNEIMITTELS SOWIE ART(EN) DER ANWENDUNG Levemir 100 E/ml Injektionslösung in einem Injektor, vorgefüllt 2. ART DER ANWENDUNG s.c. Anwendung InnoLet 3. VERFALLDATUM Verwendbar bis: 4. CHARGENBEZEICHNUNG Ch.-B.: 5. INHALT NACH GEWICHT, VOLUMEN ODER EINHEITEN 3 ml 56 B. PACKUNGSBEILAGE 57 LEVEMIR Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung Ihres Insulins beginnen. Heben Sie diese Packungsbeilage auf. Vielleicht möchten Sie diese später nochmals lesen. Wenn Sie weitere Fragen haben, wenden Sie sich bitte an Ihren Arzt, Ihre Diabetesberaterin oder Ihren Apotheker. Dieses Arzneimittel wurde Ihnen persönlich verschrieben und darf nicht an Dritte weitergegeben werden. Es kann anderen Menschen schaden, auch wenn diese dieselben Symptome haben wie Sie. Levemir 100 E/ml Injektionslösung in einer Zylinderampulle. Penfill. Insulindetemir, r-DNS Der arzneilich wirksame Bestandteil ist durch rekombinante DNS-Technologie hergestelltes Insulindetemir. 1 ml enthält 100 E Insulindetemir. 1 Zylinderampulle enthält 3 ml, entsprechend 300 E. Die sonstigen Bestandteile sind Mannitol, Phenol, m-Cresol, Zinkacetat-Dihydrat, Natriummonohydrogenphosphat-Dihydrat, Natriumchlorid, Salzsäure, Natriumhydroxid und Wasser für Injektionszwecke Es wird als klare, farblose, wässrige Lösung in Packungen mit 1, 5 oder 10 Zylinderampullen zu je 3 ml geliefert (es werden möglicherweise nicht alle Packungsgrößen in den Verkehr gebracht). Der pharmazeutische Unternehmer und Hersteller ist: Novo Nordisk A/S, Novo Allé, DK-2880 Bagsvaerd, Dänemark 1. WAS IST LEVEMIR UND WOFÜR WIRD ES ANGEWENDET? Levemir ist ein Humaninsulin-Analogon zur Behandlung von Diabetes mellitus. Es wird in einer 3 ml-Zylinderampulle (genannt Penfill) geliefert, die in ein Insulininjektionssystem passt. Levemir ist ein lang wirkendes Humaninsulin-Analogon, das Ihren Blutzuckerspiegel senkt. Die Wirkung hält abhängig von der Dosis bis zu 24 Stunden an. 2. WAS MÜSSEN SIE VOR DER ANWENDUNG VON LEVEMIR BEACHTEN? Levemir darf nicht angewendet werden, ► wenn Sie erste Anzeichen einer Unterzuckerung (Hypoglykämie) spüren (Symptome niedrigen Blutzuckers). Weitere Informationen über Unterzuckerungen finden Sie unter 4 Verhalten im Notfall. ► wenn Sie allergisch (überempfindlich) auf Insulindetemir, m-Cresol oder einen der sonstigen Bestandteile reagieren (siehe unten links). Achten Sie auf die unter 5 Welche Nebenwirkungen sind möglich? beschriebenen Symptome einer Allergie. Besondere Vorsicht bei der Anwendung von Levemir ist erforderlich, wenn Sie an einer Funktionsstörung der Nieren, der Leber, der Nebennieren, der Hirnanhangs- oder der Schilddrüse leiden. ► wenn Sie Alkohol trinken: Achten Sie auf Anzeichen einer Unterzuckerung (Hypoglykämie). ► wenn Sie sich mehr körperlich bewegen als üblich oder wenn Sie Ihre übliche Ernährung ändern wollen. ► wenn Sie krank sind: Unterbrechen Sie die Anwendung von Insulin nicht. ► wenn Sie ins Ausland reisen: Reisen über mehrere Zeitzonen hinweg können Ihren Insulinbedarf beeinflussen. ► wenn Sie schwanger sind, eine Schwangerschaft planen oder ein Kind stillen: Holen Sie den Rat Ihres Arztes ein. ► wenn Sie ein Fahrzeug führen oder Werkzeuge oder Maschinen bedienen: Achten Sie auf Anzeichen einer Unterzuckerung. Ihre Konzentrations- oder Reaktionsfähigkeit ist im Fall des ► 58 Auftretens einer Unterzuckerung vermindert. Führen Sie nie ein Fahrzeug und bedienen Sie nie eine Maschine, wenn Sie die Symptome einer Unterzuckerung bemerken. Wenn Sie häufig an Unterzuckerungen leiden oder wenn Sie Probleme haben, Unterzuckerungen zu erkennen, besprechen Sie mit Ihrem Arzt, ob Sie überhaupt Fahrzeuge führen oder Maschinen bedienen sollten. Es liegen keine klinischen Erfahrungen zur Verwendung von Levemir bei Kindern und Jugendlichen vor. Wechselwirkungen mit anderen Arzneimitteln Viele Arzneimittel haben Auswirkungen auf die Wirkung von Glucose in Ihrem Körper und können Ihre Insulindosis beeinflussen. Nachstehend sind die wichtigsten Arzneimittel aufgeführt, die sich auf Ihre Insulinbehandlung auswirken können. Informieren Sie bitte Ihren Arzt oder Apotheker, wenn Sie irgendwelche anderen Arzneimittel einnehmen/anwenden oder vor kurzem eingenommen/angewendet haben, auch wenn es sich um nicht verschreibungspflichtige Arzneimittel handelt. Ihr Insulinbedarf kann sich ändern, wenn Sie zusätzlich Folgendes nehmen: Antidiabetika zum Einnehmen, Monoaminoxidasehemmer (MAO-Hemmer), Betarezeptorenblocker, AngiotensinConverting-Enzyme (ACE)-Hemmer, Acetylsalicylsäure, Thiazide, Glucocorticoide, Schilddrüsenhormone, Betasympathomimetika, Wachstumshormon, Danazol, Octreotid und Lanreotid. 3. WIE IST LEVEMIR ANZUWENDEN? Sprechen Sie mit Ihrem Arzt und Ihrer Diabetesberaterin über Ihren Insulinbedarf. Befolgen Sie deren Rat genau. Diese Packungsbeilage ist eine allgemeine Anleitung. Falls Ihr Arzt einen Wechsel von einer Insulinart oder -marke zu einer anderen veranlasst hat, muss möglicherweise die Dosis durch Ihren Arzt angepasst werden. Vor der Verwendung von Levemir Überprüfen Sie anhand des Etiketts, dass es sich um den richtigen Insulintyp handelt. Überprüfen Sie immer die Zylinderampulle, einschließlich des Gummikolbens (Stopfens). Verwenden Sie sie nicht, wenn irgendeine Beschädigung zu sehen ist oder wenn der sichtbare Teil des Gummikolbens über das weiße Band hinausgeht. Geben Sie sie in diesem Fall Ihrem Apotheker zurück. ► Desinfizieren Sie die Gummimembran mit medizinischem Alkohol. ► ► Levemir darf nicht angewendet werden, in Insulininfusionspumpen. wenn die Zylinderampulle oder das Gerät, das die Zylinderampulle enthält, fallen gelassen, beschädigt oder zerdrückt wurde; es besteht die Gefahr des Austretens von Insulin. ► wenn es nicht korrekt aufbewahrt worden ist oder eingefroren war (siehe 6 Wie ist Levemir aufzubewahren?). ► wenn das Insulin nicht wasserklar und farblos aussieht. ► ► Die Zylinderampulle darf nicht wieder aufgefüllt werden. Levemir Penfill-Zylinderampullen sind zur Verwendung mit Insulininjektionssystemen von Novo Nordisk und mit NovoFine-Kanülen (Injektionsnadeln) vorgesehen. Falls Sie mit Levemir Penfill und einem anderen Insulin in Penfill-Zylinderampullen behandelt werden, sollten Sie zwei Insulininjektionssysteme verwenden, je eins für jede Insulinart. Anwendung dieses Insulins Levemir wird unter die Haut injiziert (subkutan). Injizieren Sie Ihr Insulin niemals direkt in eine Vene oder einen Muskel. Wechseln Sie immer innerhalb der gewählten Körperregion die Injektionsstelle, um Verdickungen unter der Haut zu vermeiden (siehe 5 Welche Nebenwirkungen sind 59 möglich?). Die besten Stellen für eine Injektion sind: Die Vorderseite Ihrer Oberschenkel, Ihre Bauchdecke (Abdomen) oder Ihre Oberarme. Sie sollten immer regelmäßig Ihren Blutzucker messen. Injizieren des Insulins • Injizieren Sie das Insulin unter die Haut. Wenden Sie hierbei die Injektionstechnik an, die Ihnen Ihr Arzt oder Ihre Diabetesberaterin gezeigt hat und die in der Bedienungsanleitung Ihres Injektionssystems beschrieben ist. • Lassen Sie die Injektionsnadel mindestens 6 Sekunden unter der Haut, um sicherzustellen, dass die vollständige Dosis injiziert wurde. • Verwerfen Sie nach jeder Injektion die Injektionsnadel. Andernfalls kann Flüssigkeit austreten. 4. VERHALTEN IM NOTFALL Wenn Sie eine Unterzuckerung erleiden Eine Unterzuckerung (Hypoglykämie) bedeutet, dass Ihr Blutzuckerspiegel zu niedrig ist. Die Warnzeichen einer Unterzuckerung können plötzlich auftreten. Diese Warnzeichen können sein: kalter Schweiß, kalte blasse Haut, Kopfschmerzen, Herzrasen, Übelkeit, großer Hunger, vorübergehende Sehstörungen, Benommenheit, ungewöhnliche Müdigkeit und Schwäche, Nervosität oder Zittern, Angstgefühle, Verwirrung, Konzentrationsschwierigkeiten. Falls Sie irgendeines dieser Warnzeichen bemerken: Essen Sie Traubenzucker oder ein stark zuckerhaltiges Produkt (Süßigkeiten, Kekse, Fruchtsaft), ruhen Sie sich anschließend aus. Nehmen Sie keinerlei Insulin, wenn Sie erste Anzeichen einer Unterzuckerung spüren. Sie sollten deswegen immer Traubenzucker, Süßigkeiten, Kekse oder Fruchtsaft bei sich haben. Sagen Sie anderen, dass sie Sie im Falle einer Bewusstlosigkeit in die stabile Seitenlage bringen und sofort einen Arzt verständigen sollen. Sie dürfen Ihnen nichts zu essen oder zu trinken geben. Sie könnten daran ersticken. ► Wenn eine schwere Unterzuckerung nicht behandelt wird, kann das zu (vorübergehenden oder dauerhaften) Hirnschäden oder sogar zum Tode führen. ► Wenn Sie eine Unterzuckerung mit Bewusstlosigkeit hatten, oder bei häufig auftretenden Unterzuckerungen, suchen Sie Ihren Arzt auf. Möglicherweise müssen Ihre Insulindosis, der Zeitpunkt der Anwendung, Ihre Ernährung oder Ihre körperliche Bewegung angepasst werden. Verwendung von Glucagon Sie können das Bewusstsein schneller wiedererlangen, wenn Ihnen das Hormon Glucagon von einer Person, die mit dessen Gabe vertraut ist, injiziert wird. In diesem Fall sollten Sie, sobald Sie wieder bei Bewusstsein sind, Traubenzucker oder ein zuckerhaltiges Produkt zu sich nehmen. Wenn Sie nicht auf die Glucagonbehandlung ansprechen, müssen Sie in einem Krankenhaus weiterbehandelt werden. Nehmen Sie nach einer Glucagoninjektion mit Ihrem Arzt oder einer Notfallstation Kontakt auf: Sie müssen den Grund für Ihre Unterzuckerung (Hypoglykämie) herausfinden, um weitere Unterzuckerungen zu vermeiden. Ursachen einer Unterzuckerung Sie bekommen eine Unterzuckerung, wenn Ihr Blutzucker zu niedrig wird. Dies kann passieren, • wenn Sie zu viel Insulin injizieren. wenn Sie zu wenig essen oder eine Mahlzeit auslassen. • • wenn Sie sich mehr als sonst körperlich anstrengen. Wenn Ihr Blutzucker zu hoch ansteigt Ihr Blutzucker kann zu hoch ansteigen (dies wird Hyperglykämie genannt). Die Warnzeichen treten allmählich auf. Zu ihnen gehören: Verstärkter Harndrang, Durst, Appetitlosigkeit, Übelkeit oder Erbrechen, Benommenheit oder Müdigkeit, gerötete trockene Haut, Mundtrockenheit und fruchtig (nach Aceton) riechender Atem. Falls Sie irgendeines dieser Warnzeichen bemerken: Überprüfen Sie Ihren Blutzuckerspiegel, untersuchen Sie wenn möglich Ihren Urin auf Ketone und suchen Sie sofort medizinische Hilfe. 60 Diese Symptome können Anzeichen eines sehr ernsten Zustandes sein, den man diabetische Ketoazidose nennt. Unbehandelt kann dieser Zustand in diabetischem Koma oder mit dem Tod enden. Ursachen für hohen Blutzucker • Sie haben eine Insulininjektion vergessen. • wiederholtes Injizieren von weniger Insulin, als Sie benötigen • eine Infektion oder Fieber mehr Essen als üblich • • weniger körperliche Bewegung als üblich 5. WELCHE NEBENWIRKUNGEN SIND MÖGLICH? Wie alle Arzneimittel kann Levemir Nebenwirkungen haben. Die Anwendung von zu viel Levemir kann zu niedrigem Blutzucker (Hypoglykämie) führen. Beachten Sie die Empfehlungen unter 4 Verhalten im Notfall. Häufig auftretende Nebenwirkungen (bei weniger als 1 von 10 Patienten) Veränderungen an der Injektionsstelle. An der Injektionsstelle können Reaktionen (Rötung, Schwellung, Juckreiz) auftreten. Diese verschwinden normalerweise nach einigen Wochen der Insulinanwendung. Suchen Sie Ihren Arzt auf, falls diese Symptome nicht verschwinden. Gelegentlich auftretende Nebenwirkungen (bei weniger als 1 von 100 Patienten) Symptome einer Allergie. Es können Quaddeln und Hautausschläge auftreten. Suchen Sie unverzüglich medizinische Hilfe, ► wenn die oben genannten Anzeichen einer Allergie auftreten, oder ► wenn Sie sich plötzlich unwohl fühlen und Sie Schweißausbrüche haben oder Übelkeit (Erbrechen), Atembeschwerden, Herzrasen oder Schwindel auftreten. Sie haben möglicherweise eine sehr seltene schwere allergische Reaktion auf Levemir oder einen seiner Bestandteile (eine so genannte generalisierte allergische Reaktion). Beachten Sie auch die Warnung unter 2 Was müssen Sie vor der Anwendung von Levemir beachten?. Sehstörungen. Zu Beginn Ihrer Insulinbehandlung können gelegentlich Sehstörungen auftreten, die aber normalerweise wieder abklingen. Veränderungen an der Injektionsstelle. Wenn Sie sich zu oft eine Injektion an der gleichen Stelle geben, können sich darunter Verdickungen bilden. Verhindern Sie dies, indem Sie die Injektionsstellen jedes Mal innerhalb der gewählten Körperregion wechseln. Geschwollene Gelenke. Zu Beginn einer Insulinbehandlung kann eine Wasseransammlung Schwellungen um Ihre Knöchel und andere Gelenke verursachen. Diese gehen bald wieder zurück. Selten auftretende Nebenwirkungen (bei weniger als 1 von 1.000 Patienten) Sensibilitätsstörung. Eine schnelle Verbesserung der Blutzuckereinstellung kann zu Sensibilitätsstörungen (Taubheit, Schwäche oder Schmerz) in Armen oder Beinen führen. Diese Symptome verschwinden in der Regel im Laufe der Behandlung wieder. Informieren Sie Ihren Arzt oder Apotheker, wenn Sie Nebenwirkungen bemerken, auch solche, die nicht in dieser Packungsbeilage aufgeführt sind. 6. WIE IST LEVEMIR AUFZUBEWAHREN? Arzneimittel für Kinder unzugänglich aufbewahren. 61 Nicht in Gebrauch befindliches Levemir Penfill ist im Kühlschrank bei 2°C – 8°C zu lagern, aber nicht in der Nähe des Gefrierfachs. Nicht einfrieren. In Gebrauch befindliches Levemir Penfill und solches, das als Ersatz mitgeführt wird, ist nicht im Kühlschrank zu lagern. Sie können es mit sich führen und bei Raumtemperatur (nicht über 30°C) bis zu 6 Wochen lang aufbewahren. Das Behältnis im Umkarton aufbewahren, um den Inhalt vor Licht zu schützen. Levemir muss vor übermäßiger Hitze und Sonnenlicht geschützt werden. Verwenden Sie Levemir nicht nach dem auf dem Etikett und dem Umkarton angegebenen Verfallsdatum. Stand der Information: 62 LEVEMIR Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung Ihres Insulins beginnen. Heben Sie diese Packungsbeilage auf. Vielleicht möchten Sie diese später nochmals lesen. Wenn Sie weitere Fragen haben, wenden Sie sich bitte an Ihren Arzt, Ihre Diabetesberaterin oder Ihren Apotheker. Dieses Arzneimittel wurde Ihnen persönlich verschrieben und darf nicht an Dritte weitergegeben werden. Es kann anderen Menschen schaden, auch wenn diese dieselben Symptome haben wie Sie. Diese Seite der Packungsbeilage beinhaltet: 1. 2. 3. 4. 5. 6. Was ist Levemir und wofür wird es angewendet? Was müssen Sie vor der Anwendung von Levemir beachten? Wie ist Levemir anzuwenden? Verhalten im Notfall Welche Nebenwirkungen sind möglich? Wie ist Levemir aufzubewahren? Rückseite: Die Bedienungsanleitung für Ihren FlexPen. Levemir 100 E/ml Injektionslösung in einem Injektor, vorgefüllt. FlexPen. Insulindetemir, r-DNS Der arzneilich wirksame Bestandteil ist durch rekombinante DNS-Technologie hergestelltes Insulindetemir. 1 ml enthält 100 E Insulindetemir. 1 vorgefüllter Injektor enthält 3 ml, entsprechend 300 E. Die sonstigen Bestandteile sind Mannitol, Phenol, m-Cresol, Zinkacetat-Dihydrat, Natriummonohydrogenphosphat-Dihydrat, Natriumchlorid, Salzsäure, Natriumhydroxid und Wasser für Injektionszwecke Es wird als klare, farblose, wässrige Lösung in Packungen mit 1, 5 oder 10 vorgefüllten Injektoren zu je 3 ml geliefert (es werden möglicherweise nicht alle Packungsgrößen in den Verkehr gebracht). Der pharmazeutische Unternehmer und Hersteller ist: Novo Nordisk A/S, Novo Allé, DK-2880 Bagsvaerd, Dänemark 1. WAS IST LEVEMIR UND WOFÜR WIRD ES ANGEWENDET? Levemir ist ein Humaninsulin-Analogon zur Behandlung von Diabetes mellitus. Es wird in einem mit 3 ml vorgefüllten Injektor (genannt FlexPen) geliefert. Levemir ist ein lang wirkendes Humaninsulin-Analogon, das Ihren Blutzuckerspiegel senkt. Die Wirkung hält abhängig von der Dosis bis zu 24 Stunden an. 2. WAS MÜSSEN SIE VOR DER ANWENDUNG VON LEVEMIR BEACHTEN? Levemir darf nicht angewendet werden, wenn Sie erste Anzeichen einer Unterzuckerung (Hypoglykämie) spüren (Symptome niedrigen Blutzuckers). Weitere Informationen über Unterzuckerungen finden Sie unter 4 Verhalten im Notfall. ► wenn Sie allergisch (überempfindlich) auf Insulindetemir, m-Cresol oder einen der sonstigen Bestandteile reagieren (siehe unten links). Achten Sie auf die unter 5 Welche Nebenwirkungen sind möglich? beschriebenen Symptome einer Allergie. ► Besondere Vorsicht bei der Anwendung von Levemir ist erforderlich, 63 ► ► ► ► ► ► ► wenn Sie an einer Funktionsstörung der Nieren, der Leber, der Nebennieren, der Hirnanhangs- oder der Schilddrüse leiden. wenn Sie Alkohol trinken: Achten Sie auf Anzeichen einer Unterzuckerung (Hypoglykämie). wenn Sie sich mehr körperlich bewegen als üblich oder wenn Sie Ihre übliche Ernährung ändern wollen. wenn Sie krank sind: Unterbrechen Sie die Anwendung von Insulin nicht. wenn Sie ins Ausland reisen: Reisen über mehrere Zeitzonen hinweg können Ihren Insulinbedarf beeinflussen. wenn Sie schwanger sind, eine Schwangerschaft planen oder ein Kind stillen: Holen Sie den Rat Ihres Arztes ein. wenn Sie ein Fahrzeug führen oder Werkzeuge oder Maschinen bedienen: Achten Sie auf Anzeichen einer Unterzuckerung. Ihre Konzentrations- oder Reaktionsfähigkeit ist im Fall des Auftretens einer Unterzuckerung vermindert. Führen Sie nie ein Fahrzeug und bedienen Sie nie eine Maschine, wenn Sie die Symptome einer Unterzuckerung bemerken. Wenn Sie häufig an Unterzuckerungen leiden oder wenn Sie Probleme haben, Unterzuckerungen zu erkennen, besprechen Sie mit Ihrem Arzt, ob Sie überhaupt Fahrzeuge führen oder Maschinen bedienen sollten. Es liegen keine klinischen Erfahrungen zur Verwendung von Levemir bei Kindern und Jugendlichen vor. Wechselwirkungen mit anderen Arzneimitteln Viele Arzneimittel haben Auswirkungen auf die Wirkung von Glucose in Ihrem Körper und können Ihre Insulindosis beeinflussen. Nachstehend sind die wichtigsten Arzneimittel aufgeführt, die sich auf Ihre Insulinbehandlung auswirken können. Informieren Sie bitte Ihren Arzt oder Apotheker, wenn Sie irgendwelche anderen Arzneimittel einnehmen/anwenden oder vor kurzem eingenommen/angewendet haben, auch wenn es sich um nicht verschreibungspflichtige Arzneimittel handelt. Ihr Insulinbedarf kann sich ändern, wenn Sie zusätzlich Folgendes nehmen: Antidiabetika zum Einnehmen, Monoaminoxidasehemmer (MAO-Hemmer), Betarezeptorenblocker, AngiotensinConverting-Enzyme (ACE)-Hemmer, Acetylsalicylsäure, Thiazide, Glucocorticoide, Schilddrüsenhormone, Betasympathomimetika, Wachstumshormon, Danazol, Octreotid und Lanreotid. 3. WIE IST LEVEMIR ANZUWENDEN? Sprechen Sie mit Ihrem Arzt und Ihrer Diabetesberaterin über Ihren Insulinbedarf. Befolgen Sie deren Rat genau. Diese Packungsbeilage ist eine allgemeine Anleitung. Falls Ihr Arzt einen Wechsel von einer Insulinart oder -marke zu einer anderen veranlasst hat, muss möglicherweise die Dosis durch Ihren Arzt angepasst werden. Injizieren des Insulins • Auf der Rückseite finden Sie eine detaillierte Anleitung. Was müssen Sie vor der Anwendung von Levemir FlexPen beachten? Überprüfen Sie anhand des Etiketts, dass es sich um den richtigen Insulintyp handelt. ► Levemir darf nicht angewendet werden, in Insulininfusionspumpen. wenn die Zylinderampulle oder das Gerät, das die Zylinderampulle enthält, fallen gelassen, beschädigt oder zerdrückt wurde; es besteht die Gefahr des Austretens von Insulin. ► wenn es nicht korrekt aufbewahrt worden ist oder eingefroren war (siehe 6 Wie ist Levemir aufzubewahren?). wenn das Insulin nicht wasserklar und farblos aussieht. ► ► ► Anwendung dieses Insulins 64 Levemir wird unter die Haut injiziert (subkutan). Injizieren Sie Ihr Insulin niemals direkt in eine Vene oder einen Muskel. Wechseln Sie immer innerhalb der gewählten Körperregion die Injektionsstelle, um Verdickungen unter der Haut zu vermeiden (siehe 5 Welche Nebenwirkungen sind möglich?). Die besten Stellen für eine Injektion sind: Die Vorderseite Ihrer Oberschenkel, Ihre Bauchdecke (Abdomen) oder Ihre Oberarme. Sie sollten immer regelmäßig Ihren Blutzucker messen. 4. VERHALTEN IM NOTFALL Wenn Sie eine Unterzuckerung erleiden Eine Unterzuckerung (Hypoglykämie) bedeutet, dass Ihr Blutzuckerspiegel zu niedrig ist. Die Warnzeichen einer Unterzuckerung können plötzlich auftreten. Diese Warnzeichen können sein: kalter Schweiß, kalte blasse Haut, Kopfschmerzen, Herzrasen, Übelkeit, großer Hunger, vorübergehende Sehstörungen, Benommenheit, ungewöhnliche Müdigkeit und Schwäche, Nervosität oder Zittern, Angstgefühle, Verwirrung, Konzentrationsschwierigkeiten. Falls Sie irgendeines dieser Warnzeichen bemerken: Essen Sie Traubenzucker oder ein stark zuckerhaltiges Produkt (Süßigkeiten, Kekse, Fruchtsaft), ruhen Sie sich anschließend aus. Nehmen Sie keinerlei Insulin, wenn Sie erste Anzeichen einer Unterzuckerung spüren. Sie sollten deswegen immer Traubenzucker, Süßigkeiten, Kekse oder Fruchtsaft bei sich haben. Sagen Sie anderen, dass sie Sie im Falle einer Bewusstlosigkeit in die stabile Seitenlage bringen und sofort einen Arzt verständigen sollen. Sie dürfen Ihnen nichts zu essen oder zu trinken geben. Sie könnten daran ersticken. ► Wenn eine schwere Unterzuckerung nicht behandelt wird, kann das zu (vorübergehenden oder dauerhaften) Hirnschäden oder sogar zum Tode führen. ► Wenn Sie eine Unterzuckerung mit Bewusstlosigkeit hatten, oder bei häufig auftretenden Unterzuckerungen, suchen Sie Ihren Arzt auf. Möglicherweise müssen Ihre Insulindosis, der Zeitpunkt der Anwendung, Ihre Ernährung oder Ihre körperliche Bewegung angepasst werden. Verwendung von Glucagon Sie können das Bewusstsein schneller wiedererlangen, wenn Ihnen das Hormon Glucagon von einer Person, die mit dessen Gabe vertraut ist, injiziert wird. In diesem Fall sollten Sie, sobald Sie wieder bei Bewusstsein sind, Traubenzucker oder ein zuckerhaltiges Produkt zu sich nehmen. Wenn Sie nicht auf die Glucagonbehandlung ansprechen, müssen Sie in einem Krankenhaus weiterbehandelt werden. Nehmen Sie nach einer Glucagoninjektion mit Ihrem Arzt oder einer Notfallstation Kontakt auf: Sie müssen den Grund für Ihre Unterzuckerung (Hypoglykämie) herausfinden, um weitere Unterzuckerungen zu vermeiden. Ursachen einer Unterzuckerung Sie bekommen eine Unterzuckerung, wenn Ihr Blutzucker zu niedrig wird. Dies kann passieren, wenn Sie zu viel Insulin injizieren. • • wenn Sie zu wenig essen oder eine Mahlzeit auslassen. • wenn Sie sich mehr als sonst körperlich anstrengen. Wenn Ihr Blutzucker zu hoch ansteigt Ihr Blutzucker kann zu hoch ansteigen (dies wird Hyperglykämie genannt). Die Warnzeichen treten allmählich auf. Zu ihnen gehören: Verstärkter Harndrang, Durst, Appetitlosigkeit, Übelkeit oder Erbrechen, Benommenheit oder Müdigkeit, gerötete trockene Haut, Mundtrockenheit und fruchtig (nach Aceton) riechender Atem. Falls Sie irgendeines dieser Warnzeichen bemerken: Überprüfen Sie Ihren Blutzuckerspiegel, untersuchen Sie wenn möglich Ihren Urin auf Ketone und suchen Sie sofort medizinische Hilfe. Diese Symptome können Anzeichen eines sehr ernsten Zustandes sein, den man diabetische Ketoazidose nennt. Unbehandelt kann dieser Zustand in diabetischem Koma oder mit dem Tod enden. Ursachen für hohen Blutzucker • Sie haben eine Insulininjektion vergessen. • wiederholtes Injizieren von weniger Insulin, als Sie benötigen • eine Infektion oder Fieber 65 • • mehr Essen als üblich weniger körperliche Bewegung als üblich 5. WELCHE NEBENWIRKUNGEN SIND MÖGLICH? Wie alle Arzneimittel kann Levemir Nebenwirkungen haben. Die Anwendung von zu viel Levemir kann zu niedrigem Blutzucker (Hypoglykämie) führen. Beachten Sie die Empfehlungen unter 4 Verhalten im Notfall. Häufig auftretende Nebenwirkungen (bei weniger als 1 von 10 Patienten) Veränderungen an der Injektionsstelle. An der Injektionsstelle können Reaktionen (Rötung, Schwellung, Juckreiz) auftreten. Diese verschwinden normalerweise nach einigen Wochen der Insulinanwendung. Suchen Sie Ihren Arzt auf, falls diese Symptome nicht verschwinden. Gelegentlich auftretende Nebenwirkungen (bei weniger als 1 von 100 Patienten) Symptome einer Allergie. Es können Quaddeln und Hautausschläge auftreten. Suchen Sie unverzüglich medizinische Hilfe, ► wenn die oben genannten Anzeichen einer Allergie auftreten, oder ► wenn Sie sich plötzlich unwohl fühlen und Sie Schweißausbrüche haben oder Übelkeit (Erbrechen), Atembeschwerden, Herzrasen oder Schwindel auftreten. Sie haben möglicherweise eine sehr seltene schwere allergische Reaktion auf Levemir oder einen seiner Bestandteile (eine so genannte generalisierte allergische Reaktion). Beachten Sie auch die Warnung unter 2 Was müssen Sie vor der Anwendung von Levemir beachten?. Sehstörungen. Zu Beginn Ihrer Insulinbehandlung können gelegentlich Sehstörungen auftreten, die aber normalerweise wieder abklingen. Veränderungen an der Injektionsstelle. Wenn Sie sich zu oft eine Injektion an der gleichen Stelle geben, können sich darunter Verdickungen bilden. Verhindern Sie dies, indem Sie die Injektionsstellen jedes Mal innerhalb der gewählten Körperregion wechseln. Geschwollene Gelenke. Zu Beginn einer Insulinbehandlung kann eine Wasseransammlung Schwellungen um Ihre Knöchel und andere Gelenke verursachen. Diese gehen bald wieder zurück. Selten auftretende Nebenwirkungen (bei weniger als 1 von 1.000 Patienten) Sensibilitätsstörung. Eine schnelle Verbesserung der Blutzuckereinstellung kann zu Sensibilitätsstörungen (Taubheit, Schwäche oder Schmerz) in Armen oder Beinen führen. Diese Symptome verschwinden in der Regel im Laufe der Behandlung wieder. Informieren Sie Ihren Arzt oder Apotheker, wenn Sie Nebenwirkungen bemerken, auch solche, die nicht in dieser Packungsbeilage aufgeführt sind. 6. WIE IST LEVEMIR AUFZUBEWAHREN? Arzneimittel für Kinder unzugänglich aufbewahren. Nicht in Gebrauch befindliches Levemir FlexPen ist im Kühlschrank bei 2°C – 8°C zu lagern, aber nicht in der Nähe des Gefrierfachs. Nicht einfrieren. In Gebrauch befindliches Levemir FlexPen und solches, das als Ersatz mitgeführt wird, ist nicht im Kühlschrank zu lagern. Sie können es mit sich führen und bei Raumtemperatur (nicht über 30°C) bis zu 6 Wochen lang aufbewahren. Lassen Sie zum Schutz vor Licht die Verschlusskappe immer aufgesetzt, wenn der FlexPen nicht in Gebrauch ist. 66 Levemir muss vor übermäßiger Hitze und Sonnenlicht geschützt werden. Verwenden Sie Levemir nicht nach dem auf dem Etikett und dem Umkarton angegebenen Verfallsdatum. Auf der Rückseite finden Sie Informationen zur Bedienung Ihres FlexPen. Stand der Information: 67 Informationen über die Injektion von Levemir FlexPen Bitte lesen Sie die folgende Bedienungsanleitung vor der Benutzung von Levemir FlexPen sorgfältig durch. Einleitung Levemir FlexPen ist ein außergewöhnlich einfach einstellbarer Insulininjektor. Sie können Dosen zwischen 1 und 60 Einheiten in Schritten von jeweils einer Einheit einstellen. Levemir FlexPen wurde speziell für die Verwendung mit NovoFine S-Kanülen (Injektionsnadeln) mit einer Länge von 8 mm oder kürzer entwickelt. Achten Sie darauf, dass Ihre Kanülenpackung mit einem S gekennzeichnet ist. S steht für „short cap“ (= verkürzte innere Hülle der Injektionsnadel). 68 Erste Schritte Überprüfen Sie anhand des Etiketts, ob Levemir FlexPen den richtigen Insulintyp enthält. Nehmen Sie die Verschlusskappe ab. Vor jeder Injektion: • Desinfizieren Sie die Gummimembran mit medizinischem Alkohol. • Entfernen Sie die Schutzlasche von einer NovoFine S-Kanüle (Injektionsnadel). • Schrauben Sie die Injektionsnadel gerade und fest auf den Levemir FlexPen (Abbildung A) • Ziehen Sie die große äußere Schutzkappe der Injektionsnadel und die innere Hülle der Injektionsnadel ab (Abbildung B). Werfen Sie die große äußere Schutzkappe der Injektionsnadel nicht weg. Vorbereitung zur Entfernung der Luft vor jeder Injektion In der Zylinderampulle und in der Injektionsnadel können sich während des üblichen Gebrauchs kleine Mengen Luft ansammeln. Gehen Sie folgendermaßen vor, um die Injektion von Luft zu vermeiden und eine korrekte Dosierung sicherzustellen: • Stellen Sie zwei Einheiten ein (Abbildung C). • Halten Sie den Levemir FlexPen mit der Injektionsnadel nach oben und klopfen Sie ein paar Mal mit dem Finger leicht gegen die Zylinderampulle, damit sich eventuell vorhandene Luftblasen oben in der Zylinderampulle sammeln (Abbildung D) • Während Sie die Injektionsnadel weiterhin nach oben halten, drücken Sie den Druckknopf ganz hinein. Der Dosisregler geht auf Null zurück. • Jetzt sollte an der Spitze der Injektionsnadel ein Insulintropfen erscheinen. Falls nicht, wechseln Sie die Injektionsnadel und wiederholen Sie den Vorgang nicht mehr als sechs Mal. Wenn dann noch immer kein Tropfen Insulin austritt, ist das Gerät defekt und darf nicht verwendet werden. Einstellen der Dosis • • Kontrollieren Sie, ob der Dosisvorwahlknopf auf Null steht. Stellen Sie die Anzahl der Einheiten ein, die Sie injizieren müssen (Abbildung E). 69 Die Dosis kann sowohl nach oben als auch nach unten korrigiert werden, indem Sie den Dosisvorwahlknopf in die entsprechende Richtung drehen. Achten Sie bei der Dosiskorrektur darauf, nicht auf den Druckknopf zu drücken, da sonst Insulin austritt. Verwenden Sie nie die Restmengenskala zum Abmessen Ihrer Insulindosis. Sie können keine größere Anzahl an Einheiten wählen, als noch in der Zylinderampulle enthalten ist. Injizieren des Insulins • • • Stechen Sie die Injektionsnadel in Ihre Haut (Abbildung F). Führen Sie die Injektionstechnik aus, die Ihnen Ihr Arzt gezeigt hat. Geben Sie sich die Dosis, indem Sie den Druckknopf ganz hineindrücken (Abbildung G). Achten Sie darauf, nur während der Injektion auf den Druckknopf zu drücken. Halten Sie den Druckknopf nach der Injektion ganz hineingedrückt, bis die Injektionsnadel aus der Haut gezogen wurde. Die Injektionsnadel muss nach der Injektion mindestens sechs Sekunden unter der Haut bleiben. Auf diese Weise wird sichergestellt, dass die vollständige Insulindosis injiziert wurde. Entfernen der Injektionsnadel • Setzen Sie die große äußere Schutzkappe der Injektionsnadel wieder auf und schrauben Sie die Injektionsnadel ab (Abbildung H). Entsorgen Sie diese sorgfältig. Verwenden Sie für jede Injektion eine neue Injektionsnadel. Entfernen Sie die Injektionsnadel nach jeder Injektion. Andernfalls könnte bei Temperaturänderungen Flüssigkeit austreten. Medizinisches Personal sowie andere Angestellte, die im Sozialbereich tätig sind, und Familienangehörige sollten allgemeine Vorsichtsmaßnahmen zur Entfernung und Entsorgung der Injektionsnadeln beachten, um unbeabsichtigte Stiche zu vermeiden. Entsorgen Sie den verbrauchten Levemir FlexPen sorgfältig mit abgeschraubter Injektionsnadel. 70 Wartung Ihr Levemir FlexPen ist für eine sehr genaue und sichere Funktionsweise entwickelt worden. Er muss mit der entsprechenden Sorgfalt behandelt werden. Wenn er fallen gelassen, beschädigt oder zerdrückt wird, besteht die Gefahr des Austretens von Insulin. Für den Fall, dass Ihr FlexPen verloren geht oder beschädigt wird, sollten Sie als Vorsichtsmaßnahme immer ein Ersatz-Insulininjektionsgerät mitführen. Levemir FlexPen darf nicht wieder aufgefüllt werden. Äußerlich kann Levemir FlexPen durch Abwischen mit einem Wattebausch, der mit medizinischem Alkohol angefeuchtet wurde, gereinigt werden. Der FlexPen darf nicht in medizinischen Alkohol gelegt, gewaschen oder mit einem Schmiermittel behandelt werden. Dadurch kann die Mechanik beschädigt werden. 71 LEVEMIR Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung Ihres Insulins beginnen. Heben Sie diese Packungsbeilage auf. Vielleicht möchten Sie diese später nochmals lesen. Wenn Sie weitere Fragen haben, wenden Sie sich bitte an Ihren Arzt, Ihre Diabetesberaterin oder Ihren Apotheker. Dieses Arzneimittel wurde Ihnen persönlich verschrieben und darf nicht an Dritte weitergegeben werden. Es kann anderen Menschen schaden, auch wenn diese dieselben Symptome haben wie Sie. Diese Seite der Packungsbeilage beinhaltet: 1. 2. 3. 4. 5. 6. Was ist Levemir und wofür wird es angewendet? Was müssen Sie vor der Anwendung von Levemir beachten? Wie ist Levemir anzuwenden? Verhalten im Notfall Welche Nebenwirkungen sind möglich? Wie ist Levemir aufzubewahren? Rückseite: Die Bedienungsanleitung für Ihren InnoLet. Levemir 100 E/ml Injektionslösung in einem Injektor, vorgefüllt. InnoLet. Insulindetemir, r-DNS Der arzneilich wirksame Bestandteil ist durch rekombinante DNS-Technologie hergestelltes Insulindetemir. 1 ml enthält 100 E Insulindetemir. 1 vorgefüllter Injektor enthält 3 ml, entsprechend 300 E. Die sonstigen Bestandteile sind Mannitol, Phenol, m-Cresol, Zinkacetat-Dihydrat, Natriummonohydrogenphosphat-Dihydrat, Natriumchlorid, Salzsäure, Natriumhydroxid und Wasser für Injektionszwecke Es wird als klare, farblose, wässrige Lösung in Packungen mit 1, 5 oder 10 vorgefüllten Injektoren zu je 3 ml geliefert (es werden möglicherweise nicht alle Packungsgrößen in den Verkehr gebracht). Der pharmazeutische Unternehmer und Hersteller ist: Novo Nordisk A/S, Novo Allé, DK-2880 Bagsvaerd, Dänemark 1. WAS IST LEVEMIR UND WOFÜR WIRD ES ANGEWENDET? Levemir ist ein Humaninsulin-Analogon zur Behandlung von Diabetes mellitus. Es wird in einem mit 3 ml vorgefüllten Injektor (genannt InnoLet) geliefert. Levemir ist ein lang wirkendes Humaninsulin-Analogon, das Ihren Blutzuckerspiegel senkt. Die Wirkung hält abhängig von der Dosis bis zu 24 Stunden an. 2. WAS MÜSSEN SIE VOR DER ANWENDUNG VON LEVEMIR BEACHTEN? Levemir darf nicht angewendet werden, ► wenn Sie erste Anzeichen einer Unterzuckerung (Hypoglykämie) spüren (Symptome niedrigen Blutzuckers). Weitere Informationen über Unterzuckerungen finden Sie unter 4 Verhalten im Notfall. ► wenn Sie allergisch (überempfindlich) auf Insulindetemir, m-Cresol oder einen der sonstigen Bestandteile reagieren (siehe unten links). Achten Sie auf die unter 5 Welche Nebenwirkungen sind möglich? beschriebenen Symptome einer Allergie. Besondere Vorsicht bei der Anwendung von Levemir ist erforderlich, 72 ► ► ► ► ► ► ► wenn Sie an einer Funktionsstörung der Nieren, der Leber, der Nebennieren, der Hirnanhangs- oder der Schilddrüse leiden. wenn Sie Alkohol trinken: Achten Sie auf Anzeichen einer Unterzuckerung (Hypoglykämie). wenn Sie sich mehr körperlich bewegen als üblich oder wenn Sie Ihre übliche Ernährung ändern wollen. wenn Sie krank sind: Unterbrechen Sie die Anwendung von Insulin nicht. wenn Sie ins Ausland reisen: Reisen über mehrere Zeitzonen hinweg können Ihren Insulinbedarf beeinflussen. wenn Sie schwanger sind, eine Schwangerschaft planen oder ein Kind stillen: Holen Sie den Rat Ihres Arztes ein. wenn Sie ein Fahrzeug führen oder Werkzeuge oder Maschinen bedienen: Achten Sie auf Anzeichen einer Unterzuckerung. Ihre Konzentrations- oder Reaktionsfähigkeit ist im Fall des Auftretens einer Unterzuckerung vermindert. Führen Sie nie ein Fahrzeug und bedienen Sie nie eine Maschine, wenn Sie die Symptome einer Unterzuckerung bemerken. Wenn Sie häufig an Unterzuckerungen leiden oder wenn Sie Probleme haben, Unterzuckerungen zu erkennen, besprechen Sie mit Ihrem Arzt, ob Sie überhaupt Fahrzeuge führen oder Maschinen bedienen sollten. Es liegen keine klinischen Erfahrungen zur Verwendung von Levemir bei Kindern und Jugendlichen vor. Wechselwirkungen mit anderen Arzneimitteln Viele Arzneimittel haben Auswirkungen auf die Wirkung von Glucose in Ihrem Körper und können Ihre Insulindosis beeinflussen. Nachstehend sind die wichtigsten Arzneimittel aufgeführt, die sich auf Ihre Insulinbehandlung auswirken können. Informieren Sie bitte Ihren Arzt oder Apotheker, wenn Sie irgendwelche anderen Arzneimittel einnehmen/anwenden oder vor kurzem eingenommen/angewendet haben, auch wenn es sich um nicht verschreibungspflichtige Arzneimittel handelt. Ihr Insulinbedarf kann sich ändern, wenn Sie zusätzlich Folgendes nehmen: Antidiabetika zum Einnehmen, Monoaminoxidasehemmer (MAO-Hemmer), Betarezeptorenblocker, AngiotensinConverting-Enzyme (ACE)-Hemmer, Acetylsalicylsäure, Thiazide, Glucocorticoide, Schilddrüsenhormone, Betasympathomimetika, Wachstumshormon, Danazol, Octreotid und Lanreotid. 3. WIE IST LEVEMIR ANZUWENDEN? Sprechen Sie mit Ihrem Arzt und Ihrer Diabetesberaterin über Ihren Insulinbedarf. Befolgen Sie deren Rat genau. Diese Packungsbeilage ist eine allgemeine Anleitung. Falls Ihr Arzt einen Wechsel von einer Insulinart oder -marke zu einer anderen veranlasst hat, muss möglicherweise die Dosis durch Ihren Arzt angepasst werden. Injizieren des Insulins • Auf der Rückseite finden Sie eine detaillierte Anleitung. Was müssen Sie vor der Anwendung von Levemir InnoLet beachten? Überprüfen Sie anhand des Etiketts, dass es sich um den richtigen Insulintyp handelt ► Levemir darf nicht angewendet werden, in Insulininfusionspumpen. wenn die Zylinderampulle oder das Gerät, das die Zylinderampulle enthält, fallen gelassen, beschädigt oder zerdrückt wurde; es besteht die Gefahr des Austretens von Insulin. ► wenn es nicht korrekt aufbewahrt worden ist oder eingefroren war (siehe 6 Wie ist Levemir aufzubewahren?). wenn das Insulin nicht wasserklar und farblos aussieht. ► ► ► 73 Anwendung dieses Insulins Levemir wird unter die Haut injiziert (subkutan). Injizieren Sie Ihr Insulin niemals direkt in eine Vene oder einen Muskel. Wechseln Sie immer innerhalb der gewählten Körperregion die Injektionsstelle, um Verdickungen unter der Haut zu vermeiden (siehe 5 Welche Nebenwirkungen sind möglich?). Die besten Stellen für eine Injektion sind: Die Vorderseite Ihrer Oberschenkel, Ihre Bauchdecke (Abdomen) oder Ihre Oberarme. Sie sollten immer regelmäßig Ihren Blutzucker messen. 4. VERHALTEN IM NOTFALL Wenn Sie eine Unterzuckerung erleiden Eine Unterzuckerung (Hypoglykämie) bedeutet, dass Ihr Blutzuckerspiegel zu niedrig ist. Die Warnzeichen einer Unterzuckerung können plötzlich auftreten. Diese Warnzeichen können sein: kalter Schweiß, kalte blasse Haut, Kopfschmerzen, Herzrasen, Übelkeit, großer Hunger, vorübergehende Sehstörungen, Benommenheit, ungewöhnliche Müdigkeit und Schwäche, Nervosität oder Zittern, Angstgefühle, Verwirrung, Konzentrationsschwierigkeiten. Falls Sie irgendeines dieser Warnzeichen bemerken: Essen Sie Traubenzucker oder ein stark zuckerhaltiges Produkt (Süßigkeiten, Kekse, Fruchtsaft), ruhen Sie sich anschließend aus. Nehmen Sie keinerlei Insulin, wenn Sie erste Anzeichen einer Unterzuckerung spüren. Sie sollten deswegen immer Traubenzucker, Süßigkeiten, Kekse oder Fruchtsaft bei sich haben. Sagen Sie anderen, dass sie Sie im Falle einer Bewusstlosigkeit in die stabile Seitenlage bringen und sofort einen Arzt verständigen sollen. Sie dürfen Ihnen nichts zu essen oder zu trinken geben. Sie könnten daran ersticken. ► Wenn eine schwere Unterzuckerung nicht behandelt wird, kann das zu (vorübergehenden oder dauerhaften) Hirnschäden oder sogar zum Tode führen. ► Wenn Sie eine Unterzuckerung mit Bewusstlosigkeit hatten, oder bei häufig auftretenden Unterzuckerungen, suchen Sie Ihren Arzt auf. Möglicherweise müssen Ihre Insulindosis, der Zeitpunkt der Anwendung, Ihre Ernährung oder Ihre körperliche Bewegung angepasst werden. Verwendung von Glucagon Sie können das Bewusstsein schneller wiedererlangen, wenn Ihnen das Hormon Glucagon von einer Person, die mit dessen Gabe vertraut ist, injiziert wird. In diesem Fall sollten Sie, sobald Sie wieder bei Bewusstsein sind, Traubenzucker oder ein zuckerhaltiges Produkt zu sich nehmen. Wenn Sie nicht auf die Glucagonbehandlung ansprechen, müssen Sie in einem Krankenhaus weiterbehandelt werden. Nehmen Sie nach einer Glucagoninjektion mit Ihrem Arzt oder einer Notfallstation Kontakt auf: Sie müssen den Grund für Ihre Unterzuckerung (Hypoglykämie) herausfinden, um weitere Unterzuckerungen zu vermeiden. Ursachen einer Unterzuckerung Sie bekommen eine Unterzuckerung, wenn Ihr Blutzucker zu niedrig wird. Dies kann passieren, • wenn Sie zu viel Insulin injizieren. • wenn Sie zu wenig essen oder eine Mahlzeit auslassen. wenn Sie sich mehr als sonst körperlich anstrengen. • Wenn Ihr Blutzucker zu hoch ansteigt Ihr Blutzucker kann zu hoch ansteigen (dies wird Hyperglykämie genannt). Die Warnzeichen treten allmählich auf. Zu ihnen gehören: Verstärkter Harndrang, Durst, Appetitlosigkeit, Übelkeit oder Erbrechen, Benommenheit oder Müdigkeit, gerötete trockene Haut, Mundtrockenheit und fruchtig (nach Aceton) riechender Atem. Falls Sie irgendeines dieser Warnzeichen bemerken: Überprüfen Sie Ihren Blutzuckerspiegel, untersuchen Sie wenn möglich Ihren Urin auf Ketone und suchen Sie sofort medizinische Hilfe. Diese Symptome können Anzeichen eines sehr ernsten Zustandes sein, den man diabetische Ketoazidose nennt. Unbehandelt kann dieser Zustand in diabetischem Koma oder mit dem Tod enden. Ursachen für hohen Blutzucker • Sie haben eine Insulininjektion vergessen. wiederholtes Injizieren von weniger Insulin, als Sie benötigen • 74 • • • eine Infektion oder Fieber mehr Essen als üblich weniger körperliche Bewegung als üblich 5. WELCHE NEBENWIRKUNGEN SIND MÖGLICH? Wie alle Arzneimittel kann Levemir Nebenwirkungen haben. Die Anwendung von zu viel Levemir kann zu niedrigem Blutzucker (Hypoglykämie) führen. Beachten Sie die Empfehlungen unter 4 Verhalten im Notfall. Häufig auftretende Nebenwirkungen (bei weniger als 1 von 10 Patienten) Veränderungen an der Injektionsstelle. An der Injektionsstelle können Reaktionen (Rötung, Schwellung, Juckreiz) auftreten. Diese verschwinden normalerweise nach einigen Wochen der Insulinanwendung. Suchen Sie Ihren Arzt auf, falls diese Symptome nicht verschwinden. Gelegentlich auftretende Nebenwirkungen (bei weniger als 1 von 100 Patienten) Symptome einer Allergie. Es können Quaddeln und Hautausschläge auftreten. Suchen Sie unverzüglich medizinische Hilfe, ► wenn die oben genannten Anzeichen einer Allergie auftreten, oder wenn Sie sich plötzlich unwohl fühlen und Sie Schweißausbrüche haben oder Übelkeit ► (Erbrechen), Atembeschwerden, Herzrasen oder Schwindel auftreten. Sie haben möglicherweise eine sehr seltene schwere allergische Reaktion auf Levemir oder einen seiner Bestandteile (eine so genannte generalisierte allergische Reaktion). Beachten Sie auch die Warnung unter 2 Was müssen Sie vor der Anwendung von Levemir beachten?. Sehstörungen. Zu Beginn Ihrer Insulinbehandlung können gelegentlich Sehstörungen auftreten, die aber normalerweise wieder abklingen. Veränderungen an der Injektionsstelle. Wenn Sie sich zu oft eine Injektion an der gleichen Stelle geben, können sich darunter Verdickungen bilden. Verhindern Sie dies, indem Sie die Injektionsstellen jedes Mal innerhalb der gewählten Körperregion wechseln. Geschwollene Gelenke. Zu Beginn einer Insulinbehandlung kann eine Wasseransammlung Schwellungen um Ihre Knöchel und andere Gelenke verursachen. Diese gehen bald wieder zurück. Selten auftretende Nebenwirkungen (bei weniger als 1 von 1.000 Patienten) Sensibilitätsstörung. Eine schnelle Verbesserung der Blutzuckereinstellung kann zu Sensibilitätsstörungen (Taubheit, Schwäche oder Schmerz) in Armen oder Beinen führen. Diese Symptome verschwinden in der Regel im Laufe der Behandlung wieder. Informieren Sie Ihren Arzt oder Apotheker, wenn Sie Nebenwirkungen bemerken, auch solche, dienicht in dieser Packungsbeilage aufgeführt sind. 6. WIE IST LEVEMIR AUFZUBEWAHREN? Arzneimittel für Kinder unzugänglich aufbewahren. Nicht in Gebrauch befindliches Levemir InnoLet ist im Kühlschrank bei 2°C – 8°C zu lagern, aber nicht in der Nähe des Gefrierfachs. Nicht einfrieren. In Gebrauch befindliches Levemir InnoLet und solches, das als Ersatz mitgeführt wird, ist nicht im Kühlschrank zu lagern. Sie können es mit sich führen und bei Raumtemperatur (nicht über 30°C) bis zu 6 Wochen lang aufbewahren. 75 Lassen Sie zum Schutz vor Licht die Verschlusskappe immer aufgesetzt, wenn InnoLet nicht in Gebrauch ist. Levemir muss vor übermäßiger Hitze und Sonnenlicht geschützt werden. Verwenden Sie Levemir nicht nach dem auf dem Etikett und dem Umkarton angegebenen Verfallsdatum. Auf der Rückseite finden Sie Informationen zur Bedienung Ihres InnoLet. Stand der Information: 76 Informationen über die Injektion von Levemir InnoLet Bitte lesen Sie die folgende Bedienungsanleitung vor der Benutzung von Levemir InnoLet sorgfältig durch. Einleitung Levemir InnoLet ist ein einfacher, kompakter vorgefüllter Injektor. Sie können Dosen zwischen 1 und 50 Einheiten in Schritten von jeweils einer Einheit einstellen. Levemir InnoLet wurde speziell für die Verwendung mit NovoFine S-Kanülen (Injektionsnadeln) mit einer Länge von 8 mm oder kürzer entwickelt. Achten Sie darauf, dass Ihre Kanülenpackung mit einem S gekennzeichnet ist. S steht für „short cap“ (= verkürzte innere Hülle der Injektionsnadel). Vorbereiten der Injektion Überprüfen Sie anhand des Etiketts, ob Levemir InnoLet den richtigen Insulintyp enthält. Nehmen Sie die Verschlusskappe ab (wie durch den Pfeil gezeigt). Aufsetzen der Injektionsnadel 77 • • • • Desinfizieren Sie die Gummimembran mit medizinischem Alkohol. Entfernen Sie die Schutzlasche von einer NovoFine S-Kanüle (Injektionsnadel). Schrauben Sie die Injektionsnadel gerade und fest auf den Levemir InnoLet (Abbildung A). Ziehen Sie die große äußere Schutzkappe der Injektionsnadel und die innere Hülle der Injektionsnadel ab. Legen Sie die große äußere Schutzkappe der Injektionsnadel in das Injektionsnadelfach. Vorbereitung zur Entfernung der Luft vor jeder Injektion In der Zylinderampulle und in der Injektionsnadel können sich während des üblichen Gebrauchs kleine Mengen Luft ansammeln. Gehen Sie folgendermaßen vor, um die Injektion von Luft zu vermeiden und eine korrekte Dosierung sicherzustellen: • Stellen Sie zwei Einheiten durch Drehen des Dosisreglers im Uhrzeigersinn ein. • Halten Sie Levemir InnoLet mit der Injektionsnadel nach oben und klopfen Sie ein paar Mal mit dem Finger leicht gegen die Zylinderampulle (Abbildung B), damit sich eventuell vorhandene Luftblasen oben in der Zylinderampulle sammeln. • Während Sie die Injektionsnadel weiterhin nach oben halten, drücken Sie den Druckknopf ganz hinein. Der Dosisregler geht auf Null zurück. • Jetzt sollte an der Spitze der Injektionsnadel ein Insulintropfen erscheinen. Falls nicht, wechseln Sie die Injektionsnadel und wiederholen Sie den Vorgang nicht mehr als sechs Mal. Wenn dann noch immer kein Tropfen Insulin austritt, ist das Gerät defekt und darf nicht verwendet werden. 78 Einstellen der Dosis • • • Kontrollieren Sie immer, ob der Druckknopf vollständig hineingedrückt ist und ob der Dosisregler auf Null steht. Stellen Sie die Anzahl der Einheiten ein, die Sie injizieren müssen, indem Sie den Dosisregler im Uhrzeigersinn drehen (Abbildung C). Verwenden Sie nie die Restmengenskala zum Abmessen Ihrer Insulindosis. Sie hören für jede einzelne eingestellte Einheit ein Klickgeräusch. Die Dosis kann durch Drehen des Dosisreglers in die eine oder andere Richtung korrigiert werden. Sie können keine größere Anzahl an Einheiten wählen, als noch in der Zylinderampulle enthalten ist. Injizieren des Insulins • • • • • Stechen Sie die Injektionsnadel in Ihre Haut. Führen Sie die Injektionstechnik aus, die Ihnen Ihr Arzt gezeigt hat. Geben Sie sich die Dosis, indem Sie den Druckknopf ganz hineindrücken (Abbildung D). Der Dosisregler stellt sich auf Null zurück, wobei Sie Klickgeräusche hören. Die Injektionsnadel muss nach der Injektion mindestens 6 Sekunden unter der Haut bleiben. Dadurch wird sichergestellt, dass die gesamte Insulinmenge injiziert wurde. Achten Sie darauf, dass Sie den Dosisregler während der Injektion nicht blockieren, da sich der Dosisregler auf Null zurückstellen können muss, wenn Sie auf den Druckknopf drücken. Entsorgen Sie die Injektionsnadel nach jeder Injektion. 79 Entfernen der Injektionsnadel • Setzen Sie die große äußere Schutzkappe der Injektionsnadel wieder auf und schrauben Sie die Injektionsnadel ab (Abbildung E). Entsorgen Sie diese sorgfältig. Verwenden Sie für jede Injektion eine neue Injektionsnadel. Schrauben Sie die Injektionsnadel immer nach jeder Injektion ab. Andernfalls könnte bei Temperaturänderungen Flüssigkeit austreten. Medizinisches Personal sowie andere Angestellte, die im Sozialbereich tätig sind, und Familienangehörige sollten allgemeine Vorsichtsmaßnahmen zur Entfernung und Entsorgung der Injektionsnadeln beachten, um unbeabsichtigte Stiche zu vermeiden. Entsorgen Sie den verbrauchten Levemir InnoLet sorgfältig mit abgeschraubter Injektionsnadel. 80 Wartung Ihr Levemir InnoLet ist für eine sehr genaue und sichere Funktionsweise entwickelt worden. Er muss mit der entsprechenden Sorgfalt behandelt werden. Wenn er fallen gelassen, beschädigt oder zerdrückt wird, besteht die Gefahr des Austretens von Insulin. Für den Fall, dass Ihr InnoLet verloren geht oder beschädigt wird, sollten Sie als Vorsichtsmaßnahme immer ein Ersatz-Insulininjektionsgerät mitführen. Levemir InnoLet darf nicht wieder aufgefüllt werden. Äußerlich kann Levemir InnoLet durch Abwischen mit einem Wattebausch, der mit medizinischem Alkohol angefeuchtet wurde, gereinigt werden. Der InnoLet darf nicht in medizinischen Alkohol gelegt, gewaschen oder mit einem Schmiermittel behandelt werden. Dadurch kann die Mechanik beschädigt werden. 81