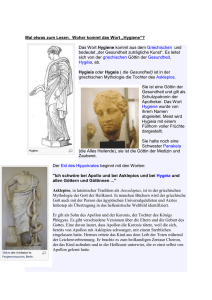
Nr. 22 - Juli 2010
Werbung

med tropole Nr. 22 Juli 2010 WIRBELSÄULENCHIRURGIE: Idiopathische Skoliose – operative Behandlung RHEUMATOLOGIE: Primäre systemische Vaskulitiden HÄMOSTASEOLOGIE: Das erworbene von Willebrand-Syndrom Aktuelles aus der Klinik für einweisende Ärzte Editorial Impressum Liebe Leserinnen und Leser, Redaktion Jens Oliver Bonnet (verantw.) Prof. Dr. Dr. Stephan Ahrens Prof. Dr. Christian Arning PD Dr. Oliver Detsch Dr. Birger Dulz PD Dr. Siegbert Faiss Dr. Christian Frerker Dr. Annette Hager Dr. Susanne Huggett Prof. Dr. Friedrich Kallinowski Prof. Dr. Uwe Kehler Dr. Jürgen Madert Dr. Kilian Rödder Prof. Dr. Jörg Schwarz Prof. Dr. Gerd Witte Cornelia Wolf Herausgeber Asklepios Kliniken Hamburg GmbH Unternehmenskommunikation Rudi Schmidt V. i. S. d. P. Rübenkamp 226 22307 Hamburg Tel. (0 40) 18 18-82 66 36 Fax (0 40) 18 18-82 66 39 E-Mail: [email protected] Auflage: 15.000 Erscheinungsweise: 4 x jährlich ISSN 1863-8341 Titel: pANCA bei Kleingefäßvaskulitiden wie mikroskopische Polyangiitis oder Churg-StraussSyndrom (siehe Seite 811 – 814) die Fußball-WM-Euphorie hat sich gelegt, die Deutsche Mannschaft schneidet, durchaus zufriedenstellend, mit einer ehrbaren Bronzemedaille ab und gleichzeitig, fast unbemerkt, hat unsere Regierung kurz vor der Sommerpause eine sogenannte Gesundheitsreform verabschiedet, die sich offensichtlich das Etikett „Reform“ noch verdienen muss und sicherlich zu mancherlei Kopfzerbrechen in den Krankenhäusern, aber auch bei unseren niedergelassenen Kollegen führen wird. Nicht erkennbar touchiert wurde durch die jetzige Gesundheitsreform das 2003 verabschiedete Gesetz zur Modernisierung der gesetzlichen Krankenversicherung (GMG), das seit dem 1. Januar 2004 neben Vertragsärzten und ermächtigten Ärzten auch medizinischen Versorgungszentren die Teilnahme an der ambulanten Versorgung erlaubt. Herr Dr. Stubbe, Geschäftsführer der MVZ Nord GmbH der AKHH, zeigt die Entwicklung der Asklepios MVZ und die Zielsetzung unseres Unternehmens für dieses Geschäftsfeld in diesem Heft detailliert auf. Medizinische Versorgungszentren werden immer noch von vielen Kollegen kritisch beäugt; jedoch ist es durchaus möglich, diese ambulanten Behandlungszentren gerade in strukturschwachen Gegenden Hamburgs und im Umland sinnvoll zu etablieren und dabei durch eine behutsame Vorgehensweise nicht nur Patienten, sondern auch die in den MVZ arbeitenden Kollegen offensichtlich zufriedenzustellen. Immerhin beschäftigt die Asklepios MVZ Nord GmbH 61 Ärzte und Psychologen in Voll- und Teilzeit, wobei ein weiteres Wachstum zu erhoffen ist, ohne dass, wie Herr Stubbe formuliert, die Interessen der niedergelassenen Ärzte oder anderer Krankenhäuser verletzt werden. Dies scheint mir in der Tat der richtige Weg für die Umsetzung des 2003 beschlossenen Gesetzes zur Modernisierung der gesetzlichen Krankenversicherung zu sein. Natürlich enthält diese Ausgabe der medtropole auch wieder interessante Arbeiten aus völlig unterschiedlichen Fachgebieten, die einmal mehr den breiten medizinischen Fächer der Hamburger Asklepios Kliniken zeigen. Abschließend hoffe ich, wieder Ihr Interesse für die Lektüre dieser medtropole geweckt zu haben. Ich möchte es an dieser Stelle nicht versäumen, den Redaktionsmitgliedern der medtropole für die geleistete Arbeit zu danken, insbesondere Herrn Bonnet von der Pressestelle der Asklepios Kliniken Hamburg, der unermüdlich recherchiert, die Redaktionssitzungen zur Zufriedenheit aller leitet und letztlich auch Motor und „guter Geist“ dieser Zeitschrift ist. Herzlichst Ihr Priv.-Doz. Dr. Meyer-Moldenhauer Ärztlicher Direktor der Asklepios Klinik Harburg Chefarzt des Urologischen Zentrums Hamburg Inhalt 804 | WIRBELSÄULENCHIRURGIE Operative Behandlung der idiopathischen Skoliose S. 804 808 | UROLOGIE Therapie der Harninkontinenz nach radikaler Prostatektomie mit dem artifiziellen Sphinkter 811 | RHEUMATOLOGIE Primäre systemische Vaskulitiden 815 | PSYCHOSOMATIK Essstörungen Stationäre oder tagesklinische Behandlung? 817 | PSYCHIATRIE UND PSYCHOTHERAPIE Können psychisch Gesunde süchtig werden? Oder ist Sucht immer ein Symptom einer anderen psychischen Störung? 820| PERSONALIA 822 | NEUROCHIRURGIE Akutmaßnahmen beim Schädel-Hirntrauma 826 | HÄMOSTASEOLOGIE Das erworbene von Willebrand-Syndrom S. 826 830 | MEDIZINISCHE VERSORGUNGSZENTREN Die MVZ Nord GmbH der Asklepios Kliniken Hamburg 832 | GESCHICHTE DER MEDIZIN Vom guten Eiter bis zum Schnellverband: Die Geschichte der Wundversorgung S. 832 Medtropole | Ausgabe 22 | Juli 2010 Operative Behandlung der idiopathischen Skoliose PD Dr. Thomas Niemeyer, Dr. Kay Steffan Im Griechischen bedeutet „scolios“ krumm und im heutigen medizinischen Kontext versteht man unter Skoliose eine Formanomalie der Wirbelsäule, eine sogenannte 3D-Deformität, die durch Abweichung in der FrontalSagittalebene und in der Rotation gekennzeichnet ist. Die mit Abstand häufigste Form der nicht sekundär bedingten Wirbelsäulendeformitäten ist die idiopathische Skoliose, die sich definitionsgemäß nicht auf andere mögliche Ursachen wie Missbildungen, neurologische Erkrankungen, Syndrome und Bindegewebserkrankungen sowie Degeneration zurückführen lässt. Kennzeichen sind eine strukturelle Seitverbiegung der Wirbelsäule mit Fehlrotationskomponente der Wirbel, die zum Scheitelpunkt hin zunimmt und für die Ausbildung von Rippenbuckel und/oder Lendenwulst verantwortlich ist, sowie die Torsion (Verwringung) der einzelnen Wirbel in sich – einige Autoren [6] sprechen auch von einer Abweichung in der 4. Ebene (intravertebrale Deformierung, Abb. 3). Häufig liegt zusätzlich eine Deformierung in der Sagittalebene mit krankhafter Begleitlordose oder Begleitkyphose vor, wobei dann von einer Lordoskoliose beziehungsweise Kyphoskoliose gesprochen wird. Diagnostik Auffällig wird die Skoliose klinisch durch zunehmende Deformierung des Rumpfes mit oder ohne Lotabweichung und mit, je nach Lage der Deformität, Ausbildung eines Rippenbuckels und/oder Lendenwulstes, Asymmetrie der Taillendreiecke und gegebenenfalls Schulterschiefstand (Abb. 4). Die typischen Veränderungen treten häufig während des Wachstumsschubes der Pubertät auf und betreffen Mädchen vier Mal häufiger als Jungen. Radiologisch können die Haupt- und Nebenkrümmungen nach der COBB-Methode auf der Ganzwirbelsäulenaufnahme ausgemessen und der Schweregrad der Skoliose bestimmt werden. Auf sogenannten röntgenologischen Bending-(Umkrümmungs-) aufnahmen lässt sich die Flexibilität von Haupt- und Nebenkrümmung bestimmen, um so prognostische Hinweise auf den Erfolg einer konservativen Korsettbehandlung oder das mögliche Ausmaß einer operativen Korrektur und die zu empfehlende Operationstechnik zu bekommen. Abb. 1: Intravertebrale Deformität mit konkavseitig kleinem Pedikel 804 Das biologische Alter bei der Entstehung einer Skoliose ist prognostisch bedeutsam. Das Skelettalter lässt sich in der Wachstumsphase anhand des Verknöcherungsstadiums der Beckenkammapophyse nach RISSER und durch eine a-p-Röntgenaufnahme der linken Hand bestimmen. Nach der Lokalisation des Krümmungsscheitels werden bei der idiopathischen Skoliose vier Typen unterschieden: Bei der bevorzugt linkskonvexen Lumbalskoliose liegt der Scheitelpunkt unterhalb des 1. Lendenwirbels, bei der Thorakolumbalskoliose in Höhe von Th12 oder L1. Idiopathische Thorakalskoliosen sind rechtskonvex mit einem Scheitelpunkt meist zwischen Th7 und Th11. Bei der doppelbogigen Skoliose liegen zwei Hauptkrümmungen vor, wobei die thorakale rechtskonvex und die lumbale linkskonvex ausgerichtet sind. Die letzte Form ist kosmetisch am wenigsten auffällig und wird meist spät erkannt, da sich die Krümmungen meist ausbalancieren. Seit ihrer Veröffentlichung 1998 ist die nach LENKE benannte Klassifikation die am weitesten verbreitete, eine zweidimensionale Klassifikation mit sechs Typen. Ziel dieser Klassifikation war es, jede mögliche adoleszente idiopathische Skolioseform klassifizieren zu können und dabei gleichzeitig Therapierichtlinien festzulegen.[5,8,9] Wirbelsäulenchirurgie Abb. 2: Ventrale Derotationsspondylodese Th9-L2: 16-jähriges Mädchen mit rechtskonvexer Thorakolumbalskoliose, Lenke Typ 5CN Therapie Eine exakte Diagnose auf Grundlage einer genauen Anamnese, der körperlichen und neurologischen Untersuchung sowie der Röntgen-, Kernspin- oder CT-Aufnahmen ergibt die Basis für eine Beratung, in der der Patient und gegebenenfalls die Eltern über die Diagnose Skoliose, deren Verlauf, eventuell bestehende Risiken und Behandlungsstrategien mit konservativem oder operativem Vorgehen aufgeklärt werden.[4] (Kosmetik) und Leidensdruck fließen zusätzlich in diesen Entscheidungsprozess ein. Aufgrund der chirurgischen Ergebnisse bei idiopathischer Skoliose gilt eine operative Therapie ab Krümmungswinkeln von mehr als 40 Grad lumbal und thorakolumbal sowie mehr als 50 G rad thorakal derzeit national wie international als indiziert, da jenseits dieser Krümmungswinkel auch nach Wachstumsabschluss in aller Regel eine Progredienz auftritt (AWMFLeitlinie). Indikation und Verlauf Dabei stehen drei Ziele im Vordergrund: Die Indikation zur operativen Therapie einer idiopathischen Skoliose wird durch verschiedene Faktoren beeinflusst: ■ maximale 3D-Korrektur unter Erhalt der Funktion und mit dem bestmöglichen kosmetischen Ergebnis ■ hohe Sicherheit durch Primärstabilität der Instrumentation: vollständige korsettfreie Nachbehandlung ■ Reduzierung von Schmerzen, wobei Schmerzen bei Kindern und Jugendlichen mit idiopathischer Skoliose nicht im Vordergrund stehen ■ Zunahme der Skoliosekrümmung (Progression) ■ Vermeidung sekundärer Komplikationen (Herz-Kreislauf-System und Lunge) ■ Schmerzen infolge einer frühen Degeneration der Wirbelsäule, hervorgerufen durch die zunehmende Verkrümmung Weitere Faktoren wie Patientenalter, CobbWinkel, individuelle Beeinträchtigung Operationsverfahren Die operativen Korrekturverfahren einer Skoliose gehören zu den maximalchirurgischen großen Eingriffen an der Wirbelsäule. Möglich sind diese Verfahren letztlich nur durch die heutigen Narkoseverfahren und das anästhesiologische perioperative Management, die unabhängig von Alter und Komorbidität fast jede notwendige Korrektur ermöglichen. Die Historie der operativen Skoliosetherapie begann vor rund 200 Jahren mit Muskeldurchtrennungen (Guerin, 1839: Myotomie Muskulatur), gefolgt von dem bis heute gültigen Prinzip der Spondylodese zur Verhinderung der Zunahme der Skoliose (Hibbs, 1911: erste Wirbelsäulenfusion) bis zur ersten instrumentierten Skoliose (Harrington, 1962 Korrektur/Stabilisierung). Diese Pionierleistung ermöglichte in der Regel Korrekturen um 50 – 60 Prozent, aber mit einem durchschnittlichen Korrekturverlust bis 25 Prozent und einer Pseudarthroserate in bis zu 20 Prozent aufgrund fehlender Primärstabilität. Erschwerend kam hinzu, dass keine Beeinflussung des sagittalen Profils gelang und auf die Operation eine mehrwöchige Bettruhe und anschließend ein Jahr im (Gips-)Korsett folgten. Mit den heutigen 805 Medtropole | Ausgabe 22 | Juli 2010 Abb. 3: 18-jährige Patientin mit doppelbogiger Skoliose Lenke Typ 3CN vor und nach Korrektur über den dorsalen Zugang von Th6-L4 primärstabilen Implantaten lassen sich Skoliosen operativ viel effektiver aufrichten und stabilisieren. Durch die Korrektur der Skoliose werden nicht fusionierte Nebenkrümmungsbereiche mit den Bandscheiben und Wirbelgelenken distal der Fusionsstrecke im Lumbal- oder Lumbosakralbereich entlastet. Die Langzeitergebnisse operierter Patienten mit idiopathischer Skoliose nach HarringtonInstrumentations-Spondylodese sind im Großen und Ganzen gut.[11] Da mit den modernen primärstabilen Verfahren bessere Korrekturergebnisse bei geringerer 806 Komplikationsrate und kürzerer Rehabilitationsphase erzielt werden, sollte die Langzeitprognose noch besser sein.[1–4,10] Verfahren zur Korrektur und Stabilisierung der Verkrümmung und Verdrehung der skoliotischen Deformität: ■ dorsale Verfahren über einen Zugangsweg von hinten ■ ventrale Verfahren über einen vorderen Zugang ■ kombinierte dorsale und ventrale Operationsverfahren Dabei werden intraoperativ Korrekturmanöver mit Distraktion, Kompression, Translation und Rotation angewendet. Die Korrektur der frontalen und sagittalen Ebene beträgt je nach Studie, verwendeten Implantaten und Flexibilität der Skoliosen zwischen 40 und 70 Prozent.[2,3,4,11] Nennenswerte Korrekturverluste treten im Implantationsbereich bei Verwendung von Pedikelschrauben oder ventralen Doppelstabsystemen nicht mehr auf. Häufig gelingt eine signifikante, kosmetisch vorteilhafte Abflachung von Rippenbuckel und/oder Lendenwulst. Bei sehr rigiden Skoliosen Wirbelsäulenchirurgie Kontakt PD Dr. Thomas Niemeyer Interdisziplinäres Wirbelsäulen Zentrum Hamburg Abteilung für Wirbelsäulen- und Skoliosechirurgie Asklepios Klinik St. Georg Lohmühlenstraße 5, 20099 Hamburg Tel. (0 40) 18 18-85 21 11 Fax (0 40) 18 18-85 30 79 E-Mail: [email protected] Abb. 4: 13-jähriges Mädchen mit 96° nach Cobb Thorakalskoliose Lenke Typ 1CN mit typischen Zeichen; prä- und postoperative Röntgenbilder einer dorsalen Korrektur von Th3-Th12 Dr. Kay Steffan Asklepios Katharina-Schroth-Klinik Orthopädisches Rehabiliationszentrum für die konservative Skoliose-Intensiv-Rehabilitation (SIR) Korczakstraße 2, 55566 Bad Sobernheim Tel. (0 67 51) 874-151 Fax (0 67 51) 874-167 E-Mail: [email protected] sind mitunter kombinierte dorsale und ventrale Operationsverfahren notwendig.[1] Zusätzliche Sicherheit bei allen korrigierenden Eingriffen wird durch ein intraoperatives Neuromonitoring mit Ableitung von SEPs und MEPs erreicht. Damit lässt sich das Querschnittsrisiko weiter minimieren. Der durchschnittliche Blutverlust und die OP-Zeit korrelieren mit dem Schweregrad der Skoliose. Die heutigen OP-Verfahren erlauben die zügige Wiedereingliederung in den Alltag. Der stationäre Aufenthalt beträgt in aller Regel bei komplikationslosem Verlauf 10 – 14 Tage und nach abgeschlossener Wundheilung dürfen die Patienten Schwimmen [7] gehen, leichte Krankengymnastik durchführen und öffentliche Verkehrsmittel benutzen. Fazit Die operative Therapie der idiopathischen Skoliose mit Korrektur des Achsenorgans in drei Ebenen gehört zu den maximalchirurgischen Eingriffen mit guten Langzeitergebnissen. Diese rekonstruktive Chirurgie der Wirbelsäule beim Kind, Jugendlichen, Erwachsenen und alten Menschen ist technisch anspruchsvoll, erfordert ein aufwendiges perioperatives Management und muss in Zentren versorgt werden, die derartige Krankheitsbilder regelmäßig diagnostizieren, operieren und das Management der Komplikationen beherrschen. Die Lebensqualität der Patienten mit Skoliose ist dank der heutigen OP-Verfahren und der damit verbundenen hohen Sicherheit nach einem solchen Eingriff gut und bedeutet fast immer eine vollständige Wiedereingliederung in den privaten und beruflichen Alltag. [5] Lenke LG, Betz RR, Harms J, Bridwell KH, Clements DH, Lowe TG, Blanke K. Adolescent idiopathic scoliosis: a new classification to determine extent of spinal arthrodesis. J Bone Joint Surg Am. 2001; 83-A(8): 1169-81. [6] Liljenqvist U, Hackenberg L. Morphometric analysis of thoracic and lumbar vertebrae in idiopathic scoliosis. Stud Health Technol Inform. 2002; 88: 382-6. [7] Liljenqvist U, Witt KA, Bullmann V, Steinbeck J, Völker K. Empfehlungen zur Sportausübung bei Patienten mit idiopathischer Skoliose. Sportverletz. Sportschaden. 2006; 20(1): 36-42. [8] Liljenqvist U, Lerner T, Bullmann V. Selektive Fusions- Literatur möglichkeiten der idiopathischen Skoliose unter kritischer [1] Bullmann V, Halm HF, Schulte T, Lerner T, Weber TP, Würdigung der Lenke-Klassifikation. Orthopäde. 2009; Liljenqvist UR. Combined anterior and posterior instru- 38(2): 189-92, 194-7. mentation in severe and rigid idiopathic scoliosis. Eur [9] Niemeyer T, Wolf A, Kluba S, Halm HF, Dietz K, Kluba Spine J. 2006 Apr; 15(4): 440-8. T. Interobserver and intraobserver agreement of Lenke and [2] Bullmann V, Halm HF, Niemeyer T, Hackenberg L, King classifications for idiopathic scoliosis and the influen- Liljenqvist U. Dual-rod correction and instrumentation of ce of level of professional training. Spine (Phila Pa 1976). idiopathic scoliosis with the Halm-Zielke instrumentation. 2006; 31(18): 2103-7; discussion 2108. Spine (Phila Pa 1976). 2003; 28(12): 1306-13. [10] Niemeyer T, Bövingloh AS, Grieb S, Schaefer J, Halm [3] Halm H, Niemeyer T, Halm B, Liljenqvist U, Steinbeck H, Kluba T. Low back pain after spinal fusion and Harring- J. Halm-Zielke. Instrumentation bei idiopathischen Skolio- ton instrumentation for idiopathic scoliosis. Int Orthop. sen. Ergebnisse bei 25 konsekutiven Patienten mit einem 2005; 29(1):47-50. Mindestnachbeobachtungszeitraum von 2 Jahren. [11] Niemeyer T, Liljenqvist U, Halm H, Winkelmann W. Z Orthop Ihre Grenzgeb. 2000; 138(1): 22-8. 2- bis 4-Jahres-Ergebnisse dorsaler Doppelstabinstrumen- [4] Halm H, Richter A, Thomsen B, Köszegvary M, Ahrens tationsspodylodesen bei idiopathischer Skoliose. Z Orthop. M, Quante M. Ventrale Skolioseoperationen. Stand der Ihre Grenzgeb. 1999; 137(5): 430-6. Technik und Vergleich mit dorsalen Verfahren. Orthopäde. 2009; 38(2): 131-4, 136-40, 142-5. 807 Medtropole | Ausgabe 22 | Juli 2010 Therapie der Harninkontinenz nach radikaler Prostatektomie mit dem artifiziellen Sphinkter Dr. Jochen Kilian, Dr. Alexander von Bargen, PD Dr. Wolf-Hartmut Meyer-Moldenhauer Das Prostatakarzinom ist die häufigste maligne Erkrankung des Mannes. In einem lokal begrenzten Stadium ist die radikale operative Entfernung der Prostata (RPx) eine standardisierte Behandlungsmethode. Als häufigste Komplikation ist die postoperative Inkontinenz ein individuelles, gesellschaftliches und gesundheitsökonomisches Problem.[1] Führen konservative oder wenig invasive Therapien nicht zum Erfolg, bleibt die urologische Prothetik mit Implantation eines artifiziellen Sphinkters als bewährtes Verfahren zur Beseitigung einer postoperativen Inkontinenz. Nach erfolgreicher Tumortherapie wird die postoperative Belastungsinkontinenz nach radikaler Prostatektomie mit 1 bis 48 Prozent angegeben.[2] Allen Patienten wird nach der radikalen Prostatektomie zur postoperativen Rehabilitation geraten, in deren Zentrum die Anleitung zur selbstständigen und regelmäßigen Beckenbodengymnastik steht, um möglichst frühzeitig eine postoperative Kontinenz zu erreichen. Bei steigenden Operationszahlen wächst auch die Zahl der Patienten mit trotz Rehabilitation anhaltender Harninkontinenz, die einer erfolgreichen Therapie bedürfen. Die persistierende Inkontinenz erfordert nach Differenzierung zwischen reiner Belastungs- und Drang-/Mischinkontinenz eine gezielte Weiterbehandlung. Während die Dranginkontinenz in der Regel gut mit einer anticholinergen Therapie zu behandeln ist, sollten Patienten mit ausgeprägter Stressinkontinenz und über sechs bis maximal zwölf Monate frustranen konservativen Therapieversuchen operativ behandelt werden.[3] 808 Operative Therapie der anhaltenden Stressinkontinenz Die submuköse, paraurethrale Injektion von „bulking agents“ (Teflon, Kollagen, Silikon [Makroplastique®]) ist eine einfach durchzuführende Maßnahme, die aber bereits im Anfangsstadium mit einer hohen Versagerrate belastet ist, die im Verlauf weiter ansteigt.[2] Wir halten daher den Einsatz von „bulking agents“ nicht mehr für gerechtfertigt, zumal dadurch andere, effizientere Therapieoptionen beeinträchtigt werden. Die anfangs hohen Erwartungen an die Stammzelltherapie zur Behandlung der Stressinkontinenz haben sich nicht erfüllt. Sie ist daher ebenfalls nicht zu empfehlen.[2] Als weiteres minimal-invasives Therapieverfahren stehen adjustierbare Ballonsysteme (ProACT®) zur Verfügung, die durch Kompression der Harnröhre mit Hilfe zweier nachfüllbarer, paraurethral platzierter Ballons die Kontinenz wiederherstellen sollen. Auf diese Weise lassen sich Kontinenzraten von bis zu 60 Prozent erreichen.[4] Mathis et al. zitieren in ihrer systematischen Übersichtsarbeit Studien, in denen Blasenperforationen (6,4 – 9 %), Dranginkontinenz (6 – 8 %), rupturierte Ballons (20,7 %[5]), Migrationen von Ballons (7 %[5]) sowie Erosionen (6,4 %[5]), die eine Ballonentfernung nötig machten, auftraten.[6] In der eigenen Klinik haben wir bei auswärtig operierten Patienten schwere Komplikationen wie urethrale Erosionen bis hin zum längerstreckigen Harnröhrenverlust und Infektionen beobachtet, die die komplette Explantation des Systems erforderten. Trotz der relativ hohen Kontinenzrate sind diese Systeme deshalb unseres Erachtens auch nicht zu empfehlen. Sehr erfolgreich sind bei moderat ausgeprägter Belastungsinkontinenz nach radikaler Prostatektomie spannungsfrei und nicht-obstruktiv wirkende Schlingensysteme. In der eigenen Klinik hat sich bei geringgradiger Stressinkontinenz die Implantation der retro-urethralen transobturatorischen Schlinge (AdVance®) bewährt. Alle bisher aufgeführten Verfahren beeinträchtigen im Falle ihres Versagens die spätere Implantation eines artifiziellen Sphinkters im Bereich der proximal bulbären Urethra, da wegen der eingetretenen Vernarbung an dieser Lokalisation keine Man- Urologie Abb. 1: Artifizieller Sphinkter (AMS 800 ®) Abb. 2: Der proximal bulbäre Cuff nach RPx Abb. 3: Der distale Doppelcuff nach RPx schettenpositionierung des artifiziellen Sphinktersystems mehr möglich ist. Deshalb bedarf es einer kritischen Indikationsstellung. Das erste eingesetzte Operationsverfahren muss das Beste sein, weshalb bei ausgeprägter Belastungsinkontinenz schon frühzeitig die Implantation eines artifiziellen Sphinkters, nach wie vor der Goldstandard in der Therapie der Post-Prostatektomie-Inkontinenz, in Erwägung gezogen werden sollte. Nach radikaler Prostatektomie kommen zwei Positionen für die Implantation der Harnröhrenmanschette in Betracht: Präoperative Diagnostik und Behandlungsablauf Der artifizielle Sphinkter (Abb.1) wurde von Bradley und Scott entwickelt und erstmals 1972 implantiert. Das heute verwendete Modell AMS 800® wurde bereits 1983 eingeführt und ist ein hydraulisches, auch mit Antibiotikabeschichtung erhältliches System, das aus drei Komponenten besteht: einer Manschette (Cuff), die um die Harnröhre gelegt wird, einem druckregulierenden Ballon, der retropubisch oder besser intraperitoneal platziert wird, und einer Kontrollpumpe, die im Skrotalfach untergebracht wird. Der im System herrschende Druck aus dem Ballon wird über die Pumpe auf die Manschette fortgeleitet und komprimiert die Harnröhre. Bei Miktion betätigt der Patient die skrotal gelegene Pumpe, wodurch der Cuff entleert und die Harnröhre freigegeben wird. Zeitverzögert verschließt sich die Manschette selbsttätig kurz nach der letzten Pumpenbetätigung. 1. Proximal-bulbäre Cuffposition mit knapp distal der Harnröhren-BlasenAnastomosenregion gelegener Verschlussmanschette (Abb. 2) 2. Der distale Doppelcuff liegt weiter distal an der bulbären Harnröhre und wird von uns bei allen voroperierten (bulking agents, Stammzelltherapie, Ballonsysteme, Schlingenoperation) oder bestrahlten Patienten verwendet (Abb. 3). An der proximal-bulbären Harnröhre muss durch Vernarbungen beziehungsweise postaktinische Durchblutungsbeeinträchtigung mit einer hohen Harnröhrenarrosionsrate gerechnet werden, weshalb in diesen Fällen ein distal-bulbärer Doppel-Cuff implantiert wird. Während die proximal-bulbäre Manschette außerhalb der Sitzdruckzone liegt, wird die Kontinenz bei einem distal-bulbär in der Sitzdruckzone platzierten Cuff kompromittiert. Zur Vergrößerung der urethralen Druckübertragungsfläche werden deshalb zwei nebeneinander liegende Cuffs implantiert. Eine sorgfältige präoperative Abklärung zur Identifizierung der für die Sphinkterimplantation geeigneten Kandidaten sichert gute Behandlungsergebnisse. Anamnese mit Erfragung / Prüfung mentaler und manueller Fähigkeiten Miktions-Inkontinenzprotokoll Pad-Test [7] Körperliche Untersuchung Labor inklusive Urinsediment und Urinkultur Sonographie des Harntraktes Retrogrades Urethrogramm / MCU Urethrocystoskopie mit Stresstest im Liegen und Stehen Uroflowmetrie Urodynamik Tab. 1 Ambulante präoperative Diagnostik vor Implantation eines artifiziellen Sphinkters Ausmaß und Grad der Inkontinenz werden mit Inkontinenzprotokoll, Pad- und Stress-Tests erfasst. Die urodynamische Untersuchung wird zum Ausschluss kombinierter Harninkontinenzformen durchgeführt, die gegebenenfalls eine Vorbeziehungsweise Begleitbehandlung mit Anticholinergika erfordern. Der Patient wird zur antibiotischen Vorbehandlung am präoperativen Tag aufgenommen und unter einem fünftägigen perioperativen Antibiotikaregime operiert. Die Entlassung 809 Die Kontinenzrate (0 bis max. 2 Vorlagen pro Tag) bei den untersuchten Patienten betrug nach Sphinkterimplantation nahezu 86 Prozent. Im auswertbaren Patientenkollektiv lag der Anteil von Revisionen bei 17,3 Prozent. Trotz der hoch erscheinenden Revisionsrate lag die Zufriedenheit nach Implantation eines artifiziellen Sphinkters bei insgesamt 94,7 Prozent (Abb. 5)! Die Lebensqualität hatte sich nach Implantation eines artifiziellen Sphinkters bei 169 von 180 Patienten (93,8 %) verbessert (Abb. 6)! Patienten, die einmal nach Aktivierung des artifiziellen Sphinktersystems kontinent waren, empfanden eine derartige Verbesserung ihrer Lebensqualität, dass sie bei einem auftretenden Systemdefekt schnellstmöglich revidiert werden wollten, um bald wieder in die gute Ausgangslage versetzt zu werden. en :3 iat ro ge n: 3 un be ka nn t: 1 ur og ne 60 Tr au ma :1 90 30 0 Prozent Abb. 4: Ursachen der Belastungsinkontinenz (n=180)[8] Patientenzufriedenheit 60 50 40 30 20 10 sehr zufrieden: 50,3 % zufrieden: 44,4 % wenig zufrieden: 3,5 % gar nicht zufrieden: 1,8 % 0 Abb. 5: Zufriedenheit nach Implantation eines artifiziellen Sphinkters im UZH [8] Anzahl der Patienten Die von Juni 2001 bis Dezember 2007 an der Asklepios Klinik Harburg operierten 269 Patienten mit Implantation eines artifiziellen Schließmuskels AMS 800® wurden im Rahmen einer Dissertation[8] mit standardisierten Fragebögen [ICIQ-SF 2004] und Pad-Test nach Klarskov und Hald [7] untersucht. 180 dieser Patienten konnten in die Auswertung einbezogen werden. Zwischenzeitlich wurden hier bis zum Mai 2010 weitere 121 AMS 800 ®-Implantationen durchgeführt. Die Ursachen der Belastungsinkontinenz sind der Abbildung 4 zu entnehmen, der größte Anteil bezieht sich auf die Post-Prostatektomie-Inkontinenz. 120 Ra dia tio :1 Ergebnisse Ursachen 150 RP x: 14 7 TU RP: 21 off PA En :1 TU RA: 2 erfolgt mit zunächst deaktiviertem Sphinktersystem. Nach einer sechswöchigen Einheilungszeit wird das System in einem kurzzeitstationären zweiten Aufenthalt mit einer Übernachtung aktiviert und die Bedienung eingeübt. Anzahl der Patienten Medtropole | Ausgabe 22 | Juli 2010 Lebensqualität 200 150 100 50 verbessert: 169 unverändert: 4 verschlechtert: 2 keine Angabe: 5 0 Abb. 6: Lebensqualität der Patienten nach AMS 800 ®-Implantation [8] Literatur matische Übersicht. Urologe. 2009; 48: 1330-8. [1] Dombo O, Otto U. Stressinkontinenz beim Mann: [7] Klarskov P, Hald T. Reproducability and realibility of Anatomische und funktionelle Besonderheiten. Journal für urinary incontinence assessment with a 60 min test. Scand Urologie und Urogynäkologie. 2004: 7-12. J Urol Nephrol. 1984; 18(4): 293-8. [2] Bauer RM, Mayer ME, Gratzke et al. Harninkontinenz [8] Bargen VA. Der artifizielle Sphinkter AMS 800 – nach radikaler Prostatektomie. Urologe. 2009; 48: 1044-9. Erfolgsrate, Komplikationen und Patientenzufriedenheit. [3] Schroeder A, Abrams P, Andersson KE et al. Guidelines Inauguraldissertation 2008; Mainz. on urinary incontinence. European Association of Urology, Arnheim. 2009: 28-34. [4] Hübner WA, Schlarp OM. Adjustable Continence Kontakt Therapy (ProACT): Evaluation of the surgical technique in Fazit comparison of the original 50 patients with the most recent 50 patients at a single centre. Eur Urol. 2007; 52: 680-6. Die Implantation eines artifiziellen Sphinkters ist bei ausgeprägter Postprostatektomie-Inkontinenz ein äußerst erfolgreiches Therapiekonzept mit vertretbarer Komplikations- und sehr hoher Kontinenz- und Zufriedenheitsrate. 810 [5] Hübner WA, Schlarp OM. Treatment of incontinence after prostatectomy using a new minimally invasive device: adjustable continence therapy. BJU Int. 2005; 96: 587-94. [6] Mathis S, Guba B, Adlbrecht C, Pramesberger C. Belastungsinkontinenz Evidenz zu vier minimal-invasiven Behandlungsmethoden mit fragwürdigem Nutzen – syste- Dr. Jochen Kilian Urologisches Zentrum Hamburg Asklepios Klinik Harburg Eißendorfer Pferdeweg 52 21075 Hamburg Tel. (0 40) 18 18-86 25 54 Fax (0 40) 18 18-86 34 26 E-Mail: [email protected] Rheumatologie Primäre systemische Vaskulitiden Dr. Keihan Ahmadi-Simab Vaskulitiden sind chronisch entzündliche Erkrankungen der Blutgefäße. Man unterscheidet primäre systemische Vaskulitiden unklarer Ätiologie und sekundäre Vaskulitiden, die in Assoziation mit anderen chronisch entzündlichen und autoimmunen Erkrankungen auftreten. Der Begriff primäre systemische Vaskulitis (PSV) umfasst klinisch, morphologisch und immunpathogenetisch unterschiedliche Immunvaskulitiden. Die Einteilung der PSV erfolgt gemäß der Nomenklatur der Chapel Hill Consensus Conference (CHC) [1] nach dem prädominanten Befallmuster der Gefäße (Gefäßtyp) und unter Berücksichtigung pathophysiologischer Aspekte, das heißt ANCA-Assoziation beziehungsweise ImmunkomplexGenese (Tab. 1). Pathogenese Pathogenetisch lassen sich die Vaskulitiden in drei Gruppen unterteilen: 1. Granulomatöse Vaskulitis 2. Immunkomplexvaskulitis 3. ANCA-assoziierte Vaskulitis (Pauci-immune Vaskulitis) Granulomatöse Vaskulitis Die Riesenzellarteriitiden (Arteriitis temporalis, M. Horton) und die Takayasu-Arteriitis betreffen die großen Gefäße und zählen zu den Granulomatösen Vaskulitiden. Sie gehen mit einer granulomatösen Entzündung in der Gefäßwand einher, wobei sich peripher weder Immunkomplexe noch Autoantikörper finden. Zu den frühesten Krankheitsprozessen in der Pathogenese der Riesenzellarteriitis gehört die Aktivierung dendritischer Zellen in der Adventitia großer Gefäße, in deren Folge es zu einer Chemokin- und Th1-Typ-Zytokinsekretion kommt. T-Zellen migrieren in der Folge über die Vasa vasorum der Adventitia in die gesamte Gefäßwand. In diesem Rahmen werden Makrophagen aktiviert und fusionieren zu Riesenzellen. Immunkomplexvaskulitis Polyarteriitis nodosa, kutane leukozytoklastische Vaskulitis, essentielle kryoglobulinämische Vaskulitis und Schönlein-HenochPurpura sind Immunkomplexvaskulitiden. Die Ablagerung zirkulierender Immunkomplexe induziert endothelseitig beziehungsweise in den Gefäßwänden eine Entzündung. Abgelagerte Immunkomplexe werden von neutrophilen Granulozyten über ihre Fc-γ-Rezeptoren erkannt, was zu einer vorzeitigen, endothelnahen Degranulierung mit konsekutiver Endothelschädigung führt. Abgelagerte Immunkomplexe und C1q induzieren zudem eine Verlangsamung des Rollens von Leukozyten über dem Endothel, was offenbar ebenfalls Entzündung und Endothelschädigung Vorschub leistet. Immunhistochemisch sind dementsprechend Immunkomplexe und Komplementfaktoren in der Gefäßwand nachzuweisen. Immunkomplexvaskulitiden sind durch einen Komplementverbrauch gekennzeichnet. dem Nachweis anti-neutrophiler zytoplasmatischer Autoantikörper (ANCA) assoziiert: Bei generalisierter WG PR3-ANCA (≥ 95 %), bei MPA MPO-ANCA (40 – 80 %) und bei CSS meist MPO-ANCA, seltener PR3-ANCA (10 – 70 %). Neben ihrer diagnostischen Bedeutung kommt den ANCA in der Pathogenese der Vaskulitis eine bedeutende Rolle zu. Nach derzeitiger Vorstellung kommt es unter dem Einfluss von Zytokinen zur Translokation der primär intrazellulären Zielantigene (zum Beispiel PR3) auf die Oberflächenmembran neutrophiler Granulozyten. Möglicherweise spielt auch eine genetische Prädisposition in der Oberflächenexpression der Zielantigene eine Rolle. Durch die Interaktion von ANCA mit den Zielantigenen auf der Zelloberfläche werden die Neutrophilen aktiviert. Es kommt zur vorzeitigen, endothelnahen Degranulation mit Freisetzung toxischer Sauerstoffradikale und lysosomaler Enzyme mit konsekutiver Schädigung des Endothels und somit Initiierung der Vaskulitis. ANCA-assoziierte Vaskulitis Symptome Zu den ANCA-assoziierten Vaskulitiden zählen die Wegenersche Granulomatose (WG), das Churg-Strauss-Syndrom (CSS) und die Mikroskopische Polyangiitis (MPA). Alle drei Vaskulitiden betreffen hauptsächlich kleine Gefäße, also kleine Arterien, Arteriolen, Kapillaren und Venolen. Da Ablagerungen von Immunkomplexen nur in geringem Maße oder gar nicht in den entzündlichen Arealen nachzuweisen sind, werden diese Vaskulitiden als „pauci-immun“ bezeichnet. Diese Vaskulitis-Gruppe ist charakteristischerweise mit Die ersten Symptome der Vaskulitiden sind häufig uncharakteristisch (Tab. 2). Klinisch Allgemeinsymptome („constitutional symptoms“) Adynamie, Fieber, Nachtschweiß, Gewichtsverlust Rheumatische Beschwerdekomplex Polymyalgie, -arthralgie, -myositis, -arthritis (auch: mono- oder oligoarthritische Bilder) Labor Akutphasenproteinerhöhung (BSG-, CRP-Erhöhung etc.) Leuko- und Thrombozytose, Anämie Tab. 2: Indirekte Hinweise für PSV („Alarmsymptome“) 811 Medtropole | Ausgabe 22 | Juli 2010 Erkrankung CHC Definition Typische klinische Symptome und Befunde Vaskulitis großer Gefäße Riesenzellarteriitis (RZA) Granulomatöse Arteriitis der Aorta und ihrer größeren Äste mit Plötzlicher Krankheitsbeginn, Fieber, B-Symptomatik, Gewichtsverlust, bitemPrädilektion für die extrakraniellen Äste der A. carotis; Tempoporale Cephalgien, tastbar verhärtete und schmerzhafte Temporalarterie, ralarterie häufig betroffen; üblicherweise Patienten jenseits des Oberarmmyalgie, Depression 40. Lebensjahres; häufig assoziiert mit Polymyalgia rheumatica Takayasu-Arteriitis Granulomatöse Entzündung der Aorta und ihrer Hauptäste; üblicherweise Patienten vor dem 40. Lebensjahr Polyarteritis nodosa (PAN) Nekrotisierende Entzündung der mittelgroßen oder kleinen B-Symptomatik, Arthralgien, Myalgien, art. Hypertonie, Polyneuropathie, Arterien ohne Glomerulonephritis und ohne Vaskulitis der Arte- Livedo reticularis, Angina abdominalis, Niereninfarkte, Angina pectoris, cereriolen, Kapillaren und Venolen brale Ischämie Kawasaki-Syndrom Arteriitis der großen, mittelgroßen und kleinen Arterien; häufig assoziiert mit dem mukokutanen Lymphknotensyndrom; Koro- Palmar- und Plantarerythem, polymorphes Erythem am Körperstamm, Fieber, nararterien häufig, Aorta und Venen z. T. betroffen; üblicherKonjunktivitis, Lymphadenopathie, Erdbeerzunge, Myokardinfarkt weise im Kindesalter B-Symptomatik, Thorakalsymptome (Angina pectoris), Claudicatio, Blutdruckdifferenz, Schwindel Vaskulitis mittelgroßer Gefäße Vaskulitis kleiner Gefäße Initialphase (lokalisierte WG): lokoregionale Symptomatik im oberen Respirationstrakt: verstopfte Nase, blutige Rhinitis, Epistaxis, Sinusitis, Otitis Granulomatöse Entzündung des Respirationstraktes und nekro- Generalisationsphase: B-Symptomatik, Arthralgien, Arthritiden, Episkleritis, Hauteffloreszenzen, Hämoptysen, Perforation des Nasenseptums, Sattelnase, Wegenersche Granuloma- tisierende Vaskulitis kleiner bis mittelgroßer Gefäße (d. h. Kapillaren, Venolen, Arteriolen und Arterien). Eine nekrotisie- blutig-borkige Rhinitis tose (WG) Trias: systemische nekrotisierende Angiitis, nekrotisierende Entzündung im rende Glomerulonephritis ist häufig. Respirationstrakt, nekrotisierende Glomerulonephritis (Pulmo-renales Syndrom), ANCA-Assoziation (PR3-ANCA) Mikroskopische Polyangiitis (MPA) Nekrotisierende Vaskulitis kleiner Gefäße (d. h. Kapillaren, Venolen oder Arteriolen) mit wenigen oder keinen ImmunkomPulmo-renales Syndrom plex-Ablagerungen. Eine nekrotisierende Arteriitis kleiner bis ANCA-Assoziation (MPO-ANCA) mittelgroßer Gefäße kann auftreten. Eine nekrotisierende Glomerulonephritis ist häufig, ebenso eine pulmonale Kapillariitis. Churg-Strauss-Syndrom (CSS) Eosinophile und granulomatöse Entzündung des Respirationstraktes und nekrotisierende Vaskulitis kleiner bis mittelgroßer Gefäße. Mit Asthma und einer Eosinophilie assoziiert. Nichtvaskulitische Prodromalphase: Asthma Bronchiale, allergische Rhinitis, Pollinosis nasi, Hypereosinophiles Syndrom Vaskulitische Phase: Arthralgien, Myalgien, B-Symptomatik, pulmonale Infiltrate, Eosinophilie, Polyneuropathie, kardiale Beteiligung ANCA-Assoziation (meist MPO-ANCA) Purpura SchönleinHenoch Vaskultis der kleinen Gefäße mit überwiegend IgA-haltigen Immundepots in situ; betroffen sind typischerweise Haut, Gastrointestinaltrakt und Glomeruli; Arthralgien und oder Arthritiden Makulopapulöses Exanthem, Fieber, Arthritiden, kolikartige abdominelle Schmerzen, Glomerulonephritis Vaskulitis der kleinen Gefäße (Kapillaren, Venolen oder ArterioEssentielle kryoglobulin- len) mit Kryoglobulinablagerungen in situ. Assoziiert mit Kryoglobulinen im Serum. Haut und Glomerula sind häufig betrofämische Vaskulitis fen. Purpura, Polyneuropathie, Neuropathia multiplex, Glomerulonephritis, gastrointestinale Vaskulitis, Komplementverbrauch, Kryoglobulinämie; 80 – 90 % der ursprünglich als „essentiell“ bezeichneten kryoglobulinämischen Vaskulitiden können heute einer chronischen HCV-Infektion zugeordnet werden. Kutane leukozyto-klastische Angiitis Palpable Purpura Isolierte leukozytoklastische Angiitis der Haut ohne systemische Vaskulitis oder Glomerulonephritis Tab. 1: Die Vaskulitiseinteilung und Definitionen gemäß der Chapel Hill Consensus Conference (CHC) sowie häufige klinische Manifestationen Im Verlauf kommen rheumatische Beschwerden hinzu, die an eine entzündliche Systemerkrankung denken lassen. Bei sorgfältiger körperlicher Untersuchung finden sich auch meist die direkten Zeichen der Vaskulitis (Tab. 3), die als direkte Folge der Gefäßläsion anzusehen sind. Zur klinischen Diagnose führt die Synopse aus Klinik (Schlüssel- und Leitsymptome), Immunserologie und histologischem Befund. Die wichtigsten Leitsymptome der PSV sind in Tabelle 1 zusammengefasst. Labordiagnostik Laborchemisch gibt es keinen Marker, der allein eine Vaskulitis beweist. So werden prinzipiell diagnoseassoziierte, aktivitäts- 812 assoziierte und/oder organbezogene Laborparameter bestimmt (Tab. 4 – 5).[2,3] Diagnostik Abhängig vom Organbefall sind weitere diagnostische Untersuchungen zur Diagnosesicherung und Erfassung der Organschädigungen erforderlich, wie zum Beispiel EKG und Langzeit-EKG (Herzrhythmusstörungen bei kardialer Beteiligung?), Echokardiographie (Perikarderguss? Kontraktilitätsstörungen bei Coronariitis und Myokarditis?), Herzkatheteruntersuchungen (Aneurysmen und Stenosen der Coronargefäße?), Myokardbiopsie (Sicherung einer Kapillaritis), Gastro- und Coloskopie (Hinweise auf gastro- intestinale Vaskulitis?), Bronchoskopie mit bronchoalveolärer Lavage und transbronchialer Biopsie (neutrophile oder lymphozytäre Alveolitis? interstitielle Pneumonitis, Kapillaritis?), Angiographie (Aneurysmen und Stenosen großer und mittelgroßer Gefäße?), Rö-Thorax (Rundherde, Infiltrate?), HRCT (Milchglasinfiltrate? Rundherde? [Abb. 1]), MagnetresonanzTomographie (Abb. 2) sowie AngiographieCT und PET-CT (Aortitis? Arteriitis?). Die histologische Sicherung der Vaskulitis ist aus diagnostischen und prognostischen Gründen anzustreben, wobei die Biopsien aus betroffenen Organen wie Haut oder Niere zu entnehmen sind. Rheumatologie Gefäßtyp Klinisches Problem Episkleritis („rotes Auge“), Hörsturz, Vertigo, Hämoptysen (alveoläre Hämorrhagie), Mikrohämaturie (Glomerulonephritis), (Mono-, Poly-) Neuritis, Herdencephalitis, palpable Purpura, NagelfalznekroKlein sen, Angina pectoris (Perimyocarditis), Purpura abdominalis (blutige Stühle) etc. Infarkte: Hirn, Herz, Niere (Makrohämaturie!), Darm (Meläna!), Extremität etc. Blutung bei Mittelgroß Ruptur von Mikroaneurysmen Stenosen: z. B. „subclavian steal syndrome“ oder Aortenbogensyndrom, Groß Aneurysma dissecans (Riesenzellarteriitis), Venen: z. B. Trombosen Cave: Therapie ANCA-assoziierter Vaskulitiden Überlappungen der Gefäßtypen eher häufig! Tab. 3: Direkte Hinweise für PSV (Leitsymptome) Bluteosinophilie (>10%) Hepatitis Bs-Antigen Hepatitis C-Antigen/HCV/RNA cANCA (PR3-ANCA) pANCA (MPO-ANCA) Kryoglobuline Endothelzellantikörper Churg-Strauss-Syndrom Panarteriitis nodosa Kryoglobulinämische Vaskulitis Wegenersche Granulomatose Mikroskopische Polyangiitis Kryoglobulinämische Vaskulitis Kawasaki-Syndrom Tab. 4: Diagnoseassoziierte Laborparameter Komplementspiegel ANCA-Titer Leuko- und Thrombozytose BSG- und CRP-Erhöhung Immunkomplexvaskulitiden Pauci-immune-Vaskulitiden Entzündungsaktivität Entzündungsaktivität Tab. 5: Aktivitätsassoziierte Laborparameter Therapie Therapie der Immunkomplexvaskulitiden Das therapeutische Procedere richtet sich nach Ausdehnung, Organmanifestation und Aktivität der Erkrankung sowie der Prognose. PSV werden immunsuppressiv behandelt. Dies erfordert eine engmaschige ärztliche Überwachung. Eine Patientenschulung trägt zur Minimierung therapiebedingter Komplikationen bei. Man unterscheidet drei Therapiestadien: Kryoglobulinämische Vaskulitis (CV) Bei der HCV-assoziierten CV wird bei nicht lebensbedrohlichen Organmanifestationen der Versuch einer HCV-Elimination durch kombinierte Gabe von Interferon-α und Ribavirin über 18 – 24 Monate empfohlen.[4] Bei lebensbedrohlichen Verläufen, etwa bei zunehmender Niereninsuffizienz, progredienter Polyneuropathie oder ZNSVaskulitis, ist eine immunsuppressive Therapie mit Cyclophosphamid (CYC) und Glucocorticoiden erforderlich, bei Therapierefraktärität ergänzt durch additive Plasmaseparationen über circa zwei Wochen. Mit dem monoklonalen Anti-CD20-Antikörper Rituximab steht eine neue Therapieoption der CV zur Verfügung. ■ Induktionstherapie: Diese erfolgt in der Regel mit Cyclophosphamid (Boli oder oral) nur über 3 – 6 Monate (Tab. 6). ■ Erhaltungstherapie: Nach erzielter Remission werden weniger toxische immunsuppressive Substanzen zur Remissionserhaltung (in der Regel mindestens zwei Jahre) eingesetzt (Tab. 6). ■ Eskalationstherapie: Bei therapierefraktärem Verlauf (etwa 5 – 10 Prozent der Patienten mit ANCA-assoziierten Vaskulitiden) ist eine Eskalation der konventionellen immunsuppressiven Therapie durch additive Maßnahmen (z. B. Plasmapherese) und/oder neue biologische Immunmodulatoren erforderlich (Tab. 7). sive Therapie mit CYC oder AZA erforderlich werden. Bei entsprechender Überwachung können auch eine GC-Monotherapie oder eine hochdosierte intravenöse Immunglobulin (IVIG)-Therapie ausreichen. Polyarteriitis nodosa (PAN) Kontrollierte Studien zur Therapie der PAN finden sich kaum. Eine aktuellere Studie zeigt, dass Patienten mit vermutlich schlechter Prognose nach Gabe von zwölf Zyklen CYC eine geringere Rezidivhäufigkeit aufweisen als nach Gabe von sechs Zyklen.[5] Schönlein-Henoch-Purpura Die Prognose ist im Allgemeinen gut. Bei schweren Verlaufsformen (rapid-progressive Glomerulonephritis, Darmbeteiligung mit Blutungen) kann eine immunsuppres- Die Therapie erfolgt abhängig von Erkrankungsstadium und -aktivität. Die lokalisierte WG kann mit Trimethoprim-Sulfamethoxazol (Cotrimoxazol) behandelt werden, wenn eine engmaschige Kontrolle gewährleistet ist.[6] Bei generalisierter, schwer verlaufender ANCA-assoziierter Vaskulitis mit organ- und/oder lebensbedrohlichen Manifestationen erfolgt die remissionsinduzierende Therapie mit Cyclophosphamid entweder nach dem „Fauci-Schema“ (2 mg/kg/Tag per os für 3 – 6 Monate) oder Austin-Schema (Boli) und Prednisolon.[7] Nach Erzielen einer Remission erfolgt eine Umstellung auf eine remissionserhaltende Therapie (mit zum Beispiel MTX, Azathioprin, MykophenolatMofetil, Leflunomid). Therapie der granulomatösen Vaskulitiden Riesenzellarteriitis (RZA) Die RZA spricht häufig auf eine GC-Monotherapie innerhalb weniger Tage gut an. Eine Startdosis von 40 bis 60 mg Prednisolonäquivalent sollte innerhalb von etwa sechs Monaten auf 5 – 7,5 mg/Tag reduziert werden. Bei Visusstörungen sollte die Therapie unverzüglich und hochdosiert (intravenös Methylprednisolon, 250 – 1.000 mg täglich über drei Tage) begonnen werden. Bei therapieresistentem Verlauf und anhaltend hohem Steroidbedarf ist die Einleitung einer immunsuppressiven, steroideinsparenden Therapie mit zum Beispiel Methotrexat (MTX) (0,3 mg/kg/Woche s. c.) oder alternativ Azathioprin angezeigt.[8] Takayasu-Arteriitis Randomisierte, placebo-kontrollierte Studien zur Behandlung der Takayasu-Arteriitis liegen bislang nicht vor. Als Standard zur Behandlung unkomplizierter Verläufe gilt allgemein eine Glukokortikoidmonotherapie, jedoch sind etwa ein Viertel der Patienten zunächst therapierefraktär und in bis zu 50 Prozent der Fälle kommt es zu Rezidiven. Daher sollte frühzeitig eine 813 Medtropole | Ausgabe 22 | Juli 2010 Behandlung mit Immunsuppressiva (z. B. MTX) begonnen werden.[9] Bei besonders aggressivem Verlauf ist CYC (als Bolusoder orale Gabe) einzusetzen. Ergebnisse einer retrospektiven Analyse von 106 gefäßchirurgisch behandelten Patienten mit Takayasu-Arteriitis zeigen, dass operative Therapieverfahren additiv zur immunsuppressiven Therapie die Prognose von Patienten mit Komplikationen und refraktärem Verlauf (zum Beispiel bei großen Aneurysmen) verbessern. Literatur Klinik ference. Arthritis Rheum. 1994; 37(2): 187-92. [2] Gross WL. Primäre systemische Vaskulitiden. Teil III. Dosis/Applikation Cotrimoxazol „Initialphase“ T/S 2 x 960 mg/die p. o. Methrotrexat blande MTX 0,3 mg/kg/Wo. i. v. oder s. c. „Fauci-Schema“ NIH-Standard intensiviert aktiv progressiv/foudroyant CYC CYC 2 mg/kg die p. o. 3 – 4 mg/kg/ die p. o. „Austin-Schema“ mäßig-aktiv bzw. überwiegend renale Vaskulitis CYC 15 – 20 mg/kg i. v. Plasmapherese foudroyant mit Nierenversagen Cotrimoxazol Voll-/Teilremission T/S 2 x 960 mg/die p. o. Methrotexat Teilremission MTX 0,3 mg/kg/Wo i. v. Azathioprin Teilremission AZA 2 – 3 mg/kg/die p. o. Cyclosporin A nach Organtransplantation CsA 3 – 5 mg/kg/die p. o. 40 – 60 ml/kg (4 – 7x) Erhaltungstherapie Behandlung refraktärer Verläufe [1] Jennette JC, Falk RJ, et al. Nomenclature of systemic vasculitides. Proposal of an international consensus con- Substanz Induktionstherapie i. v. Immunglobuline refraktär IVIG Monoklonale AK refraktär anti CD4 plus anti CD52 sequentielle Gabe i.v. Antithymozytenglobulin refraktär ATG 400 mg/kg i. v. an 5 Tagen i. v. 10 Tage Pathogenese und Therapie. Der Internist. 1999; 40(11): 1194-215. [3] Gross WL. Primär systemische Vaskulitiden Teil I: Tab. 6: Aktivitäts- und ausdehnungsadaptierte Behandlung ANCA-assoziierter Vaskulitiden Name nach der Chapel-Hill Conference 1992 Intensiviertes Protokoll bei „therapieresistenten“ PSV „therapierefraktären“ PSV Riesenzellarteriitis GC plus AZA oder MTX GC puls CYC (FAUCI- oder AustinSchema) Takayasu-Arteriitis GC plus MTX GC plus CYC (FAUCI- oder Austin-Schema) Polyarteriitis nodosa (PAN) GC & CYC-Bolus plus Plasmapherese GC plus CYC (FAUCI-Schema) Hepatitis B-Virus-assoz. PAN IFNα & Lamivudin plus Plasmapherese GC plus CYC (FAUCI-Schema) Wegener’sche Granulomatose GC & CYC (FAUCI-Schema) plus IVIG AK: a-CD4/CD52* Churg-Strauss-Syndrom GC plus CYC (FAUCI-Schema) α-Interferon (bis 3 x 106/Woche) Mikroskopische Polyangiitis GC & CYC plus IVIG α-Thymozytenglobulin Monoklonale AK: a-CD4/CD52 39(12): 2052-61. Henoch-Schönlein-Purpura GC plus IVIG (evtl. CYC) GC plus CYC (AUSTIN-Schema) [7] Fauci AS, Haynes BF, et al. Wegener’s granulomatosis: Kutane leukozytoklastische Angiitis GC plus AZA (MTX) prospective clinical and therapeutic experience with 85 Essentiell kryoglobulinämische Vaskulitis Allgemeine Übersicht. Der Internist 1999; 40(7): 779-94. [4] Della Rossa A, Tavoni A, et al. Treatment of chronic hepatitis C infection with cryoglobulinemia. Curr Opin Rheumatol. 2002; 14(3): 231-7. [5] Guillevin L, Cohen P, et al. Treatment of polyarteritis nodosa and microscopic polyangiitis with poor prognosis factors: a prospective trial comparing glucocorticoids and six or twelve cyclophosphamide pulses in sixty-five patients. Arthritis Rheum. 2003; 49(1): 93-100. [6] de Groot K, Reinhold-Keller E, et al. Therapy for the maintenance of remission in sixty-five patients with generalized Wegener’s granulomatosis. Methotrexate versus trimethoprim/sulfamethoxazole. Arthritis Rheum. 1996; α-Interferon & Ribavirin plus Plasmapherese AUSTIN-Schema plus Plasmapherese patients for 21 years. Ann Intern Med. 1983; 98(1): 76-85. [8] De Silva M, Hazleman BL. Azathioprine in giant cell Erläuterungen arteritis/polymyalgia rheumatica: a double-blind study. GC = Glucocorticoid CYC = Cyclophospamid AZA = Azathioprin GC & CP = FAUCI-Schema Ann Rheum Dis. 1986; 45(2): 136-8. * humanisiertes anti-CD4, anti-CAMPATH 1H „low-dose” MTX = Methotrexat CP = Cyclophosphamid-bolus = AUSTIN-Schema [9] Shikawa K, Maetani S. Long-term outcome for 120 Japanese patients with Takayasu’s disease. Clinical and sta- Tab. 7: Behandlung der therapieresistenten bzw. -refraktären PSV-intensivierte Therapiemöglichkeiten bei Progression tistical analyses of related prognostic factors. Circulation. 1994; 90(4): 1855-60. Kontakt Dr. Keihan Ahmadi-Simab Klinik für Rheumatologie, klinische Immunologie, Nephrologie Asklepios Klinik Altona Paul-Ehrlich-Straße 1, 22763 Hamburg Tel. (0 40) 18 18-81 11 24 Fax (0 40) 18 18-81 48 00 E-Mail: [email protected] Abb. 1: HRCT-Thorax, Lungengranulom bei M. Wegener 814 Abb. 2: MRT-Kopf, M. Wegener, Mastoiditis Psychosomatik Essstörungen Stationäre oder tagesklinische Behandlung? Dr. Helge Fehrs Essstörungen mit Krankheitswert sind vor allem die Anorexia nervosa (Magersucht, ICD10 F50.0), die Bulimia nervosa (Ess-/Brechsucht, ICD10 F50.2) sowie die Binge-Eating-Störung (Essattacken ohne Erbrechen, ICD10 F50.9). In der Therapie dieser Erkrankungen ist, wegen ihrer Chronifizierungstendenz und hoher Rückfallgefahr, eine Gesamtbehandlungsplanung von großer Bedeutung. Der Anteil chronischer Verläufe beträgt bei der Anorexie etwa 50 Prozent,[2,7] bei der Bulimia nervosa rund 30 Prozent.[1] Daher ist es sinnvoll, eher in Behandlungsabschnitten zu denken als der Vorstellung zu erliegen, eine Maßnahme wie zum Beispiel eine achtwöchige stationäre Behandlung würde die Erkrankung „heilen“. Während bis vor wenigen Jahren ambulante und stationäre Behandlungsmöglichkeiten als einzige Alternativen zur Verfügung standen, gibt es inzwischen mehrere Zentren in Deutschland, die wie das Asklepios Westklinikum Hamburg auch tagesklinische Angebote vorhalten. Dabei sind verschiedene Tagesklinikmodelle zu unterscheiden, die entweder alternativ zur stationären Behandlung (fünf Tage pro Woche) arbeiten oder aber ein Übergangssetting vom stationären zum ambulanten Bereich anbieten (zum Beispiel zwei Tage pro Woche). Stehen unterschiedliche Behandlungsoptionen zur Verfügung, sollten bei der Entscheidung über die Therapieform im Ambulanzgespräch insbesondere die Behandlungsmotivation und die Zielsetzung geklärt werden. Dabei ist der Austausch mit Vorbehandlern in der Regel hilfreich. Bei der Entlassung aus einem Behandlungsabschnitt, also an der Schnittstelle zu einem möglichen nächsten Baustein der Behandlungskette, sind die noch vorhandene Erkrankungsschwere, das Rückfallrisiko und die psychosozialen Res- sourcen zu beachten. In jedem Fall kommt einer gezielten Vorbereitung auf die Zeit nach der Klinik große Bedeutung zu. Für die meisten Patienten ist ein Stufenplan der Behandlung optimal (z. B. stationärnachstationär-tagesklinisch-ambulant). Ziele stationärer und tagesklinischer Therapie bei Essstörungen [3] ■ körperliche Stabilisierung (Anorexie: ausreichende Gewichtszunahme; Bulimie: Reduktion des selbstinduzierten Erbrechens, des Laxantienabusus und des exzessiven Sporttreibens) ■ Normalisierung des Essverhaltens (Mahlzeitenzusammensetzung, Essensstruktur) ■ Erarbeitung einer ausreichenden Behandlungs- und Änderungsmotivation ■ Herausarbeiten zentraler psychischer Problembereiche (z. B. Reifungsängste, Probleme mit der Regulation eigener Gefühle) ■ Verbesserung der psychischen Begleitsymptomatik (z. B. Depressivität, Ängste, selbstverletzendes Verhalten) ■ Arbeit an zentralen dysfunktionalen Beziehungsmustern (z. B. Abhängigkeitskonflikt) ■ Unterstützung bei Problemen im sozialen Umfeld Multimodale Therapieprogramme Sowohl in stationärer als auch in tagesklinischer Behandlung finden multimodale Therapieprogramme ihre Anwendung. Sie bestehen aus psychodynamisch oder verhaltenstherapeutisch ausgerichteten Gruppen- und Einzelpsychotherapien, erlebnisorientierten Therapieverfahren, die schwerpunktmäßig in Gruppen angeboten werden (konzentrative Bewegungstherapie, Kunst- und Gestaltungstherapie oder Musiktherapie), Ernährungsberatung, angeleitetem Kochen, Familiengesprächen sowie medizinischer Diagnostik und Behandlung. Hinzu kommen strukturierte symptomorientierte Komponenten, die sich speziell auf die Essstörung der Patientinnen beziehen. Sie halten Vorgaben zum Verzicht auf das pathologische Essverhalten, zur Gewichtsentwicklung und zur Nahrungsaufnahme vor, die häufig über Belohnungsverfahren positiv verstärkt werden. Zudem wird mit Esstagebüchern gearbeitet, die Mahlzeiten werden begleitet, es gibt Ruhephasen für Anorektikerinnen und Bulimikerinnen nach dem Essen sowie Sport- und Bewegungsangebote für übergewichtige Patienten. Dabei sind Regeln und Vorgaben im stationären Bereich enger gefasst als im tagesklinischen Bereich – auch, weil dort den Patienten mehr Verantwortung übertragen wird. 815 Medtropole | Ausgabe 22 | Juli 2010 Indikationsstellung Stationäre Behandlung Im Krankenhaus ist durch die ständige ärztliche und pflegerische Präsenz eine kontinuierliche körperliche Überwachung und Ansprechbarkeit gegeben. Die Tagesund Mahlzeitenstruktur ist vorgegeben, die Distanz zum belastenden Beziehungsumfeld oder Alltagsgeschehen durch die stationäre Aufnahme hergestellt. Abzuwägen ist, ob die „käseglockenartige“ Abschirmung durch das stationäre, regressionsfördende Milieu hilfreich ist, da es den Übergang in den Alltag erschwert. Für die meist jungen Patienten bedeutet ein Klinikaufenthalt in der Regel eine längere Unterbrechung von Schule, Ausbildung oder gerade begonnener Berufsausbildung, die wiederum destabilisierend wirken kann. Bei der Anorexie ist eine Klinikbehandlung indiziert bei raschem oder anhaltendem Gewichtsverlust (mehr als 20 Prozent über sechs Monate), gravierendem Untergewicht (BMI < 15 kg/m²) oder bei seit drei Monaten trotz ambulanter oder tagesklinischer Therapie stagnierendem erheblichem Untergewicht. Auch wenn soziale oder familiäre Einflussfaktoren den Gesundungsprozess stark behindern, ambulante oder tagesklinische Behandlungsmöglichkeiten unzureichend sind oder eine geringe Krankheitseinsicht besteht, ist an eine stationäre Behandlung zu denken. Medizinische Komplikationen wie schwere Infekte, körperliche Schwäche oder Herzrhythmusstörungen machen einen Krankenhausaufenthalt unabdingbar. Bei der Bulimia nervosa sollte einer stationären Behandlung der Vorzug gegeben werden, wenn die Symptomatik so stark ausgeprägt ist, dass der Alltag nicht mehr bewältigt werden kann oder wenn Impulsdurchbrüche in verschiedener Gestalt vorliegen (zum Beispiel Ess/Brechanfälle, selbstverletzendes Verhalten, Wutausbrüche, Suizidgedanken). Stärkere körperliche Beeinträchtigungen indizieren ebenfalls eine stationäre Therapie. Teilstationäre Behandlung Ein großer Vorteil der Tagesklinik ist die intensive Übungssituation: Täglich können Aspekte aus der Therapie zu Hause ausprobiert werden und im Alltag auftretende Schwierigkeiten (zum Beispiel mit dem 816 Essen oder in zwischenmenschlichen Beziehungen) fließen unmittelbar in die Behandlung ein. Das Selbstwirksamkeitserleben der Patienten wird gestärkt („Ich habe etwas verändert“), Nähe und Distanz lassen sich leichter regulieren. Nachteilig kann sich auswirken, dass sich die Patienten nicht so umfassend von ihren Alltagsaufgaben zurückziehen oder sich nicht aus destruktiven Beziehungen lösen können. Pathologische Verhaltensweisen können leichter unbemerkt (heimlich) aufrecht erhalten werden. Für Magersuchterkrankte sind insbesondere tagesklinische Modelle sinnvoll, die einen abgestuften Übergang in ein ambulantes Setting anbieten. Optimal sind Angebote, bei denen die Behandler der Station die Therapie auch in der Tagesklinik weiterführen (Behandlerkontinuität, Rückkehr an den vertrauten Ort). Für viele Patienten mit Bulimie ist die Tagesklinik der stationären Behandlung überlegen, vor allem, wenn die Symptomatik zwar noch regelmäßig vorhanden ist, aber nicht mehr so destruktiv umfassend auftritt. Bulimikerinnen profitieren sehr vom Übungscharakter der tagesklinischen Behandlungsform.[4,5,6] langfristigen Störungen bereits zu massiver Gewichtszunahme mit Adipositas und entsprechenden Folgeerkrankungen psychischer und körperlicher Art gekommen. Stationäre und teilstationäre Programme für essgestörte Patientinnen sollten sowohl strukturierte symptomorientierte Angebote enthalten, als auch Angebote, in welchen die psychischen Schwierigkeiten der Patienten aufgegriffen werden. Literatur [1] Fichter MM, Quadflieg N. Twelve-year course and outcome of bulimia nervosa. Psychol Med. 2004; 34: 1395-406. [2] Steinhausen HC. The outcome of anorexia nervosa in the 20th century. Am J Psychiatry. 2002; 159: 1284-93. [3] Zeeck A. in: Herpertz S, de Zwaan M, Zipfel S (Hrsg.) Handbuch Essstörungen und Adipositas, Springer 2008: 214. [4] Zeeck A, Hartmann A. Stationäre und teilstationäre Therapie bei Anorexie und Bulimie. Ärztl Psychother Psychosomat. 2008; Med 1: 17-24. [5] Zeeck A, Sandholz A, Hipp W, Schmidt A. Stationäre und teilstationäre Bulimietherapie – das Freiburger Konzept. Psychotherapeut. 2005; 50(1): 43-51. [6] Zeeck A, Weber S, Sandholz A, Wetzler-Burmeister E, Wirsching M, Hartmann A. Inpatient versus day clinic treatment for Bulimia nervosa: A randomized controlled trial. Psychother Psychosom. 2009; 78(3): 152-60. [7] Zipfel S, Lowe B, Reas DL, Deter HC, Herzog W. Long- Bei Patienten mit Binge-Eating-Störung ist eine komplexe Therapie, stationär oder tagesklinisch, insbesondere dann indiziert, wenn bereits eine Adipositas mit Folgeerkrankungen entstanden ist. term prognosis in anorexia nervosa: lessons from a 21-year follow-up study. Lancet. 2000; 355: 721-2. Fazit Essgestörte Patientinnen benötigen differenzierte Behandlungsangebote: ambulant, tagesklinisch als Alternative zur stationären Behandlung oder als Vor- und Nachbehandlung, sowie vollstationäre Behandlungsplätze, auch zur Krisenintervention ohne längere Wartezeit. Während für Patientinnen mit Anorexia nervosa stationäre mit anschließenden nachstationären tagesklinischen Behandlungen oft die geeignetste Form darstellen, profitieren Bulimikerinnen mit mittelschweren Symptomausprägungen nach neueren Erkenntnissen sogar eher von intensiven tagesklinischen Behandlungsangeboten als von vollstationären Settings. Patientinnen und Patienten mit Binge-Eating-Störung können häufig ambulant ausreichend versorgt werden – es sei denn, es ist bei chronischen Kontakt Dr. Helge Fehrs Abteilung für Psychosomatische Medizin und Psychotherapie Asklepios Westklinikum Hamburg Suurheid 20, 22559 Hamburg Tel. (0 40) 81 91-25 01 Fax (0 40) 81 91-25 99 E-Mail: [email protected] Psychiatrie und Psychotherapie Können psychisch Gesunde süchtig werden? Oder ist Sucht immer ein Symptom einer anderen psychischen Störung? Dr. Klaus Behrendt, Dr. Erich Trüg Bei Menschen, die zum Beispiel eine Schizophrenie haben, würde kein Mediziner und vermutlich auch kein anderer vernünftiger Mensch auf die Idee kommen, die Krankheit sei eigentlich immer ein Symptom einer anderen psychischen Störung. Dabei entwickelt auch sie sich oft schleichend wie die Suchterkrankung. Auch hier gibt es das geflügelte Wort „sind wir nicht alle ein bisschen schizophren?“. Doch das Verhalten, das nur bei wenigen letztendlich süchtig entgleist, kann sehr lange als normales, vielleicht lange auch als schädliches Verhalten bestehen, über das der Mensch aber noch die Kontrolle hat. Entsprechend hielt Joël, ein Suchtexperte, von dem wir auch heute noch viel lernen können, bereits 1928 fest: „Der Unterschied zwischen dem Süchtigen und dem so genannten Normalen ist kein wesentlicher, sondern ein gradmäßiger, wenn auch oft von gewaltigem Ausmaß.“[3] Die Hintergründe, vor denen aus Konsum oder schädlichem Konsum plötzlich eine Suchterkrankung wird, sind individuell und vielfältig. Die erhebliche Stigmatisierung durch die Zuschreibung einer Suchterkrankung [2] erklärt den Versuch, zur Entlastung den Hintergrund oder Auslöser als eigentliches psychisches Drama anzuführen, auf das sich die Sucht nur aufgepropft habe. Und diese Fälle gibt es auch tatsächlich.[6] Aber nicht jedem, der im Zwiespalt zwischen Wollen und Können zu einer stimulierenden oder sedierenden Substanz gegriffen oder versucht hat, innere Disharmonie mit Glücksspiel, Kaufen oder anderem befriedigendem Verhalten zu kompensieren, ist deshalb gleich eine krankheitswertige psychische Störung zuzuordnen. Wir kennen viele auch schwer gestörte Patienten, bei denen sich nur die Entwicklung der Suchterkrankung über viele Jahre zurückverfolgen lässt, andere gravierende psychische Störungen hingegen nicht. Die süchtige Entwicklung geht allerdings mit einer – grundsätzlich reversiblen – Verhaltensauffälligkeit einher, die der ungestörten Beschaffung des Suchtmittels sowie der Verdeckung und Verleugnung der Krankheit dient. Sie kann so krass und ausgeprägt sein, dass über Jahre ernsthaft die inzwischen widerlegte Hypothese von einer vorbestehenden Suchtpersönlichkeit diskutiert wurde. Im Verlauf einer schweren Suchterkrankung können sich nicht nur somatische Begleit- und Folgeerkrankungen, sondern auch andere – quasi reaktive – psychische Störungen von Krankheitswert ausbilden. Entstehungsmöglichkeiten Es besteht weithin eine wissenschaftliche Übereinstimmung in der Auffassung, dass bei Süchten verschiedene Bedingungskomplexe – auf der sozialen, personalen und biologischen Ebene – beteiligt sind. Diese Ebenen sind weder aufeinander zu reduzieren noch jeweils gleich wichtig. In unterschiedlichen Phasen dominieren verschiedene Aspekte.[1] Das „magische Dreieck“ von Droge, Umwelt und Person, in dem sich das süchtige Verhalten abspielt,[4] illustriert lediglich ein gegenseitiges Bedingungsgefüge. Dabei bleibt noch völlig offen, mit welchen Anteilen die jeweiligen Faktoren für verschiedene Gruppen von Menschen oder im Verlauf einer individuellen Karriere bestimmend sind – also welche Bedeutung etwa der Drogenwirkung im Verhältnis zur sozialen Situation oder psychischen Verfassung zukommt und wie die Rückkopplungsprozesse aussehen und im weiteren Verlauf zu gewichten sind. Suchtmittelkonsum kann besonders lustvoll beziehungsweise angenehm und positiv verstärkend erlebt werden, wenn nüchtern keine oder nur unzureichende positiven Erfahrungen gemacht wurden (Erfahrungsdefizit) oder in 817 Medtropole | Ausgabe 22 | Juli 2010 bestimmten Konstellationen keine anderen Bewältigungsmöglichkeiten zur Verfügung stehen. Suchtverhalten baut auf dem normalen alltäglichen Konsumverhalten auf und folgt der Logik „Gutes noch besser, Schlechtes gar nicht so schlimm“. Dieser Verstärkungsmechanismus kann zur Suchtentwicklung entgleisen, wenn zum Beispiel bei regelmäßigem Alkoholkonsum in einer Krise jedweder Genese schleichend mehr konsumiert wird (Missbrauch) bis hin zu einem krankheitswertigen Ausmaß (Kontrollverlust). Dass „der erste Schuss süchtig macht“ ist ein seltenes Phänomen und hat auch mit dem Suchtpotential der konsumierten Droge und ihrer Applikation zu tun. In der Regel führen nicht die Drogen, sondern deren unsachgemäße Anwendung zur Abhängigkeit. Sehr häufig ist Suchtmittelkonsum mit einer weiteren psychischen Erkrankung verknüpft, seien es Persönlichkeitsstörungen, Belastungsstörungen, Depressionen oder andere psychiatrische Erkrankungen (Komorbidität). Suchtmittel werden in diesem Zusammenhang zur Befindens- beziehungsweise Affektregulation eingesetzt. Sie sind also willkommene Substanzen, um in eine annäherungsweise psychisch ausgeglichene Balance zu kommen. 818 Hypothesen Vorauszuschicken ist, dass jede Behandlung von Krankheiten und insbesondere auch die psychischer Erkrankungen in einem historischen Kontext zu sehen ist und viel mit den persönlichen Einstellungen und Annahmen der Behandelnden zu tun hat. Sie stützt sich also letztlich nicht nur auf wissenschaftliche Erkenntnisse, sondern oft auch auf persönliche Einstellungen und Auffassungen, den Einfluss „alter Lehrer“ oder des Behandlungsteams, der Klinikleitung und ähnlichem. Dabei lassen sich mehrere Grundannahmen oder Hypothesen unterscheiden, von denen aus Behandlungskonzepte entwickelt wurden und werden: ■ „Entscheidend ist, die Suchterkrankung durchgreifend mit dem Ziel dauerhafter Abstinenz zu behandeln. Dann erledigen sich die ansonsten auftretenden psychischen Probleme und Störungen von selbst.“ Dieser früheste Einsatz professioneller Suchtbehandlung stützte sich insbesondere auf die Vorstellungen und Erfahrungen abstinenter Abhängigkeitskranker, die sich in Selbsthilfegruppen organisiert hatten. ■ Nicht selten trifft man auch auf die Auffassung, dass es ausreiche, eine auffällige psychische Störung konsequent medikamentös, psychotherapeutisch und soziotherapeutisch zu behandeln. Dann erledige sich die Sucht sozusagen von selbst.[5] ■ Nach der Hypothese der Wechselwirkung zwischen Sucht und weiterer psychischer Störung muss dagegen beides immer gleichzeitig beachtet und behandelt werden, um ein positives Behandlungsergebnis zu erreichen. Dem ist im Übrigen bescheiden entgegenzuhalten, dass der häufigste erfolgreiche Weg aus der Sucht der der Selbstheilung ohne professionelle Hilfe ist. So haben in den vergangenen drei Jahren zum Beispiel zwei Millionen Menschen in Deutschland das Rauchen aufgegeben. Es ist völlig ungeklärt, wie vielen abhängigkeitskranken Menschen es gelingt, ohne jede Unterstützung durch Ärzte oder suchtspezifische Beratungs- und Behandlungsangebote abstinent zu werden. Diese Menschen sind positiv zu verstärken. Therapeutische Hilfe, die sie offenbar nicht brauchen und oft auch gar nicht wollen, ist hier nicht indiziert. Professionelle Hilfe ist nur geboten, wenn die Störung so stark ausgeprägt ist oder die persönlichen Ressourcen so schwach sind, dass ein Ausstieg nicht allein gelingt. Und bei dieser Gruppe von Abhängigen ist im Verlauf zu klären, ob Abstinenz überhaupt erreicht werden kann und für die Patienten ein erstrebenswertes Ziel ist. Psychiatrie und Psychotherapie Unser Behandlungsansatz Unsere Basis ist der in der Suchttherapie geltende Grundsatz, die Verantwortung (für Konsum oder Nicht-Konsum) beim Patienten zu belassen. Dementsprechend ist die Herangehensweise ganz pragmatisch individuell an den Patienten angepasst. Dabei gilt es herauszufinden, was für den Patienten wirklich „passend“ ist, was er selbst will und nicht will, wozu er motiviert ist, was er anstrebt und welche Möglichkeiten ihm zur Verfügung stehen. Wir nehmen die Rolle des „Steigbügelhalters“ ein. Das heißt, wir stellen unsere Möglichkeiten in den Dienst einer Zielhierarchie, die das Überleben sichert, Schaden minimiert und ein möglichst gesundes Leben, also Lebenskompetenzen („Lebensmittel“) vermittelt – bis dahin, die Abstinenz zu ermöglichen. Das Ideal „Abstinenz“ erreichen nur sehr wenige der chronisch Abhängigen. Hier ist Suchtbegleitung indiziert, zum Beispiel die Substitution mit Ersatzstoffen, die es ermöglichen, frei von Beschaffungskriminalität und -druck ein soziales, möglichst gesundes und selbstbestimmtes Leben zu führen. Die biologische Komponente der Sucht weist uns darauf hin, dass Sucht nicht nur eine Beeinträchtigung des Willens ist. Notwendig sind daher auch medikamentöse Behandlungsstrategien wie Substitution, Rückfallmedikationsprophylaxe, eine aus- schleichende Entzugsbehandlung sowie gegebenenfalls medikamentöse Unterstützung zur Stressreduktion und eine auch medikamentöse Behandlung von Komorbidität. Literatur [1] Behrendt K, Degwitz P, Trüg E (Hrsg.). Schnittstelle Drogenentzug. Freiburg/B. Lambertus 1995 (S 12ff). [2] Erlenmeyer A: Die Morphiumsucht und ihre Behandlung, 3. Auflage. Berlin, Leipzig, Neuwied: Heuser’s Verlag 1887 (S87-88). Fazit [3] Joël E. Die Behandlung der Giftsuchten, Alkoholismus, Morphinismus, Kokainismus usw. Leipzig: Georg Thieme Die Substitution verhält sich zur Abstinenz wie der Mieter im Mietshaus zum Eigenheimbesitzer. Viele streben Letzteres an, nicht alle schaffen es und nicht zuletzt: nicht alle wollen es. Ermöglichen wir doch jedem das Seine, solange damit der individuelle Lebenswert abgesichert und erhalten werden kann. Verlag 1928 (S 11). [4] Feuerlein W (Hrsg.). Theorie der Sucht. Berlin: Springer 1986 (S 104 ff). [5] Kellermann B. Süchtiges Verhalten und Gemeinwohl. HÄB 2010; 64(4): 28-30. [6] Ringelhahn S. Persönlichkeitsstörungen und Sucht. Medtropole 2010; 20: 751-4. Weiterführende Literatur Bei medikamentösen Behandlungsstrategien sollte es, wenn möglich, aber nicht bleiben. Therapeutische beziehungsweise psychoedukative Angebote und Maßnahmen begleitend zu medikamentösen Strategien erhöhen erfahrungsgemäß die Erfolgsrate. [7] Wienberg G, Driessen M (Hrsg.) Auf dem Weg zur vergessenen Mehrheit. Innovative Konzepte für die Versorgung von Menschen mit Alkoholproblemen. Bonn: Psychiatrie-Verlag 2001. Kontakt Dr. Klaus Behrendt IV. Fachabteilung Psychiatrie und Psychotherapie Abhängigkeitserkrankungen Asklepios Klinik Nord – Ochsenzoll Langenhorner Chaussee 560 22419 Hamburg Tel. (0 40) 18 18-87 27 39 Fax (0 40) 18 18-87 17 03 E-Mail: [email protected] 819 Medtropole | Ausgabe 19 | Oktober 2009 K O N T A K T Prof. Dr. Karl-Heinz Frosch Unfall- und Wiederherstellungschirurgie Chirurgisch-Traumatologisches Zentrum Asklepios Klinik St. Georg Lohmühlenstraße 5, 20099 Hamburg Tel. (0 40) 18 18-85 22 87 Fax (0 40) 18 18-85 37 70 E-Mail: [email protected] Prof. Dr. Karl-Heinz Frosch K O N T A K T Prof. Dr. Joachim Röther Abteilung für Neurologie Asklepios Klinik Altona Paul-Ehrlich-Straße 1 22763 Hamburg Tel. (0 40) 18 18-81 14 00 Fax (0 40) 18 18-81 49 06 E-Mail: [email protected] Prof. Dr. Joachim Röther Asklepios Klinik St. Georg: Neuer Leiter des ChirurgischTraumatologischen Zentrums Am 1. Juli übernahm Prof. Dr. Karl-Heinz Frosch als Nachfolger von Prof. Dr. Christoph Eggers die Leitung der Abteilung für Unfall- und Wiederherstellungschirurgie sowie des Chirurgisch-Traumatologischen Zentrums in der Asklepios Klinik St. Georg. Prof. Frosch wurde 1968 in Bischofsgrün geboren, besuchte unter anderem das Skigymnasium Christophorusschule in Berchtesgaden, nahm 1989 bis 1990 als Mitglied der deutschen Skinationalmannschaft „Nordische Kombination“ mehrfach am Weltcup teil, absolvierte sein Medizinstudium an der Friedrich-Alexander-Universität Erlangen-Nürnberg und promovierte am dortigen Institut für klinische Immunologie und Rheumatologie. Eine Famulatur „Orthopaedic Trauma“ führte ihn ans Howard Head Medical Center in Vail, Colorado, das Praktische Jahr an die DUKE University, North Carolina. Seine Weiterbildung zum Facharzt für Chirurgie absolvierte Prof. Frosch am Klinikum Bamberg und in der Abteilung für Unfallchirurgie, Plastische und Wiederherstellungschirurgie des Universitätsklinikums Göttingen, wo er seither als Oberarzt tätig war. 2004 erwarb Prof. Frosch die Schwerpunktsbezeichung Unfallchirurgie, 2007 die Zusatzbezeichnung „Spezielle Unfallchirurgie“ sowie die Facharztanerkennung „Orthopädie und Unfallchirurgie“. Im gleichen Jahr habilitierte er sich im Fach Unfallchirurgie mit dem Thema „Entwicklung stammzellbesiedelter Titan-Miniprothesen für den Oberflächenteilersatz am Kniegelenk“ und erhielt den Preis für die beste Habilitation der Fakultät im Wintersemester 2006/2007. 2010 wurde er zum Außerplanmäßigen Professor der Univer- 820 Asklepios Klinik Altona: Neue Leitung der Neurologie sität Göttingen berufen. Seit 2008 war Prof. Frosch ständiger D-Arzt-Vertreter und geschäftsführender Oberarzt der Klinik für Unfallchirurgie, Plastische und Wiederherstellungschirurgie sowie stellvertretender Leiter der AG Arthroskopische Chirurgie der Deutschen Gesellschaft für Unfallchirurgie. Er ist Mitglied des Nichtständigen Beirats der Deutschen Gesellschaft für Unfallchirurgie und der Deutschen Gesellschaft für Orthopädie und Unfallchirurgie. Prof. Frosch ist unfallchirurgisch breit ausgebildet und erfahren in der Polytraumaund Schwerverletztenversorgung. Sein klinischer Schwerpunkt ist die Behandlung von Kniekomplextraumen, schwersten Kniegelenksverletzungen, fehlverheilten Frakturen im Kniegelenksbereich mit intraund extraartikulären Korrekturosteotomien sowie der arthroskopischen Chirurgie inkl. der hinteren Kreuzbandchirurgie. Neben den bereits bestehenden Schwerpunkten wie der Wirbelsäulenchirurgie, Neurochirurgie, Plastischer und Handchirurgie sowie der Schwerverletztenversorgung soll insbesondere die Arthroskopische Chirurgie und die Sporttraumatologie an der Asklepios Klinik St. Georg weiter ausgebaut und etabliert werden. Am 1. Juli übernahm Prof. Dr. Joachim Röther als Nachfolger von Prof. Dr. Axel Müller-Jensen die Leitung der Neurologischen Klinik in der Asklepios Klinik Altona. Nach dem Medizinstudium und der Promotion in Marburg begann Röther eine neurochirurgische (RWTH Aachen) und neurologische Ausbildung (Universitätsklinikum Heidelberg/Mannheim). An der Stanford University, USA, forschte er von 1994 bis 1996 als Stipendiat der Deutschen Forschungsgemeinschaft über physiologische Hintergründe der Diffusions- und Perfusions-MR-Bildgebung. Für diese Arbeiten wurde er mit dem Hugo-SpatzPreis der Deutschen Neurologischen Gesellschaft ausgezeichnet. Von 1996 bis 2005 war er als leitender Oberarzt und C3-Professor an den Neurologischen Universitätskliniken Jena und dem UKE Hamburg Eppendorf tätig. Von 2000 bis 2005 leitete er als Chefarzt die Neurologische und ab 2008 als Ko-Chefarzt zusätzlich die Geriatrische Klinik des Johannes Wesling Klinikums Minden. Prof. Röther ist Präsident der Deutschen Schlaganfall-Gesellschaft und hat sich in mehr als 200 wissenschaftlichen Arbeiten mit der Behandlung des Schlaganfalls befasst. Er ist als Experte in nationalen und internationalen Gremien und Studien in führenden Positionen vertreten, unter anderem als Gründungsmitglied der European Stroke Organisation, Mitglied des Editorial Board der Zeitschriften Journal of Neuroimaging und Cerebrovascular Disease und Mitglied des Scientific Board der European Stroke Conference. Prof. Röther ist Sprecher der Arbeitsgemeinschaft „Herz & Hirn“ der Deutschen Schlag- Personalia K O N T A K T Prof. Dr. Günter Seidel Abteilung für Neurologie Asklepios Klinik Nord Tangstedter Landstraße 400 22417 Hamburg Tel. (0 40) 18 18-87 30 76 Fax (0 40) 18 18-87 30 69 E-Mail: [email protected] Prof. Dr. Günter Seidel Asklepios Klinik Nord: Neue Leitung der Neurologie anfall-Gesellschaft und der Deutschen Gesellschaft für Kardiologie. Neben der Schlaganfallbehandlung und der neurologischen Intensivmedizin liegen weitere klinische Schwerpunkte von Prof. Röther in der Behandlung der Multiplen Sklerose, der Parkinsonerkrankung, der Demenz und der Hirntumoren. Diese Schwerpunkte möchte er in der Asklepios Klinik Altona weiter ausbauen. Am 1. Juli 2010 übernahm Prof. Dr. Günter Seidel als Nachfolger von Prof. Dr. Jürgen Köhler die Leitung der neurologischen Abteilung in der Asklepios Klinik Nord. Der bisherige Oberarzt in der Klinik für Neurologie im Universitätsklinikum Schleswig-Holstein, Campus Lübeck wurde 1963 in Dillenburg geboren und studierte an der Justus-Liebig-Universität in Gießen. Seidel promovierte im Pharmakologischen Institut bei Prof. Dreyer zum Thema „Membranströme in normalen und Rous-Sarkom-Virus infizierten embryonalen Hühnerfibroblasten“. Er begann seine Ausbildung zum Neurologen in der Neurologischen Uniklinik Gießen unter Prof. Dorndorf und wechselte nach vier Jahren an das Universitätsklinikum SchleswigHolstein, wo er die Facharztausbildung abschloss. Seidel absolvierte die Weiterbildungen „Spezielle neurologische Intensivmedizin“ und „Klinische Geriatrie“. 2000 folgten die Habilitation mit dem Thema „Die Sonographie des Gehirns zur Erfassung der zerebralen Makro- und Mikrozirkulation unter besonderer Berücksichtigung von Ultraschallkontrastmitteln“ und die Erteilung der Venia legendi für das Fach Neurologie. Vaskulitis), der Neurosonologie (extraund intrakranielle Farbduplexsonographie, Hirnparenchym- und Muskel-Nerv-Sonographie) und der Intensivneurologie. Seidel ist Mitglied mehrerer nationaler und internationaler Fachgesellschaften und Autor zahlreicher wissenschaftlicher Artikel und Buchbeiträge. Daneben ist er Regionalbeauftragter der Stiftung Deutsche Schlaganfall-Hilfe. In der Asklepios Klinik Nord möchte Prof. Seidel das medizinische Angebot weiter ausbauen (Schlaganfall, Multiple Sklerose, Epilepsie, Neuroonkologie) und um die Schwerpunkte Früh-Rehabilitation und Bewegungsstörungen erweitern. Prof. Dr. Günter Seidel Abteilung für Neurologie Asklepios Klinik Nord Tangstedter Landstrasse 400, 22417 Hamburg Tel. (0 40) 18 18-87 30 76 Fax (0 40) 18 18-87 30 69 E-Mail: [email protected] 2004 wurde er zum Außerplanmäßigen Professor der Medizinischen Fakultät der Universität zu Lübeck berufen. Seidels wissenschaftliche Schwerpunkte umfassen unter anderen die neurovaskuläre Medizin, Bewegungsstörungen und Demenzerkrankungen. Er beherrscht das gesamte Spektrum der klinischen Neurologie. Seine klinischen Schwerpunkte liegen in der Schlaganfallbehandlung (Stroke Unit, Primär- und Sekundärprävention, zerebrale 821 Medtropole | Ausgabe 22 | Juli 2010 Akutmaßnahmen beim Schädel-Hirntrauma Dr. Marcus Lücke, Prof. Dr. Uwe Kehler Das Schädel-Hirntrauma (SHT) ist definiert als durch äußere Gewalteinwirkung bewirkte Schädigung des Gehirns, die mit einer mehr oder minder schweren Verletzung des Schädels und der Kopfweichteile einhergehen kann. Als offenes SHT bezeichnet man dabei eine mit einer Verletzung des Schädels und der Weichteile einhergehende Duraverletzung. Unter der primären Hirnschädigung sind die Verletzungen zum Zeitpunkt des Traumas zu verstehen, die durch eine Abfolge sekundärer Hirnschäden zu einer weiteren Verschlechterung des Verlaufs und des Endergebnisses führen können. Die sekundären Hirnschäden sind therapeutischer Ansatzpunkt. Knapp 250.000 Schädel-Hirntraumata werden in Deutschland pro Jahr registriert. Davon sind etwa fünf Prozent als schwer einzuschätzen. Präklinische Versorgung Das Schädel-Hirntrauma lässt sich in drei Grade einteilen (I: leicht, II: mittelschwer, III: schwer). Die 1953 publizierte Einteilung von Tönnis beruht auf der Dauer der Bewusstseinsminderung und ist nur retrospektiv anwendbar. International üblicher ist die im Wesentlichen am Bewusstseinsgrad nach der Glascow Coma Scale (GCS, Tab. 1) orientierte Einteilung.[1] Wesentlich für die Erstbeurteilung und Versorgung sind: 1. genaue Beurteilung der Bewusstseinslage nach der GCS, dabei insbesondere auch die Dokumentation des exakten zeitlichen Verlaufs; 822 2. Bestimmung des neurologischen Status am Unfallort, dabei mindestens die konsequente Untersuchung auf fokale motorische und sensible Defizite der Pupillenweite, der Lichtreaktion, beim komatösen Patienten zudem des Cornealreflexes und die Überprüfung pathologischer Reflexe; 3. genaue Erhebung und Dokumentation der Vitalparameter, insbesondere der Sauerstoffsättigung und des Blutdrucks; 4. andere Verletzungen und Begleitumstände wie Intoxikation und Unterkühlung. Mit eindeutiger Evidenz sollte der Patient bei einer GCS unter 9 zum Transport intubiert werden, da die Aufrechterhaltung einer suffizienten Oxygenierung und Aspirationsschutz wichtiger sind als die exakte Beurteilung der Bewusstseinslage bei Eintreffen in der Klinik.[2] Dabei sollten jedoch in jedem Fall die Bewusstseinslage nach der GCS und der neurologische Status zum Zeitpunkt der Intubation erhoben und dokumentiert werden, um in der Klinik eine Prioritätenhierarchie für Diagnostik und Erstmaßnahmen sowie eine Prognoseeinschätzung zu ermöglichen. Für die medikamentöse Therapie am Unfallort zur Hirnprotektion besteht keine evidenzbasierte Empfehlung, mit der Ausnahme, dass Glukokortikoide aufgrund eines statistisch schlechteren Ergebnisses nicht appliziert werden sollten. Die Gabe von Mannitol zur kurzfristigen Hirndrucksenkung kann bei schlechtem Status (Pupillenerweiterung, tiefes Koma) sinnvoll sein.[3] Neurochirurgie Abb. 1: Akutes epidurales Hämatom mit deutlich Abb. 2: SHT mit diffusen Kontusionen ohne aktuellen größeren raumfordernden Effekt und erhaltenen basalen raumforderndem Effekt → Indikation zur sofortigen Cisternen → intensivmedinische Überwachung, Kontroll-CCT nach 4-8 Stunden. Im Falle der prolongierten Beatmung operativen Entlastung ggf. Einlage einer Hirndrucksonde Klinische Versorgung CCT großzügig gestellt werden, insbesondere wenn die operative Versorgung anderer Verletzungen ansteht. Nicht zu unterschätzen ist das sekundäre Auftreten von Gerinnungsstörungen bei größerem Blutumsatz. Auch bei unauffälligem primärem CCT sollte in so einem Fall eine CCT-Verlaufskontrolle erfolgen, wenn der Patient nicht zeitnah angemessen neurologisch (Extubation) untersucht werden kann. Bei Vorliegen eines unauffälligen CCT genügt beim bewusstseinsklaren Patienten die stationäre Überwachung über 24 Stunden. Ist der Patient intubiert und sediert, sollte er schnellstmöglich wach und extubiert werden, um eine klinische Überwachung zu ermöglichen. Nach Sicherung der Vitalparameter stehen die neurologische Befunderhebung und Diagnostik ganz oben auf der Prioritätenliste. Die Indikation zum CCT nach Schädel-Hirntrauma besteht bei ■ Bewusstseinsminderung ■ neurologischen Defiziten, die auf eine Hirnbeteiligung hindeuten ■ Krampfanfall ■ Erbrechen ■ stärkeren mnestischen Störungen ■ Hinweisen auf eine Schädelverletzung ■ Hinweisen auf eine Liquorrhoe ■ Hinweisen auf eine Gerinnungsstörung (Marcumar!) Auch wenn der Patient am Unfallort bewusstseinsklar war und aus anderer Indikation, etwa zur Schmerztherapie, intubiert wurde, sollte die Indikation zum Zeigt ein auffälliges CCT eine epidurale, subdurale, intracerebrale oder subarachnoidale Blutung, ein Hirnödem, einen Hydrocephalus oder eine andere potentiell lebensbedrohliche Raumforderung, sollte der Fall immer einem Neurochirurgen demonstriert werden. Dieser kann gegebenenfalls die Indikation zur sofortigen operativen Intervention stellen oder eine Risikoeinschätzung und Empfehlung zu weiterem Monitoring, Therapiemaßnahmen und zur Prognose abgeben. Operative Intervention Bei einer intrakraniellen Raumforderung (v. a. bei subduralem, epiduralem oder intracerebralem Hämatom) und unmittelbar lebensbedrohlichem Status ist eine sofortige neurochirurgische Entlastung notwendig. Wenige Minuten können in solchen Situationen über Leben, Tod oder die Ausprägung einer irreversiblen Behinderung entscheiden! Die Operationsindikation stellt der Neurochirurg anhand der Gesamtschau aus neurologischem und allgemein klinischem 823 Medtropole | Ausgabe 22 | Juli 2010 Punkte Augen öffnen beste sprachliche Äußerung beste motorische Antwort 6 – – gezielt auf Aufforderung 5 – orientiert gezielt auf Schmerzreiz 4 spontan verwirrt ungezielt auf Schmerzreiz 3 auf Ansprache unangemessen Beugen auf Schmerzreiz 2 auf Schmerzreiz unverständliche Laute Strecken auf Schmerzreiz 1 nicht keine keine Tab. 1: Die Glascow Coma Scale zur international gebräuchlichen Einteilung der Bewusstseinslage. Die Addition der Punkte aus drei Qualitäten ergibt einen Punktwert von 3 – 15. Kraniotomie mit Ausräumung einer umschriebenen raumfordernden Blutung epidural, subdural oder intracerebral Kraniektomie, insbesondere bei Hirnödem oder diffusen Kontusionen, ggf. auch in Kombination mit der Ausräumung einer umschriebenen Raumforderung, vor allem einer subduralen oder intracerebralen Blutung. Dabei evtl. Kryokonservierung eines großen Knochendeckels zur späteren Re-Implantation. Dura- und Schädeldachplastik, insbesondere bei offenem Schädel-Hirntrauma oder Impressionsfraktur. Bei persistierender Rhinoliquorrhoe und seltener Otoliquorrhoe evtl. sekundäre Deckung des Schädelbasisdefekts im Intervall. Anlage einer intraventrikulären Drainage zur Hirndruckmessung und ggf. -senkung, insbesondere bei Vorliegen eines Hydrocephalus. Anlage einer Hirndruckmesssonde zum Monitoring einer konservativen Hirndrucktherapie, ggf. zum Feststellen des richtigen Zeitpunktes für eine neuerliche CCT-Kontrolle oder operative Therapie. Abb. 3: SHT mit Hirnkontusionen und Hirnödem, Oberkörperhochlagerung um 30° zur Verbesserung des venösen Abflusses kurzfristige Hyperventilation (CO2 nicht unter 30 – 35 mmHg) Mannitol oder andere Osmodiuretika TRIS-Puffer Senkung der Körperkerntemperatur antiepileptische Medikation Tab. 2: Neurochirurgische Interventionen Tab. 3: Konservative Maßnahmen auf der Intensivstation Konservative Maßnahmen auf der Intensivstation gen, Operationen) ist ein Hirndruckmonitoring zu erwägen, wenn prolongierte Sedierung und Beatmung erforderlich sind.[4] zusätzlich Nachweis freier intrakranieller Luft als Beweis eines offenen SHT → Anlage einer Hirndrucksonde, Kontroll-CCT nach 4 – 8 Stunden, bei Nachweis einer persistierenden Liquorfistel ggf. spätere Deckung Status, allgemeiner und akuter Anamnese sowie aktueller Bildgebung und eventuell auch des Hirndrucks. Gerade bei Grenzfällen erfordert diese Entscheidung viel Erfahrung, da, abgesehen von bestimmten Hirndruckwerten, für die Indikationsstellung wenig in Zahlen oder Messwerten sinnvoll abgebildet werden kann. 824 In erster Linie ist die Homöostase für Kreislauf, Ventilation, Körpertemperatur, Gerinnung und Metabolismus zu wahren. Operative Maßnahmen ohne notfallmäßige Indikation sollten zurückgestellt werden, insbesondere wenn ein größerer Blutumsatz und damit verbundene mögliche Gerinnungsstörungen zu erwarten sind. Die Schäden, die dadurch im Gehirn entstehen können, werden niemals wieder ausheilen! Ist keine eindeutige neurologische Beurteilung möglich, sollte bei pathologischem CCT oder adäquatem Trauma nach 4 – 8 Stunden ein VerlaufsCCT erfolgen. Insbesondere bei grenzwertig raumfordernden Befunden mit noch zu erwartender Dynamik oder weiteren Risikofaktoren (schwere zusätzliche Verletzun- Die verschiedenen medikamentösen und physikalischen Maßnahmen der Hirndrucktherapie (Tab. 3) dienen der Aufrechterhaltung des Metabolismus des Hirngewebes. Allerdings ist für keine über die Analgosedierung und Aufrechterhaltung der Homöostase hinausgehende medikamentöse Therapie ein gesicherter Nutzen belegt, der evidenzbasiert eine generelle Empfehlung rechtfertigt. Auf die lange propagierte Anwendung von Glukokortikoiden sollte aufgrund einer signifikanten Steigerung der 14-Tages-Letalität verzichtet werden.[5] Neurochirurgie GCS > 9 SHT, Vitalparameter stabilisiert GCS < 9 GCS = 15, unauffllige weitere Parameter GCS < 15 oder auffllige weitere Parameter CCT Evaluation des neurologischen Status und Intubation stationre berwachung unauffllige CCT, Patient wach und nicht intensivpflichtig auffllige CCT q im Intervall, initial nach 4 Ð 8 Stunden q bei ICP-Anstieg neurochirurgische Evaluation q Intensivstation Ð ggf. ICP q Drucksonde Ð ggf. Sedierung neurochirurgische Operation Abb. 4: BU Prognose und Nachbehandlung Literatur [1] Bullock R, Chesnut RM, Clifton G, et al. Guidelines for Generell liegt die Letalität beim schweren SHT bei etwa 25 Prozent.[6] Entscheidend für die Prognose des weiteren Lebens eines polytraumatisierten Patienten ist meist das Ausmaß der persistierenden Ausfälle und kognitiven Einschränkungen als Folge der ZNS-Schädigung. In der Akutphase ist, wenn nicht eindeutige Grenzparameter überschritten sind, eine Prognoseeinschätzung oft sehr schwierig, die Verläufe sind auch sehr unterschiedlich. Beim schweren SHT treten die entscheidenden funktionellen Besserungen innerhalb der ersten drei Monate ein, das Endstadium ist erst nach einem Jahr und später zu erwarten. Um die Neuroplastizität maximal auszuschöpfen, ist dabei auch die statusangepasste stufenweise früh einsetzende Rehabilitationsbehandlung wesentlich. the management of severe head injury. Brain Trauma Foundation. Eur J Emerg Med. 1996 Jun; 3(2): 109-27. Kontakt Prof. Dr. Uwe Kehler Dr. Marcus Lücke [2] Gabriel EJ, Ghajar J, Jagoda A, et al. Guidelines for prehospital management of traumatic brain injury. J Neurotrauma. 2002 Jan; 19(1): 111-74. [3] Roberts I, Schierhout G, Wakai A. Mannitol for acute traumatic brain injury. The Cochrane Database of Systematic Reviews 2003, Issue 2. Art. No.: CD001049 [4] Balestreri M, Czosnyka M, Hutchinson P, et al. Impact of intracranial pressure and cerebral perfusion pressure on severe disability and mortality after head injury. Neurocrit Neurochirurgie Neurozentrum und Wirbelsäulenzentrum Asklepios Klinik Altona Paul-Ehrlich-Straße 1 22763 Hamburg Tel. (0 40) 18 18-81 16 71 Fax (0 40) 18 18-81 49 11 E-Mail: [email protected] Care. 2006; 4(1): 8-13. [5] CRASH Trial Collaborators. Effect of intravenous corticosteroids on death within 14 days in 10008 adults with clinically significant head injury (MRC CRASH trial): randomised placebo-controlled trial. Lancet (2004) 364: 1321-28. Guidelines [6] Penrod: Prognosis. In Marion (ed) Traumatic Brain inju- http://www.aans.org/education/clinical%20_guidelines.asp ry. Thieme: 135-40. http://www.uni-duesseldorf.de/AWMF/ll/008-001.htm 825 Medtropole | Ausgabe 22 | Juli 2010 Das erworbene von Willebrand-Syndrom Prof. Dr. Ulrich Budde, Dr. Sonja Schneppenheim, Dr. Hala El Abd-Müller, Dr. Rita Dittmer Das 1926 erstmals durch Erik von Willebrand beschriebene von Willebrand-Syndrom (VWS) ist die häufigste vererbbare Bluterkrankheit, die Männer und Frauen aller Ethnien gleichermaßen betrifft. Das erworbene VWS gilt als sehr viel seltener und wurde daher deutlich später erstmals beschrieben. Es ist davon auszugehen, dass es häufig übersehen wird, vor allem wenn Erfahrungen mit diesen Patienten fehlen. Grundsätzlich können alle Disziplinen mit diesen Patienten in Kontakt kommen und bei vielen wird die Diagnose noch nicht gestellt sein. Daher ist es wichtig, die Aufmerksamkeit auf diese Hämostasestörung zu wecken und diagnostische Wege aufzuzeigen. Vor allem ist es wichtig zu wissen, dass Blutungen nicht nur durch erniedrigte Gerinnungseiweiße ausgelöst werden können, sondern auch bei nicht selten exzessiv erhöhten Faktoren, wenn diese Faktoren dysfunktionell sind. Synthese und Funktion des von Willebrand-Faktors (VWF) Syntheseorte für den VWF sind ausschließlich Endothelzellen und Megakariozyten. Die Synthesewege sind komplex (Abb. 1) und es entstehen Multimere gleicher Zusammensetzung, jedoch, abhängig von der Anzahl der Monomere, unterschiedlicher Größe zwischen 500 – 20000 KD. Die Größe der Multimere wird durch die Metalloprotease (ADAMTS13) reguliert. Der im Blut zirkulierende VWF ist das Produkt aus Synthese, Speicherung, Sekretion und Modifikation im Kreislauf. Der VWF bewirkt gemeinsam mit dem subendothelialen Collagen und Thrombozyten den primären Wundverschluss. 826 Pathomechanismus und häufigste Grundkrankheiten des erworbenen von Willebrand-Syndroms (eVWS) Bei den meisten Patienten mit eVWS wird der VWF in normaler, nicht selten sogar erhöhter Konzentration synthetisiert und ins Plasma sekretiert. Die quantitativen und/oder qualitativen Veränderungen des VWF entstehen erst nach der Synthese durch unterschiedliche Pathomechanismen, die typisch für die jeweiligen Erkrankungen sind, jedoch nicht selten in Kombination auftreten (Tab. 1). Durch (1) pathologisch erhöhten Scherstress wird der VWF aktiviert und bindet vermehrt an seine Rezeptoren. Der gebundene VWF unterliegt anschließend einer Proteolyse durch ADAMTS13, die zu einem Verlust der großen Multimere und gesteigerter Bildung proteolytischer Fragmente führt. Das eVWS bei angeborenen Herzfehlern wurde bereits 1986 beschrieben.[4] Im Erwachsenenalter fallen vor allem Patienten mit Aortenstenosen [10] durch eine hämorrhagische Diathese auf. Die Koinzidenz von Aortenstenose und gastrointestinalen Blutungen ist als Heyde Syndrom (1958) bekannt. Aktuelle Publikationen [9] berichten vor allem bei Herzunterstützungssystemen (sog. künstlichen Herzen) über gravierende, sogar tödliche Blutungskomplikationen (Abb. 2). Ein weiterer Mechanismus für ein eVWS im höheren Alter ist die durch arteriosklerotische Prozesse induzierte zunehmende Einengung des Gefäßlumens im arteriellen Gefäßsystem. Erreicht hierdurch der Scherstress pathologische Werte, kommt es zum Verlust großer Multimere. Bei krankhaft erhöhten Thrombozytenzahlen sind die (2) Rezeptoren auf der Thrombozytenoberfläche expandiert. Die an sich physiologische Adhäsion in Gebieten mit hohem Scherstress entfernt dadurch vermehrt die besonders aktiven großen Multimere aus dem Plasma. Auch hier werden sie nach erfolgter Bindung durch ADAMTS13 proteolysiert, so endgültig aus Hämostaseologie durch Plasmin induzierte verstärkte Proteolyse wurde für die primäre und sekundäre Hyperfibrinolyse, aber auch für die Lysetherapie beschrieben. Eine (5) verminderte Synthese des VWF induziert ein eVWS Typ 1 (Hypothyreose). Bei einer Reihe von mit einem eVWS einhergehenden Erkrankungen wie einem eVWS nach Behandlung mit Valproinsäure, Viruserkrankungen (z. B. chronische Hepatitis C) oder Hepatopathien, Amyloidose, Glykogenspeicherkrankheit Typ 1 und Turner Syndrom ist bisher kein Pathomechanismus bekannt. Abb. 1: Biosynthese des VWF in der Endothelzelle; ER = endoplasmatisches retikulum; WP = Weibel-Palade-Körperchen dem Plasma entfernt und es lassen sich die vermehrten proteolytischen Fragmente nachweisen. Dabei nimmt die proteolytische Spaltung exponentiell mit steigender Thrombozytenzahl zu.[7] Zu den häufigen Komplikationen myeloproliferativer Erkrankungen zählen Thrombose und Blutungen, die nicht selten gleichzeitig auftreten. Während unterhalb einer Thrombozytenzahl von 1.000 x 109/l Thromboembolien führend sind, herrschen bei Zahlen über 2.000 x 109/l Blutungen vor. Zwischen 1.000 und 2.000 x 109/l können beide Komplikationen, nicht selten sogar gleichzeitig, auftreten.[1] Das eVWS bei lymphoproliferativen Erkrankungen geht meist mit einer deutlichen Verminderung des VWF und einem Verlust der großen Multimere einher. Angeschuldigt werden (3) spezifische oder unspezifische Autoantikörper, die zur Immunkomplexbildung und verstärkter Elimination des VWF führen. Allerdings entgehen diese Antikörper meist dem Nachweis. Da in vielen Fällen der VWF stark vermindert ist, wird der F VIII nicht ausreichend stabilisiert mit der Folge einer kombinierten Störung der primären und sekundären Hämostase. Daher haben diese Patienten gravierende Blutungskomplikationen, die sich vor allem in Form großflächiger Hautblutungen oder gastrointestinaler Blutungen darstellen. Bei monoklonaler Gammopathie unklarer Signifikanz (MGUS) oder Myelom vom Typ IgG ist der VWF fast immer dysfunktionell (erworbener Typ 2 [Abb. 3]). Dagegen haben Patienten mit einer monoklonalen Gammopathie vom Typ IgM meist einen erworbenen Typ 1 (Abb. 4). Nicht selten führt eine (4) verstärkte Proteolyse durch ADAMTS13 (spezifisch für den VWF) oder andere Proteasen wie Plasmin oder Calpain (nicht spezifisch) zum Verlust großer Multimere. Die durch ADAMTS13 hervorgerufene verstärkte Proteolyse wurde bereits für kardiovaskuläre und myeloproliferative Erkrankungen beschrieben. Sie tritt jedoch auch bei der terminalen Niereninsuffizienz und bei Behandlung mit Ciprofloxacin auf. Eine Um den Blick für das erworbene VWS zu schärfen, hat die ISTH eine Website eingerichtet, auf der Patienten mit erworbenem VWS diskutiert werden können und die aktualisierte Literatur sowie Adressen von Ärzten mit besonderer Erfahrung auf diesem Gebiet zu finden sind (IntREaVWS.com / intreavws.com). Epidemiologie Das eVWS tritt wesentlich seltener auf als das angeborene VWS, dürfte jedoch auch unterschätzt werden. Die von Thiede et al.[9] beschriebenen 35 Patienten aus einem Zentrum waren wie folgt verteilt: kardiovaskulär 46 Prozent, lymphoproliferativ 31 Prozent, myeloproliferativ 3 Prozent. Die Patienten mit kardiovaskulären Erkrankungen hatten eine extrem hohe Mortalität innerhalb von zwei Jahren (50 %), jedoch war in keinem Fall das eVWS ursächlich. Die Patienten mit den schwersten Blutungssymptomen (lymphoproliferative Erkrankungen) hatten alle überlebt. Bei den übrigen Patienten waren zwölf Prozent verstorben. Die Blutungsfrequenz war mit 19 Prozent pro Jahr hoch, mit 34 Prozent noch höher war die Notwendigkeit für einen operativen Eingriff in den nächsten zwei Jahren. Dies zeigt, dass eine exakte Abklärung eine sehr hohe Priorität hat. 827 Medtropole | Ausgabe 22 | Juli 2010 Spezifische oder unspezifische Autoantikörper, die zur Immunkomplexbildung und verstärkter Elimination des VWF führen ■ Lymphoproliferative Erkrankungen ■ Neoplasien ■ Immunologische Erkrankungen Adsorption des VWF an maligne Zellklone oder andere Zelloberflächen ■ ■ ■ ■ Abb. 2: VWF Multimere bei einem Patienten mit „Kunstherz“ (2) und im normalen Plasma (1). Bei A handelt es sich um ein Gel mittlerer Auflösungsfähigkeit (gute Auftrennung der individuellen Oligomere in Triplets), bei B um ein Gel niedriger Auflösungsfähigkeit (bessere Darstellung des Verlustes großer Multimere). C stellt das Gel niedriger Auflösungsfähigkeit densitometrisch dar. Der Verlust der großen Multimere (Pfeil auf der Grenze zwischen großen und mittelgroßen Multimeren) ist eindeutig erkennbar. Lymphoproliferative Erkrankungen Neoplasien Myeloproliferative Erkrankungen pathologischer Scherstress Verstärkte Proteolyse des VWF spezifisch ■ ■ ■ ■ Myeloproliferative Erkrankungen pathologischer Scherstress Urämie Ciprofloxacin unspezifisch (Plasmin) ■ primäre Hyperfibrinolyse ■ sekundäre Hyperfibrinolyse ■ Lysetherapie Pathologischer Scherstress ■ ■ ■ ■ ■ kongenitale Herzerkrankungen Aortenstenose Herzunterstützungssysteme Endokarditis Gefäßmalformationen (M. Osler, Kasabach-Merritt-Syndrom) ■ schwere Arteriosklerose Verminderte Synthese ■ Unterfunktion der Schilddrüse Unbekannt Abb. 3: Vergleich der VWF Multimere eines Patienten mit MGUS vom Typ IgG (4) und im normalen Mischplasma (3). Bei D handelt es sich um ein Gel mittlerer Auflösungsfähigkeit (gute Auftrennung der individuellen Oligomere in Triplets), bei E um ein Gel niedriger Auflösungsfähigkeit (bessere Darstellung des Verlustes großer Multimere). Eine Triplet-Struktur ist praktisch nicht vorhanden. Es handelt sich also um nicht-prozessierten VWF (zu kurze Verweil- ■ ■ ■ ■ ■ Valproinsäure Viruserkrankungen Hepatopathien Amyloidose Glykogenspeicherkrankheit Typ 1 Viruserkrankungen ■ Turner-Syndrom dauer im Plasma). C stellt das Gel niedriger Auflösungsfähigkeit densitometrisch dar. Der Verlust der großen Multimere (Pfeil auf der Grenze zwischen großen und mittelgroßen Multimeren) ist eindeutig erkennbar. Tab. 1: Pathogenetische Mechanismen bei verschiedenen Erkrankungen[6] Klinische Symptome Leitsymptom des klassischen VWS ist die verlängerte Schleimhautblutung: Blutungen nach Zahnextraktion, Epistaxis, Blutungen aus dem Magen-/Darmtrakt und dem Urogenitalsystem sowie Blutungen nach arteriellen Punktionen und Blutungen nach Einnahme von Aggregationshemmern oder Coumarinen. Diagnostik Zur Bestätigung eines erworbenen von Willebrand-Syndroms müssen zunächst die auch bei dem angeborenen VWS notwendigen Tests eingesetzt werden (Tab. 2 und 3). Der Verdacht auf eine erworbene Form erfordert eine sorgfältige Erhebung der Eigenund Familienanamnese. Bei Verdacht auf ein erworbenes VWS, das durch Antikörper gegen den VWF ausgelöst ist, kommt die Suche nach diesen Antikörpern hinzu.[3] A) Global- und Suchteste Eigen- und Familienanamnese (Blutungszeit) PFA-100 oder vergleichbare Instrumente aPTT Blutbild F VIII-Aktivität B) Spezifische Teste VWF-Antigen (VWF:Ag) Ristocetin cofactor Aktivität (VWF:RCo) Collagen Bindungskapazität (VWF:CB) C) Teste spezialisierter Laboratorien VWF Multimere VWF-Propeptid (VWF:AgII) Antikörper gegen den VWF Tab. 2: Teste zur Diagnostik des eVWS 828 Hämostaseologie Abb. 4: Vergleich der VWF Multimere eines Patienten mit MGUS vom Typ IgG (1) mit Multimeren von normalem Mischplasma (2,5), Multimeren eines Patienten mit angeborenem Typ 2A (3) und Multimeren eines Patienten mit MGUS vom Typ IgM (4). Ohne Kenntnis der Anamnese ist die Unterscheidung zwischen einem angeborenen und erworbenen VWS Typ 2A kaum möglich. In allen drei Patientenproben sind die großen Multimere zwar vorhanden, jedoch in ihrer Konzentration deutlich herabgesetzt. Beim Typ IgM sind alle Multimere vorhanden (erworbener Typ 1). Es fällt jedoch die stark verzerrte Bandenstruktur auf, die für ein IgM-Paraprotein typisch ist. assoziierte Erkrankung n (%) kardiovaskulär 45 (32 %) lymphoproliferativ 26 (19 %) myeloproliferativ 57 (41 %) Sonstige 11 (8 %) VWF: Ag (median) Bereich 167 % 52 – 602 15,5 % 6 – 50 107,5 % 39 – 243 337,5 % 52 – 627 VWF: CB (median) Bereich 137 % 36 – 478 6% < 1 – 18 71% 10 – 204 282 % 32 – 524 Ratio VWF: Ag / VWF: CB (median) Bereich 0,77 0,3 – 1,02 0,40 0,06 – 0,83 0,74 0,26 – 1,0 0,78 0,62 – 0,84 Tab. 3: Laborbefunde bei den von uns im Jahr 2009 diagnostizierten Patienten mit erworbenem VWS Therapie Literatur [1] Budde U, Schäfer G, Müller N, et al. Acquired von Die Behandlung der Grundkrankheit hat in vielen Fällen die besten Erfolgsaussichten. Wie bei dem angeborenen VWS stehen auch hier mit dem Desmopressin und den zugelassenen F VIII/VWF-Konzentraten zwei Hauptprinzipien der Behandlung zur Verfügung. Dabei sind aber die Besonderheiten des eVWS zu beachten. Sowohl FVIII/VWF-Konzentrate als auch Desmospressin wirken initial blutstillend bei myeloproliferativen Erkrankungen. Die Korrektur ist jedoch von deutlich kürzerer Dauer als bei dem angeborenen VWS. Außerdem kann die Normalisierung des VWF thromboembolische Komplikationen zur Folge haben. Gut belegt sind der schlechte Anstieg und die erheblich verkürzte Halbwertzeit nach Infusion von FVIII/VWFKonzentraten und Desmopressin bei Patienten mit lymphoproliferativen Erkrankungen und monoklonaler Gammopathie.[5] Bei Nachweis von monoklonalem IgG ist die Anwendung von HDIgG meist erfolgreich, allerdings nur passager. Beim Typ IgM einer monoklonalen Gammopathie ist HDIgG wirkungslos. Hier bleibt lediglich die symptomatische Behandlung, zum Beispiel mit rekombinantem F VIIa. Willebrand’s disease in the myeloproliferative syndrome. Kontakt Prof. Dr. Ulrich Budde Blood 1984; 64: 981-85. [2] Coppes MJ, Zandvoort SWH, Sparling CR, Poon AO, Weitzman S, Blanchette VS. Acquired von Willebrand dis- Hämostaseologie Medilys Laborgesellschaft mbH Paul-Ehrlich-Straße 1, 22763 Hamburg ease in Wilm’s tumor patients. J Clin Oncol 1992; 10: 422-7. [3] Federici AB, Rand JH, Bucciarelli P, et al. Acquired von Willebrand syndrome: Data from an international registry. Thromb Haemost 2000; 84: 345-9. Tel. (0 40) 18 18-81 59 75 Fax (0 40) 18 18-81 49 48 E-Mail: [email protected] [4] Gill JC, Wilson AD, Endres-Brooks J, Montgomery RR. Loss of the largest von Willebrand factor multimers from plasma of patients with congenital cardiac defects. Blood [9] Thiede A, Priesack J, Werwitzke S, et al. Diagnostic 1986; 67: 758-61. workup of patients with acquired von Willebrand syndro- [5] Michiels JJ, Budde U, van Genderen PJJ, et al. Acquired me: a retrospective single-centre cohort study. J Thromb von Willebrand Syndromes: Clinical features, etiology, Haemost 2008; 6: 569-76. pathophysiology, classification and management. Best [10] Vincentelli A, Susen S, Le Touneau T, et al. Acquired Pract Clin Haematol 2001; 14: 401-36. von Willebrand syndrome in aortic stenosis. N Engl J Med [6] Schneppenheim R, Budde U. von Willebrand-Syndrom 2003; 349: 343-9. und von Willebrand-Faktor. UNI-MED Verlag AG BremenLondon Boston 2. Aufl. 2006. [7] Shim K, Anderson PJ, Tuley EA, Wiswall E, Sadler E. Platelet-VWF complexes are preferred substrates of ADAMTS13 under fluid shear stress. Blood 2008; 111: 651-57. [8] Simone JV, Cornet JA, Abildgaard CF: Acquired von Willebrand’s syndrome in systemic lupus erythematodes. Blood 1968; 31: 806-11. 829 Medtropole | Ausgabe 22 | Juli 2010 Medizinische Versorgung im Zentrum Die MVZ Nord GmbH der Asklepios Kliniken Hamburg Dr. Hans-Martin Stubbe Das Gesetz zur Modernisierung der gesetzlichen Krankenversicherung (GMG) vom 14. November 2003 MVZ NORD erlaubt seit dem 1. Januar 2004 neben Vertragsärzten und Ermächtigten Ärzten auch Medizinischen Versorgungszentren die Teilnahme an der ambulanten Versorgung MVZ Heidberg-Ochsenzoll Pädiatrie, Radiologie, Neurochirurgie, Psychiatrie, Psychologie, Innere Medizin Dr. Theobald Hormann Fr. Wolf PD Dr. Veelken Dipl.-med. Wagner Prof. Dr. Kremer et al. Hr. Jungfer Dipl.-Psych. Ziertmann Dipl.-Psych. Heumann Dr. Nagel gesetzlich Krankenversicherter. Die Asklepios MVZ Nord GmbH wurde am 27. Juni 2007 im Rahmen einer außerordentlichen Sitzung des Zulassungsausschusses der KV Hamburg zugelassen und nahm am 1. September 2007 ihre Tätigkeit auf. Unternehmensziel ist die Komplettierung des medizinischen Angebotes im niedergelassenen Bereich. Hier deckt sich das Ziel des Gesetzgebers, Ärztinnen und Ärzten eine weitere Möglichkeit der niedergelassenen Tätigkeit zu eröffnen, mit unserer Intention. Weder ist beabsichtigt, Arztpraxen in „lukrative“ Stadtteile zu verlegen, noch für Einweisungen in die eigenen Krankenhäuser zu sorgen. Um dies zu dokumentieren, gab die Asklepios MVZ Nord GmbH bereits am 18. Juni 2008 eine freiwillige, öffentliche Selbstverpflichtungserklärung gegenüber der Kassenärztlichen Vereinigung Hamburg ab, die dies ausschließt. Zu keinem Zeitpunkt wurde seither gegen diese Selbstverpflichtung verstoßen. Die Standorte unserer Gesundheitszentren befinden sich durchweg in eher strukturschwachen Gegenden Hamburgs und im Umland. Diese Strategie wird weiter verfolgt. Somit ist für uns der Westen Hamburgs nicht Blankenese sondern Osdorf. Mit der Errichtung der Asklepios MVZ 830 MVZ Mitte Kardiologie, Psychiatrie, Physiotherapie, Chirurgie Dr. Hinrichs Dr. Peschel Hr. Gensch PD Dr. Niemeyer Dr. Flügel MVZ Labor Altona Labormedizin Dr. Otte Dr. Dittmer Dr. El Abd-Müller MVZ Harburg Gynäkologie, Psychiatrie, Orthopädie, Allg. Med., Chirurgie, Kinderchirurgie, Gefäßchirurgie, Psychologie Dr. Unger Dr. Ude Dr. Bosse Dr. Bonitz-Swoboda MVZ Seevetal Dr. Hütter Gynäkologie, Orthopädie Dr. Halsner Dr. Gheorgiu Prof. Dr. Kallinowski Dr. Reichle Dr. Daum Hr. Maack Dr. Richter Hr. Kleinschmidt Dr. Zebidi Dipl.-Psych. Fränzi Martens Dipl.-Psych. Ziegler Dr. Johnsen (AKB) Nord GmbH haben die Asklepios Kliniken Hamburg Vertragsärzten die Möglichkeit gegeben, auch nach Übergabe der Praxis ohne wirtschaftliche Zwänge weiter ärztlich tätig zu sein. Auf diese Weise können sie dem wachsenden Problem, geeignete MVZ Bergedorf Innere Medizin, Orthopädie, Gynäkologie, Psychiatrie MVZ Geesthacht Dr. Sliwiok Allg. Med., Orthopädie Dr. Weidenfeld Dr. Hadaschick Dr. Friedrichs Dr. Logmani Fr. Ballnus Dr. Pietschmann Dr. Godat Dr. Stammer (AKW) Fr. Radzko Fr. Kossin Praxisnachfolger zu finden, aus dem Wege gehen. Vielmehr haben sie nun sogar die Möglichkeit, ihre Erfahrung und ihr Wissen über einen selbst gewählten Zeitraum auf die Nachfolgerin oder den Nachfolger zu übertragen. Wie regelmäßige, wissen- Medizinische Versorgungszentren „In einer gesundheitspolitisch unsicheren Zeit gibt uns der Anschluss an den Asklepios-Konzern mehr finanzielle Sicherheit. Unsere Arbeitsplätze und die unserer Mitarbeiterinnen sind gesichert und es besteht die Möglichkeit, einer Teilzeittätigkeit nachzugehen. Im Umfeld des Konzerns ist die Urlaubsvertretung möglich somit ist die Kontinuität der Patientenbetreuung gesichert. Der interdisziplinäre Austausch wird gefördert und der Kontakt zu den Kliniken wird enger.“ Dr. Edmund Hütter Dr. Peter Halsner MVZ Harburg schaftliche Untersuchungen im Unternehmen zeigen, erwächst aus diesem sanften Übergang auch für unsere Patienten mehr Sicherheit und Zufriedenheit. Die Medizinischen Versorgungszentren können aber auch für jüngere Kollegen eine interessante Option sein: Hier haben sie die Chance, ohne finanzielle Risiken eigenständig ambulant zu arbeiten. Sie nutzen sowohl die Sicherheit eines großen Unternehmens als auch die häufig besseren Arbeitsbedingungen in einer Praxis. Die bisherigen Erfahrungen zeigen, dass auch der Wegfall von Nacht- und Wochenenddiensten durchaus ein Argument bei der Entscheidung für diesen ärztlichen Tätigkeitsbereich ist. Gemäß der Selbstverpflichtung, die im September 2009 noch einmal in Form einer eidesstattlichen Erklärung des Geschäftsführers bekräftigt wurde, gibt es auch keine Anweisungen an die Mitarbeiter, bei Klinikeinweisungen bestimmte Kliniken zu bevorzugen. Eine oft über Jahrzehnte gewachsene oder durch die räumliche Nähe geprägte Zusammenarbeit mit Krankenhäusern anderer Träger wird auch unter dem Dach der Asklepios MVZ Nord GmbH gepflegt und im besten Fall sogar weiter ausgebaut. Denn der aufgeklärte Patient mit seiner Entscheidungssouveränität steht auch hier im Vordergrund. einmal ein anderer Eindruck entstehen, sind wir für Hinweise dankbar und zu jeder Zeit gesprächsbereit. Kontakt Unter diesen Vorgaben hat sich die Asklepios MVZ Nord GmbH sehr positiv entwickelt, derzeit sind hier 61 Ärzte und Psychologen mit Voll- oder Teilzeitverträgen angestellt. Auch künftig wird das Unternehmen innerhalb der selbst gesetzten und der vom Gesetzgeber vorgegebenen Regeln weiter wachsen – ohne die Interessen niedergelassener Ärzte oder anderer Krankenhäuser zu verletzen. Sollte Dr. Hans-Martin Stubbe Geschäftsführer Asklepios MVZ Nord GmbH Lohmühlenstraße 5, Haus W 20099 Hamburg Tel. (0 40) 18 18-85 26 50 Fax (0 40) 18 18-85 26 59 E-Mail: [email protected] 831 ISSN 1863-8341 Geschichte der Medizin Vom guten Eiter bis zum Schnellverband: Die Geschichte der Wundversorgung Jens Oliver Bonnet Die Wundversorgung mit Verbandsmaterialien aus Blättern, Harzen oder Rinden ist vermutlich so alt wie die Menschheit selbst, auch wenn Aufzeichnungen darüber nicht einmal 5.000 Jahre zurück reichen: Papyrusrollen aus dem alten Ägypten beschreiben Verletzungen, die mit in Öl und Honig getränktem feinen Leinen verbunden wurden. Bereits Hippokrates (460 – 375 v. Chr.) unterschied Schnittwunden ohne Verunreinigung von komplizierten Verletzungen mit abgestorbenem Gewebe. Schnittwunden reinigte er mit Wein oder abgekochtem Regenwasser, vernähte sie und ließ sie unter mit starkem Rotwein getränkten Leinenkompressen primär heilen. Verschmutzte oder entzündete Wunden mussten dagegen schnell durch den Vorgang der Eiterung gebracht werden, offen bleiben und sekundär heilen. Nach der Vier-Säfte-Lehre interpretierte Hippokrates die Entzündung als Säftestau, der durch Eiterung aufgelöst werden kann. Obwohl die Ärzte der Antike weder weiße Blutkörperchen noch Bakterien kannten, ahnten sie bereits die Bedeutung der verschiedenen Eiterformen: Weißer Eiter galt als günstig (Pus bonum et laudabile), dünnflüssiger oder stinkender Eiter dagegen als prognostisch ungünstig.[1] In speziellen Fällen riefen die Ärzte gezielt eine Eiterung hervor, wenn die Wunde nicht primär verheilen konnte. Bei Entzündungszeichen in primär heilbaren Wunden trugen sie dagegen entzündungshemmende Mineralstoffe und Kräuter auf. Um die Wundeiterung in zerklüfteten und verschmutzten Wunden zu stimulieren, brachte Hippokrates in Wein abgekochte Schafswolle in die Wunde ein – dabei achtete er auf größtmögliche Reinlichkeit. Aulus Cornelius Celsus (ca. 25 v. Chr. – 50 n. Chr.) erwähnt in seinen Schriften Techniken der Blutstillung und der Kauterisation durch www.medtropole.de Hilfe zur Selbsthilfe: der erste Pflasterschnellverband Ausbrennen der Wunde mit einem heißen Eisen,[1] Claudius Galen (129 – 216 n. Chr.) beschreibt bereits 108 verschiedene Verbände, darunter die bis heute gebräuchlichen Schildkröten- und den Kornährenverbände. Im kirchlich geprägten Mittelalter gab es nur wenige Ärzte in Diensten der Adligen und Reichen, während die medizinische Versorgung der Bevölkerung vor allem durch Bader, Barbiere, Scherer und „weise Frauen“ geleistet wurde.[2] Das im Mittelalter verbreitete Einbringen von Schmutz in primär heilbare Wunden beruhte vermutlich auf einer Fehlinterpretation des Hippokratischen Konzeptes des lobenswerten Eiters. Eine bahnbrechende Entdeckung machte der französische Barbier Ambroise Paré (1510 – 1590), der als Militärchirurg die bis dahin mit kochendem Holunderöl kauterisierten Schusswunden mit einem Digestivum aus Eigelb, Rosenöl und Terpentin bestrich, weil ihm während eines Gefechts das Öl ausging: Den so Behandelten erging es erheblich besser als ihren kauterisierten Kameraden.[3] 1865 entdeckte Louis Pasteur, dass Gärung und Fäulnis durch mikroskopisch kleine Lebewesen verursacht werden. Joseph Lister erkannte, dass diese Keime für Wundinfektionen verantwortlich waren und führte 1867 den mit Karbolsäure getränkten Wundverband ein, der die Todesraten in den Kliniken deutlich senkte.[4] Einen weiteren Meilenstein legte der Tübinger Chirurg Viktor von Bruns 1870 mit der Erfindung der hydrophilen Verbandwatte, indem er Baumwolle bleichte und entfettete. 1874 beschrieb Lister ein Verfahren zur Herstellung eines keimabtötenden Wundverbands, der Listerschen Carbolgaze. 1922 brachte die Hamburger Firma Beiersdorf mit dem Hansaplast Schnellverband mit Mullkissen den ersten Pflasterverband auf den Markt, der eine eigenständige Versorgung kleiner Verletzungen durch den Patienten ermöglichte. Bis dahin erforderten selbst Bagatellverletzung professionelle Hilfe. 1962 legte Georg Winter den Grundstein für die moderne feuchte Wundbehandlung sekundär heilender Wunden.[5] Literatur [1] Majno G. The Healing Hand – Man and Wound in the Ancient World, Harvard University Press, Cambridge 1975. [2] Ackerknecht EH. Geschichte der Medizin, 5. Auflage, Stuttgart 1986: 75. [3] Forrest, R. D.: Development of wound therapy from the dark ages to the present, Journal of the Royal Society of Medicine 1982, Bd. 75: 268-73. [4] Lister J. On a new method of treating compound fracture, abscess, etc., The Lancet. 1867; 45: 326-29. [5] Winter GD. Formation of the scab and the rate of epithelization of superficial wounds in the skin of the young domestic pig. Nature. 1962; 193: 293-4. BUCHTIPP W. Sellmer, A. Bültemann, W. Tigges Wundfibel: Wunden versorgen, behandeln, heilen 193 S.; MWV 2010; € 24,95 ISBN: 978-3-941468-14-6