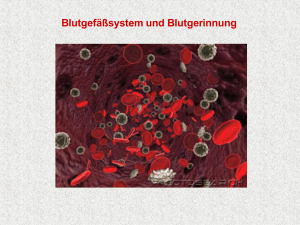
Dissertation endgültig - FreiDok plus - Albert-Ludwigs
Werbung

Aus der Medizinischen Universitätsklinik der Albert-Ludwigs-Universität Freiburg im Breisgau R ETROSPEKTIVE A NALYSE DER M ACHBARKEIT UND E FFIZIENZ VON G RANULOZYTENTRANSFUSIONEN BEI P ATIENTEN MIT SCHWEREN I NFEKTIONEN IN DER N EUTROPENIE I NAUGURAL – D ISSERTATION zur Erlangung des Medizinischen Doktorgrades der Medizinischen Fakultät der Albert-Ludwigs-Universität Freiburg im Breisgau Vorgelegt 2006 von Matthias Eckenweiler geboren in Hechingen DEKAN PROF. DR. C. PETERS 1. GUTACHTER PROF. DR. H. BERTZ 2. GUTACHTER PD DR. M. DETTENKOFER JAHR DER PROMOTION 2007 I N E RINNERUNG AN MEINEN V ATER 1 Inhaltsverzeichnis I NHALTSVERZEICHNIS 1 EINLEITUNG.............................................................................................................................................. 4 1.1 EINFÜHRUNG ........................................................................................................................................ 4 1.2 PHYSIOLOGIE UND FUNKTION DER GRANULOZYTEN ............................................................................ 4 1.3 NEUTROPENIE ..................................................................................................................................... 10 1.4 INFEKTIONEN IN DER NEUTROPENIE ................................................................................................... 11 1.4.1 Risiko und Einteilung .................................................................................................................... 11 1.4.2 Häufigste Erreger und Krankheitsbilder....................................................................................... 13 1.4.3 Therapie ........................................................................................................................................ 15 1.5 G-CSF ................................................................................................................................................ 18 1.6 GRANULOZYTENTRANSFUSIONEN ....................................................................................................... 20 1.6.1 Historischer Hintergrund .............................................................................................................. 20 1.6.2 Indikationen................................................................................................................................... 28 1.6.3 Gewinnung und Transfusion der Granulozytenkonzentrate .......................................................... 29 1.6.4 Nebenwirkungen............................................................................................................................ 31 1.7 2 ZIEL DER ARBEIT ................................................................................................................................ 33 PATIENTEN, SPENDER UND METHODEN ....................................................................................... 34 2.1 PATIENTEN ......................................................................................................................................... 34 2.2 SPENDER ............................................................................................................................................. 37 2.3 METHODEN ......................................................................................................................................... 38 2.3.1 Standardtherapie und Indikation zur Granulozytentransfusion .................................................... 38 2.3.2 Leukapherese................................................................................................................................. 38 2.3.3 Transfusion.................................................................................................................................... 39 2.3.4 Definitionen................................................................................................................................... 39 2.3.5 Datenerfassung und Statistik......................................................................................................... 41 Inhaltsverzeichnis 3 2 ERGEBNISSE............................................................................................................................................ 43 3.1 SPENDER UND LEUKAPHERESE ........................................................................................................... 43 3.1.1 Leukapheresen pro Spender und Blutbildveränderungen ............................................................. 43 3.1.2 Bestandteile des Leukapheresats................................................................................................... 45 3.1.3 Verhältnis zwischen Spender-Leukozytenzahl und Ertrag ............................................................ 46 3.2 PATIENTEN UND GRANULOZYTENTRANSFUSIONEN ............................................................................ 47 3.2.1 Indikationen................................................................................................................................... 47 3.2.2 Leukozytenanstieg nach Granulozytentransfusion ........................................................................ 49 3.2.3 Nebenwirkungen............................................................................................................................ 50 3.2.4 Überleben...................................................................................................................................... 51 3.3 GRANULOZYTENTRANSFUSIONEN BEI BAKTERIELLER PNEUMONIE ODER PNEUMONIE OHNE ERREGERNACHWEIS ............................................................................................................................ 52 3.3.1 Patientencharakteristika und klinischer Verlauf........................................................................... 52 3.3.2 CRP-Verlauf nach Transfusion ..................................................................................................... 54 3.3.3 Überleben nach Transfusion ......................................................................................................... 56 3.4 GRANULOZYTENTRANSFUSIONEN BEI BAKTERIELLER SEPSIS ............................................................. 57 3.4.1 Patientencharakteristika und klinischer Verlauf........................................................................... 57 3.4.2 CRP-Verlauf nach Transfusion ..................................................................................................... 59 3.4.3 Überleben nach Transfusion ......................................................................................................... 61 3.5 GRANULOZYTENTRANSFUSIONEN BEI PILZINFEKTIONEN .................................................................... 62 3.5.1 Patientencharakteristika und klinischer Verlauf........................................................................... 62 3.5.2 CRP-Verlauf nach Transfusion ..................................................................................................... 65 3.5.3 Überleben nach Transfusion ......................................................................................................... 67 3.6 MÖGLICHE EINFLUSSVARIABLEN AUF DEN TRANSFUSIONSERFOLG .................................................... 68 3.6.1 Infektion......................................................................................................................................... 68 3.6.2 Vorbestehende Neutropeniedauer ................................................................................................. 69 3.6.3 Transfundierte Granulozytenzahl.................................................................................................. 70 3.6.4 Hämatopoetische Regeneration .................................................................................................... 71 Inhaltsverzeichnis 4 3 DISKUSSION ............................................................................................................................................ 72 4.1 ERGEBNISSE DER LEUKAPHERESE ....................................................................................................... 72 4.2 NEBENWIRKUNGEN BEI SPENDERN UND PATIENTEN ........................................................................... 72 4.3 ANSPRECHEN, KLINISCHER VERLAUF UND ÜBERLEBEN NACH GRANULOZYTENTRANSFUSIONEN ...... 74 4.4 ZUKUNFTSPERSPEKTIVEN ................................................................................................................... 79 5 ZUSAMMENFASSUNG........................................................................................................................... 80 6 VERZEICHNISSE .................................................................................................................................... 81 7 6.1 ABKÜRZUNGSVERZEICHNIS ................................................................................................................ 81 6.2 ABBILDUNGSVERZEICHNIS.................................................................................................................. 84 6.3 TABELLENVERZEICHNIS ...................................................................................................................... 85 6.4 LITERATURVERZEICHNIS .................................................................................................................... 86 ANHANG ................................................................................................................................................. 105 7.1 LEBENSLAUF..................................................................................................................................... 105 7.2 DANKSAGUNG .................................................................................................................................. 107 1 Einleitung 4 1 Einleitung 1.1 Einführung In den vergangenen Jahren sind durch die Entwicklung von hochwirksamen Zytostatika deutliche Fortschritte in der Behandlung maligner Erkrankungen erzielt worden. Die Anwendung dieser Substanzen in intensivierten Chemotherapieprotokollen, oft in Kombination mit Knochenmarktransplantation, führt jedoch häufig zu einer drastischen und lebensbedrohlichen Zytopenie und Immunsuppression der Patienten, die meist über mehrere Wochen besteht. In diesen Phasen der reduzierten Infektabwehr bleiben trotz verbesserter prophylaktischer Maßnahmen und neuen hocheffektiven Antibiotika bzw. Antimykotika auch heute noch nicht beherrschbare Infektionen eine der Haupttodesursachen von Patienten mit malignen Erkrankungen. Das Risiko an diesen lebensbedrohlichen Infektionen zu erkranken stellt somit leider oft ein limitierender Faktor für potentiell kurative Chemotherapien dar. Daraus ergibt sich der Bedarf an alternativer bzw. ergänzender effektiver Therapie von Infektionen während der Immunsuppression und der damit verbundenen Zytopenie. Eine dieser Möglichkeiten sind Granulozytentransfusionen. Während Transfusionen von Erythrozyten bei Patienten mit schwerer Anämie sowie die Substitution von Thrombozyten bei thrombozytopenischen Patienten mit hohem Risiko für akute Blutungen gängige Methoden der Transfusionsmedizin darstellen, gilt der Ersatz von Granulozyten bei Infektionen in der Zytopenie auch heute noch als neuartige und noch nicht ausreichend erforschte Möglichkeit supportiver Therapie. 1.2 Physiologie und Funktion der Granulozyten Die Granulozyten gehören zusammen mit den Monozyten und den Lymphozyten zu den weißen Blutkörperchen, den so genannten Leukozyten (WBC; white blood cells). Diese Zellen bilden gemeinsam die Grundlage des menschlichen Immunsystems. Dabei sind die Granulozyten ein wesentlicher Träger der unspezifischen Abwehr von Infektionen und unterscheiden sich sowohl morphologisch als auch funktionell von den anderen Leukozyten. Bei den Granulozyten werden neutrophile, eosinophile und basophile Zellen unterschieden, die einer unterschiedlichen Verteilung im Blut folgen. Die Zahl der Leukozyten im Blut von gesunden Erwachsenen beträgt etwa 4.500 – 10.000 Zellen pro Mikroliter. Dabei entfallen 1 Einleitung 5 1.800 – 7.500 (50 – 65 %) auf die neutrophilen, 40 – 450 (2 – 4 %) auf die eosinophilen und 10 – 200 (0,5 -1 %) auf die basophilen Granulozyten1 2 [135; 159; 170]. Die neutrophilen Granulozyten sind somit die am häufigsten im peripheren Blut gesunder Menschen vorkommenden Leukozyten. Diese Werte können bei Kindern je nach Alter deutlich differieren, da z.B. bei Säuglingen Leukozytenzahlen bis 25.000 / µl durchaus noch im Normbereich liegen [74]. Eosinophile und basophile Granulozyten spielen hauptsächlich bei allergischen Reaktionen eine Rolle. Im Hinblick auf die unspezifische Abwehr von Bakterien und Pilzen sind sie jedoch nur von untergeordneter Bedeutung und sollen daher im Rahmen dieser Arbeit nicht näher beschrieben werden. Die Granulozyten und Monozyten des Blutes werden im Knochenmark aus einer gemeinsamen multipotenten myeloischen Stammzelle gebildet. Unter dem Einfluss von verschiedenen Wachstumsfaktoren und Zytokinen (z.B. SCF, G-CSF, GM-CSF, IL-3) werden so bei einem gesunden Erwachsenen mit 70 kg Körpergewicht pro Tag ca. 1011 neutrophile Granulozyten produziert [17]. Dabei durchlaufen die Zellen unterschiedliche Reifungsstadien vom Myeloblasten, der die erste morphologisch charakterisierbare Vorstufe des neutrophilen Granulozyten darstellt, bis hin zum reifen segmentkernigen Granulozyten des peripheren Blutes, der bei Bedarf ins Gewebe wandern kann (s. Abb. 1.1). Die für die verschiedenen Granulozytenreihen charakteristischen neutrophilen, eosinophilen und basophilen Granula treten erstmals im Stadium der Promyelozyten bzw. Myelozyten auf. Die normale Zeit vom Myelozytenstadium bis zur Freisetzung von reifen neutrophilen Granulozyten ins Blut liegt normalerweise zwischen fünf und sieben Tagen und kann bei Infektionen auf zwei Tage verkürzt werden. Bei erhöhtem Bedarf kann auch die Granulozytenproduktion deutlich erhöht werden und man findet häufig unreife Formen der Zellen im peripheren Blut [51; 124]. Den zuletzt genannten Vorgang nennt man auch Linksverschiebung. Unter physiologischen Bedingungen werden die reifen Granulozyten jedoch nur zum Teil in das Blutgefäßsystem abgegeben, während ein weitaus größerer Teil (10 - 15fach) im Knochenmark als Reservepool verbleibt. Diese Knochenmarkreserve kann dann zu jeder Zeit abgerufen werden [74]. Die in den Blutstrom abgegebenen Zellen wandern normalerweise nicht mehr ins Knochenmark zurück, sondern verweilen mit einer Halbwertszeit von nur 6 - 8 Stunden in den Blutgefäßen. Dabei verteilen sie sich etwa zu gleichen Teilen (jeweils ca. 2 x 1010) auf einen rand- 1 2 Diese Referenzbereiche können je nach Autor etwas differieren. In einer neueren Schreibweise werden die Werte pro Liter Blut angegeben, z.B. 4,5 – 10 x 109 / l. 6 1 Einleitung ständigen (marginalen) Pool, der durch die Anhaftung der Granulozyten an die Endothelzellen der Gefäße, insbesondere der Lungen- und Milzgefäße entsteht und einen zirkulierenden Pool. Nur die frei im Blut zirkulierenden Granulozyten, also ca. 20 % der täglich produzierten Menge, werden im Blutbild erfasst und stehen prinzipiell einer Sammlung für Granulozytenkonzentrate zur Verfügung. Allerdings befinden sich die zwei Pools in einem dynamischen Gleichgewicht und körperliche Bewegung, Aufregung oder Stress bewirken eine Verschiebung der Granulozyten vom randständigen in den zirkulierenden Pool. Außerdem lässt sich eine vermehrte Freisetzung von Granulozyten aus der Knochenmarkreserve in den zirkulierenden Pool durch eine Reihe verschiedener Pharmaka (z.B. Adrenalin, Glukokortikoide) auslösen [10; 42; 175]. Schließlich verlassen die Granulozyten die Blutbahn und wandern ins Gewebe ein um dort ihre Funktionen im Rahmen der unspezifischen Immunabwehr zu erfüllen. Dieser normalerweise irreversible Vorgang endet mit dem Absterben der Granulozyten nach ungefähr 1 - 5 Tagen [51; 74]. Myeloblast Promyelozyt Myelozyt Metamyelozyt Stabkerniger Neutrophiler Knochenmark Segmentkerniger Neutrophiler Blut Segmentkerniger Neutrophiler Gewebe Abb. 1.1 Entwicklung der neutrophilen Granulozyten Reife neutrophile Granulozyten haben einen Durchmesser von 12 – 15 µm und weisen einen charakteristischen, dichten Zellkern auf, der in zwei bis fünf Segmente (am häufigsten drei) geteilt ist. Sie werden daher auch segmentkernige oder polymorphkernige neutrophile Granulozyten (PMNL, polymorphonuclear leukocytes) genannt. Im Gegensatz dazu werden ihre direkten Vorläuferzellen Stabkernige genannt, da diese Zellen noch nicht die klaren, fadenförmigen Abschnürungen zwischen den Kernsegmenten besitzen. Das Chromatin dieser Zel- 1 Einleitung 7 len ist noch grob geklumpt und schlank (gurkenförmig) [124]. Daneben haben die reifen Zellen ein blasses, unregelmäßig konturiertes Zytoplasma mit zahlreichen feinen Granula. Man unterscheidet azurophile (blauviolett sich anfärbende) Primärgranula, die bereits im Promyelozytenstadium erscheinen, von den sekundären (spezifischen) Granula die im reifen Neutrophilen überwiegen, jedoch erst im Myelozytenstadium sichtbar werden. Während erstere u.a. unspezifische Kollagenase, Elastase, Myeloperoxidase, saure Phosphatase, Cathepsin G sowie kationische antibakterielle Proteine enthalten, findet man in den sekundären Granula Enzyme wie die alkalische Leukozytenphosphatase, Aminopeptidase, spezifische Kollagenase, Laktoferrin und Lysozym. Beide Arten von Granula enthalten somit Enzyme lysosomalen Ursprungs, die den Granulozyten die Ausübung ihrer physiologischen Funktionen (Phagozytose, Zytolyse) ermöglichen [51; 74; 109]. Auf der Oberfläche der Granulozyten finden sich neben den humanen Leukozytenantigenen (HLA) der Klasse Ι und anderen myeloischen Differenzierungsantigenen verschiedene membranständige Rezeptoren und Adhäsionsmoleküle, darunter Rezeptoren für Komplementfaktoren, für den Fc-Teil von Immunglobulinen und für unterschiedliche Zytokine (Entzündungsmediatoren). Insbesondere scheint den Bindungsstellen für so genannte Chemokine, einer Unterfamilie der Zytokine, die eine starke chemotaktische Aktivität als Antwort auf Entzündungssignale haben, eine besonders wichtige Rolle für die physiologischen Funktionen der Granulozyten zuzukommen [117]. Die Hauptfunktion der neutrophilen Granulozyten besteht in der Phagozytose und der Elimination von Mikroorganismen. Um diese wirkungsvoll beseitigen zu können, müssen die Neutrophilen an den Ort der Infektion gelangen, um dort die Erreger an die Zelloberfläche binden und anschließend inkorporieren zu können. Dieser komplexe Vorgang ist in Abbildung 1.2 schematisch dargestellt. Mit Hilfe von verschiedenen Zytokinen, die im Bereich der Entzündung z.B. durch geschädigte Fibroblasten oder ortständige Gewebemakrophagen produziert werden, exprimieren die Endothelzellen der Blutgefäße Adhäsionsmoleküle, an welche die vorbeiströmenden Granulozyten binden. Dieser Adhäsionsvorgang wird durch die lokale Blutströmungsverlangsamung aufgrund einer Gefäßdilatation im Bereich von Entzündungen erleichtert. Nach der festen Bindung an die Endothelzellen treten die Granulozyten durch die normalerweise virtuelle Lücke zwischen zwei Endothelzellen hindurch (Diapedese) und gelangen so ins Gewebe. Die Wanderungsrichtung (gezielte Migration) wird durch einen chemotaktischen Gradienten bestimmt, d.h. Bakterien, Makrophagen, Endothelzellen aber auch aktivierte Granulozyten produzieren Substanzen (Chemokine), die sowohl Granulozyten als auch Monozyten anlocken und so zum Entzündungsherd führen (Chemotaxis). Die amöboide Fortbewegung der Zellen 8 1 Einleitung wird unter Ausbildung von so genannten Pseudopodien erreicht. Am Ort der Entzündung angekommen nehmen die Granulozyten die Fremdkörper auf, indem die Zellmembran das Partikel umfließt und durch Fusion ihrer distalen Enden ein Vesikel (Phagosom oder Endosom) innerhalb der Zelle bildet. Dieser Vorgang der Phagozytose wird durch die Anheftung von Immunglobulinen oder Komplementfaktoren an die Oberfläche der Fremdkörper erleichtert (Opsonierung) [75; 124]. Die so inkorporierten Fremdkörper, z.B. Bakterien können nun sowohl durch sauerstoffabhängige als auch durch nichtoxidative Reaktionen abgetötet werden. Endothelzellen Neutrophiler Granulozyt Blut Adhäsionsmoleküle Diapedese Gewebe Chemotaxis Phagozytose Opsonierte Fremdkörper Abtötung & Verdauung Abb. 1.2 Funktion der neutrophilen Granulozyten Im Rahmen der Aktivierung des oxidativen Abtötungssystems, ausgelöst durch hohe Konzentrationen an chemotaktischen Stimuli und diverse Rezeptor-Ligand-Interaktionen (u.a. die Bindung von Erregern über den Fc-Rezeptor), kommt es zu einer abrupten Steigerung des oxidativen Stoffwechsels. Dieser Vorgang wird als respiratory burst bezeichnet. Dabei werden aus O2, NADPH und intrazellulären Halogeniden eine Vielzahl an mikrobiziden Verbindungen, wie Superoxid (O2-), Wasserstoffperoxid (H2O2), Hydroxyradikal (OH) und hypohalogenisierten Säuren (HOCL) gebildet und freigesetzt. Die wichtigsten dabei beteiligten Enzyme sind die Myeloperoxidase und die NADPH-Oxidase. Zwar haben die gebildeten Sub- 1 Einleitung 9 stanzen eine teils direkt abtötende Wirkung, doch besitzen viele Bakterien wiederum, wie auch der menschliche Organismus selbst, Mechanismen, die vor diesen Radikalen schützen, wie z.B. der Abbau von O2- und H2O2 zu O2, H2 und H2O durch die Superoxiddismutase und die Katalase [74; 124]. Bei den nichtoxidativen Mechanismen der Granulozyten zur Bakterienabtötung kommt es zur Fusion der aufgenommenen Fremdkörper mit den präformierten enzymhaltigen primären und spezifischen (sekundären) Granula des Zytoplasmas. Während die lysosomalen Enzyme (u.a. saure Phosphatase und Lysozym) bereits bei niedrigem pH zytotoxisch wirksam sind, entfalten die kationischen Proteine der primären Granula erst bei alkalischem pH ihre volle mikrobizide Aktivität. Auch das bereits oben erwähnte Laktoferrin, ein Eisen bindendes Molekül, welches in den spezifischen Granula der neutrophilen Granulozyten gespeichert wird, hat eine bakteriostatische Wirkung, indem es den Bakterien Eisen entzieht und damit ihr weiteres Wachstum verhindert. Im Gegensatz zu den Enzymen und Proteinen der primären Granula, die überwiegend intrazellulär wirken und nur freigesetzt werden, wenn die Granulozyten mit phagozytierbaren Partikeln zusammentreffen, kann die Freisetzung der Inhaltsstoffe von spezifischen Granula auch durch lösliche Stimuli induziert werden. Diese können außerdem auch nach außen in den Extrazellularraum abgegeben werden (Degranulation), was allerdings schädigend auf das umliegende Gewebe wirken kann. Die Freisetzung von Granulainhalt und von Sauerstoffradikalen ist wesentlich mitbeteiligt am Gewebeschaden bei Asthma bronchiale, zystischer Fibrose, entzündlichen Darmerkrankungen und ischämischer Reperfusion [51; 75; 124]. Wie bereits oben erwähnt, sterben die Granulozyten letztlich im Rahmen einer Infektion und der damit verbundenen physiologischen Abwehrfunktion der Zellen bereits wenige Tage nach dem Übertritt ins Gewebe ab. Über den Vorgang der Apoptose (programmierter Zelltod) von Granulozyten und das Entfernen der abgestorbenen Zellen durch Makrophagen ist jedoch erst wenig bekannt. 1 Einleitung 10 1.3 Neutropenie Unter einer Neutropenie, oder auch Granulozytopenie genannt, versteht man einen Abfall der absoluten Neutrophilenzahl (ANC; absolute neutrophil count) unter 1.500 Zellen pro Mikroliter bei einem größeren Kind oder einem Erwachsenen.3 Die Neutropenien können nach unterschiedlichen Gesichtspunkten eingeteilt werden. Eine der Möglichkeiten besteht darin, die Neutropenien unter pathogenetischen Gesichtspunkten zu betrachten. Dabei unterscheidet man u.a. Neutropenien aufgrund von Stammzelldefekten (z.B. die relativ seltene angeborene oder erworbene zyklische Neutropenie) oder Reifungsstörungen der determinierten Stammzellen (chronische benigne Neutropenie), bzw. Störungen der Stammzellproliferation (z.B. aplastische Anämie), Neutropenien bei Stoffwechselerkrankungen (Hyperglyzinämie, Glykogenose Ιb, etc.), Neutropenien bei phänotypischen Anomalien (z.B. Shwachman-Diamond-Syndrom) und die schwere kongenitale Neutropenie (Kostmann-Syndrom). Daneben gibt es noch die große Gruppe der erworbenen Neutropenien, die u.a. bei Splenomegalie (z.B. im Rahmen eines Felty-Syndroms), bei ineffektiver Granulopoese (Vitamin-B12- oder Folsäuremangel) oder auch bei Infektionen (Hepatitis A und B, Masern, Röteln, Salmonellose, Tuberkulose, etc.) auftreten können. Nicht zu vergessen sind Neutropenien, die durch eine Vielzahl unterschiedlicher Medikamente induziert werden können, wie z.B. durch Sulfonamide und Penizilline, Thyreostatika, Phenothiazine, Antirheumatika und Antipyretika, um nur einige der häufigen Auslöser zu nennen. Aufgrund der leider durchschnittlich zunehmenden Inzidenz der malignen Erkrankungen, werden auch immer häufiger schwere Formen der Granulozytopenie v.a. im Rahmen der intensiven Chemotherapie von hämatologischen Neoplasien (z.B. akute Leukämie), der Strahlentherapie und auch der autologen oder allogenen Stammzelltransplantation gesehen. Eine andere Möglichkeit ist die klinische Einteilung, mit Hilfe derer versucht wird, das Risiko v.a. für bakterielle und mykotische Infektionen abzuschätzen. Man unterscheidet hierbei eine milde (ANC = 1.000 – 1.5000 / µl) von einer mäßigen (ANC = 500 – 1.000 / µl) und einer schweren (ANC < 500 / µl) Neutropenie [123]. Die klinische Bedeutung liegt in der daraus resultierenden hochgradigen Abwehrschwäche, die sehr häufig zu schwersten Infektionen der Haut, der Schleimhäute oder der inneren Organe führen kann, v.a. bei ausgeprägten Neutropenien mit Werten unter 200 Granulozyten / µl. Allerdings ist zu beachten, dass es auch Patienten mit über Jahre bestehenden, ausgeprägten Neutropenien gibt, die nicht an ernsten Infektionen leiden [74; 123]. 3 Gesunde Menschen schwarzer Hautfarbe oder aus dem Mittleren Osten können infolge eines höheren Anteils randständiger Neutrophiler um bis zu 200 Zellen / µl niedrigere Werte haben. 1 Einleitung 11 1.4 Infektionen in der Neutropenie 1.4.1 Risiko und Einteilung Immunsupprimierte Patienten haben im Vergleich zu Immungesunden neben einer erhöhten Morbidität und Mortalität für Infektionen mit obligat pathogenen Erregern, ein spezifisch erhöhtes Risiko für reaktivierte Infektionen bei latenten Erregern (z.B. CMV, HSV) und für opportunistische Infektionen, welche bei intaktem Immunsystem nicht zu einer klinischen Erkrankung führen. Über 80 % der Infektionserreger stammen von der körpereigenen endogenen mikrobiellen Flora ab, und bis zu 50 % sind dabei nosokomial, d.h. im Krankenhaus erworben [101]. Die erhöhte Infektanfälligkeit ist unterschiedlich stark ausgeprägt und hängt von zusätzlich betroffenen Abwehrsystemen des Körpers ab. Zum Beispiel erleichtern durch Chemo- und/oder Strahlentherapie induzierte Schädigungen im Mund und Magen-DarmTrakt wesentlich den Eintritt von Erregern. Daneben erhöhen Granulozytenfunktionsstörungen, die im Rahmen der Grundkrankheit, z.B. bei der akuten myeloischen Leukämie (AML), oder als Folge einer Steroidtherapie auftreten können, sowie ein Mangel an Lymphozyten oder Antikörpern die Infektionswahrscheinlichkeit deutlich [1; 101]. Hauptrisikofaktor für das Auftreten von schweren Infektionen ist jedoch die Neutropenie, mit einer signifikanten Zunahme bei Werten unterhalb von 1.000 neutrophilen Granulozyten pro Mikroliter Blut [16]. Bei einem Abfall unter 500 / µl bzw. 100 / µl ist das Risiko einer tödlichen Infektion drastisch erhöht. Steigen die Leukozyten während der antimikrobiellen Behandlung nicht über 500 / µl an, so erhöht auch dies signifikant das Risiko des tödlichen Infektionsverlaufes [104]. Nach der zu erwartenden Gesamtdauer der Neutropenie werden die Patienten unterschiedlichen Risikogruppen zugeordnet (s. Tab. 1.1). Hochrisikopatienten, also Patienten mit einer länger als zehn Tagen anhaltenden schweren Granulozytopenie (< 100 / µl) erleiden in 80 % der Fälle infektiöse Komplikationen [102]. An dieser Einteilung orientieren sich die verschiedenen Therapieschemata für aufgetretene Infektionen und deren Verlauf. Zusätzlich müssen jedoch eine Vielzahl an weiteren Risikofaktoren berücksichtigt werden. Dazu gehören u.a. Alter > 60 Jahre, maligne Systemerkrankung, Intensität und Toxizität der Therapie für Knochenmark und Schleimhäute, Zustand nach allogener Knochenmark- bzw. Stammzelltransplantation und zusätzliche Immunsuppression. Daneben spielen chronische Lungen- und Darmerkrankungen, sonstige schwere Begleiterkrankungen, vorbestehende chronische Infektionen oder Kolonisation mit bekannten problematischen Erregern (z.B. Pseudomonas aeruginosa, multiresistente Staphylokokken, Sprosspilze) und iatrogene bzw. nosokomiale Schädigungen von Haut und Schleimhaut (Operationen, zentrale Venenkatheter, parenterale Ernäh- 12 1 Einleitung rung, etc.) eine wichtige Rolle. Bei bestehenden Zweifeln an der Risikoeinschätzung sollten die Patienten nach dem Hochrisikotherapieprotokoll behandelt werden [1]. Tabelle 1.1 Risikozuordnung für den Verlauf der Infektion nach der zu erwartenden Ge- samtdauer der Neutropenie (nach [1]) Zu erwartende Neutropeniedauer Risikogruppe ≤ 5 Tage Niedrigrisikopatient 6-9 Tage Standardrisikopatient ≥ 10 Tage Hochrisikopatient Die Infektionen in der Neutropenie lassen sich nach den Empfehlungen der Arbeitsgemeinschaft Infektiologie in der Hämatologie und Onkologie der Deutschen Gesellschaft für Hämatologie und Onkologie und anderen Fachgremien [18; 56; 82; 87; 102; 104; 125] in folgende drei Gruppen einteilen: 1. Unerklärtes Fieber 2. klinisch gesicherte Infektion 3. mikrobiologisch gesicherte Infektion mit oder ohne Bakteriämie Als unerklärtes Fieber oder Fieber unbekannter Genese (FUO; fever of unknown origin) wird neu aufgetretenes Fieber ohne richtungweisende klinische oder mikrobiologische Infektionsbefunde gewertet. Dabei wird Fieber als eine einmalige orale Temperaturmessung von ≥ 38,3°C und Werte ≥ 38,0° C für mindestens eine Stunde anhaltend oder zweimal innerhalb von 24 Stunden definiert. Als klinisch gesicherte Infektion (CDI; clinically documented infection) gilt Fieber in Verbindung mit einem diagnostisch eindeutigen lokalisierten Befund, beispielsweise einer Pneumonie oder einer Haut-Bindegewebe-Infektion, dessen mikrobiologische Pathogenese jedoch nicht bewiesen werden kann oder der einer Untersuchung nicht zugänglich ist. Eine mikrobiologisch gesicherte Infektion (MDI; microbiologically documented infection) liegt vor, wenn neben einem lokalisierbaren Infektionsbefund ein zeitlich und mikrobiologisch plausibler Erregernachweis gelingt oder wenn Infektionserreger in der Blutkultur auch ohne lokalisierten Infektionsherd nachweisbar sind. Für koagulasenegative Staphylokokken und Corynebacterium Species ist ein mindestens zweimaliger Nachweis aus separat entnom- 1 Einleitung 13 menen Blutkulturen erforderlich, während ein einmaliger Nachweis als Kontamination gewertet wird. Bei Lungeninfiltraten wird der Erregernachweis in der Blutkultur oder der bronchoalveolären Lavage als zuverlässig angesehen, während Befunde aus Rachenabstrichen, Sputum, Speichel oder Mundspülflüssigkeit nur im Falle des Nachweises obligat pathogener Erreger im unmittelbaren zeitlichen Zusammenhang mit dem Auftreten von Lungeninfiltraten als klinisch relevant gewertet werden. Bei abdominellen Infektionssymptomen wird der Nachweis von Clostridium difficile mit gleichzeitigen Toxinnachweis aus der Stuhlprobe als Erregersicherung akzeptiert, während andere potenziell pathogene Erreger in mindestens zwei konsekutiven Stuhlproben nachweisbar sein müssen. Bei katheterassoziierten Infektionen ist die positive Blutkultur in Verbindung mit dem Nachweis des gleichen Infektionserregers aus dem entfernten Kathetermaterial oder mit einem Abstrich von einer entzündeten Einstichstelle erforderlich. Der alleinige Nachweis einer Besiedlung des Katheters wird als Kontamination gewertet. Kommt es zur Entzündung des subkutanen Anteils von getunnelten zentralvenösen Kathetern, spricht man von einer Tunnelinfektion. Von einer so genannten Tascheninfektion spricht man dann, wenn sich die subkutane Tasche bei implantierten Portsystemen infiziert. Bei Beteiligung der Katheteraustrittsstelle wird eine Ausdehnung der Infektion von mindestens 2 cm in den Tunnel als notwendige Bedingung angesehen. Bei Harnwegsinfektionen wird ein pathologisches Isolat in signifikanter Keimzahl gefordert, bei Wundinfektionen der Keimnachweis aus Abstrich- oder Punktionsmaterial. Im Rahmen der diagnostischen Maßnahmen bei Patienten mit neutropenischem Fieber ist zu berücksichtigen, dass die üblichen Zeichen und Symptome einer Infektion wesentlich geringer ausgeprägt sein können und Fieber häufig das einzige frühe Zeichen der Infektion darstellt. Erklärt wird dies durch die im Rahmen des Immundefektes eingeschränkten Möglichkeiten des Organismus mit einer Entzündung auf einen systemischen oder lokalen Infekt zu reagieren. Dadurch gelingt es leider nur bei 30 - 50 % der Patienten mit Fieber in der Neutropenie den infektiösen Ursprung klinisch oder mikrobiologisch nachzuweisen [49]. 1.4.2 Häufigste Erreger und Krankheitsbilder Die wichtigsten Erreger bei Infektionen in der Neutropenie sind in Tabelle 1.2 aufgeführt, wobei über 85 % der bakteriellen Infektionen durch koagulasenegative Staphylokokken (v.a. Staphylococcus epidermidis), α- und β-hämolysierende Streptokokken, Staphylococcus aureus, E. coli, Klebsiella pneumoniae und Pseudomonas aeruginosa ausgelöst sind. Innerhalb dieses Erregerspektrums ist es in den letzten Jahren unter anderem aufgrund der eingeführten 14 1 Einleitung prophylaktischen Maßnahmen (Cotrimoxazol oder Fluorchinolon-Präparate) zu einer deutlichen Häufigkeitsverschiebung in den grampositiven Bereich gekommen, wobei jedoch ca. 25 - 30 % der Infektionen polymikrobiell sind. Außerdem ist die Inzidenz von invasiven Pilzinfektionen während der letzten 10 - 15 Jahre, u.a. durch die Verwendung von zentralen Venenkathetern und den frühen Einsatz von Breitspektrumantibiotika, v.a. bei Patienten mit länger dauernder Knochenmarkaplasie und bei Patienten nach allogener Stammzelltransplantation deutlich angestiegen [1; 18; 54; 82; 136; 138]. Im Rahmen einer Autopsiestudie an Patienten mit hämatologischen Neoplasien konnte diese steigende Häufigkeit zwischen 1979 (10 %) und 1990 (16 %) belegt werden. Dabei waren invasive Mykosen in bis zu 76 % der Fälle die maßgebliche Todesursache [129]. Unter den Erregern findet man dabei in über 85 % der Fälle Candida albicans bzw. tropicalis und Aspergillus fumigatus bzw. flavus [54]. Initial sind sie dabei hauptsächlich bei Lungeninfiltraten relevant. Werden erst nach mehr als fünf Tagen Erreger nachgewiesen, dann sind dies in etwa 30 - 40 % der dokumentierten Infektionen Pilze [104]. Tabelle 1.2 Häufigstes Erregerspektrum bei Diagnosestellung (modifiziert nach [94]) Grampositive Bakterien Gramnegative Bakterien Anaerobier - Clostridium spp. (v.a. C. difficile) Pilze - Koagulasenegative Staphylokokken - Escherichia coli - Candida spp. - Staphylococcus aureus - Pseudomonas spp. (v.a. P. aeruginosa) - Aspergillus spp. - Streptococcus spp. (v.a. S. viridans) - Proteus spp. - Mucor spp. - Enterococcus faecalis/faecium - Klebsiella spp. - Corynebakterium spp. - Enterobacter spp. 1 Einleitung 15 Neben einer Bakteriämie/Fungämie bzw. einer Sepsis, deren Häufigkeit meist mit 10 - 30 % der dokumentierten Infektionen je Neutropeniephase angegeben wird [53; 104; 125; 177], machen folgende sieben Lokalisationen den größten Teil der Infektionsherde beim neutropenischen Patienten aus: Oropharynx, Peridontium, Lunge, distaler Ösophagus, Kolon, Perianalregion, Haut. Dabei geht einer invasiven Infektion meist eine lokale Besiedlung des Organs oder benachbarter Organe voraus. Zum Beispiel werden Pneumonien häufig von Keimen verursacht, die den Oropharynx kolonisieren, perianale Läsionen sind meist durch Erreger bedingt, welche den unteren Intestinaltrakt besiedeln [54]. Unter den oben genannten Lokalisationen ist die Lunge am häufigsten betroffen. Bei ca. 15 % aller Patienten mit ausgeprägter Neutropenie nach intensiver Chemotherapie entwickeln sich Lungeninfiltrate, und die Wahrscheinlichkeit einer Pilzinfektion liegt dabei über 50 %. Besonders bedrohlich und lebensgefährlich ist die invasive Aspergillose mit einer Letalität von 70 - 80 % beim neutropenischen Patienten und bis zu 100 % beim Patienten nach allogener Stammzelltransplantation [46; 54; 101; 104]. Aufgrund der hohen Inzidenz und dem oft tödlichen Ausgang von Infektionen in der Neutropenie ist für die optimale Behandlung der betroffenen Patienten eine adäquate Diagnostik unerlässlich. Diese sollte neben einer klinischen Untersuchung, serologischen, mikrobiologischen und bildgebenden Verfahren (z.B. Röntgen, Sonografie, CT) auch invasive Methoden (BAL, Biopsie, u.a.) beinhalten, da v.a. bei atypischen Infektionen häufig nur damit die Erreger histologisch oder zytologisch nachgewiesen werden können. 1.4.3 Therapie Bei Patienten mit Fieber über 38° C in der Neutropenie muss von einer bakteriellen Infektion ausgegangen werden. Da sich diese aufgrund der Abwehrschwäche innerhalb von wenigen Stunden lebensbedrohlich entwickeln kann, muss nach Abnahme von Untersuchungsmaterial für den Nachweis der jeweiligen Erreger (z.B. in Blutkulturen) unverzüglich mit einer antimikrobiellen (primär antibakteriellen) Therapie begonnen werden. Zum Beispiel liegt die Letalität einer zu spät behandelten Infektion, welche sich zur Sepsis entwickelt bei 70 - 100 %, wobei bereits Therapieverzögerungen von nur wenigen Stunden nach Beginn der ersten Symptome als zu spät gewertet werden müssen. Für den Beginn einer Therapie bei Patienten mit neutrophilen Granulozyten < 500 /µl oder < 1.000 /µl mit zu erwartendem Abfall unter 500 /µl gelten daher folgende Indikationen: 1 Einleitung • 16 Fieber ohne erkennbare Ursache (Definition s.o.) oder zusätzlich klinisch, radiologisch oder mikrobiologisch dokumentierte Infektion • Symptome oder Befunde einer Infektion bei afebrilen Patienten • Klinische Diagnose einer Sepsis, auch ohne Fieber Der Anstieg des C-reaktiven Proteins (CRP), ein in der Leber produziertes Akutphasenprotein, das als empfindlicher aber unspezifischer Indikator für entzündliche Prozesse und Gewebeschädigungen gilt, ohne gleichzeitigen Fieberanstieg bzw. ohne Organsymptomatik wird bisher nicht als Indikation zur antimikrobiellen Therapie herangezogen. Allerdings kann er als Frühindikator für eine beginnende Infektion gewertet werden [1; 54; 81; 82; 102]. Die eingeleitete antibiotische Therapie ist empirisch, d.h. es werden gut untersuchte Substanzen oder Kombinationen mit einem breitem Wirkspektrum (u.a. gegen Enterobakterien, Pseudomonas aeruginosa und Staphylokokken) eingesetzt, ohne einen mikrobiologischen Erregernachweis abzuwarten. Bei Vorliegen von bakteriologischen Befunden soll die Therapie dann nach diesen ausgerichtet, jedoch nicht eingeengt werden, da häufig weitere unerkannte Erreger die Infektion verursacht haben können und es beim neutropenen Patienten nicht selten zu einem raschen Keimwechsel kommt. Außerdem muss bei Nachweis von resistenten Keimen das Wirkspektrum der initialen antibiotischen Therapie um diese erweitert werden. Je nach Risikoeinschätzung werden die betroffenen Patienten stufenweise nach entsprechenden Therapieschemata behandelt. Während bei Niedrigrisikopatienten zu Beginn noch eine orale Duotherapie mit einem fluoriertem Chinolon (Gyrasehemmer) und einem Breitbandpenicillin in Kombination mit einem Betalactamaseinhibitor (z.B. Ciprofloxacin + Amoxicillin/Clavulansäure) erwogen wird, erhalten Patienten der Standard- und Hochrisikogruppe von Anfang an eine intravenöse Therapie. In der Monotherapie werden dabei neben Breitspektrum-Cephalosporinen (Cefepim oder Ceftazidim) und gegen Pseudomonas aeruginosa wirksame Penicillinen mit Betalactamaseinhibitoren (z.B. Piperacillin/Tazobactam) auch Carbapeneme (Imipenem oder Meropenem) eingesetzt. Die Kombination von einem dieser Präparate mit einem Aminoglykosid, beispielsweise Amikacin, Gentamicin oder Netilmicin, findet häufig Anwendung in der Duotherapie. Bei klinisch kritischen Situationen, Resistenzproblemen oder fulminanten Infektionen z.B. mit Streptococcus viridans werden zusätzlich Glykopeptide (häufig Vancomycin) gegeben [1; 54; 81; 82; 103]. 1 Einleitung 17 Wenn nach 72 - 96 Stunden immer noch Fieber besteht und eine länger anhaltende Neutropeniedauer zu erwarten ist, sollte die Therapie durch Ergänzung von Präparaten, Erweiterung des Wirkspektrums etc. modifiziert werden. Dabei ist v.a. zu beachten, dass auch eine nichtbakterielle Infektion, eine bakterielle Infektion mit Resistenz gegenüber den verwendeten Antibiotika, eine neu aufgetretene Zweitinfektion, unzureichende Serum- und Gewebespiegel der Antibiotika und auch Medikamentenfieber oder Infektionen an nicht vaskularisierten Stellen (Katheter, „Abszesse“) Gründe für persistierendes Fieber sein können. Eine systemische antimykotische Therapie sollte in Erwägung gezogen werden, wenn es 72 Stunden nach der ersten Therapiemodifikation noch nicht zu einem Ansprechen gekommen ist [102]. Da Pneumonien nur zu 62 % auf die initiale antibakterielle Therapie ansprechen – im Vergleich zu 82 % bei anderen nachgewiesenen Infektionen [104; 110] – , sollte bei Patienten mit der klinischen Diagnose einer Pneumonie neben der Gabe von Antibiotika eine empirische antimykotische Therapie bei persistierendem Fieber durchgeführt werden [13]. Das früher häufig eingesetzte konventionelle Amphotericin B sowie Fluconazol wurden in den letzten Jahren immer mehr durch neuere und besser wirkende Antimykotika mit geringerer Toxizität, wie Itraconazol, Voriconazol und Caspofungin ergänzt, bzw. ersetzt. Liposomales Amphotericin B hat jedoch nach wie vor einen Stellenwert, v.a. in der Behandlung der invasiven Aspergillose [19; 20; 66; 169; 172]. Analog zu der Wahrscheinlichkeit, dass Pneumonien in bis zu 50 % der Fälle durch Pilze verursacht sind, muss auch bei Patienten mit abdomineller Symptomatik die Vielfalt des Erregerspektrums beachtet werden. Zum Beispiel können durch die zusätzliche Gabe von Metronidazol auch Infektionen mit Anaerobiern erfasst werden. Selbstverständlich müssen bei entsprechenden klinischen Hinweisen und diagnostischen Befunden ebenso antivirale und antiparasitäre Therapien eingeleitet werden. Im Allgemeinen wird das therapeutische Ansprechen 72 - 96 Stunden nach Therapiebeginn und Modifikation kontrolliert, wobei ein Abfallen der Körpertemperatur unter 38° C, ohne dass Anzeichen für eine Infektion bestehen, als wichtigster Erfolgsparameter gewertet wird. Aber auch ein Abfall von CRP oder Procalcitonin korreliert signifikant mit dem klinischen Ansprechen auf die Therapie [62]. Nach Entfieberung unter 38° C werden Patienten mit < 500 Neutrophilen/µl noch 5 - 7 Tage weiterbehandelt, Patienten mit > 500 Neutrophilen/µl noch für zwei Tage. Im Falle einer gesicherten Infektion werden außerdem solange Antiinfektiva gegeben, bis keine mikrobiologischen oder klinischen Infektionszeichen mehr nachweisbar sind. Damit nach Beendigung der antimikrobiellen Therapie ein Infektionsrezidiv oder eine 1 Einleitung 18 Sekundärinfektion erfasst werden können, ist eine Nachbeobachtungszeit von ca. sieben Tagen erforderlich [1; 81; 102; 103]. Immer häufiger werden heute zusätzlich rekombinante hämatopoetische Wachstumsfaktoren, z.B. G-CSF, und auch Granulozytentransfusionen als Begleitmedikation gegeben, um die Regeneration der neutrophilen Granulozyten zu beschleunigen und um die kritische Phase der Neutropenie zu überbrücken, da diese die Dauer der Infektionstherapie ganz entscheidend beeinflusst. 1.5 G-CSF Der Granulozyten-Kolonie-stimulierende Faktor (G-CSF; granulocyte-colony-stimulating factor) gehört neben anderen hämatopoetischen Wachstumsfaktoren und Koloniestimulierenden Faktoren (z.B. IL-3, IL-6, GM-CSF) zu der Gruppe der Zytokine, die v.a. Wachstum und Differenzierung hämatopoetischer Stamm- und Vorläuferzellen, aber auch Zahl und Funktion reifer neutrophiler Granulozyten regulieren [100]. G-CSF ist ein aus 174 Aminosäuren bestehendes Glykoprotein mit einem Molekulargewicht von ungefähr 20 kDa und einer überwiegenden α-Helix Tertiärstruktur [73]. Das kodierende Gen wurde auf dem Abschnitt q21-q22 von Chromosom 17 lokalisiert, ganz in der Nähe von anderen an der Entwicklung der neutrophilen Granulozyten beteiligten Genen [60]. Gebildet wird G-CSF von Monozyten, Makrophagen, Fibroblasten, Knochenmarkstromazellen und Endothelzellen und wirkt wie andere Kolonie-stimulierende Faktoren durch die Bindung an hochaffine G-CSF-spezifische Rezeptoren. Das Vorhandensein dieser Rezeptoren wurde vom Myeloblasten bis zum reifen neutrophilen Granulozyten an allen an der Granulopoese beteiligten Zellen nachgewiesen, nicht aber an Zellen der erythrozytären oder megakaryozytären (Thrombopoese) Differenzierungsreihe [43; 150; 171]. Die essentielle Beteiligung von G-CSF an der normalen Entwicklung neutrophiler Granulozyten wurde u.a. 1994 an knock-out Mäusen mit einem G-CSF-Gendefekt demonstriert [96]. Zwar zeigten diese lebensfähigen und fertilen Mäuse makroskopisch keine Auffälligkeiten, jedoch entwickelten sie eine chronische Neutropenie (etwa 20 - 30 % der normalen Granulozytenzahl), verbunden mit einer Reduktion der granulopoetischen Vorläuferzellen im Knochenmark um 50 %. Im Zusammenhang mit einer durch Listeria monocytogenes induzierten Sepsis zeigten sie eine deutlich beeinträchtigte Fähigkeit zur Infektabwehr und einen fehlenden Anstieg der neutrophilen Granulozyten im Blut. 1 Einleitung 19 Neben einer vermehrten und beschleunigten Produktion der Granulozyten und einer Mobilisierung der Knochenmarkreserve ins Gefäßsystem, was letztlich in einer Erhöhung des zirkulierenden Pools resultiert [11], haben verschiedene Studien gezeigt, dass G-CSF über eine Hemmung der Apoptose zu einer verlängerten Überlebenszeit der Granulozyten führt [35]. Außerdem werden die spezifischen Funktionen der Zellen wie Chemotaxis, Phagozytose, respiratory burst und mikrobizide Aktivität unter dem Einfluss von G-CSF verstärkt oder zumindest erhalten [6; 40; 85; 137]. G-CSF ist seit mehreren Jahren in rekombinanter Form (rhG-CSF) kommerziell verfügbar und ist inzwischen neben Erythropoetin das bei weitem am häufigsten therapeutisch eingesetzte Zytokin. Angewendet wird es dabei teils zur Prävention aber v.a. zur interventionellen Therapie der Neutropenie und den damit häufig verbundenen Infektionen, da durch die Gabe von G-CSF (meist in einer Dosierung von 5 µg / kg s.c.) die hämatopoetische Regeneration beschleunigt und somit die neutropenieassoziierte Morbidität, insbesondere die Inzidenz von Fieber und Infektionen reduziert, die Hospitalisationsdauer verkürzt und der Antibiotikaverbrauch vermindert werden kann. Dabei ist es von untergeordneter Bedeutung, ob die Granulozytopenie durch myelosuppressive Chemo- und/oder Strahlentherapie induziert wurde, oder im Rahmen einer Leukämie, einer aplastischen Anämie oder idiopathisch aufgetreten ist, [36; 38; 76; 126; 150; 164]. Allerdings wirkt G-CSF nur dann effektiv, solange die Patienten noch über eine ausreichend hohe Anzahl dafür empfänglicher hämatopoetischer Vorläuferzellen verfügen [41]. Aufgrund von Kosten-Nutzen-Analysen wird der Einsatz dieser Substanz heute trotz der teils viel versprechenden Ergebnisse routinemäßig noch nicht empfohlen, sondern beschränkt sich auf die supportive Behandlung von Patienten mit schweren und lebensbedrohlichen Infektionen [13; 50; 106; 107; 126; 165]. Neben der Möglichkeit rhG-CSF als direktes Therapeutikum einzusetzen, wird diese Substanz mittlerweile bereits seit einigen Jahren auch bei gesunden Menschen zur Mobilisation von Granulozyten angewandt. Durch die relativ nebenwirkungsarme subkutane Applikation von G-CSF (s. Kap. 1.6.4) in einer Dosierung von 5 - 10 µg / kg pro Tag und moderne Apheresetechniken ist es möglich geworden, von gesunden Spendern eine hohe Zahl an Granulozyten (3 - 9 x 1010) im Rahmen einer Leukapherese zu gewinnen [11; 31; 34; 40; 98; 157]. Diese Entwicklungen haben zu einem erneuten Interesse an Granulozytentransfusionen als mögliche supportive Therapie geführt [24; 41; 79]. 1 Einleitung 20 1.6 Granulozytentransfusionen 1.6.1 Historischer Hintergrund Seit über 70 Jahren wird daran geforscht, die Infektabwehr immunsupprimierter Patienten durch Transfusion von neutrophilen Granulozyten zu unterstützen. Bereits in den 30er Jahren des letzten Jahrhunderts wurde über eine Granulozytengabe berichtet [158]. Dabei wurde neutropenen Patienten ein „Leukozyten-Gemisch“ (leukocytic cream) intramuskulär verabreicht, woraufhin bei neun von zehn Patienten ein Anstieg der absoluten Neutrophilenzahl im peripheren Blut verzeichnet werden konnte. 1953 wurden zum ersten Mal erfolgreich Leukozyten intravenös transfundiert. Empfänger waren in diesem Fall Hunde mit einer totalen Knochenmarkaplasie, die zuvor mit einer potentiell letalen Dosis bestrahlt wurden [23]. Fünf Jahre später zeigte dieselbe Arbeitsgruppe, dass Leukozyten von Ratten teilweise ihre physiologischen Funktionen beibehielten, nachdem sie neutropenen Mäusen injiziert wurden [22]. In den 60er Jahren wurden Patienten mit unbehandelter chronisch-myeloischer Leukämie (CML) als Spender für Granulozytentransfusionen herangezogen, da diese häufig Granulozytenzahlen von mehr als 50 x 109 / l im peripheren Blut aufweisen4 und es somit möglich war, von diesen Patienten ungefähr 7 x 1010 neutrophile Granulozyten zu gewinnen [58; 121]. Ein möglicher Vorteil bestand weiterhin in einer verlängerten Halbwertszeit der Myelozyten und anderer granulozytärer Vorläuferzellen, die einen Großteil der transfundierten Zellen ausmachten, und länger im zirkulierenden Zell-Pool nachgewiesen werden konnten. Von den damals transfundierten Tumorpatienten, die unter Fieber in der Leukopenie litten, entfieberten 54 % innerhalb von 36 Stunden [121]. Dennoch ist es verständlich, dass CML-Patienten heute nicht mehr als Spender in Frage kommen, da sie zum einen relativ selten sind, und zum anderen die Gefahr des Anwachsens leukämischer Zellen und die Übertragung weiterer potentieller Pathogene auf den Empfänger nicht ausgeschlossen werden kann. Parallel zu der Verwendung von CML-Patienten als Spender für Granulozytentransfusionen wurde in den 60er Jahren sowohl die Filtrations- als auch die Zentrifugationsleukapherese entwickelt. Durch diese neuen Verfahrenstechniken ist es möglich geworden, Leukozyten von gesunden Spendern zu gewinnen. Die Filtrationsleukapherese, bei der Spenderblut über eine Nylonmembran geleitet wurde und die daran anheftenden Granulozyten über einen Waschschritt zur Transfusion gewonnen werden konnten, war eine billige und einfach zu handhabende Methode. Indes galt die Zentrifugationsleukapherese anfangs als aufwendig, teuer und kaum effektiv, da u.a. Granulozyten und Erythrozyten aufgrund ihrer ähnlichen Dichte nur 4 Entspricht einer Granulozytenzahl von 50.000 /µl 1 Einleitung 21 schwer voneinander zu trennen waren. Außerdem erlaubte das Filtrationsverfahren einen deutlich höheren Gewinn an Granulozyten (bis ca. 6 x 1010), was dazu geführt hat, dass in den 70er Jahren viele Studien unter Verwendung der Filtrationsleukapherese durchgeführt wurden [5; 63; 69; 72]. Im Laufe der Zeit stellte sich allerdings heraus, dass es durch die Adhäsion der Granulozyten an die Nylonmembran zu einem raschen Funktionsverlust der Zellen und zu einer Aktivierung des Komplementsystems kommt. Zudem haben durch Filtration gewonnene Granulozyten eine verkürzte Lebensdauer und eine verminderte Migrationsfähigkeit, und eine Stunde nach Transfusion ließen sich nur noch 20 % der transfundierten Zellen nachweisen [115]. Darüber hinaus konnte bei Spendern während den ersten 30 Minuten der Filtrationsleukapherese eine vorübergehende schwere Neutropenie beobachtet werden, und auch sonst kam es sowohl bei Empfängern als auch bei Spendern v.a. durch die Komplementaktivierung zu teils schweren Nebenwirkungen [37; 65; 134]. Daher wurde diese Methode heute wieder zugunsten der Zentrifugationsleukapherese verlassen. Unter Verwendung dieses Verfahrens wird das Spenderblut durch Zentrifugation in verschiedene Phasen getrennt, und die gewünschten Zellen, beispielsweise Leukozyten, können so selektiv gesammelt werden. Die Funktion der gesammelten Zellen wird dabei nicht wesentlich beeinträchtigt. Daher gilt die Zentrifugationsleukapherese heute als Methode der Wahl zur Apherese von Granulozyten [153]. Um eine größere Ausbeute bei der Zellgewinnung zu erzielen, konzentrierten sich Studien der 70er Jahre auf pharmakologische Methoden, die Zahl der Granulozyten im peripheren Blut gesunder Spender zu erhöhen. Während die Vorbehandlung der Spender mit Etiocholanolon, einem Katecholamin-Metabolit, aufgrund schwerer Nebenwirkungen, wie Fieber, Schüttelfrost und generalisierte Schmerzen, relativ schnell wieder verlassen wurde, ist es durch die Applikation von Glukokortikoiden und die Verwendung von Hydroxyethylstärke (HES) möglich geworden, die Zahl der gesammelten Granulozyten von 0,5 x 1010 auf bis zu 3 x 1010 zu erhöhen [39; 63; 147]. Während Glukokortikoide eine Verschiebung der Granulozyten vom randständigen in den zirkulierenden Pool sowie eine Freisetzung der Granulozyten aus der Knochenmarkreserve in die Gefäße bewirken, führt die Gabe von HES zum Spenderblut zu einer Sedimentationsbeschleunigung der Erythrozyten in der Zentrifuge, wodurch die Trennung der Granulozyten von den Erythrozyten erleichtert wird. Dabei ruft HES im Vergleich zu anderen Sedimentationsbeschleunigern nur wenige Nebenwirkungen [21; 112; 151] hervor und ist deutlich effektiver [92; 93; 111; 118; 119]. Auch die Vorbehandlung der Spender mit Glukokortikoiden zeigte eine geringe klinische Nebenwirkungsrate, wenngleich auch Bedenken hinsichtlich einer möglichen steroidinduzierten Funktionsstörung der Leukozyten geäu- 22 1 Einleitung ßert wurde. Diese Vermutung hat sich jedoch durch verschiedene kontrollierte Studien nicht bestätigt [5; 72; 168], und man geht heute davon aus, dass Glukokortikoide bei gleichzeitiger Hemmung der Apoptose zu keiner klinisch relevanten Einschränkung der Granulozyten führen [97; 130]. In den folgenden Jahren wurden daraufhin verschiedene Glukokortikoide in unterschiedlichen Dosierungen getestet. In den meisten Studien wurden die höchsten gewinnbaren Granulozytenzahlen (ca. 2 - 3 x 1010) unter Verwendung von Dexamethason oder Prednison erzielt [59; 108; 153]. Während anfangs v.a. viele kleinere, unkontrollierte klinische Studien zu Granulozytentransfusionen bei Erwachsenen publiziert wurden und meist einen Vorteil für die transfundierten Patienten nahe legten, führten die ständigen Fortschritte in der Sammlung von Spendergranulozyten seit den 70er Jahren auch bald zu ersten kontrollierten klinischen Studien. Diese Arbeiten wurden von Wright [175] und Strauss [153] zusammengefasst. Einen Überblick über Umfang und Erfolg oder Misserfolg dieser Studien gibt Tabelle 1.3. Tabelle 1.3 Granulozytentransfusionen bei Erwachsenen in sieben kontrollierten Studien (modifiziert nach [136]) Versuchsgruppe Autor Jahr Kontrollgruppe Patienten Überleben Patienten Überleben [n] [%] [n] [%] Erfolg Graw et al. [63] 1972 39 46 37 30 Teilweise Higby et al. [72] 1975 17 76 19 26 Ja Fortuny et al. [57] 1975 17 78 22 80 Nein Vogler et al. [168] 1977 17 59 13 15 Ja Alavi et al. [5] 1977 12 82 19 62 Teilweise Herzig et al. [69] 1977 13 75 14 36 Ja Winston et al. [173] 1982 48 63 47 72 Nein In der ersten kontrollierten Studie, die 1972 veröffentlicht wurde, berichteten Graw und Mitarbeiter über Granulozytentransfusionen bei Patienten mit nachgewiesener oder wahrscheinlicher Gram-negativer Sepsis. Patienten, die vier Granulozytentransfusionen erhielten, überlebten zu 100 %, Patienten mit drei Granulozytentransfusionen zu 80 %. In der Kontrollgruppe, die aus Patienten bestand, für die kein passender Spender gefunden werden konnte, überlebten 1 Einleitung 23 nur 30 % das infektiöse Ereignis [63]. Diese Ergebnisse und weitere wichtige Erkenntnisse dieser Studie, wie die erhöhte Nebenwirkungsrate und die geringere Zahl an zirkulierenden Granulozyten nach der Transfusion unter Verwendung der Filtrationsleukapherese sowie die Erhöhung der zirkulierenden Granulozytenzahl bei AB0- und möglicherweise auch bei HLAKompatibilität, haben den Weg für weitere Studien gebahnt. So wurden diese ersten positiven Ergebnisse 1975 in einer Studie von Higby und Mitarbeitern, in der alle Patienten, unabhängig vom klinischen Verlauf, vier Granulozytentransfusionen erhielten, größtenteils bestätigt. Dagegen konnten Fortuny und Mitarbeitern im selben Jahr keinen Erfolg der Granulozytentransfusionen aufzeigen. In ihrer Studie hatte die Kontrollgruppe mit alleiniger antibiotischer Behandlung eine sehr hohe Überlebensrate (80 %) [57], was allerdings darauf hindeutet, dass Patienten in die Studie eingeschlossen wurden, die nicht bedrohlich erkrankt waren. Vogler und Winton zeigten 1977, dass besonders Patienten mit prolongierter Neutropenie von Granulozytentransfusionen profitierten [168]. Zu diesem Schluss kam auch die Arbeitsgruppe um Herzig [69]. Daneben berichteten Vogler und Winton über ein fehlendes Ansprechen auf diese Art von Therapie bei Patienten, die weniger als 0,3 x 1010 Granulozyten pro Transfusion erhielten [168]. In der Studie von Alavi und Mitarbeitern wurden Patienten mit Fieber in der Neutropenie, darunter einige mit relativ guter Prognose, Granulozyten transfundiert und es konnte teilweise eine Wirksamkeit bei klinisch dokumentierten Infektionen gezeigt werden, insbesondere bei Patienten mit anhaltendem Knochenmarkversagen. Zusätzlich gab es Hinweise auf eine prophylaktische Wirkung gegen Pilzinfektionen [5]. 1982 konnten Winston und Mitarbeiter keinen Vorteil der transfundierten Patienten gegenüber der Kontrollgruppe demonstrieren, allerdings wurden im Mittel auch nur 0,5 x 1010 neutrophile Granulozyten transfundiert [173]. Die hohe Überlebensrate der Patienten aus der Kontrollgruppe deutete außerdem darauf hin, dass entweder Patienten in die Studie eingeschlossen wurden, die nicht an ernsten Infektionen erkrankt waren, oder aber die verwendeten Antibiotika wirksamer als in früheren Studien waren. Insgesamt zeigte sich somit in drei der sieben kontrollierten Studien ein signifikanter Überlebensvorteil transfundierter Patienten [69; 72; 168], in zwei weiteren Studien ein Trend hinsichtlich eines besseren klinischen Verlaufes [5; 63] und in zwei Studien keinerlei Überlegenheit der Granulozytentransfusionen. Jedoch lassen sich bei genauerer Betrachtung teils deutliche Unterschiede in der Art der Granulozytengewinnung und der verabreichten Granulozytendosis erkennen (s. Tab. 1.4). Diese Faktoren hatten zum Teil erhebliche Auswirkungen auf das Resultat der Studien. 1 Einleitung 24 Tabelle 1.4 Charakteristika der sieben kontrollierten Granulozytentransfusions-Studien (modifiziert nach [136]) Autor Leukaphereseverfahren Granulozytendosis (x 1010) Erfolg Filtration 2,0 Zentrifugation 0,6 Filtration 2,2 Ja Fortuny et al. [57] Zentrifugation 0,4 Nein Vogler et al. [168] Zentrifugation 2,7 Ja Filtration 5,9 Teilweise Filtration 1,7 Zentrifugation 0,4 Zentrifugation 0,5 Graw et al. [63] Higby et al. [72] Alavi et al. [5] Herzig et al. [69] Winston et al. [173] Teilweise Ja Nein Ein großes Problem der 70er und 80er Jahre, das die Ergebnisse von Granulozytentransfusionen bei Erwachsenen negativ beeinflusst hat, war die geringe Anzahl an von Spendern gewonnenen Granulozyten. Trotz Mobilisierung mit Glukokortikoiden haben diese niedrige Ausbeute und die kurze Halbwertszeit der transfundierten Zellen häufig zu keinem oder kaum messbarem Anstieg der zirkulierenden Granulozyten beim Empfänger geführt [89]. Daneben dämpften auch der hohe technische und finanzielle Aufwand, die mit Granulozytentransfusionen assoziierten, teils erheblichen Nebenwirkungen [71] und der Einsatz von neuen antimikrobiellen Wirkstoffen den anfänglichen Enthusiasmus. Buckner und Clift resümierten bereits 1984, dass Granulozytentransfusionen teuer seien und gesunde Spender in eine zeitaufwendige, unbequeme und riskante Prozedur involvierten. Sie kamen daher zu der Ansicht, dass es nur wenige klinische Situationen gäbe, in denen der Einsatz von Granulozytentransfusionen gerechtfertigt wäre und eine breitere Anwendung des Verfahrens eine bessere Technik der Granulozytengewinnung voraussetze [25]. Bei Kindern, darunter Kinder mit septischer Granulomatose und Neugeborene mit dringendem Verdacht auf Sepsis, wurden auch weiterhin in einer Reihe von Zentren Granulozytentransfusionen durchgeführt, da den kleinen Patienten relativ gesehen eine hohe Zahl an Zellen von gesunden Erwachsenen transfundiert werden konnte [30; 90; 152]. Erst die Entdeckung des Potentials von G-CSF und die klinische Anwendung dieser Substanz zur Mobilisierung von Granulozyten bei gesunden Spendern (s. Kap. 1.5) haben zu einem 1 Einleitung 25 erneuten und verstärkten Interesse an Granulozytentransfusionen geführt. Unterstützt wurde dies durch weiterhin verbesserte Sammeltechniken und den dringenden Bedarf an effektiver Behandlung von Infektionen in der Neutropenie. [41; 78]. Seit Anfang der 90er Jahre wurden daher viele Studien publiziert, in denen u.a. versucht wurde, die optimale Dosierung von GCSF und auch die der Kombination von G-CSF und Glukokortikoiden herauszuarbeiten, um bei gesunden Spendern eine möglichst hohe Zahl an zirkulierenden Granulozyten im peripheren Blut (ANC) zu erzielen [4; 11; 31; 70; 77; 84; 94; 98; 128; 133]. Im Vergleich zu früheren Studien, in denen die Spender ausschließlich mit Glukokortikoiden vorbehandelt wurden, konnte so die Zellzahl der durch Zentrifugationsleukapherese gewonnenen Granulozytenkonzentrate häufig um ein Vielfaches erhöht werden. Ein Überblick dieser Ergebnisse ist in Tabelle 1.5 dargestellt. Bei anschließender Transfusion der Zellen konnte in den meisten Fällen ein deutlicher Anstieg der Granulozyten im Blut der Patienten verzeichnet werden. Teilweise wurden sogar Normalwerte erreicht. So berichteten Bensinger und Mitarbeiter bereits 1993 von einem mittleren, 24 Stunden nach der Transfusion gemessenen, Anstieg der Zellen auf 0,95 x 109 /l [11]. In der Studie von Hübel und Mitarbeitern führten Granulozytentransfusionen von mit G-CSF vorbehandelten Fremdspendern eine Stunde danach zu einer medianen Granulozytenzahl in Höhe von 1,7 x 109 /l [77]. Wurden die Fremdspender zuvor mit G-CSF und Dexamethason stimuliert, so wurde bei den Empfängern ein medianer Granulozytenwert von 1,1 x 109 /l erreicht, verglichen mit 0,2 x 109 Granulozyten pro Liter nach Transfusion von Granulozytenkonzentraten, die von verwandten Spendern gewonnen wurden. Diesen wurde dabei vor der Leukapherese ebenfalls nur G-CSF appliziert. Einen deutlich höheren Wert (2,6 x 109 /l) konnten Price und Mitarbeiter sowohl eine Stunde nach der Granulozytengabe, als auch am nächsten Morgen bei ihren Patienten messen [133]. In einer anderen Studie, in der 30 Patienten insgesamt 301 Granulozytentransfusionen erhielten [128], wurde die Wahrscheinlichkeit, innerhalb von fünf Tagen eine absolute Granulozytenzahl von > 0,5 x 109 /l zu erreichen, mit 85 % angegeben. Obwohl die Ergebnisse von den Studien, die verschiedene Strategien der Zellmobilisation verfolgten, darauf hinweisen, dass eine höhere Granulozytendosis auch zu einem höheren Anstieg der Granulozytenzahl beim Empfänger führt [77; 128], konnte in manchen Studien diesbezüglich kein klarer Zusammenhang dargestellt werden [3; 4; 133]. Ursachen dieser abweichenden Beobachtungen können u.a. unterschiedliche Ausgangswerte der Zellzahlen vor der Transfusion, Inkompatibilität der Leukozyten zwischen Spender und Empfänger und ein fehlender einheitlicher Zeitpunkt der Messung sein. 26 1 Einleitung Tabelle 1.5 Ergebnisse der Granulozytengewinnung nach Stimulation mit G-CSF und/oder Glukokortikoiden Autor & Jahr Stimulationsregime ANC (x 109/l) Anzahl GK (n) PMNL / GK (x 1010) G-CSF, 5µg/kg/d s.c., x 12 d 29,6 58 4,2 Caspar et al. 1993 [31] G-CSF, 300µg s.c., x 1 d 20,2 22 4,4 Hester et al. 1995 [70] G-CSF, 5µg/kg/d s.c., x 4-5 d 23,8 – 35,5 124 4,1 Liles et al. 1997 [98] G-CSF, 300µg s.c. x 1 d G-CSF, 600µg s.c. x 1 d Dexamethason, 8mg p.o. x 1 d G-CSF, 300µg + Dex. 8mg x 1 d G-CSF, 600µg + Dex. 8mg x 1 d 26,5 27,4 9,0 33,9 43,0 n.d. n.d. Jendiroba et al. 1998 [84] G-CSF, 5µg/kg/d s.c., x 4-5 d G-CSF, 5µg/kg/d s.c., x 4-5 da Prednison, 60mg/d p.o., x 4-5 d 34,2b 29,3 20,7 221 179 64 4,2 4,6 2,9 Peters et al. 1999 [128] G-CSF, 5µg/kg/d s.c., x 5 d Prednisolon 50-100mg i.v., x 1 d 15,8c 4,5d 175 126 4,5 1,3 Adkins et al. 2000 [4] G-CSF, 10µg/kg/d s.c., d 1, 4, 6, 8 14,8 - 45,4 127 5,6 – 9,9 G-CSF, 600µg s.c. + Dex. 8mg p.o., x 1 d 30,9 175 8,2 3,0 18,9 22,4 13 37 5 5,1 5,5 10,6 219 4,6 5,4 8,1 Bensinger et al. 1993 [11] Price et al. 2000 [133] Lee et al. 2001 [94] Hübel et al. 2002 [77] Dex., 3mg/m² i.v., x 1 d G-CSF, 5µg/kg/d s.c., x 1 d G-CSF, 5µg/kg/d s.c. + Dex., 3mg/m² i.v., x 1 d G-CSF, 600µg s.c., x 1 dc G-CSF, 600µg s.c., x 1 dd G-CSF, 600µg + Dex. 8mg p.o., x 1 dd n.e. 327 ANC, absolute Neutrophilenzahl (absolute neutrophil count); Dex., Dexamethason; GK, Granulozytenkonzentrat; i.v., intravenös; n.d., nicht durchgeführt; n.e. nicht evaluierbar; PMNL, neutrophile Granulozyten (polymorphonuclear leukocytes); p.o., per os; s.c., subkutan; a Nur jeden zweiten Tag Ergebnisse dieser Studie beziehen sich auf die Gesamtzahl an Leukozyten c Verwandte Spender d Fremdspender b 1 Einleitung 27 In den vergangenen Jahren wurden Granulozytentransfusionen am häufigsten zur Behandlung von Patienten mit lebensbedrohlichen Infektionen in der Neutropenie, die auf die konventionelle antimikrobielle Therapie nicht ausreichend ansprachen, eingesetzt. Beispiele dieser Infektionen sind bakterielle oder mykotische Sepsis und invasive Aspergillose. Die meisten Zentren versuchen Granulozytentransfusionen ein- bis zweimal täglich oder zumindest einmal in zwei Tagen durchzuführen [33; 83; 128; 133]. Werden dabei nur Verwandte und enge Freunde der Patienten als Spender rekrutiert, so führt dies häufig zu logistischen Problemen, wenn keine ausreichend hohe Zahl an Spendern mit passender Blutgruppe und CMV-Status zur Verfügung stehen. Dahingegen haben Hübel und Mitarbeiter gezeigt, dass die Zeit von der Indikationsstellung bis zur Durchführung der ersten Transfusion verkürzt werden kann, wenn freiwillige Fremdspender rekrutiert werden [77]. In einer anderen Studie konnten durch die Kombination von Fremdspendern und Spendern aus der Verwandtschaft 75 % der geplanten täglichen Granulozytentransfusionen bei Patienten mit Sepsis in der Neutropenie durchgeführt werden [133]. Obwohl immer mehr Studien, auch aus jüngster Vergangenheit, gezeigt haben, dass Granulozytentransfusionen eine sichere und effektive Therapiemaßnahme bei Patienten mit schweren Infektionen in der Neutropenie sein können (s. Tab. 1.6), so sind diese Ergebnisse nur bedingt aussagekräftig. Viele Berichte stammen aus kleinen unkontrollierten Studien und einzelnen Fallberichten mit unterschiedlichen Ausgangssituationen, infektiösen Komplikationen, etc., und es mangelt bis heute an großen kontrollierten Multicenter-Studien. Neben der therapeutischen Anwendung von Granulozytentransfusionen wurde immer wieder auch versucht, den klinischen Wert von prophylaktischen Transfusionen herauszuarbeiten. So führten verschiedene Arbeitsgruppen Granulozytentransfusionen bei Patienten nach autologer [4] und allogener [2; 3; 15] Stammzelltransplantation durch, darunter auch bei Patienten mit Pilzinfektionen in der Vorgeschichte [88]. Die Ergebnisse dieser Studien zeigten, dass prophylaktische Granulozytentransfusionen eine sichere Methode sind und sowohl die Dauer der Neutropenie als auch die Inzidenz und Schwere einer Sepsis reduzieren konnten. Dies führte zu einer geringeren Anzahl an Tagen mit Fieber, einem reduzierten Antibiotikaverbrauch und einem möglichen positiven Einfluss auf das Langzeitüberleben der Patienten [2; 15; 88]. Insgesamt betrachtet bleiben die Aussagekraft bisheriger Resultate und somit auch der klinische Wert von prophylaktischen und therapeutischen Granulozytentransfusionen gegenwärtig immer noch umstritten. Der Einsatz von Granulozytentransfusionen beschränkt sich daher auf bestimmte klinische Situationen (s. Kap. 1.6.2). Ergebnisse zukünftiger, kontrollierter Studien 28 1 Einleitung sollen zeigen, ob das Indikationsspektrum erweitert werden kann und ob Granulozytentransfusionen ein fester Bestandteil der Infektionstherapie in der Neutropenie sein werden. Tabelle 1.6 Ergebnisse der Granulozytentransfusions-Therapie aus den letzten Jahren Autor & Jahr Anzahl Patienten (n) Ergebnisse nach GTx GesamtAnsprechen (%) Hester et al. 1995 [70] 15 Positives Ansprechen: 9/15 M 60 Dignani et al. 1997 [48] 15 Positiver Verlauf: 11/15 (2/4 HP; 9/11 SP) 73 Peters et al. 1999 [128] 30 Überleben an Tag 100 mit Infektionsfreiheit : 21/30 (14/17 B ; 7/13 M) 70 Price et al. 2000 [133] 19 Infektionsfreiheit: 8/19 (0/5 A; 4/7 C; 3/3B) 42 Lee et al. 2001 [94] 25 Positiver Verlauf : 10/25 (14/31 B; 8/11 M)a 40 Illerhaus et al. 2002 [83] 18 Klinische Stabilisierung oder Besserung : 12/18b 67 Cesaro et al. 2003 [33] 15 Positives Ansprechen: 9/15 (6 CR ; 3 PR) 60 Rutella et al. 2003 [139] 20 Positiver Verlauf: 6/11 B; 4/7 M; 1/2 CDI 55 A, Aspergillose; B, bakterielle Infektion; C, Candidämie; CDI, klinisch gesicherte Infektion (clinically documented infection); CR, vollständige Erholung (complete recovery); GTx, Granulozytentransfusion; HP, Hefepilz; M, mykotische Infektion; PR, partielle Besserung ( partial recovery); SP, Schimmelpilz a b Z.T. Patienten mit Mehrfachinfektionen Darunter u.a. 5/9 mit invasiv-pulmonaler Aspergillose, 7/9 mit schwerer Sepsis; z.T. Mehrfachinfektionen . 1.6.2 Indikationen Nach den Aussagen der Infectious Diseases Society of America kann der routinemäßige Einsatz von Granulozytentransfusionen bei neutropenen Patienten bisher nicht empfohlen werden [81]. Diese Art von Therapie gilt auch heute noch als ein experimentelles, klinisches Verfahren, welches nur im Rahmen von Studien angewandt werden sollte [26; 78]. Dennoch gibt es bestimmte Situationen in der Neutropenie, in denen der Einsatz von G-CSF-stimulierten Granulozytentransfusionen angebracht und gerechtfertigt sein kann. Dazu gehören schwere Infektionen bei Patienten mit weniger als 200 - 500 neutrophilen Granulozyten/µl, die trotz maximaler antibiotischer und antimykotischer Therapie für mehr als 48 Stunden einen progredienten Verlauf zeigen und aufgrund der Erregerspezies und der zu erwartenden Neutropeniedauer 1 Einleitung 29 mit hoher Wahrscheinlichkeit lebensbedrohlich für den Patienten werden können. Beispiele dieser Infektionen sind nekrotisierende Fasziitis, schwere neutropenische Typhlitis (syn. neutropenische Kolitis, nekrotisierende Enteropathie), systemische Pilzinfektionen, etc. [14; 26]. Diese Indikationsbereiche haben sich im Laufe der Jahre durch klinische Erfahrung und veröffentlichte Daten aus einzelnen Fallberichten und Studien herauskristallisiert. Allerdings werden Granulozytentransfusionen, auch aufgrund der oft nicht ausreichenden Spenderverfügbarkeit, in manchen Zentren nur dann zur Infektionstherapie in Erwägung gezogen, wenn davon auszugehen ist, dass sich die Knochenmarkfunktion und in Folge dessen die absolute Zahl an neutrophilen Granulozyten des Empfängers in einer absehbaren Zeit erholen wird. Vorgeschlagen wird dabei ein Zeitraum von sieben Tagen [14]. Zusätzlich zu den o.g. Indikationen können auch Patienten, die an einer der seltenen angeborenen Granulozytenfunktionsstörungen, wie z.B. der septischen Granulomatose leiden, bei progredienten und lebensbedrohlichen Infektionen von Granulozytentransfusionen profitieren. Ein Erfolg ist bei diesen Patienten auch dann möglich, wenn sie eine normale absolute Granulozytenzahl im peripheren Blut aufweisen [178]. Des Weiteren können Granulozytentransfusionen erfolgreich bei Neugeborenen mit Sepsis und Neutropenie aufgrund erschöpfter Granulozytenreserve im Knochenmark eingesetzt werden [29]. Der klinische Nutzen der therapeutischen sowie der prophylaktischen Gabe von Granulozytenkonzentraten soll in derzeit laufenden Studien in Europa und den USA erforscht bzw. bestätigt werden. Unter anderem wird eine geplante prospektive Multicenter-Studie, die durch das Transfusion Medicine/Hemostasis Clinical Trial Network (USA) beaufsichtigt wird, voraussichtlich wertvolle Informationen diesbezüglich liefern. 1.6.3 Gewinnung und Transfusion der Granulozytenkonzentrate Wie bereits in Kapitel 1.6.1 erwähnt, werden Granulozytenkonzentrate durch maschinelle Apherese, und zwar heute ausschließlich mittels Zentrifugationsleukapherese, von gesunden Spendern gewonnen. Die Spende dieser Präparate ist dabei stets eine gerichtete Spende für einen bestimmten Patienten. Die in Deutschland geltenden Anforderungen an die Spender (Gesundheit, Eignung, Spendertauglichkeit) sind in nationalen und europäischen Gesetzen und Richtlinien beschrieben und beinhalten beispielsweise Blutgruppenkompatibilität mit dem Empfänger, Alter (i.A. 18-68 Jahre) und negative Infektionsserologie für HIV, TPHA, 1 Einleitung 30 HBsAg und HCV [27; 55]. Außerdem sollten bei CMV-seronegativen Patienten nur Granulozytenpräparate von CMV-seronegativ getesteten Spendern eingesetzt werden. Tierexperimentelle Untersuchungen und klinische Erfahrungen haben gezeigt, dass ein Konzentrat für einen erwachsenen Patienten mehr als 2 x 1010 und für Neugeborene mehr als 3 x 109 Granulozyten enthalten sollte [9; 26; 166]. Zur Gewinnung eines ausreichend hohen Granulozytengehalts werden die Spender daher mit Glukokortikoiden und/oder gentechnisch hergestelltem G-CSF vorbehandelt. Da G-CSF derzeit in Deutschland nicht für diese Indikation zugelassen ist, dürfen solche Vorbehandlungen nur im Rahmen von Studien mit einem zustimmenden Votum der zuständigen Ethikkommission sowie einer Probandenversicherung erfolgen. Außerdem ist bei Gabe von G-CSF an Frauen im gebärfähigen Alter zuvor eine Schwangerschaft auszuschließen [26]. Der optimale Zeitpunkt der Apherese liegt bei 8 - 12 Stunden nach der letzten Gabe von G-CSF, da in diesem Zeitraum die maximale Anzahl an zirkulierenden Granulozyten zu erwarten ist [99]. Um während der Zentrifugation eine ausreichende Trennung von Granulozyten und Erythrozyten zu erreichen, hat sich der Einsatz des Sedimentationsbeschleunigers Hydroxyethylstärke (HES) bewährt. Da Unverträglichkeitsreaktionen auf HES beschrieben sind, wird eine so genannte biologische Vorprobe durch intravenöse Injektion von 1 ml 6 %iger HES mit anschließender 5-minütiger Beobachtungszeit empfohlen. Außerdem beschränkt der Einsatz dieses Sedimentationsbeschleunigers wegen der Gefahr für das Auftreten von starkem Juckreiz die Zahl der bei einem Spender erlaubten Granulozytapheresen auf vier pro Jahr [26; 47]. Während der Apherese werden dem Spenderblut dann 200 bis maximal 750 ml 6%ige HES sowie ein Antikoagulanz (Tri-Natrium-Citrat) zugesetzt. Anschließend wird jedes gewonnene Konzentrat zur Verhinderung einer Graft-Versus-Host-Reaktion mit 30 Gy bestrahlt. Aufgrund der autolytischen Tendenz von Granulozyten sollten die Granulozytenkonzentrate innerhalb von sechs Stunden nach Herstellung transfundiert werden. Allerdings haben verschiedene Studien gezeigt, dass es auch möglich ist, Granulozytenkonzentrate bei 10 - 24° C bis zu 24 Stunden in Ruhe und ohne wesentlichen Funktionsverlust zu lagern und anschließend erfolgreich zu transfundieren [80; 91; 145]. Die Granulozytentransfusion erfolgt über ein normales Transfusionsgerät mit Standardfilter (DIN 58360, Porengröße 170 µm – 230 µm) und einer empfohlenen Transfusionsgeschwindigkeit von 1 x 1010 Zellen pro Stunde [26].Unmittelbar vor der Transfusion ist jedes Granulozytenkonzentrat einer optischen Qualitätsprüfung zu unterziehen. Hierbei ist vor allem auf Unversehrtheit des Beutels, Koagel- und Aggregatbildung, Verfärbungen sowie auf Hämolyse 1 Einleitung 31 zu achten. Auffällige Granulozytenkonzentrate dürfen nicht transfundiert werden. Weiterhin sind die einwandfreie Beschriftung, die korrekte Zuordnung zum Patienten und das Verfallsdatum des Präparates zu kontrollieren. Um mögliche pulmonale Transfusionsreaktionen durch gleichzeitige Gabe von Amphotericin B (s. Kap. 1.6.4) zu vermeiden, sollte zur Granulozytentransfusion ein zeitlicher Abstand von 4 - 6 Stunden eingehalten werden, auch wenn dieser Zusammenhang mehr und mehr in Frage gestellt wird [52]. Weiterhin sollte bei Frauen im gebärfähigen Alter eine Prophylaxe mit Anti-D Immunglobulin immer dann durchgeführt werden, wenn die Gabe von Rh(D)-positiven Granulozytenpräparaten unvermeidlich ist. Damit kann eine Immunisierung der Patientinnen vermieden werden [26]. Kommt es nach Granulozytentransfusionen bei den Empfängern zu einem wiederholten Ausbleiben eines adäquaten Inkrements (Granulozytenanstieg < 0,5 x 109 /l), sollte durch spezifische Untersuchungen (z.B. Lymphozytotoxizitätstest) eine Vor-Alloimmunisierung des Empfängers gegen HLA- und granulozytenspezifische Antigene ausgeschlossen werden. Bei positivem Testbefund sind entsprechend HLA- und/oder Granulozytenantigen-kompatible Granulozyten zu transfundieren [26]. 1.6.4 Nebenwirkungen Bei Spendern sind die Nebenwirkungen von G-CSF (und auch von Glukokortikoiden) erfahrungsgemäß gering und beschränken sich meist auf lokales Brennen an der Einstichstelle, dosisabhängige leichte und vorübergehende Knochen- und Muskelschmerzen, moderate Kopfschmerzen, selten Übelkeit, Müdigkeit oder auch Schlaflosigkeit [8; 11; 28; 31; 133; 155]. Allerdings treten diese unerwünschten Nebenwirkungen bei bis zu 80 % der Spender auf, und in einer Studie von McCullough und Mitarbeitern [113] haben ungefähr 75 % der Spender aufgrund der vorübergehenden Nebenwirkungen Schmerzmittel eingenommen. Dadurch konnte aber in den meisten Fällen eine deutliche Linderung erzielt werden. Spender sollten auch auf den Umstand eines möglicherweise erhöhten Thromboserisikos hingewiesen und auf Vorliegen einer Thrombophilie untersucht werden, da von einer Gerinnungsaktivierung im Sinne einer Hyperkoagulabilität nach G-CSF-Applikation berichtet wurde [149]. Außerdem wiesen Ghodsi und Mitarbeiter 2001 auf ein möglicherweise erhöhtes Kataraktrisiko bei Granulozytenspendern nach wiederholter Gabe von Glukokortikoiden hin [61]. Eine einmalige Gabe von G-CSF führt, nach gelegentlich innerhalb der ersten 30 Minuten auftretender transienter Neutropenie, zu einem über 24 - 48 Stunden anhaltenden Granulozytenanstieg im Blut des Spenders, mit einem maximalen Wert nach ungefähr 12 Stunden. 1 Einleitung 32 Durch wiederholte Applikation kann dieser erhöhte Level für mindestens zwei Wochen aufrechterhalten werden. Nach Absetzen von G-CSF kommt es innerhalb weniger Tage zu einer vollständigen Normalisierung des Blutbildes [11; 34; 98]. Bis heute gibt es insgesamt nur wenig Langzeiterfahrung über die Behandlung mit G-CSF. In bisherigen Untersuchungen konnten jedoch noch keine negativen Folgen gezeigt werden [32; 143; 154]. Weitere Nebenwirkungen bei Spendern wie starker Juckreiz, Flush, Blutdruck- und Herzfrequenzanstieg bei zu schneller Infusion und Wasserretention mit Hyponatriämie können durch die Gabe von HES auftreten. Allerdings sind auch hier keine langfristigen Nebenwirkungen bekannt [28; 120]. Als sehr seltene unerwünschte Nebenwirkung sind anaphylaktoide Reaktionen beschrieben worden (Häufigkeit < 1:1.000.000). Daneben können bei Patienten mit Gerinnungsstörungen (z.B. von Willebrand-Jürgens-Syndrom) Blutungen auftreten [160], welche sich jedoch durch Auswahl eines geeigneten HES-Präparates minimieren lassen [161163]. Insgesamt treten unerwünschte Nebenwirkungen bei Granulozytenspendern zwar relativ häufig auf, jedoch meist nur in milder Ausprägung. In einer Studie von Price und Mitarbeitern ergab eine Umfrage unter Spendern nach der Leukapherese eine 98 %ige Bereitschaft, noch einmal an einer Granulozytenspende teilzunehmen [133]. Im Rahmen einer deutschösterreichischen Multicenter-Studie waren dies immerhin noch 85 % [28]. Von den Empfängern werden Granulozytentransfusionen im Allgemeinen gut toleriert. Die am häufigsten zu beobachtenden Nebenwirkungen sind Fieber und Schüttelfrost, seltener Hautausschlag (Urtikaria), Dyspnoe, Tachykardie und Hypotension [4; 28; 77; 94; 116; 128; 133]. Während diese Nebenwirkungen meist als gering bis moderat beschrieben werden und teilweise durch Prämedikation und reduzierte Transfusionsgeschwindigkeit minimiert werden können, besteht doch die Gefahr einer Granulozytentransfusion-assoziierten pulmonalen Reaktion, die einen tödlichen Ausgang zur Folge haben kann [94]. Pathophysiologisch liegen dieser pulmonalen Reaktion verschiedenartige Ursachen zu Grunde. Dazu zählen anaphylaktische Reaktionen, Überwässerung, Lungenödem und TRALI (transfusion related acute lung injury) [140]. Bei letzterem geht man davon aus, dass es im Mikrogefäßsystem der Lunge zur Aggregation von neutrophilen Granulozyten kommt. In den 80er Jahren des letzten Jahrhunderts wurden verschiedene Fälle von gravierenden Nebenwirkungen einer Granulozytentransfusion und gleichzeitiger Gabe von konventionellem Amphotericin B beschrieben. Hiernach können unter dieser Kombinationsbehandlung lebensbedrohliche pulmonale Reaktionen auftreten [12; 176]. Obwohl in darauf folgenden Untersuchungen dieser Zusammenhang nicht bestätigt wurde [52; 86], wird auch heute noch empfoh- 1 Einleitung 33 len, einen zeitlichen Abstand zwischen den Granulozytentransfusionen und der Gabe von Amphotericin B einzuhalten (s. Kap. 1.6.3). Weiterhin scheint die Gefahr einer durch die Granulozytentransfusion bedingten Alloimmunisierung durch HLA-Klasse-I- und granulozytenspezifische Alloantikörper des Empfängers zu bestehen, welche zu schweren febrilen Transfusionsreaktionen führen kann [68; 114; 144; 156]. Allerdings wurde in zwei neueren Studien der Zusammenhang zwischen einer Leukozyteninkompatibilität und dem Auftreten von unerwünschten Nebenwirkungen nicht bestätigt [4; 133]. Dennoch sollte bei fehlendem Inkrement nach Granulozytentransfusionen, dem Auftreten eines gegenüber Thrombozytenpräparaten refraktären Zustandes, posttransfusionellen pulmonalen Infiltraten und häufigen febrilen Transfusionsreaktionen eine Alloimmunisierung in Betracht gezogen und weitere Untersuchungen veranlasst werden. 1.7 Ziel der Arbeit Seit 1996 werden in der Medizinischen Klinik und der Kinderklinik der Universität Freiburg Granulozytentransfusionen durchgeführt. Ziel dieser Arbeit ist es, die Daten aller Transfusionen, die bei Patienten im Rahmen der supportiven Therapie bei schweren Infektionen in der Neutropenie durchgeführt wurden, zu erfassen und zu analysieren. Zum einen soll die Durchführung und die Machbarkeit der Granulozytengewinnung sowie der -transfusion erläutert werden, zum anderen soll die Effektivität dieser Therapieoption anhand des klinischen Verlaufs und unter Zuhilfenahme von laborchemischen Parametern und der Überlebenszeitanalyse beschrieben werden. Dazu sollen die Patienten entsprechend ihrer infektiologischen Erkrankung in verschiedene Gruppen eingeteilt werden, um so ein eventuell unterschiedliches Ansprechen der Transfusionen auf die durch verschiedene Erreger ausgelösten Krankheitsbilder herauszuarbeiten. Des Weiteren soll untersucht werden, ob es zusätzliche Faktoren gibt, die die Wahrscheinlichkeit für das Ansprechen auf die Granulozytentransfusionen beeinflussen können. 2 Patienten, Spender und Methoden 34 2 Patienten, Spender und Methoden 2.1 Patienten An der Universitätsklinik Freiburg werden seit 1996 Granulozytentransfusionen durchgeführt. Dabei werden die Empfänger wie auch die Spender der Granulozytenkonzentrate vor der Transfusion über mögliche Risiken und Nebenwirkungen dieser Behandlungsmethode aufgeklärt. Diese Aufklärung, die nach den Richtlinien der Deklaration von Helsinki erfolgt, und die Einwilligung in das Verfahren werden durch eine Unterschrift des Patienten bestätigt. Die entsprechenden Durchführungsprotokolle wurden der Ethikkommission vorgelegt und von dieser positiv begutachtet. In dem Zeitraum von Anfang 1996 bis Ende 2003 wurden insgesamt 318 Leukapheresen initiiert, von denen allerdings drei vorzeitig abgebrochen werden mussten. Ursachen dafür waren in zwei Fällen Zuflussstörungen vom Spender zum Zellseperator und in einem Fall eine vasovagale Reaktion (vorübergehend Übelkeit, Kaltschweißigkeit, fehlende periphere Pulse ohne Bewusstseinsverlust) des Spenders. Aufgrund unzureichender Datenlage konnten fünf Transfusionen nicht weiter verfolgt und ausgewertet werden. Des Weiteren wurden drei Granulozytenkonzentrate nicht transfundiert, da eine Patientin vor der geplanten Transfusion starb, bei einer Patientin der Verdacht auf ein Sweet-Syndrom nach Gabe von G-CSF gestellt wurde und ein Patient nach vorangegangener Granulozytentransfusion Alloantikörper gegen Granulozyten entwickelte. Von den 307 auswertbaren Granulozytentransfusionen wurden 75 prophylaktisch durchgeführt, 44 davon im Rahmen einer klinikinternen Studie von Illerhaus und Mitarbeitern [83]. Diese prophylaktischen Transfusionen wurden in dieser Arbeit aufgrund einer anderen Aufgabenstellung und Zielsetzung nicht näher betrachtet. Insgesamt konnten daher die Daten von 232 Granulozytentransfusionen, die an der Universitätsklinik Freiburg zwischen 1996 und 2003 bei 70 Patienten als supportive Therapiemaßnahme bei schweren Infektionen in der Neutropenie durchgeführt wurden, erfasst und ausgewertet werden. Dabei entfielen 23 Granulozytentransfusionen auf acht Säuglinge und Kinder und 209 Transfusionen auf 62 erwachsene Patienten. Tabelle 2.1 gibt einen Überblick über die Patientencharakteristika und die Anzahl der Transfusionen pro Patient. Die Verteilung der verschiedenen Grunderkrankungen auf das gesamte Patientenkollektiv ist in Abbildung 2.1 noch einmal graphisch dargestellt. 35 2 Patienten, Spender und Methoden Tabelle 2.1 Patientencharakteristika Erwachsene Kinder Gesamt 62 8 70 Männlich/weiblich 39/23 6/2 45/25 Alter (Jahre) Median Range 49 17-77 11 0,2-16 44 0,2-77 2 36 3 4 2 - 6 38 3 5 3 2 9 2 2 5 3 2 9 4 2 1-25 2 1-10 2 1-25 13 19 11 11 3 2 3 1 3 2 2 1 - 16 21 13 11 3 2 3 1 1 Anzahl der Patienten Grunderkrankung ALL AML Aplastische Anämie CML Hodgkin Lymphom MDS NHL Sonstige (Agranulozytose, MammaKarzinom, Histiozytose, Neuroblastom) Anzahl GTx pro Patient Median Range Anzahl Patienten mit 1 GTx 2 GTx 3 GTx 4 GTx 6 GTx 7 GTx 8 GTx 10 GTx 25 GTx ALL, akute lymphatische Leukämie; AML, akute myeloische Leukämie; CML, chronische myeloische Leukämie; GTx, Granulozytentransfusion; MDS, myelodysplastisches Syndrom; NHL, Non-Hodgkin-Lymphom 36 2 Patienten, Spender und Methoden Hodgkin Lymphom 3 CML 5 NHL 9 ALL 6 Aplastische Anämie 3 MDS 2 Sonstige 4 AML 38 Abb. 2.1 Hämatologische Grunderkrankungen aller Patienten (n = 70) Im Jahr 2002 erhielt eine Patientin zu zwei unterschiedlichen Zeitpunkten und unter verschiedenen Indikationen jeweils vier Granulozytentransfusionen, so dass die Daten dieser Patientin zum Teil getrennt in die Auswertung miteinbezogen wurden. Erkennbar ist dies an der Gesamtzahl der Patienten, da in diesen Fällen von 71, bzw. 63 Patienten ausgegangen wurde. Die Verteilung der Patienten und entsprechend die der Granulozytentransfusionen über die Jahre ist in Abbildung 2.2 dargestellt. 70 Anzahl Patienten und GTx 58 60 50 42 35 40 30 34 25 18 20 10 13 12 5 5 1996 1997 16 12 11 8 6 3 0 1998 1999 2000 2001 2002 Jahr Patienten (Gesamt n=71) GTx (Gesamt n=232) Abb. 2.2 Anzahl der Patienten und GTx pro Jahr 2003 37 2 Patienten, Spender und Methoden 2.2 Spender Für die insgesamt 232 Granulozytentransfusionen standen 90 Spender zur Verfügung, davon neun Spender für 23 Transfusionen bei Kindern und 81 Spender für 209 Transfusionen bei erwachsenen Patienten. Einen Überblick über Geschlecht, Alter und Anzahl der Leukapheresen pro Spender sowie die Aufteilung nach den Empfängern gibt Tabelle 2.2. Tabelle 2.2 Spendercharakteristika Spender für Erwachsene Spender für Kinder Gesamt 81 9 90 Männlich/weiblich 36/45 5/4 41/49 Alter (Jahre) Median Range 37 18-69 33 18-39 36 18-69 Leukapheresen pro Spender Median Range 2 1-13 2 1-5 2 1-13 Anzahl der Spender Alle Spender wurden aus der Verwandtschaft oder der näheren Bekanntschaft der Patienten ausgewählt und haben sich freiwillig zur Verfügung gestellt. Sie wurden über die Besonderheiten des Verfahrens zur Gewinnung von Granulozyten sowie die möglichen Risiken und Nebenwirkungen aufgeklärt und haben diese Aufklärung und die Einwilligung in das Verfahren durch Unterschrift bestätigt. Grundvoraussetzungen für eine mögliche Granulozytenspende waren dabei die identische Blutgruppe (AB0 und Rh +/-) von Patient und Spender und ein negatives Testergebnis des Spenders für eine Schwangerschaft sowie für HAV-, HBV-, HCVund HIV-Infektionen und für Treponema pallidum und Toxoplasmose. In einem Fall erhielt eine CMV-negative Patientin aufgrund einer rasch progressiven Aspergillose und einem fehlenden CMV-negativen Spender Granulozytenkonzentrate von einem CMV-positiven Spender. Bei allen anderen CMV-negativen Patienten wurden Granulozytenpräparate von CMVseronegativ getesteten Spendern eingesetzt. Alle Spender erhielten ca. 12 Stunden vor jeder Leukapherese einmalig subkutan 5 µg / kgKG G-CSF (Filgrastim; Neupogen®, Amgen, München, Deutschland). Zuvor wurden sie klinisch untersucht und es wurden verschiedene Laboruntersuchungen (Blutbild, Leber- und Nierenfunktionswerte, CRP) durchgeführt. 2 Patienten, Spender und Methoden 38 2.3 Methoden 2.3.1 Standardtherapie und Indikation zur Granulozytentransfusion Alle Patienten wurden nach den Standardempfehlungen für Infektionen in der Neutropenie antibiotisch behandelt. Sobald die Leukozyten eines Patienten unter 1.000 / µl fielen und die Körpertemperatur auf über 38,3° C anstieg oder aber im Blut des Patienten ein nicht anderweitig zu erklärender CRP-Anstieg gemessen werden konnte und der Patient Symptome einer Infektion zeigte, wurde eine Infektion angenommen. Nach Abnahme von Blutkulturen, Sputum- und Urinproben wurde dann eine Behandlung mit Breitbandantibiotika, z.B. Ceftazidim, Piperacillin oder Carbapeneme begonnen. Außer im Rahmen entsprechender Therapieprotokolle wurden prophylaktisch keine Antibiotika und Antimykotika verabreicht. Bei über 48 Stunden persistierendem Fieber in der Neutropenie wurde die Therapie mit Vancomycin (2 x 1 g / Tag) erweitert und im Falle eines Verdachts einer Pilzinfektion zusätzlich mit Amphotericin B (1 mg / kgKG / Tag) eskaliert. Konnte ein Erreger isoliert werden, so wurde die antibiotische Therapie entsprechend den Resistenztestungen geändert und angepasst. Erythrozytenkonzentrate wurden bei Abfall des Hämoglobins unter 8 g / dl und Thrombozytenkonzentrate bei Abfall der Gesamtthrombozytenzahl unter 15.000 / µl transfundiert. Granulozytentransfusionen wurden bei Anstieg der Infektionsparameter und Verschlechterung des klinischen Zustandes trotz maximaler Eskalation der antibiotischen und antimykotischen Therapie und einer nicht zu erwartenden hämatopoetischen Regeneration innerhalb der folgenden fünf Tagen sobald als möglich initiiert. 2.3.2 Leukapherese Alle Granulozytenkonzentrate wurden mit dem COBE Spectra Zellseperator (COBE BCT, Lakewood, CO, USA) unter Verwendung der Spectra Software Version 5.1 gewonnen. Das Sammelprinzip für Granulozyten mit der COBE Spectra ist halbautomatisch mit einer durch das PMN-Programm vorgegebenen Basiseinstellung, die durch visuelle Überwachung der Separationskammer sowie dem Abgleich der Farbe im Sammelschlauch mit einer von der Firma COBE mitgelieferten Farbskalakarte (COBE Spectra WBC Colorgram) noch optimiert werden kann. Während jeder Apherese wurden ungefähr 5 - 7 Liter Blut vom Spender mit einer kontinuierlichen Durchflussrate von 40 - 70 ml/min verarbeitet. Die Zellsammelrate wurde dabei auf 2 ml/min eingestellt. Im Rahmen der anfänglichen Apheresen wurde als Sedimentationsbeschleuniger 6 %ige HES 200/0,5 (Molekulargewicht: 200 kDa, Substitutions- 2 Patienten, Spender und Methoden 39 grad: 30 %) (HAES-steril 6 %, Fresenius, Bad Homburg, Germany) mit ACD-A (Baxter, Unterschleißheim, Germany) in dem Verhältnis 1 : 1 gemischt und anschließend dem Spenderblut in einem Verhältnis von 1 : 15 beigefügt. Ab 1999 wurde eine Mischung aus 470 - 500 ml 6 %ige HES 450/0,7 (Plasmasteril, Fresenius, Bad Homburg, Germany) und 30 ml 46,7 %igem Tri-Natrium Citrat verwendet und dem Spenderblut in einem Verhältnis von 1 : 13 zugeführt, da sich gezeigt hat, dass der Gewinn an Granulozyten und somit der Reinheitsgrad der Konzentrate dadurch gesteigert werden konnte. 2.3.3 Transfusion Alle Granulozytenkonzentrate wurden mit 30 Gy (anfangs noch mit 20 Gy) bestrahlt und innerhalb von sechs Stunden nach der Apherese entsprechend den allgemeinen Transfusionsrichtlinien und der klinischen Verträglichkeit transfundiert. Zuvor erhielten die Empfänger nach den Standardempfehlungen 500 - 1.000 mg Paracetamol und eine Ampulle (50 mg) Clemastin als Prämedikation. Die anfängliche Gabe von 4 mg Dexamethason wurde wegen der möglichen Funktionsbeeinträchtigung der transfundierten Granulozyten durch Glukokortikoide wieder verlassen. Um das Risiko für mögliche Nebenwirkungen zu reduzieren, wurde den Patienten sowohl acht Stunden vor, als auch acht Stunden nach der Granulozytentransfusionen kein Amphotericin B gegeben. Abhängig von der Spenderverfügbarkeit und dem klinischen Zustand der Patienten wurde versucht, Granulozytentransfusionen jeden zweiten Tag durchzuführen, und zwar so lange, bis die Patienten hämatopoetisch regeneriert hatten. 2.3.4 Definitionen Neutropenie An der Universitätsklinik Freiburg liegt der Normbereich für Granulozyten zwischen 40 und 75 % bei einer Gesamtleukozytenzahl von 4.300 - 10.000/µl. Eine Neutropenie wurde im Rahmen dieser Arbeit definiert als WBC < 1.000/µl. Bei fünf Patienten wurde trotz einer Leukozytenzahl von ≥ 1.000/µl eine Neutropenie definiert, da bei Ihnen ein großer Anteil von malignen Zellen und/oder ein sehr geringer Prozentsatz an Granulozyten im Blut gemessen werden konnte und somit von einer absoluten Granulozytenzahl von ≤ 500/µl ausgegangen werden musste. 2 Patienten, Spender und Methoden 40 Infektionen Anhand klinischer, radiologischer und mikrobiologischer Befunde wurde jedem Patienten eine Infektion zugeordnet, die als Indikation zur Granulozytentransfusionen betrachtet werden kann. Bei Überschneidungen von verschiedenen Infektionen wurde mittels des zeitlichen Auftretens der Befunde, des klinischen Verlaufs und der im Vordergrund stehenden Symptomatik eine Infektion als dominierend bewertet und zur Einteilung herangezogen. Zur Auswertung der Transfusionsdaten wurden die Patienten nach ihren Infektionen zum Zeitpunkt der Indikationsstellung zur Granulozytentransfusionen in folgende Gruppen eingeteilt: • Bakterielle Pneumonie und Pneumonie ohne Erregernachweis (POE) • Bakterielle Sepsis • CRP-Anstieg unbekannter Genese (CUO, CRP of unknown origin)5 • Fieber unbekannter Genese (FUO) • Mykotischen Infektionen Da sich diese Arbeit auf die Therapie schwerer Infektionen in der Neutropenie konzentriert, wurden die Daten der Patienten mit der Indikation CUO oder FUO zur Granulozytentransfusionen von der detaillierten Auswertung ausgeschlossen. CRP-Verlauf Als ein laborchemischer Parameter um den Verlauf einer Infektion unter Granulozytentransfusionen darzustellen, wurde das C-reaktive Protein gewählt. An der Universität Freiburg wurde der Referenzbereich dieses Entzündungsparameters mit 0 - 0,5 mg/dl angegeben. Ausgangspunkt der Verlaufsbeschreibung war der zuletzt gemessene CRP-Wert vor der ersten Transfusion (in den meisten Fällen ca. 4 - 8 Stunden vor der Transfusion). Als Endpunkt wurde der am dritten Tag nach der letzten Granulozytentransfusionen gemessene CRP-Wert gewählt, unabhängig davon, ob der Patient eine oder mehrere Transfusionen erhalten hatte. Konnte bei einem Patienten dieser Wert aus diversen Gründen nicht ermittelt werden (Tod, kurzfristige Entlassung oder Verlegung, Fehlmessung, etc.), so wurde der nach der letzten Transfusion zuletzt dokumentierte Wert zur Datenauswertung herangezogen. Um eine über5 Hausintern wird bei einem deutlichen Anstieg des CRP unter Ausschluss sonstiger Ursachen, auch ohne Fieber von einer Infektion ausgegangen und antiinfektiös behandelt. 2 Patienten, Spender und Methoden 41 sichtliche Darstellung des CRP-Verlaufs zu erhalten, wurde aus den jeweiligen Datenreihen der Median berechnet und dieser graphisch dargestellt. Das Signifikanzniveau des medianen CRP-Abfalls wurde mit Hilfe des t-Tests für verbundene Stichproben berechnet. Endogene hämatopoetische Regeneration Von einer endogenen hämatopoetischen Regeneration wurde ausgegangen, wenn im Blut der Patienten an drei oder mehr aufeinander folgenden Tagen ein kontinuierlicher Leukozytenwert von ≥ 1.000/µl gemessen werden konnte und dieser Anstieg nicht auf direkt transfusionsbedingte Ereignisse zurückzuführen war. Überleben als Indikator für den Transfusionserfolg Für die Auswertung der Daten und den Vergleich mit Ergebnissen aus der Literatur wurde das Überleben an Tag 30 nach der ersten Granulozytentransfusion als Indikator für ein positives Ansprechen und somit für den Transfusionserfolg gewertet. Die Berechnung der Überlebenszeiten bzw. der Überlebenswahrscheinlichkeit erfolgte mit der Kaplan-Meier-Methode. 2.3.5 Datenerfassung und Statistik Der Beobachtungszeitraum beginnt am 1. Januar 1996 und endet am 31. Dezember 2003. Zur Datenerhebung dienten die Patientenakten und die elektronische Patientendatenverwaltung (PDV) Freiburg sowie das Arztbriefsystem der Kinderklinik und der Abteilung Hämatologie und Onkologie der Universitätsklinik Freiburg. Bis auf wenige noch nicht mikroverfilmte Patientenakten, sind alle Daten und Datenverwaltungsprogramme über das klinikinterne Bearbeitungsprogramm Medoc® abrufbar. Zur Erfassung und Auswertung aller stattgefundenen Leukapheresen dienten außerdem die Daten der Metreon Bioproducts GmbH® mit dem Tochterunternehmen Cell Genix®. Die statistische Auswertung der gewonnenen Daten erfolgte mit Hilfe von Microsoft® Excel XP Professional und Graph Pad Prism® Version 4.00. Zur Untersuchung auf Signifikanz kamen dabei je nach Größe und Verteilung der Stichproben folgende Testverfahren zur Anwendung: der t-Test, der Wilcoxon-Test und der U-Test nach Mann, Withney und Wilcoxon. Der dabei ermittelte p-Wert gibt an, auf welchem Niveau sich das signifikante Ergebnis ein- 2 Patienten, Spender und Methoden 42 stellt und ermöglicht so eine aussagekräftige Beschreibung der Testergebnisse. Das Signifikanzniveau wurde auf 5 % festgelegt. Stammten die Daten aus größeren Stichproben mit normalverteilter Grundgesamtheit so wurden entweder der t-Test für unverbundene Stichproben (s. Kap. 3.1.2) oder der t-Test für verbundene Stichproben (s. Kap. 3.2.2) angewendet. Bei unbekannter Verteilung und kleiner Stichprobengröße wurden verbundene Stichproben mit Hilfe des Wilcoxon-Test (s. Kap. 3.3.2, 3.4.2, 3.5.2) und unverbundene Stichproben mit Hilfe des U-Test nach Mann-Whitney und Wilcoxon (s. Kap. 3.6.2, 3.6.3) auf Signifikanz untersucht. In Kapitel 3.1.3 wurden die erhobenen Daten in einem Korrelationsdiagramm dargestellt und es wurde neben dem p-Wert nach Pearson auch der Korrelationskoeffizient nach Spearmann bestimmt. Die graphische Darstellung der Überlebensverteilung der Patienten erfolgte mit Hilfe der Überlebenszeitkurve nach Kaplan-Meier in Form einer umgekehrten Summenhäufigkeitsfunktion. Nach dieser Methode wird für jeden Tag die Wahrscheinlichkeit errechnet, diesen lebend zu überstehen. Da in der hier vorliegenden Arbeit aufgrund der akut lebensbedrohlichen Infektionen v.a. das Kurzzeitüberleben von großem Interesse war, wurde zur besseren Übersicht die Zeitachse (x-Achse) zweigeteilt. Der erste Abschnitt geht von Tag 0 bis Tag 50 nach der ersten Granulozytentransfusion und ist in 10-Tage-Abständen skaliert, während der zweite Abschnitt bei Tag 50 beginnt und in 500-Tage-Abständen das Langzeitüberleben darstellt. Zur Untersuchung auf Signifikanz von verschiedenen Überlebenszeitkurven untereinander (s. Kap. 3.2.4, 3.6.1, 3.6.4) kam der Logrank-Test zur Anwendung. 43 3 Ergebnisse 3 Ergebnisse 3.1 Spender und Leukapherese 3.1.1 Leukapheresen pro Spender und Blutbildveränderungen Für die im Beobachtungszeitraum untersuchten 232 Granulozytentransfusionen stellten sich aus dem näheren Umfeld der Patienten insgesamt 90 Spender freiwillig zur Verfügung. Das Durchschnittsalter zum Zeitpunkt der ersten Leukapherese lag bei 39 Jahren (SD ± 12). Aus Tabelle 3.1 wird ersichtlich, dass der größte Teil der Spender (93,3 %) ein- bis viermal zur Gewinnung von Granulozytenkonzentraten herangezogen wurde, während fünf oder mehr Leukapheresen pro Spender eher die Ausnahme waren (6,7 %). Tabelle 3.1 Leukapheresen pro Spender Spender für Erwachsene Spender für Kinder Gesamt Spender mit 1 Leukapherese 25 3 28 Spender mit 2 Leukapheresen 25 2 27 Spender mit 3 Leukapheresen 12 2 14 Spender mit 4 Leukapheresen 15 - 15 Spender mit 5 Leukapheresen - 2 2 Spender mit 6 Leukapheresen 1 - 1 Spender mit 8 Leukapheresen 1 - 1 Spender mit 11 Leukapheresen 1 - 1 Spender mit 13 Leukapheresen 1 - 1 Median Leukapheresen/Spender 2 2 2 1-13 1-5 1-13 Range Wie bereits in Kapitel 2.2 beschrieben, wurden alle Spender vor jeder Behandlung mit G-CSF und der anschließenden Leukapherese mittels klinischer Untersuchung und verschiedener Labortests auf Spendertauglichkeit überprüft. Die Werte des Blutbildes wurden dabei sowohl vor als auch nach jeder Granulozytensammlung analysiert und sind in Tabelle 3.2 dargestellt. Bei zwei Leukapheresen fehlten die Angaben der Blutwerte sowohl vor als auch nach der Spende, bei 13 Weiteren wurden die nach der Zellsammlung gemessenen Werte nicht dokumentiert. 44 3 Ergebnisse Neben dem zu erwartenden Abfall der Leukozyten im Blut der Spender nach der Leukapherese konnten teilweise auch recht deutliche Veränderungen sowohl bei der Zahl der Erythrozyten und der Thrombozyten als auch beim Hämoglobinwert gemessen werden. Bei einem Patienten musste der von 177.000/µl auf 33.400/µl gefallene Thrombozytenwert nachträglich auf Station noch einmal kontrolliert werden. Bei zwei Spendern musste die Leukapherese im Verlauf aufgrund von Zuflussstörungen abgebrochen und später wiederholt werden. Dadurch verringerte sich der Ausgangswert der Leukozyten im Blut vor der Leukapherese von 21.900/µl und 25.100/µl auf 16.100/µl und 22.000/µl. Bei einer Spenderin musste die Leukapherese nach Verarbeitung von 5,2 Litern Blut vorzeitig aufgrund eines zu niedrigen Hämoglobinwertes (9,1 g/dl) abgebrochen werden, da dieser von ihr nicht toleriert wurde. Neben diesen Komplikationen und den teils nicht unerheblichen Blutbildveränderungen wurden keine weiteren Nebenwirkungen bei den Spendern dokumentiert. Tabelle 3.2 Blutbild der Spender vor und nach der Leukapherese (Median/Range) Spender für Erwachsene Spender für Kinder Gesamt 34,6 (10,7 - 85,4) 22,0 (7,2 - 65,2) 34,3 (24-57,7) 24,1 (16,8-45,1) 34,6 (10,7-85,4) 22,3 (7,2-65,2) 4,4 (3,3-5,6) 3,8 (2,8-4,9) 4,8 (4,0-5,7) 4,2 (3,4-4,8) 4,5 (3,3-5,7) 3,8 (2,8-4,9) 13,1 (9,6-17,1) 11,3 (8,3-15,4) 14,3 (12,2-16,7) 12,8 (10,2-14,3) 13,2 (9,6-17,1) 11,5 (8,3-15,4) 228,0 (104-440) 192,5 (33,4-362) 211,0 (145-281) 176,0 (92,8-240) 226,5 (104-440) 191,0 (33,4-362) Leukozyten (x 103/µl) Prä (n=230) Post (n=217) Erythrozyten (x 106/µl) Prä (n=230) Post (n=217) Hämoglobin (g/dl) Prä (n=230) Post (n=217) Thrombozyten (x 103/µl) Prä (n=230) Post (n=217) 45 3 Ergebnisse 3.1.2 Bestandteile des Leukapheresats Die 232 Leukapheresen wurden anhand ihres Volumens und der verschiedenen zellulären Bestandteile analysiert. Bei zwei Leukapheresen fehlten jegliche Angaben über das gewonnene Produkt, bei neun Weiteren fehlten verschiedene Angaben über die zellulären Bestandteile. Tabelle 3.3 Volumen und zelluläre Bestandteile der Leukapheresate (Median/Range) für Erwachsene für Kinder Gesamt 274 (50-446) 189 (92-316) 267,5 (50-446) Leukozyten (x 1010) 4,69 (0,3-11,28) 2,36 (0,18-6,41) 4,62 (0,18-11,28) Granulozyten (x 1010) 3,74 (0,01-10,39) 1,27 (0,05-5,56) 3,59 (0,01-10,39) 15,02 (0-50,88) 13,72 (0-71,04) 15,00 (0-71,04) Volumen (ml) Thrombozyten (x 1010) Im Durchschnitt konnten 253,3 ml (SD ± 70,7 ml) durch die Leukapherese gewonnen werden. Das arithmetische Mittel der darin enthaltenen Thrombozyten betrug 16,55 x 1010 (SD ± 10,08 x 1010), das der Leukozyten 4,67 x 1010 (SD ± 2,53 x 1010). Die entsprechenden medianen Werte sind in Tabelle 3.3 wiedergegeben und die weitere Differenzierung der Leukozyten ist in Abbildung 3.1 graphisch dargestellt. % Eosinophile; 0,4 % Monozyten; 9,9 % Basophile; 0,3 % Lymphozyten; 22,3 % Neutrophile; 67,1 Abb. 3.1 Differenzierung der Leukozyten im Leukapheresat (Prozentangaben der jeweiligen Mittelwerte) 46 3 Ergebnisse Durch den ab 1999 veränderten Sedimentationsbeschleuniger (s. Kap. 2.3.2) konnte der Gewinn an Granulozyten und somit der Reinheitsgrad der Konzentrate signifikant gesteigert werden (p < 0,0001). Während bis 1999 im Schnitt 1,30 x 1010 Granulozyten pro Leukapheresat gewonnen wurden (SD ± 1,26 x 1010; Median 0,93 x 1010; Range 0,01 - 6,93 x 1010), konnte dies durch die Umstellung auf durchschnittlich 5,11 x 1010 Granulozyten pro Leukapheresat Granulozyten/Leukapheresat x 1010 (SD ± 1,82 x 1010; Median 4,83 x 1010; Range 1,12 - 10,39 x 1010) gesteigert werden. 12.5 10.0 7.5 5.0 2.5 0.0 vor 1999 (n=92) ab 1999 (n=136) Leukapheresen Abb. 3.2 Gewonnene Granulozyten pro Leukapheresat vor und ab 1999 3.1.3 Verhältnis zwischen Spender-Leukozytenzahl und Ertrag Setzt man die im Rahmen der Leukapherese gewonnenen Leukozyten in Relation zu den Leukozytenwerten der Spender vor der Zellsammlung, so zeigt sich ein leichter, allerdings nicht signifikanter Trend hinsichtlich steigender Zellzahlen. Unter Berücksichtigung, dass 1999 an der Universitätsklinik Freiburg der Sedimentationsbeschleuniger verändert wurde (s. Kap. 2.3.2), zeigt sich bei der Darstellung der o.g. Werte der Spender nach 1999 eine signifikante Korrelation nach Pearson (p < 0,0001; Korrelationskoeffizient r = 0,6299). In Abbildung 3.3 ist dieser Zusammenhang anhand einer Regressionsgerade (y = 1,2724 x + 18,639) graphisch dargestellt. 47 3 Ergebnisse WBC pro Leukapheresat (x 109) 120 100 80 60 40 20 0 0 10 20 30 40 50 60 70 Spender-WBC vor Leukapherese (x 103/µl) Abb. 3.3 Spender-WBC im Verhältnis zu gewonnenen WBC ab 1999 3.2 Patienten und Granulozytentransfusionen 3.2.1 Indikationen Im Folgenden werden die Daten von insgesamt 232 therapeutischen Granulozytentransfusionen, die zwischen 1996 und 2003 stattgefunden haben, dargestellt. Bei 17 erwachsenen Patienten wurde die Indikation zur Granulozytentransfusion aufgrund einer bakteriellen Pneumonie (n = 5) oder einer Pneumonie ohne Erregernachweis (n = 12) gestellt, bei 17 Patienten aufgrund einer bakteriellen Sepsis. 21 Patienten erhielten Granulozytentransfusionen, da bei Ihnen in der Phase der Neutropenie eine lebensbedrohliche mykotische Infektion diagnostiziert wurde, davon 16 Patienten mit invasiv-pulmonaler Aspergillose (8 CDI; 8 MDI) und je ein Patient mit einer cerebralen Aspergillose, einer CandidaPneumonie, einer Candida-Sepsis, einer Mucormykose und einem mykotischen Leberbefall (CDI). Bei acht Patienten konnte trotz eines lebensbedrohlichen klinischen Zustandes weder mikrobiologisch noch klinisch eine Infektion nachgewiesen werden, und die Granulozytentransfusionen wurden unter der Indikation FUO (n = 4) oder CUO (n = 4) durchgeführt. Bei den Kindern verteilten sich die Infektdiagnosen wie folgt: vier Pilzinfektionen (mikrobiologisch gesicherte invasiv-pulmonale Aspergillosen), zwei bakterielle Septikämien, eine Pneumonie ohne Erregernachweis und einmal FUO. Abbildung 3.4 zeigt die Verteilung der Granu- 48 3 Ergebnisse lozytentransfusionen auf die verschiedenen Indikationsgruppen. Dabei ist anzumerken, dass ein Patient, bei dem eine Pilzinfektion diagnostiziert wurde (klinisch gesicherte invasivpulmonale Aspergillose), 25 Granulozytentransfusionen innerhalb von zwei Monaten erhalten hat und sich daher in dieser Indikationsgruppe das Verhältnis von Patienten zu Granulozytentransfusionen deutlich in Richtung der Transfusionen verschiebt. 120 101 Anzahl Patienten und GTx 100 80 54 51 60 40 18 25 19 20 26 9 0 Bakt. Pneumonie & POE Bakt. Sepsis Pilzinfektionen CUO / FUO Infektionen Patienten (Gesamt n=71) GTx (Gesamt n=232) Abb. 3.4 Verteilung der GTx auf die Indikationsgruppen Die Ursache der Neutropenie konnte retrospektiv bei einem der 63 Patienten nicht eruiert werden. Während acht Patienten (12,7 %) aufgrund Ihrer hämatologischen Grunderkrankung neutropen waren, war bei 43 Patienten (68,3 %) eine vorausgegangene Chemotherapie die Ursache. Bei elf Patienten (17,5 %) wurden die Infektionen in der Neutropenie nach autologer (n = 7) oder allogener (n = 4) Stammzelltransplantation diagnostiziert, wobei vier Patienten bereits vor der Transplantation neutropen waren und die Indikation zur Granulozytentransfusion sowohl vor als auch nach der Stammzellgabe gestellt wurde. Von den acht Kindern, die Granulozytentransfusionen erhalten haben, waren fünf (62,5 %) aufgrund einer vorausgegangenen Chemotherapie neutropen. Bei den anderen drei Patienten (37,5 %) fand die Transfusion im Rahmen einer Infektion in der Phase der Neutropenie nach allogener Stammzelltransplantation statt. 49 3 Ergebnisse 3.2.2 Leukozytenanstieg nach Granulozytentransfusion Der mediane Leukozytenanstieg und der weitere Verlauf der Leukozyten innerhalb der ersten 18 Stunden nach Granulozytentransfusion sind in Abbildung 3.5 dargestellt. Die Werte eines Patienten, der vier Granulozytentransfusionen erhalten hatte, wurden in diesem Diagramm nicht berücksichtigt, da bei ihm aufgrund eines leukämischen Schubes über 100.000 Leukozyten pro Mikroliter gemessen wurden. Ausgehend von 0,3 x 103 Leukozyten pro Mikroliter (Median; Range 0,1 - 15,4 x 103 /µl) stiegen die im Blut der Patienten gemessenen Leukozyten signifikant (p < 0,001) innerhalb der ersten 3 - 6 Stunden nach der Transfusion im Median auf einen maximalen Wert von 0,8 x 103 /µl (Range 0,1 - 13,0 x 103 /µl) an. Am nächsten Morgen, entsprechend 14 - 18 Stunden nach der Transfusion, wurde eine mediane Leukozytenzahl in Höhe von 0,6 x 103 /µl (Range 0,1 - 11,5 x 103 /µl) gemessen. Die vereinzelt recht hohen Leukozytenwerte erklären sich zum einen durch den Effekt vorangegangener Granulozytentransfusionen und zum anderen durch einen Anstieg leukämischer Zellen. 1,0 0,9 0,8 3 WBC (x 10 /µl) 0,7 0,6 0,5 0,4 0,3 0,2 0,1 0,0 prä GTx (n=204) 0-3 (n=55) 3-6 (n=108) Zeit nach GTx (h) Abb. 3.5 Medianer Leukozytenanstieg nach GTx 14-18 (n=204) 50 3 Ergebnisse In Abbildung 3.6 ist mit Hilfe eines Box- und Whiskerdiagramms noch einmal der Leukozytenanstieg nach Transfusion dargestellt. Allerdings wurden in dieser Darstellung nur diejenigen Patienten berücksichtigt, die vor der ersten Transfusion 1.000 oder weniger Leukozyten pro Mikroliter Blut hatten. Durch diese Zensierung der Patienten konnte die Streubreite der Daten zum Teil deutlich reduziert werden und es zeigte sich auch hier, ausgehend von den Werten vor den Transfusionen, ein signifikanter Anstieg der Leukozyten (p < 0,0001). Der mediane Ausgangswert der Leukozyten vor den 23 Transfusionen, die bei insgesamt acht Kindern und Säuglingen durchgeführt wurden, lag bei 0,4 x 103 /µl (Range 0,0 - 1,5 x 103 /µl). Hier wurde der maximale mediane Wert in Höhe von 0,5 x 103 /µl (Range 0,3 - 2,6 x 103 /µl) bereits innerhalb der ersten drei Stunden nach der Transfusion gemessen. 6 Leukozyten (x 10³/µl) 5 4 3 2 1 0 prä GTx (n=174) 0-3 (n=53) 3-6 (n=99) 14-18 (n=173) Zeit nach GTx (h) Abb. 3.6 Leukozytenanstieg nach GTx bei Patienten mit WBC ≤ 1.000/µl vor 1. GTx 3.2.3 Nebenwirkungen Im Allgemeinen wurden die Granulozytentransfusionen von den Empfängern problemlos toleriert und nur in wenigen Fällen wurden Nebenwirkungen beschrieben. Bei einer Patientin (#7) kam es nach der ersten Granulozytentransfusionen zur Antikörperbildung, so dass die geplante zweite Granulozytentransfusionen abgesagt werden musste und 3 Ergebnisse 51 keine weiteren stattfinden konnten. Bei einem weiteren Patienten, und zwar einem Kind, bei dem die Indikation zur Granulozytentransfusion aufgrund der Diagnose FUO gestellt wurde, kam es im Rahmen von drei durchgeführten Granulozytentransfusionen zum Auftreten von antithrombozytären Antikörpern. Ein Patient (#4) entwickelte während der sechsten Granulozytentransfusion eine anaphylaktische Reaktion mit Schüttelfrost und Dyspnoe, die aber unter medikamentöser Behandlung gut therapierbar war. Im Zusammenhang mit Granulozytentransfusionen bzw. dem damit verbundenen Leukozytenanstieg im Rahmen der hämatopoetischen Regeneration wurde bei drei erwachsenen Patienten (#13; #47; #48) und einem Kind, einem neunjährigen Jungen mit ALL, ein Capillary-Leak-Syndrom diagnostiziert. Während bei den drei erwachsenen Patienten der Zustand unter intensivmedizinischen Maßnahmen stabilisiert und verbessert werden konnte, kam es bei dem Jungen aufgrund zusätzlich progredienter pneumonischer Infiltrate (V.a. invasiv-pulmonale Aspergillose) und dem radiologischen Verdacht auf ein beginnendes parapneumonisches ARDS zu einem letalen Ausgang. Wie bereits in Kapitel 2.2 erwähnt, erhielt eine CMV-negative Patientin, ein 15-jähriges Mädchen mit einer ALL, aufgrund einer rasch progressiven Aspergillose und einem fehlenden CMV-negativen Spender insgesamt drei Granulozytenkonzentrate von einem CMV-positiven Spender. Trotz einer antiviralen Prophylaxe zeigte die Patientin 24 Tage nach der letzten Transfusion Symptome einer sich entwickelnden CMV-Infektion, die letztlich zu einer weiteren Verschlechterung der durch die Lungenaspergillose vorgeschädigten pulmonalen Situation und damit zum Tode der jungen Patientin führte. Des Weiteren konnten auch bei dieser Patientin Antikörper gegen Granulozyten nachgewiesen werden. 3.2.4 Überleben Die graphische Darstellung nach Kaplan-Meier in Abbildung 3.7 zeigt die Überlebenswahrscheinlichkeit nach der ersten Granulozytentransfusion für alle Patienten, die als supportive Therapie einer lebensbedrohlichen Infektion in der Neutropenie Granulozyten erhalten hatten. Dabei lag die Wahrscheinlichkeit, den Tag 30 nach der ersten Granulozytentransfusion zu überleben, für einen erwachsenen Patienten bei 66,7 %, bei einem Kind bei 50 %. Die mediane Überlebenszeit für einen Erwachsenen betrug 102 Tage (Range 0,5 - 2598 Tage), die für ein Kind 33 Tage (Range 1 - 1905). Im Logrank-Test zeigte sich beim Vergleich der zwei Kurven kein statistisch signifikanter Unterschied (p = 0,9851). 52 3 Ergebnisse 100 Überleben (%) 80 60 40 20 0 0 10 20 30 40 50 500 1500 2500 Zeit (Tage) Erwachsene (n=63) Kinder (n=8) Abb. 3.7 Gesamtüberleben nach 1. GTx 3.3 Granulozytentransfusionen bei bakterieller Pneumonie oder Pneumonie ohne Erregernachweis 3.3.1 Patientencharakteristika und klinischer Verlauf Bei 17 erwachsenen Patienten wurde die Indikation zur Granulozytentransfusion aufgrund einer schweren bakteriellen Pneumonie oder einer Pneumonie, bei der zumindest initial kein Erreger nachgewiesen werden konnte, gestellt. In fünf Fällen konnte bereits vor der Transfusion mindestens ein Erreger nachgewiesen werden, bei vier weiteren Patienten gelang dies erst im Verlauf, während bei acht Patienten zu keiner Zeit eine Keimidentifikation gelang. Einen Überblick über Grunderkrankung, Infektion und klinischen Verlauf gibt Tabelle 3.4. Innerhalb dieses Patientenkollektivs konnte bei sieben Patienten (41,2 %) innerhalb von fünf Tagen nach der letzten Granulozytentransfusion an drei oder mehr aufeinander folgenden Tagen ein kontinuierlicher Leukozytenwert von ≥ 1.000/µl gemessen werden, so dass davon ausgegangen wurde, dass diese Patienten hämatopoetisch regeneriert hatten. 53 3 Ergebnisse Tabelle 3.4 Patienten mit bakterieller Pneumonie oder Pneumonie ohne Erregernachweis Patienten Alter (Jahre) Geschlecht Diagnose #1 54 m AML #2 54 m #3 55 #4 Anzahl GTx Indikation zur GTx Klinischer Verlauf Häm. Reg. bis 5 Tage nach letzter GTx Überleben 30 Tage nach 1. GTx 1 Aspirationspneumonie (Enterococcus faecalis) Stabiler Verlauf und regrediente Infiltrate + + AML 2 POE nach allogener KMT Im Verlauf Rückgang von Infiltraten und CRP, aber rezidivierende Fieberschübe - - m NHL 2 Legionellen-Pneumonie Verschlechterung; progrediente Infiltrate; fünf Tage nach letzter GTx gestorben - - 59 m AML 6 POE; später Pseudomonas aeruginosa Initial regrediente Infiltrate; stabiler Verlauf; anaphylaktische Reaktion während 6. GTx - + #5 42 m HL 3 POE; im Verlauf Nachweis von Klebsiellen/Staphylokokken, radiologischer V.a. pulmonale Aspergillose Regrediente Infiltrate; zusätzlich Candida-Sepsis; Obduktion: erfolgreich therapiertes Aspergillom; chronisch organisierende aber auch infarktoide Pneumonieherde + - #6 33 w CML 1 POE Progrediente Infiltrate; Obduktion: Pilzmyokarditis; Influenza- und Aspergillus-Pneumonie - - #7 65 w CML 1 Bakterielle Mischpneumonie Deutliche Befundbesserung; Bildung von Antikörper gegen Granulozyten + + #8 66 m AA 1 POE Deutliche Befundbesserung; 14 Tage nach GTx kein sicherer Infiltratnachweis im CT - + #9 63 w AML 4 POE; im Verlauf V.a. pulmonale Aspergillose Deutlicher Rückgang der pulmonalen Symptomatik und der Infektparameter + + #10 77 m AML 3 POE Deutlicher Rückgang der pulmonalen Infiltrate und stabiler pulmonaler Verlauf; tiefes, zerebrales Koma; - - #11 58 m AML 4 Bakterielle Pneumonie (Entero-, Staphylokokken) Weitgehende Infiltratrückbildung und Rückgang der Infektparameter + + #12 32 m AML 8 POE; im Verlauf Nachweis von Aspergillus Progrediente und neue Infiltrate; Rückgang unklarer Leberherde (CT); im Verlauf bakterielle Sepsis; letztlich nicht beherrschbare Infektsituation (39 Tage nach 1. GTx) + + #13 63 m AML 1 POE; im Verlauf Nachweis von Aspergillus Intubation bei Capillary-Leak-Syndrom nach GTx; zögerliche Besserung der Infektsituation - + #14 35 w ALL 3 POE CRP initial rückläufig; Infiltrate unverändert; letztlich nicht beherrschbare Infektsituation - - #15 30 m CML 2 Bakterielle Pneumonie (Enterokokken, Pseudomonas aeruginosa) Initial regrediente Infiltrate und Stabilisierung der Beatmungssituation; 7 Tage nach 1. GTx an multiresistenter Pseudomonas-Pneumonie gestorben - - #16 50 m AML 4 POE Im Verlauf CRP langsam rückläufig; nach initialer Infiltratregredienz neue, teils progrediente Infiltrate; ein Monat nach letzter GTx deutliche Rückbildung der Infiltrate - + #17 56 w AML 4 POE; im Verlauf V.a. pulmonale Aspergillose CRP rückläufig und stetige Besserung des klinischen Zustandes + + Erwachsene AA, aplastische Anämie, ALL, akute lymphatische Leukämie; AML, akute myeloische Leukämie; CML, chronische myeloische Leukämie; CRP, C-reaktives Protein; CT, Computertomographie; GTx, Granulozytentransfusion; HL, Hodgkin Lymphom, KMT, Knochenmarktransplantation; m, männlich; NHL, NonHodgkin-Lymphom; POE, Pneumonie ohne Erregernachweis; V.a., Verdacht auf; w, weiblich 3 Ergebnisse 54 Die radiologischen Kontrollen nach Granulozytentransfusion ergaben bei acht Patienten (47,1 %) eine zum Teil recht deutliche Befundregredienz, während bei drei Patienten (17,6 %) ein Progress der pulmonalen Infiltrate beobachtet wurde. Retrospektiv konnte bei sechs Patienten keine definitive Aussage bezüglich des radiologischen Verlaufes gemacht werden. Gründe hierfür waren unklare oder schwankende Befundangaben oder fehlende Verlaufskontrollen bei entsprechender klinischer Situation. Ein Junge, ca. 18 Monate alt, mit einer diagnostizierten Histiozytose, erhielt ebenfalls aufgrund einer Pneumonie ohne Erregernachweis einmalig eine Granulozytentransfusion. In den Tagen nach der Transfusion kam es jedoch zu einer deutlichen Verschlechterung des klinischen Zustandes mit zunehmender pulmonaler Infiltration, einer ausbleibenden hämatopoetischen Regeneration, und es wurde noch vor seinem Tod der Verdacht auf ein parapneumonisches ARDS gestellt. 3.3.2 CRP-Verlauf nach Transfusion Von den 17 Patienten mit einer bakteriellen Pneumonie oder einer Pneumonie ohne initialen Erregernachweis konnte nur bei einer Patientin (#6) der CRP-Verlauf nicht dargestellt werden, da diese bereits am Tag der ersten Transfusion an den Folgen der massiven Infektion in der Neutropenie verstorben war und somit dem vor der Transfusion gemessenen Wert kein Endwert zugeordnet werden konnte. Der mediane CRP-Wert vor der ersten Granulozytentransfusion lag in diesem Patientenkollektiv bei 24,3 mg/dl (Range 2,5 - 44,4 mg/dl) und fiel im Verlauf bis zum dritten Tag nach der letzten Transfusion auf 15,0 mg/dl (Range 1,9 36,1 mg/dl). Dieser signifikante CRP-Abfall (p = 0,0354) ist in Abbildung 3.8 graphisch dargestellt. Bei dem 18 Monate alten, an einer Histiozytose erkrankten Jungen fiel das CRP von initial 19,3 mg/dl nur sehr zögerlich auf 17,8 mg/dl innerhalb der drei Tage nach seiner Granulozytentransfusion. 55 3 Ergebnisse 30,0 25,0 CRP (mg/dl) 20,0 15,0 10,0 5,0 0,0 1.GTx (n=16) x. GTx + 3 d (n=16) Zeit Abb. 3.8 CRP-Verlauf (Median) bei Patienten mit bakterieller Pneumonie oder POE Um einen möglichen Einfluss der hämatopoetischen Regeneration einzelner Patienten auf den Verlauf des Entzündungsparameters herauszuarbeiten, wurden die CRP-Werte der Patienten, die bis zum dritten Tag nach ihrer letzten Granulozytentransfusion bereits hämatopoetisch regeneriert hatten, den Werten der restlichen Patienten gegenübergestellt. Auch hier wurden die jeweiligen Mediane berechnet und der Verlauf graphisch dargestellt (s. Abb. 3.9). Bei den vier Patienten mit hämatopoetischer Regeneration fiel das CRP im Verlauf von 27,0 mg/dl (Range 10,4 - 42,0 mg/dl) auf 14,3 mg/dl (Range 9,8 - 24,4 mg/dl). Demgegenüber kam es bei den 12 Patienten, die bis zum dritten Tag nach ihrer letzten Granulozytentransfusion noch nicht hämatopoetisch regeneriert hatten, zu einem medianen CRP-Abfall von 24,3 mg/dl (Range 2,5 - 44,4 mg/dl) auf 15,3 mg/dl (Range 1,9 - 36,1 mg/dl). Beide CRP-Abfälle sind in dieser Subanalyse nichtsignifikant (p > 0,05) und auch der Vergleich beider Geraden untereinander zeigt keinen signifikanten Unterschied. 56 3 Ergebnisse 30,0 25,0 CRP (mg/dl) 20,0 15,0 10,0 5,0 0,0 1. GTx x. GTx + 3 d Zeit häm. Reg. (n=4) keine häm. Reg. (n=12) Abb. 3.9 CRP-Verlauf (Median) bei Patienten mit und ohne hämatopoetischer Regeneration 3.3.3 Überleben nach Transfusion Das mediane Überleben der erwachsenen Patienten (n = 17), die in der Phase der Neutropenie Granulozytentransfusionen aufgrund einer schweren bakteriellen Pneumonie oder einer Pneumonie mit fehlendem Erregernachweis erhalten haben, lag bei 57 Tagen (Range 0,5 1485 Tage). Die Wahrscheinlichkeit, 30 Tage nach der ersten Granulozytentransfusionen noch am Leben zu sein, betrug 58,8 %. Somit konnte bei zehn Patienten mit Hilfe der Granulozytentransfusionen die kritische Phase der Neutropenie überbrückt und die das Leben bedrohende Infektion therapiert werden. Von den sieben Patienten, die bis zu diesem Zeitpunkt gestorben waren, erlag ein Patient (#10) aller Wahrscheinlichkeit nach den direkten Folgen seiner hämatologischen Grunderkrankung, während fünf Patienten (#3, #5, #6, #14, #15) das infektiöse Geschehen in der Neutropenie nicht überlebten. Bei einem Patienten (#2) konnte die unmittelbare Todesursache nicht eruiert werden. Abbildung 3.10 zeigt die graphische Darstellung der nach der Kaplan-Meier-Methode berechneten Überlebenskurve. Das Kind, mit der Diagnose einer Histiozytose und einer Pneumonie ohne Erregernachweis in der Phase der Neutropenie nach allogener Transplantation, starb elf Tage nach der Transfusion an den direkten Folgen seiner Infektion. 57 3 Ergebnisse 100 Überleben (%) 80 60 40 20 0 0 10 20 30 40 50 500 1000 1500 Zeit (Tage) Abb. 3.10 Überleben nach 1. GTx bei bakterieller Pneumonie oder POE (n = 17) 3.4 Granulozytentransfusionen bei bakterieller Sepsis 3.4.1 Patientencharakteristika und klinischer Verlauf 17 erwachsenen Patienten, bei denen in der Phase der Neutropenie eine lebensbedrohliche bakterielle Sepsis klinisch im Vordergrund stand, wurden insgesamt 50 Granulozytenkonzentrate transfundiert. Während in 16 Fällen vor der Transfusion mindestens ein Erreger in der Blutkultur nachgewiesen werden konnte, war es bei einem Patienten (#25) nicht möglich einen Keim zu isolieren. Dennoch wurde auch bei ihm klinisch die Diagnose einer bakteriellen Sepsis gestellt, da an der Haut dieses Patienten multiple septische Streuherde, am ehesten durch Staphylokokken verursacht, gefunden wurden. Neben einer bakteriellen Sepsis konnte bei zehn Patienten (58,8 %) zusätzlich die Diagnose einer Pneumonie gestellt werden, davon in drei Fällen eine invasiv-pulmonale Aspergillose, die einmal klinisch (#32) und zweimal mikrobiologisch (#23, #26) gesichert wurde. Des Weiteren wurden bei einem Patienten (#33), entgegen dem in Kapitel 2.3.3 beschriebenen Prozedere, die Granulozyten vom Bruder (HLAidenter Stammzellspender) nicht bestrahlt, um einen GvL-Effekt durch die im Konzentrat befindliche Lymphyozytenpopulation zu ermöglichen. 58 3 Ergebnisse Tabelle 3.5 Patienten mit bakterieller Sepsis Patienten Alter (Jahre) Geschlecht Diagnose #18 34 w Mamma-Ca #19 40 m #20 17 #21 Anzahl GTx Indikation zur GTx Klinischer Verlauf Häm. Reg. bis 5 Tage nach letzter GTx Überleben 30 Tage nach 1. GTx 4 Multiresistente Enterokokken-Sepsis; später Candida glabrata in BK CRP langsam rückläufig; klinische Besserung bis zur vollständigen Erholung + + Agranulozytose 2 k.n. StaphylokokkenSepsis Intubation über 2 Monate; Stabilisierung und langsame, aber vollständige Erholung + + w AML 4 E. coli, Enterobacter cloacae, Enterococcus faecium, k.n. Staphylokokken-Sepsis Rückläufige Infektparameter und klinische Stabilisierung; vollständige Erholung - + 42 m AML 3 k.n. StaphylokokkenSepsis Klinische Stabilisierung; fremd-allogene KMT 3 Tage nach letzter GTx - + #22 33 m AML 2 k.n. StaphylokokkenSepsis Stabiler klinischer Verlauf; zusätzliche pneumonische Infiltrate im Verlauf regredient - + #23 37 m CML 6 k.n. StaphylokokkenSepsis Verschlechterung; V.a. pulmonale Aspergillose; 4 Tage nach letzter GTx gestorben + - #24 63 m NHL 4 E. coli-Sepsis Massiver Progress der Grunderkrankung; 2 Tage nach letzter GTx gestorben - - #25 30 w NHL 2 Multiple septische Streuherde an der Haut (CDI) CRP rückläufig; klinische Verbesserung + + #26 58 m NHL 2 Pseudomonas aeruginosa, Enterococcus faecium, k.n. Staphylokokken-Sepsis Verschlechterung; zusätzlich progrediente pulmonale Infiltrate; 6 Tage nach letzter GTx gestorben; Obduktion: invasiv-pulmonale Aspergillose - - #27 42 w AML 2 Streptokokken-Sepsis Langanhaltender Leukozyten- und Thrombozytenanstieg; deutliche klinische Verbesserung + + #28 56 w AML 2 Pseudomonas aeruginosa-Sepsis Klinische Stabilisierung und initialer CRP-Abfall - + #29 73 m MDS 2 Pseudomonas aeruginosa-Sepsis Rückläufige septische Konstellation; zusätzliche pulmonale Infiltrate regredient; Zeichen eines oligoanurischen Nierenversagens; Obduktion: beidseitige Candida-Pneumonie - - #30 63 w AML 4 k.n. StaphylokokkenSepsis Stabilisierung des klinischen Bildes und Rückgang der Infektparameter + + #31 31 m AML 3 E. coli-Sepsis Deutliche Verbesserung; CRP rückläufig; zusätzliche pulmonale Infiltrate regredient + + #32 54 m AML 3 E. coli-Sepsis Klinische Stabilisierung und rückläufiges CRP; V.a. pulmonale Aspergillose; im Verlauf regrediente pulmonale Infiltrate + + #33 35 m AML 2 k.n. StaphylokokkenSepsis Klinische Verbesserung, rückläufiges CRP + + #34 23 w AML 3 Enterococcus faeciumSepsis Zusätzliche pneumonische Infiltrate; nur kurzfristige Besserung des klinischen Zustands; Obduktion: chronisch karnifizierende, interstitielle Pneumonie ohne Erregernachweis - - Erwachsene ALL, akute lymphatische Leukämie; AML, akute myeloische Leukämie; ARDS, akutes Lungenversagen (adult respiratory distress syndrome); BK, Blutkultur; Ca, Karzinom (carcinoma); CDI, klinisch gesicherte Infektion (clinically documented infection); CML, chronische myeloische Leukämie; CRP, C-reaktives Protein; E. coli, Escherichia coli; GTx, Granulozytentransfusion; Häm.Reg., hämatopoetische Regeneration; KMT, Knochenmarktransplantation; k.n., koagulase-negativ; m, männlich; MDS, Myelodysplastisches Syndrom; NHL, Non-Hodgkin-Lymphom; V.a., Verdacht auf; w, weiblich 3 Ergebnisse 59 Bei neun der 17 Patienten (52,9 %) konnte innerhalb von fünf Tagen nach der letzten Granulozytentransfusion an drei oder mehr aufeinander folgenden Tagen ein kontinuierlicher Leukozytenwert von ≥ 1.000/µl gemessen werden, so dass davon ausgegangen wurde, dass diese Patienten hämatopoetisch regeneriert hatten. Von den zehn Patienten mit zusätzlichen pulmonalen Infiltraten zeigten 50 % eine eindeutige Befundbesserung in den radiologischen Kontrollaufnahmen nach Beendigung der Granulozytengabe. Bei den anderen fünf Patienten kam es entweder zu keiner signifikanten radiologischen Befundänderung oder aber sogar zu einer Verschlechterung der pulmonalen Situation. Zwei Kinder erhielten ebenfalls aufgrund einer lebensbedrohlichen bakteriellen Sepsis Granulozyten. Ein knapp zwei Jahre alter, an einem Neuroblastom erkrankter Junge erhielt zweimalig Granulozytenkonzentrate, nachdem bei ihm die Diagnose einer Klebsiellen-Sepsis in der Neutropenie gestellt wurde. Darunter kam es zu rückläufigen Infektparametern und zu einer deutlichen Besserung der klinischen Situation. Des Weiteren konnte bei ihm innerhalb von fünf Tagen nach der letzten Transfusion eine hämatopoetische Regeneration verzeichnet werden. Das andere Kind, ein neunjähriger Junge mit der Diagnose ALL, der an einer Staphylokokken-Sepsis und zusätzlich einer pulmonalen Aspergillose erkrankt war, konnte von den zwei Granulozytentransfusionen, die ihm verabreicht wurden nicht profitieren. Bei ihm kam es nach den Transfusionen zu einem Capillary-Leak-Syndrom und es wurde der Verdacht auf ein parapneumonisches ARDS gestellt. 3.4.2 CRP-Verlauf nach Transfusion Im Verlauf der zwei bis maximal sechs Granulozytentransfusionen, die bei den Patienten mit bakterieller Sepsis durchgeführt wurden, zeigte sich im Median ein signifikanter CRP-Abfall von initial 21,8 mg/dl (Range 0,5 - 50,4 mg/dl) auf 15,6 mg/dl (Range 0,6 - 56,7 mg/dl) bis zum dritten Tag nach der letzten Transfusion (p = 0,0386). Die Subanalyse dieses Patientenkollektivs hinsichtlich des CRP-Verlaufs und der hämatopoetischen Regeneration ergab bei den Patienten, die hämatopoetisch regeneriert hatten, einen nichtsignifikanten medianen CRP-Abfall von 21,8 mg/dl (Range 3,3 - 46,8 mg/dl) auf 3,2 mg/dl (Range 0,6 - 56,7 mg/dl). Demgegenüber ist das CRP bei den Patienten ohne Regeneration im Median von 22,1 mg/dl (Range 0,5 - 50,4 mg/dl) bis zum dritten Tag nach der letzten Granulozytentransfusion auf 16,1 mg/dl (Range 1,2 - 27,4 mg/dl) gefallen. Dieser Abfall erweist sich mit Hilfe des Wilcoxon-Tests als signifikant (p = 0,0273). Der Vergleich beider Geraden zeigt keinen signifikanten Unterschied. 60 3 Ergebnisse 30,0 25,0 CRP (mg/dl) 20,0 15,0 10,0 5,0 0,0 1.GTx (n=17) x.GTx + 3 d (n=17) Zeit Abb. 3.11 CRP-Verlauf (Median) bei Patienten mit bakterieller Sepsis 30,0 25,0 CRP (mg/dl) 20,0 15,0 10,0 5,0 0,0 1. GTx x. GTx + 3 d Zeit häm. Reg. (n=7) keine häm. Reg. (n=10) Abb. 3.12 CRP-Verlauf (Median) bei Patienten mit und ohne hämatopoetischer Regeneration 3 Ergebnisse 61 Im Blut des Jungen mit der Diagnose eines Neuroblastoms konnte vom Tag der ersten Granulozytentransfusion bis zum dritten Tag nach seiner zweiten und zugleich auch letzten Transfusion ein CRP-Rückgang von 5,6 mg/dl auf 2,6 mg/dl verzeichnet werden. Dem hingegen stieg das CRP bei dem neunjährigen Jungen von anfänglich 26,0 mg/dl um 15 mg/dl auf 41 mg/dl an. 3.4.3 Überleben nach Transfusion Das mediane Überleben der erwachsenen Patienten (n = 17), die Granulozytentransfusionen im Rahmen eines bakteriell-septischen Geschehens erhalten hatten, lag bei 163Tagen (Range 4 - 2508 Tage). 12 der insgesamt 17 erwachsenen Patienten profitierten insofern von den Granulozytentransfusionen, als dass die Infektion in der kritischen Phase der Neutropenie beherrscht werden konnte und sie auch 30 Tage nach der ersten Transfusion noch am Leben waren. Dies entspricht einer 30-Tage-Überlebenswahrscheinlichkeit von 70,6 %. Ein Patient (#24), der insgesamt vier Granulozytentransfusionen erhalten hatte, starb zehn Tage nach der ersten Granulozytentransfusion bei anhaltend hohen Infektparametern an den Folgen des massiven Progresses seiner Grunderkrankung, einem NHL. Die anderen vier Patienten, die 30 Tage nach der ersten Transfusion nicht mehr am Leben waren, starben an den direkten Folgen ihrer schweren Infektion. Ein Patient (#23) starb bei septischer Konstellation im Multiorganversagen. Bei drei Patienten konnte im Rahmen der Obduktion eine pulmonale Infiltration nachgewiesen werden, davon einmal eine invasiv-pulmonale Aspergillose (#26), einmal eine beidseitige Candida-Pneumonie und einmal eine chronisch karnifizierende, interstitielle Pneumonie ohne Erregernachweis (#34). Während es bei dem knapp zweijährigen Jungen mit der diagnostizierten Klebsiellen-Sepsis zu einer raschen Verbesserung des klinischen Bildes mit rückläufigen Infektparametern kam, verschlechterte sich der Zustand des neun Jahre alten Junge, der an einer StaphylokokkenSepsis und im Verlauf auch an einer invasiv-pulmonalen Aspergillose erkrankt war, zunehmend. Neben den bereits erwähnten Diagnosen kam es bei ihm zu einem Capillary-LeakSyndrom nach Granulozytentransfusion, und er starb fünf Tage nach der ersten, bzw. vier Tage nach der letzten Transfusion bei Verdacht auf ein parapneumonisches ARDS in der kardio-respiratorischen Insuffizienz. 62 3 Ergebnisse 100 Überleben (%) 80 60 40 20 0 0 10 20 30 40 50 500 1500 2500 Zeit (Tage) Abb. 3.13 Überleben nach 1.GTx bei bakterieller Sepsis (n = 17) 3.5 Granulozytentransfusionen bei Pilzinfektionen 3.5.1 Patientencharakteristika und klinischer Verlauf Im Beobachtungszeitraum erhielten 21 Patienten insgesamt 86 Granulozytentransfusionen aufgrund einer schweren Pilzinfektion in der Neutropenie. Wie bereits in Kapitel 3.2.1 beschrieben, war die am häufigsten gestellte Diagnose eine invasiv-pulmonale Aspergillose, die in acht von 16 Fällen nicht nur klinisch, sondern auch mikrobiologisch schon vor der ersten Transfusion nachgewiesen werden konnte. Während der Verdacht auf mykotische Leberabszesse bei einem Patienten (#53) bei fehlendem Erregernachweis nur klinisch mit Hilfe der Computertomographie und einer explorativen Laparoskopie geäußert werden konnte, gelang sowohl bei den Patienten mit Candida-Sepsis (#41) und cerebraler Aspergillose (#46), als auch bei den Patienten mit rhinocerebraler Mukormykose (#48) und Candida-Pneumonie (#50) der mikrobiologische Erregernachweis bereits vor der ersten Granulozytentransfusion. Bei elf der 21 Patienten mit mykotischen Infektionen (52,4 %) konnte innerhalb von fünf Tagen nach der letzten Granulozytentransfusion an drei oder mehr aufeinander folgenden Tagen 3 Ergebnisse 63 ein kontinuierlicher Leukozytenwert von ≥ 1.000/µl gemessen werden, so dass davon ausgegangen wurde, dass diese Patienten hämatopoetisch regeneriert hatten. Die radiologischen Kontrollen ergaben bei acht der 16 Patienten (50 %) mit invasivpulmonaler Aspergillose eine z.T. recht deutliche Befundbesserung. Bei einigen Patienten (s. Tab. 3.6) wurden letztlich nur noch narbig-streifige Veränderungen der Lunge beschrieben, so dass von einer vollständigen Abheilung ausgegangen wurde. Währen es bei drei Patienten (18,8 %) zu keiner signifikanten Befundänderung kam oder aber keine weiteren radiologischen Kontrollen dokumentiert wurden, verschlechterte sich der pulmonale Zustand bei fünf der 16 Patienten (31,25 %) auch nach der Gabe von Granulozytenkonzentraten. Eine mikrobiologisch gesicherte invasiv-pulmonale Aspergillose in der Neutropenie konnte bei vier Kindern diagnostiziert werden. Es handelte sich dabei um einen zwei Monate alten Säugling mit einer ALL, ein 12-jähriges Mädchen mit einer AML, ein 15-jähriges Mädchen mit einem ALL-Rezidiv und um einen 16 Jahre alten Jungen mit einem AML-Rezidiv. Während es bei dem Säugling bereits nach einer Granulozytentransfusion zu einer Stabilisierung mit rückläufigen Infektparametern und einem deutlichen Anstieg der Leukozyten kam, verschlechterte sich der Zustand des 12-jährigen Mädchens auch nach zehn Transfusionen zunehmend. Bei progredienten pulmonal-infiltrativen Prozessen zeigte die Patientin schließlich das Vollbild einer Aspergillus-Sepsis. Obwohl sich der klinische Zustand des 15-jährigen Mädchens nach drei Granulozytentransfusionen deutlich besserte, zeigten die radiologischen Kontrollen eine deutliche Befundprogredienz und zunehmende Einschmelzungen der pulmonalen Infiltrate. Anzumerken bleibt jedoch, dass die Patientin nach den Transfusionen der vom CMV-positiven Vater gewonnen Granulozyten an einer CMV-Infektion erkrankte und letztlich nicht geklärt werden konnte, ob die zunehmenden pulmonalen Infiltrate nicht durch diese Neuinfektion (mit-) bedingt waren. Der 16-jährige Junge starb bereits am Folgetag nach der ersten Transfusion im septischen Schock bei systemischer Aspergillose. 64 3 Ergebnisse Tabelle 3.6 Patienten mit Pilzinfektionen Patienten Alter (Jahre) Geschlecht Diagnose #35 67 m AML #36 29 w #37 32 #38 Anzahl GTx Indikation zur GTx Klinischer Verlauf Häm. Reg. bis 5 Tage nach letzter GTx Überleben 30 Tage nach 1. GTx 2 Invasiv-pulmonale Aspergillose Deutlicher Rückgang der pulmonalen Infiltrate; klinische Verbesserung + + AML 1 V.a. pulmonale und renale Aspergillose Verschlechterung; Obduktion: disseminierte invasive Aspergillose (Niere, Lunge) - - w CML 4 V.a. peritoneale/ pulmonale Aspergillose Rückgang der pulmonalen Infiltrate; rasche Besserung des klinischen Zustandes + + 59 w AML 1 Invasiv-pulmonale Aspergillose Konstante, konfluierende Infiltrate; 10 Tage nach GTx an akuter pulmonaler Blutung (Gefäßarrosion) gestorben + - #39 39 m HL 8 Invasiv-pulmonale Aspergillose Entfieberung nach 4. GTx; CRP rückläufig; deutliche Regredienz der Infiltrate im Verlauf + + #40 24 m AML 25 V.a. invasiv-pulmonale Aspergillose Klinische Verbesserung; deutliche Regredienz der Infiltrate --> narbige Residuen (CT) - + #41 39 m ALL 2 Candida albicans Fungämie Zunehmende Besserung; deutliche Rückbildung der zusätzlichen Infiltrate + + #42 71 m AML 2 V.a. invasiv-pulmonale Aspergillose Entfieberung 4 Tage nach letzter GTx; deutliche Besserung des klinischen Zustandes; konstante bis diskret regrediente Infiltrate + + #43 44 w AML 8 Invasiv-pulmonale Aspergillose Deutlicher Rückgang der pulmonalen Infiltrate und Besserung des klinischen Zustandes - + #44 54 m AML 7 V.a. invasiv-pulmonale Aspergillose Im Verlauf CRP rückläufig, deutliche Regredienz der Infiltrate --> narbige Residuen (CT) - + #45 52 m AML 2 V.a. invasiv-pulmonale Aspergillose Initial Stabilisierung der Infektkonstellation; im Verlauf konstante, teils progrediente Aspergilloseherde; Obduktion 35 Tage nach 1. GTx: Hirninfarkt rechts; Mukor-Pneumonie/-Myokarditis; V.a. Algeninfektion + + #46 46 w HL 1 Cerebrale Aspergillose Klinische Stabilisierung; folgende Liquordiagnostik wieder Aspergillus-negativ + + #47 48 w AA 4 V.a. invasiv-pulmonale Aspergillose Capillary-Leak-Syndrom nach 4. GTx; regrediente Infiltrate; CRP rückläufig + + #48 64 m MDS 1 Rhinocerebrale Mukormykose Konstanter cerebraler Abszessnachweis (CT); Verschlechterung des pulmonalen Status durch Capillary-Leak-Syndrom nach GTx und zusätzliches Infiltrat - + #49 72 w AML 3 Invasiv-pulmonale Aspergillose Befundverschlechterung; zusätzliche Infiltrate im Verlauf; 2 Tage nach letzter GTx gestorben - - #50 46 m AML 4 Candida albicans/krusei Pneumonie Initial leichte Besserung und CRP-Abfall; im Verlauf neu aufgetretene pulmonale Infiltrate (Klebsiellen), progredient septisches Geschehen (Candida glabrata Fungämie) - - #51 49 m AML 2 Invasiv-pulmonale Aspergillose Neue und progrediente pulmonale Infiltrate; progredientes septisches Geschehen; Obduktion: ARDS; Enterokokken Pneumonie - - #52 44 m AML 2 V.a. invasiv-pulmonale Aspergillose Deutlicher Leukozytenanstieg, CRP-Abfall; Stabilisierung - + #53 32 m AML 1 V.a. mykotische Leberabszesse Infektparameter rückläufig; deutliche Regredienz der Leberherde + + #54 65 w AML 3 Invasiv-pulmonale Aspergillose Klinische Verschlechterung und progrediente pulmonale Infiltrate - - #55 37 w AA 3 Invasiv-pulmonale Aspergillose Initial CRP rückläufig; konstante Infiltrate; im Verlauf rezidivierende Infekte + + Erwachsene AA, aplastische Anämie, ALL, akute lymphatische Leukämie; AML, akute myeloische Leukämie; ARDS, akutes Lungenversagen (adult respiratory distress syndrome); CML, chronische myeloische Leukämie; CRP, C-reaktives Protein; CT, Computertomographie; GTx, Granulozytentransfusion; Häm.Reg., hämatopoetische Regeneration; HL, Hodgkin Lymphom; m, männlich; MDS, myelodysplastisches Syndrom; V.a., Verdacht auf; w, weiblich 65 3 Ergebnisse 3.5.2 CRP-Verlauf nach Transfusion 30,0 CRP (mg/dl) 25,0 20,0 15,0 10,0 5,0 0,0 1.GTx (n=21) x.GTx + 3 d (n=21) Zeit Abb. 3.14 CRP-Verlauf (Median) bei Patienten mit Pilzinfektionen In Abbildung 3.14 ist der mediane CRP-Verlauf der 21 Patienten, denen aufgrund einer Pilzinfektion in der Neutropenie Granulozyten transfundiert wurden, dargestellt. Bei einem Patienten (#53) wurde am Tag der ersten und bei ihm auch zugleich der letzten Granulozytentransfusion kein CRP-Wert dokumentiert, so dass dem Ausgangswert zur Verlaufsbeschreibung die Messung vom Vortag zu Grunde gelegt wurde. Im Beobachtungszeitraum vom Tag der ersten Granulozytentransfusion bis zum dritten Tag nach der letzten Transfusion zeigte sich ein signifikanter medianer CRP-Abfall (p = 0,0031) von 23,5 mg/dl (Range 6,5 - 40,9 mg/dl) auf 13,9 mg/dl (Range 3,3 - 30,8 mg/dl). Bei differenzierter Betrachtung der Patienten mit und ohne hämatopoetischer Regeneration zeigte sich bei den Patienten, die regeneriert hatten, ein signifikanter medianer CRP-Abfall (p = 0,0020) von anfänglich 20,4 mg/dl (Range 14,4 - 40,9 mg/dl) auf 9,8 mg/dl (Range 3,3 21,7 mg/dl). Hingegen fiel das CRP bei den Patienten, bei denen es bis zum dritten Tag nach der letzten Transfusion noch nicht zu einer hämatopoetischen Regeneration gekommen war, im Median von 24,0 mg/dl (Range 6,5 - 33,2 mg/dl) auf 19,8 mg/dl (Range 4,1 - 30,8 mg/dl). Dies entspricht einem nichtsignifikanten Abfall des Entzündungsparameters. Der Vergleich beider Geraden zeigt einen signifikanten Unterschied (p = 0,0378). 66 3 Ergebnisse 30,0 25,0 CRP (mg/dl) 20,0 15,0 10,0 5,0 0,0 1. GTx x. GTx + 3 d Zeit häm. Reg. (n=10) keine häm. Reg. (n=11) Abb. 3.15 CRP-Verlauf (Median) bei Patienten mit und ohne hämatopoetischer Regeneration Während der 16-jährige Junge, der so wie drei weitere Kinder an einer invasiv-pulmonalen Aspergillose erkrankt war, bereits am Tag seiner ersten Granulozytentransfusion verstarb und es bei dem 12 Jahre alten Mädchen im Verlauf bis zu ihrem Tod am zweiten Tag nach der zehnten Transfusion zu einem CRP-Anstieg von 22,0 mg/dl auf 38,0 mg/dl kam, zeigten die zwei anderen Kinder einen recht deutlichen CRP-Rückgang. Bei dem Säugling, der bereits am ersten Tag nach seiner Granulozytentransfusion hämatopoetisch regenerierte, fiel das CRP bis zum dritten Tag nach der Transfusion von initial 7,2 mg/dl auf 3,8 mg/dl. Ein deutlicher CRP-Rückgang von 21,0 mg/dl am Tag der ersten Transfusion bis auf 8,6 mg/dl am dritten Tag nach der letzten Transfusion konnte bei dem 15-jährigen Mädchen verzeichnet werden. Auch bei ihr kam es bis zu diesem Zeitpunkt bereits zu einer hämatopoetischen Regeneration. 67 3 Ergebnisse 3.5.3 Überleben nach Transfusion Das mediane Überleben der 21 erwachsenen Patienten, die in der Phase der Neutropenie Granulozytentransfusionen aufgrund einer lebensbedrohlichen Pilzinfektion erhalten hatten, lag bei 141 Tagen (Range 5 - 2598 Tage). Der klinische Zustand von 15 der insgesamt 21 Patienten konnte mit Hilfe der Granulozytentransfusionen bis zum Tag 30 nach der ersten Transfusion deutlich verbessert oder zumindest stabilisiert werden. Entsprechend liegt die 30-TageÜberlebenswahrscheinlichkeit bei 71,4 %. Bei allen sechs Patienten, die bis zum diesem Zeitpunkt bereits verstorben waren, war die Infektion unmittelbar als Todesursache anzunehmen oder sogar nachweisbar. Während vier dieser sechs Patienten (#36, #38, #49, #54) den Folgen einer invasiv-pulmonalen Aspergillose erlagen, konnte bei einem Patienten (#51) die vor der Granulozytentransfusion mikrobiologisch gesicherte Aspergillus-Infektion in der Obduktion nach antimykotischer Therapie nicht mehr nachgewiesen werden. Stattdessen zeigten sich hier eine Enterokokken-Pneumonie sowie ein ARDS. Zu der initial diagnostizierten mykotischen Pneumonie eines Patienten (#50) kamen im Verlauf noch bakterielle Infiltrate hinzu. Dieser Patient verstarb bei progredientem septischen Geschehen acht Tage nach der letzten Granulozytentransfusion in der kardio-respiratorischen Insuffizienz. 100 Überleben (%) 80 60 40 20 0 0 10 20 30 40 50 500 1500 2500 Zeit (Tage) Abb. 3.16 Überleben nach 1. GTx bei Pilzinfektionen (n = 21) 3 Ergebnisse 68 In der Untergruppe der invasiv-pulmonalen Aspergillosen (n = 16) zeigte sich bei einem medianen Überleben von 232 Tagen (Range 5 - 2598 Tage) eine Wahrscheinlichkeit von 68,8 %, 30 Tage nach der ersten Granulozytentransfusion noch am Leben zu sein. Die 30-Tage-Überlebenswahrscheinlichkeit der vier Kinder lag bei 50 %. Wie bereits in Kapitel 3.4.1 erwähnt, starb der 16-jährige Junge bereits am Folgetag nach der ersten Granulozytentransfusion im septischen Schock bei systemischer Aspergillose. Bei einem deutlichen Progress der ausgedehnten mykotischen Infiltrate in beiden Lungenflügeln kam es bei dem 12-jährigen Mädchen zu einer zunehmenden Verschlechterung des Allgemeinzustandes, so dass die junge Patientin schließlich das Vollbild einer Aspergillus-Sepsis zeigte und zwei Tage nach der letzten Transfusion den Folgen ihrer schweren Infektion in der Neutropenie erlag. Zwar konnte der klinische Zustand der 15 Jahre alten Patientin soweit stabilisiert werden, dass sie 30 Tage nach der ersten Granulozytentransfusion noch am Leben war, jedoch zeigte sie nach Erhalt der vom CMV-positiven Vater gewonnenen Granulozyten im Verlauf Symptome einer CMV-Infektion. Bei progredienten pulmonalen Infiltraten und den Zeichen eines ARDS kam es letztlich zu einer pulmonalen und kardialen Dekompensation, und das Mädchen verstarb 43 Tage nach der letzten Granulozytentransfusion. 3.6 Mögliche Einflussvariablen auf den Transfusionserfolg 3.6.1 Infektion Obwohl das mediane Überleben in den drei verschiedenen Patientenkollektiven auf den ersten Blick recht deutliche Unterschiede aufweist (57 Tage bei bakterieller Pneumonie bzw. POE, 163 Tage bei bakterieller Sepsis und 141 Tage bei Pilzinfektionen) konnte beim Vergleich der einzelnen Überlebenskurven untereinander mit Hilfe des Logrank-Tests kein signifikanter Unterschied gezeigt werden. Im Hinblick auf das direkte Ansprechen auf die Granulozytentransfusionen, gemessen an der 30-Tage-Überlebenswahrscheinlichkeit (bakterielle Pneumonie: 58,8 %; bakterielle Sepsis: 70,6 %; Pilzinfektionen: 71,4 %), zeigte sich ebenfalls zwischen den einzelnen Indikationsgruppen kein signifikanter Unterschied. 69 3 Ergebnisse 100 Überleben (%) 80 60 40 20 0 0 10 20 30 40 50 500 1500 2500 Ze it (Tage) Bakt. Pneumonie/POE (n=17) Bakt. Sepsis (n=17) Pilzinfektion (n=21) Abb. 3.17 Überlebenswahrscheinlichkeiten im Vergleich 3.6.2 Vorbestehende Neutropeniedauer Die mediane Dauer der Neutropenie vor der ersten Granulozytentransfusion betrug bei den 55 erwachsenen Patienten mit schweren Infektionen 15 Tage (Range 3 - 68 Tage). Die Kinder, die Granulozytentransfusionen aufgrund einer schweren Infektion erhalten hatten (n = 7), waren im Median 25 Tage neutropen (Range 17 - 40 Tage), wobei bei einem Kind die Neutropeniedauer nicht eruiert werden konnte. In beiden Gruppen wurde zur Bestimmung der Neutropeniedauer jeweils der Tag der ersten Transfusion mitgezählt. Während die Patienten mit positivem Ansprechen auf die Granulozytentransfusionen (n = 37) im Median 15 Tage (Range 5 - 68 Tage) vor der ersten Transfusion neutropen waren, betrug die Dauer der Neutropenie der Patienten mit fehlendem Ansprechen (n = 18) 15,5 Tage (Range 3 - 36 Tage). Dieser Unterschied ist nicht signifikant (p > 0,05). Als Kriterium für ein positives Ansprechen auf die Granulozytentransfusionen wurde hier das Überleben an Tag 30 nach der ersten Transfusion herangezogen. Auch bei den Kindern zeigte sich kein signifikanter Unterschied in der Dauer der Neutropenie zwischen den Patienten mit und denen ohne positivem Ansprechen auf die Transfusionen (p > 0,05). 70 3 Ergebnisse 3.6.3 Transfundierte Granulozytenzahl Insgesamt wurden den 71 Patienten 232 Granulozytenkonzentrate transfundiert. Im Median wurden durch ein Leukapheresat 3,59 x 1010 Granulozyten übertragen. Bei der Berechnung in Bezug auf das jeweilige Körpergewicht der Patienten, ergab dies bei den acht Kindern, die zusammen 23 Granulozytentransfusionen erhalten hatten, eine mediane Zelldosis in Höhe von 0,0447 x 1010 Granulozyten/kgKG (Range 0,0015 - 0,3411 x 1010 Granulozyten/kgKG). Bei den 55 erwachsenen Patienten, die an einer schweren Infektion in der Neutropenie erkrankt waren, errechnete sich eine mediane Granulozytenzahl in Höhe von 0,0534 x 1010 /kgKG (Range 0,0001 - 0,1954 x 1010 Granulozyten/kgKG). Im Hinblick auf den veränderten Sedimentationsbeschleuniger ab 1999 zeigte sich bei den Transfusionen, die alle erwachsenen Patienten seit diesem Jahr erhalten hatten (n = 132), eine mediane transfundierte Granulozytenzahl von 0,0695 x 1010 /kgKG (Range 0,0174 - 0,1954 x 1010 /kgKG). Dabei wurden den Patienten, die ein positives Ansprechen auf die Granulozytentransfusionen zeigten, im Median 0,0720 x 1010 /kgKG Zellen (Range 0,0274 - 0,1954 x 1010 /kgKG) transfundiert, während die Patienten ohne Erfolg im Median 0,0568 x 1010 /kgKG Granulozyten (Range 0,0397 - 0,1285 x 1010 /kgKG) pro Transfusion erhalten hatten. Der Vergleich zeigt einen signifikanten Unterschied (p = 0,0227). In diese Subanalyse wurden Patienten, bei denen die Indikation zur Granulozytentransfusion allein aufgrund von Fieber und/oder einer CRP-Erhöhung gestellt wurde (FUO/CUO), nicht mit einbezogen. Granulozyten/kgKG x 10 10 0.25 0.20 0.15 0.10 0.05 0.00 Erfolg (n=37) kein Erfolg (n=18) Patienten Abb. 3.18 Transfundierte Granulozyten/kgKG bei Patienten mit und ohne Erfolg 71 3 Ergebnisse 3.6.4 Hämatopoetische Regeneration Von den 55 erwachsenen Patienten, denen Granulozyten aufgrund einer schweren Infektion in der Neutropenie transfundiert wurden, haben 27 bis zum fünften Tag nach der ersten Transfusion endogen hämatopoetisch regeneriert. Im Vergleich der Überlebenskurve dieser 27 Patienten mit der der 28 Patienten, die nicht hämatopoetisch regeneriert hatten, errechnet sich - bei einer medianen Überlebenszeit von 168 bzw. 19 Tagen - im Logrank-Test ein signifikanter Vorteil für die Patienten, bei denen sich das Knochenmark rasch erholen konnte (p = 0,0140). Betrachtet man nur die 30-Tage-Überlebenswahrscheinlichkeit, so zeigt sich auch hier ein deutlich signifikanter Unterschied (p = 0,0006). 100 Überleben (%) 80 60 40 20 0 0 10 20 30 40 50 500 1500 2500 Zeit (Tage) häm. Reg. (n=27) keine häm. Reg. (n=28) Abb. 3.19 Überlebenswahrscheinlichkeit mit und ohne hämatopoetischer Regeneration 4 Diskussion 72 4 Diskussion 4.1 Ergebnisse der Leukapherese Der zu Beginn der Granulozytentransfusions-Ära aufgekommene Enthusiasmus wurde aufgrund der meist sehr geringen Zahl an Granulozyten, die von den Spendern gewonnen werden konnten, bis zur Entdeckung von G-CSF, z.T. wieder deutlich gebremst. Erst durch die klinische Anwendung dieses Wachstumsfaktors, in manchen Studien auch in Kombination mit Glukokortikoiden, zur Stimulierung der Granulopoese bei gesunden Spendern und durch verbesserte Apheresetechniken konnte das Interesse an Granulozytentransfusionen wieder gesteigert werden [24; 41; 79]. Durch diese neuen Entwicklungen ist es möglich geworden, im Rahmen einer Leukapherese zwischen 3 und 10 x 1010 Granulozyten pro Leukapheresat zu gewinnen [11; 31; 40; 77; 84; 94]. Von den in dieser Arbeit beschriebenen 232 Leukapheresaten konnte retrospektiv in 228 Fällen die darin gewonnene Granulozytenzahl bestimmt werden. Durchschnittlich waren hier in jedem Produkt 3,57 x 1010 (SD ± 2,47 x 1010; Median 3,59 x 1010, Range 0,01 - 10,39 x 1010) Granulozyten enthalten. Im Vergleich zu den in den o.g. Studien erzielten Zellzahlen, erscheint dies auf den ersten Blick als relativ geringe Ausbeute. Wie jedoch bereits in den Kapiteln 2.3.2 und 3.1.2 beschrieben, wurde 1999 der im Rahmen der Leukapherese eingesetzte Sedimentationsbeschleuniger an der Universitätsklinik Freiburg verändert. Dies führte dazu, dass bei allen seit diesem Zeitpunkt durchgeführten Leukapheresen (n = 136) eine signifikant höhere Zahl an Granulozyten gewonnen werden konnte (p < 0,0001), nämlich durchschnittlich 5,11 x 1010 Granulozyten pro Leukapheresat (SD ± 1,82 x 1010; Median 4,83 x 1010; Range 1,12 - 10,39 x 1010), im Vergleich zu durchschnittlich 1,30 x 1010 Granulozyten pro Leukapheresat vor 1999 (SD ± 1,26 x 1010; Median 0,93 x 1010; Range 0,01 - 6,93 x 1010). 4.2 Nebenwirkungen bei Spendern und Patienten Bei keinem der 90 Granulozytenspender in dieser Arbeit wurden schwere Nebenwirkungen beschrieben. Sowohl die subkutane Applikation von G-CSF vor jeder Spende, als auch in den meisten Fällen das Spendeverfahren an sich wurden von den Spendern gut toleriert. Nur in drei Fällen (1,29 %) kam es zu Komplikationen, so dass die Leukapherese vorzeitig abgebrochen werden musste. Zweimal handelte es sich dabei um eine im Verlauf der Apherese aufgetretene Zuflussstörung, und bei einer Spenderin kam es im Verlauf der Leukapherese zu ei- 4 Diskussion 73 nem deutlichen Hämoglobinabfall, der von ihr nicht toleriert wurde, so dass das Verfahren abgebrochen werden musste und auch nicht mehr wiederholt werden konnte. Bei allen anderen Spendern kam es nur zu den in Kapitel 3.1.1 beschriebenen Blutbildveränderungen, die problemlos toleriert wurden. Diese positiven Erfahrungen bestätigen größtenteils die Ergebnisse vorangegangener Studien [8; 11; 28; 31; 133; 155]. Allerdings berichteten einige Autoren von häufig auftretenden milden Nebenwirkungen. So gaben z.B. 69 % der 261 Spender in einer Studie von McCullough und Mitarbeiter geringe Nebenwirkungen wie Muskel- und Knochenschmerzen, Kopfschmerzen, Müdigkeit und Übelkeit an, die immerhin ca. 75 % dieser Spender dazu veranlasst haben, Schmerzmittel einzunehmen [113]. Auch in einer Arbeit von Bux und Mitarbeitern, in der 183 Spender zur Gewinnung von 507 Granulozytenkonzentraten zur Verfügung standen, wurden relativ häufig (ca. 60 %) geringe, G-CSF assoziierte Nebenwirkungen dokumentiert. Leukapherese assoziierte Nebenwirkungen wurden bei 14 % der Spender beobachtet. Insgesamt verlangten jedoch nur 13 der 183 Spender aufgrund starker Knochenschmerzen, Kopfschmerzen oder Juckreiz lindernde Medikamente, und nur 5 % der Spender wären zu einer erneuten Granulozytenspende nicht mehr bereit gewesen [28]. Price und Mitarbeiter zeigten in ihrer Untersuchung, dass obwohl nur 28 % ihrer Spender völlig frei von Nebenwirkungen waren, dennoch 98 % der Spender sich für eine weitere Granulozytenspende bereit erklären würden [133]. Leider konnte in der hier vorliegenden Arbeit retrospektiv keine Aussage über das Auftreten geringer Nebenwirkungen, wie Kopf- und Gliederschmerzen, etc. gemacht werden, da diese nicht ausreichend dokumentiert wurden. Ein immer wieder häufig und ausführlich diskutiertes Thema ist das Risiko für das Auftreten von Komplikationen bei Empfängern von Granulozytentransfusionen. Während in der hier vorliegenden Arbeit auftretende Symptome, wie z.B. leichtes Fieber, Schüttelfrost oder Tachykardie größtenteils nicht direkt und nicht zweifelsfrei den Granulozytentransfusionen zuzuschreiben war, so traten doch bei 8 Patienten (11,27 %) z.T. schwerwiegende Komplikationen auf. Darunter waren als noch moderat auftretende Nebenwirkungen die Bildung von granulozytären (n = 2) und thrombozytären (n = 1) Antikörpern sowie das Auftreten einer anaphylaktischen Reaktion (n = 1), die medikamentös gut behandelbar war. Vier Patienten mussten intensivmedizinisch überwacht und therapiert werden, da bei Ihnen ein CapillaryLeak-Syndrom in zeitlichem Zusammenhang mit den Transfusionen diagnostiziert wurde. Bei einem Patienten kam es dabei zu einem letalen Ausgang. Anzumerken bleibt jedoch, dass bei allen vier Patienten zusätzlich der Verdacht auf eine invasiv-pulmonale Aspergillose geäußert 4 Diskussion 74 wurde und somit letztlich bei vorliegender respiratorischer Insuffizienz nicht definitiv geklärt werden konnte, was ausschlaggebend für die Lungenschädigung war. Auch Lee und Mitarbeiter berichteten von pulmonalen Reaktionen im Zusammenhang mit Granulozytentransfusionen bei zwei Patienten, wovon einer der beiden an den Folgen eines Lungenödems starb. Schädigungen der Lunge bleiben daher nach wie vor eine möglicherweise schwerwiegende, wenn auch eher selten auftretende Komplikation bei der Transfusion von Blut oder Blutbestandteilen [140; 148] und sollten daher stets bei Granulozytentransfusionen im Hinterkopf behalten werden. Eine weitere mögliche Komplikation ist die Übertragung infektiöser, insbesondere viraler Krankheiten. Während das Risiko einer HBV-, HCV- oder HIV-Infektion im allgemeinen als gering bis sehr gering eingestuft wird [7; 131; 146], scheint die Übertragung einer CMVInfektion v.a. im Rahmen von Granulozytentransfusionen bei immunkomprimierten Patienten eine etwas größere Rolle zu spielen [67; 122; 174]. An der Universitätsklinik Freiburg kam es zwischen 1996 und 2003 im Rahmen der Granulozytentransfusionen bei einer Patientin zu einer tödlich endenden CMV-Infektion durch die Übertragung von Granulozyten eines CMVpositiven Spenders. In diesem speziellen Fall wurde bei fehlendem CMV-negativen Spender das Risiko einer CMV-Infektion im Vergleich zu dem lebensbedrohlichen Risiko der progressiven und therapierefraktären pulmonalen Aspergillose als geringer eingestuft. Bei engmaschigen Kontrollen in Bezug auf eine beginnende Infektion und einer präventiven Behandlung sobald die Infektion molekularbiologisch nachgewiesen wurde, wird diese Vorgehensweise v.a. bei Hochrisikopatienten auch von anderen Autoren unterstützt [122]. 4.3 Ansprechen, klinischer Verlauf und Überleben nach Granulozytentransfusionen Als erster nachweisbarer Effekt der Granulozytentransfusionen konnte in dieser Arbeit ein signifikanter Leukozytenanstieg im Blut der Patienten nach den Transfusionen gezeigt werden. Verschiedene Studien der letzten Jahre zeigten ebenfalls einen signifikanten Anstieg der Granulozyten bzw. Leukozyten bei den Empfängern, sofern eine adäquate Zahl an Granulozyten transfundiert wurde [4; 11; 128; 139]. Dies entspricht den Aussagen früherer Autoren, nach denen mindestens 2 - 3 x 1010 neutrophile Granulozyten transfundiert werden müssen, um einen messbaren Anstieg der Zellen im peripheren Blut der Empfänger zu erreichen [89; 153; 166]. 4 Diskussion 75 Um den klinischen Verlauf und somit auch das Ansprechen auf die Behandlung mit Granulozytentransfusionen der Patienten in dieser Arbeit zu beschreiben war initial geplant, neben dem CRP-Verlauf und dem Überleben auch das Auftreten von Fieber, bzw. den Zeitpunkt der Fieberfreiheit als Kriterium heranzuziehen. Diese Idee musste während der Zusammentragung und Auswertung der Daten jedoch wieder verworfen werden, da es bei vielen Patienten aufgrund der schwarz-weiß Mikroverfilmung der Patientenakten nicht möglich war, die Temperaturkurve von der Pulskurve zu unterscheiden. Von den 63 erwachsenen Patienten, die an der Universitätsklinik Freiburg zwischen 1996 und 2003 Granulozytentransfusionen erhalten hatten und deren Daten im Rahmen dieser Arbeit ausgewertet wurden, waren 44 an Tag 30 nach der ersten Transfusion noch am Leben. Dies entspricht einer Erfolgsquote von 66,7 %. Eine mögliche Erklärung für das geringere Ansprechen der acht Kinder, von denen 30 Tage nach der ersten Granulozytentransfusionen nur noch die Hälfte am Leben war, mag der relativ späte Zeitpunkt der Transfusion gewesen sein, an dem sich die Kinder z.T. bereits in einem äußerst schlechten und kritischen Gesundheitszustand befanden. 58,8 % der Patienten (entsprechend 10/17), die Granulozytentransfusionen aufgrund einer schweren bakteriellen Pneumonie oder einer Pneumonie ohne Erregernachweis erhalten hatten, zeigten – gemessen an dem Überleben an Tag 30 nach der ersten Transfusion – ein positives Ansprechen. Neben einem signifikanten CRP-Abfall konnte zudem bei acht Patienten (47,1 %) in den radiologischen Kontrollen ein z.T. recht deutlicher Rückgang der pulmonalen Infiltrate gezeigt werden. Bei den Patienten mit bakterieller Sepsis profitierten 12 von 17 (70,6 %) im Hinblick auf das Überleben von den Granulozytentransfusionen. Auch in diesem Patientenkollektiv kam es im Verlauf der Transfusionen zu einem signifikanten CRP-Abfall. In der Gruppe der Patienten, bei denen die Indikation zur Granulozytentransfusion aufgrund einer schweren Pilzinfektion gestellt wurde, profitierten 15 von 21 von dieser ergänzenden Therapieoption, d.h. die 30-Tage-Überlebenswahrscheinlichkeit betrug 71,4 %. In der Untergruppe der invasiv-pulmonalen Aspergillosen (n = 16) lag diese Wahrscheinlichkeit bei 68,8 % und es zeigten sich radiologisch bei acht der 16 Patienten eine z.T. recht deutliche Befundregredienz, bis hin zur vollständigen Abheilung. Wie auch in den anderen Infektionsgruppen, konnte auch in der Gruppe der Patienten mit Pilzinfektionen ein signifikanter CRPAbfall im Verlauf der Transfusionen verzeichnet werden. In der Literatur wurden für die Therapie von invasiven Aspergillosen (meist pulmonal) mit Amphotericin B Ansprechraten von 40 % und weniger dokumentiert [44; 66; 127]. Bei Pati- 4 Diskussion 76 enten mit invasiv-pulmonaler Aspergillose nach Knochenmarktransplantation lag die Mortalität z.T. sogar bei über 94 % [46]. Allerdings zeigen die Ergebnisse aus Studien, in denen die Patienten mit Antimykotika der neueren Generation behandelt wurden größere Erfolge. Hier lagen die Ansprech- bzw. Überlebensraten bei 48 – 71 % [45; 66; 127]. Insgesamt müssen jedoch alle Ergebnisse, insbesondere wenn sie zum Therapievergleich herangezogen werden, mit Vorsicht gewertet werden, da es sich teilweise um unterschiedliche Patientenkollektive handelt und z.B. der Anteil der mikrobiologisch nachgewiesenen invasiven Aspergillosen erheblich variieren kann. Während Grigg und Mitarbeiter 1996 in ihrer Studie [64], in der drei von drei Patienten mit bakterieller Infektion überlebten und alle fünf Patienten mit Pilzinfektionen starben, eher entmutigende Ergebnisse vorwiesen, berichteten Hester und Mitarbeiter ein Jahr zuvor über eine Ansprechrate von 60 % bei 15 Patienten mit mykotischen Infektionen, die Granulozytentransfusionen erhalten hatten [70]. Auch Peters und Mitarbeiter, die 30 Kinder mit Granulozytenkonzentraten behandelten, berichteten über ein gutes Ansprechen [128]. 100 Tage nach dem Beginn der Transfusionen lebten noch 70 % der Patienten. Dabei zeigte sich ein signifikanter Unterschied zwischen dem Überleben der Patienten mit bakteriellen Infektionen (82 %) und denen mit Pilzinfektionen (54 %). In der Gruppe der neun Patienten mit invasiver Aspergillose kam es bei fünf Patienten (56 %) zu einer vollständigen Ausheilung der Infektion. Hübel und Mitarbeiter verglichen im Jahr 2002 den klinischen Verlauf eines großen Patientenkollektivs nach Granulozytentransfusionen mit dem einer Kontrollgruppe [77]. Dabei zeigte sich eine nichtsignifikante Tendenz eines schlechteren klinischen Verlaufes bei Patienten, die Granulozytentransfusionen erhalten haben, unabhängig davon, ob die transfundierten Zellen von verwandten oder fremden Spendern gewonnen wurden (progressiver oder tödlicher Verlauf in 40,3 % der Fälle aus der Kontrollgruppe, vs. 55,9 % und 57,5 % bei Patienten mit verwandten bzw. fremden Granulozytenspendern). Patienten mit bakterieller Sepsis, die der Studiengruppe angehörten und daher Granulozytentransfusionen erhielten, hatten zudem einen signifikant schlechteren Verlauf. Allerdings sind diese negativen Ergebnisse nur mit Vorsicht zu interpretieren, da es sich hierbei nicht um eine prospektiv randomisierte Studie handelte und die Patienten der Kontrollgruppe teilweise „historisch“ waren. Hinzu kommt, dass es wahrscheinlicher war, dass Patienten mit ernsthafteren Infektionen der Transfusionsgruppe zugeordnet wurden. Insgesamt konnte in Bezug auf den Gesamtverlauf, insbesondere das Langzeitüberleben kein relevanter Unterschied gezeigt werden. Ergebnisse jüngster Untersuchungen lassen wiederum positive Erwartungen aufkommen. In einer prospektiven nichtkontrollierten Studie behandelten Lee und Mitarbeiter 32 Patienten 4 Diskussion 77 mit schweren Infektionen in der Neutropenie mit durchschnittlich 3,8 Granulozytentransfusionen [95]. 19 Patienten (59,4 %) sprachen auf die Granulozytentransfusionstherapie an. Die Subanalyse zeigte in 80 %, 66,7 % und 50 % der Fälle mit mykotischen, bzw. gramnegativen und grampositiven bakteriellen Infektionen ein positives Ansprechen. Die Migrationsfähigkeit der transfundierten Granulozyten wurde szintigraphisch mit Hilfe von radioaktiv markierten Zellen bei vier Patienten untersucht. Die zwei auf die Therapie ansprechenden Patienten zeigten dabei eine vermehrte Aufnahme der radioaktiv markierten Granulozyten in die infiltrativen pulmonalen Läsionen, während die zwei Patienten, die nicht von den Granulozytentransfusionen profitieren konnten, szintigraphisch keinerlei Aufnahme zeigten. Unter der Annahme, dass der Erfolg der Granulozytentransfusionen von der Fähigkeit der Granulozyten abhängt, an den Ort des infektiösen Geschehens zu migrieren, weisen Lee und Mitarbeiter darauf hin, dass die Granulozyten-Szintigraphie dazu verwendet werden kann, die Wahrscheinlichkeit für das Ansprechen auf die Behandlung mit Granulozytentransfusionen vorauszusagen. 2004 analysierten Safdar und Mitarbeiter in einer retrospektiven Fall-Kontroll-Studie 491 Patienten mit einer Candidämie [142]. Darunter befanden sich 29 Patienten, die Granulozytentransfusionen erhalten hatten und 462 Patienten ohne Transfusionen. Entgegen den Erwartungen der Autoren erholten sich weniger Patienten, denen Granulozyten transfundiert wurden vollständig von ihrer Infektion, im Vergleich zu denjenigen ohne Transfusionen (35 % vs. 67 %). Die Mortalitätsrate war in beiden Gruppen jedoch annähernd gleich (48 % in der Gruppe mit vs. 45 % ohne Granulozytentransfusionen, p = 0,5). Da in der Gruppe der Patienten, die Granulozytentransfusionen erhalten hatten, vermehrt Risikofaktoren für eine erhöhte Mortalität (z.B. länger andauernde Neutropenie, vermehrtes Auftreten von invasiven Durchbruch-Mykosen, häufiger vorangegangene Blutstammzelltransfusionen) zu finden waren, kamen die Autoren zu dem Schluss, dass die Transfusionen dennoch effektiv waren und die Überlebensrate dieser Hochrisikopatienten höher als erwartet lag. Die Ergebnisse einer im letzten Jahr von Mousset und Mitarbeitern veröffentlichten Studie waren im Hinblick auf die Effektivität von Granulozytentransfusionen viel versprechend. In dieser prospektiven, nicht-randomisierten Studie wurden bei 23 Patienten sekundärprophylaktisch sowie bei 44 fortschreitenden, lebensbedrohlichen Infektionen Granulozyten transfundiert. 30 Tage nach der ersten Transfusion konnte in der Interventionsgruppe in 36 von 44 Fällen (82 %) ein positiver Verlauf dokumentiert werden. Dabei zeigten die Patienten mit bakteriellen Infektionen (n = 13) eine nichtsignifikante Tendenz, besser auf die Behandlung mit Granulozytentransfusionen anzusprechen, im Vergleich zu den 31 Patienten mit Pilzinfek- 4 Diskussion 78 tionen (92 % vs. 78 %). Eine Infektkontrolle bei invasiver Aspergillose konnte in 77 % der Fälle (17/22) erreicht werden. In der Gruppe der prophylaktischen Transfusionen kam es bei keinem der 23 Hochrisikopatienten zu einer Reaktivierung einer in der Vergangenheit bereits schon einmal aufgetretenen schweren Infektion. Um mögliche Prädiktoren für den Erfolg von Granulozytentransfusionen herauszuarbeiten wurden die Patienten neben der Art ihrer Infektion auch hinsichtlich der Dauer der vorbestehenden Neutropenie und der Zahl der pro Kilogramm Körpergewicht transfundierten Granulozyten untersucht. In allen drei Infektionsgruppen konnte ein z.T. sehr guter Transfusionserfolg verzeichnet werden, wobei Patienten mit Pilzinfektionen mit einer 30-TageÜberlebenswahrscheinlichkeit von 71,4 % am besten – wenn auch nicht signifikant – auf die Granulozytentransfusionen ansprachen. Anzumerken bleibt jedoch in diesem Zusammenhang, dass einige Patienten sowohl an bakteriellen als auch an mykotischen Infektionen erkrankt waren, sie jedoch anhand der - zum Zeitpunkt der Indikationsstellung zur Granulozytentransfusion - im Vordergrund stehenden klinischen Symptomatik einer der drei Gruppen zugeordnet wurden. Letztlich bleiben so diese Ergebnisse mit Vorsicht zu bewerten. Im Hinblick auf die Anzahl der Tage, an denen die Patienten vor der ersten Transfusion neutropen waren, zeigte sich kein signifikanter Unterschied zwischen den Patienten mit und denen ohne Erfolg. Zu diesem Schluss kamen sowohl Peters als auch Lee und Mitarbeiter [95; 128]. Dagegen zeigte sich in der hier vorgelegten Arbeit, dass den Patienten, die auf die Behandlung mit Granulozytenkonzentraten gut angesprochen haben, signifikant mehr Granulozyten pro Kilogramm Körpergewicht transfundiert wurden. Dieser Zusammenhang wurde in der Literatur bereits schon mehrfach dokumentiert [105; 153; 167; 166]. Bereits 1966 wurde der Zusammenhang zwischen dem Grad der Ausprägung bzw. der Dauer der Neutropenie und dem Risiko für Infektionen von Bodey und Mitarbeitern beschrieben [16]. Auch in späteren Arbeiten wurde immer wieder gezeigt, dass die hämatopoetische Regeneration und der damit verbundene Wiederanstieg der neutrophilen Granulozyten im peripheren Blut der bestimmende Faktor hinsichtlich des Überlebens einer schweren Infektion, wie z.B. einer systemischen Pilzinfektion darstellt [132; 141]. In der hier vorliegenden Arbeit konnte gezeigt werden, dass Patienten, die – möglicherweise initiiert oder unterstützt durch die Granulozytentransfusionen – rasch hämatopoetisch regenerierten, einen deutlich signifikanten Überlebensvorteil (p = 0,0006) im Vergleich zu den Patienten mit fehlender Regeneration hatten. In welchem Ausmaß Granulozytentransfusionen unter Umständen die Erholung des Immunsystems der betroffenen Patienten beschleunigen können, bleibt jedoch nach wie vor offen. 4 Diskussion 79 4.4 Zukunftsperspektiven Auch wenn die Ergebnisse jüngster Studien, wie auch die Ergebnisse der hier vorgelegten Arbeit, den Schluss nahe legen, dass Granulozytentransfusionen eine sehr große und vielleicht auch entscheidende Bedeutung in der supportiven Therapie von lebensbedrohlichen Infektionen in der Neutropenie zugeschrieben werden kann, so stehen doch das – wenn auch geringe Risiko für schwerwiegende Komplikationen und Nebenwirkungen und der hohe finanzielle und logistische Aufwand dieser Transfusionen dem gegenüber. Außerdem bleibt abzuwarten bzw. in diesem Zusammenhang weiter auszuwerten, welchen Erfolg die Behandlung v.a. mit neueren Antimykotika mit sich bringt und ob dadurch ggf. der Einsatz von Granulozytentransfusionen bei vielleicht gleichen oder auch besseren Erfolgsaussichten wieder vermehrt in Frage gestellt wird. Auf jeden Fall ist der Bedarf an zukünftigen, klinisch kontrollierten und prospektiv randomisierten Studien hinsichtlich der Behandlung mit Granulozytentransfusionen gegeben, denn letztlich müssen Granulozytentransfusionen bis heute noch als experimentelle Therapie angesehen werden. Große Hoffnung wird auf die Ergebnisse einer Phase III Studie des Transfusion Medicine/Hemostasis Clinical Trials Network gesetzt, in der über 200 Patienten Granulozyten in hohen Dosierungen transfundiert werden sollen. Um diese hohe Patientenzahl zu erreichen, werden wahrscheinlich 15 bis 20 verschiedene Einrichtungen daran teilnehmen. Mit den Ergebnissen ist bis in ungefähr drei bis vier Jahren zu rechnen und man hofft, dass dann eindeutige und zuverlässige Aussagen hinsichtlich des klinischen Einsatzes von Granulozytentransfusionen zu treffen sind. 5 Zusammenfassung 80 5 Zusammenfassung Die insgesamt zunehmende Inzidenz von malignen Erkrankungen und die klinische Anwendung von intensivierten und aggressiven (Radio-) Chemotherapien bergen bis heute die Gefahr für das Auftreten von lebensbedrohlichen Infektionen in der Neutropenie. Bereits seit vielen Jahren wird postuliert, dass Granulozytentransfusionen einen positiven Einfluss auf die Behandlung dieser schweren, insbesondere therapierefraktären Infektionen haben und somit von großem klinischem Nutzen sein können. Bis heute gibt es jedoch keine abgeschlossene prospektiv randomisierte Studie, die einen Beweis für die Effizienz der Granulozytentransfusionen erbringen konnte. In dieser Arbeit wurden die Daten von insgesamt 232 Granulozytentransfusionen, 90 Spendern, 63 erwachsenen Patienten und acht Kindern der Universitätsklinik Freiburg aus dem Beobachtungszeitraum von 1996 bis 2003 erfasst, beschrieben und analysiert. Durch die Vorbehandlung der Spender mit G-CSF konnten im Median 3,59 x 1010 Granulozyten (Range 0,01 - 10,39 x 1010) durch die Leukapherese gewonnen werden. 55 erwachsenen Patienten wurden aufgrund einer lebensbedrohlichen Infektion im Median 0,0534 x 1010 Granulozyten/kgKG (Range 0,0015 - 0,3411 x 1010 Granulozyten/kgKG) transfundiert. Nebenwirkungen waren bei den Spendern sehr gering, und auch bei den Empfängern traten nur in sehr seltenen Fällen ernstere Komplikationen auf. Die Patienten wurden entsprechend der Art der Infektion, an der sie erkrankt waren in verschiedene Gruppen eingeteilt. Das Ansprechen auf die Transfusionen wurde anhand der klinischen und laborchemischen Verläufe und der Überlebenswahrscheinlichkeiten dargestellt. Die 30-Tage-Überlebenswahrscheinlichkeit nach der ersten Granulozytentransfusion lag bei 17 Patienten mit bakterieller Pneumonie bei 58,8 %, bei 17 Patienten mit bakterieller Sepsis bei 70,6 % und bei 21 erwachsenen Patienten, die an einer Pilzinfektion erkrankt waren bei 71,4 %. Dieser Unterschied ist nicht signifikant. Des Weiteren konnte in der hier vorliegenden Arbeit gezeigt werden, dass der Erfolg der Granulozytentransfusionen nicht von der Dauer der vorbestehenden Neutropenie, jedoch von der jeweiligen Anzahl an transfundierten Granulozyten abhängt. Die Ergebnisse dieser retrospektiven Analyse zeigen, dass Granulozytentransfusionen eine sichere und effektive Therapieoption bei Patienten mit schweren Infektionen in der Neutropenie, wie z.B. die invasiv-pulmonale Aspergillose, sein können. Eine prospektive, klinisch kontrollierte Studie, die aktuell an der Universitätsklinik Freiburg läuft, wird wahrscheinlich weitere wertvolle Informationen diesbezüglich liefern können. 81 6 Verzeichnisse 6 Verzeichnisse 6.1 Abkürzungsverzeichnis ALL Akute lymphatische Leukämie AML Akute myeloische Leukämie ANC Absolute Neutrophilenzahl (absolute neutrophil count) ARDS Akutes Lungenversagen (adult respiratory distress syndrome) BAL Bronchoalveolare Lavage BK Blutkultur Ca Karzinom (carcinoma) CDI Klinisch gesicherte Infektion (clinically documented infection) CML Chronische myeloische Leukämie CMV Cytomegalie-Virus CRP C-reaktives Protein CT Computertomographie CUO CRP-Anstieg unbekannter Genese (CRP of unknown origin) d Tag (dies) E. coli Escherichia coli FUO Fieber unbekannter Genese (fever of unknown origin) G-CSF Granulozyten-Kolonie-stimulierender Faktor (granulocyte-colony-stimulating factor) GM-CSF Granulozyten-Monozyten-Kolonie-stimulierender Faktor GTx Granulozytentransfusion GvL-Effekt Graft versus Leukämie-Effekt h Stunde (hora) Häm. Reg. Hämatopoetische Regeneration HAV Hepatitis A Virus 82 6 Verzeichnisse HBsAg Hepatitis B Oberflächen- (surface) Antigen HBV Hepatitis B Virus HCV Hepatitis C Virus HES Hydroxyethylstärke HIV Human immunodeficiency virus HLA Humanes Leukozytenantigen HSV Herpes simplex Virus IL Interleukin kgKG Kilogramm Körpergewicht KMT Knochenmarktransplantation k.n. koagulase-negativ m männlich MDI Mikrobiologisch gesicherte Infektion (microbiologically documented infection) MDS Myelodysplastisches Syndrom NADPH Reduziertes Nikotinamid-Adenin-Dinukleotid-Phosphat NHL Non-Hodgkin Lymphom PDV Patientendatenverwaltung pH Potenz und Maß für Wasserstoffionenkonzentration (pondus hydrogenii) PMN Polymorphkernig (polymorphonuclear) PMNL Polymorphkernige neutrophile Granulozyten (polymorphonuclear leukocytes) POE Pneumonie ohne Erregernachweis Rh Rhesus rhG-CSF Rekombinanter, humaner Granulozyten-Kolonie-stimulierender Faktor s.c. subkutan SCF Stammzellfaktor (stem cell factor) SD Standardabweichung (standard deviation) 83 6 Verzeichnisse spp. Species (Plural) TPHA Treponema-pallidum-Hämagglutinations-Assay TRALI Transfusionsassoziierte akute Lungeninsuffizienz (transfusion related acute lung injury) w weiblich WBC Leukozyten (white blood cells) 6 Verzeichnisse 84 6.2 Abbildungsverzeichnis Abb. 1.1 Entwicklung der neutrophilen Granulozyten ............................................................ 6 Abb. 1.2 Funktion der neutrophilen Granulozyten .................................................................. 8 Abb. 2.1 Hämatologische Grunderkrankungen aller Patienten (n = 70)................................. 36 Abb. 2.2 Anzahl der Patienten und GTx pro Jahr .................................................................. 36 Abb. 3.1 Differenzierung der Leukozyten im Leukapheresat ................................................ 45 Abb. 3.2 Gewonnene Granulozyten pro Leukapheresat vor und ab 1999 ............................. 46 Abb. 3.3 Spender-WBC im Verhältnis zu gewonnenen WBC ab 1999................................. 47 Abb. 3.4 Verteilung der GTx auf die Indikationsgruppen ..................................................... 48 Abb. 3.5 Medianer Leukozytenanstieg nach GTx.................................................................. 49 Abb. 3.6 Leukozytenanstieg nach GTx bei Patienten mit WBC ≤ 1.000/µl vor 1. GTx ....... 50 Abb. 3.7 Gesamtüberleben nach 1. GTx ................................................................................ 52 Abb. 3.8 CRP-Verlauf (Median) bei Patienten mit bakterieller Pneumonie oder POE ......... 55 Abb. 3.9 CRP-Verlauf (Median) bei Patienten mit und ohne hämatopoetischer Regeneration............................................................................................................ 56 Abb. 3.10 Überleben nach 1. GTx bei bakterieller Pneumonie oder POE (n = 17) ............... 57 Abb. 3.11 CRP-Verlauf (Median) bei Patienten mit bakterieller Sepsis ............................... 60 Abb. 3.12 CRP-Verlauf (Median) bei Patienten mit und ohne hämatopoetischer Regeneration.......................................................................................................... 60 Abb. 3.13 Überleben nach 1.GTx bei bakterieller Sepsis (n = 17)......................................... 62 Abb. 3.14 CRP-Verlauf (Median) bei Patienten mit Pilzinfektionen .................................... 65 Abb. 3.15 CRP-Verlauf (Median) bei Patienten mit und ohne hämatopoetischer Regeneration.......................................................................................................... 66 Abb. 3.16 Überleben nach 1. GTx bei Pilzinfektionen (n = 21)............................................. 67 Abb. 3.17 Überlebenswahrscheinlichkeiten im Vergleich..................................................... 69 Abb. 3.18 Transfundierte Granulozyten/kgKG bei Patienten mit und ohne Erfolg .............. 70 Abb. 3.19 Überlebenswahrscheinlichkeit mit und ohne hämatopoetischer Regeneration ..... 71 6 Verzeichnisse 85 6.3 Tabellenverzeichnis Tabelle 1.1 Risikozuordnung für den Verlauf der Infektion nach der zu erwartenden Gesamtdauer der Neutropenie (nach [1]) ............................................................ 12 Tabelle 1.2 Häufigstes Erregerspektrum bei Diagnosestellung (modifiziert nach [94])........ 14 Tabelle 1.3 Granulozytentransfusionen bei Erwachsenen in sieben kontrollierten Studien (modifiziert nach [136]) ...................................................................................... 22 Tabelle 1.4 Charakteristika der sieben kontrollierten Granulozytentransfusions-Studien (modifiziert nach [136]) ...................................................................................... 24 Tabelle 1.5 Ergebnisse der Granulozytengewinnung nach Stimulation mit G-CSF und/oder Glukokortikoiden ................................................................................................ 26 Tabelle 1.6 Ergebnisse der Granulozytentransfusions-Therapie aus den letzten Jahren ....... 28 Tabelle 2.1 Patientencharakteristika ...................................................................................... 35 Tabelle 2.2 Spendercharakteristika ........................................................................................ 37 Tabelle 3.1 Leukapheresen pro Spender ................................................................................ 43 Tabelle 3.2 Blutbild der Spender vor und nach der Leukapherese (Median/Range) ............. 44 Tabelle 3.3 Volumen und zelluläre Bestandteile der Leukapheresate (Median/Range) ........ 45 Tabelle 3.4 Patienten mit bakterieller Pneumonie oder Pneumonie ohne Erregernachweis.. 53 Tabelle 3.5 Patienten mit bakterieller Sepsis ......................................................................... 58 Tabelle 3.6 Patienten mit Pilzinfektionen .............................................................................. 64 6 Verzeichnisse 86 6.4 Literaturverzeichnis [1] Abel R, Backmund G, Caspari G, Eichenlaub D, Hager K, Kuse E-R and Link H (2004) Infektionen bei speziellen Patienten. In: Adam D, Doerr HW, Lode H (Hrsg.) Die Infektiologie. 1. Aufl. Springer, Berlin, Heidelberg, New York: 1286-1362 [2] Adkins D, Goodnough LT, Moellering J, Brown R, Khoury H, Vij R and DiPersio J (1999) Reduction in antibiotic utilization and in febrile days by transfusion of G-CSF mobilized prophylactic granulocyte components: a randomized study. Blood 94: 590a [3] Adkins D, Spitzer G, Johnston M, Velasquez W, Dunphy F and Petruska P (1997) Transfusions of granulocyte-colony-stimulating factor-mobilized granulocyte components to allogeneic transplant recipients: analysis of kinetics and factors determining posttransfusion neutrophil and platelet counts. Transfusion 37: 737-748 [4] Adkins DR, Goodnough LT, Shenoy S, Brown R, Moellering J, Khoury H, Vij R and DiPersio J (2000) Effect of leukocyte compatibility on neutrophil increment after transfusion of granulocyte colony-stimulating factor-mobilized prophylactic granulocyte transfusions and on clinical outcomes after stem cell transplantation. Blood 95: 3605-3612 [5] Alavi JB, Root RK, Djerassi I, Evans AE, Gluckman SJ, MacGregor RR, Guerry D, Schreiber AD, Shaw JM, Koch P and Cooper RA (1977) A randomized clinical trial of granulocyte transfusions for infection in acute leukemia. N Engl J Med 296: 706-711 [6] Allen RC, Stevens PR, Price TH, Chatta GS and Dale DC (1997) In vivo effects of recombinant human granulocyte colony-stimulating factor on neutrophil oxidative functions in normal human volunteers. J Infect Dis 175: 1184-1192 [7] Alvarez do Barrio M, Gonzalez Diez R, Hernandez Sanchez JM and Oyonarte Gomez S (2005) Residual risk of transfusion-transmitted viral infections in Spain, 1997-2002, and impact of nucleic acid testing. Euro Surveill 10: 20-22 [8] Anderlini P, Przepiorka D, Seong D, Miller P, Sundberg J, Lichtiger B, Norfleet F, Chan KW, Champlin R and Korbling M (1996) Clinical toxicity and laboratory effects of granulocyte-colony-stimulating factor (filgrastim) mobilization and blood stem cell apheresis from normal donors, and analysis of charges for the procedures. Transfusion 36: 590-595 6 Verzeichnisse [9] 87 Appelbaum FR, Bowles CA, Makuch RW and Deisseroth AB (1978) Granulocyte transfusion therapy of experimental Pseudomonas septicemia: study of cell dose and collection technique. Blood 52: 323-331 [10] Athens JW, Haab OP, Raab SO, Mauer AM, Ashenbrucker H, Cartwright GE and Wintrobe MM (1961) Leukokinetic studies. IV. The total blood, circulating and marginal granulocyte pools and the granulocyte turnover rate in normal subjects. J Clin Invest 40: 989-995 [11] Bensinger WI, Price TH, Dale DC, Appelbaum FR, Clift R, Lilleby K, Williams B, Storb R, Thomas ED and Buckner CD (1993) The effects of daily recombinant human granulocyte colony-stimulating factor administration on normal granulocyte donors undergoing leukapheresis. Blood 81: 1883-1888 [12] Berliner S, Weinberger M, Ben-Bassat M, Lavie G, Weinberger A, Giller S and Pinkhas J (1985) Amphotericin B causes aggregation of neutrophils and enhances pulmonary leukostasis. Am Rev Respir Dis 132: 602-605 [13] Bertz H, Auner HW, Weissinger F, Salwender HJ, Einsele H, Egerer G, Sandherr M, Schuttrumpf S, Sudhoff T and Maschmeyer G (2003) Antimicrobial therapy of febrile complications after high-dose chemo-/radiotherapy and autologous hematopoietic stem cell transplantation--guidelines of the Infectious Diseases Working Party (AGIHO) of the German Society of Hematology and Oncology (DGHO). Ann Hematol 82 Suppl 2: S167-174 [14] Bishton M and Chopra R (2004) The role of granulocyte transfusions in neutropenic patients. British Journal of Haematology 127: 501-508 [15] Blum W, Hallem C, Vij R, Shenoy S, Goodnough L, Brown R, Khoury H, Westervelt P, DiPersio J and Adkins D (2001) Improved survival in allogeneic peripheral blood stem cell (PBSC) transplant patients who received prophylactic granulocyte transfusions from HLA-matched donors: long-term follow-up. Blood 98: 58a [16] Bodey GP, Buckley M, Sathe YS and Freireich EJ (1966) Quantitative relationships between circulating leukocytes and infection in patients with acute leukemia. Ann Intern Med 64: 328-340 [17] Boggs DR (1974) Transfusion of neutrophils as prevention or treatment of infection in patients with neutropenia. N Engl J Med 290: 1055-1062 6 Verzeichnisse [18] 88 Böhme A, Karthaus M, Einsele H, Ruhnke M, Südhoff T, Buchheidt D, Enzensberger R, Szelenyi H, Glasmacher A, Just-Nübling G and Gümbel H (1999) Diagnostik systemischer Pilzinfektionen in der Hämatologie. Standardempfehlungen der Arbeitsgemeinschaft Infektiologie in der Hämatologie und Onkologie der Deutschen Arbeitsgemeinschaft für Hämatologie und Onkologie. Dtsch Med Wochenschr 124 Suppl 1: S24-30 [19] Böhme A, Ruhnke M, Buchheidt D, Karthaus M, Einsele H, Guth S, Heussel G, Heussel CP, Junghanss C, Kern WK, Kubin T, Maschmeyer G, Sezer O, Silling G, Südhoff T, Szelenyi Dagger H and Ullmann AJ (2003) Treatment of fungal infections in hematology and oncology--guidelines of the Infectious Diseases Working Party (AGIHO) of the German Society of Hematology and Oncology (DGHO). Ann Hematol 82 Suppl 2: S133-140 [20] Boogaerts M, Maertens J, van Hoof A, de Bock R, Fillet G, Peetermans M, Selleslag D, Vandercam B, Vandewoude K, Zachee P and De Beule K (2001) Itraconazole versus amphotericin B plus nystatin in the prophylaxis of fungal infections in neutropenic cancer patients. J Antimicrob Chemother 48: 97-103 [21] Bothner U, Georgieff M and Vogt NH (1998) Assessment of the safety and tolerance of 6% hydroxyethyl starch (200/0.5) solution: a randomized, controlled epidemiology study. Anesth Analg 86: 850-855 [22] Brecher G, Cronkite EP, Bond VP and Dutcher TF (1958) Problems of leucocyte transfusions. Acta Haematol 20: 179-184 [23] Brecher G, Wilbur KM and Cronkite EP (1953) Transfusion of separated leukocytes into irradiated dogs with aplastic marrows. Proc Soc Exp Biol Med 84: 54-56 [24] Briones MA, Josephson CD and Hillyer CD (2003) Granulocyte transfusion: revisited. Curr Hematol Rep 2: 522-527 [25] Buckner CD and Clift RA (1984) Prophylaxis and treatment of infection of the immunocompromised host by granulocyte transfusions. Clin Haematol 13: 557-572 [26] Bundesärztekammer (2003). Leitlinien zur Therapie mit Blutkomponenten und Plasmaderivaten, 3. überarbeitete und erweiterte Auflage. Deutscher Ärzte-Verlag, Köln: 49-61 6 Verzeichnisse [27] 89 Bundesärztekammer und Paul-Ehrlich-Institut (2004) Richtlinien zur Gewinnung von Blut und Blutbestandteilen und zur Anwendung von Blutprodukten (Hämotherapie) (berücksichtigt Neufassungen 2001 und 2003). Deutscher Ärzte-Verlag, Köln [28] Bux J, Cassens U, Dielschneider T, Duchscherer M, Edel E, Eichler H, Haas C, Moog R, Peschke H, Peters C, Ryzenkov I, Schlenke P, Ullrich H and Wiesneth M (2003) Tolerance of granulocyte donors towards granulocyte colony-stimulating factor stimulation and of patients towards granulocyte transfusions: results of a multicentre study. Vox Sang 85: 322-325 [29] Cairo MS (1990) The use of granulocyte transfusion in neonatal sepsis. Transfus Med Rev 4: 14-22 [30] Cairo MS, Worcester CC, Rucker RW, Hanten S, Amlie RN, Sender L and Hicks DA (1992) Randomized trial of granulocyte transfusions versus intravenous immune globulin therapy for neonatal neutropenia and sepsis. J Pediatr 120: 281-285 [31] Caspar CB, Seger RA, Burger J and Gmur J (1993) Effective stimulation of donors for granulocyte transfusions with recombinant methionyl granulocyte colony-stimulating factor. Blood 81: 2866-2871 [32] Cavallaro AM, Lilleby K, Majolino I, Storb R, Appelbaum FR, Rowley SD and Bensinger WI (2000) Three to six year follow-up of normal donors who received recombinant human granulocyte colony-stimulating factor. Bone Marrow Transplant 25: 8589 [33] Cesaro S, Chinello P, De Silvestro G, Marson P, Picco G, Varotto S, Pittalis S and Zanesco L (2003) Granulocyte transfusions from G-CSF-stimulated donors for the treatment of severe infections in neutropenic pediatric patients with oncohematological diseases. Support Care Cancer 11: 101-106 [34] Chatta GS, Price TH, Allen RC and Dale DC (1994) Effects of in vivo recombinant methionyl human granulocyte colony-stimulating factor on the neutrophil response and peripheral blood colony-forming cells in healthy young and elderly adult volunteers. Blood 84: 2923-2929 [35] Colotta F, Re F, Polentarutti N, Sozzani S and Mantovani A (1992) Modulation of granulocyte survival and programmed cell death by cytokines and bacterial products. Blood 80: 2012-2020 6 Verzeichnisse [36] 90 Crawford J, Ozer H, Stoller R, Johnson D, Lyman G, Tabbara I, Kris M, Grous J, Picozzi V, Rausch G and et al. (1991) Reduction by granulocyte colony-stimulating factor of fever and neutropenia induced by chemotherapy in patients with small-cell lung cancer. N Engl J Med 325: 164-170 [37] Dahlke MB, Shah SL, Sherwood WC, Shafer AW and Brownstein PK (1979) Priapism during filtration leukapheresis. Transfusion 19: 482-486 [38] Dale DC (1994) Potential role of colony-stimulating factors in the prevention and treatment of infectious diseases. Clin Infect Dis 18 Suppl 2: S180-188 [39] Dale DC, Fauci AS, Guerry DI and Wolff SM (1975) Comparison of agents producing a neutrophilic leukocytosis in man. Hydrocortisone, prednisone, endotoxin, and etiocholanolone. J Clin Invest 56: 808-813 [40] Dale DC, Liles WC, Llewellyn C, Rodger E and Price TH (1998) Neutrophil transfusions: kinetics and functions of neutrophils mobilized with granulocyte-colonystimulating factor and dexamethasone. Transfusion 38: 713-721 [41] Dale DC, Liles WC and Price TH (1997) Renewed interest in granulocyte transfusion therapy. Br J Haematol 98: 497-501 [42] Dancey JT, Deubelbeiss KA, Harker LA and Finch CA (1976) Neutrophil kinetics in man. J Clin Invest 58: 705-715 [43] Demetri GD and Griffin JD (1991) Granulocyte colony-stimulating factor and its receptor. Blood 78: 2791-2808 [44] Denning DW (1998) Invasive aspergillosis. Clin Infect Dis 26: 781-803; quiz 804-785 [45] Denning DW, Ribaud P, Milpied N, Caillot D, Herbrecht R, Thiel E, Haas A, Ruhnke M and Lode H (2002) Efficacy and safety of voriconazole in the treatment of acute invasive aspergillosis. Clin Infect Dis 34: 563-571 [46] Denning DW and Stevens DA (1990) Antifungal and surgical treatment of invasive aspergillosis: review of 2,121 published cases. Rev Infect Dis 12: 1147-1201 [47] Deutsche Gesellschaft für Transfusionsmedizin und Immunhämatologie (1998) Durchführung präparativer zellulärer Hämapheresen zur Gewinnung von Blutbestandteilkonzentraten. II. Empfehlungen zur präparativen Leuko- und Thrombozytapherese der Deutschen Gesellschaft für Transfusionsmedizin und Immunhämatologie (DGTI). Infusionsther Transfusionsmed 25: 376-382 6 Verzeichnisse [48] 91 Dignani MC, Anaissie EJ, Hester JP, O'Brien S, Vartivarian SE, Rex JH, Kantarjian H, Jendiroba DB, Lichtiger B, Andersson BS and Freireich EJ (1997) Treatment of neutropenia-related fungal infections with granulocyte colony-stimulating factorelicited white blood cell transfusions: a pilot study. Leukemia 11: 1621-1630 [49] Donnelly JP and Pauw BE (2005) Infections in the immunocompromised host: general principles. In: Mandell GL, Bennett JE, Dolin R (eds.) Mandell, Douglas and Bennett's principles and practice of infectious diseases. 6th edition. Churchill Livingstone, New York, 2: 3421-3432 [50] Doorduijn JK, Buijt I, van der Holt B, van Agthoven M, Sonneveld P and Uyl-de Groot CA (2004) Economic evaluation of prophylactic granulocyte colony stimulating factor during chemotherapy in elderly patients with aggressive non-Hodgkin's lymphoma. Haematologica 89: 1109-1117 [51] Dreger P and Schmitz N (2004). Bildung, Aufbau, Funktion und Kinetik hämatopoetischer Zellen. In: Mueller-Eckhardt C, Kiefel V (Hrsg.) Transfusionsmedizin. 3. Aufl. Springer, Berlin, Heidelberg, New York: 19-39 [52] Dutcher JP, Kendall J, Norris D, Schiffer C, Aisner J and Wiernik PH (1989) Granulocyte transfusion therapy and amphotericin B: adverse reactions? Am J Hematol 31: 102-108 [53] Einsele H, Bertz H, Beyer J, Kiehl MG, Runde V, Kolb HJ, Holler E, Beck R, Schwerdfeger R, Schumacher U, Hebart H, Martin H, Kienast J, Ullmann AJ, Maschmeyer G, Kruger W, Niederwieser D, Link H, Schmidt CA, Oettle H and Klingebiel T (2003) Infectious complications after allogeneic stem cell transplantation: epidemiology and interventional therapy strategies--guidelines of the Infectious Diseases Working Party (AGIHO) of the German Society of Hematology and Oncology (DGHO). Ann Hematol 82 Suppl 2: S175-185 [54] Einsele H, Heesemann J, Roggenkamp A, Hengel H and Koszinowski U (2000) Infektionen bei Immunsuppression. In: Marre R, Mertens T, Trautmann M, Vanek E (Hrsg.) Klinische Infektiologie. 1. Aufl. Urban & Fischer, München, Jena: 811-835 6 Verzeichnisse [55] 92 EuropäischeUnion (2003) Richtlinie 2002/98/EG des Europäischen Parlaments und des Rates vom 27.01.2003 zur Festlegung von Qualitäts- und Sicherheitsstandards für die Gewinnung, Testung, Verarbeitung, Lagerung und Verteilung von menschlichem Blut und Blutbestandteilen und zur Änderung der Richtlinie 2001/83/EG. Amtsbl der Europ Union L33/30 [56] Fätkenheuer G, Buchheidt D, Fuhr HG, Heussel G, Junghanss C, Karthaus M, Kellner O, Kern WV, Kisro J, Sezer O, Südhoff T and Szelenyi H (2001) Venenkatheterassoziierte Infektionen bei Patienten mit Neutropenie. Dtsch Med Wochenschr 126: 89-95 [57] Fortuny IE, Bloomfield CD, Hadlock DC, Goldman A, Kennedy BJ and McCullough JJ (1975) Granylocyte transfusion: a controlled study in patients with acute nonlymphocytic leukemia. Transfusion 15: 548-558 [58] Freireich EJ, Levin RH, Whang J, Carbone PP, Bronson W and Morse EE (1964) The function and fate of transfused leukocytes from donors with chronic myelocytic leukemia in leukopenic recipients. Ann N Y Acad Sci 113: 1081-1089 [59] French JE, Solomon JM and Fratantoni JC (1982) Survey on the current use of leukapheresis and the collection of granulocyte concentrates. Transfusion 22: 220-225 [60] Gabrilove JL and Jakubowski A (1990) Hematopoietic growth factors: biology and clinical application. J Natl Cancer Inst Monogr 73-77 [61] Ghodsi Z and Strauss RG (2001) Cataracts in neutrophil donors stimulated with adrenal corticosteroids. Transfusion 41: 1464-1468 [62] Giamarellos-Bourboulis EJ, Grecka P, Poulakou G, Anargyrou K, Katsilambros N and Giamarellou H (2001) Assessment of procalcitonin as a diagnostic marker of underlying infection in patients with febrile neutropenia. Clin Infect Dis 32: 1718-1725 [63] Graw RG, Jr., Herzig G, Perry S and Henderson ES (1972) Normal granulocyte transfusion therapy: treatment of septicemia due to gram-negative bacteria. N Engl J Med 287: 367-371 [64] Grigg A, Vecchi L, Bardy P and Szer J (1996) G-CSF stimulated donor granulocyte collections for prophylaxis and therapy of neutropenic sepsis. Aust N Z J Med 26: 813-818 6 Verzeichnisse [65] 93 Hammerschmidt DE, Craddock PR, McCullough F, Kronenberg RS, Dalmasso AP and Jacob HS (1978) Complement activation and pulmonary leukostasis during nylon fiber filtration leukapheresis. Blood 51: 721-730 [66] Herbrecht R, Denning DW, Patterson TF, Bennett JE, Greene RE, Oestmann JW, Kern WV, Marr KA, Ribaud P, Lortholary O, Sylvester R, Rubin RH, Wingard JR, Stark P, Durand C, Caillot D, Thiel E, Chandrasekar PH, Hodges MR, Schlamm HT, Troke PF and de Pauw B (2002) Voriconazole versus amphotericin B for primary therapy of invasive aspergillosis. N Engl J Med 347: 408-415 [67] Hersman J, Meyers JD, Thomas ED, Buckner CD and Clift R (1982) The effect of granulocyte transfusions on the incidence of cytomegalovirus infection after allogeneic marrow transplantation. Ann Intern Med 96: 149-152 [68] Herzig RH (1989) The negative aspects of granulocyte transfusions. Cancer Invest 7: 589-592 [69] Herzig RH, Herzig GP, Graw RG, Jr., Bull MI and Ray KK (1977) Successful granulocyte transfusion therapy for gram-negative septicemia. A prospectively randomized controlled study. N Engl J Med 296: 701-705 [70] Hester JP, Dignani MC, Anaissie EJ, Kantarjian HM, O'Brien S and Freireich EJ (1995) Collection and transfusion of granulocyte concentrates from donors primed with granulocyte stimulating factor and response of myelosuppressed patients with established infection. J Clin Apheresis 10: 188-193 [71] Higby D and Burnett D (1980) Granulocyte transfusions: current status. Blood 55: 2-8 [72] Higby D, Yates JW, Henderson ES and Holland JF (1975) Filtration leukapheresis for granulocyte transfusion therapy. Clinical and laboratory studies. N Engl J Med 292: 761-766 [73] Hill CP, Osslund TD and Eisenberg D (1993) The structure of granulocyte-colonystimulating factor and its relationship to other growth factors. Proc Natl Acad Sci U S A 90: 5167-5171 [74] Hoffbrand AV, Pettit JE, Moss PAH and Hoelzer D (2003) Grundkurs Hämatologie. 2., aktualisierte und erweiterte Auflage. Blackwell, Berlin, Wien 6 Verzeichnisse [75] 94 Holländer G, Barthlott T, Keller M, Krenger W and Piali L (2005) Das natürliche Immunsystem. In: Wahn U, Seger R, Wahn V, Holländer GA (Hrsg.) Pädiatrische Allergologie und Immunologie. 4. Aufl. Urban & Fischer, München, Jena: 7-38 [76] Hollingshead LM and Goa KL (1991) Recombinant granulocyte colony-stimulating factor (rG-CSF). A review of its pharmacological properties and prospective role in neutropenic conditions. Drugs 42: 300-330 [77] Hübel K, Carter RA, Liles WC, Dale DC, Price TH, Bowden RA, Rowley SD, Chauncey TR, Bensinger WI and Boeckh M (2002) Granulocyte transfusion therapy for infections in candidates and recipients of HPC transplantation: a comparative analysis of feasibility and outcome for community donors versus related donors. Transfusion 42: 1414-1421 [78] Hübel K, Dale DC, Engert A and Liles WC (2001) Current status of granulocyte (neutrophil) transfusion therapy for infectious diseases. J Infect Dis 183: 321-328 [79] Hübel K, Dale DC and Liles WC (2001) Granulocyte transfusion therapy: update on potential clinical applications. Curr Opin Hematol 8: 161-164 [80] Hübel K, Rodger E, Gaviria JM, Price TH, Dale DC and Liles WC (2005) Effective storage of granulocytes collected by centrifugation leukapheresis from donors stimulated with granulocyte-colony-stimulating factor. Transfusion 45: 1876-1889 [81] Hughes WT, Armstrong D, Bodey GP, Bow EJ, Brown AE, Calandra T, Feld R, Pizzo PA, Rolston KV, Shenep JL and Young LS (2002) 2002 guidelines for the use of antimicrobial agents in neutropenic patients with cancer. Clin Infect Dis 34: 730-751 [82] Hughes WT, Armstrong D, Bodey GP, Brown AE, Edwards JE, Feld R, Pizzo P, Rolston KV, Shenep JL and Young LS (1997) 1997 guidelines for the use of antimicrobial agents in neutropenic patients with unexplained fever. Infectious Diseases Society of America. Clin Infect Dis 25: 551-573 [83] Illerhaus G, Wirth K, Dwenger A, Waller CF, Garbe A, Brass V, Lang H and Lange W (2002) Treatment and prophylaxis of severe infections in neutropenic patients by granulocyte transfusions. Ann Hematol 81: 273-281 [84] Jendiroba DB, Lichtiger B, Anaissie E, Reddy V, O'Brien S, Kantarjian H and Freireich EJ (1998) Evaluation and comparison of three mobilization methods for the collection of granulocytes. Transfusion 38: 722-728 6 Verzeichnisse [85] 95 Joos K, Herzog R, Einsele H, Northoff H and Neumeister B (2002) Characterization and functional analysis of granulocyte concentrates collected from donors after repeated G-CSF stimulation. Transfusion 42: 603-611 [86] Karp DD, Ervin TJ, Tuttle S, Gorgone BC, Lavin P and Yunis EJ (1982) Pulmonary complications during granulocyte transfusions: incidence and clinical features. Vox Sang 42: 57-61 [87] Kern WV, Beyer J, Böhme A, Buchheidt D, Cornely O, Einsele H, Kisro J, Krüger W, Maschmeyer G, Ruhnke M, Schmidt CA, Schwartz S and Szelenyi H (2000) Infektionsprophylaxe bei neutropenischen Patienten. Dtsch Med Wochenschr 125: 15821588 [88] Kerr JP, Liakopolou E, Brown J, Cornish JM, Fleming D, Massey E, Oakhill A, Pamphilon DH, Robinson SP, Totem A, Valencia AM and Marks DI (2003) The use of stimulated granulocyte transfusions to prevent recurrence of past severe infections after allogeneic stem cell transplantation. Br J Haematol 123: 114-118 [89] Klein HG, Strauss RG and Schiffer CA (1996) Granulocyte transfusion therapy. Semin Hematol 33: 359-368 [90] Laurenti F, Ferro R, Isacchi G, Panero A, Savignoni PG, Malagnino F, Palermo D, Mandelli F and Bucci G (1981) Polymorphonuclear leukocyte transfusion for the treatment of sepsis in the newborn infant. J Pediatr 98: 118-123 [91] Leavey PJ, Thurman G and Ambruso DR (2000) Functional characteristics of neutrophils collected and stored after administration of G-CSF. Transfusion 40: 414-419 [92] Lee JH, Cullis H, Leitman SF and Klein HG (1995) Efficacy of pentastarch in granulocyte collection by centrifugal leukapheresis. J Clin Apheresis 10: 198-202 [93] Lee JH, Leitman SF and Klein HG (1995) A controlled comparison of the efficacy of hetastarch and pentastarch in granulocyte collections by centrifugal leukapheresis. Blood 86: 4662-4666 [94] Lee JJ, Chung IJ, Park MR, Kook H, Hwang TJ, Ryang DW and Kim HJ (2001) Clinical efficacy of granulocyte transfusion therapy in patients with neutropeniarelated infections. Leukemia 15: 203-207 6 Verzeichnisse [95] 96 Lee JJ, Song HC, Chung IJ, Bom HS, Cho D and Kim HJ (2004) Clinical efficacy and prediction of response to granulocyte transfusion therapy for patients with neutropenia-related infections. Haematologica 89: 632-633 [96] Lieschke GJ, Grail D, Hodgson G, Metcalf D, Stanley E, Cheers C, Fowler KJ, Basu S, Zhan YF and Dunn AR (1994) Mice lacking granulocyte colony-stimulating factor have chronic neutropenia, granulocyte and macrophage progenitor cell deficiency, and impaired neutrophil mobilization. Blood 84: 1737-1746 [97] Liles WC, Dale DC and Klebanoff SJ (1995) Glucocorticoids inhibit apoptosis of human neutrophils. Blood 86: 3181-3188 [98] Liles WC, Huang JE, Llewellyn C, SenGupta D, Price TH and Dale DC (1997) A comparative trial of granulocyte-colony-stimulating factor and dexamethasone, separately and in combination, for the mobilization of neutrophils in the peripheral blood of normal volunteers. Transfusion 37: 182-187 [99] Liles WC, Rodger E and Dale DC (2000) Combined administration of G-CSF and dexamethasone for the mobilization of granulocytes in normal donors: optimization of dosing. Transfusion 40: 642-644 [100] Liles WC and Van Voorhis WC (1995) Review: nomenclature and biologic significance of cytokines involved in inflammation and the host immune response. J Infect Dis 172: 1573-1580 [101] Link H (1997) Infektionen und Tumorerkrankungen: Therapie und Prophylaxe. In: Ostendorf PC, Seeber S (Hrsg.) Hämatologie and Onkologie. 1. Aufl. Urban & Schwarzenberg, München, Wien, Baltimore: 884-893 [102] Link H, Blumenstengel K, Böhme A, Cornely O, Kellner O, Nowrousian MR, Ostermann H, Schiel X and Wilhelm M (1999) Antimikrobielle Therapie von unerklärtem Fieber bei Neutropenie. Standardempfehlungen der Arbeitsgemeinschaft Infektiologie in der Hämatologie und Onkologie der Deutschen Gesellschaft für Hämatologie und Onkologie. Dtsch Med Wochenschr 124 Suppl 1: S3-8 6 Verzeichnisse 97 [103] Link H, Böhme A, Cornely OA, Höffken K, Kellner O, Kern WV, Mahlberg R, Maschmeyer G, Nowrousian MR, Ostermann H, Ruhnke M, Sezer O, Schiel X, Wilhelm M and Auner HW (2003) Antimicrobial therapy of unexplained fever in neutropenic patients--guidelines of the Infectious Diseases Working Party (AGIHO) of the German Society of Hematology and Oncology (DGHO), Study Group Interventional Therapy of Unexplained Fever, Arbeitsgemeinschaft Supportivmassnahmen in der Onkologie (ASO) of the Deutsche Krebsgesellschaft (DKG-German Cancer Society). Ann Hematol 82 Suppl 2: S105-117 [104] Link H, Maschmeyer G, Meyer P, Hiddemann W, Stille W, Helmerking M and Adam D (1994) Interventional antimicrobial therapy in febrile neutropenic patients. Study Group of the Paul Ehrlich Society for Chemotherapy. Ann Hematol 69: 231-243 [105] Lowenthal RM, Grossman L, Goldman JM, Storring RA, Buskard NA, Park DS, Murphy BC, Spiers AS and Galton DA (1975) Granulocyte transfusions in treatment of infections in patients with acute leukaemia and aplastic anaemia. Lancet 1: 353-358 [106] Lyman GH (2003) Balancing the benefits and costs of colony-stimulating factors: a current perspective. Semin Oncol 30: 10-17 [107] Lyman GH, Lyman CG, Sanderson RA and Balducci L (1993) Decision analysis of hematopoietic growth factor use in patients receiving cancer chemotherapy. J Natl Cancer Inst 85: 488-493 [108] Mannoni P, Rodet M, Vernant JP, Brun B, Coquin-Radeau EI, Bracq C, Rochant H and Dreyfus B (1979) Efficiency of prophylactic granulocyte transfusions in preventing infections in acute leukaemia. Rev Fr Transfus Immunohematol 22: 503-518 [109] Marx A and Drenckhahn D (2004) Blut, Blutbildung. In: Benninghoff A (Begr.), Drenckhahn D (Hrsg.) Anatomie. 16. Aufl. Urban & Fischer, München, 2: 17-40 [110] Maschmeyer G, Link H, Hiddemann W, Meyer P, Helmerking M, Eisenmann E, Schmitt J and Adam D (1994) Pulmonary infiltrations in febrile patients with neutropenia. Risk factors and outcome under empirical antimicrobial therapy in a randomized multicenter study. Cancer 73: 2296-2304 [111] McCredie KB, Freireich EJ, Hester JP and Vallejos C (1974) Increased granulocyte collection with the blood cell separator and the addition of etiocholanolone and hydroxyethyl starch. Transfusion 14: 357-364 6 Verzeichnisse 98 [112] McCullough J (1979) Leukapheresis and granulocyte transfusion. CRC Crit Rev Clin Lab Sci 10: 275-327 [113] McCullough J, Clay M, Herr G, Smith J and Stroncek D (1999) Effects of granulocyte-colony-stimulating factor on potential normal granulocyte donors. Transfusion 39: 1136-1140 [114] McCullough J, Clay M, Hurd D, Richards K, Ludvigsen C and Forstrom L (1986) Effect of leukocyte antibodies and HLA matching on the intravascular recovery, survival, and tissue localization of 111-indium granulocytes. Blood 67: 522-528 [115] McCullough J, Weiblen BJ, Deinard AR, Boen J, Fortuny IE and Quie PG (1976) In vitro function and post-transfusion survival of granulocytes collected by continuousflow centrifugation and by filtration leukapheresis. Blood 48: 315-326 [116] Menitove JE and Abrams RA (1987) Granulocyte transfusions in neutropenic patients. Crit Rev Oncol Hematol 7: 89-113 [117] Middleton J, Patterson AM, Gardner L, Schmutz C and Ashton BA (2002) Leukocyte extravasation: chemokine transport and presentation by the endothelium. Blood 100: 3853-3860 [118] Mishler JM (1975) Hydroxyethyl starch as an experimental adjunct to leukocyte separation by centrifugal means: review of safety and efficacy. Transfusion 15: 449-460 [119] Mishler JM, Hadlock DC, Fortuny IE, Nicora RW and McCullough JJ (1974) Increased efficiency of leukocyte collection by the addition of hydroxyethyl starch to the continuous flow centrifuge. Blood 44: 571-581 [120] Mishler JM, Moser AM and Carter JB (1976) The safety of dexamethasone and hydroxyethyl starch in the multiply leukapheresed donor. Transfusion 16: 170-173 [121] Morse EE, Freireich EJ, Carbone PP, Bronson W and Frei E (1965) The transfusion of leukocytes from donors with chronic myelocytic leukemia to patients with leukopenia. Transfusion 6: 183-192 [122] Nichols WG, Price T and Boeckh M (2002) Cytomegalovirus infections in cancer patients receiving granulocyte transfusions. Blood 99: 3483-3484 [123] Niethammer D (1997) Erkrankungen des leukozytären Systems. In: Ostendorf PC, Seeber S (Hrsg.) Hämatologie and Onkologie. 1. Aufl. Urban & Schwarzenberg, München, Wien, Baltimore: 455-462 6 Verzeichnisse 99 [124] Niethammer D (1997) Granulozytäres System. In: Ostendorf PC, Seeber S (Hrsg.) Hämatologie and Onkologie. 1. Aufl. Urban & Schwarzenberg, München, Wien, Baltimore: 17-23 [125] Ostermann H, Derigs HG, Heussel G, Kern WV, Kiehl M, Kienast J, Mesters R, Schiel X, Schumann RR and Weiss M (1999) Sepsis in neutropenia. Standard recommendations of the Work Group of Infections in Hematology and Oncology of the German Association for Hematology and Oncology. Dtsch Med Wochenschr 124 Suppl 1: S14-17 [126] Ozer H, Armitage JO, Bennett CL, Crawford J, Demetri GD, Pizzo PA, Schiffer CA, Smith TJ, Somlo G, Wade JC, Wade JL, 3rd, Winn RJ, Wozniak AJ and Somerfield MR (2000) 2000 update of recommendations for the use of hematopoietic colonystimulating factors: evidence-based, clinical practice guidelines. American Society of Clinical Oncology Growth Factors Expert Panel. J Clin Oncol 18: 3558-3585 [127] Patterson TF, Kirkpatrick WR, White M, Hiemenz JW, Wingard JR, Dupont B, Rinaldi MG, Stevens DA and Graybill JR (2000) Invasive aspergillosis. Disease spectrum, treatment practices, and outcomes. I3 Aspergillus Study Group. Medicine (Baltimore) 79: 250-260 [128] Peters C, Minkov M, Matthes-Martin S, Potschger U, Witt V, Mann G, Hocker P, Worel N, Stary J, Klingebiel T and Gadner H (1999) Leucocyte transfusions from rhG-CSF or prednisolone stimulated donors for treatment of severe infections in immunocompromised neutropenic patients. Br J Haematol 106: 689-696 [129] Pfaffenbach B, Donhuijsen K, Pahnke J, Bug R, Adamek RJ, Wegener M and Ricken D (1994) Systemic fungal infections in hematologic neoplasms. An autopsy study of 1,053 patients. Med Klin (Munich) 89: 299-304 [130] Phillips TR, Yang WC and Schultz RD (1987) The effects of glucocorticosteroids on the chemiluminescence response of bovine phagocytic cells. Vet Immunol Immunopathol 14: 245-256 [131] Pillonel J and Laperche S (2005) Trends in risk of transfusion-transmitted viral infections (HIV, HCV, HBV) in France between 1992 and 2003 and impact of nucleic acid testing (NAT). Euro Surveill 10: 5-8 [132] Pizzo PA (1993) Management of fever in patients with cancer and treatment-induced neutropenia. N Engl J Med 328: 1323-1332 6 Verzeichnisse 100 [133] Price TH, Bowden RA, Boeckh M, Bux J, Nelson K, Liles WC and Dale DC (2000) Phase I/II trial of neutrophil transfusions from donors stimulated with G-CSF and dexamethasone for treatment of patients with infections in hematopoietic stem cell transplantation. Blood 95: 3302-3309 [134] Price TH and Dale DC (1979) Blood kinetics and in vivo chemotaxis of transfused neutrophils: effect of collection method, donor corticosteroid treatment, and shortterm storage. Blood 54: 977-986 [135] Pries A, Wenger R and Zakrezewicz (2005) Blut. In: Deetjen P, Speckmann EJ, Hescheler J (Hrsg.) Physiologie. Urban & Fischer, München, Jena: 339-377 [136] Ramphal R (2004) Changes in the etiology of bacteremia in febrile neutropenic patients and the susceptibilities of the currently isolated pathogens. Clin Infect Dis 39 Suppl 1: S25-31 [137] Roilides E, Walsh TJ, Pizzo PA and Rubin M (1991) Granulocyte colony-stimulating factor enhances the phagocytic and bactericidal activity of normal and defective human neutrophils. J Infect Dis 163: 579-583 [138] Rolston KV (2004) The Infectious Diseases Society of America 2002 guidelines for the use of antimicrobial agents in patients with cancer and neutropenia: salient features and comments. Clin Infect Dis 39 Suppl 1: S44-48 [139] Rutella S, Pierelli L, Sica S, Serafini R, Chiusolo P, Paladini U, Leone F, Zini G, D'Onofrio G, Leone G and Piccirillo N (2003) Efficacy of granulocyte transfusions for neutropenia-related infections: retrospective analysis of predictive factors. Cytotherapy 5: 19-30 [140] Sachs UJ and Bux J (2003) TRALI after the transfusion of cross-match-positive granulocytes. Transfusion 43: 1683-1686 [141] Safdar A and Armstrong D (2001) Infectious morbidity in critically ill patients with cancer. Crit Care Clin 17: 531-570, vii-viii [142] Safdar A, Hanna HA, Boktour M, Kontoyiannis DP, Hachem R, Lichtiger B, Freireich EJ and Raad, II (2004) Impact of high-dose granulocyte transfusions in patients with cancer with candidemia: retrospective case-control analysis of 491 episodes of Candida species bloodstream infections. Cancer 101: 2859-2865 6 Verzeichnisse 101 [143] Sakamaki S, Matsunaga T, Hirayama Y, Kuga T and Niitsu Y (1995) Haematological study of healthy volunteers 5 years after G-CSF. Lancet 346: 1432-1433 [144] Schiffer CA, Aisner J, Daly PA, Schimpff SC and Wiernik PH (1979) Alloimmunization following prophylactic granulocyte transfusion. Blood 54: 766-774 [145] Schmitt A, Reinhardt P, Schmitt M, Nowak-Harnau S, Maccari B, Schulz A, Kubanek B and Wiesneth M (2002) Functional state of steroid- versus G-CSF-mobilized granulocytes: considerations about the storage of granulocyte concentrates for neutropenic patients. Infus Ther Transfus Med 29: 57-64 [146] Schreiber GB, Busch MP, Kleinman SH and Korelitz JJ (1996) The risk of transfusion-transmitted viral infections. The Retrovirus Epidemiology Donor Study. N Engl J Med 334: 1685-1690 [147] Shoji M and Vogler WR (1974) Effects of hydrocortisone on the yield and bactericidal function of granulocytes collected by continuous-flow centrifugation. Blood 44: 435443 [148] Silliman CC and McLaughlin NJ (2006) Transfusion-related acute lung injury. Blood Rev 20: 139-159 [149] Söhngen D, Wienen S, Siebler M, Boogen C, Scheid C, Schulz A, Kobbe G, Diehl V and Heyll A (1998) Analysis of rhG-CSF-effects on platelets by in vitro bleeding test and transcranial Doppler ultrasound examination. Bone Marrow Transplant 22: 10871090 [150] Steward WP (1993) Granulocyte and granulocyte-macrophage colony-stimulating factors. Lancet 342: 153-157 [151] Stoll M, Treib J, Schenk JF, Windisch F, Haass A, Wenzel E and Schimrigk K (1997) No coagulation disorders under high-dose volume therapy with low-molecular-weight hydroxyethyl starch. Haemostasis 27: 251-258 [152] Strauss RG (1989) Current status of granulocyte transfusions to treat neonatal sepsis. J Clin Apheresis 5: 25-29 [153] Strauss RG (1993) Therapeutic granulocyte transfusions in 1993. Blood 81: 16751678 6 Verzeichnisse 102 [154] Stroncek DF, Clay ME, Herr G, Smith J, Ilstrup S and McCullough J (1997) Blood counts in healthy donors 1 year after the collection of granulocyte-colony-stimulating factor-mobilized progenitor cells and the results of a second mobilization and collection. Transfusion 37: 304-308 [155] Stroncek DF, Clay ME, Petzoldt ML, Smith J, Jaszcz W, Oldham FB and McCullough J (1996) Treatment of normal individuals with granulocyte-colony-stimulating factor: donor experiences and the effects on peripheral blood CD34+ cell counts and on the collection of peripheral blood stem cells. Transfusion 36: 601-610 [156] Stroncek DF, Leonard K, Eiber G, Malech HL, Gallin JI and Leitman SF (1996) Alloimmunization after granulocyte transfusions. Transfusion 36: 1009-1015 [157] Stroncek DF, Matthews CL, Follmann D and Leitman SF (2002) Kinetics of G-CSFinduced granulocyte mobilization in healthy subjects: effects of route of administration and addition of dexamethasone. Transfusion 42: 597-602 [158] Strumia MM (1934) The effect of leukocytic cream injections in the treatment of the neutropenia. Am J Med Sci 187: 527-544 [159] Thomas L (1998) Labor und Diagnose. 5. Aufl. TH-Books, Frankfurt/Main [160] Treib J, Haass A and Pindur G (1997) Coagulation disorders caused by hydroxyethyl starch. Thromb Haemost 78: 974-983 [161] Treib J, Haass A, Pindur G, Grauer MT, Jung F, Wenzel E and Schimrigk K (1997) Increased haemorrhagic risk after repeated infusion of highly substituted medium molecular weight hydroxyethyl starch. Arzneimittelforschung 47: 18-22 [162] Treib J, Haass A, Pindur G, Grauer MT, Wenzel E and Schimrigk K (1996) All medium starches are not the same: influence of the degree of hydroxyethyl substitution of hydroxyethyl starch on plasma volume, hemorrheologic conditions, and coagulation. Transfusion 36: 450-455 [163] Treib J, Haass A, Pindur G, Treib W, Wenzel E and Schimrigk K (1996) Influence of intravascular molecular weight of hydroxyethyl starch on platelets. Eur J Haematol 56: 168-172 6 Verzeichnisse 103 [164] Trillet-Lenoir V, Green J, Manegold C, Von Pawel J, Gatzemeier U, Lebeau B, Depierre A, Johnson P, Decoster G, Tomita D and et al. (1993) Recombinant granulocyte colony stimulating factor reduces the infectious complications of cytotoxic chemotherapy. Eur J Cancer 29A: 319-324 [165] Uyl-de Groot CA, Vellenga E and Rutten FF (1996) An economic model to assess the savings from a clinical application of haematopoietic growth factors. Eur J Cancer 32A: 57-62 [166] Vamvakas EC and Pineda AA (1996) Meta-analysis of clinical studies of the efficacy of granulocyte transfusions in the treatment of bacterial sepsis. J Clin Apher 11: 1-9 [167] Vamvakas EC and Pineda AA (1997) Determinants of the efficacy of prophylactic granulocyte transfusions: a meta-analysis. J Clin Apher 12: 74-81 [168] Vogler WR and Winton EF (1977) A controlled study of the efficacy of granulocyte transfusions in patients with neutropenia. Am J Med 63: 548-555 [169] Walsh TJ, Teppler H, Donowitz GR, Maertens JA, Baden LR, Dmoszynska A, Cornely OA, Bourque MR, Lupinacci RJ, Sable CA and dePauw BE (2004) Caspofungin versus liposomal amphotericin B for empirical antifungal therapy in patients with persistent fever and neutropenia. N Engl J Med 351: 1391-1402 [170] Weiss C and Jelkmann W (2000) Funktion des Blutes. In: Schmidt RF, Thews G, Lang F (Hrsg.) Physiologie des Menschen. 28. Aufl. Springer, Berlin, Heidelberg, New York: 411-447 [171] Williams ME and Quesenberry PJ (1992) Hematopoietic growth factors. Hematol Pathol 6: 105-124 [172] Wingard JR (2004) Empirical antifungal therapy in treating febrile neutropenic patients. Clin Infect Dis 39 Suppl 1: S38-43 [173] Winston DJ, Ho WG and Gale RP (1982) Therapeutic granulocyte transfusions for documented infections. A controlled trial in ninety-five infectious granulocytopenic episodes. Ann Intern Med 97: 509-515 [174] Winston DJ, Ho WG, Young LS and Gale RP (1980) Prophylactic granulocyte transfusions during human bone marrow transplantation. Am J Med 68: 893-897 [175] Wright DG (1984) Symposium on infectious complications of neoplastic disease (Part II). Leukocyte transfusions: thinking twice. Am J Med 76: 637-644 6 Verzeichnisse 104 [176] Wright DG, Robichaud KJ, Pizzo PA and Deisseroth AB (1981) Lethal pulmonary reactions associated with the combined use of amphotericin B and leukocyte transfusions. N Engl J Med 304: 1185-1189 [177] Yadegarynia D, Tarrand J, Raad I and Rolston K (2003) Current spectrum of bacterial infections in patients with cancer. Clin Infect Dis 37: 1144-1145 [178] Yomtovian R, Abramson J, Quie P and McCullough J (1981) Granulocyte transfusion therapy in chronic granulomatous disease. Report of a patient and review of the literature. Transfusion 21: 739-743 105 7 Anhang 7 Anhang 7.1 Lebenslauf Persönliche Daten Name: Matthias Eckenweiler Wohnort: Ferdinand – Weiß – Str. 57 79106 Freiburg i.Br. Geburtsdatum: 20. August 1978 Geburtsort: Hechingen Schulische Ausbildung Sept. 1984 – Juli 1988 Grund- und Hauptschule Hechingen Sept. 1988 – Juli 1997 Allgemeines Gymnasium Hechingen Juni 1997 Allgemeine Hochschulreife Berufliche Ausbildung Okt. 1997 – Okt. 1998 Zivildienstleistender im Kindergarten für behinderte Kinder der KBF (Körper – Behinderten – Förderung Neckar – Alb) Februar – März 1999 Krankenpflegepraktikum Kreiskrankenhaus Hechingen April 1999 – Sept. 2003 Studium der Humanmedizin an der Eberhard – Karls – Universität Tübingen März 2001 Ärztliche Vorprüfung März 2002 Erster Abschnitt der Ärztlichen Prüfung Seit Oktober 2003 Weiterführung des Studiums für Humanmedizin an der Albert – Ludwigs – Universität Freiburg im Breisgau März 2005 Zweiter Abschnitt der Ärztlichen Prüfung November 2006 Dritter Abschnitt der Ärztlichen Prüfung 106 7 Anhang Famulaturen September 2001 Innere Medizin, Kreiskrankenhaus Hechingen September 2002 Chirurgische Gemeinschaftspraxis, Rottenburg a. N. November 2002 Preyer´sches Kinderspital, Wien, Österreich Januar 2003 Samui International Hospital, Koh Samui, Thailand Praktisches Jahr Okt. 2005 – Jan. 2006 Pädiatrie, St. Josefskrankenhaus Freiburg Jan. 2006 – Mai 2006 Innere Medizin, St. Josefskrankenhaus Freiburg Mai 2006 – Juni 2006 Chirurgie, St. Josefskrankenhaus Freiburg Juli 2006 – Aug. 2006 Chirurgie, Moi Teaching and Referral Hospital, Eldoret, Kenia 7 Anhang 107 7.2 Danksagung Mein herzlicher Dank geht an Herrn Prof. Dr. Bertz für die Überlassung dieses interessanten Themas und die kontinuierliche Unterstützung bei der Entstehung der Dissertation. Seine freundliche und menschliche Art hat mich über die ganze Zeit begleitet. Außerdem danke ich Herrn PD Dr. Dettenkofer, der sich freundlicherweise dazu bereit erklärt hat, die Funktion des Zweitgutachters zu übernehmen. Für die Beantwortung meiner manchmal endlos erscheinenden Anzahl an Fragen, die hilfreichen Tipps und Anregungen sowie die intensive Unterstützung hinsichtlich thematischer und organisatorischer Sachverhalte bedanke ich mich sehr herzlich bei Herrn Dr. Illerhaus. Ich danke Frau Matt für die Bereitstellung von Patientendaten sowie Frau Dr. Herzog und Ihren Kolleginnen für die Hilfestellung beim Auffinden und Erfassen der Leukapheresedaten. Bei Frau Dr. Ihorst möchte ich mich für die Durchsicht meiner Daten und die Unterstützung bei der statistischen Auswertung bedanken. Mein persönlicher Dank gilt meinen Freunden, insbesondere Raphael Spielmann, die immer ein offenes Ohr für mich hatten und mir mit Rat und Tat zur Seite standen. Ich danke meinen Eltern, die es mir ermöglicht haben, meine Ziele verfolgen und erreichen zu können. Sie haben mich stets motiviert und mir immer wieder Kraft gegeben. Danke Isabel.