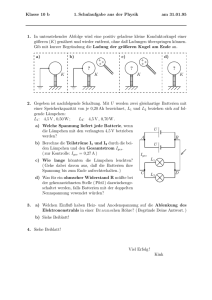
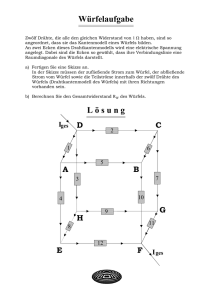
Abbildung
Werbung

Ausweitung selektivvertraglicher Versorgung Anhang: Analyse der Wirkstoffgruppen in Bezug auf Substitutions- und Risikoselektionspotenzial Berlin, Januar 2010 IGES Institut GmbH Friedrichstraße 180, 10117 Berlin Tel.: 030 – 23 08 09·0; E-Mail: [email protected]; www.iges.de 2 IGES IGES 3 Inhalt 1 Einleitung ......................................................................................... 13 2 Mittel bei säurebedingten Erkrankungen (A02) .......................... 15 2.1 2.2 3 3.1 3.2 4 4.1 4.2 4.3 4.4 4.5 4.6 4.7 5 5.1 5.2 5.3 5.4 6 6.1 6.2 7 7.1 Übersicht über die Wirkstoffgruppe ........................................... 15 Protonenpumpenhemmer (A02BC) ............................................ 16 Antidiabetika: Insuline (A10A) ...................................................... 19 Übersicht über die Wirkstoffgruppe ........................................... 19 Analyse der Wirkstoffgruppe Human- und Analoginsuline (A10A) .............................................................. 20 Antidiabetika: exkl. Insuline (A10B) ............................................. 23 Übersicht über die Wirkstoffgruppe ........................................... 23 Analyse der Wirkstoffgruppe Biguanide (A10BA) .................... 24 Analyse der Wirkstoffgruppe α-Glucosidasehemmer (A10BF) ...................................................................................... 25 Analyse der Wirkstoffgruppe Sulfonylharnstoffe und Glinide (A10BB / A10BX) ......................................................... 26 Analyse der Wirkstoffgruppe Thiazolidindione / Glitazone (A10BG) .....................................................................29 Analyse der Wirkstoffgruppe mit Wirkung auf das Inkretinsystem (A10BH, A10BX) .............................................. 30 Fazit Antidiabetika (ohne Insuline) ............................................ 33 Antithrombotische Mittel (B01) ..................................................... 34 Übersicht über die Wirkstoffgruppe ........................................... 34 Thrombozytenaggregationshemmer (TAH), exkl. Heparin (B01AC)........................................................................ 35 Vitamin K-Antagonisten (B01AA) ............................................ 37 Heparingruppe (B01AB) ............................................................ 39 Antianämika (B03) .......................................................................... 42 Übersicht über die Wirkstoffgruppe ........................................... 42 Erythropoetine (B03XA) ............................................................ 43 Mittel mit Wirkung auf das Renin-Angiotensin-System (RAS) (C09) ...................................................................................... 46 Übersicht über die Wirkstoffgruppe ........................................... 46 4 7.2 7.3 7.4 8 8.1 8.2 9 IGES ACE-Hemmer (C09AA) ............................................................. 48 Angiotensin-II-Rezeptor-Antagonisten (Sartane) (C09CA) und Renin-Inhibitoren (C09XA).................................50 Fazit Mittel mit Wirkung auf das ReninAngiotensinsystem ...................................................................... 53 Lipidsenker (C10) ............................................................................ 54 Übersicht über die Wirkstoffgruppe ........................................... 54 HMG-CoA-Reduktasehemmer (Statine) (C10AA) .................... 55 Systemische Antibiotika (J01) ........................................................ 58 9.1 9.2 9.3 9.4 9.5 9.6 9.7 9.8 Übersicht über die Wirkstoffgruppe ........................................... 58 Tetracycline (J01A) ....................................................................60 Betalactam-Antibiotika, Penicilline (J01C) ................................ 62 Betalactam-Antibiotika, Cephalosporine (J01D) ....................... 65 Sulfonamide (J01E) und Andere Antibiotika (J01X) ................. 67 Makrolide, Ketolide und Lincosamide (J01F) ............................ 69 Chinolone (J01M) ....................................................................... 72 Fazit "Systemische Antibiotika" ................................................. 74 10 Systemische Antivirale Mittel (J05) ............................................... 75 10.1 11 11.1 11.2 12 12.1 12.2 13 13.1 13.2 13.3 14 14.1 14.2 14.3 Übersicht über die Wirkstoffgruppe ........................................... 75 Antineoplastische Mittel (L01) ....................................................... 77 Übersicht über die Wirkstoffgruppe ........................................... 77 Proteinkinaseinhibitoren / Tyrosinkinasehemmer (L01XE) ...................................................................................... 79 Immunsuppressiva (L04) ................................................................ 81 Übersicht über die Wirkstoffgruppe ........................................... 81 TNF-alpha-Inhibitoren (L04AB) ................................................ 82 Antiphlogistika und Antirheumatika (M01) .................................85 Übersicht über die Wirkstoffgruppe ........................................... 85 Konventionelle NSAR (M01AA - M01AG) .............................. 86 Selektive COX2-Inhibitoren / Coxibe (M01AH) ....................... 89 Analgetika (N02) .............................................................................. 92 Übersicht über die Wirkstoffgruppe ........................................... 92 Opioide (N02A) .......................................................................... 93 Andere Analgetika und Antipyretika (N02B) ............................. 96 IGES 15 15.1 15.2 15.3 15.4 15.5 16 16.1 16.2 16.3 16.4 16.5 17 17.1 17.2 17.3 17.4 17.5 18 18.1 18.2 18.3 18.4 18.5 5 Antiepileptika (N03) ........................................................................ 99 Übersicht über die Wirkstoffgruppe ........................................... 99 Carboxamide (N03AF) .............................................................100 Fettsäurederivate (N03AG) ......................................................102 Andere Antiepileptika (N03AX) ..............................................104 Fazit Antiepileptika (N03) ........................................................106 Antiparkinsonmittel (N04) ...........................................................107 Übersicht über die Wirkstoffgruppe .........................................107 Anticholinergika (N04AA) .......................................................108 Dopaminagonisten (N04BC) ....................................................110 L-Dopa Kombinationen (N04BA) ............................................113 Fazit Antiparkinsonmittel (N04) ..............................................115 Psycholeptika (N05).......................................................................116 Übersicht über die Wirkstoffgruppe .........................................116 Konventionelle Antipsychotika, niedrig – mittel potent (N05A) ......................................................................................118 Konventionelle Antipsychotika, hochpotent (N05A) ...............120 Antipsychotika, atypisch (N05A) .............................................122 Fazit Antipsychotika .................................................................124 Psychoanaleptika, Antidepressiva (N06A) ..................................126 Übersicht über die Wirkstoffgruppe .........................................126 Nichtselektive Monoamin-Wiederaufnahmehemmer (NSMRI) (N06AA) ...................................................................127 Selektive Serotonin-Wiederaufnahmehemmer (SSRI) (N06AB) ...................................................................................130 Andere Antidepressiva (N06AX) .............................................132 Fazit Antidepressiva .................................................................134 Abbildungen Abbildung 1: Bewertungskriterien für die Wirkstoffgruppe der Mittel bei säurebedingten Erkrankungen ......................................................15 Abbildung 2: Bewertungskriterien für die Wirkstoffgruppe der Protonenpumpenhemmer .............................................................17 Abbildung 3: Bewertungskriterien für die Wirkstoffgruppe der Human- und Analoginsuline ..............................................................................20 Abbildung 4: Bewertungskriterien für die Wirkstoffgruppe der Antidiabetika ohne Insuline ................................................................................24 6 IGES Abbildung 5: Bewertungskriterien für die Wirkstoffgruppe der αGlucosidasehemmer.....................................................................25 Abbildung 6: Bewertungskriterien für die Wirkstoffgruppen der Sulfonylharnstoffe und Glinide ......................................................27 Abbildung 7: Bewertungskriterien für die Wirkstoffgruppe der Thiazolidindione / Glitazone..........................................................29 Abbildung 8: Bewertungskriterien für die Gruppe der DPP-IV-Wirkstoffe...........31 Abbildung 9: Bewertungskriterien für die Wirkstoffgruppe der Antithrombotischen Mittel .............................................................34 Abbildung 10: Bewertungskriterien für die Wirkstoffgruppe der Thrombozytenaggregationshemmer .............................................36 Abbildung 11: Bewertungskriterien für die Wirkstoffgruppe der Vitamin-KAntagonisten ................................................................................38 Abbildung 12: Bewertungskriterien für die Wirkstoffe der Heparingruppe ...........40 Abbildung 13: Bewertungskriterien für die Wirkstoffgruppe der Antianämika .......43 Abbildung 14: Bewertungskriterien für die Wirkstoffgruppe der Erythropoetine ..............................................................................44 Abbildung 15: Bewertungskriterien für die Wirkstoffgruppe der Mittel mit Wirkung auf das Renin-Angiotensin-System .................................47 Abbildung 16: Bewertungskriterien für die Wirkstoffgruppe der ACEHemmer .......................................................................................49 Abbildung 17: Bewertungskriterien für die Wirkstoffgruppen der AngiotensinII-Rezeptor-Antagonisten und der Renin-Inhibitoren .....................51 Abbildung 18: Bewertungskriterien für die Wirkstoffgruppe der Lipidsenker ........54 Abbildung 19: Bewertungskriterien für die Wirkstoffgruppe der HMG-CoAReduktasehemmer (Statine) und Ezetimib ...................................56 Abbildung 20: Bewertungskriterien für die Wirkstoffe der systemischen Antibiotika.....................................................................................59 Abbildung 21: Bewertungskriterien für die Wirkstoffgruppe der Tetracycline .......60 Abbildung 22: Bewertungskriterien für die Wirkstoffgruppe der Penicilline (ohne Beta-Lactamase-feste Penicillinen) ....................................63 Abbildung 23: Bewertungskriterien für die Wirkstoffgruppe der Cephalosporine ............................................................................66 Abbildung 24: Bewertungskriterien für die Wirkstoffgruppen der Makrolide, Ketolide und Lincosamide.............................................................70 Abbildung 25: Bewertungskriterien für die Wirkstoffgruppe der Chinolone ..........72 Abbildung 26: Bewertungskriterien für die Wirkstoffgruppe der systemischen antiviralen Mittel ...........................................................................76 Abbildung 27: Bewertungskriterien für die Wirkstoffgruppe der Antineoplastischen Mittel ..............................................................78 IGES 7 Abbildung 28: Bewertungskriterien für die Wirkstoffgruppe der Proteinkinaseinhibitoren ...............................................................79 Abbildung 29: Bewertungskriterien für die Wirkstoffgruppe der Immunsuppressiva .......................................................................81 Abbildung 30: Bewertungskriterien für die Wirkstoffgruppe der TNF-alphaInhibitoren ....................................................................................83 Abbildung 31: Bewertungskriterien für die Wirkstoffgruppe der Antiphlogistika und Antirheumatika ...............................................86 Abbildung 32: Bewertungskriterien für die Wirkstoffgruppe der Konventionellen NSAR .................................................................87 Abbildung 33: Bewertungskriterien für die Wirkstoffgruppe der Coxibe ...............90 Abbildung 34: Bewertungskriterien für die Wirkstoffgruppe der Analgetika ..........92 Abbildung 35: Bewertungskriterien für die Wirkstoffgruppe der Opioide ..............94 Abbildung 36: Bewertungskriterien für die Wirkstoffgruppe der Anderen Analgetika und Antipyretika ..........................................................97 Abbildung 37: Bewertungskriterien für die Wirkstoffgruppe der Antiepileptika ... 100 Abbildung 38: Bewertungskriterien für die Wirkstoffgruppe der Carboxamide ... 101 Abbildung 39: Bewertungskriterien für die Wirkstoffgruppe der Fettsäurederivate ....................................................................... 102 Abbildung 40: Bewertungskriterien für die Wirkstoffgruppe der Anderen Antiepileptika .............................................................................. 104 Abbildung 41: Bewertungskriterien für die Wirkstoffgruppe der Antiparkinsonmittel ..................................................................... 107 Abbildung 42: Bewertungskriterien für die Wirkstoffgruppe der Anticholinergika .......................................................................... 109 Abbildung 43: Bewertungskriterien für die Wirkstoffgruppe der Dopaminagonisten...................................................................... 111 Abbildung 44: Bewertungskriterien für die Wirkstoffgruppe der L-Dopa Kombinationen ........................................................................... 114 Abbildung 45: Bewertungskriterien für die Wirkstoffgruppe der Psycholeptika ............................................................................. 116 Abbildung 46: Bewertungskriterien für die Wirkstoffgruppe der Konventionellen Antipsychotika, niedrig - mittel potent ............... 119 Abbildung 47: Bewertungskriterien für die Wirkstoffgruppe der Konventionellen hochpotenten Antipsychotika ............................ 121 Abbildung 48: Bewertungskriterien für die Wirkstoffgruppe der atypischen Antipsychotika ............................................................................ 123 Abbildung 49: Bewertungskriterien für die Wirkstoffgruppe der Antidepressiva ............................................................................ 126 Abbildung 50: Bewertungskriterien für die Wirkstoffgruppe der nichtselektiven Monoamin-Wiederaufnahmehemmer ................. 128 8 IGES Abbildung 51: Bewertungskriterien für die Wirkstoffgruppe der Selektiven Serotonin-Wiederaufnahmehemmer ........................................... 130 Abbildung 52: Bewertungskriterien für die Wirkstoffgruppe der Anderen Antidepressiva ............................................................................ 133 Tabellen Tabelle 1: Marktdaten zur Wirkstoffgruppe der Mittel bei säurebedingten Erkrankungen ...............................................................................15 Tabelle 2: Marktpreise zur Wirkstoffgruppe der Protonenpumpenhemmer .............................................................16 Tabelle 3: Marktdaten zur Wirkstoffgruppe der Insuline und Analoga ............19 Tabelle 4: Marktpreise zur Wirkstoffgruppe der Human- und Analoginsuline ..............................................................................20 Tabelle 5: Marktdaten zur Wirkstoffgruppe Antidiabetika (exkl. Insuline) .......23 Tabelle 6: Marktpreise zur Wirkstoffgruppe der Biguanide ............................24 Tabelle 7: Marktpreise zur Wirkstoffgruppe der α-Glucosidasehemmer ........25 Tabelle 8: Marktpreise zu den Wirkstoffgruppen der Sulfonylharnstoffe und Glinide ...................................................................................26 Tabelle 9: Marktpreise zur Wirkstoffgruppe der Thiazolidindione / Glitazone ......................................................................................29 Tabelle 10: Marktpreise zur Gruppe der DPP-IV-Wirkstoffe ............................30 Tabelle 11: Marktdaten zur Wirkstoffgruppe der antithrombotischen Mittel .....34 Tabelle 12: Marktpreise zur Wirkstoffgruppe der Thrombozytenaggregationshemmer .............................................35 Tabelle 13: Marktpreise zur Wirkstoffgruppe der Vitamin-K-Antagonisten .......37 Tabelle 14: Marktpreise zu den Wirkstoffen der Heparingruppe ......................39 Tabelle 15: Marktdaten zur Wirkstoffgruppe der Antianämika .........................42 Tabelle 16: Marktpreise zur Wirkstoffgruppe der Erythropoetine .....................43 Tabelle 17: Marktdaten zur Wirkstoffgruppe der Mittel mit Wirkung auf das Renin-Angiotensin-System.....................................................46 Tabelle 18: Marktpreise zur Wirkstoffgruppe der ACE-Hemmer ......................48 Tabelle 19: Marktpreise zu den Wirkstoffgruppen der Angiotensin-IIRezeptor-Antagonisten und der Renin-Inhibitoren ........................50 Tabelle 20: Marktdaten zur Wirkstoffgruppe der Lipidsenker ...........................54 Tabelle 21: Marktpreise zur Wirkstoffgruppe der HMG-CoAReduktasehemmer (Statine) und Ezetimib ...................................55 Tabelle 22: Marktdaten zur Wirkstoffgruppe der systemischen Antibiotika ......58 IGES 9 Tabelle 23: Marktpreise zur Wirkstoffgruppe der Tetracycline .........................60 Tabelle 24: Marktpreise zur Wirkstoffgruppe der Penicilline ............................62 Tabelle 25: Marktpreise zur Wirkstoffgruppe der Cephalosporine ...................65 Tabelle 26: Marktpreise zu den Wirkstoffgruppen der Sulfonamide und Anderen Antibiotika ......................................................................67 Tabelle 27: Marktpreise zu den Wirkstoffgruppen der Makrolide, Ketolide und Lincosamide ..........................................................................69 Tabelle 28: Marktpreise zur Wirkstoffgruppe der Chinolone ............................72 Tabelle 29: Übersicht über die Wirkstoffgruppe der Systemischen Antiviralen Mittel ...........................................................................75 Tabelle 30: Übersicht über die Wirkstoffgruppe der Antineoplastischen Mittel ............................................................................................77 Tabelle 31: Übersicht über die Wirkstoffgruppe der Proteinkinaseinhibitoren / Tyrosinkinasehemmer ..........................79 Tabelle 32: Marktdaten zur Wirkstoffgruppe der Immunsuppressiva ...............81 Tabelle 33: Marktpreise zur Wirkstoffgruppe der TNF-alpha-Inhibitoren..........82 Tabelle 34: Marktdaten zur Wirkstoffgruppe der Antiphlogistika und Antirheumatika .............................................................................85 Tabelle 35: Marktpreise zur Wirkstoffgruppe der Konventionellen NSAR ........86 Tabelle 36: Marktpreise zur Wirkstoffgruppe der Coxibe .................................89 Tabelle 37: Marktdaten zur Wirkstoffgruppe der Analgetika ............................92 Tabelle 38: Marktpreise zur Wirkstoffgruppe der Opioide ................................93 Tabelle 39: Marktpreise zur Wirkstoffgruppe der Anderen Analgetika und Antipyretika ..................................................................................96 Tabelle 40: Marktdaten zur Wirkstoffgruppe der Antiepileptika ........................99 Tabelle 41: Marktpreise zur Wirkstoffgruppe der Carboxamide ..................... 100 Tabelle 42: Marktpreise zur Wirkstoffgruppe der Fettsäurederivate .............. 102 Tabelle 43: Marktpreise zur Wirkstoffgruppe der Anderen Antiepileptika....... 104 Tabelle 44: Marktdaten zur Wirkstoffgruppe der Antiparkinsonmittel ............. 107 Tabelle 45: Marktpreise zur Wirkstoffgruppe der Anticholinergika ................. 108 Tabelle 46: Marktpreise zur Wirkstoffgruppe der Dopaminagonisten ............ 110 Tabelle 47: Marktpreise zur Wirkstoffgruppe der L-Dopa Kombinationen ...... 113 Tabelle 48: Marktdaten zur Wirkstoffgruppe der Psycholeptika ..................... 116 Tabelle 49: Marktpreise zur Wirkstoffgruppe der Konventionellen Antipsychotika, niedrig - mittel potent ......................................... 118 Tabelle 50: Marktpreise zur Wirkstoffgruppe der konventionellen hochpotenten Antipsychotika ...................................................... 120 10 IGES Tabelle 51: Marktpreise zur Wirkstoffgruppe der Atypischen Antipsychotika ............................................................................ 122 Tabelle 52: Marktdaten zur Wirkstoffgruppe der Antidepressiva.................... 126 Tabelle 53: Marktpreise zur Wirkstoffgruppe der nichtselektiven Monoamin-Wiederaufnahmehemmer (NSMRI) ........................... 127 Tabelle 54: Marktpreise zur Wirkstoffgruppe der selektiven SerotoninWiederaufnahmehemmer ........................................................... 130 Tabelle 55: Marktpreise zur Wirkstoffgruppe der "Anderen Antidepressiva"........................................................................... 132 IGES 11 Abkürzungsverzeichnis Abkürzung Erläuterung ACE Angiotensin-konvertierendes Enzym ASS Acetylsalicylsäure ATC Anatomisch-therapeutisch-chemische Klassifikation COMT Catechol-O-Methyltransferase CYP Cytochrom-P450 DDD Defined daily dose (Definierte Tagesdosis) DIMDI Deutsches Institut für medizinische Dokumentation und Information DPP-IV Dipeptidylpeptidase 4 GABA Gamma-Aminobuttersäure G-BA Gemeinsamer Bundesausschuss GLP-1 Glucagon-like peptide HIV Humanes Immunodefizienz-Virus HMG CoA 3-Hydroxy-3-Methylglutaryl Coenzym A IQWiG Institut für Qualität und Wirtschaftlichkeit im Gesundheitswesen MAO Monoaminoxidase NMH Niedermolekulares Heparin NSAR Nichtsteroidales Antirheumatikum NSMRI Nichtselektiver Monoamin-Wiederaufnahmehemmer NVI Nationale Verordnungsinformationen PPI Protonenpumpeninhibitor RAS Renin-Angiotensin-System SSNRI Selektiver Serotonin-Noradrenalin-Wiederaufnahmehemmer SSRI Selektiver Serotonin-Wiederaufnahmehemmer TAH Thrombozytenaggregationshemmer TCA Tricyclisches Antidepressivum 12 IGES Abkürzung Erläuterung TNF-alpha Tumornekrosefaktor-alpha UFH Unfraktioniertes Heparin WHO Weltgesundheitsorganisation IGES 1 13 Einleitung Im diesem Anhang wird für jede der betrachteten Wirkstoffgruppen im Detail dargestellt, ob ein Substitutions- bzw. Risikoselektionspotenzial anzunehmen ist. Die Analyse folgt der im Bericht im Abschnitt 5.2 beschriebenen Methodik. Die Ergebnisse werden jeweils für die Wirkstoff- bzw. Arzneimittelgruppe insgesamt gezeigt sowie ggf. für alle oder besonders relevante Untergruppen. Der detaillierten Ergebnisdarstellung folgt jeweils ein Fazit, das die Ergebnisse zusammenfasst in Bezug auf: Unterschiede in der Zulassung Medizinisch zu bewertendes Substitutionspotenzial unabhängig vom Zulassungsstatus Mögliches Risikoselektionspotenzial Ergänzt wird die Darstellung durch Marktdaten, die eine Übersicht zu den Verbrauchsanteilen der Wirkstoffgruppen in gerundeten definierten Tagesdosen (DDD) geben sowie Angaben zu den Preisen je DDD der dargestellten Wirkstoffe (verordnungsgewichteter mittlerer Preis im Jahr 2008 sowie nicht gewichtete Preisspanne der im Jahr 2008 zu Lasten der GKV verordneten PZN). Zu berücksichtigen ist hierbei allerdings, dass die gültigen Preise häufig bereits das Resultat aktuell gültiger Regulierungsmaßnahmen sind und nicht von vorneherein Schlussfolgerungen auf ein eventuelles marktrelevantes Potenzial zulassen. Die DDD ist definiert als die zu erwartende tägliche Erhaltungsdosis in der Hauptindikation (bzw. der für die Festlegung der DDD betrachteten Indikation) bei einem Erwachsenen von 70 kg Körpergewicht. Insofern gewährleistet die Angaben von Preisen je DDD eine gewisse Vergleichbarkeit hinsichtlich der zu erwartenden Tagestherapiekosten. In Wirkstoffgruppen kann jedoch die Tagesdosis, die bei der Mehrzahl der Patienten verordnet wird, erheblich von der festgelegten DDD abweichen. D.h., in diesen Fällen suggerieren die Preise je DDD mögliche Einsparpotenziale, die nicht gegeben sind. Da es keine systematischen Untersuchungen zu dieser Problematik gibt, sondern nur Analysen zu ausgewählten Stoffgruppen (z. B. Grimmsmann und Himmel 2009) können die Wirkstoffgruppen, die von solch einer fehlerhaften Einschätzung betroffen sein könnten, hier nicht markiert werden. 14 IGES Für die im Detail betrachteten Wirkstoffe werden Angaben zu Generika gemacht. Diese Angaben berücksichtigen lediglich, ob im Jahr 2008 entsprechende Generika zu Lasten der GKV verordnet wurden. Aussagen zum Patentschutz lassen sich daraus nicht ableiten, da viele patentfreie Wirkstoffe mit kleinen Märkten nicht als Generika verfügbar sind. IGES 15 2 Mittel bei säurebedingten Erkrankungen (A02) 2.1 Übersicht über die Wirkstoffgruppe Tabelle 1: Marktdaten zur Wirkstoffgruppe der Mittel bei säurebedingten Erkrankungen Anz. Herst. Bezeichnung A02BC Protonenpumpenhemmer 45 1.705.476.395 93,3% A02BA Histamin-H2-Rezeptorantagonisten 37 116.873.452 6,4% A02A Antacida 36 1.450.353 0,1% Sonstige 15 4.496.240 0,2% 1.828.000.000 100,0% Gesamt Quelle: DDD 2008 Marktanteil (in DDD) ATC Berechnung IGES nach NVI (INSIGHT Health) Die Wirkstoffgruppe der Mittel gegen säurebedingte Erkrankungen ist eine sehr umfangreiche Gruppe mit erheblichen Unterschieden bezüglich der Wirkpotenz und des Wirkprinzips zwischen den einzelnen Untergruppen, so dass die Gruppe als ganze zu heterogen ist, um eine differenzierte Analyse durchführen zu können (Abbildung 1). Aufgrund der dominierenden Stellung der Protonenpumpenhemmer (Tabelle 1) wurde für die vorliegende Analyse nur diese Wirkstoffgruppe berücksichtigt. Abbildung 1: Bewertungskriterien für die Wirkstoffgruppe der Mittel bei säurebedingten Erkrankungen Kriterium Zulassungsbestimmungen Evidenzlage Einnahmekomfort Mittel bei säurebedingten Erkrankungen (A02) 16 IGES Mittel bei säurebedingten Erkrankungen (A02) Kriterium Nebenwirkungen, Kinetik Öffentlichkeitswirksamkeit Präferenzen von Ärzten und Patienten Quelle: 2.2 IGES Protonenpumpenhemmer (A02BC) Tabelle 2: Marktpreise zur Wirkstoffgruppe der Protonenpumpenhemmer ATC Wirkstoff Anz. OriginalHerst. präparat Gene rika A02BC01 Omeprazol 39 Antra x 0,37-8,76 0,61 A02BC02 Pantoprazol x 0,48-8,76 0,65 A02BC03 Lansoprazol 19 Agopton x 0,32-1,93 0,53 A02BC04 Rabeprazol 2 Pariet 0,54-1,95 0,62 A02BC05 Esomeprazol 1 Nexium 0,67-8,76 0,79 Quelle: 4 Pantozol, Rifun Preisspanne €/DDD Mittelw. € Berechnung IGES nach NVI (INSIGHT Health) Die auf dem deutschen Markt aus dieser Gruppe verfügbaren Wirkstoffe sind in Tabelle 2 dargestellt. Drei der fünf Wirkstoffe werden mittlerweile von Generikaherstellern angeboten. Der mit deutlichem Abstand am häufigsten verschriebene Wirkstoff ist Omeprazol. Für bestimmte Dosierungen, Packungsgrößen und Indikationen wurden die Wirkstoffe Omeprazol und Pantoprazol im Jahr 2009 aus der Verschreibungspflicht entlassen, die Entwicklung in Bezug auf die Verordnungszahlen ist noch abzuwarten. Die Preisspanne innerhalb der Gruppe der verschreibungspflichtigen Protonenpumpenhemmer liegt zwischen 0,32-8,76 €/DDD bei einem Mittelwert von 0,63 € (Berechnung IGES nach NVI (INSIGHT Health)). Die vom Mittelwert deutlich nach oben abweichenden Preise pro DDD lassen sich auf parenterale Zubereitungen zurückführen, bei denen die Preise für eine Durchstechflasche (=1 DDD) deutlich höher ausfallen als die Preise für orale Darreichungsformen. Für Lansoprazol und Rabeprazol existieren keine parenteralen Zubereitungen, daher ist die Preisspanne für diese Wirkstoffe auch deutlich geringer bei ansonsten vergleichbaren Mittelwerten. IGES 17 Abbildung 2: Bewertungskriterien für die Wirkstoffgruppe der Protonenpumpenhemmer Protonenpumpenhemmer (A02BC) Kriterium Zulassungsbestimmungen Evidenzlage Einnahmekomfort Nebenwirkungen, Kinetik Öffentlichkeitswirksamkeit Präferenzen von Ärzten und Patienten Quelle: IGES Zulassungsbestimmungen und Evidenzlage Das Kriterium "Zulassungsbestimmungen" ist als heterogen zu bezeichnen, da die einzelnen Wirkstoffe jeweils nur für einen Teil aller denkbaren Indikationen zugelassen sind. Diese umfassen allerdings auch vergleichsweise kleinteilige Teilindikationen mit unterschiedlichen Symptomen nach Lokalisation, Schweregrad und unterschiedlichem Behandlungsziel. Zusätzlich gibt es Indikationen für einzelne definierte Erkrankungssyndrome und unterschiedliche Altersbeschränkungen, so dass sich für keine zwei der Substanzen ein vollständig gleiches Zulassungsbild finden lässt. Bezüglich der Kontraindikationen sind die Substanzen vergleichbar. Zur Lage der Evidenz innerhalb der Gruppe zeigen sich keine gravierenden Unterschiede. Einzig Esomeprazol zeigt leichte Vorteile in der Dauer bis zum Wirkeintritt bei Refluxösophagitis, so dass sich hier insgesamt eine weitgehende Homogenität abzeichnet (Labenz et al. 2002a, Labenz et al. 2002b, Schubert-Zsilavecz und Stark 2005). Nebenwirkungen, Kinetik und Einnahmekomfort Der Einnahmekomfort ist bei den Substanzen mit durchweg einmal täglicher Einnahme vergleichbar. Von drei der fünf Stoffe (Omeprazol, Esomeprazol, Pantoprazol) sind auch parenterale Anwendungsformen verfügbar, die allerdings nur selten benötigt werden. Die Nebenwirkungsrate 18 IGES ist insgesamt gering und vergleichbar. Bezüglich der Metabolisierung ergeben sich vergleichbare Bedingungen für die Wirkstoffe und auch die Interaktionspotenziale unterscheiden sich kaum (Aktories et al. 2009, S. 553ff., Labenz et al. 2002b).1 Öffentlichkeitswirksamkeit und Präferenzen Bei der öffentlichen Wahrnehmung einer eventuellen Einschränkung auf einzelne Substanzen ist zu bedenken, dass diese Wirkstoffgruppe in der Bevölkerung breit angewendet wird. Im Zuge der Freistellung von der Verschreibungspflicht für definierte Stärken und Anwendungsgebiete einzelner Substanzen im Jahre 2009 ist in Zukunft mit einer stärkeren Beschränkung der Verordnung auf chronische Verlaufsformen zu rechnen. Insbesondere von dieser Gruppe Betroffener ist aber - ganz allgemein - bei einer Erstattungseinschränkung mit negativen Reaktionen zu rechnen. In Bezug auf die PPI sind die Präferenzen von Ärzten und Patienten jedoch eher als nicht gravierend einzuschätzen, da die Substanzen in der Regel eher als Klasse wahrgenommen werden und nur bei Unverträglichkeiten auf andere Wirkstoffe ausgewichen wird. Fazit Zahlreiche Unterschiede bei der Zulassung (bspw. sind nicht alle Wirkstoffe zur Anwendung bei Kindern zugelassen), die aber medizinisch niedriger zu bewerten sind. Medizinisch bewertet ist ein Substitutionspotential vorhanden. In der Wahrnehmung bei Ärzten und Patienten sind wenig Unterschiede vorhanden, hieraus ergibt sich nur ein geringes Risikoselektionspotential. 1 Die PPI werden durch das Enzym CYP2D19 verstoffwechselt, das in verschiedenen genetisch bedingten Varianten vorkommt (Polymorphismus). Relevante Unterschiede in Bezug auf die Metabolisierung der einzelnen PPI selbst ergeben sich dadurch nicht. Allerdings werden in letzter Zeit Unterschiede bezüglich der Aktivierung anderer Pharmaka (Clopidogrel) diskutiert, die möglicherweise durch die PPIWirkstoffe unterschiedlich beeinflusst wird (NN (2009) Clopidogrel (Plavix, Iscover)...Probleme mit Protonenpumpenhemmern? Arznei-Telegramm 40:22). IGES 19 3 Antidiabetika: Insuline (A10A) 3.1 Übersicht über die Wirkstoffgruppe Tabelle 3: Marktdaten zur Wirkstoffgruppe der Insuline und Analoga Anz. DDD 2008 Herst. Marktanteil (in DDD) ATC Bezeichnung A10AB Insuline und Analoga, schnell wirkend 7 389.827.427 48,6% A10AE Insuline und Analoga, lang wirkend 3 115.451.405 14,4% A10AD Insuline und Analoga, schnell wirkend in Kombination mit intermediär wirkend (Mischinsuline) 7 174.832.836 21,8% 7 121.981.011 15,2% 802.100.000 100,0% A10AC Insuline und Analoga, intermediär wirkend Gesamt Quelle: Berechnung IGES nach NVI (INSIGHT Health) Die Wirkstoffgruppe der Insuline und Analoga kann eingeteilt werden anhand der Wirkdauer der Substanzen und anhand der Art des Insulins (Human-2 oder Analoginsulin). Die auf dem deutschen Markt verfügbaren Insulinarten sind in Tabelle 3 dargestellt. Humaninsulin wird geringfügig häufiger verschrieben als Analoginsulin. Die Preisspanne innerhalb der gesamten Gruppe liegt zwischen 0,49-7,58 €/DDD bei einem Mittelwert von 1,45 € (Berechnung IGES nach NVI (INSIGHT Health)), wobei insbesondere die Insulinanaloga durch höhere Preise auffallen (in der Tabelle 4 kursiv dargestellt). Hier ist jedoch zu beachten, dass die dargestellten Preise sich auf den Apothekenverkaufspreis beziehen. Für die GKV entstehen tatsächlich keine höheren Kosten bei Verordnung von kurz wirkenden Insulinanaloga, da sie lt. Arzneimittel-Richtlinie des G-BA bei der Mehrzahl der Patienten nur dann verordnungsfähig sind, wenn sie nicht mit Mehrkosten im Vergleich zu kurz wirkendem Humaninsulin einhergehen. 2 Entsprechend der ATC-Klassifikation gehören zu den Insulinen entsprechende Wirkstoffe vom Schwein oder Rind sowie Humaninsulin. Seit einigen Jahren ist in Deutschland nur noch Humaninsulin erhältlich. 20 IGES Tabelle 4: ATC Marktpreise zur Wirkstoffgruppe der Human- und Analoginsuline Wirkstoff Anz. OriginalHerst. präparat A10AB01 Insulin (human) 7 A10AB04 Insulin lispro Gene rika* Preisspanne €/DDD (x) Mittelw. € 0,49-2,84 1,25 3 Humalog 1,14-1,97 1,67 A10AB05 Insulin aspart 2 NovoRapid 1,14-5,24 1,69 A10AB06 Insulin glulisin 2 Apidra 0,54-5,27 1,63 A10AC01 Insulin (human) 7 (x) 1,03-1,60 1,25 A10AD01 Insulin (human) 7 (x) 1,03-5,87 1,25 A10AD04 Insulin lispro 3 Humalog 1,28-7,58 1,70 A10AD05 Insulin aspart 2 NovoMix 1,47-5,30 1,72 A10AE04 Insulin glargin 1 Lantus 0,78-2,35 1,95 A10AE05 Insulin detemir 2 Levemir 1,95-2,15 2,00 * Die mit (x) gekennzeichneten Insuline werden von drei "Originalherstellern" sowie von mehreren Generika-Herstellern angeboten. Ob sie deshalb als Generika (bzw. Biosimilars) bezeichnet werden können, ist strittig, denn die Information zur Herstellung von Humaninsulin - die kodierende Gensequenz - unterliegt keinem Wirkstoffpatent:. Erst seit 1998 können Patente erteilt werden, die sich auch auf Gensequenzen beziehen (EGRichtlinie über den rechtlichen Schutz biotechnologischer Erfindungen); biotechnologisch hergestelltes Humaninsulin ist aber bereits seit Anfang der 1980er Jahre im Handel. Es ist also davon auszugehen, dass hier keine Generikasituation vorliegt. Quelle: 3.2 Berechnung IGES nach NVI (INSIGHT Health) Analyse der Wirkstoffgruppe Human- und Analoginsuline (A10A) Abbildung 3: Bewertungskriterien für die Wirkstoffgruppe der Human- und Analoginsuline Kriterium Zulassungsbestimmungen Evidenzlage Einnahmekomfort Nebenwirkungen, Kinetik Human- und Analoginsuline (A10A) IGES 21 Human- und Analoginsuline (A10A) Kriterium Öffentlichkeitswirksamkeit Präferenzen von Ärzten und Patienten Quelle: IGES Zulassungsbestimmungen und Evidenzlage Die zugelassenen Indikationen sind für die Substanzen entsprechend ihrer Wirkdauer und ihres Einsatzes im Rahmen der Therapie vergleichbar. Die Evidenz der Wirksamkeit ist für die Humaninsuline gut belegt, für die Analoginsuline ergeben sich teilweise in einigen Untersuchungen leichte Vorteile (die heftig diskutiert werden). Die spezifischen Molekülvariationen lassen einen differenzierteren Einsatz zu, da Wirkdauer und -eintritt der Substanzen optimiert wurden. Die Vorteile der Analoginsuline ergeben sich dabei hauptsächlich aus einer Verbesserung der Lebensqualität der Patienten und einer Verminderung von Hypoglykämien und Anwendungsfehlern (Aktories et al. 2009, S. 621ff., IQWiG 2009a, Kaiser 2005). Nebenwirkungen, Kinetik und Einnahmekomfort Aus den Unterschieden bei Wirkeintritt bzw. -dauer ergeben sich auch die in der Fachwelt heftig diskutierten Verbesserungen beim Einnahmekomfort, da eine patientengerechtere und -individuelle Therapie möglich ist. Auch in der Pumpentherapie werden besondere Anforderungen an die eingesetzten kurzwirksamen Insuline gestellt, die nicht von allen Insulinen gleichermaßen erfüllt werden (Forst 2001). Bei der Häufigkeit allergischer Nebenwirkungen zeigt sich zwischen Human- und Analoginsulin kein Unterschied. Insulin glargin steht im Verdacht, dass der mitogene Effekt höher ist als der der anderen Substanzen, für alle Analoga wird eine erhöhte Kanzerogenität aktuell kontrovers diskutiert und kann derzeit weder bestätigt noch ausgeschlossen werden (IQWiG 2006a, Aktories et al. 2009, S. 621ff., Kaiser 2005): Die Ergebnisse aus Langzeitstudien stehen noch aus. Abgesehen von der unterschiedlichen Wirkdauer der Substanzen ist die Kinetik vergleichbar, es sind keine Unterschiede bei der Metabolisierung und damit dem Interaktionspotential zu beobachten. Öffentlichkeitswirksamkeit und Präferenzen In Bezug auf die Wirksamkeit einer Erstattungseinschränkung ist die breite Anwendung der Insuline zu berücksichtigen. Insbesondere Diabetiker, die mittels moderner Therapieregime und meist auch mit Analoginsulinen be- 22 IGES handelt werden, gelten als gut informiert (Vana 2005) und dürften empfindlich auf derartige Einschränkungen reagieren. Patientenorganisationen und Fachgesellschaften für Diabetes haben großen Einfluss auf ihre Mitglieder und setzen sich deutlich vernehmbar für diese ein, wie schon beim bedingten Erstattungsausschluss der Analoga durch den G-BA deutlich geworden ist. Eine Erstattungseinschränkung wird von bereits mit Insulin behandelten Patienten auch deshalb negativ gesehen, weil eine ggf. notwendige Umstellung der Therapie auf andere Insuline in der Regel eine mehr oder weniger aufwendige Um- und Neueinstellung und entsprechende Schulung der Patienten erfordert. Fazit Keine ausgeprägten Unterschiede in der Zulassung. Medizinisch bewertet ist das Substitutionspotential hoch (im Vergleich Humaninsulin / Analoga). Ausgeprägte Unterschiede in der Wahrnehmung bei Ärzten und Patienten vorhanden, hieraus ergibt sich ein Risikoselektionspotential. IGES 23 4 Antidiabetika: exkl. Insuline (A10B) 4.1 Übersicht über die Wirkstoffgruppe Tabelle 5: Marktdaten zur Wirkstoffgruppe Antidiabetika (exkl. Insuline) Anz. Herst. Bezeichnung A10BA Biguanide 23 519.959.265 44,3% A10BB Sulfonylharnstoffderivate 20 494.972.174 42,2% A10BG Thiazolidindione 2 41.017.565 3,5% A10BD Kombinationen orale Antidiabetika 6 37.388.311 3,2% (A10BX) Glinide 2 36.486.513 3,1% A10BH DPP-IV-Inhibitoren 4 20.665.473 1,8% A10BF Alpha Glukosidasehemmer 2 17.437.797 1,5% (A10BX) Inkretinhemmer 2 4.744.650 0,4% 1.172.700.000 100,0% Gesamt Quelle: DDD 2008 Marktanteil (in DDD) ATC Berechnung IGES nach NVI (INSIGHT Health) Die Arzneimittelgruppe der Antidiabetika ohne Insuline ist eine sehr umfangreiche Gruppe mit erheblichen Unterschieden bezüglich des Wirkprinzips zwischen den einzelnen Untergruppen, so dass die Gruppe als ganze zu heterogen ist, um eine differenzierte Analyse durchführen zu können ( 24 IGES Abbildung 4). Daher erfolgt eine differenziertere Betrachtung der einzelnen verordnungsrelevanten in Tabelle 5 aufgeführten Wirkstoffgruppen. Aufgrund der Vielzahl der verfügbaren Therapieprinzipien ist unabhängig von dem hier angewendeten Schema auch zu überlegen, ob es Substitutionsmöglichkeiten zwischen Wirkstoffen verschiedener Wirkstoffklassen gibt. IGES 25 Abbildung 4: Bewertungskriterien für die Wirkstoffgruppe der Antidiabetika ohne Insuline Antidiabetika ohne Insuline (A10B) Kriterium Zulassungsbestimmungen Evidenzlage Einnahmekomfort Nebenwirkungen, Kinetik Öffentlichkeitswirksamkeit Präferenzen von Ärzten und Patienten Quelle: 4.2 IGES Analyse der Wirkstoffgruppe Biguanide (A10BA) Tabelle 6: Marktpreise zur Wirkstoffgruppe der Biguanide ATC Wirkstoff A10BA02 Metformin Quelle: Anz. Herst Originalpräparat 39 Glucophage Gener Preisspanne ika €/DDD x 0,25-1,79 Mittelw. € 0,31 Berechnung IGES nach NVI (INSIGHT Health) Die Wirkstoffgruppe der Biguanide besteht nur aus der Substanz Metformin, die seit langem verfügbar ist. In der Behandlung des Typ-2Diabetes gilt Metformin als Mittel der Wahl und ist das am häufigsten verordnete Antidiabetikum in Deutschland. Die Substanz wird derzeit von 39 Herstellern angeboten, die Preisspanne liegt dabei zwischen 0,25-1,79 €/DDD bei einem Mittelwert von 0,31 € (Berechnung IGES nach NVI 26 IGES (INSIGHT Health)). Eine weitere Betrachtung im Rahmen dieser Analyse erübrigt sich mangels direkter Vergleichssubstanzen. 4.3 Analyse der Wirkstoffgruppe α-Glucosidasehemmer (A10BF) Marktpreise zur Wirkstoffgruppe der α-Glucosidasehemmer Tabelle 7: Anz. Gene Originalpräparat Herst. rika Preisspanne €/DDD Mittelw. € ATC Wirkstoff A10BF01 Acarbose 3 Glucobay x 0,98-5,38 1,45 A10BF02 Miglitol 2 Diastabol x 1,10-3,70 1,56 Quelle: Berechnung IGES nach NVI (INSIGHT Health) Aus der Wirkstoffgruppe der α-Glucosidasehemmer sind auf dem deutschen Markt zwei Substanzen erhältlich (Tabelle 7), die aufgrund des geringen Marktanteils nur von 2 bzw. 3 Herstellern angeboten werden, obwohl sie generisch verfügbar sind. Acarbose wird deutlich häufiger verschrieben als Miglitol. Die Preisspanne innerhalb der Gruppe liegt zwischen 0,98-5,38 €/DDD bei einem Mittelwert von 1,46 € (Berechnung IGES nach NVI (INSIGHT Health)). Abbildung 5: Bewertungskriterien für die Wirkstoffgruppe der α-Glucosidasehemmer α-Glukosidasehemmstoffe (A10BF) Kriterium Zulassungsbestimmungen Evidenzlage Einnahmekomfort Nebenwirkungen, Kinetik Öffentlichkeitswirksamkeit Präferenzen von Ärzten und Patienten Quelle: IGES IGES 27 Zulassungsbestimmungen und Evidenzlage Die zugelassenen Indikationen und bestehenden Kontraindikationen sind nahezu deckungsgleich. Bei vergleichbarer Wirkweise zeigt keine der Substanzen einen Vorteil gegenüber der anderen. Nebenwirkungen, Kinetik und Einnahmekomfort Die Einnahmesituation ist identisch und auch die Nebenwirkungen der beiden Substanzen sind vergleichbar (Aktories et al. 2009, S. 631, Matthaei und Häring 2008). Öffentlichkeitswirksamkeit und Präferenzen Die alpha-Glukosidasehemmer haben als ergänzende Therapie nur einen begrenzten Effekt auf den Blutzucker, und werden nur von einer Minderheit der Patienten verwendet - daher dürfte eine öffentliche Reaktion eher verhalten ausfallen. Fazit Keine Unterschiede in der Zulassung. Medizinisch betrachtet besteht ein hohes Substitutionspotential. Vergleichsweise kleine Patientengruppe, daher nur geringes Risikoselektionspotential. 4.4 Analyse der Wirkstoffgruppe Sulfonylharnstoffe und Glinide (A10BB / A10BX) Tabelle 8: Marktpreise zu den Wirkstoffgruppen der Sulfonylharnstoffe und Glinide ATC Wirkstoff A10BB01 Glibenclamid A10BB08 Gliquidon A10BB09 Gliclazid A10BB12 Glimepirid A10BX02 Repaglinid A10BX03 Nateglinid Quelle: Anz. Herst Originalpräparat 21 Euglucon Gene rika Preisspanne €/DDD 0,16-3,52 0,23 1 Glurenorm 0,74-1,32 0,75 2 Diamicron 0,17-3,56 1,13 0,13-1,04 0,18 3 NovoNorm 0,39-4,92 1,25 2 Starlix 1,61-4,77 1,78 25 Amaryl x Mittelw. € x Berechnung IGES nach NVI (INSIGHT Health) Die Wirkstoffe der Gruppen Sulfonylharnstoffe und Glinide sind für die vorliegende Analyse zusammengefasst worden, da ihnen ein prinzipiell vergleichbares Wirkprinzip zugrunde liegt und die Glinide gewissermaßen 28 IGES eine Weiterentwicklung der Sulfonylharnstoffe darstellen. Auf dem deutschen Markt werden die vier Sulfonylharnstoffe von insgesamt 32 Herstellern angeboten, wobei sich die meisten auf Glibenclamid und Glimepirid konzentrieren. Die zwei Glinide werden von vier Herstellern angeboten, sie sind beide patentgeschützt (Tabelle 8), Repaglinid wird häufiger verschrieben als Nateglinid. Die Preisspanne innerhalb der Gruppe der Sulfonylharnstoffe liegt zwischen 0,13-3,56 €/DDD bei einem Mittelwert von 0,20 € und die der Glinide zwischen 0,39-4,92 €/DDD bei einem Mittelwert von 1,32 € (Berechnung IGES nach NVI (INSIGHT Health)). Abbildung 6: Bewertungskriterien für die Wirkstoffgruppen der Sulfonylharnstoffe und Glinide Sulfonylharnstoffe (A10BB) Kriterium Glinide (A10BX) Zulassungsbestimmungen Evidenzlage Einnahmekomfort Nebenwirkungen, Kinetik Öffentlichkeitswirksamkeit Präferenzen von Ärzten und Patienten Quelle: IGES In der Abbildung 6 sind die Ergebnisse der Analyse schematisch zusammengefasst, getrennt nach Sulfonylharnstoffen und Gliniden. Zulassungsbestimmungen und Evidenzlage Für beide Gruppen sind Zulassungen und Kontraindikationen identisch, wobei Nateglinid nur in Kombination mit Metformin zugelassen ist. Ein zusätzlicher Wirkmechanismus von Glimepirid konnte nicht überzeugend belegt werden, die Evidenz zeigt Vorteile einzelner Substanzen, bezüglich des kardiovaskulären Effektes. Endpunktstudien liegen jedoch nur für Glibenclamid vor, sodass eine abschließende Aussage derzeit nicht möglich ist (Francesconi 2003). IGES 29 Nebenwirkungen, Kinetik und Einnahmekomfort Die Glinide bieten den Sulfonylharnstoffen gegenüber den Vorteil eines schnelleren Wirkeintritts und einer kurzen Plasmahalbwertszeit, was den Vorteil des flexibleren Einsatzes bietet. Weitere Vorteile sind jedoch nicht erkennbar (Aktories et al. 2009, S. 624ff.). Auch für die Glinide fehlen Endpunktstudien, die Verordnung erfolgt insgesamt betrachtet zurückhaltend (KVBW 2009). Allen Wirkstoffen gemeinsam ist die vergleichsweise hohe Gefahr für Hypoglykämien, wobei die Wirkstoffe keine Unterschiede in der Höhe des Risikos zu zeigen scheinen (Aktories et al. 2009, S. 624ff.). Weitere Nebenwirkungen sind für die Sulfonylharnstoffe bzw. Glinide jeweils vergleichbar. Interaktionen können vor allem bei Repaglinid auftreten. Die Metabolisierung der Glinide erfolgt durch unterschiedliche Enzyme und auch durch andere als die der Sulfonylharnstoffe (Griese et al. 2006). Öffentlichkeitswirksamkeit und Präferenzen Innerhalb der jeweiligen Gruppe scheint eine Einschränkung auf einen oder mehrere der Wirkstoffe unproblematisch. Bei Zusammenfassung beider Gruppen (Sulfonylharnstoffe und Glinide als sogenannte beta-zytotrope Wirkstoffe) zur Auswahl eines Wirkstoffes muss aufgrund der unterschiedlichen Anwendung (flexiblere Einnahme der Glinide zu den Mahlzeiten) mit Problemen gerechnet werden. Fazit Sulfonylharnstoffe Keine ausgeprägten Unterschiede in der Zulassung. Medizinisch betrachtet besteht ein hohes Substitutionspotential. Vergleichbare Anwendung und keine Unterschiede in der Wahrnehmung bei Ärzten und Patienten vorhanden, daher ergibt sich kein Risikoselektionspotential. Fazit Glinide Keine ausgeprägten Unterschiede in der Zulassung. Medizinisch betrachtet besteht ein hohes Substitutionspotential. Vergleichbare Anwendung und keine Unterschiede in der Wahrnehmung bei Ärzten und Patienten, daher kein Risikoselektionspotential. Fazit Sulfonylharnstoffe und Glinide als beta-zytotrope Wirkstoffe Teilweise Unterschiede in der Zulassung (Nateglinid ist nur in Kombination mit Metformin zugelassen). Medizinisch betrachtet besteht ein hohes Substitutionspotential. Bei Zusammenfassen der Gruppen sind die prinzipiell unterschiedliche Anwendung und vorhandene Unterschiede in der Wahrnehmung bei Ärzten und Patienten und ein sich daraus ergebendes Risikoselektionspotenzial zu beachten. 30 4.5 IGES Analyse der (A10BG) Tabelle 9: Wirkstoffgruppe Thiazolidindione / Glitazone Marktpreise zur Wirkstoffgruppe der Thiazolidindione / Glitazone Anz. Herst Originalpräparat gene- Preisspanne risch €/DDD Mittelw. € ATC Wirkstoff A10BG02 Rosiglitazon 2 Avandia 1,47-2,36 1,73 A10BG03 Pioglitazon 2 Actos 1,58-3,15 1,88 Quelle: Berechnung IGES nach NVI (INSIGHT Health) Auf dem deutschen Markt sind zwei patentgeschützte Glitazone von je einem Hersteller und einem Importeur verfügbar (Tabelle 9). Pioglitazon wird häufiger verschrieben als Rosiglitazon. Die Preisspanne in der Gruppe liegt zwischen 1,47-3,15 €/DDD bei einem Mittelwert von 1,85 € (Berechnung IGES nach NVI (INSIGHT Health)). Abbildung 7: Bewertungskriterien für die Wirkstoffgruppe der Thiazolidindione / Glitazone Thiazolidindione (Glitazone) (A10BG) Kriterium Zulassungsbestimmungen Evidenzlage Einnahmekomfort Nebenwirkungen, Kinetik Öffentlichkeitswirksamkeit Präferenzen von Ärzten und Patienten Quelle: IGES Zulassungsbestimmungen und Evidenzlage Die Thiazolidindione unterscheiden sich hinsichtlich der Zulassung und der Kontraindikationen nicht. Für keine der beiden Substanzen zeigen sich Vor- IGES 31 teile in der Wirkung, auch nicht gegenüber Wirkstoffen aus anderen Substanzklassen, wobei Langzeituntersuchungen im Hinblick auf Folgeerkrankungen fehlen (IQWiG 2009b, KVBW 2009, Aktories et al. 2009, S. 629f.). Nebenwirkungen, Kinetik und Einnahmekomfort Die Einnahme der Substanzen erfolgt gleich, die Nebenwirkungen sind vergleichbar, wobei Studien darauf hinweisen, dass das kardiovaskuläre Risiko bei der Behandlung mit Rosiglitazon erhöht ist (Winkelmayer et al. 2008). Bezüglich der Metabolisierung der Stoffe bestehen kaum Unterschiede, das Interaktionspotenzial ist als gering einzustufen (Aktories et al. 2009, S. 629f.). Öffentlichkeitswirksamkeit und Präferenzen Da die Glitazone auch eher als Wirkstoffklasse wahrgenommen werden, besteht insgesamt ein zwar hohes Substitutions- aber niedriges Risikoselektionspotenzial. Fazit Keine Unterschiede in der Zulassung. Medizinisch betrachtet besteht ein hohes Substitutionspotential. Kaum Unterschiede in der Wahrnehmung bei Ärzten und Patienten vorhanden, daher ergibt sich kein Risikoselektionspotential. 4.6 Analyse der Wirkstoffgruppe mit Wirkung auf das Inkretinsystem (A10BH, A10BX) Tabelle 10: Marktpreise zur Gruppe der DPP-IV-Wirkstoffe Anz. Herst Originalpräparat Gene rika Preisspan Mittelw. € ne €/DDD ATC Wirkstoff A10BH01 Sitagliptin 3 Januvia 1,96-2,21 1,97 A10BH02 Vildagliptin 1 Galvus 1,93-2,21 2,09 A10BX04 Exenatid 1 Byetta 3,94-4,15 4,01 Quelle: Berechnung IGES nach NVI (INSIGHT Health) Auf dem deutschen Markt waren im Jahr 2008 drei patentgeschützte Substanzen von je einem Hersteller mit Wirkung auf das Inkretin-System verfügbar, wobei das Exenatid als GLP-1-Agonist einen anderen Angriffspunkt hat als die Gliptine (als Dipeptydilpeptidase(DPP)-IV-Inhibitor) und auch in einer anderen Applikationsform vorliegt (Tabelle 10). Sitagliptin wird deutlich häufiger verschrieben als die anderen Wirkstoffe dieser Gruppe. 32 IGES Ende 2009 ist mit Saxagliptin ein weiterer DPP-IV-Inhibitor und mit Liraglutid ein weiterer GLP-1-Agonist auf den Markt gebracht worden, die in dieser Analyse jedoch noch nicht berücksichtigt werden konnten. Mit den heutigen Marktteilnehmern wäre eine Teilung der Gruppe in die beiden Wirkstoffklassen (DPP-IV-Inhibitoren und GLP-1-Agonisten) aufgrund besserer Vergleichbarkeit sinnvoller. Die Preisspanne liegt zwischen 1,932,21 €/DDD bei einem Mittelwert von 1,98 € für die DPP-IV-Inhibitoren (Berechnung IGES nach NVI (INSIGHT Health)). Abbildung 8: Bewertungskriterien für die Gruppe der DPP-IV-Wirkstoffe DPP-IV-Wirkstoffe (A10BH, A10BX) Kriterium Zulassungsbestimmungen Evidenzlage Einnahmekomfort Nebenwirkungen, Kinetik Öffentlichkeitswirksamkeit Präferenzen von Ärzten und Patienten Quelle: IGES Zulassungsbestimmungen und Evidenzlage Wie aus der Abbildung 8 ersichtlich ist, sind die betrachteten Wirkstoffe in einigen Kriterien als homogen einzustufen, in anderen zeigen sich deutliche Unterschiede. Bei Zulassung und Kontraindikationen sind Unterschiede in der Kombination ersichtlich: Vildagliptin und Exenatid sind zur Anwendung in Kombination mit Metformin oder einem Sulfonylharnstoff zugelassen, während Sitagliptin auch als Monotherapie und zur Anwendung in Kombination mit Metformin und einem Sulfonylharnarnstoff oder in Kombination mit einem Glitazon zugelassen ist. Kontraindikationen bestehen derzeit kaum. Insbesondere fehlende Langzeit- und Vergleichsstudien machen eine Beurteilung der Wirkstoffe schwierig, derzeit sind keine gravie- IGES 33 renden Vor- oder Nachteile einer der Substanzen beim Vergleich untereinander erkennbar. Nebenwirkungen, Kinetik und Einnahmekomfort Der unter Exenatid-Behandlung erzielten Gewichtsabnahme steht bei den Gliptinen ein gleichbleibendes Gewicht gegenüber. Ein weiterer deutlicher Vorteil dieser neueren Substanzen scheint die verringerte Hypoglykämiegefahr zu sein, was ihnen Therapievorteile gegenüber einigen anderen Substanzklassen der Antidiabetika sichert (Nauck et al. 2007). Ansonsten fehlen bislang Studien zu patientenrelevanten Endpunkten (IQWiG 2007). Unterschiede bestehen wie erwähnt in der Applikation: Während die Gliptine oral anwendbar sind, kann Exenatid nur parenteral verabreicht werden. Die Nebenwirkungsprofile der Substanzen sind uneinheitlich, bei Sitagliptin und Exenatid scheinen die gastrointestinalen, bei Vildagliptin die zentralnervösen Nebenwirkungen im Vordergrund zu stehen (IQWiG 2007, Fachinformationen). Öffentlichkeitswirksamkeit und Präferenzen Bei den Präferenzen ist zwischen Exenatid und den Gliptinen zu unterscheiden. Exenatid scheint den Vorteil zu bieten, wirksamer als andere Antidiabetika (excl. Insuline) zu sein und somit eine Insulintherapie aufschieben zu können, wenngleich der Effekt auf die langfristige Blutzuckersenkung eher mäßig erscheint (Fachinformation Exenatid). Die endgültige Beurteilung dieser verhältnismäßig neuen Substanzen erfordert noch weitere Vergleichsstudien und insbesondere Langzeituntersuchungen (Aktories et al. 2009). Fazit Keine ausgeprägten Unterschiede in der Zulassung. Medizinisch betrachtet ist ein Substitutionspotential vorhanden trotz prinzipiell unterschiedlicher Anwendung. Keine abschließende Bewertung möglich, da relativ neue Substanzen Auch Unterschiede in der Wahrnehmung bei Ärzten und Patienten zwischen Gliptinen und GLP-1-Agonisten vorhanden, daher ergibt sich ein Risikoselektionspotential. 34 4.7 IGES Fazit Antidiabetika (ohne Insuline) Innerhalb der einzelnen Wirkstoffgruppen der Antidiabetika besteht hohes Substitutionspotential, in der Regel ist somit ein Austausch und damit eine Erstattungseinschränkung im Rahmen der vorliegenden Analyse gegeben. Aufgrund der Vielzahl der verfügbaren Therapieprinzipien ist zusätzlich zu dem hier innerhalb der Subgruppen betrachteten Substitutionspotenzial zu prüfen, ob über einzelne Subgruppen hinweg ein Substitutionpotenzial besteht (bspw. zwischen Wirkstoffen aus der Gruppe der Sulfonylharnstoffe und der Glinide). Insbesondere bei den neueren Wirkstoffklassen ist zu bedenken, dass derzeit keine abschließende Beurteilung möglich ist, weil Vergleichs- und Langzeitstudien nicht vorliegen. Das in allen Wirkstoffgruppen potentiell bestehende Risikoselektionspotenzial muss in die Entscheidung über eventuelle Erstattungseinschränkungen mit einbezogen werden. IGES 35 5 Antithrombotische Mittel (B01) 5.1 Übersicht über die Wirkstoffgruppe Tabelle 11: Marktdaten zur Wirkstoffgruppe der antithrombotischen Mittel Anz. Herst. Bezeichnung B01AC Thrombozytenaggregationshemmer 27 727.555.317 62,1% B01AB Heparingruppe 14 106.621.462 9,1% B01AA Vitamin K-Antagonisten 9 331.576.450 28,3% Sonstige 5.946.770 0,5% Gesamt 1.171.700.000 100,0% Quelle: DDD 2008 Marktanteil (in DDD) ATC Berechnung IGES nach NVI (INSIGHT Health) Die Wirkstoffgruppe der Antithrombotika ist eine sehr umfangreiche Gruppe mit erheblichen Unterschieden bezüglich der Indikationen, der Wirkstärke und des Wirkprinzips zwischen den einzelnen Untergruppen, so dass die Gruppe als ganze zu heterogen ist, um eine differenzierte Analyse durchführen zu können (Abbildung 9). Aufgrund der dominierenden Stellung der drei in der Tabelle 11 namentlich genannten Wirkstoffgruppen wird die differenzierte Analyse im Weiteren auf diese beschränkt. Abbildung 9: Bewertungskriterien für die Wirkstoffgruppe der Antithrombotischen Mittel Kriterium Zulassungsbestimmungen Evidenzlage Einnahmekomfort Antithrombotische Mittel (B01) 36 IGES Antithrombotische Mittel (B01) Kriterium Nebenwirkungen, Kinetik Öffentlichkeitswirksamkeit Präferenzen von Ärzten und Patienten Quelle: 5.2 IGES Thrombozytenaggregationshemmer (TAH), exkl. Heparin (B01AC) Tabelle 12: Marktpreise zur Wirkstoffgruppe der Thrombozytenaggregationshemmer ATC Wirkstoff B01AC04 Clopidogrel B01AC05 Ticlopidin B01AC06 Acetylsalicylsäure Quelle: Anz. OriginalHerst. präparat 6 Plavix, Iscover Gene Preisspanne rika €/DDD Mittelw. € x 1,82-4,09 2,51 13 Tiklyd x 1,05-2,20 1,13 19 Aspirin x 0,03-0,14 0,04 Berechnung IGES nach NVI (INSIGHT Health) Die Wirkstoffgruppe der Thrombozytenaggregationshemmer (TAH) umfasst mehrere Substanzen, im Weiteren beschränkt sich diese Analyse jedoch auf die für den deutschen Markt wesentlichen in Tabelle 12 dargestellten Wirkstoffe. Ende 2009 ist mit Prasugrel ein weiterer Wirkstoff hinzugekommen. Ticlopidin wird im Vergleich mit den anderen beiden Wirkstoffen in dieser Gruppe deutlich seltener verschrieben. Die Preisspanne innerhalb der Gruppe der TAH liegt zwischen 0,03-4,09 €/DDD bei einem Mittelwert von 0,62 € (Berechnung IGES nach NVI (INSIGHT Health)). IGES 37 Abbildung 10: Bewertungskriterien für die Wirkstoffgruppe der Thrombozytenaggregationshemmer Thrombozytenaggregationshemmer (TAH) (B01AC) Kriterium Zulassungsbestimmungen Evidenzlage Einnahmekomfort Nebenwirkungen, Kinetik Öffentlichkeitswirksamkeit Präferenzen von Ärzten und Patienten Quelle: IGES Zulassungsbestimmungen und Evidenzlage Die Analyse der Wirkstoffgruppe der Thrombozytenaggregationshemmer zeigt die uneinheitliche Zulassungslage, vor allem in Teilindikationen bei bestimmten Begleiterkrankungen oder Umständen. Die teureren Substanzen (Clopidogrel und Ticlopidin) werden zudem als Reservemittel bei ASSUnverträglichkeit eingesetzt. Die Wirkstoffe sind in ihrer Wirkung und Wirkstärke vergleichbar, wenngleich sie oft in unterschiedlichen Indikationen zur Anwendung kommen. Das IQWiG kommt in seiner vergleichenden Bewertung für Clopidogrel und ASS zu dem Schluss, dass die LangzeitMonotherapie mit Clopidogrel in der Indikation periphere arterielle Verschlusskrankheit einen Zusatznutzen hat in Bezug auf die Reduktion des Risikos für thromboembolische Ereignisse, für eine Überlegenheit in der Reduktion der Gesamtmortalität konnten jedoch keine Nachweise gefunden werden (IQWiG 2006b). Nebenwirkungen, Kinetik und Einnahmekomfort In der Art und Häufigkeit der Einnahme sind keine relevanten Unterschiede feststellbar, klinische Vorteile einer der Substanzen sind nicht eindeutig 38 IGES belegt (Frenzel 2006). Die gastrointestinalen Nebenwirkungen von Clopidogrel und Ticlopidin sind gegenüber ASS vermindert. Bei Ticlopidin besteht das Risiko, dass es unter der Therapie zu einer Knochenmarksdepression kommt. Clopidogrel besitzt insgesamt das günstigste Nebenwirkungs- und Interaktionsprofil der drei Substanzen (Patscheke 2003, Aktories et al. 2009, S. 528ff.). Öffentlichkeitswirksamkeit und Präferenzen Da es sich bei den Thrombozytenaggregationshemmern um eine vergleichsweise sensible Wirkstoffgruppe handelt, die häufig verordnet wird und die Indikationen, insbesondere in der Sekundärprophylaxe vielfach mit Ängsten verbunden ist, ist mit hoher öffentlicher Aufmerksamkeit sowohl bei Patienten als auch bei Ärzten zu rechnen, wenn diese Wirkstoffgruppe im Rahmen eines Erstattungsausschlusses behandelt wird. Bei einer Einschränkung auf ASS, wegen des großen Preisunterschiedes die wahrscheinlichste, lässt sich demnach eine hohe Risikoselektionsmöglichkeit erkennen. Fazit Teilweise eingeschränkte Anwendungsgebiete Medizinisch betrachtet ist ein Substitutionspotential vorhanden, Unterschiede bestehen hauptsächlich hinsichtlich der Nebenwirkungen. Negative Reaktionen sind zu erwarten, Risikoselektionspotential ist vorhanden und als wahrscheinlich effektiv zu bewerten 5.3 Vitamin K-Antagonisten (B01AA) Tabelle 13: ATC Marktpreise zur Wirkstoffgruppe der Vitamin-K-Antagonisten Wirkstoff Herst. Originalpräparat B01AA03 Warfarin 1 Coumadin B01AA04 Phenprocoumon 8 Marcumar Quelle: Gene rika x Preisspan Mittelw. € ne €/DDD 0,33-0,94 0,34 0,17-1,06 0,20 Berechnung IGES nach NVI (INSIGHT Health) Die Wirkstoffgruppe der Vitamin-K-Antagonisten umfasst zwei Substanzen von zusammen 9 Herstellern, wobei Phenprocoumon traditionell in Deutschland die weitaus häufiger verordnete Substanz ist und auch von einigen Generikaherstellern angeboten wird (Tabelle 13). Die Preisspanne innerhalb der Wirkstoffgruppe liegt zwischen 0,17-1,06 €/DDD bei einem Mittelwert von 0,21 € (Berechnung IGES nach NVI (INSIGHT Health)). IGES 39 Abbildung 11: Bewertungskriterien für die Wirkstoffgruppe der Vitamin-KAntagonisten Vitamin-K-Antagonisten (B01AA) Kriterium Zulassungsbestimmungen Evidenzlage Einnahmekomfort Nebenwirkungen, Kinetik Öffentlichkeitswirksamkeit Präferenzen von Ärzten und Patienten Quelle: IGES Zulassungsbestimmungen und Evidenzlage Der Vergleich der beiden sehr ähnlichen Substanzen zeigt ein sehr homogenes Bild bezüglich der angelegten Kriterien Zulassung und Wirksamkeit. Nebenwirkungen, Kinetik und Einnahmekomfort Die wesentlichen Unterschiede zwischen den Substanzen bestehen in der unterschiedlichen Kinetik: Insbesondere die Eliminations-Halbwertszeit ist unterschiedlich, was sich im unterschiedlichen Neben- und Wechselwirkungspotential zeigen kann und Auswirkungen auf die Möglichkeit der Therapieunterbrechung zum Beispiel vor Operationen oder bei sonstigen auftretenden Risiken oder Nebenwirkungen haben kann (Aktories et al. 2009, S. 532ff.). Öffentlichkeitswirksamkeit und Präferenzen Coumadin wird in der Regel als Alternative für eine Patientenminderheit verordnet und die Umstellung kann mit Komplikationen verbunden sein, was auch in einer erhöhten öffentlichen Wirksamkeit bei Erstattungsausschluss resultieren dürfte. Da zudem der Preisunterschied der Substanzen nicht groß ist, ist zwar ein Substitutionspotential aufgrund der prinzipiellen Austauschbarkeit vorhanden, ein tatsächliches Einsparpotential sowie eine Patientenselektion erscheint jedoch fraglich. 40 IGES Fazit Keine ausgeprägten Unterschiede in der Zulassung. Medizinisch betrachtet ist ein großes Substitutionspotential vorhanden. Kaum Unterschiede in der Wahrnehmung bei Ärzten und Patienten, daher mit derzeitigen Alternativen kaum Risikoselektionspotential. 5.4 Heparingruppe (B01AB) Tabelle 14: Marktpreise zu den Wirkstoffen der Heparingruppe Anz. OriginalHerst präparat ATC Wirkstoff B01AB01 Heparin (unfraktioniert) 7 B01AB04 Dalteparin 2 Fragmin P B01AB05 Enoxaparin B01AB06 Gene Preisspanrika ne €/DDD 0,61-5,33 2,51 0,93-17,10 3,14 2 Clexane 1,61-8,00 2,84 Nadroparin 3 Fraxiparin 2,71-8,55 3,95 B01AB08 Reviparin 2 Clivarin 2,96-9,70 4,87 B01AB10 Tinzaparin 3 innohep 2,68-8,55 4,21 B01AB13 Certoparin 2 Mono Embolex 2,98-9,95 4,49 Quelle: x Mittelw. € Berechnung IGES nach NVI (INSIGHT Health) Die Wirkstoffgruppe umfasst unterschiedlich modifizierte bzw. in ihrer Molekülgröße voneinander abweichende Heparine von insgesamt 14 Herstellern (Tabelle 14). Das unfraktionierte Heparin (UFH) wurde weitgehend von den niedermolekularen patentgeschützten Heparinen (NMH) verdrängt und wird nur noch in speziellen Indikationen angewendet. Unter den NMH ist Enoxaparin der am häufigsten verordnete Wirkstoff. Die Preisspanne innerhalb der Wirkstoffgruppe liegt zwischen 0,61-17,10 €/DDD bei einem Mittelwert von 3,30 € (Berechnung IGES nach NVI (INSIGHT Health)). IGES Abbildung 12: 41 Bewertungskriterien für die Wirkstoffe der Heparingruppe Kriterium Heparingruppe (B01AB) Zulassungsbestimmungen Evidenzlage Einnahmekomfort Nebenwirkungen, Kinetik Öffentlichkeitswirksamkeit Präferenzen von Ärzten und Patienten Quelle: IGES Zulassungsbestimmungen und Evidenzlage Die Analyse der Heparine auf Substitutionspotential ist durch einige Einschränkungen gekennzeichnet. Für einige der NMH bestehen Zulassungen für zusätzliche Indikationen (hauptsächlich für die Behandlung von Herzinfarkt und anderen thromboembolischen Ereignissen). Im Vergleich zu unfraktioniertem Heparin sind die NMH besser wirksam und verträglich und bieten eine kalkulierbarere Wirkung, da es sich insgesamt um definiertere Moleküle handelt. Nebenwirkungen, Kinetik und Einnahmekomfort Die NMH unterscheiden sich in ihrer Molekülgröße und damit auch – klinisch jedoch nicht relevant – in der Kinetik und Selektivität. Ein insgesamt großer Vorteil gegenüber dem UFH ist die bessere Bioverfügbarkeit und allgemein längere Halbwertszeit, so dass eine einmal tägliche Gabe dieser Heparine vorgenommen werden kann. Die unerwünschten Wirkungen sind für die NMH gegenüber dem UFH vermindert (Aktories et al. 2009, S. 532ff.). Öffentlichkeitswirksamkeit und Präferenzen Bei der Heparintherapie handelt es sich in der Regel nicht um eine Dauertherapie, Reaktionen von Patienten brauchen daher bei einer Einschränkung 42 IGES bezüglich einzelner NMH kaum berücksichtigt zu werden. Große Reaktionen würde jedoch eine Beschränkung auf unfraktioniertes Heparin hervorrufen, da die Evidenzlage deutlich zugunsten der NMH spricht und ein Erstattungsausschluss dieser vermutlich als eine ungerechtfertigte Rationierung empfunden werden würde. Eine Lenkungs- und Selektionswirkung für definierte Patientengruppen ließe sich überdies auf diese Weise nicht erreichen. Fazit Keine ausgeprägten Unterschiede in der Zulassung. Medizinisch betrachtet ist ein eingeschränktes Substitutionspotential vorhanden. Außer bei UFH existieren kaum Unterschiede in der Wahrnehmung bei Ärzten und Patienten, meist nur kurzfristige Anwendung, daher nur sehr geringes Risikoselektionspotential IGES 43 6 Antianämika (B03) 6.1 Übersicht über die Wirkstoffgruppe Tabelle 15: Marktdaten zur Wirkstoffgruppe der Antianämika Anz. Herst. Bezeichnung B03A Eisen 25 55.562.987 28,8% B03XA Erythropoietin 11 24.044.163 12,4% B03B Vit B / Folsäure 39 111.890.293 58,4% Sonstige 1.702.000 0,9% Gesamt 193.200.000 100,0% Quelle: DDD 2008 Marktanteil (in DDD) ATC Berechnung IGES nach NVI (INSIGHT Health) Die Wirkstoffgruppe der Antianämika ist eine sehr umfangreiche Gruppe mit erheblichen Unterschieden bezüglich der Indikationen, der Wirkstärke und des Wirkprinzips zwischen den einzelnen Untergruppen, so dass die Gruppe als ganze zu heterogen ist, um eine differenzierte Analyse durchführen zu können (Abbildung 13). Tabelle 15 zeigt die Verbrauchsanteile der wichtigsten Antianämika in DDD. Scheinbar haben Vitamin B12- und Folsäurepräparate den höchsten Anteil. Ursache dafür ist, dass Vitamin B12Präparate in der Regel in sehr viel höherer Dosierung eingesetzt werden, als es die DDD erwarten lässt.3 Betrachtet man den Anteil der Erythropoietine am Gesamtumsatz der Gruppe (nach AVP 2008), so beträgt der Marktanteil 83,7 % (Berechnung IGES nach NVI (INSIGHT Health)). Daher wird die differenzierte Analyse im Weiteren auf die Erythropoietine beschränkt. 3 Die DDD für Cyanocobalamin liegt bei 20 Mikrogramm parenteral. In den ersten Wochen der Behandlung eines Vitamin-B12-Mangels werden üblicherweise 1000 bis 2000 Mikrogramm pro Woche verabreicht, täglich also 10 bis 15 DDD. 44 IGES Abbildung 13: Bewertungskriterien für die Wirkstoffgruppe der Antianämika Kriterium Antianämika (B03) Zulassungsbestimmungen Evidenzlage Einnahmekomfort Nebenwirkungen, Kinetik Öffentlichkeitswirksamkeit Präferenzen von Ärzten und Patienten Quelle: 6.2 IGES Erythropoetine (B03XA) Tabelle 16: ATC Marktpreise zur Wirkstoffgruppe der Erythropoetine Wirkstoff B03XA01 Erythropoetin Anz. OriginalHerst. präparat 9 Erypo, Retacrit, NeoRecormon Biosimilars Preisspanne €/DDD x Mittelw. € 9,34-22,53 11,91 B03XA02 Darbepoetin alfa 3 Aranesp 11,63-14,72 12,66 B03XA03 Pegzerepoetin alfa 1 Mircera 11,17-12,35 11,52 Quelle: Berechnung IGES nach NVI (INSIGHT Health) Die Wirkstoffgruppe der Erythropoetine setzt sich aus Substanzen zusammen, die entweder als Biosimilars des Erythropoetin gut vergleichbar oder im Falle der anderen weiter abgewandelten Wirkstoffe bedingt miteinander vergleichbar sind (Tabelle 16). Die kürzer wirksamen Erythropoetine werden deutlich häufiger verschrieben als die abgewandelten Wirkstoffe. Die Preisspanne innerhalb der gesamten Gruppe der Erythropoetine liegt zwi- IGES 45 schen 9,34-22,53 €/DDD bei einem Mittelwert von 12,20 € (Berechnung IGES nach NVI (INSIGHT Health)). Abbildung 14: Bewertungskriterien für die Wirkstoffgruppe der Erythropoetine Kriterium Erythropoetine (B03XA) Zulassungsbestimmungen Evidenzlage Einnahmekomfort Nebenwirkungen, Kinetik Öffentlichkeitswirksamkeit Präferenzen von Ärzten und Patienten Quelle: IGES Zulassungsbestimmungen und Evidenzlage Die unterschiedlichen Biosimilars und das Referenzpräparat mit dem Wirkstoff Epoetin alfa sind therapeutisch äquivalent (Bleick 2008). Die Zulassungen der abgewandelten Wirkstoffe und Epoetin beta sind gegenüber den Erythropoetin alfa und zeta eingeschränkt und somit nicht völlig vergleichbar. In der Wirkung hingegen unterscheiden sich alle betrachteten Substanzen nicht voneinander. Nebenwirkungen, Kinetik und Einnahmekomfort Lediglich die Kinetik und damit die Wirkdauer der Substanzen unterscheidet sich deutlich (Leinmüller 2007). Bei Darbepoetin und Pegzerepoetin alfa sind deutlich längere Dosisintervalle möglich und erforderlich. Die Dosierung der Substanzen kann zwischen den Herstellern variieren, weshalb ein Präparatewechsel vorsichtig erfolgen sollte (Aktories et al. 2009, S. 748f.). Öffentlichkeitswirksamkeit und Präferenzen Die Präparate werden nur bei einem kleinen Patientenkreis angewendet und unterscheiden sich kaum in ihrer Wirkung, eine entsprechende ausreichend 46 IGES starke Lenkungswirkung bei Einschränkung der Erstattung ist daher kaum zu erwarten. Fazit Keine großen Unterschiede in der Zulassung. Medizinisch betrachtet ist ein großes Substitutionspotential vorhanden. Nur kleiner Patientenkreis, wenig Unterschiede in der Wahrnehmung bei Ärzten und Patienten, daher kaum Risikoselektionspotential. IGES 47 7 Mittel mit Wirkung auf das Renin-Angiotensin-System (RAS) (C09) 7.1 Übersicht über die Wirkstoffgruppe Tabelle 17: Marktdaten zur Wirkstoffgruppe der Mittel mit Wirkung auf das ReninAngiotensin-System Anz. Herst. Bezeichnung C09AA ACE-Hemmer, rein 68 3.667.526.472 59,0% C09CA Angiotensin-II-Antagonisten, rein 19 887.734.167 14,3% C09XA Renin-Inhibitoren 2 18.707.528 0,3% C09B ACE-Hemmer, Kombinationen 51 1.042.148.089 16,8% C09D Angiotensin II Antagonisten, Kombinationen 21 602.357.716 9,7% Sonstige 1.426.000 0,0% Gesamt 6.219.900.000 100,0% Quelle: DDD 2008 Marktanteil (in DDD) ATC Berechnung IGES nach NVI (INSIGHT Health) Zwar weisen auch die Kombinationspräparate relevante Marktanteile in Bezug auf Verbrauch sowie Umsatz (nicht dargestellt) auf, dennoch wurden für die Analyse nur die Monosubstanzen aus dieser Wirkstoffgruppe miteinander verglichen. Die daraus abgeleiteten Ergebnisse lassen sich im Prinzip auf die meisten Kombinationspräparate übertragen, denn die meisten der hierzu zählenden Präparate kombinieren einen Angiotensin-IIAntagonisten (Sartan) oder einen ACE-Hemmer mit dem Diuretikum Hydrochlorothiazid. Die Mittel mit Wirkung auf das Renin-AngiotensinSystem (RAS) stellen innerhalb der blutdrucksenkenden Arzneistoffe in Bezug auf den Verbrauch und Umsatz die wichtigste Gruppe dar. Die drei einzelnen Stoffgruppen weisen nur geringe Unterschiede bezüglich des Wirkprinzips auf, trotzdem sollen die Subgruppen getrennt betrachtet werden, da Unterschiede bzgl. der Präferenz a priori bekannt sind (Abbildung 15). 48 IGES Abbildung 15: Bewertungskriterien für die Wirkstoffgruppe der Mittel mit Wirkung auf das Renin-Angiotensin-System Mittel mit Wirkung auf RAS (C09) Kriterium Zulassungsbestimmungen Evidenzlage Einnahmekomfort Nebenwirkungen, Kinetik Öffentlichkeitswirksamkeit Präferenzen von Ärzten und Patienten Quelle: IGES IGES 7.2 49 ACE-Hemmer (C09AA) Tabelle 18: Marktpreise zur Wirkstoffgruppe der ACE-Hemmer Anz. OriginalHerst. präparat Gene rika Preisspan Mittelw. € ne €/DDD ATC Wirkstoff C09AA01 Captopril 38 Lopirin x 0,09-4,05 0,19 C09AA02 Enalapril 35 Xanef x 0,06-1,73 0,14 C09AA03 Lisinopril 26 Acerbon x 0,08-1,60 0,14 C09AA04 Perindopril 0,56-0,95 0,68 C09AA05 Ramipril 37 Delix x 0,04-1,50 0,07 C09AA06 Quinapril 10 Accupro x 0,15-1,21 0,22 C09AA07 Benazepril 8 Cibacen x 0,07-0,68 0,13 C09AA08 Cilazapril 1 Dynorm 0,21-2,22 0,28 C09AA09 Fosinopril 5 Fosinorm 0,13-1,23 0,26 C09AA10 Trandolapril 1 Udrik 0,28-2,38 0,32 C09AA11 Spirapril 2 Quadropril 0,29-0,69 0,29 C09AA13 Moexipril 1 Fempress 0,27-0,93 0,31 C09AA15 Zofenopril* 1 Bifril C09AA16 Imidapril 1 Tanatril 1 Coversum *keine Marktdaten aus 2008 vorhanden Quelle: Berechnung IGES nach NVI (INSIGHT Health) Die umfangreiche Wirkstoffgruppe der ACE-Hemmer setzt sich aus weit verbreiteten generischen und weniger verordnungsstarken patentgeschützten Substanzen zusammen, die trotz ihrer prinzipiellen Ähnlichkeiten nur bedingt miteinander vergleichbar sind (Tabelle 18). Die Preisspanne innerhalb der gesamten Gruppe der ACE-Hemmer liegt zwischen 0,044,05 €/DDD bei einem Mittelwert von 0,10 € (Berechnung IGES nach NVI (INSIGHT Health)). Die am weitaus häufigsten verordnete Substanz ist Ramipril, ihr niedriger mittlerer Preis pro DDD schlägt sich daher deutlich im niedrigen Mittelwert der gesamten Gruppe nieder. 50 IGES Abbildung 16: Bewertungskriterien für die Wirkstoffgruppe der ACE-Hemmer ACE-Hemmer (C09AA) Kriterium Zulassungsbestimmungen Evidenzlage Einnahmekomfort Nebenwirkungen, Kinetik Öffentlichkeitswirksamkeit Präferenzen von Ärzten und Patienten Quelle: IGES Zulassungsbestimmungen und Evidenzlage Für die Indikation essentielle Hypertonie sind alle Wirkstoffe zugelassen. Für die zweite Hauptindikation der ACE-Hemmer - Herzinsuffizienz - sind jedoch nur 8 der 12 untersuchten gehandelten Monopräparate zugelassen. Weitere Anwendungsgebiete finden sich in der Zulassung einzelner Präparate. Auch bei Kontraindikationen ergibt sich ein zwar vergleichbares aber nicht einheitliches Bild. Die ACE-Hemmer sind in ihrer Wirkung in therapieäquivalenten Dosierungen dennoch gut untereinander vergleichbar. Das IQWiG fand in seiner Bewertung verschiedener Blutdruck senkender Wirkstoffgruppen Vorteile für die ACE-Hemmer bezüglich des Herzinsuffizienzrisikos gegenüber anderen Wirkstoffgruppen (IQWiG 2009c). Nebenwirkungen, Kinetik und Einnahmekomfort Klinisch relevante Vorteile zeigen sich bei keiner der Substanzen, die Unterschiede sind hauptsächlich in der Kinetik begründet (Dominiak 2003). Captopril unter Umständen auch Enalapril, weisen aufgrund ihrer kürzeren Wirkungsdauer den Nachteil auf, zweimal täglich eingenommen werden zu müssen, was sich in einer schlechteren Compliance niederschlagen kann. ACE-Hemmer sind generell nebenwirkungsarm und werden in der Regel gut vertragen, die wenigen Nebenwirkungen sind systematisch bedingt, IGES 51 wobei bei Captopril allerdings einige Nebenwirkungen häufiger beobachtet wurden (Aktories et al. 2009, S. 450ff.). Öffentlichkeitswirksamkeit und Präferenzen ACE-Hemmer werden häufig verordnet und gelten als Standardbehandlung. Eine entsprechende Steuerungswirkung lässt sich von dieser Wirkstoffgruppe daher erwarten, obwohl kaum gezielt Risikogruppen definiert werden können, die spezielle ACE-Hemmer bevorzugen. Zu berücksichtigen wären zudem auch öffentliche Reaktionen, die aufgrund der breiten Anwendung vermutlich nicht ausbleiben würden. Fazit Eingeschränkte Vergleichbarkeit in der Zulassung. Medizinisch betrachtet ist ein großes Substitutionspotential vorhanden. Wirkstoffe gelten als Standardbehandlung, breite Anwendung, daher Risikoselektionspotential möglich, medizinische Kriterien bei Lenkung jedoch fraglich 7.3 Angiotensin-II-Rezeptor-Antagonisten (Sartane) (C09CA) und Renin-Inhibitoren (C09XA) Tabelle 19: Marktpreise zu den Wirkstoffgruppen der Angiotensin-II-RezeptorAntagonisten und der Renin-Inhibitoren Anz. Gene Originalpräparat Herst. rika ATC Wirkstoff C09CA01 Losartan 3 Lorzaar Protect C09CA02 Eprosartan 5 Emestar C09CA03 Valsartan C09CA04 Preisspan Mittelw. € ne €/DDD 0,61-4,55 0,87 0,72-1,36 0,88 4 Diovan 0,32-2,90 0,61 Irbesartan 3 Karvea 0,52-2,16 0,70 C09CA06 Candesartan 4 Atacand 0,31-2,10 0,49 C09CA07 Telmisartan 4 Micardis 0,51-2,08 0,61 C09CA08 Olmesartan medoxomil 3 Votum, Olmetec 0,46-2,12 0,76 C09XA02 Aliskiren 2 Rasilez 0,68-1,41 0,89 Quelle: x Berechnung IGES nach NVI (INSIGHT Health) Die Gruppe der Sartane besteht bis auf Eprosartan nur aus Wirkstoffen, die z.Zt. noch patentgeschützt sind (Tabelle 19), weitere Wirkstoffe werden jedoch zum Teil noch in 2010 generisch verfügbar sein. Derzeit ist 52 IGES Candesartan der am häufigsten verordnete Wirkstoff in dieser Gruppe. Die Substanzen sind allgemein gut miteinander vergleichbar. Der vergleichsweise hohe Wert der Preisspanne von Losartan ist speziellen "Starterpacks" zuzurechnen, die Tabletten unterschiedlicher Wirkstärke enthält und zu Beginn der Therapie die Eindosierung erleichtern soll, woraus sich ein höherer Preis pro DDD errechnet. Der derzeit einzige verfügbare Renininhibitor Aliskiren setzt vom Wirkprinzip her auf einer höheren Stufe an, führt aber ebenso wie die Sartane zu einer verminderten Wirkung von Angiotensin II. Trotzdem sollen die Gruppen hier getrennt betrachtet werden, weil eine abschließende Beurteilung der erst jüngst eingeführten Renin-Inhibitoren noch nicht möglich ist. Die Preisspanne innerhalb der Gruppe der Sartane liegt zwischen 0,31-4,55 €/DDD bei einem Mittelwert von 0,61 € (Berechnung IGES nach NVI (INSIGHT Health)). Abbildung 17: Bewertungskriterien für die Wirkstoffgruppen der Angiotensin-IIRezeptor-Antagonisten und der Renin-Inhibitoren Sartane (C09CA) Kriterium Renin-Inhibitor (C09XA) Zulassungsbestimmungen X Evidenzlage X Einnahmekomfort X Nebenwirkungen, Kinetik X Öffentlichkeitswirksamkeit X Präferenzen von Ärzten und Patienten X Quelle: IGES Zulassungsbestimmungen und Evidenzlage Bei der Betrachtung der Wirkstoffe zeigt sich, dass die Zulassungssituation ähnlich wie bei den ACE-Inhibitoren ist. Alle Wirkstoffe sind zur Behandlung der essentiellen Hypertonie zugelassen, 3 der 7 Sartane sind auch zur Behandlung der Herzinsuffizienz indiziert. Daneben sind einzelne Präparate auch in zusätzlichen Indikationen zugelassen. Bei den Kontraindikationen zeigen sich hingegen keine relevanten Unterschiede. In ihrer Wirksamkeit IGES 53 sind die hier beschriebenen Substanzen therapeutisch gut miteinander vergleichbar. In den üblichen Dosierungen sind sie auch äquivalent zu den ACE-Hemmern (Deutsche Hochdruckliga 2009, Cuspidi et al. 2002, Yusuf et al. 2008, EMEA 2009). Zusätzliche Vorteile scheinen sich allenfalls für bestimmte Patientengruppen zu ergeben. Auch im Hinblick auf die Vermeidung von Folgeerkrankungen zeigen sich kaum relevante Unterschiede zwischen diesen betrachteten Wirkstoffgruppen, wobei die Datenlage aufgrund fehlender Endpunktstudien für Aliskiren bislang nicht beurteilt werden kann, für die Sartane konnte auch das IQWiG in seiner Bewertung verschiedener blutdrucksenkender Wirkstoffgruppen nur wenige Endpunktstudien finden (Deutsche Hochdruckliga 2009, IQWiG 2009c, Matchar et al. 2008, Nieber 2008, Stojilikovic und Behnia 2007). Nebenwirkungen, Kinetik und Einnahmekomfort Größere Unterschiede bestehen hingegen in den Nebenwirkungen und bei der Metabolisierung der Substanzen. Obwohl allgemein alle beschriebenen Substanzen gut verträglich sind, können die Sartane als nebenwirkungsärmer gegenüber den ACE-Inhibitoren bezeichnet werden (Aktories et al. 2009, S.450 ff.). Üblicherweise werden sie auch gerade bei Unverträglichkeit gegen diese eingesetzt (Deutsche Hochdruckliga 2009). Während die ACE-Hemmer nach Aktivierung überwiegend kaum weiter metabolisiert werden, findet bei den meisten Sartanen – außer bei Valsartan, Telmisartan und Eprosartan – eine umfangreiche Modifikation über das CYPEnzymsystem statt und es können sich Wechselwirkungen mit anderen Arzneistoffen ergeben die z.B. die blutdrucksenkende Wirkung etwas abschwächen können, aber offensichtlich generell gesehen nur geringe klinische Relevanz besitzen. Die Eliminierung erfolgt bei ACE-Hemmern überwiegend renal, während dies bei den Sartanen hauptsächlich über den Darm erfolgt (Altmannsberger 2001, Dominiak 2003). In der Einnahme unterscheiden sich die Sartane kaum, bei einigen Präparaten kann jedoch u.U. die einmal tägliche Gabe bei vielen Patienten nicht ausreichend sein (ifap 2009, Oparil et al. 2001). Öffentlichkeitswirksamkeit und Präferenzen Die Sartane dürften überwiegend als Wirkstoffklasse wahrgenommen werden, da sie sich therapeutisch kaum voneinander unterscheiden. Aufgrund der breiten Anwendung dürfte dennoch mit Reaktionen in der Öffentlichkeit gerechnet werden. In Bezug auf das Risikoselektionspotential gilt dafür ähnliches wie bereits bei der Wirkstoffgruppe der ACE-Hemmer (Kap. 7.2) angemerkt. Fazit Unterschiede in der Zulassung sind vorhanden. 54 IGES Medizinisch betrachtet ist bei den Sartanen ein großes Substitutionspotential vorhanden. Kaum Unterschiede in der Wahrnehmung bei Ärzten und Patienten, aber breite Anwendung. Kaum Risikoselektionspotential, medizinische Kriterien bei Lenkung jedoch fraglich 7.4 Fazit Mittel mit Wirkung auf das Renin-Angiotensinsystem Innerhalb der Gruppe der Sartane, ACE-Hemmer und Renin-Hemmer (derzeit lediglich durch einen Wirkstoff vertreten) scheinen aus therapeutischer Sicht jeweils keine gravierenden Unterschiede zu bestehen, ausgenommen die z.T. eingeschränkten Indikationsgebiete. Bei entsprechendem Setzen der Auswahlbedingung (z.B. "Es muss mindestens ein Wirkstoff mit der zusätzlichen Indikation Herzinsuffizienz erstattet werden") scheint ein Substituieren innerhalb der Gruppen nicht zu Nachteilen zu führen. Auch aus der Einteilung der Wirkstoffe hinsichtlich ihrer Kinetik erwachsen mit Ausnahme einiger ACE-Hemmer keine therapeutisch bedeutsamen Probleme, eine einmal tägliche Gabe gewährleistet bei den meisten Substanzen eine dauerhaft sichere Blutdrucksenkung. Es wäre daher durchaus denkbar, eine Substitution zwischen ACE-Hemmern und Sartanen zuzulassen. Allerdings muss berücksichtigt werden, dass Sartane als besser verträglich gelten und die Gruppe der Patienten, die ACE-Hemmer nicht verträgt, vergleichsweise hoch ist (die Angaben schwanken zwischen 5 und 20%). Ergänzend lässt sich anführen, dass eine effektive Bluthochdrucktherapie bei der überwiegenden Zahl der Patienten nur durch eine Kombination verschiedener Wirkstoffklassen erreichen lässt, mit Einschränkungen im Arsenal der zur Verfügung stehenden therapeutischen Alternativen könnte in vielen Fällen auch im Hinblick auf zusätzliche Erkrankungen bzw. Komedikationen und insbesondere der Vermeidung von Folgeerkrankungen keine optimale Therapie erreicht werden. Aus der Kombination von ACEHemmern und Sartanen konnten keine therapeutischen Vorteile im Vergleich mit der jeweiligen Monotherapie gesehen werden. Der erst 2007 eingeführte Renininhibitor Aliskiren lässt noch keine abschließende Bewertung zu. Zusätzliche Vorteile scheinen sich nicht zu ergeben, jedoch lassen sich Wechselwirkungen bei Komedikationen, die mit den anderen Wirkstoffgruppen auftreten, aufgrund einer anderen Metabolisierung umgehen. IGES 55 8 Lipidsenker (C10) 8.1 Übersicht über die Wirkstoffgruppe Tabelle 20: Marktdaten zur Wirkstoffgruppe der Lipidsenker Anz. DDD 2008 Herst. ATC Bezeichnung C10AA Statine (C10AX) Ezetimib C10AB Fibrate C10AC Gallensäure bindende Mittel Sonstige Gesamt Quelle: Marktanteil (in DDD) 52 2.462.597.703 90,3% 2 177.983.219 6,5% 24 41.017.565 2,9% 9 2.078.049 0,1% 12 5.432.651 0,2% 2.727.000.000 100,0% Berechnung IGES nach NVI (INSIGHT Health) Die Wirkstoffgruppe der Lipidsenker ist eine sehr umfangreiche Gruppe mit erheblichen Unterschieden bezüglich der Indikationen, der Wirkpotenz und des Wirkprinzips zwischen den einzelnen Untergruppen, so dass die Gruppe als ganze zu heterogen ist, um eine differenzierte Analyse durchführen zu können (Abbildung 18). Aufgrund der dominierenden Stellung der Statine und des Ezetimibs wird die differenzierte Analyse im Weiteren auf diese Substanzgruppen beschränkt. Abbildung 18: Bewertungskriterien für die Wirkstoffgruppe der Lipidsenker Kriterium Zulassungsbestimmungen Evidenzlage Einnahmekomfort Lipidsenker (C10) 56 IGES Kriterium Lipidsenker (C10) Nebenwirkungen, Kinetik Öffentlichkeitswirksamkeit Präferenzen von Ärzten und Patienten Quelle: 8.2 IGES HMG-CoA-Reduktasehemmer (Statine) (C10AA) Tabelle 21: Marktpreise zur Wirkstoffgruppe der HMG-CoA-Reduktasehemmer (Statine) und Ezetimib Anz. Herst Originalpräparat Gene rika Preisspan Mittelw. € ne €/DDD ATC Wirkstoff C10AA01 Simvastatin 44 Zocor x 0,10-1,53 0,16 C10AA02 Lovastatin 18 Mevinacor x 0,32-1,79 0,46 C10AA03 Pravastatin 28 Mevalotin x 0,19-1,39 0,30 C10AA04 Fluvastatin 15 Cranoc x 0,24-1,24 0,34 C10AA05 Atorvastatin 1 Sortis 0,24-1,32 0,54 C10AA07 Rosuvastatin* 1 Crestor C10AX09 Ezetimib 2 Ezetrol 1,71-1,99 1,72 *keine Marktdaten aus 2008 vorhanden Quelle: Berechnung IGES nach NVI (INSIGHT Health) Die Gruppe der Statine besteht hauptsächlich aus generisch verfügbaren Wirkstoffen, zwei der Statine sowie Ezetimib sind derzeit noch patentgeschützt (Tabelle 21). Simvastatin ist der deutlich am häufigsten verordnete Wirkstoff dieser Gruppe. Die Statine sind insgesamt gut miteinander vergleichbar. Der derzeit einzige Vertreter einer neuartig wirkenden Substanzklasse Ezetimib ist getrennt zu betrachten. Die Preisspanne innerhalb der Gruppe der Statine liegt zwischen 0,10-1,79 €/DDD bei einem Mittelwert von 0,19 € (Berechnung IGES nach NVI (INSIGHT Health)). IGES 57 Abbildung 19: Bewertungskriterien für die Wirkstoffgruppe der HMG-CoAReduktasehemmer (Statine) und Ezetimib Kriterium Statine (C10AA) Ezetimib (C10AX) Zulassungsbestimmungen X Evidenzlage X Einnahmekomfort X Nebenwirkungen, Kinetik X Öffentlichkeitswirksamkeit X Präferenzen von Ärzten und Patienten X Quelle: IGES Zulassungsbestimmungen und Evidenzlage In der Betrachtung der zugelassenen Anwendungsgebiete der hier verglichenen Wirkstoffe zeigen sich Unterschiede für einzelne Indikationen, insbesondere bei der Hyperlipidämie und kardiovaskulären Protektion. Auch in den Kontraindikationen zeigen sich Unterschiede, so dass die Zulassungssituation insgesamt als nicht einheitlich beurteilt wird. Für einige der Substanzen sind bessere Wirkungen in einigen Indikationen nachgewiesen worden, auch zeigen sich über die cholesterin- und lipidsenkende Wirkung hinausgehende Effekte, deren Relevanz jedoch noch nicht endgültig bewertet werden kann. Endpunktstudien zeigten jedoch keine eindeutige Überlegenheit einer der Substanzen, die Effekte hängen von mehreren Faktoren ab (Aktories et al. 2009, S. 608 ff., Zylka-Menhorn 2004, Rudolph 2004, Gysling 2002). Nebenwirkungen, Kinetik und Einnahmekomfort Beim Einnahmekomfort ergeben sich keine relevanten Unterschiede, die meisten Substanzen werden einmal täglich eingenommen. Die auftretenden Nebenwirkungen gelten in der Mehrheit als Klasseneffekte und es zeigen sich kaum Unterschiede (Gysling 2002). In der Kinetik unterscheiden sich die Substanzen hingegen deutlich: In der Bioverfügbarkeit und Elimination bestehen Unterschiede, bei einigen Substanzen ist die Metabolisierung auf 58 IGES eines oder wenige Enzyme beschränkt, bei anderen findet diese kaum oder sehr umfassend über viele verschiedene statt. Daraus ergibt sich ein für die Wirkstoffe deutlich unterschiedliches Wechselwirkungspotential, die in bestimmten Konstellationen auch erhebliche klinische Relevanz haben. Einige Statine können zudem einzelne Enzyme, die für den Abbau anderer Arzneistoffe verantwortlich sind, hemmen und dadurch deren Wirkung bzw. Toxizität beeinflussen. Allerdings sind die Statine generell nebenwirkungsarm und können als gut verträglich bezeichnet werden (Aktories et al.2009, S. 608 ff.). Öffentlichkeitswirksamkeit und Präferenzen Bei den Statinen handelt es sich um eine breit angewendete Arzneimittelgruppe für die nur vereinzelt bei verschiedenen Patienten Präferenzen bestehen. Zu berücksichtigen ist auch, dass die Indikationen für die die Statine zugelassen sind, in der Regel keine Beschwerden verursachen und die Prävention von Folgeerkrankungen im Vordergrund steht. Bei Patienten, die ihr gewohntes Präparat nach einer Erstattungseinschränkung nicht mehr erhalten, besteht daher in der Regel keinen übermäßiger Leidensdruck. Aus den Erfahrungen mit dem Präparat Sortis® kann aber abgeleitet werden, dass eine Erstattungseinschränkung auch hier deutliche Reaktionen hervorrufen würde. Ob auch Ezetimib in die in einer Gruppe mit den Statinen zur Auswahl zur Verfügung stehen sollte, kann derzeit noch nicht beurteilt werden, da die erforderlichen Studien (bspw. Endpunktstudien) noch nicht vorliegen. Fazit Teilweise eingeschränkte Anwendungsgebiete. Medizinisch bewertet ist ein Substitutionspotential in der Gruppe der Statine größtenteils vorhanden. Breite Anwendung, negative Reaktionen sind zu erwarten. Ein Risikoselektionspotential ist vorhanden und als wahrscheinlich effektiv zu bewerten. IGES 59 9 Systemische Antibiotika (J01) 9.1 Übersicht über die Wirkstoffgruppe Tabelle 22: ATC Marktdaten zur Wirkstoffgruppe der systemischen Antibiotika Bezeichnung Anz. Herst DDD 2008 Marktanteil (in DDD) J01CA/CR Penicilline, erw. / Kombis 48 94.672.473 24,2% J01F Makrolide, Lincosamide 51 73.845.838 18,9% J01A Tetracycline 37 64.546.841 16,5% J01M Chinolone 52 39.131.103 10,0% J01DC Cephalosporine, 2. Gen 31 38.194.663 9,8% J01CE Penicilline, beta-Lactamase-sensitiv 24 30.424.478 7,8% J01DD Cephalosporine, 3. Gen 27 10.887.072 2,8% J01X Andere 24 10.140.587 2,6% J01CF Penicilline, andere 11 380.031 0,1% J01EE Co-Trim 22 19.600.049 5,0% J01DB Cephalosporine, 1. Gen 11 3.278.130 0,8% J01EA Trimethoprim 1 1.378.116 0,4% J01G Aminoglykoside 21 958.680 0,2% J01EC Sulfadiazin 1 280.733 0,1% J01DE/DI Cephalosporine, andere 2 731 0,0% Sonstige 3.180.474 0,8% Gesamt 390.900.000 100,0% Quelle: Berechnung IGES nach NVI (INSIGHT Health) Die Arzneimittelgruppe der systemischen Antibiotika ist sehr umfangreich mit erheblichen Unterschieden bezüglich des Wirkprinzips und damit der jeweils empfindlichen Keime und Indikationen. Die Gruppe als ganze ist daher zu heterogen, um eine differenzierte Analyse durchführen zu können (Abbildung 20). Insbesondere die Zulassungssituation ist schwierig zu beurteilen, da strenggenommen eine Vergleichbarkeit der Substanzen nur bei voller Übereinstimmung der empfindlichen Keime gegeben ist und sich nicht allein an Indikationen (wie z.B. "Infektionen der Atemwege") orientieren kann. Auf eine derartig detaillierte Beurteilung wurde verzichtet, 60 IGES denn sie sollte von einem Expertengremium durchgeführt werden. Daher wurde das Zulassungskriterium weniger stark gewichtet als in anderen Gruppen. Weiterhin ist zu berücksichtigen, dass für alle Gruppen eine lokal unterschiedliche Resistenzsituation vorliegen kann, die durch eine Beschränkung auf ausgewählte Wirkstoffe verstärkt werden kann. Einschränkungen in einzelnen Wirkstoffgruppen können unter Umständen zu Schwierigkeiten bei einigen Patientengruppen führen, jedoch ist für die meisten Indikationen möglich, auf Substanzen aus anderen Wirkstoffgruppen auszuweichen. Öffentliche Reaktionen sind als gering einzustufen, da Antibiotika meist nur für einen kurzen Zeitraum bei akuten Erkrankungen eingesetzt werden. Allerdings ist hieraus auch kaum eine Lenkungswirkung zu erwarten, die Anzahl der dauerhaft behandelten Patienten ist vergleichsweise gering. Aufgrund der im Vergleich bedeutenderen Marktanteile der oberen 9 in der Tabelle 22 dargestellten Gruppen wird die differenzierte Analyse auf diese Substanzgruppen beschränkt. Für die Gruppe "Co-Trim" erübrigt sich eine weitere Analyse, da es sich hierbei ausschließlich um die fixe Kombination aus Sulfamethoxazol und Trimethoprim handelt. Abbildung 20: Bewertungskriterien für die Wirkstoffe der systemischen Antibiotika Systemische Antibiotika (J01) Kriterium Zulassungsbestimmungen Evidenzlage Einnahmekomfort Nebenwirkungen, Kinetik Öffentlichkeitswirksamkeit Präferenzen von Ärzten und Patienten Quelle: IGES IGES 9.2 61 Tetracycline (J01A) Tabelle 23: Marktpreise zur Wirkstoffgruppe der Tetracycline ATC Wirkstoff J01AA02 Doxycyclin J01AA07 Tetracyclin J01AA08 Minocyclin J01AA12 Tigecyclin Quelle: Anz. Gene Originalpräparat Herst. rika 29 Vibramycin 4 Tefilin 17 Klinomycin PreisspanMittelw. € ne €/DDD x 0,30-8,28 0,62 x 1,10-2,40 1,29 x 0,74-3,40 1,20 129,25 129,25 1 Tygacil Berechnung IGES nach NVI (INSIGHT Health) Die Tetracycline stellt eine kleinere Gruppe von Wirkstoffen dar. Das generisch verfügbare Doxycyclin dominiert den Markt. Oxytetracyclin als Monopräparat ist nur in topischen Zubereitungen im Handel und wird hier nicht berücksichtigt. Die Preise innerhalb der von 37 Herstellern angebotenen Tetracycline liegen zwischen 0,30-129,25 €/DDD bei einem Mittelwert von 0,68 € (Berechnung IGES nach NVI (INSIGHT Health)). Abbildung 21: Bewertungskriterien für die Wirkstoffgruppe der Tetracycline Kriterium Tetracycline (J01AA) Zulassungsbestimmungen Evidenzlage Einnahmekomfort Nebenwirkungen, Kinetik Öffentlichkeitswirksamkeit Präferenzen von Ärzten und Patienten Quelle: IGES 62 IGES Zulassungsbestimmungen und Evidenzlage Bei den Indikationen für welche die einzelnen Tetracycline zugelassenen sind, zeigen sich große Überschneidungsbereiche. Alle verfügbaren älteren Tetracycline wirken nahezu identisch gegen die gleichen Erreger mit geringen Unterschieden in der Wirkintensität. Bei den meisten Keimen kann zudem eine Parallelresistenz angenommen werden, einige Bakterienarten zeigen hohe Resistenzraten gegen diese Wirkstoffe (arznei-telegramm 2006, Aktories et al. 2009, S. 830ff.). Hinsichtlich des antimikrobiellen Wirkspektrums und der Wechselwirkungen bestehen deutliche Unterschiede zur Reservesubstanz Tigecyclin, die erst seit kurzer Zeit verfügbar ist und gegen ein breites Spektrum an Erregern wirkt. Daher sollte diese Susbtanz nicht von der Erstattung ausgeschlossen werden. Nebenwirkungen, Kinetik und Einnahmekomfort Innerhalb der Gruppe wurden pharmakokinetische Eigenschaften und die Verträglichkeit gegenüber der Ursubstanz Tetracyclin verbessert, die im Gegensatz zu den anderen viermal täglich eingenommen werden muss. Doxycyclin wird kaum metabolisiert, gravierende Unterschiede in den Interaktionspotentialen der Wirkstoffe zeigen sich insgesamt jedoch nicht. Doxycyclin kann ohne Berücksichtigung der Nierenfunktion verordnet werden. In der Zusammenschau der Eigenschaften gilt Doxycyclin als die Substanz mit den günstigsten und verträglichsten Eigenschaften (Aktories et al. 2009, S. 830 ff.). Öffentlichkeitswirksamkeit und Präferenzen Da die Tetrazykline, ebenso wie andere Antibiotika, meist nur für eine kurzzeitig begrenzte Dauer im akuten Erkrankungsfall eingenommen werden, ergibt sich hieraus nur ein geringes Risikoselektionspotential. Fazit Kaum Unterschiede in den Zulassungen. Medizinisch bewertet ist ein Substitutionspotential vorhanden. Endgültige Bewertung durch Expertengremium. Wenige Substanzen, breite Anwendung für meist nur kurze Dauer bei akuten Erkrankungen. Geringes Risikoselektionspotential IGES 9.3 63 Betalactam-Antibiotika, Penicilline (J01C) Tabelle 24: ATC Marktpreise zur Wirkstoffgruppe der Penicilline Wirkstoff Anz. OriginalHerst. präparat Gene Preisspanne rika €/DDD Mittelw. € J01CA01 Ampicillin 3 x 2,10-8,49 2,45 J01CA04 Amoxicillin 32 x 0,55-10,09 1,01 33,42-57,38 36,15 J01CA10 Mezlocillin 1 Baypen J01CA12 Piperacillin 7 Tazobac x 1,17-121,26 70,91 J01CE01 Benzylpenicillin 3 x 3,23-13,03 4,17 x 0,60-5,54 1,62 2,74-3,31 2,99 40,31-92,10 56,75 2,96-4,59 3,85 J01CE02 Phenoxymethyl penicillin J01CE03 Propicillin J01CE08 Benzylpenicillin -Benzathin 22 Arcasin 1 Baycillin 2 Tardocillin x Phenoxymethyl J01CE10 penicillinBenzathin 1 J01CF05 Flucloxacillin 3 Staphylex x 5,19-21,14 8,84 Ampicillin und J01CR01 EnzymInhibitoren 6 x 9,48-37,12 14,32 x 3,23-72,05 7,12 6,72-11,38 9,87 102,90-116,97 111,21 4,59-5,68 5,28 Amoxicillin und J01CR02 EnzymInhibitoren Infecto Bicillin 22 Abiclav J01CR04 Sultamicillin 1 Unacid PD Piperacillin und J01CR05 EnzymInhibitoren 4 J01CR50 Quelle: Kombinationen von Penicillinen 1 Flanamox x Berechnung IGES nach NVI (INSIGHT Health) Die Gruppe der Penicilline besteht aus den Penicillinen mit erweitertem Wirkungsspektrum (J01CA), den Beta-Lactamase-sensitiven Penicillinen (J01CE), den Beta-Lactamase-festen Penicillinen (J01CF) sowie Kombinationen von Penicillinen, incl. Kombinationen mit Beta-LactamaseInhibitoren (J01CR). Da Flucloxacillin sich im Wirkspektrum gegenüber den anderen Penicillinen deutlich unterscheidet – es ist als einziges gegen Staphylokokken wirksam – und somit eine Alleinstellung besitzt, wird auf eine Bewertung im Rahmen dieser Analyse verzichtet. Alle Wirkstoffe sind 64 IGES mittlerweile patentfrei, generisch verfügbar sind allerdings nur einige der Wirkstoffe, die auch wirtschaftliche Bedeutung haben (Tabelle 24). Die Marktanteile der ambulant verordneten Penicilline unterscheiden sich deutlich, Amoxicillin ist hier die am häufigsten angewendete Substanz. Die Substanzen der jeweiligen Untergruppen sind bei den meisten Indikationen alternativ einsetzbar (Aktories et al. 2009, S. 801 ff., arznei-telegramm 2007). Die Preisspanne innerhalb der Gruppe der von 24 Herstellern angebotenen Betalactamase-sensitiven Penicilline liegt zwischen 0,6092,10 €/DDD bei einem Mittelwert von 1,82 € und bei den von 48 Herstellern angebotenen Penicillinen mit erweitertem Wirkungsspektrum und Kombinationen zwischen 0,55-121,26 €/DDD bei einem Mittelwert von 1,52 € (Berechnung IGES nach NVI (INSIGHT Health)). Auch in der Wirkstoffgruppe der Penicilline sind die hohen Preisspannen bei den meisten Wirkstoffen parenteralen Zubereitungsformen zuzurechnen. Insbesondere die Wirkstoffe Mezlocillin, Benzylpenicillin-Benzathin und Piperacillin / Tazobactam sind nur parenteral anwendbar, was sich in deren hohen Preisen pro DDD niederschlägt. Abbildung 22: Bewertungskriterien für die Wirkstoffgruppe der Penicilline (ohne BetaLactamase-feste Penicillinen) Penicilline mit erw. Wirkung u. Kombin. (J01CA, J01CR) Kriterium Zulassungsbestimmungen Evidenzlage Einnahmekomfort Nebenwirkungen, Kinetik Öffentlichkeitswirksamkeit Präferenzen von Ärzten und Patienten Quelle: IGES Penicilline, β-Lactamase-sensitiv (J01CE) IGES 65 Zulassungsbestimmungen und Evidenzlage Die Zulassung der einzelnen Penicilline ist innerhalb der definierten Untergruppen als einheitlicher zu beurteilen als bei den anderen AntibiotikaGruppen, zwischen den Untergruppen bestehen jedoch auch hier deutliche Unterschiede in der Erregerempfindlichkeit, so dass sich für die meisten der Wirkstoffe und Zubereitungsformen unterschiedliche Einsatzgebiete ergeben, die zum Teil sehr speziell sein können. Zu beachten sind dabei auch die unterschiedliche Verfügbarkeit von oralen bzw. parenteralen Zubereitungen und Depotformen. Nebenwirkungen, Kinetik und Einnahmekomfort Die Kinetik ist bei äquivalenten Applikationsformen vergleichbar, entsprechend ist auch die Einnahmehäufigkeit von der Zubereitung abhängig und bei gleicher Applikation vergleichbar. Die Penicilline sind im Allgemeinen gut verträglich und haben eine große therapeutische Breite, bei Neben- und Wechselwirkungen ergibt sich somit ein homogenes Bild, die Häufigkeit der auftretenden unerwünschten Wirkungen unterscheidet sich meist nur unwesentlich. Bei einigen Substanzen treten vereinzelt charakteristische Nebenwirkungen auf (Aktories et al. 2009, S. 801 ff.). Öffentlichkeitswirksamkeit und Präferenzen Da die Penicilline, ebenso wie andere Antibiotika, meist nur für eine kurzzeitig begrenzte Dauer im akuten Krankheitsfall eingenommen werden, ergibt sich hieraus kein Risikoselektionspotential, zudem ist nicht mit negativen Reaktionen zu rechnen. Fazit Nur teilweise eingeschränkte Anwendungsgebiete, zum Teil unterschiedliche Anwendungsformen, die nicht substituierbar sind. Medizinisch bewertet ist ein Substitutionspotential innerhalb der definierten Gruppen von Penicillinen vorhanden. Endgültige Bewertung durch Expertengremium. Breite Anwendung für meist nur kurze Dauer bei akuten Erkrankungen. Negative Reaktionen nicht zu erwarten, kein Risikoselektionspotential vorhanden. 66 9.4 IGES Betalactam-Antibiotika, Cephalosporine (J01D) Tabelle 25: Marktpreise zur Wirkstoffgruppe der Cephalosporine Herst. Originalpräparat Gene Preisspanne rika €/DDD Mittelw. € ATC Wirkstoff J01DC02 Cefuroxim 26 Elobact x 0,60-60,80 1,93 J01DC04 Cefaclor 17 x 0,38-5,64 2,40 J01DD01 Cefotaxim 10 Claforan x 35,55-81,67 47,08 J01DD02 Ceftazidim 7 Fortum x 58,28-111,48 85,51 J01DD04 Ceftriaxon 11 Rocephin x 19,09-68,00 34,13 J01DD08 Cefixim 13 Suprax x 2,26-8,34 4,03 J01DD13 Cefpodoxim 12 Orelox x 2,75-14,08 4,87 J01DD14 Ceftibuten 2,91-8,16 4,59 2 Keimax *keine Marktdaten aus 2008 vorhanden Quelle: Berechnung IGES nach NVI (INSIGHT Health) Die Gruppe der Cephalosporine stellt eine große Gruppe von Wirkstoffen dar und wird üblicherweise in die Cephalosporine der 1.-4. Generation eingeteilt, die allerdings nicht immer einheitlich definiert ist. Hier werden nur die Gruppen betrachtet, die heute eine wichtige Rolle spielen, nämlich Substanzen der 2. und 3. Generation. Die generisch verfügbaren Wirkstoffe dominieren den Markt deutlich (Tabelle 25). Weitere Einteilungen werden oft nach Applikationsform oder nach Erregerspezifität vorgenommen, dadurch resultieren im Endeffekt Gruppen mit 1-3 Wirkstoffen. Cefuroxim ist der am häufigsten verordnete Wirkstoff. Die Preisspanne innerhalb der Gruppe der von 31 Herstellern angebotenen Cephalosporine der 2. Generation liegt zwischen 0,38-60,80 €/DDD bei einem Mittelwert von 2,12 €, die der 3. Generation von 27 Herstellern zwischen 2,26-111,48 €/DDD bei einem Mittelwert von 5,16 € (Berechnungen IGES nach NVI (INSIGHT Health)). Auch bei den Cephalosporeinen der 3. Generation (J01DD) gibt es parenterale Zubereitungsformen für einige Wirkstoffe, die zu hohen Preisspannen führen und den Mittelwert der Gruppe insgesamt nach oben ziehen. IGES 67 Abbildung 23: Bewertungskriterien für die Wirkstoffgruppe der Cephalosporine Cephalosporine der 2. Generation (J01DC) Kriterium Cephalosporine der 3. Generation (J01DD) Zulassungsbestimmungen Evidenzlage Einnahmekomfort Nebenwirkungen, Kinetik Öffentlichkeitswirksamkeit Präferenzen von Ärzten und Patienten Quelle: IGES Zulassungsbestimmungen und Evidenzlage Die Zulassungen sind für die einzelnen Substanzen nicht einheitlich, wobei es dennoch einige Überschneidungsbereiche gibt. Hauptsächlich zu berücksichtigen ist aber die Empfindlichkeit der Erreger. Hier sind ebenfalls einige Überschneidungsbereiche erkennbar, jedoch sprechen spezielle Erreger zum Teil nur auf wenige Wirkstoffe an. Aufgrund der großen Auswahl an Wirkstoffen ist eine Einschränkung auf einen Teil der Substanzen möglich, soweit die Bandbreite der Erreger mit den gewählten Wirkstoffen abgedeckt werden kann und unterschiedliche Zubereitungsformen berücksichtigt werden. Die entsprechenden Einteilungen nach Applikationsform und Erregerspezifität können hierzu herangezogen werden, allerdings ergeben sich dann relativ kleine Gruppen mit 1-3 Wirkstoffen (z.B. in Aktories et al. 2009, S.807ff.). Auch die Verfügbarkeit von Reservemitteln sollte gewährleistet bleiben. Eine detailliertere Untersuchung durch ein Expertengremium ist hier in jedem Fall erforderlich. Nebenwirkungen, Kinetik und Einnahmekomfort Bezüglich der Einnahme unterscheiden sich die Wirkstoffe kaum, eine mehrmals tägliche Einnahme ist meist erforderlich. Entsprechend ist auch die Kinetik hauptsächlich von der Einnahmeform abhängig, aber bei gleicher Applikation meist vergleichbar. Die Nebenwirkungsraten der Cephalo- 68 IGES sporine sind meist gering und betreffen in vergleichbarem Ausmaß hauptsächlich den Gastrointestinaltrakt und Hautreaktionen. Öffentlichkeitswirksamkeit und Präferenzen Die Cephalosporine werden, ebenso wie andere Antibiotika, meist nur für eine kurze Dauer im akuten Krankheitsfall eingenommen. Aufgrund der zahlreichen Wirkstoffe in dieser Gruppe ist mit negativen Reaktionen bei Erstattungseinschränkungen kaum zu rechnen. Ein Risikoselektionspotential ist daher kaum vorhanden. Fazit Teilweise unterschiedliche Anwendungsgebiete. Medizinisch bewertet ist größtenteils ein Substitutionspotential innerhalb der Cephalosporin-Subgruppen vorhanden. Endgültige Bewertung durch Expertengremium. Breite Anwendung für meist nur kurze Dauer bei akuten Erkrankungen. Zahlreiche Wirkstoffe, daher sind negative Reaktionen kaum zu erwarten, Risikoselektionspotential kaum vorhanden 9.5 Sulfonamide (J01E) und Andere Antibiotika (J01X) Tabelle 26: ATC Marktpreise zu den Wirkstoffgruppen der Sulfonamide und Anderen Antibiotika Wirkstoff Anz. OriginalHerst präparat Gen Preisspanne erika €/DDD Mittelw. € J01EA01 Trimethoprim 1 Infectotrimet 1,21-5,24 2,68 J01EC02 Sulfadiazin 1 Urospasmon 0,55-0,86 0,59 J01EE01 Sulfamethoxazol u. Trimethoprim 22 x 0,61-11,63 x 58,64-167,21 64,95 99,55-127,90 104,71 1,69 J01XA01 Vancomycin 8 Vanco J01XA02 Teicoplanin 2 Targocid J01XB01 Colistin 3 Colistin x 4,90-298,99 59,69 J01XD01 Metronidazol 8 Clont x 7,15-60,56 25,11 J01XE01 Nitrofurantoin 4 Uro-Tablinen x 0,60-2,96 0,81 J01XX01 Fosfomycin 2 Monuril 17,43-71,60 18,03 J01XX07 Nitroxolin 2 Nilox 3,31-19,77 4,01 J01XX08 Linezolid 2 Zyvoxid 179,93-188,77 181,95 J01XX09 Daptomycin 1 Cubicin 104,35-109,70 108,12 Quelle: Berechnung IGES nach NVI (INSIGHT Health) IGES 69 Aufgrund der wenigen noch im Handel befindlichen Wirkstoffe und Präparate der Sulfonamide (J01E) - tatsächlich relevant ist nur die Kombination aus Sulfamethoxazol und Trimethoprim (Cotrimoxazol) - erübrigt sich eine Bewertung in dieser Gruppe (Tabelle 26). Aufgrund der großen Heterogenität der Substanzen und Wirkweisen in dem Sammelbecken der "Anderen Antibiotika" (J01X) erscheint eine Auswahl bzw. Beschränkung nicht sinnvoll. Es finden sich hier sowohl bewährte als auch innovative, in der Regel aber kaum verzichtbare Wirkstoffe, die ein spezifisches Wirkspektrum aufweisen bzw. ihre Nische berechtigt ausfüllen. Somit wird auf eine Analyse des Substitutionspotentials auch in dieser Gruppe verzichtet (Tabelle 26). Die Wirkstoffe dieser Gruppe erfahren eine breite Anwendung für allerdings meist nur kurze Dauer bei akuten Erkrankungen. Negative Reaktionen sind bei Einschränkungen jedoch zu erwarten. Ein Risikoselektionspotenzial ist daher prinzipiell vorhanden, das aber kaum nutzbar sein dürfte. Die Preisspanne innerhalb der Gruppe der von 24 Herstellern angebotenen Anderen Antibiotika liegt zwischen 0,60-298,99 €/DDD bei einem Mittelwert von 4,08 € (Berechnung IGES nach NVI (INSIGHT Health)). Die große Anzahl an Wirkstoffen, die zum Teil als lang etablierte Wirkstoffe relativ günstige Preise pro DDD haben und anderenteils sehr spezielle Reserveantibiotika, die nur eine geringe Marktrelevanz (insbesondere in der ambulanten Versorgung) haben und in speziellen Darreichungsformen sehr hohe Preise je DDD haben, führen zu den enormen Preisunterschieden in dieser Wirkstoffgruppe. 70 9.6 IGES Makrolide, Ketolide und Lincosamide (J01F) Tabelle 27: Marktpreise zu den Wirkstoffgruppen der Makrolide, Ketolide und Lincosamide Anz. Herst Originalpräparat ATC Wirkstoff J01FA01 Erythromycin J01FA02 Spiramycin J01FA06 Roxithromycin 32 Rulid J01FA09 Clarithromycin J01FA10 Azithromycin J01FA15 Telithromycin 1 Ketek J01FF01 Clindamycin 27 Sobelin Quelle: 17 Gene rika x Preisspanne €/DDD Mittelw. € 0,86-89,23 2,36 16,18-43,63 31,88 x 1,30-3,86 2,05 20 Klacid x 0,31-58,62 1,69 21 Zithromax x 0,59-10,00 3,04 7,39-8,45 7,98 1,93-134,43 3,10 2 Selectomycin x Berechnung IGES nach NVI (INSIGHT Health) Die erweiterte Gruppe der Makrolidantibiotika besteht hauptsächlich aus den Makroliden im eigentlichen Sinn (J01FA), sowie Substanzen mit verwandten Strukturen, dem Ketolid Telithromycin und dem Lincosamid Clindamycin. Die generisch verfügbaren Wirkstoffe dominieren den Markt (Tabelle 27), ihre Anteile sind annähernd miteinander vergleichbar. Makrolide gelten als Alternative zu den Penicillin-Antibiotika, so dass bei einer eventuellen Unverträglichkeit der einen meist auf die andere Wirkstoffgruppe gewechselt werden kann (Aktories et al. 2009, S. 824 ff., arzneitelegramm 2007). Die Preisspanne innerhalb der gesamten Gruppe der von 51 Herstellern angebotenen Makrolidantibiotika liegt zwischen 0,31134,43 €/DDD bei einem Mittelwert von 2,43 € (Berechnung IGES nach NVI (INSIGHT Health)). Auch hier sind die hohen Preisspannen bei den meisten Wirkstoffen parenteralen Zubereitungsformen zuzurechnen, die für die Wirkstoffe Roxithromycin, Azithromycin und Telithromycin nicht verfügbar sind, was sich in deren niedrigerer Preisspanne niederschlägt. IGES 71 Abbildung 24: Bewertungskriterien für die Wirkstoffgruppen der Makrolide, Ketolide und Lincosamide Makrolide, Ketolide, Lincosamide (J01F) Kriterium Zulassungsbestimmungen Evidenzlage Einnahmekomfort Nebenwirkungen, Kinetik Öffentlichkeitswirksamkeit Präferenzen von Ärzten und Patienten Quelle: IGES Zulassungsbestimmungen und Evidenzlage Die Makrolide sind insgesamt für viele Indikationen zugelassen, das breiteste Spektrum deckt dabei die älteste Substanz Erythromycin ab, Spiramycin und Telithromycin sind nur für wenige Anwendungsgebiete einsetzbar und gelten als Reserveantibiotika. Insgesamt ist die Zulassungssituation sehr heterogen, verschiedene Keime sprechen nur auf bestimmte Makrolide an bzw. werden von ihnen unterschiedlich stark gehemmt (Lode et al. 2006). Unter Berücksichtigung der Zulassungssituation können die häufigsten Infekte mit den zur Verfügung stehenden Makroliden ähnlich gut therapiert werden. Das Ketolid Telithromycin ist aufgrund eines erweiterten Wirkmechanismus auch gegen einige zusätzliche Keime wirksam. Das Wirkspektrum des Lincosamids Clindamycin ist ähnlich dem des Erythromycins und wird insbesondere gegen Staphylokokken eingesetzt, gegen die es wirksamer ist als die übrigen Makrolide (Aktories et al. 2009, S. 824 ff., arznei-telegramm 2007). Nebenwirkungen, Kinetik und Einnahmekomfort Die größten Unterschiede zwischen den Substanzen sind die Einnahmeschemata, wobei Erythromycin drei- bis viermal täglich für 7-10 Tage, 72 IGES Azithromycin hingegen nur einmal täglich für meist 3 Tage einzunehmen ist. Auch bei der Verträglichkeit zeigen sich große Unterschiede zwischen den Substanzen, insbesondere die schlechte Magen-Darm-Verträglichkeit des Erythromycin fällt hierbei auf (arznei-telegramm 2007). Unterschiede bei Interaktionen ergeben sich vor allem aus der unterschiedlichen Metabolisierung, die meisten Makrolide werden über das Enzymsystem CYP3A4 verstoffwechselt und können dieses und andere Enzyme in unterschiedlicher Intensität hemmen, wodurch ein hohes Interaktionspotential mit vielen Arzneistoffe resultiert. Die Substanzen unterscheiden sich hierbei deutlich: Clarithromycin und Erythromycin besitzen ein ähnlich hohes Interaktionspotential, wohingegen dieses bei Azithromycin kaum vorhanden ist (Aktories et al. 2009, S. 824 ff., Lode et al. 2006). Telithromycin besitzt eine veränderte Kinetik, was eine einmal tägliche Gabe ermöglicht. Clindamycin sollte üblicherweise viermal täglich über mehrere Wochen angewendet werden. Öffentlichkeitswirksamkeit und Präferenzen Mit starken öffentlichen Reaktionen ist bei einer Versorgungseinschränkung kaum zu rechnen, da die Anwendung für meist nur kurze Dauer im akuten Krankheitsfall erfolgt. Einzelne Präferenzen bei Ärzten sind als unkritisch einzustufen. Fazit Zahlreiche Unterschiede bei den Zulassungen. Medizinisch bewertet ist ein eingeschränktes Substitutionspotential vorhanden. Endgültige Bewertung durch Expertengremium. Anwendung bei akuten Erkrankungen. Negative Reaktionen sind kaum zu erwarten, kein Risikoselektionspotential vorhanden. IGES 9.7 73 Chinolone (J01M) Tabelle 28: Marktpreise zur Wirkstoffgruppe der Chinolone Anz. OriginalHerst. präparat Gene rika Preisspanne €/DDD Mittelw. € ATC Wirkstoff J01MA01 Ofloxacin 17 Tarivid x 1,74-81,60 3,91 J01MA02 Ciprofloxacin 43 Ciprobay x 2,07-104,11 4,00 J01MA04 Enoxacin 3,82-5,77 5,02 J01MA06 Norfloxacin 19 Barazan 1,29-4,28 2,69 J01MA12 Levofloxacin 1 Tavanic 0,78-71,27 3,70 J01MA14 Moxifloxacin 4 Avalox 0,50-59,84 5,44 J01MB04 Pipemidsäure 1 Deblaston 4,08-5,54 4,82 Quelle: 1 Enoxor x Berechnung IGES nach NVI (INSIGHT Health) Die Gruppe der Chinolone besteht hauptsächlich aus den Fluorchinolonen (J01MA). Die generisch verfügbaren Wirkstoffe dominieren den Markt (Tabelle 28). Die ältere Substanz Pipemidsäure wird heute nur noch selten angewendet, der am häufigsten verordnete Wirkstoff ist Ciprofloxacin. Die Preisspanne innerhalb der gesamten Gruppe der von 52 Herstellern angebotenen Chinolone liegt zwischen 0,50-104,11 €/DDD bei einem Mittelwert von 4,09 € (Berechnung IGES nach NVI (INSIGHT Health)). Die hohen Werte der Preisspannen für die Wirkstoffe Ofloxacin, Levofloxacin, Moxifloxacin und Ciprofloxacin sind parenteralen Zubereitungsformen mit einem vergleichsweise hohen Preis pro DDD zuzurechnen. Abbildung 25: Bewertungskriterien für die Wirkstoffgruppe der Chinolone Kriterium Zulassungsbestimmungen Evidenzlage Einnahmekomfort Nebenwirkungen, Kinetik Chinolone (J01M) 74 IGES Kriterium Chinolone (J01M) Öffentlichkeitswirksamkeit Präferenzen von Ärzten und Patienten Quelle: IGES Zulassungsbestimmungen und Evidenzlage Die Zulassungssituation ist aufgrund der Vielzahl an Indikationen nicht einheitlich. Im Wirkspektrum ist eine deutliche Heterogenität wahrnehmbar, was zu einer Gruppenbildung innerhalb der Chinolone geführt hat. Diese Gruppierung führt dazu, dass sich die Chinolone auf einige wenige Substanzen einschränken ließen, mit denen alle entsprechenden Indikationen abgedeckt werden können: Ciprofloxacin, Levofloxacin und Moxifloxacin (Burgmann 2007, Lode et al. 2006). Eine Beschränkung auf diese Substanzen als Grundversorgung wäre demnach möglich. Nebenwirkungen, Kinetik und Einnahmekomfort Die Einnahmehäufigkeit der Präparate ist zwar unterschiedlich, jedoch sind diese Unterschiede aufgrund der in der Regel nur kurzzeitigen Einnahme als weniger gravierend zu betrachten. In der Kinetik und Metabolisierung unterscheiden sich die Wirkstoffe zum Teil, wodurch bei Patienten mit eingeschränkter Nierenfunktion Probleme entstehen können (Aktories et al. 2009, S. 838 ff.), zum anderen ergibt sich für die Substanzen jeweils auch ein unterschiedliches Nebenwirkungs- und Interaktionspotential (Lode et al. 2006), was den Therapieerfolg bei bestimmten Patienten beeinträchtigen kann. Öffentlichkeitswirksamkeit und Präferenzen In einer öffentlichen Diskussion wird sich die Einschränkung auf wenige Substanzen kaum niederschlagen, da die Antibiotika allgemein nur selten in Dauertherapie verordnet werden. Präferenzen dürfte es nur für bestimmte Patientengruppen geben, die aber als unkritisch zu betrachten sind. Fazit Teilweise eingeschränkte Anwendungsgebiete. Medizinisch bewertet ist ein Substitutionspotential innerhalb weiter zu bildender Untergruppen vorhanden. Unterschiede bestehen auch hinsichtlich Nebenwirkungen. Endgültige Bewertung durch Expertengremium. IGES 75 Breite Anwendung für meist nur kurze Dauer bei akuten Erkrankungen. Negative Reaktionen sind nicht zu erwarten, kein Risikoselektionspotential vorhanden. 9.8 Fazit "Systemische Antibiotika" Wie eingangs bereits erwähnt, stellen die systemischen Antibiotika eine sehr umfangreiche Gruppe mit hoher Strukturvariation und erheblichen Unterschieden bezüglich des Wirkprinzips und damit der jeweils empfindlichen Keime und Indikationen. Einschränkungen in einzelnen Wirkstoffgruppen können unter Umständen zu Schwierigkeiten bei bestimmten Patientengruppen führen, da aufgrund der unterschiedlichen Empfindlichkeit der Erreger bzw. resultierend aus einer aktuellen Resistenzsituation eine optimale Therapie bei weitgehender Einschränkung der Erstattung unter Umständen gefährdet ist. Für die meisten Indikationen ist es jedoch auch möglich auf Substanzen aus anderen Wirkstoffgruppen auszuweichen. Die endgültige Beurteilung für eine Auswahl der Wirkstoffe und Bestimmung eines Mindeststandards sollte von einem Expertengremium durchgeführt werden. Ein Erstattungsausschluss von sogenannten Reserveantibiotika sollte in jedem Fall vermieden werden, da dies ethisch kaum vertretbar wäre und hieraus auch deutliche negative Reaktionen der Öffentlichkeit resultieren würden. Die öffentlichen Reaktionen sind ansonsten als eher gering einzustufen, da Antibiotika allgemein nur für einen vorübergehenden Zeitraum eingesetzt werden. Allerdings ist hiervon auch kaum eine Lenkungswirkung zu erwarten, da die Anzahl der dauerhaft behandelten Patienten im Vergleich äußerst gering ist. Sollte eine nicht erstattete Therapie erforderlich sein, ist die finanzielle Belastung einer kurzzeitigen Therapie in der Regel für die Patienten zu verkraften oder es kann im Rahmen einer konzeptuell eventuell vorgesehenen Ausnahme- oder Härtefallregelung die erhoffte Lenkungswirkung umgangen werden. 76 IGES 10 Systemische Antivirale Mittel (J05) 10.1 Übersicht über die Wirkstoffgruppe Tabelle 29: Übersicht über die Wirkstoffgruppe der Systemischen Antiviralen Mittel ATC Bezeichnung J05AA Thiosemicarbazone J05AB Nukleoside und Nukleotide, exkl. Inhibitoren der Reversen Transkriptase J05AC Cyclische Amine J05AD Phsophonsäurederivate J05AE Proteasehemmer J05AF Nukleosidale, nukleotidale Inhibitoren der Reversen Transkriptase J05AG Nichtnukleosidale Inhibitoren der Reverse Transkriptase J05AH Neuraminidasehemmer J05AR Antivirale Mittel zur Behandlung von HIV Infektionen, Kombinationen J05AX Andere antivirale Mittel Quelle: Zusammenstellung IGES nach DIMDI 2009 Die Wirkstoffgruppe der Systemischen Antiviralen Mittel ist eine sehr umfangreiche Gruppe. Die bedeutendsten Untergruppen beinhalten Wirkstoffe, die vornehmlich im Bereich der Spezialversorgung für die Behandlung der HIV-Erkrankung, sowie einiger anderer Viruserkrankungen (z.B. Virushepatitis B und C, Infektionen durch Herpes- und Zytomegalieviren) eingesetzt werden (In der Tabelle 29 kursiv dargestellt, sowie Teile der Gruppe J05AX). Im Jahr 2008 wurden 32.114.455 DDD aus der gesamten Wirkstoffgruppe der Antiviralen Mittel verordnet. Davon entfielen 25.568.387 DDD (79,6 %) auf die Wirkstoffe gegen HIV (Berechnung IGES nach NVI (INSIGHT Health)). Eine Analyse des Substitutionspotentials bei diesen Wirkstoffen wird als nicht sinnvoll erachtet, da auf einzelne Wirkstoffe aus diesem Bereich nur schwer verzichtet werden kann (Abbildung 26). Zudem ist für eine erfolgreiche Therapie eine Kombinationstherapie aus mindestens drei Wirkstoffen erforderlich, wobei nur bestimmte Kombinationen sinnvoll sind. Schließlich ist im individuellen Fall die Beachtung der jewei- IGES 77 ligen Resistenzsituation erforderlich, auf die ggf. die Auswahl der Wirkstoffkombination abzustimmen ist. Mit einer starken Lenkungswirkung, die auch spürbare finanzielle Effekte für die jeweilige Krankenkasse ergäbe, könnte zwar gerechnet werden, aus medizinischen und ethischen Gründen können jedoch kaum Einschnitte unternommen werden. Bei einer Einschränkung in diesem sensiblen Bereich wäre zudem mit starken negativen öffentlichen Reaktionen zu rechnen. Abbildung 26: Bewertungskriterien antiviralen Mittel für die Wirkstoffgruppe der systemischen Systemische antivirale Mittel (J05) Kriterium Zulassungsbestimmungen Evidenzlage Einnahmekomfort Nebenwirkungen, Kinetik Öffentlichkeitswirksamkeit Präferenzen von Ärzten und Patienten Quelle: IGES Fazit Große Heterogenität der Wirkstoffe bezüglich Zulassung und Wirksamkeit, medizinisch betrachtet besteht kein Substitutionspotential. Vergleichsweise kleiner Patientenkreis in der Spezialversorgung. Starke negative Reaktionen sind zu erwarten. Ein großes und vermutlich effektives Risikoselektionspotential ist prinzipiell vorhanden, das aber kaum nutzbar sein dürfte. 78 IGES 11 Antineoplastische Mittel (L01) 11.1 Übersicht über die Wirkstoffgruppe Tabelle 30: Übersicht über die Wirkstoffgruppe der Antineoplastischen Mittel ATC Bezeichnung L01A Alkylanzien L01B Antimetabolite L01C Pflanzliche Alkaloide und andere natürliche Mittel L01D Zytotoxische Antibiotika u. verwandte Substanzen L01XA Platinhaltige Verbindungen L01XB Methylhydrazine L01XC Monoklonale Antikörper L01XD Sensibilisatoren für die photodynamische/RadioTherapie L01XE Proteinkinase-Hemmer L01XX Andere antineoplastische Mittel L01XY Kombinationen von antineoplastischen Mitteln Quelle: Zusammenstellung IGES nach DIMDI 2009 Die Wirkstoffgruppe der antineoplastischen Mittel ist eine sehr umfangreiche Gruppe mit zahlreichen Untergruppen, die zusammen genommen zu unterschiedlich sind, um gemeinsam im Sinne dieser Analyse untersucht zu werden (Abbildung 27). Auch die Betrachtung der Subgruppen würde erhebliche Heterogenitäten zeigen, die zudem aufgrund der Komplexizität der Therapie mit Zytostatika nur von entsprechenden Experten beurteilt werden kann und beurteilt werden sollte. Die vom Marktanteil her bedeutendste Untergruppe ist die der Proteinkinaseinhibitoren (In der Tabelle 30 kursiv dargestellt)4. Im Jahr 2008 wurden 21.516.677 DDD aus der gesamten Wirkstoffgruppe der Anti- 4 Zu berücksichtigen ist, dass hier nur die ambulante Versorgung mit entsprechenden Fertigarzneimitteln betrachtet wird. In der stationären Versorgung und unter Berücksichtigung von ambulant verordneten Zytostatika-Rezepturen kann sich ein völlig anderes Bild ergeben. IGES 79 neoplastischen Mittel (incl. Komplementäre Therapie) verordnet. Davon entfielen 21,3 % auf die Proteinkinaseinhibitoren (Berechnung IGES nach NVI (INSIGHT Health)). Eine tiefgehende Analyse des Substitutionspotentials dieser Subgruppe wird jedoch aus den o.g. Gründen als nicht sinnvoll erachtet (s. Kap. 11.2). Für die übrigen antineoplastischen Mittel ist vermutlich die Freigabe von einzelnen Subgruppen zur Erstattungseinschränkung nicht oder nur in wenigen Fällen möglich. Ähnlich wie bei den Antiviralen Mitteln (J05, Kap. 10) kann zwar auch bei den antineoplastischen Mitteln mit einer starken Lenkungswirkung gerechnet werden, die auch spürbare finanzielle Effekte für die jeweilige Krankenkasse ergäbe, aus medizinischen und ethischen Gründen verbieten sich jedoch entsprechende Einschnitte. Bei einer Einschränkung in diesem sensiblen Bereich wäre zudem mit starken öffentlichen Reaktionen zu rechnen. Abbildung 27: Bewertungskriterien für die Wirkstoffgruppe der Antineoplastischen Mittel Antineoplastische Mittel (L01) Kriterium Zulassungsbestimmungen Evidenzlage Einnahmekomfort Nebenwirkungen, Kinetik Öffentlichkeitswirksamkeit Präferenzen von Ärzten und Patienten Quelle: IGES 80 11.2 IGES Proteinkinaseinhibitoren / Tyrosinkinasehemmer (L01XE) Tabelle 31: Übersicht über die Wirkstoffgruppe der Proteinkinaseinhibitoren / Tyrosinkinasehemmer Anz. Herst Originalpräparat ATC Wirkstoff L01XE01 Imatinib 2 Glivec L01XE02 Gefitinib 2 Iressa L01XE03 Erlotinib 2 Tarceva L01XE04 Sunitinib 2 Sutent L01XE05 Sorafenib 2 Nexavar L01XE06 Dasatinib 2 Sprycel L01XE07 Lapatinib 2 Tyverb L01XE08 Nilotinib 2 Tasigna L01XE09 Temsirolimus 2 Torisel Quelle: Berechnung IGES nach NVI (INSIGHT Health) Die Proteinkinaseinhibitoren sind hochspezifische Antikörper für die Behandlung spezieller Krebserkrankungen (Tabelle 31). Derzeit sind nur patentgeschützte Originalpräparate im Handel. Die mit 49,2% der DDD am häufigsten verordnete Substanz in dieser Gruppe ist Imatinib, sein Anteil ist jedoch in den letzten Jahren zugunsten neuer Substanzen deutlich gesunken (Häussler et al. 2009). Abbildung 28: Bewertungskriterien für die Wirkstoffgruppe der Proteinkinaseinhibitoren Kriterium Zulassungsbestimmungen Evidenzlage Einnahmekomfort Nebenwirkungen, Kinetik Proteinkinaseinhibitoren (L01XE) IGES 81 Öffentlichkeitswirksamkeit Präferenzen von Ärzten und Patienten Quelle: IGES Schon ein Blick auf die zugelassenen Indikationsgebiete der einzelnen Wirkstoffe zeigt, dass es sich bei den Proteinkinaseinhibitoren um Substanzen mit sehr unterschiedlichem Charakter handelt. Es sind hochspezifische Antikörper, die in die Signaltransduktion von Tumoren eingreifen und somit deren Wachstum unterbinden. Die Tyrosinkinasen und andere Angriffspunkte dieser Wirkstoffe sind bei verschiedenen Tumoren unterschiedlich aufgebaut, was eine spezifische Hemmung und ein spezielles Wirkstoffdesign erfordert. Somit finden sich in dieser Gruppe zwar prinzipiell ähnliche Wirkstoffe, die aber nicht miteinander vergleichbar sind, da sie gegen unterschiedliche Tumorerkrankungen wirksam sind. Auf einzelne Wirkstoffe aus diesem Bereich kann daher nicht verzichtet werden. Fazit Große Heterogenität der Wirkstoffe bezüglich Zulassung und Wirksamkeit, medizinisch betrachtet kein Substitutionspotential. Vergleichsweise kleiner Patientenkreis in der Spezialversorgung. Starke negative Reaktionen sind zu erwarten. Ein großes und vermutlich effektives Risikoselektionspotential ist prinzipiell vorhanden, das aber kaum nutzbar sein dürfte. 82 IGES 12 Immunsuppressiva (L04) 12.1 Übersicht über die Wirkstoffgruppe Tabelle 32: Marktdaten zur Wirkstoffgruppe der Immunsuppressiva Anz. Herst Bezeichnung L04AA Selektive Immunsuppressiva 8 20.658.312 24,5% L04AD Calcineurin-Hemmer 9 11.049.513 13,1% L04AB TNF-Hemmer 4 13.093.951 15,6% L04AX Andere 26 38.957.245 46,3% Sonstige 441.000 0,5% Gesamt 84.200.000 100,0% Quelle: DDD 2008 Marktanteil (in DDD) ATC Berechnung IGES nach NVI (INSIGHT Health) Die Wirkstoffgruppe der Immunsuppressiva besteht aus spezifischen und unspezifischen Wirkstoffen mit deutlich unterschiedlichen Einsatzgebieten, so dass sich bei der Gesamtbetrachtung ein sehr heterogener Eindruck ohne Substitutionspotential ergibt (Abbildung 29). Die Gruppe der "Anderen Immunsuppressiva" ist zwar die verordnungsstärkste, die mit 55,1 % vom Umsatz her bedeutendste Untergruppe innerhalb der Immunsuppressiva ist jedoch die der TNF-alfa-Inhibitoren (Berechnung IGES nach NVI (INSIGHT Health)). Daher beschränkt sich die Analyse des Substitutionspotentials bei den Immunsuppressiva auf diese Wirkstoffgruppe. Abbildung 29: Bewertungskriterien für die Wirkstoffgruppe der Immunsuppressiva Kriterium Zulassungsbestimmungen Evidenzlage Einnahmekomfort Immunsuppressiva (L04) IGES 83 Kriterium Immunsuppressiva (L04) Nebenwirkungen, Kinetik Öffentlichkeitswirksamkeit Präferenzen von Ärzten und Patienten Quelle: 12.2 IGES TNF-alpha-Inhibitoren (L04AB) Tabelle 33: Marktpreise zur Wirkstoffgruppe der TNF-alpha-Inhibitoren Anz. Herst Originalpräparat Gene rika Preisspanne €/DDD Mittelw. € ATC Wirkstoff L04AB01 Etanercept 2 Enbrel 60,90-64,66 62,04 L04AB02 Infliximab 2 Remicade 32,16-33,41 32,55 L04AB04 Adalimumab 2 Humira 63,51-69,57 64,38 L04AB05 Certolizumab pegol* 1 Cimzia L04AB06 Golimumab* 1 Simponi * Quelle: Markteinführung erst Ende 2009 Berechnung IGES nach NVI (INSIGHT Health) Aus der Gruppe der TNF-alpha-Inhibitoren sind auf dem deutschen Markt fünf Substanzen verfügbar, wobei Certolizumab und Golimumab erst seit November 2009 im Handel sind, die Marktanteile der übrigen Wirkstoffe sind annähernd vergleichbar. Die Preisspanne innerhalb der Gruppe der von 4 Herstellern angebotenen TNF-alpha-Inhibitoren (ohne Berücksichtigung der neuen Wirkstoffe Certolizumab und Golimumab) liegt zwischen 32,1669,57 €/DDD bei einem Mittelwert von 56,06 € (Berechnung IGES nach NVI (INSIGHT Health)). 84 IGES Abbildung 30: Bewertungskriterien für die Wirkstoffgruppe der TNF-alpha-Inhibitoren TNF-alpha-Inhibitoren (L04AB) Kriterium Zulassungsbestimmungen Evidenzlage Einnahmekomfort Nebenwirkungen, Kinetik Öffentlichkeitswirksamkeit Präferenzen von Ärzten und Patienten Quelle: IGES Zulassungsbestimmungen und Evidenzlage Die Zulassungslage ist für die einzelnen Substanzen unterschiedlich. Neben Rheumatoider Arthritis, Psoriasis-Arthritis und Psoriasis sind teilweise keine weiteren Indikationen zugelassen, bei Infliximab und Adalimumab bestehen auch Indikationen für chronisch-entzündliche Darmerkrankungen. In Bezug auf Immunogenität und Wirksamkeit in einigen Teilindikationen bestehen entsprechend dem derzeit publizierten Kenntnistand zur Evidenz Unterschiede zwischen den Wirkstoffen (arznei-telegramm 2009, Nast et al. 2006). Insgesamt fehlt es an Vergleichsstudien der TNF-alpha-Hemmstoffe untereinander (arznei-telegramm 2009), eine vergleichende Übersicht kommt jedoch zu dem Ergebnis, dass die Wirkstoffe in ihrer Wirksamkeit weitgehend vergleichbar sind (Singh et al. 2009). In der Leitlinie zur Behandlung von Morbus Crohn erfolgt, abgesehen von der Zulassungssituation, keine differenzierte Betrachtung der TNF-alpha-Blocker (Hoffmann et al. 2008). Bei Vorliegen von Kontraindikationen ist auch ein Off-label-Gebrauch mit anderen Substanzen, auch den neueren, denkbar. Nebenwirkungen, Kinetik und Einnahmekomfort Die häufigsten Nebenwirkungen der TNF-alpha-Hemmstoffe unterscheiden sich kaum und können als Gruppeneffekte betrachtet werden. Die Wirkstoffe werden unterschiedlich oft verabreicht, zwischen einmal wöchentlich und IGES 85 einmal monatlich. Daher erfordern insbesondere die länger wirksamen Wirkstoffe eine längere Zeit der Nachbeobachtung und Achtsamkeit bei Absetzen bzw. Umstellen der Medikation. Der Wirkstoff Infliximab kann im Unterschied zu den anderen nur als Infusion verabreicht werden. Öffentlichkeitswirksamkeit und Präferenzen Zu beachten ist bei diesen Substanzen zudem der Aspekt der Öffentlichkeitswirksamkeit, da die Betroffenen oft sehr gut informiert über möglich Behandlungsalternativen sind und von hochspezialisierten Fachärzten behandelt werden. Gleichzeitig besteht ein hoher Leidensdruck, was bei Erstattungseinschränkungen zu starken Reaktionen von Seiten der Patienten und der Ärzteschaft führen dürfte. Fazit Deutliche Unterschiede bei den Zulassungen, die aber medizinisch niedriger zu bewerten sind. Z.T. Off-label-Gebrauch bei anderen als den zugelassenen Indikationen. Medizinisch bewertet ist ein geringes Substitutionspotenzial vorhanden. In der Wahrnehmung bei Ärzten und Patienten sind Unterschiede vorhanden. Negative Reaktionen sind zu erwarten, hieraus ergibt sich ein Risikoselektionspotenzial, dessen Nutzbarkeit jedoch fraglich ist. 86 IGES 13 Antiphlogistika und Antirheumatika (M01) 13.1 Übersicht über die Wirkstoffgruppe Tabelle 34: Marktdaten zur Wirkstoffgruppe der Antiphlogistika und Antirheumatika ATC Bezeichnung M01AA Butylpyrazolidine M01AB Essigsäure-Derivate und verwandte Substanzen M01AC Oxicame M01AE Propionsäure-Derivate M01AG Fenamate M01AA-AG NSAR, konventionell (insgesamt) M01AH Coxibe M01AX Andere NSAR, Kombinationen und Basistherapuetika Anz. Herst. DDD 2008 97 952.763.182 86,6% 3 74.654.412 6,8% 16 72.852.977 6,6% 1.100.000.000 100,0% Gesamt Quelle: Marktanteil (in DDD) Berechnung IGES nach NVI (INSIGHT Health) Die Wirkstoffgruppe der Antiphlogistika und Antirheumatika besteht aus Wirkstoffen mit unterschiedlichen Wirkprinzipien, so dass sich bei der Gesamtbetrachtung ein heterogener Eindruck ergibt (Abbildung 31). Die am besten vergleichbaren und vom Marktanteil her bedeutendsten Untergruppen sind die konventionellen nicht steroidalen Antirheumatika (NSAR) (in der Tabelle 34 wurden die ersten fünf Gruppen entsprechend zusammengefasst) und die Coxibe. Daher beschränkt sich die weitergehende Analyse des Substitutionspotentials bei den Antiphlogistika und Antirheumatika auf diese Wirkstoffe. IGES 87 Abbildung 31: Bewertungskriterien für die Wirkstoffgruppe der Antiphlogistika und Antirheumatika Antiphlogistika und Antirheumatika (M01) Kriterium Zulassungsbestimmungen Evidenzlage Einnahmekomfort Nebenwirkungen, Kinetik Öffentlichkeitswirksamkeit Präferenzen von Ärzten und Patienten Quelle: 13.2 IGES Konventionelle NSAR (M01AA - M01AG) Tabelle 35: Marktpreise zur Wirkstoffgruppe der Konventionellen NSAR Anz. OriginalHerst präparat Gene Preisspanrika ne €/DDD Mittelw. € ATC Wirkstoff M01AA01 Phenylbutazon 2 Ambene x 0,36-9,75 1,65 M01AB01 Indometacin 8 x 0,32-3,40 0,50 M01AB05 Diclofenac 33 Voltaren x 0,03-14,81 0,41 M01AB11 Acemetacin 10 Rantudil x 0,37-2,28 0,78 M01AB14 Proglumetacin 1 Protaxon 0,44-2,08 0,59 M01AB16 Aceclofenac 2 Beofenac 0,46-2,20 0,85 M01AC01 Piroxicam 0,21-10,75 0,51 M01AC05 Lornoxicam 2 Telos 0,35-1,72 0,46 M01AC06 Meloxicam 13 Mobec 0,22-11,00 0,40 21 x x 88 IGES Anz. OriginalHerst präparat Gene Preisspanrika ne €/DDD Mittelw. € ATC Wirkstoff M01AE01 Ibuprofen 58 x 0,08-12,00 0,59 M01AE02 Naproxen 31 x 0,05-2,20 0,52 M01AE03 Ketoprofen 5 Gabrilen x 0,37-16,15 0,58 M01AE11 Tiaprofensäure 1 Surgam 0,64-1,42 0,76 M01AE14 Dexibuprofen 2 Deltaran 0,98-3,97 1,23 M01AE17 Dexketoprofen 1 Sympal 1,48-7,80 2,05 M01AG06 Etofenamat 1 Rheumon 1,44-11,42 3,57 Quelle: Berechnung IGES nach NVI (INSIGHT Health) Die Gruppe der konventionellen NSAR besteht aus mehreren Substanzen in Untergruppen gemäß ihrer unterschiedlichen Strukturen. Prinzipiell können sie aber auf den gleichen Wirkmechanismus zurückgeführt werden. Die weitaus am häufigsten angewendeten Wirkstoffe sind Diclofenac und Ibuprofen. Die Preisspanne innerhalb der gesamten Gruppe der von 97 Herstellern angebotenen konventionellen NSAR liegt zwischen 0,0316,15 €/DDD bei einem Mittelwert von 0,51 € (Berechnung IGES nach NVI (INSIGHT Health)). In der Wirkstoffgruppe der konventionellen NSAR sind die hohen Preisspannen bei den meisten Wirkstoffen parenteralen Zubereitungsformen zuzurechnen, die allerdings nicht für alle Wirkstoffe verfügbar sind, was sich in deren niedrigerer Preisspanne zeigt. Abbildung 32: Bewertungskriterien für die Wirkstoffgruppe der Konventionellen NSAR Kriterium Zulassungsbestimmungen Evidenzlage Einnahmekomfort Nebenwirkungen, Kinetik NSAR, konventionell (M01AA-M01AG) IGES 89 Öffentlichkeitswirksamkeit Präferenzen von Ärzten und Patienten Quelle: IGES Zulassungsbestimmungen und Evidenzlage Mit Ausnahme der Oxicame und einiger der Propionsäure-Derivate sind die Anwendungsgebiete bei den verfügbaren Wirkstoffen nahezu identisch. Ebenso die Nebenwirkungen und Gegenanzeigen, so dass sich formal keine Unterschiede im Einsatz zeigen. Differenziell betrachtet ergeben sich jedoch unterschiedliche Anwendungspräferenzen für die einzelnen Wirkstoffe bei bestimmten Indikationen. Die Behandlungsleitlinie der Deutschen Gesellschaft für Rheumatologie5 stellt hierzu fest, dass "die Entscheidung für ein Präparat mit kurzer, mittlerer oder langer Halbwertszeit […] den Bedürfnissen des Patienten entsprechend gefällt werden und sich am Nebenwirkungsprofil der einzelnen Substanzen orientieren [sollte].". Nebenwirkungen, Kinetik und Einnahmekomfort Die möglichen Nebenwirkungen sind aufgrund des ähnlichen Wirkmechanismus der Substanzen vergleichbar, die Unterschiede liegen in Ausmaß und Häufigkeit des Auftretens. Aus diesem Grund und wegen zusätzlich auftretender Nebenwirkungen gelten die Substanzen Indometacin, Phenylbutazon und Piroxicam als Reservepräparate (Aktories et al. 2009, S. 383 ff.). Die empfohlene Anwendungshäufigkeit ist bei allen Substanzen vergleichbar und eher abhängig von der Galenik. Die pharmakokinetischen Daten sind mit einigen Ausnahmen, wie den länger wirksamen Oxicamen und Naproxen ebenfalls vergleichbar. Der Wirkeintritt ist bei den Substanzen unterschiedlich. Fast alle Wirkstoffe werden umfangreich metabolisiert und besitzen eine hohe Plasmaeiweißbindung. Wegen der Vielzahl der Wirkstoffe ist eine Erstattungseinschränkung unproblematisch. Öffentlichkeitswirksamkeit und Präferenzen Bei der Einschränkung der Erstattung sind mehrere Varianten denkbar. Bei Verzicht auf eine oder mehrere der Standardsubstanzen (Diclofenac, Ibuprofen, Naproxen) ist damit zu rechnen, dass dadurch aufgrund der breiten Anwendung starke Reaktionen hervorgerufen würden, eine starke Lenkungswirkung im Sinne ließe sich dadurch aber sicherlich erreichen. Bei 5 Quelle: http://dgrh.de/fileadmin/media/ Qualitaetssicherung/Leitlinien/6_KAP4.PDF 90 IGES Verzicht auf die spezielleren, seltener verordneten Wirkstoffe sind eher Einzelfälle betroffen, ein Ausweichen auf andere Substanzen sollte jedoch möglich bleiben. Die sich hieraus ergebende Lenkungswirkung kann aber vermutlich als weniger effektiv angesehen werden. Fazit Kaum Unterschiede in den Zulassungen der zahlreichen Wirkstoffe. Medizinisch bewertet ist ein Substitutionspotential vorhanden. Unterschiede bestehen hauptsächlich hinsichtlich der Galenik und der Häufigkeit von Nebenwirkungen. Breite Anwendung, viele negative Reaktionen sind daher zu erwarten. Ein Risikoselektionspotential ist insgesamt vorhanden und als wahrscheinlich effektiv zu bewerten 13.3 Selektive COX2-Inhibitoren / Coxibe (M01AH) Tabelle 36: Marktpreise zur Wirkstoffgruppe der Coxibe Gene rika Preisspanne €/DDD Wirkstoff M01AH01 Celecoxib 2 Celebrex 1,36-2,81 1,52 M01AH04 Parecoxib 2 Dynastat 10,36-22,09 11,55 M01AH05 Etoricoxib 2 Arcoxia 0,15-3,44 1,13 Quelle: Herst. Originalpräparat ATC Mittelw.€ Berechnung IGES nach NVI (INSIGHT Health) Die Gruppe der Coxibe besteht nach Marktrücknahmen nur noch aus drei Substanzen (Tabelle 36). Bei diesen Wirkstoffen handelt es sich ebenfalls um NSAR. Etoricoxib wird häufiger verordnet als die übrigen Wirkstoffe dieser Gruppe. Die Preisspanne innerhalb der von insgesamt 3 Herstellern angebotenen Coxibe liegt zwischen 0,15-22,09 €/DDD bei einem Mittelwert von 1,26 € (Berechnung IGES nach NVI (INSIGHT Health)). Parecoxib fällt durch seine vergleichsweise höheren Kosten pro DDD auf, da es nur als parenterale Zubereitung verfügbar ist. IGES 91 Abbildung 33: Bewertungskriterien für die Wirkstoffgruppe der Coxibe Kriterium Coxibe (M01AH) Zulassungsbestimmungen Evidenzlage Einnahmekomfort Nebenwirkungen, Kinetik Öffentlichkeitswirksamkeit Präferenzen von Ärzten und Patienten Quelle: IGES Zulassungsbestimmungen und Evidenzlage Insbesondere das nur parenteral wirksame Parecoxib unterscheidet sich in Zulassung, Anwendung und Einnahme, bei den übrigen Substanzen sind kaum Unterschiede erkennbar. In der Wirkung sind die Coxibe miteinander vergleichbar. Nebenwirkungen, Kinetik und Einnahmekomfort Auch die Rate an unerwünschten Wirkungen ist bei den verfügbaren Substanzen vergleichbar. Auch die gastrointestinale Verträglichkeit ist bei allen Coxiben ähnlich und nicht überzeugend besser als bei den übrigen NSAR. Ein Nachteil gegenüber den konventionellen NSAR stellt zudem das erhöhte Risiko für kardiologische Wirkungen dar, die als Klasseneffekt der Coxibe interpretiert werden können (arznei-telegramm 2007). Bei einer Einschränkung in der Erstattung kann weitgehend problemlos auf eine verwandte Substanz ausgewichen werden, auch ein Wechsel zu konventionellen NSAR dürfte in den meisten Fällen nicht mit Problemen verbunden sein, so dass prinzipiell auch die Zusammenfassung in einer Wirkstoffgruppe der NSAR in Betracht gezogen werden kann. 92 IGES Öffentlichkeitswirksamkeit und Präferenzen Da die Coxibe nach wie vor von vielen Ärzten und Patienten als besonders gut verträgliche Wirkstoffe angesehen werden, dürfte ein kompletter Verzicht auf die Gruppe mit deutlichen negativen Reaktionen verbunden sein. Bei nur teilweisem Verzicht dürften die Proteste verhaltener ausfallen, da ein Klasseneffekt unterstellt wird, daher ist dann auch kein Risikoselektionspotential anzunehmen. Fazit Kaum Unterschiede in den Zulassungen. Medizinisch bewertet ist ein hohes Substitutionspotential vorhanden. In der Wahrnehmung bei Ärzten und Patienten sind kaum Unterschiede präsent, hieraus ergibt sich nur ein geringes Risikoselektionspotential. Nur bei Verzicht auf gesamte Wirkstoffgruppe sind negative Reaktionen und ein größeres Risikoselektionspotential wahrscheinlich. Fazit NSAR (konventionelle NSAR plus Coxibe) Kaum Unterschiede in den Zulassungen. Medizinisch bewertet ist ein hohes Substitutionspotential vorhanden. In der Wahrnehmung bei Ärzten und Patienten sind Unterschiede in der Verträglichkeit präsent, hieraus ergibt sich nur ein Risikoselektionspotential. Negative Reaktionen und ein größeres Risikoselektionspotential wahrscheinlich. IGES 93 14 Analgetika (N02) 14.1 Übersicht über die Wirkstoffgruppe Tabelle 37: Marktdaten zur Wirkstoffgruppe der Analgetika Anz. Herst. Bezeichnung N02A Opioide 61 364.958.359 33,5% N02B Andere Analgetika und Antipyretika 91 197.756.670 61,9% N02C Migränemittel 7 2.527.966 0,4% N02CC Triptane 30 17.756.407 3,0% Sonstige 6.600.597 1,1% Gesamt 589.600.000 100,0% Quelle: DDD 2008 Marktanteil (in DDD) ATC Berechnung IGES nach NVI (INSIGHT Health) Die Wirkstoffgruppe der Analgetika besteht aus vielen Wirkstoffen sehr unterschiedlicher Charakteristik. Bei der Gesamtbetrachtung ergibt sich ein äußerst heterogener Eindruck mit nur geringem Substitutionspotential (Abbildung 26). Die weitere Analyse beschränkt sich daher auf die marktrelevanten Gruppen der Opioide und der "Anderen Analgetika und Antipyretika" (Tabelle 37). Abbildung 34: Bewertungskriterien für die Wirkstoffgruppe der Analgetika Kriterium Zulassungsbestimmungen Evidenzlage Einnahmekomfort Nebenwirkungen, Kinetik Analgetika (N02) 94 IGES Kriterium Analgetika (N02) Öffentlichkeitswirksamkeit Präferenzen von Ärzten und Patienten Quelle: 14.2 IGES Opioide (N02A) Tabelle 38: Marktpreise zur Wirkstoffgruppe der Opioide ATC Wirkstoff N02AA01 Morphin N02AA03 Hydromorphon N02AA05 N02AA08 Anz. Herst. Originalpräparat Preisspanne €/DDD Mittelw. € x 1,64-19,42 3,49 2 Palladon x 3,09-25,86 7,56 Oxycodon 9 Oxygesic x 5,39-27,54 7,54 Dihydrocodein 1 DHC x 3,28-6,48 4,29 1 x 8,50-12,97 9,32 Oxycodon, N02AA55 Kombinationen 22 Gene rika N02AA59 Codein, Kombin. exkl. Psycholeptika 4 x 0,44-4,95 2,77 N02AA65 Codein / Diclofenac 1 x 1,36-5,11 2,03 N02AA66 Codein / ASS 2 x 2,16-7,56 4,82 N02AA69 Codein / Paracetamol 8 x 0,34-11,77 2,15 N02AB02 Pethidin 3 Dolantin x 4,12-22,48 7,21 N02AB03 Fentanyl 24 Durogesic x 3,62-43,22 5,19 N02AC03 Piritramid 1 Dipidolor 10,07 10,07 N02AC06 Levomethadon 1 Polamidon 1,04-9,60 1,21 N02AE01 Buprenorphin 4 Temgesic 4,92-41,37 9,80 N02AF02 Nalbufin 1 Nubain 17,93 17,93 N02AX02 Tramadol 30 Tramal x 0,77-14,65 1,24 N02AX51 Tilidin, Kombinat. 21 Valoron x 0,74-20,93 1,21 Quelle: x Berechnung IGES nach NVI (INSIGHT Health) IGES 95 Die Gruppe der Opioide besteht aus zahlreichen Substanzen mit ähnlichen Strukturen, die prinzipiell auf den gleichen Wirkmechanismus zurückgeführt werden können, sowie teilweise aus Kombinationen mit anderen Analgetika oder andern aktiven Zusatzstoffen. Größere Unterschiede der Substanzen liegen in ihrer analgetischen Potenz. Das am häufigsten verordnete Opioid ist Fentanyl. Die Preisspanne innerhalb der gesamten Gruppe der von 61 Herstellern angebotenen Opioide liegt zwischen 0,3443,22 €/DDD bei einem Mittelwert von 3,03 € (Berechnung IGES nach NVI (INSIGHT Health)). Die hohen Preisunterschiede bei einzelnen Wirkstoffen sind auch bei den Opioiden den zahlreichen unterschiedlichen Anwendungsformen zuzurechnen. Abbildung 35: Bewertungskriterien für die Wirkstoffgruppe der Opioide Kriterium Opioide (N02A) Zulassungsbestimmungen Evidenzlage Einnahmekomfort Nebenwirkungen, Kinetik Öffentlichkeitswirksamkeit Präferenzen von Ärzten und Patienten Quelle: IGES Zulassungsbestimmungen und Evidenzlage Die Zulassung in der Indikation Schmerz in seinen vielfältigen Ausprägungen und Ursachen ist formal für alle verfügbaren Präparate vergleichbar. Die Opioide unterscheiden sich hauptsächlich durch ihre unterschiedliche analgetische Potenz und damit in ihrer Anwendung bei verschiedenen Schmerzarten und -intensitäten. Dies führte auch zur Bildung von Gruppen vergleichbarer Potenz, wie sie auch im WHO-Stufenschema zur Schmerz- 96 IGES behandlung berücksichtigt sind6. Die Entwicklung verschiedenster Zubereitungsformen bestimmt in erster Linie den Einsatz der Präparate als Basistherapie bei chronischen Schmerzen, zur Linderung bei Schmerzspitzen oder vorübergehend bei akuten Schmerzen z.B. postoperativ. Hier steht eine große Bandbreite an Zubereitungen zur Verfügung, unterschiedliche orale Zubereitungen die den Wirkstoff sofort oder retardiert freisetzen, weiterhin parenterale Formen wie Injektionslösungen, Pflaster. Bei den starken Opioiden gilt Morphin als Mittel der ersten Wahl, die weiteren werden meist bei speziellen Erfordernissen an die Applikationsart angewendet oder wenn eine noch stärkere analgetische Wirkung als bei Morphin erforderlich ist. Ein wichtiges Behandlungsprinzip ist auch die sogenannte Opioidrotation, bei der bei Therapieversagen mit einem der Wirkstoffe auf vergleichbare oder stärker wirksame gewechselt wird, was für einen dauerhaften Therapieerfolg bisweilen unabdingbar sein kann (Aktories et al. 2009, S. 230 ff.). Nebenwirkungen, Kinetik und Einnahmekomfort Die Nebenwirkungen der Substanzen sind, bedingt durch die ähnlichen Wirkprinzipien, ebenfalls vergleichbar, Unterschiede bestehen in der Regel nur in Häufigkeit und Intensität einzelner unerwünschter Wirkungen (arznei-telegramm 2007), wodurch sich allerdings unterschiedliche Profile ergeben. Aufgrund der vergleichsweise geringen gefäßkontrahierenden Wirkung des Morphins ist sein Einsatz bei Herzinfarkt indiziert, bei kolikartigen Schmerzen wird wegen seiner leichten spasmolytischen Eigenschaften Pethidin oder aber eine Kombination aus Morphin und Nitraten bevorzugt (Aktories et al. 2009, S. 230 ff., arznei-telegramm 2006). Einige der Substanzen (Morphin, Dihydrocodein, Tramadol, Tilidin) werden durch Metabolisierung in aktive Wirkformen umgewandelt. Ist eine solche Aktivierung erforderlich, so ist damit zu rechnen, dass diese Wirkstoffe bei kleinen Gruppen von Patienten nicht wirken, weil ihnen die entsprechende Enzymausstattung fehlt. Bei anderen Wirkstoffen findet kaum Metabolisierung statt (Oxycodon), so dass bei Leberschäden oder entsprechendem Enzymmangel keine Beeinträchtigung der Wirkung erfolgt. Auch die Eliminierung über andere Wege als die Niere kann bei gestörter Nierenfunktion zu Vorteilen für einige Substanzen führen (Tilidin, Hydromorphon, Buprenorphin) (Junker und Freynhagen 2008). Öffentlichkeitswirksamkeit und Präferenzen Insgesamt lassen sich nur wenige Wirkstoffe finden, die aus therapeutischer Sicht verzichtbar wären. Die unterschiedlichen Eigenschaften und Anwen- 6 http://www.who.int/cancer/palliative/painladder/en/ IGES 97 dungen der Substanzen bedingen die uneingeschränkte Verfügbarkeit eines gewissen Spektrums von Substanzen aus medizinischer Sicht (Junker und Freynhagen 2008). Eine Einschränkung in der Erstattung kann nur bedingt empfohlen werden, da zum einen medizinisch-ethische Gründe dagegen sprechen, zum andern gerade im Indikationsgebiet der chronischen Schmerzen eine hochsensible Patientenklientel vorliegt, bei denen mit heftigen Reaktionen zu rechnen sein dürfte. Aufgrund der Vielzahl der Wirkstoffe ließe sich eine Auswahl begründbar durchführen, woraus sich auch eine deutliche Lenkungswirkung für Patientengruppen ergeben würde. Allerdings sollte dabei sichergestellt sein, dass möglichst viele verschiedene Arzneiformen zur Verfügung stehen und auch die unterschiedlichen Wirkpotenzen angemessen berücksichtigt werden. Ein Verzicht auf das Referenztherapeutikum Morphin kann nicht empfohlen werden. Fazit Kaum Unterschiede in den Zulassungen, die Unterschiede liegen hauptsächlich in der Wirkstärke und damit auch in Anwendungsgebieten. Medizinisch bewertet ist ein Substitutionspotential auch innerhalb der Gruppen mit vergleichbarer Wirkstärke nur bedingt vorhanden. In der Wahrnehmung bei Ärzten und Patienten sind deutliche Unterschiede präsent, negative Reaktionen sind zu erwarten. Hieraus ergibt sich ein Risikoselektionspotential, dessen Nutzbarkeit jedoch fraglich ist. 14.3 Andere Analgetika und Antipyretika (N02B) Tabelle 39: Marktpreise zur Wirkstoffgruppe der Anderen Analgetika und Antipyretika ATC Wirkstoff N02BA01 Acetylsalicylsäure N02BB01 Phenazon N02BB02 Metamizol-Na N02BB04 Propyphenazon N02BE01 Paracetamol N02BG07 N02BG08 Quelle: Herst eller Originalpräparat 26 Aspirin Gene rika Preisspanne €/DDD Mittelw. € x 0,04-14,10 0,07 3 Migränin x 0,84-6,16 2,29 11 Novalgin x 0,69-8,15 1,55 0,85-1,99 1,02 1 Demex 57 ben-u-ron x 0,22-15,89 0,46 Flupirtin 2 Katadolon x 2,35-15,22 2,93 Ziconotid 1 Prialt 11,67-62,20 19,98 Berechnung IGES nach NVI (INSIGHT Health) 98 IGES Die Gruppe der Anderen Analgetika besteht aus sehr unterschiedlichen Substanzen mit prinzipiell unterschiedlichen Wirkmechanismen. Einige der Wirkstoffe sind rezeptfrei erhältlich und sind daher auch nur unter bestimmten Bedingungen erstattungsfähig, so dass der am häufigsten verordnete Wirkstoff in dieser Gruppe das verschreibungspflichtige Metamizol ist. Die Preisspanne innerhalb der gesamten Gruppe der von 91 Herstellern angebotenen Anderen Analgetika liegt zwischen 0,04-62,20 €/DDD bei einem Mittelwert von 1,33 € (Berechnung IGES nach NVI (INSIGHT Health)). Ziconotid steht nur als Infusionslösung für die intrathekale Applikation zur Verfügung. Abbildung 36: Bewertungskriterien für die Wirkstoffgruppe der Anderen Analgetika und Antipyretika Andere Analgetika und Antipyretika (N02B) Kriterium Zulassungsbestimmungen Evidenzlage Einnahmekomfort Nebenwirkungen, Kinetik Öffentlichkeitswirksamkeit Präferenzen von Ärzten und Patienten Quelle: IGES Zulassungsbestimmungen und Evidenzlage Die in dieser Gruppe zusammengefassten Wirkstoffe haben unterschiedliche Charakteristika und Wirkungen, daher sind auch die zugelassenen Indikationen unterschiedlich. Abhängig von der analgetischen Wirksamkeit besteht eine Zulassung entweder für leichte bis mäßige oder für starke Schmerzen. Zusätzliche Indikationen für einige der Substanzen bestehen zudem bei Fieber, Verspannungen oder krampfartigen Schmerzen. Das klassische Schmerzmittel Acetylsalicylsäure (ASS) lässt sich in der Wirkung eher mit den Antirheumatika (M01) vergleichen. Paracetamol hat vermutlich einen zentral schmerzstillenden und fiebersenkenden Angriffs- IGES 99 punkt, die Pyrazolinone (Metamizol, Phenazon, Propyphenazon) haben miteinander vergleichbare Wirkungen, ihnen fehlt, ebenso wie dem Paracetamol die entzündungshemmende Wirkkomponente. Abgesehen von Metamizol werden sie nur noch selten eingesetzt. Flupirtin hat eine Muskelkrampf lösende Wirkkomponente und ist ein reines Analgetikum. Ziconotid hat einen von den anderen Wirkstoffen völlig abweichenden Wirkmechanismus und ist nur bei einer kleinen Gruppe von Patienten mit starken chronischen Schmerzen indiziert. Die insgesamt großen Unterschiede der Wirkstoffe in dieser Gruppe lassen einen direkten Vergleich im Sinne dieser Analyse kaum zu. Nebenwirkungen, Kinetik und Einnahmekomfort Aufgrund des unterschiedlichen Charakters der Substanzen besitzen sie unterschiedliche unerwünschte Wirkungen. Ebenso werden sie meist von verschiedenen Enzymen bzw. in unterschiedliche Ausmaß metabolisiert, wodurch sich auch die Interaktionspotentiale unterschiedlich darstellen. Die Einnahme orientiert sich in der Regel am individuellen Bedarf und ist zudem stark abhängig von der eingesetzten Galenik. Das starke, zentral wirkende Ziconotid ist nur intrathekal anwendbar. Eine Einschränkung auf eine oder wenige dieser Substanzen erscheint nicht sinnvoll und ist auch kaum begründbar. Öffentlichkeitswirksamkeit und Präferenzen Die nicht-opioiden Analgetika erfahren eine breite Anwendung, eine Einschränkung dürfte starke negative Reaktionen hervorrufen und ist medizinisch kaum begründbar. Fazit Deutliche Unterschiede bei den Zulassungen. Aus medizinisch-therapeutischer Sicht kaum Substitutionspotential vorhanden. Uneinheitliche Wirkstoffgruppe. Breite Anwendung, daher sind starke negative Reaktionen zu erwarten. Risikoselektionspotential ist prinzipiell vorhanden und als wahrscheinlich effektiv zu bewerten, die Nutzbarkeit ist jedoch fraglich. 100 IGES 15 Antiepileptika (N03) 15.1 Übersicht über die Wirkstoffgruppe Tabelle 40: Marktdaten zur Wirkstoffgruppe der Antiepileptika Anz. Herst. Bezeichnung N03AA Barbiturate und Derivate 5 10.958.396 3,8% N03AB Hydantoine 4 12.210.105 4,2% N03AD Succinimide 4 1.148.067 0,4% N03AE Benzodiazepine 3 4.210.668 1,4% N03AF Carboxamide 24 77.228.160 26,5% N03AG Fettsäure-Derivate 25 57.845.211 19,9% N03AX Andere 46 127.772.958 43,9% 291.410.000 100,0% Gesamt Quelle: DDD 2008 Marktanteil (in DDD) ATC Berechnung IGES nach NVI (INSIGHT Health) Die Wirkstoffgruppe der Antiepileptika besteht aus unterschiedlichen Wirkstoffen, die zusammengenommen zu verschieden sind, um sie direkt miteinander vergleichen zu können (Abbildung 37). Die vom Marktanteil her bedeutendsten Untergruppen sind die Carboxamide, die Fettsäurederivate und die "Anderen Antiepileptika" (Tabelle 40). Die detaillierte Analyse des Substitutionspotentials wird daher auf diese Untergruppen beschränkt. IGES 101 Abbildung 37: Bewertungskriterien für die Wirkstoffgruppe der Antiepileptika Kriterium Antiepileptika (N03) Zulassungsbestimmungen Evidenzlage Einnahmekomfort Nebenwirkungen, Kinetik Öffentlichkeitswirksamkeit Präferenzen von Ärzten und Patienten Quelle: 15.2 Carboxamide (N03AF) Tabelle 41: ATC IGES Marktpreise zur Wirkstoffgruppe der Carboxamide Wirkstoff Herst. Originalpräparat Gene rika Preisspanne Mittelw. € €/DDD N03AF01 Carbamazepin 23 Tegretal x 0,41-3,62 0,66 N03AF02 Oxcarbazepin 4 Trileptal x 0,36-3,85 1,90 N03AF03 Rufinamid 1 Inovelon 9,55-10,73 9,74 Quelle: Berechnung IGES nach NVI (INSIGHT Health) Aus der Gruppe der Carboxamide sind auf dem deutschen Markt drei Substanzen erhältlich, von denen Carbamazepin häufiger verordnet wird als die übrigen Wirkstoffe. Die Preisspanne innerhalb der gesamten Gruppe der von 24 Herstellern angebotenen Carboxamid-Antiepileptika liegt zwischen 0,36-10,73 €/DDD bei einem Mittelwert von 0,90 € (Berechnung IGES nach NVI (INSIGHT Health)). Der neuere Wirkstoff Rufinamid fällt hierbei durch deutlich höhere DDD-Kosten auf, was in seiner sehr speziellen Indikation begründet ist. 102 IGES Abbildung 38: Bewertungskriterien für die Wirkstoffgruppe der Carboxamide Kriterium Carboxamide (N03AF) Zulassungsbestimmungen Evidenzlage Einnahmekomfort Nebenwirkungen, Kinetik Öffentlichkeitswirksamkeit Präferenzen von Ärzten und Patienten Quelle: IGES Zulassungsbestimmungen und Evidenzlage Die Zulassungen der drei Substanzen unterscheiden sich deutlich. Carbamazepin ist für zahlreiche epileptische und neuropathische Teilindikationen zugelassen, Oxcarbazepin für die Therapie von fokalen Anfällen und die wesentlich neuere Substanz Rufinamid nur als Zusatzmedikation für das seltene Lennox-Gastaut-Syndrom bei Kindern. Nebenwirkungen, Kinetik und Einnahmekomfort Weitere Unterschiede ergeben sich insbesondere aus den verminderten unerwünschten Wirkungen der neu entwickelten Substanzen. Insbesondere bei der Behandlung mit Carbamazepin kommt es häufiger zu unerwünschten Wirkungen, Oxcarbazepin ist insgesamt nebenwirkungsärmer, Rufinamid ist offenbar deutlich besser verträglich. Die Wirkstoffe werden in ähnlicher Weise zweimal täglich eingenommen, von Carbamazepin und Oxcarbazepin liegen auch retardierte und flüssige Zubereitungen vor. In der ihren kinetischen Eigenschaften unterscheiden sich die Wirkstoffe kaum, die Wechselwirkungen mit anderen Arzneistoffen, insbesondere auch anderen Antiepileptika erfordern aufgrund der Metabolisierung der Substanzen und ihrer enzyminduzierenden Eigenschaften ein sorgfältiges Einstellen der Patienten. IGES 103 Öffentlichkeitswirksamkeit und Präferenzen In der Wahrnehmung bei Ärzten und Patienten sind deutliche Unterschiede präsent, daher sind bei Einschränkungen negative Reaktionen zu erwarten. Fazit Deutliche Unterschiede bei den Zulassungen. Auch medizinisch bewertet kaum Substitutionspotential vorhanden. Negative Reaktionen sind zu erwarten. Hieraus ergibt sich ein Risikoselektionspotential, dessen Nutzbarkeit jedoch fraglich ist. 15.3 Fettsäurederivate (N03AG) Tabelle 42: Marktpreise zur Wirkstoffgruppe der Fettsäurederivate ATC Wirkstoff N03AG01 Valproinsäure N03AG04 Vigabatrin N03AG06 Tiagabin Quelle: Herst. Originalpräparat 24 Convulex gene- Preisspanne risch €/DDD x Mittelw. € 0,09-40,12 0,89 2 Sabril 3,75-5,57 4,36 2 Gabitril 4,35-6,00 4,69 Berechnung IGES nach NVI (INSIGHT Health) Die Gruppe der Fettsäure-Antiepileptika besteht auf dem deutschen Markt aus drei Substanzen, Valproinsäure ist der mit deutlichem Abstand relevanteste Wirkstoff. Die Preisspanne innerhalb der gesamten Gruppe der von 25 Herstellern angebotenen Fettsäurederivate liegt zwischen 0,0940,12 €/DDD bei einem Mittelwert von 0,93 € (Berechnung IGES nach NVI (INSIGHT Health)). Die parenteralen Zubereitungen für Valproinsäure bedingen dessen hohen maximalen Preis pro DDD. Abbildung 39: Bewertungskriterien für die Wirkstoffgruppe der Fettsäurederivate Kriterium Zulassungsbestimmungen Evidenzlage Einnahmekomfort Fettsäurederivate (N03AG) 104 IGES Nebenwirkungen, Kinetik Öffentlichkeitswirksamkeit Präferenzen von Ärzten und Patienten Quelle: IGES Zulassungsbestimmungen und Evidenzlage Die Wirkung der drei Substanzen in dieser Gruppe ist deutlich unterschiedlich. Während Valproinsäure vorwiegend über das GABA-erge System wirksam ist, aber vermutlich auch über Na-Kanäle wirkt, greifen Vigabatrin und Tiagabin ausschließlich auf unterschiedliche Weise in das GABA-erge System ein. Hieraus resultiert auch die Anwendung bei unterschiedlichen Anfallarten. Valproinsäure besitzt aufgrund seines mehrfachen Wirkansatzes breitere Einsatzmöglichkeiten in der Behandlung. Die wesentlich seltener verordneten Substanzen Tiagabin und Vigabatrin sind als Reservemittel nur als Zusatzmedikation zugelassen. Nebenwirkungen, Kinetik und Einnahmekomfort Die Nebenwirkungen unterscheiden sich in Art und Intensität zwischen den Substanzen, ebenso die kinetischen Eigenschaften und das Interaktionspotential mit anderen Arzneistoffen. Während Vigabatrin abgesehen von häufigen neurologischen Effekten wenig relevante Nebenwirkungen und kaum Wechselwirkungen zeigt, weist Valproinsäure demgegenüber ein breiteres Spektrum auf. Öffentlichkeitswirksamkeit und Präferenzen Die in allen untersuchten Bereichen großen Unterschiede der Wirkstoffe dieser Gruppe sind auch Ärzten und Patienten bewusst, starke negative Reaktionen sind daher bei Einschränkungen in der Erstattung zu erwarten. Eine begründbare Einschränkung erscheint wenig möglich und sinnvoll, zumal es sich bei Valproinsäure um eines der am häufigsten eingesetzten Mittel, bei den anderen um wichtige Reservemittel handelt. Fazit Deutliche Unterschiede bei den Zulassungen. Auch medizinisch bewertet kein Substitutionspotential vorhanden. Sehr heterogene Wirkstoffgruppe, negative Reaktionen sind zu erwarten. Hieraus ergibt sich ein Risikoselektionspotential, dessen Nutzbarkeit jedoch fraglich ist. IGES 15.4 105 Andere Antiepileptika (N03AX) Tabelle 43: Marktpreise zur Wirkstoffgruppe der Anderen Antiepileptika Herst. Originalpräparat ATC Wirkstoff N03AX03 Sultiam N03AX09 Lamotrigin 33 Lamictal N03AX10 Felbamat 2 Taloxa N03AX11 Topiramat 5 Topamax N03AX12 Gabapentin 27 Neurontin N03AX14 Levetiracetam N03AX15 Gene rika Preisspanne €/DDD 2,12-4,50 2,74 0,96-49,83 1,68 2,68-16,49 13,27 x 6,70-15,70 9,51 x 1,11-12,93 2,70 3 Keppra 5,02-61,37 5,38 Zonisamid 3 Zonegran 4,21-23,38 5,76 N03AX16 Pregabalin 4 Lyrica 0,89-23,52 4,71 N03AX18 Lacosamid 1 Vimpat 2,88-6,87 4,38 N03AX21 Kaliumbromid 1 Dibro-BE 1,71 1,71 Quelle: 1 Ospolot Mittelw. € x x Berechnung IGES nach NVI (INSIGHT Health) Die Gruppe der Anderen Antiepileptika besteht auf dem deutschen Markt aus zehn Substanzen mit sehr unterschiedlicher Charakteristik. Größere Marktanteile können Pregabalin und Gabapentin für sich verzeichnen. Die Preisspanne innerhalb der gesamten Gruppe der von 46 Herstellern angebotenen "Anderen Antiepileptika" liegt zwischen 0,89-61,37 €/DDD bei einem Mittelwert von 3,94 € (Berechnung IGES nach NVI (INSIGHT Health)). Auch in dieser Wirkstoffgruppe bedingen die parenteralen Zubereitungen die hohen Preise pro DDD und damit die großen Preisspannen für einige der Wirkstoffe. Abbildung 40: Bewertungskriterien für die Wirkstoffgruppe der Anderen Antiepileptika Kriterium Zulassungsbestimmungen Evidenzlage Einnahmekomfort Andere Antiepileptika (N03AX) 106 IGES Nebenwirkungen, Kinetik Öffentlichkeitswirksamkeit Präferenzen von Ärzten und Patienten Quelle: IGES Zulassungsbestimmungen und Evidenzlage Auch in dieser großen Gruppe von Antiepileptika, in der sich viele verschiedene Wirkprinzipien finden, unterscheiden sich die zugelassenen Anwendungsgebiete deutlich. Die Substanzen Topiramat und Gabapentin mit ihren multiplen Wirkmechanismen, die in nahezu alle bekannten für Epilepsie relevanten Neurotransmittersysteme eingreifen, gehören zu der Gruppe, außerdem die häufig verordneten Substanzen mit definiertem Wirkmechanismus Pregabalin und Lamotrigin und auch Reservetherapeutika wie Felbamat und Lacosamid sowie einige andere. Dementsprechend unterschiedlich stellt sich auch die Zulassungssituation für diese Wirkstoffe dar. Die meisten Arzneistoffe in dieser Gruppe stellen wichtige Optionen in der Zusatzmedikation bei Epilepsie dar, wenn eine Behandlung mit den übrigen Standardtherapeutika alleine keinen ausreichenden Effekt zeigen. Einige werden auch oder überwiegend zur Behandlung neuropathischer Schmerzen eingesetzt, wie Pregabalin oder Gabapentin. Die erfolgreiche Therapie ergibt sich in der Regel durch erratische Anwendung einer oder mehrerer der Substanzen (arznei-telegramm 2008). Bei einigen sind die tatsächlichen Wirkmechanismen nach wie vor nicht absolut gesichert. Nebenwirkungen, Kinetik und Einnahmekomfort Bezüglich Nebenwirkungen, Einnahmekomfort und in ihrer Kinetik unterscheiden sich die Substanzen erwartungsgemäß deutlich. Abgesehen von systematischen, meist zentralnervösen Beeinträchtigungen besitzt jede Substanz ihr eigenes Neben- und Wechselwirkungsprofil. Einige der Wirkstoffe zeichnen sich durch ein besonders niedriges Interaktionspotential aus (Gabapentin, Levetiracetam), wohingegen andere durch Enzyminhibierung oder -induktion die Verstoffwechselung zahlreicher anderer Arzneistoffe und besonders auch anderer Antiepileptika beeinflussen (Topiramat, Felbamat). Durch Langzeitgebrauch entstehende Spätfolgen sind für die neueren Substanzen noch nicht vollständig absehbar (Aktories et al. 2009, S. 286ff.). IGES 107 Öffentlichkeitswirksamkeit und Präferenzen Die deutlichen Unterschiede in den Profilen der einzelnen Wirkstoffe dieser Gruppe sind Ärzten und Patienten bewusst und werden therapeutisch ausgenutzt. Einschränkungen dürften daher deutliche negative Reaktionen hervorrufen. Fazit Deutliche Unterschiede bei den Zulassungen. Auch medizinisch bewertet kein Substitutionspotential vorhanden. Sehr heterogene Wirkstoffgruppe, negative Reaktionen sind zu erwarten. Hieraus ergibt sich ein Risikoselektionspotential, dessen Nutzbarkeit jedoch fraglich ist. 15.5 Fazit Antiepileptika (N03) Zusammen mit der Zulassung hängt die Wahl des geeigneten Antiepileptikums insbesondere von der Art der auftretenden Anfälle ab, individuelle Konstitution, Bedürfnisse und sonstige Medikation des Patienten sind aber ebenso entscheidend. Mittel der Wahl bei fokalen Anfälle sind die Carboxamide, Topiramat, Lamotrigin und Levetiracetam, bei primär generalisierten Anfällen ist Valproinsäure meist besser geeignet. Bei initialem oder späterem Therapieversagen und vor allem bei auftretenden Nebenwirkungen kommen die weiteren Substanzen entsprechend ihrer Charakteristik zum Einsatz. Ca. 20 % der Patienten werden mit einer Kombinationstherapie aus zwei oder mehreren Wirkstoffen mit unterschiedlichen Wirkprinzipien behandelt (Aktories et al. 2009, S. 286ff.). Ein wichtiger Aspekt bei der Beurteilung der Substanzen ist, dass sich der Erfolg bei der Therapie der Epilepsie in vielen Fällen erst nach Ausprobieren mehrerer Wirkstoffe einstellt. Eine klare Handlungsempfehlung kann nicht in jedem Fall gegeben werden. Nebenwirkungen können einen häufigeren Wechsel auch bei erfolgreicher Behandlung nach einiger Zeit erforderlich machen. Insbesondere bei der Kombinationstherapie sind die neueren Substanzen mit ihrem meist deutlich geringeren Interaktionspotential besser geeignet (Elger et al. 2008). Eine Einschränkung auf wenige der verfügbaren Substanzen kann eine befriedigende Therapie für die Patienten in vielen Fällen unmöglich machen bzw. wird mit Folgeschäden erkauft. Die Wirkung in der Öffentlichkeit kann hierbei deutlich ausfallen und heftige negative Reaktionen auch bei nicht direkt Beteiligten hervorrufen. Eine entsprechende Lenkungswirkung für Patientengruppen im Sinne eines großen Risikoselektionspotentials kann dementsprechend unterstellt werden. 108 IGES 16 Antiparkinsonmittel (N04) 16.1 Übersicht über die Wirkstoffgruppe Tabelle 44: Marktdaten zur Wirkstoffgruppe der Antiparkinsonmittel Anz. Herst. DDD 2008 Marktanteil (in DDD) ATC Bezeichnung N04AA Anticholinergika 10 16.229.301 11,5% N04BA Levodopa und Kombinationen 26 58.842.316 41,7% N04BB/BX Andere 20 20.066.152 14,2% N04BC* Dopamin-Agonisten, Ergot 21 6.678.196 4,7% N04BC* Dopamin-Agonisten, Non-Ergot 19 25.315.107 17,9% N04BD MAO-B-Hemmer 19 8.892.120 6,3% N04BX COMT-Hemmer 5 2.826.087 2,0% Sonstige 2.250.721 1,6% Gesamt 141.100.000 100,0% * die Marktanteile der beiden Untergruppen wurden hier getrennt dargestellt. Quelle: Berechnung IGES nach NVI (INSIGHT Health) In der Wirkstoffgruppe der Antiparkinsonmittel sind unterschiedliche Therapieprinzipien versammelt, die zusammen zu verschieden sind, um sie direkt miteinander vergleichen zu können (Abbildung 41). Die am ehesten vergleichbaren Untergruppen mit den größten Marktanteilen sind neben den Levodopa-Kombinationen die Dopaminagonisten und die Anticholinergika (Tabelle 44). Die Analyse wird sich daher auf diese beschränken. Abbildung 41: Bewertungskriterien für die Wirkstoffgruppe der Antiparkinsonmittel Kriterium Zulassungsbestimmungen Evidenzlage Antiparkinsonmittel (N04) IGES 109 Kriterium Antiparkinsonmittel (N04) Einnahmekomfort Nebenwirkungen, Kinetik Öffentlichkeitswirksamkeit Präferenzen von Ärzten und Patienten Quelle: 16.2 Anticholinergika (N04AA) Tabelle 45: ATC IGES Marktpreise zur Wirkstoffgruppe der Anticholinergika Wirkstoff Herst. Originalpräparat Gene rika Preisspanne €/DDD Mittelw. € N04AA01 Trihexyphenidyl 2 Artane x 0,50-1,87 0,75 N04AA02 Biperiden 5 Akineton x 0,56-5,54 0,79 N04AA03 Metixen 2 Tremarit 1,17-2,37 1,76 N04AA04 Procyclidin 1 Osnervan 1,46 1,46 N04AA11 Bornaprin 2 Sormodren 0,64-1,35 0,76 Quelle: Berechnung IGES nach NVI (INSIGHT Health) Die Gruppe der Anticholinergika umfasst im wesentlichen fünf Substanzen, die in deutlich unterschiedlichem Ausmaß verordnet werden, der weitaus häufigste Wirkstoff ist dabei Biperiden (Tabelle 45). Die Preisspanne innerhalb der gesamten Gruppe der von 10 Herstellern angebotenen Anticholinergika liegt zwischen 0,50-5,54 €/DDD bei einem Mittelwert von 0,81 € (Berechnung IGES nach NVI (INSIGHT Health)). 110 IGES Abbildung 42: Bewertungskriterien für die Wirkstoffgruppe der Anticholinergika Kriterium Anticholinergika (N04AA) Zulassungsbestimmungen Evidenzlage Einnahmekomfort Nebenwirkungen, Kinetik Öffentlichkeitswirksamkeit Präferenzen von Ärzten und Patienten Quelle: IGES Zulassungsbestimmungen und Evidenzlage Die Zulassung für die fünf Substanzen ist nahezu identisch, wobei bei Procyclidin, Metixen und Bornaprin die Behandlung der Tremorsymptomatik im Vordergrund steht. Dies ist wichtig, da L-Dopa gegen diese Symptome oft nicht ausreichend wirksam ist. Sie gelten zudem als Mittel der Wahl bei durch Neuroleptika ausgelösten extrapyramidalen Störungen (arznei-telegramm 2009). In der Wirksamkeit unterscheiden sich die Substanzen ebenfalls kaum, die Wirksamkeit ist bei allen Substanzen am besten bezüglich der Rigor- und Tremorsymptomatik und der Verminderung des Speichelflusses (arznei-telegramm 2009, Aktories et al. 2009, S. 300ff.). Sinnvollerweise werden sie daher in der Regel als Zusatzmedikation eingesetzt. Insgesamt stehen laut einem Cochrane-Review jedoch zu wenige verlässliche Daten zur Verfügung, um die Substanzen miteinander vergleichen zu können (Katzenschlager et al. 2003). Nebenwirkungen, Kinetik und Einnahmekomfort Die typischen Nebenwirkungen der Anticholinergika zeigen sich bei allen der zur Verfügung stehenden Substanzen in vergleichbarem Maß (Reichmann et al. 2000). In den kinetischen Daten unterscheiden sich die Substanzen ebenfalls kaum, die mehrmals tägliche Einnahme ist bei allen erforderlich. Bei allen Stoffen ist das Interaktionspotential ähnlich. IGES 111 Öffentlichkeitswirksamkeit und Präferenzen Die Wirkstoffe sind gut miteinander vergleichbar und es bestehen bei Ärzten und Patienten keine großen Wahrnehmungsunterschiede. Die Verordnungsmengen in dieser Wirkstoffgruppe sind in den letzten Jahren insgesamt rückläufig (Häussler et al. 2009). die Patientengruppe, die mit diesen Wirkstoffen behandelt wird, ist vergleichsweise klein. Mit negativen Reaktionen ist daher nur in geringem Ausmaß zu rechnen, ein Risikoselektionspotenzial im Sinne dieser Untersuchung besteht nicht. Fazit Kaum Unterschiede in den Zulassungen. Medizinisch betrachtet sind sich die Wirkstoffe ähnlich, daher ist ein Substitutionspotential vorhanden. Vergleichsweise kleinere Patientengruppe. Mit Reaktionen ist nur bedingt zu rechnen. Hieraus ergibt sich nur ein geringes Risikoselektionspotential. 16.3 Dopaminagonisten (N04BC) Tabelle 46: Marktpreise zur Wirkstoffgruppe der Dopaminagonisten Wirkstoff N04BC01 Bromocriptin N04BC02 Pergolid N04BC03 Dihydroergocryptinmesilat N04BC06 Cabergolin 10 Cabaseril N04BC07 Apomorphin N04BC10 Lisurid N04BC04 Ropinirol N04BC05 Pramipexol 2 Sifrol N04BC08 Piribedil N04BC09 Rotigotin Quelle: Herst. Originalpräparat ATC Gene Preisspanrika ne €/DDD Mittelw. € 8 Pravidel x 5,07-12,17 7,08 10 Parkotil x 6,61-24,00 7,18 5,78-9,18 6,02 4,07-8,97 5,38 2 APO-go 8,48-51,62 10,38 2 Dopergin 3,55-10,34 4,12 3,43-28,88 6,75 8,71-17,67 10,93 1 Clarium 11,20-14,00 11,94 2 Neupro 3,56-24,18 11,06 2 Almirid 16 Requip x x Berechnung IGES nach NVI (INSIGHT Health) Die Gruppe der Dopaminagonisten umfasst zehn Substanzen in zwei Untergruppen, den Ergot- und den Non-Ergot-Dopaminagonisten (Tabelle 46). Die Anzahl der Verordnungen verschiebt sich dabei in den letzten Jahren immer mehr zugunsten der letzteren Gruppe. Der am weitaus häufigsten 112 IGES verordnete Wirkstoff ist demzufolge auch mit Pramipexol ein Non-ErgotDopaminagonist. Die Preisspanne innerhalb der Gruppe der von 21 Herstellern angebotenen Ergot-Dopaminagonisten liegt zwischen 3,5551,62 €/DDD bei einem Mittelwert von 6,03 € und die der von 19 Herstellern angebotenen Non-Ergot-Dopaminagonisten zwischen 3,4328,88 €/DDD bei einem Mittelwert von 9,72 € (Berechnungen IGES nach NVI (INSIGHT Health)). Abbildung 43: Bewertungskriterien für die Wirkstoffgruppe der Dopaminagonisten Kriterium Dopaminagonisten (N04BC) Zulassungsbestimmungen Evidenzlage Einnahmekomfort Nebenwirkungen, Kinetik Öffentlichkeitswirksamkeit Präferenzen von Ärzten und Patienten Quelle: IGES Zulassungsbestimmungen und Evidenzlage Alle aufgeführten Wirkstoffe sind zur Therapie des Morbus Parkinson zugelassen, einige nur in Kombinationstherapie oder als Mittel der zweiten Wahl (s.u.). Pramipexol und Rotigotin sind ähnlich wie L-Dopa / Benserazid auch zur Behandlung des Restless-Legs-Syndroms zugelassen. Dopaminagonisten werden meist zusätzlich zu einer Therapie mit anderen Antiparkinsonmitteln gegeben, wenn diese allein nicht ausreichend wirksam sind. Sie können eine Therapie mit L-Dopa aufschieben und dessen meist nach einigen Behandlungsjahren auftretenden Wirkungseinschränkungen und -fluktuationen hinauszögern (Konta und Frank 2008, Aktories et al. 2009, S.299ff.). Die erwähnte Verschiebung der Verordnungen zugunsten der Non-Ergot-Agonisten ist berechtigt, da diese in der Regel vor allem weniger und weniger ausgeprägte Neben- und Wechselwirkungen IGES 113 aufweisen als die ergolinen Agonisten (Konta und Frank 2008). Pramipexol gilt generell als Mittel der Wahl (arznei-telegramm 2007). Die Wirkung der Dopaminagonisten wird bei allen Mitteln über die Dopamin-D2-Rezeptoren, bei den Non-Ergot-Agonisten zusätzlich auch über Dopamin-D3Rezeptoren vermittelt. Pergolid, Dihydroergocryptin, und Apomorphin wirken auch über Dopamin-D1-Rezeptoren. Lisurid ist nur als Kombinationsbehandlung mit L-Dopa zugelassen und dann besonders gut synergistisch wirksam, es hat Einfluss auf alle dopaminergen Rezeptoren und auf das serotonerge System. Die in der Indikation Parkinson erst relativ kurz auf dem Markt befindliche Substanz Piribedil hat außer der Wirkung auf D2und Dopamin-D3-Rezeptoren auch Einfluss auf α2-adrenerge Rezeptoren, was ein geringeres Auftreten der häufigen Spätdyskinesien bedingen soll, tatsächlich nachgewiesen werden konnte dies bisher jedoch nicht. Das nur akut parenteral anwendbare Apomorphin ist als Zusatzmedikation insbesondere bei motorischen on-/off-Phänomenen anwendbar, die mit den üblichen Medikamenten alleine nicht in den Griff zu bekommen sind. Seine Anwendung unterscheidet sich stark von der der anderen Substanzen in dieser Gruppe und kann nicht verglichen werden, da sie sehr eingeschränkt ist und individuell festgelegt wird. Die unterschiedlich ausgeprägte RezeptorSelektivität bedingt unterschiedliche Wirkintensität und Einfluss auf bestimmte Symptome der Parkinson-Erkrankung. Nebenwirkungen, Kinetik und Einnahmekomfort Ebenso kann die unterschiedliche Rezeptor-Selektivität die bei der Behandlung auftretenden Nebenwirkungen verstärken. Hierbei sind die häufigsten bei den untersuchten Substanzen vergleichbar und bedingt durch den Angriffspunkt. Die bei Ropinirol stärker auftretenden Schlafattacken können im Alltag belastend sein. Bei Cabergolin und Pergolid treten Herzklappenveränderungen und Fibrosen häufig auf, weshalb sie als Reservemittel der zweiten Wahl eingestuft werden (arznei-telegramm 2009). Die Einnahme erfolgt bis auf Cabergolin mit seiner vergleichsweise sehr langen Halbwertszeit mehrmals täglich, bei Apomorphin individuell unterschiedlich bis zu 12 mal, je nach auftretender Symptomatik. Rotigotin ist nur als Pflaster erhältlich, die Anwendung erfolgt einmal täglich. Die Substanzen werden unterschiedlich stark an Plasmaproteine gebunden und unterschiedlich stark von P450-Enzymen metabolisiert, was unterschiedliche Potenziale zu Wechselwirkungen mit anderen Arzneistoffen zur Folge hat. Die meisten und häufigsten Interaktionen sind jedoch durch den Wirkmechanismus über die Dopaminrezeptoren bedingt. Öffentlichkeitswirksamkeit und Präferenzen Die Verordnungszahlen zeigen, dass insgesamt das Prinzip der non-ErgotDopaminagonisten mit der Hauptsubstanz Pramipexol bevorzugt wird, was medizinisch auch nachvollziehbar und begründbar ist. Dieses Therapieprin- 114 IGES zip ist allerdings mit höheren Kosten verbunden als bei anderen Wirkstoffen, weshalb eine Einschränkung auf andere Wirkstoffe dieser Gruppe (wie z.B. ausgewählte Ergot-Agonisten) eine direkte Kostenreduktion herbeiführen könnte. Sofern diese sich nicht auf Mittel der zweiten Wahl beschränkt, wird dies auch als vertretbar angesehen. Hieraus könnte auch eine deutliche Lenkungswirkung für Patientengruppen entstehen. Fazit Teilweise abweichende Anwendungsgebiete. Medizinisch bewertet ist ein Substitutionspotential in den weiteren Untergruppen vorhanden, Unterschiede bestehen hauptsächlich hinsichtlich der Neben- und Wechselwirkungen. Negative Reaktionen sind zu erwarten, großes Risikoselektionspotential vorhanden und als wahrscheinlich effektiv zu bewerten. 16.4 L-Dopa Kombinationen (N04BA) Tabelle 47: ATC Marktpreise zur Wirkstoffgruppe der L-Dopa Kombinationen Wirkstoff L-Dopa / DecarboxylaseN04BA03 hemmer / COMTHemmer N04BA10 L-Dopa / Carbidopa N04BA11 Levodopa / Benserazid Quelle: Anz. Herst Originalpräparat 6 Stalevo 19 Isicom 5 Madopar gene- Preisspanne Mittelw. € risch €/DDD x 3,38-22,12 7,57 x 0,23-41,91 1,73 x 1,13-7,07 2,23 Berechnung IGES nach NVI (INSIGHT Health) Auf dem deutschen Markt sind derzeit zwei fixe Kombinationen mit dem Wirkstoff L-Dopa (Levodopa) und Decarboxylasehemmern sowie eine Dreifachkombination zusätzlich mit einem COMT-Hemmer erhältlich. Im Falle der Zweifachkombination ist der Verbrauch nahezu gleich verteilt, die fixe Dreifachkombination wird derzeit noch seltener verordnet, ihr Anteil steigt allerdings in den letzten Jahren an (Häussler et al. 2009). Die Preisspanne innerhalb der gesamten von 26 Herstellern angebotenen Gruppe von L-Dopa und seinen Kombinationen liegt zwischen 0,23-41,91 €/DDD bei einem Mittelwert von 2,64 € (Berechnung IGES nach NVI (INSIGHT Health)). Der hohe Preis pro DDD für eine gelförmige Zubereitung zur Einnahme bedingt die große Preisspanne für die L-Dopa/CarbidopaKombinationen. IGES 115 Abbildung 44: Bewertungskriterien für die Wirkstoffgruppe der L-Dopa Kombinationen L-Dopa Kombinationen (N04BA) Kriterium Zulassungsbestimmungen Evidenzlage Einnahmekomfort Nebenwirkungen, Kinetik Öffentlichkeitswirksamkeit Präferenzen von Ärzten und Patienten Quelle: IGES Zulassungsbestimmungen und Evidenzlage Aufgrund der Dosisanpassungsphänomene und schnellen Nachlassens der Wirkung von L-Dopa alleine wird die Monosubstanz heutzutage nicht mehr verwendet, sondern nur noch in Kombination mit mindestens einem den Dopaminabbau hemmenden Wirkstoff eingesetzt. Hierbei ist die Kombination mit den Decarboxylasehemmern Carbidopa oder Benserazid und dem COMT-Hemmer Entacapon gängig. Medizinisch-therapeutische Unterschiede zwischen den verfügbaren Decarboxylasehemmern bestehen nicht. Der COMT-Hemmer Entacapon wird in der Regel erst in späteren Stadien der Krankheit zu einer Kombination aus L-Dopa und einem Decarboxylasehemmer hinzugegeben bzw. die entsprechende fixe Dreifachkombination angewandt, da die im Laufe der Jahre meist auftretenden Wirkungsfluktuationen so abgemildert werden können und die L-DopaDosis meist verringert werden kann. Insofern ist ein Vergleich nur sinnvoll zwischen den zweifachen L-Dopa-Decarboxylasehemmer-Kombinationen. Nebenwirkungen, Kinetik und Einnahmekomfort Die Decarboxylasehemmer unterscheiden sich ebenfalls kaum in ihrer Anwendung, sowie in ihren Neben- und Wechselwirkungen. 116 IGES Öffentlichkeitswirksamkeit und Präferenzen Die Entscheidung für einen der Decarboxylasehemmer als Kombinationspartner für L-Dopa ist rational nicht begründbar, die Verordnungszahlen sind annähernd gleich verteilt, in der Wahrnehmung bei Ärzten und Patienten sind wenig Unterschiede präsent und negative Reaktionen sind kaum zu erwarten, daher besteht kein Risikoselektionspotential. Fazit Keine Unterschiede in den Zulassungen. Medizinisch bewertet ist ein hohes Substitutionspotential bei den Zweifachkombinationen vorhanden. In der Wahrnehmung bei Ärzten und Patienten sind wenig Unterschiede präsent und negative Reaktionen sind kaum zu erwarten, daher kein Risikoselektionspotential 16.5 Fazit Antiparkinsonmittel (N04) Die Therapie muss patientenindividuell angepasst werden, daher sollten die unterschiedlichen Wirkstoffgruppen an sich erhalten bleiben. In jeder der angesprochenen Gruppen ist prinzipiell jedoch eine Einschränkung auf wenige Substanzen möglich, auch wenn dadurch die Therapiequalität im Hinblick auf die jeweilige Standardbehandlung abnimmt, insbesondere in der Gruppe der Dopaminagonisten. Aus diesen Maßnahmen können sich mit Blick auf die durchschnittliche Therapiedauer von mehreren Jahren und den teilweise erheblichen Kosten deutliche Einsparungen für die Kasse ergeben. Im Hinblick auf die unter der Therapie entstehende und unterschiedliche Lebensqualität der Patienten können durch eine derartige Einschränkung auch gezielte Patientengruppen adressiert werden. Eine Einschränkung auf die im Vergleich wesentlich günstigere Therapie mit L-DopaKombinationen alleine kann hingegen nicht vertreten und empfohlen werden, da spätestens nach einigen Jahren eine Kombination aus mehreren Therapieprinzipien einschließlich L-Dopa-Kombinationen obligatorisch durchgeführt werden muss. IGES 117 17 Psycholeptika (N05) 17.1 Übersicht über die Wirkstoffgruppe Tabelle 48: ATC Marktdaten zur Wirkstoffgruppe der Psycholeptika Anz. Herst. Bezeichnung DDD 2008 Marktanteil (in DDD) Konventionell, niedrig – mittel potent 33 64.587.172 10,6% Konventionell, hoch potent 22 64.549.924 10,6% Atypische 48 130.832.553 21,5% N05AL03 Tiaprid 15 6.398.960 1,1% N05AN01 Lithium 7 20.761.186 3,4% Sonstige (incl. Benzodiazepine) 320.170.205 52,7% Gesamt 607.300.000 100,0% Quelle: Berechnung IGES nach NVI (INSIGHT Health) In der Wirkstoffgruppe der Psycholeptika stehen sich mehrere unterschiedliche Therapieprinzipien für unterschiedliche Krankheitsbilder gegenüber, die zusammengenommen zu verschieden sind, um sie direkt miteinander vergleichen zu können (Abbildung 45). Die Substanzen Lithium und Tiaprid stellen eigene Therapieansätze dar. Die vom Umsatz her bedeutendsten Untergruppen, auf die sich die weitere Analyse beschränkt, sind daher die konventionellen und die atypischen Antipsychotika. Diese sind hier zur besseren Vergleichbarkeit nicht nach ATC-Gruppen sondern nach Indikation bzw. Wirksamkeit zusammengefasst worden (Tabelle 48). Abbildung 45: Bewertungskriterien für die Wirkstoffgruppe der Psycholeptika Kriterium Zulassungsbestimmungen Evidenzlage Psycholeptika (N05) 118 IGES Einnahmekomfort Nebenwirkungen, Kinetik Öffentlichkeitswirksamkeit Präferenzen von Ärzten und Patienten Quelle: IGES Zulassungsbestimmungen und Evidenzlage Die antipsychotischen Wirkungen werden bei den konventionellen Antipsychotika vorwiegend über eine antagonistische Wirkung an Dopamin-D2-Rezeptoren entfaltet, bei den atypischen sind meist noch andere Neurotransmittersysteme stärker involviert. Die atypischen Substanzen haben daher meist eine bessere Wirkung auch auf die Negativsymptomatik schizophrener Erkrankungen, die bei den konventionellen Neuroleptika weniger ausgeprägt ist. Patienten, bei denen die konventionellen Wirkstoffe nicht ausreichend wirksam sind, können oft von atypischen Substanzen profitieren (arznei-telegramm 2008). Die Wirkstoffe haben neben der antipsychotischen Wirkung auch teilweise weitere Wirkkomponenten, wie sedierende, anxiolytische, kognitive und antidepressive Effekte, die für die Behandlung ausgenutzt werden. Somit lassen sich für die meisten der Substanzen individuelle Wirkprofile erstellen, die bei bestimmten Patientengruppen besonders vorteilhaft sind. Nebenwirkungen, Kinetik und Einnahmekomfort Aus der unterschiedlichen Rezeptorselektivität resultieren außerdem die generell häufigeren und intensiveren Nebenwirkungen der konventionellen Antipsychotika. Die Nebenwirkungen lassen sich prinzipiell unterschiedlich charakterisieren. Die vegetativen Nebenwirkungen sind für die Patienten oft belastend, aber meist weniger gefährlich und kommen bei bestimmten Wirkstoffen in allen Gruppen vor, bei den Atypika jedoch deutlich seltener. Insbesondere die häufigen extrapyramidal-motorischen Nebenwirkungen, die oft stark beeinträchtigend sind, sind bei den Atypischen Wirkstoffen deutlich seltener. Die nur sehr selten auftretenden schwerwiegenden und lebensbedrohenden Nebenwirkungen können prinzipiell bei allen Substanzen auftreten. Eine individuelle Risikobeurteilung ist bei der Auswahl der Substanz sowohl bezüglich des Wirk- als auch des Nebenwirkungsprofils durchzuführen (DGPPN 2005). IGES 119 Öffentlichkeitswirksamkeit und Präferenzen Wegen der unterschiedlichen Wirkungen der Substanzen, die therapeutisch ausgenutzt werden, muss bei Einschränkungen mit deutlichen negativen Reaktionen gerechnet werden. Aus gleichem Grund ist bei den als sensibel einzustufenden Patienten ein großes Risikoselektionspotential vorhanden. Fazit Unterschiedliche Anwendungsgebiete. Aus medizinisch-therapeutischer Sicht kaum Substitutionspotential vorhanden. Deutliche negative Reaktionen sind zu erwarten, Risikoselektionspotential ist vorhanden und als wahrscheinlich effektiv zu bewerten, die Anwendbarkeit ist jedoch fraglich. 17.2 Konventionelle Antipsychotika, niedrig – mittel potent (N05A) Tabelle 49: Marktpreise zur Wirkstoffgruppe der Konventionellen Antipsychotika, niedrig - mittel potent Anz. OriginalHerst. präparat Gene rika Preisspanne €/DDD Mittelw. € ATC Wirkstoff N05AA02 Levomepromazin 3 Neurocil 0,79-16,19 1,55 N05AB10 Perazin 2 Taxilan 0,36-2,60 0,49 N05AC02 Thioridazin 3 Melleril 0,86-7,19 1,58 N05AD03 Melperon N05AD05 20 Eunerpan x 0,66-26,44 2,04 Pipamperon 8 Dipiperon x 1,51-4,80 2,21 N05AF03 Chlorprothixen 4 Truxal x 0,98-10,81 1,70 N05AF05 Zuclopenthixol 2 Ciatyl-Z 0,57-14,87 1,03 N05AL01 Sulpirid 1,44-20,05 2,31 N05AX07 Prothipendyl 1,18-3,95 1,61 Quelle: 17 Dogmatil x 2 Dominal Berechnung IGES nach NVI (INSIGHT Health) Die Gruppe der konventionellen niedrig- bis mittel-potenten Antipsychotika umfasst neun Substanzen, die Unterschiede im Ausmaß der Verordnungen sind dabei nicht so groß wie in anderen Wirkstoffgruppen. Die häufigsten Wirkstoffe sind die generisch verfügbaren Melperon, Pipamperon und Sulpirid (Häussler et al. 2009). Die Preisspanne innerhalb der gesamten Gruppe der von 33 Herstellern angebotenen Konventionellen niedrig- bis mittel-potenten Antipsychotika liegt zwischen 0,36-26,44 €/DDD bei einem Mittelwert von 1,52 € (Berechnung IGES nach NVI (INSIGHT Health)). 120 IGES Abbildung 46: Bewertungskriterien für die Wirkstoffgruppe der Konventionellen Antipsychotika, niedrig - mittel potent Antipsychotika, Konventionell, niedrig – mittel potent (N05A) Kriterium Zulassungsbestimmungen Evidenzlage Einnahmekomfort Nebenwirkungen, Kinetik Öffentlichkeitswirksamkeit Präferenzen von Ärzten und Patienten Quelle: IGES Zulassungsbestimmungen und Evidenzlage Die zugelassenen Anwendungsgebiete der hier untersuchten Wirkstoffe unterscheiden sich nur wenig, allen Substanzen gemein ist die Anwendung bei psychotischen Erkrankungen und psychomotorischen Unruhe- und Erregungszuständen. Zusätzliche Indikationen beruhen auf speziellen zusätzlichen Wirkkomponenten. Die Anwendungsgebiete von Sulpirid unterscheiden sich deutlicher von denen der anderen Wirkstoffe. Auch die Kontraindikationen sind im Wesentlichen vergleichbar. Die Einteilung in niedrig bis mittelpotente konventionelle Antipsychotika beruht auf der Wirkstärke im Vergleich zur neuroleptischen Potenz des Chlorpromazin. Dabei ist innerhalb dieser Gruppe Zuclopenthixol die Substanz mit der stärksten und Sulpirid diejenige mit der schwächsten Wirkstärke. Die beiden Substanzen unterscheiden sich um den Faktor 25. Der Effekt, also das patientenindividuelle Ansprechen auf eine Substanz ist von diesem Index jedoch nicht unmittelbar abhängig. Nebenwirkungen, Kinetik und Einnahmekomfort Den niedrig- bis mittelpotenten Wirkstoffen gemein ist die vergleichsweise starke Sedierung und das verstärkte Auftreten vegetativer Symptome. Die häufig auftretenden extrapyramidal-motorischen Nebenwirkungen werden vor allem durch Melperon, Prothipendyl und Pipamperon seltener hervorge- IGES 121 rufen. In der Kinetik unterscheiden sich die Substanzen teilweise, was bei einigen Substanzen zu einer weniger häufig erforderlichen Einnahme führen kann. Die Metabolisierung findet meist über die gleichen Mechanismen statt, einige Wirkstoffe sind zudem leichte Inhibitoren des abbauenden Enzyms, was zu verstärkten Wechselwirkungen führen kann. Öffentlichkeitswirksamkeit und Präferenzen Wegen der zusätzliche Anwendungsgebiete einzelner Substanzen, die auch therapeutisch ausgenutzt werden, wird bei Einschränkungen bei den als sensibel einzustufenden Patienten mit negativen Reaktionen zu rechnen sein. Ein Risikoselektionspotential ist vorhanden. Fazit Teilweise zusätzliche Anwendungsgebiete. Aus medizinisch-therapeutischer Sicht nur eingeschränktes Substitutionspotential vorhanden. Negative Reaktionen sind zu erwarten, Risikoselektionspotential ist vorhanden und als wahrscheinlich effektiv zu bewerten, die Nutzbarkeit ist jedoch fraglich 17.3 Konventionelle Antipsychotika, hochpotent (N05A) Tabelle 50: Marktpreise zur Wirkstoffgruppe der konventionellen hochpotenten Antipsychotika Anz. Herst. Originalpräparat ATC Wirkstoff N05AB02 Fluphenazin 4 Lyogen N05AB03 Perphenazin 3 Decanthan N05AD01 Haloperidol N05AD06 Bromperidol N05AD07 Gene Preisspanne Mittelw. € rika €/DDD 0,41-6,50 0,66 0,99-5,39 1,62 0,18-4,09 0,57 3 Impromen 1,13-2,66 1,55 Benperidol 2 Glianimon 0,17-1,95 0,26 N05AD08 Droperidol 1 2,79 2,79 N05AF01 Flupentixol 4 Fluanxol x 0,56-3,78 1,22 N05AG01 Fluspirilen 4 Imap x 0,76-2,62 1,41 N05AG02 Pimozid 3 Orap 0,61-1,39 0,77 Quelle: 12 Haldol x x Berechnung IGES nach NVI (INSIGHT Health) Die Gruppe der konventionellen hochpotenten Antipsychotika umfasst neun Substanzen, die häufigsten Wirkstoffe sind nach wie vor Haloperidol und 122 IGES Benperidol (Häussler et al. 2009). Die Preisspanne innerhalb der gesamten Gruppe der von 22 Herstellern angebotenen konventionellen hochpotenten Antipsychotika liegt zwischen 0,17-6,50 €/DDD bei einem Mittelwert von 0,74 € (Berechnung IGES nach NVI (INSIGHT Health)). Abbildung 47: Bewertungskriterien für die Wirkstoffgruppe der Konventionellen hochpotenten Antipsychotika Antipsychotika, Konventionell, hochpotent (N05A) Kriterium Zulassungsbestimmungen Evidenzlage Einnahmekomfort Nebenwirkungen, Kinetik Öffentlichkeitswirksamkeit Präferenzen von Ärzten und Patienten Quelle: IGES Zulassungsbestimmungen und Evidenzlage Die Wirkstoffe sind annähernd für die gleichen Indikationsgebiete zugelassen, für einige Substanzen ergeben sich erweiterte Anwendungsgebiete durch zusätzliche Wirkkomponenten. Die Einteilung der hochpotenten konventionellen Antipsychotika beruht ebenso auf der Wirkstärke im Vergleich zur neuroleptischen Potenz des Chlorpromazins. Dabei hat Benperidol in dieser Gruppe eine etwa fünfmal stärkere Potenz als Perphenazin. Der Effekt, also das patientenindividuelle Ansprechen auf eine Substanz ist von diesem Index jedoch nicht unmittelbar abhängig. Nebenwirkungen, Kinetik und Einnahmekomfort Die hochpotenten Wirkstoffe haben gemeinsam, dass die typischen extrapyramidal-motorischen Nebenwirkungen häufiger und stärker ausgeprägt auftreten als bei den niedrig bis mittelpotenten konventionellen und auch als bei den atypischen Antipsychotika. Bezüglich der kinetischen Daten herr- IGES 123 schen größere Unterschiede. Wirkeintritt und Eliminationshalbwertszeit unterscheiden sich Während einige der Substanzen nahezu vollständig durch CYP-Enzyme metabolisiert werden (z.B. Haloperidol), trifft dies für andere nicht zu (z.B. Flupentixol). Dies hat auch Einfluss auf die Einahmehäufigkeit der Wirkstoffe. Während einige Substanzen mehrmals täglich angewendet werden, wird Fluspirilen nur einmal wöchentlich parenteral verabreicht. Öffentlichkeitswirksamkeit und Präferenzen Wegen der zusätzliche Anwendungsgebiete einzelner Substanzen, die auch therapeutisch ausgenutzt werden, wird bei Einschränkungen bei den als sensibel einzustufenden Patienten mit negativen Reaktionen zu rechnen sein. Ein Risikoselektionspotential ist vorhanden. Fazit Teilweise zusätzliche Anwendungsgebiete. Aus medizinisch-therapeutischer Sicht nur eingeschränktes Substitutionspotential vorhanden. Negative Reaktionen sind zu erwarten, Risikoselektionspotential ist vorhanden und als wahrscheinlich effektiv zu bewerten, die Nutzbarkeit ist jedoch fraglich. 17.4 Antipsychotika, atypisch (N05A) Tabelle 51: Marktpreise zur Wirkstoffgruppe der Atypischen Antipsychotika Anz. OriginalHerst. präparat ATC Wirkstoff N05AE03 Sertindol 1 Serdolect N05AE04 Ziprasidon 2 Zeldox N05AH02 Clozapin N05AH03 Olanzapin* N05AH04 Quetiapin N05AL05 Amisulprid 17 Solian N05AX08 Risperidon 39 Risperdal N05AX11 Zotepin 1 Nipolept N05AX12 Aripiprazol 3 Abilify 13 Leponex (23) Zyprexa Gen Preisspanne erika €/DDD Mittelw. € 5,92-7,11 6,11 4,11-78,24 6,56 x 1,90-9,97 2,30 (x) 2,05-21,78 5,02 5,33-23,03 7,83 x 0,87-7,36 2,12 x 0,31-16,84 5,71 1,14-5,44 1,54 6,66-25,16 10,20 3 Seroquel * Generika mussten Ende 2008 nach einem Gerichtsbeschluss wieder vom Markt genommen werden. Quelle: Berechnung IGES nach NVI (INSIGHT Health) 124 IGES Auch die Gruppe der atypischen Antipsychotika umfasst neun Substanzen, die am häufigsten verordneten Wirkstoffe sind Olanzapin, Quetiapin und Risperidon. Die Preisspanne innerhalb der gesamten Gruppe der von 48 Herstellern angebotenen atypischen Antipsychotika liegt zwischen 0,2978,24 €/DDD bei einem Mittelwert von 5,53 € (Berechnung IGES nach NVI (INSIGHT Health)). Die angegebenen Preise für Olanzapin beinhalten Preise für die zahlreichen im Jahr 2008 kurzzeitig auf dem Markt befindlichen Generika. Zwischenzeitlich wurde der noch bestehende Patentschutz des Originals durch Gerichtsbeschluss bestätigt und die aktuelle Spanne der Preise pro DDD dürfte enger ausfallen. Abbildung 48: Bewertungskriterien für die Wirkstoffgruppe der atypischen Antipsychotika Antipsychotika, Atypisch (N05A) Kriterium Zulassungsbestimmungen Evidenzlage Einnahmekomfort Nebenwirkungen, Kinetik Öffentlichkeitswirksamkeit Präferenzen von Ärzten und Patienten Quelle: IGES Zulassungsbestimmungen und Evidenzlage Die Zulassungen der atypischen Antipsychotika weichen, ähnlich wie bei den anderen Untergruppen der Antipsychotika, leicht voneinander ab, wenn zusätzliche Wirkkomponenten ausreichend stark sind. Somit wird auch hier eine Anwendung bei speziellen Patientengruppen ermöglicht. Insbesondere die atypischen Antipsychotika sind häufig bei zusätzlich auftretenden depressiven Störungen einsetzbar. Bei einigen Patientengruppen können manche Substanzen kontraindiziert sein. IGES 125 Nebenwirkungen, Kinetik und Einnahmekomfort Auch bei den atypischen Neuroleptika unterscheiden sich die Nebenwirkungen der Substanzen voneinander. Besonders bei den endokrinologischen, orthostatischen und anticholinergen Nebenwirkungen sowie bei der Gewichtszunahme bestehen deutliche Unterschiede in den Häufigkeiten, was bei der Wirkstoffwahl zu einer patientenindividuellen Risikobeurteilung führen sollte (Agelink et al. 2006). Unter Clozapin bedarf es aufgrund des Risikos der Agranulozytose einer regelmäßigen Überwachung des Blutbildes. Die unterschiedlichen Eliminationshalbwertszeiten und wege der Substanzen bedingen unterschiedliche Einnahmebedingungen. Das Potential für metabolische Wechselwirkungen ist auch in dieser Wirkstoffgruppe unterschiedlich stark ausgeprägt, auch bedingt durch substanzspezifische Metabolisierung durch verschiedene Enzyme, ist aber insgesamt bei allen Substanzen verhältnismäßig hoch. Amisulprid wird nur wenig metabolisiert. Spezielle Depotformulierungen einiger Präparate sorgen für eine gleichmäßige Wirkstofffreisetzung aus einer parenteralen Darreichungsform über zum Teil mehrere Wochen, was bei bestimmten Patientengruppen die Compliance verbessert. Öffentlichkeitswirksamkeit und Präferenzen Wegen der zusätzliche Anwendungsgebiete einzelner Substanzen, die auch therapeutisch ausgenutzt werden, wird bei Einschränkungen bei den als sensibel einzustufenden Patienten mit negativen Reaktionen zu rechnen sein. Ein Risikoselektionspotential ist vorhanden. Fazit Teilweise bestehen Unterschiede bei den Zulassungen. Aus medizinisch-therapeutischer Sicht nur eingeschränktes Substitutionspotential vorhanden. Negative Reaktionen sind zu erwarten, Risikoselektionspotential ist vorhanden und als wahrscheinlich effektiv zu bewerten, die Nutzbarkeit ist jedoch fraglich. 17.5 Fazit Antipsychotika Insgesamt sollte gerade bei der Erstbehandlung schizophrener Erkrankungen eher den atypischen Antipsychotika der Vorzug gegeben werden: Diese werden in der S3-Leitlinie der DGPPN als Mittel der Wahl bevorzugt. Eine individuelle Risikoabschätzung bezüglich der Nebenwirkungen ist jedoch bei der Therapieentscheidung ebenso Voraussetzung wie die Auswahl nach dem Wirkprofil der Substanzen (Aktories et al. 2009, S. 310 ff., DGPPN 2005). Somit ergibt sich für jede einzelne Gruppe und im Gesamtvergleich ein nur eingeschränktes Substitutionspotential, das für verschiedene Patien- 126 IGES ten unterschiedlich groß sein kann. Aufgrund der Vielzahl der angebotenen Substanzen und zu erwartenden Neuentwicklungen kann jedoch insgesamt eine Einschränkung bei der Wirkstoffauswahl erfolgen. In dieser sensiblen Wirkstoffgruppe ergibt sich auch ein ausreichend großes Risikoselektionspotential für bestimmte Patientengruppen, da viele (der psychisch kranken) Patienten vermutlich eher die Krankenkasse wechseln würden als ihr Medikament. Mit negativen Reaktionen der Betroffenen ist bei Wirkstoffeinschränkungen häufig zu rechnen. IGES 127 18 Psychoanaleptika, Antidepressiva (N06A) 18.1 Übersicht über die Wirkstoffgruppe Tabelle 52: Marktdaten zur Wirkstoffgruppe der Antidepressiva Anz. Herst. Bezeichnung N06AA Nichtselektive Monoamin Wiederaufnahmehemmer (NSMRI) 34 293.655.750 29,5% N06AB SSRI 40 434.793.643 43,6% N06AX Andere Antidepressiva 48 232.943.268 23,4% N06AP Pflanzliche Antidepressiva 33 27.124.165 2,7% N06AG Monoaminoxidase A Hemmer 16 7.871.775 0,8% 996.600.000 100,0% Gesamt Quelle: DDD 2008 Marktanteil (in DDD) ATC Berechnung IGES nach NVI (INSIGHT Health) Die Wirkstoffgruppe der Antidepressiva ist innerhalb der Gruppe der Psychoanaleptika eine sehr umfangreiche Gruppe mit erheblichen Unterschieden bezüglich einzelner Indikationen, der Wirkpotenz und des Wirkprinzips zwischen den einzelnen Untergruppen, so dass die Gruppe als ganze zu heterogen ist, um eine differenzierte Analyse durchführen zu können (Abbildung 49). Aufgrund der dominierenden Stellung der ersten drei in der Tabelle 52 dargestellten Gruppen, wird die differenzierte Analyse im Weiteren auf diese Substanzgruppen beschränkt. Abbildung 49: Bewertungskriterien für die Wirkstoffgruppe der Antidepressiva Kriterium Zulassungsbestimmungen Evidenzlage Einnahmekomfort Antidepressiva (N06A) 128 IGES Kriterium Antidepressiva (N06A) Nebenwirkungen, Kinetik Öffentlichkeitswirksamkeit Präferenzen von Ärzten und Patienten Quelle: 18.2 IGES Nichtselektive (N06AA) Tabelle 53: ATC Monoamin-Wiederaufnahmehemmer (NSMRI) Marktpreise zur Wirkstoffgruppe der nichtselektiven MonoaminWiederaufnahmehemmer (NSMRI) Wirkstoff Herst. Originalpräparat Gene Preisspanne rika €/DDD Mittelw. € N06AA02 Imipramin 4 Tofranil x 0,44-5,41 0,69 N06AA04 Clomipramin 7 Anafranil x 0,55-7,55 0,69 N06AA05 Opipramol 21 Insidon x 0,29-1,81 0,48 N06AA06 Trimipramin 16 Stangyl x 0,41-3,70 0,73 N06AA09 Amitriptylin 11 Saroten x 0,26-4,35 0,43 N06AA10 Nortriptylin 1 Nortrilen x 0,68-4,16 0,80 x 0,27-12,37 0,54 N06AA12 Doxepin 21 Aponal N06AA21 Maprotilin 9 Ludiomil x 0,28-10,98 0,43 N06AA25 Amitriptylinoxid 2 Equilibrin x 0,19-1,40 0,28 Quelle: Berechnung IGES nach NVI (INSIGHT Health) Die Gruppe der nichtselektiven Monoamin-Wiederaufnahmehemmer, oft auch als klassische oder Tricyclische Antidepressiva (TCA) bezeichnet, besteht hauptsächlich aus generisch verfügbaren älteren Wirkstoffen (Tabelle 53), der am häufigsten verordnete ist Amitriptylin. Die klassischen Antidepressiva sind aufgrund unterschiedlicher Wirkmechanismen und Ansatzpunkte in der Physiologie der Neurotransmitter nur bedingt miteinander vergleichbar. Die Preisspanne innerhalb der gesamten Gruppe der von 34 Herstellern angebotenen nichtselektiven Monoamin-Wiederaufnahmehemmer liegt zwischen 0,19-12,37 €/DDD bei einem Mittelwert von 0,51 € (Be- IGES 129 rechnung IGES nach NVI (INSIGHT Health)). Unterschiedliche Zubereitungsformen der Wirkstoffe bedingen auch in dieser Gruppe die zum Teil erheblichen Preisunterschiede pro DDD. Abbildung 50: Bewertungskriterien für die Wirkstoffgruppe der nichtselektiven Monoamin-Wiederaufnahmehemmer Nichtselektive MonoaminWiederaufnahmehemmer, NSMRI (N06AA) Kriterium Zulassungsbestimmungen Evidenzlage Einnahmekomfort Nebenwirkungen, Kinetik Öffentlichkeitswirksamkeit Präferenzen von Ärzten und Patienten Quelle: IGES Zulassungsbestimmungen und Evidenzlage Aufgrund der unterschiedlichen Wirkprofile, die als eher aktivierend oder antriebsdämpfend ausgebildet sind, ergeben sich für die einzelnen Substanzen in dieser Gruppe unterschiedliche Indikationen und Zusatzindikationen (Aktories et al. 2009, S. 318 ff.). Die Wirkungen der einzelnen Stoffe sind daher nur schwer miteinander vergleichbar; jede Substanz hat eine besondere Nische in der Behandlung verschiedener psychischer Erkrankungen und kann daher nur schwer gegen andere ausgetauscht werden. Die Einnahme erfolgt je nach Wirkstoff zwischen einmal und dreimal täglich. Nebenwirkungen, Kinetik und Einnahmekomfort Aufgrund des unterschiedlichen Eingriffs in den NeurotransmitterStoffwechsel sowie weiterer Effekte ergibt sich auch ein unterschiedliches Spektrum an zu erwartenden Nebenwirkungen. TCA weisen gerade im Alter anticholinerge und kardiale Nebenwirkungen auf. Bei Patienten mit ausgeprägten Schlafstörungen oder innerer Unruhe kann ein sedierendes Profil 130 IGES günstig sein. Einige der Substanzen gelten zudem als milder bezüglich der klassischen Nebenwirkungen dieser Wirkstoffgruppe, erzeugen allerdings andere Effekte (z.B. Maprotilin, Nortriptylin). Die einzelnen Vertreter dieser Wirkstoffgruppe haben deutlich voneinander abweichende Wirkungen. Die aktuelle S3-Leitlinie zu Behandlung der unipolaren Depression geht explizit auf die individuelle Patientensituation ein: "Patienten reagieren physisch und psychisch unterschiedlich hinsichtlich Wirkung und Nebenwirkung von Antidepressiva, weswegen die individuelle Gewichtung der unerwünschten Wirkungen bei der Stoffauswahl eine Rolle spielt" (DGPPN et al. 2009). Öffentlichkeitswirksamkeit und Präferenzen Eine Einschränkung in dieser Wirkstoffgruppe kann als therapeutisch nicht vertretbar bewertet werden und dürfte große Reaktionen von Seiten der Patientenvertreter als auch der Ärzteschaft hervorrufen, da für gut eingestellte Patienten auch oftmals große Probleme aus einer Medikationsumstellung erwachsen würden. Fazit Zahlreiche Unterschiede in den Zulassung. Aus medizinisch-therapeutischer Sicht kaum Substitutionspotential vorhanden. In der Wahrnehmung bei Ärzten und Patienten sind diese Unterschiede präsent, deutliche negative Reaktionen sind zu erwarten. Hieraus ergibt sich ein großes Risikoselektionspotential, das aber kaum nutzbar sein dürfte. IGES 18.3 131 Selektive Serotonin-Wiederaufnahmehemmer (SSRI) (N06AB) Tabelle 54: Marktpreise zur Wirkstoffgruppe Wiederaufnahmehemmer der selektiven ATC Wirkstoff Anz. OriginalHerst. präparat Gene rika N06AB03 Fluoxetin 24 Fluctin x 0,27-2,16 0,34 N06AB04 Citalopram 29 Cipramil x 0,30-6,05 0,46 N06AB05 Paroxetin 27 Seroxat x 0,25-1,39 0,39 N06AB06 Sertralin 31 Zoloft x 0,29-2,81 0,47 N06AB08 Fluvoxamin 10 Fevarin x 0,32-2,39 0,48 N06AB10 Escitalopram 0,60-2,10 1,20 Quelle: Preisspanne €/DDD Serotonin- 6 Cipralex Mittelw. € Berechnung IGES nach NVI (INSIGHT Health) Die Gruppe der selektiven Serotonin-Wiederaufnahmehemmer (SSRI), besteht hauptsächlich aus generisch verfügbaren Wirkstoffen (Tabelle 54). Citalopram ist der am häufigsten verordnete Wirkstoff dieser Gruppe. Die SSRI sind aufgrund größerer Ähnlichkeiten besser miteinander vergleichbar als die tricyclischen und anderen Antidepressiva. Die Preisspanne innerhalb der gesamten Gruppe der von 40 Herstellern angebotenen SSRI liegt zwischen 0,25-6,05 €/DDD bei einem Mittelwert von 0,51 € (Berechnung IGES nach NVI (INSIGHT Health)). Abbildung 51: Bewertungskriterien für die Wirkstoffgruppe der Selektiven SerotoninWiederaufnahmehemmer Kriterium Zulassungsbestimmungen Evidenzlage Einnahmekomfort Nebenwirkungen, Kinetik Öffentlichkeitswirksamkeit SSRI (N06AB) 132 IGES Kriterium SSRI (N06AB) Präferenzen von Ärzten und Patienten Quelle: IGES Zulassungsbestimmungen und Evidenzlage Die zugelassenen Anwendungsgebiete der SSRI sind weitgehend ähnlich, es bestehen jedoch auch Zusatzindikationen für einzelne Substanzen, weshalb keine vollständige Homogenität vorliegt. Die gewonnene Evidenz zeigt jedoch, dass die einzelnen Substanzen gut miteinander vergleichbar sind und ein Austausch aus medizinischer Sicht weniger problematisch ist als bei den tricyclischen Antidepressiva, da die für Serotonin selektiveren Substanzen andere Neurotransmitter weniger stark beeinflussen (Qaseem et al. 2008). Dennoch können Patienten unterschiedlich auf die verfügbaren Substanzen ansprechen, was in klinischen Studien aber nur schwer zu demonstrieren ist (Solai et al. 2001). Nebenwirkungen, Kinetik und Einnahmekomfort Die SSRI haben allgemein weniger Nebenwirkungen als die TCA, sind insgesamt besser verträglich und besitzen eine größere therapeutische Breite als die TCA (Aktories et al. 2009, S. 318 ff., Rief et al. 2009). Unterschiede bestehen jedoch auch hier zwischen den Substanzen, vornehmlich in der Höhe der Eintrittswahrscheinlichkeit bzw. der Intensität (Qaseem et al. 2008). So scheint beispielsweise das Suizidrisiko bei Jugendlichen unter der Behandlung mit verschiedenen SSRI nicht gleich hoch zu sein (Hetrick et al. 2007). Auch in der Kinetik bestehen Unterschiede zwischen den SSRI, insbesondere Fluoxetin fällt durch seine lange Wirkdauer auf. Eine einmal tägliche Einnahme ist jedoch bei allen Substanzen möglich. Durch die Umsetzung durch unterschiedliche Metabolisierungsenzyme besteht für die Substanzen ein unterschiedliches Interaktionspotential, besonders die neuere Substanz Escitalopram besitzt hier offenbar günstigere Wirkungen als die übrigen Stoffe. Die meisten der SSRI inhibieren das Enzym CYP2D6 und erhöhen damit das Potential für Interaktionen (Aktories et al. 2009, S. 318 ff.). Öffentlichkeitswirksamkeit und Präferenzen Da das Vertrauen von Patienten mit Depressionen und anderen psychischen Erkrankungen in ihre Therapie in der Regel sehr individuell ist und unbedingtes Vertrauen der Patienten zu ihren verordneten Arzneimitteln erforderlich ist, ist bei Einschränkung der Erstattung in der Öffentlichkeit mit starken Reaktionen vonseiten der Patienten und Therapeuten zu rechnen. IGES 133 Fazit Teilweise eingeschränkte Anwendungsgebiete. Medizinisch bewertet ist Substitutionspotential vorhanden, Unterschiede bestehen hauptsächlich hinsichtlich der Kinetik und der Häufigkeit von Nebenwirkungen. Negative Reaktionen sind zu erwarten, Risikoselektionspotential vorhanden und als wahrscheinlich effektiv zu bewerten 18.4 Andere Antidepressiva (N06AX) Tabelle 55: Marktpreise zur Wirkstoffgruppe der "Anderen Antidepressiva" Anz. OriginalHerst. präparat Gene rika Preisspanne €/DDD Mittelw. € ATC Wirkstoff N06AX02 Tryptophan 3 Ardeytropin x 0,98-1,90 1,10 N06AX03 Mianserin 7 Tolvin x 0,80-3,90 0,94 N06AX05 Trazodon 3 Thombran x 1,20-3,87 1,52 N06AX11 Mirtazapin 29 Remergil x 0,44-5,68 0,76 N06AX12 Bupropion 3 Elontril 0,91-3,53 2,30 N06AX16 Venlafaxin 30 Trevilor x 0,80-6,58 2,24 N06AX18 Reboxetin 3 x 1,60-3,29 1,97 N06AX21 Duloxetin 4 Cymbalta 2,06-6,12 2,93 N06AX22 Agomelatin* Edronax, Solvex Valdoxan *keine Marktdaten aus 2008 vorhanden Quelle: Berechnung IGES nach NVI (INSIGHT Health) Die Gruppe der "Anderen Antidepressiva" ist eine Art Sammelbecken für sehr unterschiedliche Arzneistoffe. Hierzu gehören sowohl ältere Substanzen als auch neue Entwicklungen mit verhältnismäßig spezifischen Wirkmechanismen (Tabelle 55). Der am häufigsten verordnete Wirkstoff ist Mirtazapin. Die "Anderen Antidepressiva" sind daher als ganze Gruppe nicht miteinander vergleichbar, so dass für die Analyse mehrere Untergruppen gebildet werden müssten, die dann jedoch auch mit schon beschriebenen Gruppen (wie z.B. den SSRI) verglichen werden könnten. Die Preisspanne innerhalb der gesamten Gruppe der von insgesamt 48 Herstellern erhältlichen Anderen Antidepressiva liegt zwischen 0,44-6,58 €/DDD bei einem Mittelwert von 1,57 € (Berechnung IGES nach NVI (INSIGHT Health)). 134 IGES Abbildung 52: Bewertungskriterien für die Wirkstoffgruppe der Anderen Antidepressiva Andere Antidepressiva (N06AX) Kriterium Zulassungsbestimmungen Evidenzlage Einnahmekomfort Nebenwirkungen, Kinetik Öffentlichkeitswirksamkeit Präferenzen von Ärzten und Patienten Quelle: IGES Zulassungsbestimmungen und Evidenzlage Meist besteht für die Wirkstoffe nur eine Zulassung zur Anwendung bei Depressionen, was allerdings über den tatsächlichen klinischen Einsatz wenig aussagt. Für einige der Stoffe bestehen auch Zulassungen für zusätzliche Indikationen. Bei den "Anderen Antidepressiva" handelt es sich insgesamt um eine sehr uneinheitliche Wirkstoffgruppe, die aber vor allem durch die untereinander besser vergleichbaren Wirkstoffe der Selektiven Serotonin-Noradrenalin-Wiederaufnahmehemmer (SSNRI) Venlafaxin und Duloxetin, sowie die älteren α2-Adrenozeptor-Antagonisten Mianserin und Mirtazapin geprägt wird. Letztere wirken eher psychomotorisch dämpfend, während die SSNRI ähnlich wie die SSRI antriebssteigernd wirken. In seinen Nutzenbewertungen zu verschiedenen Wirkstoffen aus der Gruppe der "Anderen Antidepressiva" konnte das IQWiG zwar Anhaltspunkte für die Überlegenheit einzelner Wirkstoffe in einigen Bereichen finden, jedoch war keine der Substanzen gemäß der berücksichtigten Studien den anderen eindeutig überlegen (IQWiG 2009d, IQWiG 2009e). Nebenwirkungen, Kinetik und Einnahmekomfort Insgesamt sind die Substanzen gekennzeichnet durch eine sehr geringe Toxizität, wobei das Nebenwirkungsspektrum sich nicht einheitlich darstellt (Aktories et al. 2009, S.318ff). Eine Einschränkung der Verfügbarkeit er- IGES 135 scheint hier insgesamt aufgrund der unterschiedlichen Wirk- und Nebenwirkungsprofile und der wenigen direkt miteinander vergleichbaren Substanzen wenig sinnvoll. Öffentlichkeitswirksamkeit und Präferenzen In der Wahrnehmung bei Ärzten und Patienten sind große Unterschiede vorhanden. Da das Vertrauen von Patienten mit Depressionen in ihre Therapie in der Regel sehr individuell ist und unbedingtes Vertrauen der Patienten zu ihren verordneten Arzneimitteln erforderlich ist, ist bei Einschränkung der Erstattung in der Öffentlichkeit mit starken Reaktionen vonseiten der Patienten und Therapeuten zu rechnen. Hieraus ergibt sich ein theoretisches großes Risikoselektionspotential. Fazit Uneinheitliche Wirkstoffgruppe mit zahlreichen Unterschieden bei den Zulassungen. Medizinisch bewertet ist kaum Substitutionspotential vorhanden. In der Wahrnehmung bei Ärzten und Patienten sind große Unterschiede vorhanden, starke negative Reaktionen sind zu erwarten. Hieraus ergibt sich ein Risikoselektionspotential, das aber kaum nutzbar sein dürfte. 18.5 Fazit Antidepressiva Ein direkter Vergleich und somit Austausch zwischen TCA und SSRI ist nicht möglich aufgrund der unterschiedlichen Wirk- und Nebenwirkungsprofile und der fehlenden sedierenden Wirkkomponente der SSRI, somit erschließt sich für beide Gruppen ein anderer Patientenkreis. In der Praxis wird häufig ein Wechsel zwischen den Therapiegruppen und innerhalb der Therapiegruppen vorgenommen, eine individuelle Einstellung der Patienten ist oft langwierig, ein Ansprechen auf den ersten eingesetzten Wirkstoff oft nicht gegeben, so dass die Substanzen in der Mehrheit als deutlich unterschiedliche Therapieoptionen und -alternativen wahrzunehmen sind. Die Nebenwirkung des bei bestimmten Patientengruppen beobachteten erhöhten Suizidrisikos ist insofern zu relativieren, dass es sowohl bei TCA als auch SSRI auftritt. Einzelne Indikationen sind oftmals nur für wenige Substanzen gegeben (Zwangsstörungen, Schmerzen, Migräne, Bulimie, Fatigue u.a.), so dass auch insofern eine Selektion ungünstig erscheint. Die für einige Substanzen nicht unübliche Anwendung bei Indikationen im Off-labelGebrauch als Alternative oder Ergänzung zu etablierten Therapien stellt eine Einschränkung zusätzlich in Frage. Die Wirksamkeit der Antidepressiva bei der Therapie der schweren Depression unterscheidet sich nicht signifikant, jedoch das Vorkommen von spezifischen Nebenwirkungen. Daher 136 IGES soll nach den aktuellen Leitlinienempfehlungen eine Substanzauswahl individuell nach angestrebter differenzierter Wirkung und günstigem Nebenwirkungsprofil erfolgen. Generell sind alle neueren Antidepressiva den Triund Tetrazyklika aufgrund der besseren Verträglichkeit und der niedrigeren Toxizität vorzuziehen. Bei Therapieresistenz ist der Wechsel auf eine Substanz mit anderem Wirkmechanismus zu empfehlen. Bei Kombinationstherapien sollten nicht mehrere Antidepressiva derselben Wirkgruppe verordnet werden. Bei zusätzlich bestehenden psychotischen Symptomen ist die Kombination mit einem atypischen Antipsychotikum empfehlenswert. Aufgrund fehlender anticholinerger, antihistaminerger und antiadrenerger Eigenschaften weisen SSRI in der Regel ein günstiges Nebenwirkungsprofil auf (DGPPN 2009). Die Gruppe der SSRI ließe sich unter Umständen beschränken, sofern mindestens alle Indikationsbereichen abgedeckt sind. Die klinisch wichtigsten Unterschiede zwischen den einzelnen SSRI betreffen die unterschiedliche Eliminationshalbwertszeiten der Wirkstoffe und ihrer aktiven Metabolite sowie das differierende Cytochrom-P450-Inhibitions- und damit Wechselwirkungspotenzial. IGES 137 Literaturverzeichnis Agelink MW, Kornischka J, Cordes J, Klimke A, Hauner H, Ziegler D (2006): Allgemeinmedizinische Aspekte der Therapie mit Antipsychotika der zweiten Generation, in: Deutsches Ärzteblatt 42(103), S. A2802-8. Aktories K, Förstermann U, Hofmann FB, Starke K (Hrsg.) (2009) Allgemeine und spezielle Pharmakologie und Toxikologie: Begründet von W. Forth, D. Henschler und W. Rummel. Elsevier GmbH, München Altmannsberger SHG, Paneitz A, Siegmund W, Kroemer HK (2001): Wirkung der AT1Rezeptorantagonisten, in: Pharmazie in unserer Zeit 4(30), S. 296-302. arznei-telegramm: Online-Volltextregister als Informationsquelle für verschiedene Wirkstoffe und Wirkstoffgruppen: http://www.arznei-telegramm.de/ Bleick A (2008): Renale Anämie - Epoetin-alfa-Biosimilar: Neue Option in der Anämietherapie, in: Dialyse aktuell 12, S. 520-521. Burgmann H (2006): Chinolone 2007-Ein Update, in: Antibiotika Monitor 6(22), S. 7990. Cuspidi C, Muiesan ML, Valagussa L, Salvetti M, Di Biagio C, Agabiti-Rosei E, et al.; CATCH study group (2002): Comparative effects of candesartan and enalapril on left ventricular hypertrophy in patients with essential hypertension: the Candesartan Assessment in the Treatment of Cardiac Hypertrophy (CATCH) study, in: Journal of Hypertension 20, S. 2293–2300. Deutsche Hochdruckliga (2009): Leitlinien zur Therapie der arteriellen Hypertonie in: Nieren- und Hochdruckkrankheiten 38(4), S. 137-188 DGPPN, BÄK, KBV, AWMF, AkdÄ, BPtK, BApK, DAGSHG, DEGAM, DGPM, DGPs, DGRW (Hrsg.) für die Leitliniengruppe Unipolare Depression: S3Leitlinie/ Nationale VersorgungsLeitlinie Unipolare Depression – Kurzfassung, 1. Auflage 2009. DGPPN, ÄZQ, AWMF - Berlin, Düsseldorf 2009. DGPPN, Deutsche Gesellschaft für Psychiatrie, Psychotherapie und Nervenheilkunde (Hrsg.) (2005): S3 Praxisleitlinien in Psychiatrie und Psychotherapie. Band 1 – Behandlungsleitlinie Schizophrenie. Steinkopff-Verlag, Darmstadt, November 2005. DIMDI, Deutsches Institut für Medizinische Dokumentation und Information: Amtliche Deutsche ATC-Klassifikation 2009 mit DDD; http://www.dimdi.de/dynamic/de/klassi/downloadcenter/atcddd/vorgaenger/versi on2009/atc-ddd-amtlich-2009.pdf (Zugriff: 19.10.09) Dominiak P (2003): Stellenwert der ACE-Hemmer in der Hochdrucktherapie, in: Pharmazie in unserer Zeit 1(32), S. 24-9. Elger CE et al.(2008): S3-Leitlinie der DGN, Erster epileptischer Anfall und Epilepsien im Erwachsenenalter, in: Diener HC, Putzki N et al. (Hrsg.): Leitlinien für Diagnostik und Therapie in der Neurologie; 4. überarbeitete Auflage 2008, Georg Thieme Verlag Stuttgart, S. 654 ff. EMEA (2009): Rasilez, Zusammenfassung des EPAR für die Öffentlichkeit; http://www.ema.europa.eu/humandocs/PDFs/EPAR/rasilez/H-780-de1.pdf (Zugriff am 28.01.10) 138 IGES Forst T (2001): Schnell wirkende Insulinanaloga, in: Pharmazie in unserer Zeit 2(30), S. 118-123 Francesconi M (2003): Aspekte kardiovaskulärer Wirkungen von Sulfonylharnstoffen, in: Journal für Kardiologie 10 Supplementum C, S. 6-10 Frenzel T (2006): Aggrenox nach Schlaganfall? Leitlinien und Standard, in: arzneitelegramm 37(2), S. 21-2. Griese N, Renner K, Schulz M (2006): Orale Antidiabetika richtig einnehmen, in: Pharmazeutische Zeitung 47 online; http://www.pharmazeutische-zeitung.de/ index.php?id=2285 (Zugriff am 15.12.2009). Grimmsmann T, Himmel W (2009) Inwieweit bilden definierte Tagesdosen (DDD) die tatsächlich verordneten Tagesdosen ab? Eine Analyse ambulanter Verordnungsdaten. Gesundheitswesen 71 (1-7) Gysling E (2002): pharma-kritik, Statine; http://www.infomed.org/pharma-kritik/pk09a02.html (Zugriff: 17.12.2009). Häussler B, Höer A, Hempel E, Klein S (2009) Arzneimittel-Atlas 2009. Der Arzneimittelverbrauch in der GKV. München: Urban und Vogel Hetrick S, Merry S, McKenzie J, Sindahl P, Proctor M (2007): Selective serotonin reuptake inhibitors (SSRIs) for depressive disorders in children and adolescents, in: Cochrane Database Syst Rev. (3) Article No.: CD004851. Hoffmann JC, Preiss JC, Autschbach F, Buhr HJ, Häuser W et al.(2008): S3-Leitlinie, Diagnostik und Therapie des Morbus Crohn, in: Zeitschrift für Gastroenterologie 46, S. 1094–1146. ifap (2009): Therapie-Leitfaden - Praxisproblem Hypertonie, Aktuelle Therapie der Hypertonie; http://www.ifap.de/leitfaeden/hypertonie/therapie/index.html (Zugriff am 17.12.2009). IQWiG (2006a): Kurzwirksame Insulinanaloga zur Behandlung des Diabetes mellitus Typ 2; http://www.iqwig.de/index.140.html (Zugriff am 28.01.10). IQWiG (2006b): Clopidogrel versus Acetylsalicylsäure in der Sekundärprophylaxe vaskulärer Erkrankungen; http://www.iqwig.de/index.356.html (Zugriff am 28.01.10). IQWiG (2009a): Langwirksame Insulinanaloga zur Behandlung des Diabetes mellitus Typ 2; http://www.iqwig.de/index.558.html (Zugriff am 28.01.10). IQWiG (2009b): Glitazone zur Behandlung des Diabetes mellitus Typ 2; http://www.iqwig.de/index.139.html (Zugriff am 28.01.10). IQWiG (2009c): Verschiedene antihypertensive Wirkstoffe als Therapie der ersten Wahl bei Patienten mit essentieller Hypertonie; http://www.iqwig.de/index.388.html (Zugriff am 28.01.10). IQWiG (2009d): Selektive Serotonin- und Noradrenalin-Wiederaufnahme-Hemmer (SNRI) zur Behandlung der Depression; http://www.iqwig.de/index.560.html (Zugriff am 28.01.10). IQWiG (2009e): Bupropion, Mirtazapin und Reboxetin bei der Behandlung der Depression; http://www.iqwig.de/index.582.html (Zugriff am 28.01.10). IGES 139 Junker U, Freynhagen R (2008): Tumorschmerzen, Hoch differenzierte Opioidtherapie, in: Deutsches Ärzteblatt 8(105), S. A384-6. Kaiser T (2005): Wie wirken Insulinanaloga in der Diabetes-Therapie? http://www.diabetesgate.de/diabetes/2005/insulinanaloga.php (Zugriff 08.12.09). Katzenschlager R, Sampaio C, Costa J, Lees A (2002): Anticholinergics for symptomatic management of Parkinson´s disease, in: Cochrane Database of Systematic Reviews, Issue 3. Art. No.: CD003735. Konta B, Frank W (2008): Die Therapie der Parkinsonerkrankung mit Dopaminagonisten, in: GMS Health Technology Assessment, Vol. 4, Doc05 KVBW, Kassenärztliche Vereinigung Baden-Württemberg (2009): Verordnungsforum 11, Schwerpunkt Praxisbesonderheiten für Heilmittel; http://www.kvbawue.de/uploads/tx_userkvbwpdfdownload/11Verordnungsforum .pdf, S. 19-23 (Zugriff 28.01.2010) Labenz J, Petersen K-U, Rösch W, Koelz H (2002): Auswahl von Protonenpumpeninhibitoren, in: Deutsches Ärzteblatt 99(37), S. A2425-9. sowie Kommentarantwort (2002b) in: Deutsches Ärzteblatt 100(9), S. A567-9. Leinmüller R (2007): Mircera, Therapie der renalen Anämie wird einfacher, in: Deutsches Ärzteblatt 50(104), S. A3500 Lode H, Stahlmann R, Skopnik H (2006): Rationaler Einsatz oraler Antibiotika bei Erwachsenen und Schulkindern (Lebensalter ab 6 Jahre), in: Chemotherapie Journal 5(15), S. 129-144. Matchar DB, McCrory DC, Orlando LA, Patel MR, Patel UD, Patwardhan MB, Powers B, Samsa GP, Gray RN (2008): Systematic review: comparative effectiveness of angiotensin-converting enzyme inhibitors and angiotensin II receptor blockers for treating essential hypertension, in: Ann Intern Med. 148(1), S. 16-29. Matthaei S, Häring HU (2008): Behandlung des Diabetes mellitus Typ2, DDG-Praxisleitlinie, in: Diabetologie 3 Suppl 2, S. S157–S161. Nast A, Kopp IB, Augustin M, Banditt KB, Boehncke WH et al. (2006): S3-Leitlinie zur Therapie der Psoriasis vulgaris, in: Journal der Deutschen Dermatologischen Gesellschaft S2(4), S. S1-S126. Nauck MA, Meininger G, Sheng D, Terranella L, Stein PP; Sitagliptin Study 024 Group (2007): Efficacy and safety of the dipeptidyl peptidase-4 inhibitor, sitagliptin, compared with the sulfonylurea, glipizide, in patients with type 2 diabetes inadequately controlled on metformin alone: a randomized, double-blind, noninferiority trial, in: Diabetes Obes Metab. 9(2), S. 194-205. Nieber K (2008): Renin-Inhibitoren, Neue Hoffnung für Patienten mit Hypertonie, in: Pharmazeutische Zeitung online; http://www.pharmazeutischezeitung.de/index.php?id=4490 (Zugriff 28.01.10). Oparil S, Williams D, Chrysant SG, Marbury TC, Neutel J (2001): Comparative efficacy of olmesartan, losartan, valsartan, and irbesartan in the control of essential hypertension, in: J Clin Hypertens (Greenwich) 3(5), S. 283-91, 318. Patscheke H (2003): Thrombozytenaggregationshemmer, in: Hämostaseologie 23(4), S. 181-5. 140 IGES Qaseem A, Snow V, Denberg TD, Forciea MA, Owens DK; the Clinical Efficacy Assessment Subcommittee of the American College of Physicians (2008): Using Second-Generation Antidepressants to Treat Depressive Disorders: A Clinical Practice Guideline from the American College of Physicians, in: Ann Intern Med. 149, S. 725-33. Reichmann H, Engfer A, Jost W, Sommer U, Verspohl E (2000): Morbus Parkinson Nebenwirkungs- und Interaktionsdatenbank, URN:urn:nbn:de:0007-21663019 (Zugriff am 05.01.10) Rief W, Nestoriuc Y, von Lilienfeld-Toal A, Dogan I, Schreiber F et al. (2009): Differences in adverse effect reporting in placebo groups in SSRI and tricyclic antidepressant trials: a systematic review and meta-analysis, in: Drug Safety 32(11), S. 1041-56. Rudolph H (2004): Sind wirklich alle Statine gleich und einfach austauschbar?, in: Ärztezeitung online; http://www.aerztezeitung.de/kongresse/ kongresse2004/ muenchen_kardiologen/?sid=327905 (Zugriff: 7.12.2009). Schubert-Zsilavecz M, Stark H (2005): Protoneninhibitoren. Strukturen, Mechanismen und Entwicklungen, in: Pharmazie in unserer Zeit 34(3), S. 194-9. Siebenand S (2009): Antidiabetika, Heiße Eisen im Feuer, in: Pharmazeutische Zeitung 154(50), S. 24-5. Singh JA, Christensen R, Wells GA, Suarez-Almazor ME, Buchbinder R, et al. (2009): Biologics for rheumatoid arthritis: an overview of Cochrane reviews, in: Cochrane Database of Systematic Reviews, Issue 4. Art. No.: CD007848. Solai LK, Mulsant BH, Pollock BG (2001): Selective serotonin reuptake inhibitors for late-life depression: a comparative review, in: Drugs Aging 18(5), S. 355-68. Stojilikovic L, Behnia R (2007): Role of renin angiotensin system inhibitors in cardiovascular and renal protection: a lesson from clinical trials, in: Curr Pharm Des. 13(13), S. 1335-45. Vana G (2005): Fühlen sich Patienten mit Asthma, Diabetes Typ II und Herzkreislauferkrankungen ausreichend informiert?; http://www.patientenanwalt.com (Zugriff am 15.12.2009). Winkelmayer WC, Setoguchi S, Levin R, Solomon DH (2008): Comparison of cardiovascular outcomes in elderly patients with diabetes who initiated rosiglitazone vs. pioglitazone therapy, in: Arch Intern Med. 168(21), S. 2368-75. Yusuf S, Teo KK, Pogue J, Dyal L, Copland I, Schumacher H, Dagenais G, Sleight P, Anderson C et al; ONTARGET Investigators (2008): Telmisartan, ramipril, or both in patients at high risk for vascular events, in: N Engl J Med 358(15), S. 1547-59. Epub 2008 Mar 31. Zylka-Menhorn V (2004): Cholesterinsenkung mit Statinen, Nicht über einen Kamm scheren, in: Deutsches Ärzteblatt 13(101), S. A830-2.