Chondrogene Knochentumoren
Werbung

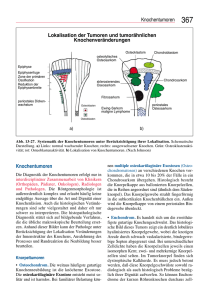
Knochentumoren © Schattauer 2009 Chondrogene Knochentumoren M. Tonak; A. A. Kurth Klinik für Orthopädie und orthopädische Chirurgie, Universitätsmedizin, Johannes Gutenberg Universität, Mainz Schlüsselwörter Keywords Knorpeltumoren, Chondrosarkome Cartilagenous tumours, chondrosarcomas Zusammenfassung Summary Chondrogene Tumoren sind unter den Tumoren des Skeletts eine der häufigsten Vertreter – insgesamt aber relativ selten. Die Mehrzahl ist gutartig oder niedrig maligne. Einige Chondrosarkome weisen jedoch ein hoch aggressives Verhalten auf. Für die Diagnosestellung ist die Synopse aus Klinik, Radiologie und Histologie unerlässlich. Periphere gutartige Knorpeltumoren ohne klinische Symptomatik bedürfen meist keiner Therapie. Bei der Behandlung von Chondrosarkomen steht die chirurgische Kontrolle des Lokalrezidivs im Vordergrund. Daneben gibt es unter kurativer Intention bisher keine zufrieden stellenden auf Chemotherapeutika oder Strahlenapplikation basierenden Therapieoptionen. Momentan gilt es, die Ergebnisse von Studien mit neuen Chemotherapeutika und monoklonalen Antikörpern abzuwarten. Neue Therapieansätze mit Bisphosphonaten weisen in vitro vielversprechende Ergebnisse auf, haben jedoch aus den Laboratorien in die klinische Anwendung noch einen langen Weg vor sich. Zur Beschleunigung der Diagnosestellung und Optimierung der Therapie sollten die Diagnostik und die Behandlung chondrogener Tumoren in einem Zentrum für Knochentumoren mit interdisziplinärem Setting erfolgen. Cartilagenous tumours of the skeleton are generally very unusual. Compared to other bone tumours they are one of the most common. Most of them are benign or of low-grade malignancy. However some subtypes of chondrosarcomas show a highly aggressive behaviour. It is important that good clinical, radiological and histological correlations are provided to make an accurate diagnosis in a cartilagenous tumour. Benign cartilaginous tumours without clinical appearance usually need no special treatment. Surgical management of a local recurrence is in the main focus of treatment. Until now there are no appropriate alternatives for therapy based on X-rays or conventional chemotherapeutics. Investigators are currently awaiting results of therapies with new chemotherapeutics and monoclonal antibodies. Novel therapies with bisphosphonates show in vitro hopeful results. However it will be a long way from the laboratories to clinical application. Finally, patients should be evaluated and managed in the context of a multidisciplinary setting to promote timeliness of care and optimize treatment. Korrespondenzadresse Dr. med. M. Tonak Klinik für Orthopädie und orthopädische Chirurgie Universitätsmedizin Johannes Gutenberg Universität Mainz Langenbeckstr. 1, 55131 Mainz E-Mail: [email protected] Cartilagenous bone tumours Osteologie 2009; 18: 191–199 eingereicht: 10. August 2009 angenommen: 19. August 2009 Chondrogene Tumoren sind unter den primären Tumoren des Skeletts eine der häufigsten Vertreter – insgesamt aber verhältnismäßig selten. Gutartige Knorpeltumoren stellen die Mehrzahl der benignen Knochentumoren und weisen vielfältige Erscheinungsformen auf (씰Tab. 1). Die Chondro- sarkome repräsentieren nach dem Osteosarkom den zweithäufigsten primären malignen Knochentumor. Unter differenzialdiagnostischen Gesichtspunkten gestaltet sich besonders die Abgrenzung von benignen Enchondromen und Osteochondromen zu GI- bzw. sekundär entarteten Chondrosarkomen schwierig. Zur präzisen Diagnose ist daher das Zusammenspiel aller Aspekte der Anamnese, klinischen, radiologischen und histologischen Beurteilung von entscheidender Bedeutung. Molekularbiologische Identifizierungsmethoden sind etabliert, haben aber im diagnostischen Alltag nur ergänzenden Wert. Benigne Knorpeltumoren Enchondrom Das hylalinknorpelige differenzierte Enchondrom ist der häufigste Knorpel- und zweithäufigste Knochentumor gutartiger Dignität und stellt den häufigsten Tumor der Finger dar. Es weist eine intramedulläre Lage in den metaphysären Abschnitten der vorwiegend kleinen aber auch langen Röhrenknochen auf (1) (씰Abb. 1). Die meisten Fälle werden in der 3.-4. Lebensdekade diagnostiziert. Ein Auftreten ist jedoch in jedem Lebensalter möglich. Eine geschlechterspezifische Prädominanz gibt es nicht. Es wird vermutet, dass sich Enchondrome aus Zonen mit dysplastischen Chondrozyten der Wachstumsplatten entwickeln. Diese Areale sind nicht in der Lage, die normale enchondrale Ossifikation zu durchlaufen. Stattdessen verbleiben sie in den Metaphysen und wandern während des Längenwachstums Richtung Diaphysen. Liegen diese Zonen dysplastischer Knorpelzellen intramedullär, spricht man von Enchondromen. Sind sie außerhalb der Kortikalis lokalisiert, werden sie als periostale oder juxtakortikale Chondrome bezeichnet. Schließlich können dysplastische Knorpelinseln im Weichteilgewebe als Weichteilchondrome oder in Gelenken, Schleimbeuteln und Sehnenscheiden im Rahmen einer synovialen Chondromatose gefunden werden (씰Abb. 2). Enchondrome treten klinisch nur selten in Erscheinung, meistens im Rahmen pathologischer Frakturen der Finger. Daher handelt es sich bei Enchondromen häufig um radioOsteologie 3/2009 Downloaded from www.osteologie-journal.de on 2017-08-20 | IP: 88.99.70.242 For personal or educational use only. No other uses without permission. All rights reserved. 191 192 M. Tonak; A. A. Kurth: Chondrogene Knochentumoren Tab. 1 Auflistung der bekannten Knorpeltumoren. Auf die fettgedruckten Tumoren wird im Text ausführlich eingegangen. Die übrigen Tumoren stellen absolute Raritäten dar. benigne maligne Enchondrome Chondrosarkome ● periostale Chondrome ● Enchondromatosen – klassische (konventionelle) ● Weichteilchondrome – dedifferenzierte Chondrosarkome (Grad IV) ● synoviale Chondromatose – Klarzellchondrosarkome ● primäre Chondrosarkome – mesenchymale Chondrosarkome Osteochondrome (kartilaginäre Exostose) ● – periostale Chondrosarkome multiple hereditäre kartilaginäre Exostosen – synoviale Chondrosarkome Chondroblastome (Codman Tumor) – extraskelettale Chondrosarkome Chondromyxoidfibrome ● logische Zufallsbefunde, woraus wiederum das Fehlen von Daten zur genauen Inzidenz resultiert. Die schwerwiegendste Komplikation besteht in einer malignen Transformation zu Chondrosarkomen. Bei solitären Enchondromen ist eine Entartung selten, vorzugsweise in den langen Röhren- oder Plattenknochen und nahezu nie in den kurzen Röhrenknochen zu finden. Der schmerzhafte knorpelige Tumor der langen Röhrenknochen ohne Fraktur bei zuvor symptomfreien Patienten ist im Sinne eines Chondrosarkoms malignitätsverdächtig. sekundäre Chondrosarkome Häufig genügen konventionelle Röntgenaufnahmen, um Enchondrome zu identifizieren. Das röntgenologische Erscheinungsbild entspricht typischerweise Lodwick-IA-Läsionen und ist in kleinen Röhrenknochen meist transparent, während Enchondrome der langen Röhrenknochen häufig Verkalkungen zeigen (씰Abb. 3 und 4). Die Verkalkungen der Tumormatrix stellen sich als Ring-, Punkt- und Bogenformen dar, so dass man von einer so genannten „Popkornstruktur“ spricht. Enchondrome der langen Röhrenknochen sind scharf begrenzt, ohne die Kortikalis zu tangieren. Dagegen wird regelmäßig ein expansives Wachstum mit Knochenauftreibungen bei Befall des Handskeletts beobachtet (씰Abb. 5). Die Ausdünnung der Kortika- lis („scalopping“) kann Papierstärke erreichen, was zu den mit Enchondromen der kleinen Röhrenknochen assoziierten pathologischen Frakturen führen kann. CT und MRT erweisen sich zur Beurteilung des Tumorausmaßes und der genauen Grenzen – besonders in den wenig bis gar nicht mit Trabekeln durchzogenen Diaphysen – als sinnvoll. Die häufig lobuläre Struktur von Enchondromen ist kernspintomografisch gut erkennbar. Wie fast alle kartilaginären und fibrösen Strukturen weisen Enchondrome eine mittlere Signalintensität in den T1- und eine hohe Intensität in den T2-gewichteten Sequenzen auf. Die CT-Diagnostik besitzt vor allem bei der Differenzierung zwischen Enchondrom und G1-Chondrosarkom ihren Stellenwert, um das entscheidende Merkmal, die Kortikalisdestruktion, zu beurteilen. Liegt lediglich eine Ausdünnung der Kortikalis vor, empfiehlt sich die kurzfristige CT-Verlaufkontrolle. Szintigrafisch weisen Enchondrome wie die Chondrosarkome eine erhöhte Traceranreicherung auf, weshalb die Skelettszintigrafie nicht zur Differenzierung der Tumorentität und Dignität geeignet ist. Mikroskopisch zeigt sich lobulierter hyaliner Knorpel mit der typischen blau-grauen Färbung und einer soliden relativ kollagenarmen Matrix. Die Chondrozyten liegen in unterschiedlicher Anzahl immer in Lakunen. Die Enchondrome der langen Röhrenknochen sind generell zellarm. Die Knorpelhaufen liegen multizentrisch im Knochenmark, jedoch ohne die knöchernen Trabekel zu tangieren. Häufig werden die Knorpelhaufen von knöchernen Trabekeln eingeschlossen, was im Röntgenbild als kalzifizierter Ring imponiert. Abb. 2 Abb. 1 Chondrosarkome – Enchondrome: Prädilektionsstellen Osteologie 3/2009 Synoviale Enchondromatose des Kniegelenks © Schattauer 2009 Downloaded from www.osteologie-journal.de on 2017-08-20 | IP: 88.99.70.242 For personal or educational use only. No other uses without permission. All rights reserved. M. Tonak; A. A. Kurth: Chondrogene Knochentumoren Im Gegensatz zu den langen Röhrenknochen sind die Enchondrome der Phalangen relativ zellreich. Die Zellen sind häufig vergrößert und haben hyperchromatische Kerne, Doppelkerne oder sichtbare Nucleoli. Diese Merkmale würden in langen Röhrenknochen für ein Chondrosarkom sprechen. Bei den phalangealen Enchondromen stellen sie jedoch keine Malignitätskriterien dar. Diese Tatsache betont die außerordentliche Notwendigkeit, den histologischen Befund immer im Kontext mit der Lokalisation, radiologischen Kriterien und der klinischen Symptomatik zu beurteilen. Generell sind klinisch unauffällige Enchondrome benigne Tumoren, die keiner Behandlung bedürfen. Die Kürettage von Enchondromen ohne klinische und radiologische Malignitätskriterien wird heutzutage als obsolet angesehen, da eine eindeutige histopathologische Differenzierung zu den G1-Chondrosarkomen wegen ihrer niedrigen Proliferationsrate und geringen ZellAtypien häufig nicht vorgenommen werden kann (2). In unserer klinischen Praxis werden wir häufig mit dem ausdrücklichen Wunsch einer chirurgischen Ausräumung der Enchondrome trotz fehlender Malignitätskriterien konfrontiert. Eine von uns empfohlene Verlaufskontrolle nach 6 Monaten wird regelmäßig als zu belastend empfunden. Die ausführliche Aufklärung der Patienten über den fraglichen Nutzen und das Risiko der Operation im Verhältnis zur sehr geringen Wahrscheinlichkeit einer Entartung, führt jedoch oft nicht zur Einsicht, von der Operation abzusehen. Enchondromatosen Die sehr seltenen nicht hereditären Enchondromatosen sind durch das multifokale Wachstum von Enchondromen und periostalen Chondromen charakterisiert. Der bei dieser Erkrankung oft vorhandene Befall nur einer Körperhälfte wird nach seinem Erstbeschreiber als „Morbus Ollier“ bezeichnet (씰Abb. 5). Prädilektionsstellen sind Ilium, Femur und Tibia metadiaphysär, gefolgt von Phalangen, Metakarpalen und Metatarsalen. Die Erkrankung beginnt bereits in der Kindheit und führt zu ausgeprägten Skelettdeformierungen. Histologisch finden sich lobulierte, hyperzelluläre Knorpeltumoren mit Abb. 4 Großes Enchondrom der Tibia mit popkornartigen Verkalkungen und scharfer Begrenzung ohne Durchbrechung der Kortikalis Abb. 3 Pathologische Kleinfinger-Endgliedfraktur bei Enchondrom, das Scalopping ist an der noch intakten dorsalen Kortikalis erkennbar vergrößerten oder doppelten Kernen, was isoliert betrachtet Chondrosarkome vermuten lässt. Daher ist die Zusammenschau des histologischen Bilds mit klinischen und radiologischen Daten entscheidend für die Diagnosestellung. Dies muss insbesondere unter Berücksichtigung des hohen Risikos einer Chondrosarkomentwicklung von 10–30 % bei Enchondromatosen gelten (3). Diagnostisch wegweisend für die maligne Entartung sind Schmerzen, radiologisch das Auftreten von Kortikalisdestruktionen mit Tumorausbreitung in die Weichteilumgebung und histologisch die Präsenz von myxoider Matrix sowie eine Infiltration der Markräume mit Destruktion der SpongiosaTrabekel. Das gleichzeitige Auftreten einer Enchondromatose mit einer Weichteilhämangiose wird als „Maffucci-Syndrom“ bezeichnet. Die Weichteilhämangiome können disseminiert in Haut und Unterhaut auftreten. In den vaskulären Malformationen auftretende Phle- Abb. 5 Multipler Enchondrombefall des Kleinfingers mit kolbigen Auftreibungen bei einem Patienten mit M. Ollier © Schattauer 2009 Osteologie 3/2009 Downloaded from www.osteologie-journal.de on 2017-08-20 | IP: 88.99.70.242 For personal or educational use only. No other uses without permission. All rights reserved. 193 194 M. Tonak; A. A. Kurth: Chondrogene Knochentumoren drängung von angrenzenden Nerven, Sehnen, Gefäßen oder Knochen mit entsprechender Symptomatik indiziert. Insbesondere vor dem Wachstumsabschluss ist ein Rezidiv meist vorprogrammiert (씰Abb. 8). Chondroblastom Abb. 6 Verteilungsmuster von solitären und multiplen Osteochondromen (kartilaginäre Exostosen) boliten führen für gewöhnlich zur Entdeckung der Hämangiome. Die Chondrome verhalten sich beim Maffuci-Syndrom hinsichtlich Verteilung, Entartungsrisiko, klinischem, radiologischem und histologischem Erscheinungsbild analog der isolierten Enchondromatose. Osteochondrom (kartilaginäre Exostose) Die relativ häufigen Osteochondrome (OC) stellen genau genommen keine echten Neoplasien sondern vielmehr das Produkt von dislozierten Wachstumsfugenanteilen der Knochenoberfläche dar. Dies erklärt auch die typische Größenprogredienz während des Abb. 7 Typisches gestieltes (medial) und breitbasiges (lateral) Osteochondrom des Humerus Längenwachstums, die mit Wachstumsabschluss sistiert (4). OC können an jedem Knochen mit enchondraler Ossifikation auftreten. Die prädominanten Lokalisationen sind in 씰Abb. 6 dargestellt. Typischerweise präsentieren die palpablen oder sichtbaren Tumoren im Röntgenbild einen breitbasigen oder sessilen aus dem Markraum herauskommenden knöchernen Anteil (씰Abb. 7). Die oft wie ein Pilzkopf aufsitzende bis zu 2 cm starke Knorpelkappe lässt sich mit der MRT gut beurteilen. Treten OC multifokal auf, liegt meist eine hereditäre multiple kartilaginäre Exostosen-Erkrankung vor, die autosomal dominant vererbt wird. Aufgrund der geringen Entartungswahrscheinlichkeit ist eine prophylaktische Resektion der Tumoren nur in Ausfällen bei Ver- Nahezu pathognomonisch sind die sehr seltenen Chondroblastome epiphysär oder epimetaphysär in den langen Röhren bevorzugt männlicher Patienten im 2. Lebensjahrzehnt lokalisiert. Radiologisch kennzeichnend ist die scharf begrenzte Osteolyse oft mit amorpher Matrixverkalkung und Epiphysenfugen-Beteiligung (씰Abb. 9). Kernspintomografisch zeigen der gesamte Tumor oder häufiger nur Teile im T2-gewichteten SE-Bild eine hohe Signalintensität. Rundlich, ovale, scharf begrenzte Zellen mit schwach eosinophilem Zytoplasma eingebettet in eine Matrix mit geringen hyalinen Anteilen und chondroosteoidem Charakter treten histologisch beim Chondroblastom auf. Areale mit sekundären aneurysmatischen Knochenzysten zeigen sich nicht selten, ebenso wie Riesenzellen – allerdings mit deutlich geringer Kernzahl verglichen mit dem ebenfalls epimetaphysär gelegenen Riesenzelltumor. Trotz des immunhistochemisch fehlenden Nachweises von Kollagen II wird das Chondroblastom zu den knorpelbildenden Tumoren gezählt. Therapeutisch erfolgt üblicherweise die sorgfältige Kürettage und Auffüllung mit Knochenspänen oder Zement. Rezidive sind in ca. 20 % möglich und Lungenmetastasen werden in Einzelfällen beschrieben (5, 6). Chondromyxoidfibrom Abb. 8 Großes Rezidiv eines Osteochondroms des Humerus in situ Das Chondromyxoidfibrom (CMF) ist ein seltener, langsam wachsender, leichte Schmerzen verursachender gutartiger Tumor, der ca. 1–3 % aller benignen Knochentumore ausmacht und in rund 80 % in der 2. bis 3. Lebensdekade auftritt. Bevorzugte Lokalisation des metadiaphysär gelegenen CMF ist die proximale Tibia (38 %) gefolgt von distalem und proximalem Femur (14 %). Talus (11 %), tarsale Phalangen (11 %) und Becken (9 %) sind weitere Prädilektionsstellen (7). Osteologie 3/2009 © Schattauer 2009 Downloaded from www.osteologie-journal.de on 2017-08-20 | IP: 88.99.70.242 For personal or educational use only. No other uses without permission. All rights reserved. M. Tonak; A. A. Kurth: Chondrogene Knochentumoren Für die radiodiagnostische Aufarbeitung wird das CMF im konventionellen Röntgenbild ausreichend genau abgebildet. Typisch ist die exzentrische Lage in den langen Röhrenknochen, während in kleinen Röhrenknochen der gesamte Durchmesser ausgefüllt wird. Nahezu alle CMF sind osteolytisch, weisen häufig einen nicht immer vollständigen Sklerosesaum und selten (<10 %) knorpeltumortypische ring- oder bogenförmige Matrixverkalkungen auf. In der MRT stellt sich das CMF in den T1-gewichteten Sequenzen muskelisointens und in der T2-Wichtung meist signalintensiv jedoch inhomogen dar. Histologisch findet sich ein lobulärer Aufbau mit fibromyxoider Matrix. Hyaliner Knorpel tritt nur in ca. 20 % der Fälle auf. Die Therapie besteht in einer sorgfältigen Kürretage oder wegen der ca. 20 %-igen Rezidivrate in einer lokalen Exzision. Differenzialdiagnostisch bietet das CMF wenige Charakteristika. Aneurysmatische Knochenzyste, nichtossifizierendes Fibrom (NOF) aber auch Chondrosarkom und -blastom müssen anhand der Korrelation von radiologischen und histologischen Kriterien abgegrenzt werden. Chondrosarkome Das als malignes Pendant des Enchondroms aufzufassende Chondrosarkom (CS) stellt nach dem Osteosarkom den zweithäufigsten primär malignen Knochentumor mit einer Inzidenz von 10/1 000 000 Einwohnern/Jahr dar. Etwa 80 % der malignen Korpeltumoren sind sogenannte klassische CS und kommen bevorzugt an Becken, Femur und Schultergürtel vor, finden sich aber auch an Rippen und Wirbelkörpern. An den Phalangen stellen CS eine absolute Rarität dar, obwohl sie die Prädilektionsstellen für Enchondrome sind (씰Abb. 1). Es findet sich eine leichte Prädominanz des männlichen Geschlechts und ein Altersgipfel in der 5. bis 7. Lebensdekade. Treten CS bei Kindern und Jugendlichen auf, zeigen sie häufiger einen aggressiven Krankheitsverlauf (씰Abb. 10). Klinisch und anamnestisch ist der Schmerz vor der Schwellung das häufigste Symptom. Pathologische Frakturen treten etwas häufiger als bei den Enchondromen auf, sind jedoch insgesamt eher selten. Den bildgebenden Verfahren kommt bei der Diagnosestellung eine überragende Bedeutung zu, da vor allem niedrigmaligne CS sehr inhomogen sind und in ihrem histologischen Bild in weiten Anteilen nicht von Enchondromen zu unterscheiden sein können (4). Das Röntgenbild liefert Informationen über die radiologische Morphologie inklusive Kortikalis-Destruktionen, extraossärer Tumorkomponenten, endostale Kompaktaarrodierung (Scalopping), Kalzifizierung und periostaler Reaktion wie z. B. Spiculae (씰Abb. 11). Letztere sind vermehrt mit höhergradigen schnell wachsenden CS assoziiert. Heterogene Osteolysen, die allen drei Lodwick-Typen entsprechen, können beobachtet werden. CS sind tendenziell groß und weisen bei Diagnose röntgenologisch eine durchschnittliche Ausdehnung von zirka 10 cm auf (8). Sie sind meist unscharf begrenzt. Dagegen weisen Enchondrome eine scharfe Abgrenzung zum umgebenden Knochengewebe auf und erreichen sehr selten mit CS vergleichbare Ausdehnungen. Das Muster der Matrixverkalkungen lässt sich vor allem in der CT erkennen und stellt ebenfalls einen wichtigen Parameter zur Beurteilung der Dignität dar. Enchondrome zeigen meist eine homogene Mineralisation über den gesamten Tumor. Höher maligne, schnell wachsende CS weisen oft kleine punktförmige Verkalkungen auf. Bei ihnen überwiegt die osteolytische Komponente. Bei CS mit niedrigem Malignitätsgrad finden sich auf Grund des langsamen Wachstums eher ring-, bogenförmige und zusammenhängende schollige Verkalkungen (4). Bezüglich der Beurteilung der intra- und extraossären Tumorausdehnung ist die MRT Abb. 9 Seltene Lokalisation eines Chondroblastoms der distalen Tibiaepiphyse; typisch ist die epiphysäre Lage der CT überlegen. Kernspintomografisch ergibt sich eine schärfere Demarkierung zwischen tumorösem und normalem Knochen. Die Einmauerung oder Verdrängung von Nerven- und Gefäßstrukturen sowie das Einbrechen in Gelenke können besser beurteilt werden. Aufgrund des hohen Wassergehalts der chondroiden Matrix zeigen die CS eine Abb. 10 Chondrosarkom des Beckens mit Exulzerationen und desaströsen Ausmaßen bei einem 18-jährigen Patienten mit Migrationshintergrund © Schattauer 2009 Osteologie 3/2009 Downloaded from www.osteologie-journal.de on 2017-08-20 | IP: 88.99.70.242 For personal or educational use only. No other uses without permission. All rights reserved. 195 196 M. Tonak; A. A. Kurth: Chondrogene Knochentumoren Abb. 12 Dedifferenziertes Chondrosarkom des proximalen Femurs im Schnitt; charakteristisch ist die große extraossäre Komponente sowie das Nebeneinander von niedrigmalignen (knorpelig) und hochmalignen (myxoid) Anteilen Abb. 11 Grad-II-Chondrosarkom des linken Os ilium eines 22-jährigen Patienten mit deutlicher Kortikalisdestruktion und knochenübergreifendem Wachstum a) Beckenübersicht b) CT transversal. hohe Signalintensität in den T2, fettgesättigten und kontrastmittelverstärkten Sequenzen. Bei zunehmender Entdifferenzierung findet sich dabei ein inhomogenes Bild aufgrund von nekrotischen Tumorarealen und der Abnahme der Matrixanteile (9). Histopathologisch gelten ein Markraum ausfüllendes Wachstum mit Zerstörung des trabekulären Knochens, Nekrosen und muzinöses Tumormaterial ohne Zellen als beweisend für einen malignen Charakter des Knorpeltumors (10). Weitere Malignitätskriterien sind hyperzelluläre Areale und eine hohe Anzahl von Zellen mit Doppelkernen oder erkennbaren Kernkörperchen. Diese Befunde finden sich jedoch auch oft bei Enchondromen, vor allem der Phalangen. Dedifferenziertes Chondrosarkom Die hochmalignen, auch als Grad-IV-Chondrosarkome bezeichneten dedifferenzierten Chondrosarkome machen rund 10% aller CS aus. Die betroffenen Patienten sind im Schnitt 10 Jahre älter als Patienten mit klassischen CS. Vorzugsweise sind dedifferenzierte CS im Bereich des Beckengürtels und seltener im Schulterbereich lokalisiert. Die Terminologie ist kritisch betrachtet nicht korrekt, da die vorliegenden Zellen nicht dedifferenziert sind. Allerdings ist der Begriff dedifferenziertes CS historisch bereits fest in der Literatur verankert und betont die klinische und histopathologische Sonderstellung dieser Form des CS. Lang anhaltende Schmerzanamnese, Schwellung und pathologische Frakturen sind die typischen klinischen Symptome. Klassischerweise zeigt das dedifferenzierte CS in der Bildgebung ein zweigeteiltes Muster auf. Neben den niedrigmalignen Tumorkomponenten mit geordneten ringförmigen Kalzifikationen und Scalopping-Phänomen zeigen sich dedifferenzierte Anteile mit ausgeprägten Kortikalisdestruktionen und großen extraossären Weichteilkomponenten kennzeichnend für das aggressive osteolytische Wachstum. Die unterschiedlichen Komponenten lassen sich meist kernspintomografisch gut darstellen (11). Der radiologische Befund korreliert histologisch mit der Kombination aus meist großen Anteilen eines Enchondroms oder GradI-CS und kleineren High-grade-Sarkomarealen. Typischerweise bestehen beide Tumorkomponenten nebeneinander und sind nicht miteinander vermengt (씰Abb. 12). Die spindelzelligen High-grade-Areale können dem histologischen Bild eines Fibrosarkoms, eines konventionellen Osteosarkoms, eines pleomorphen (MFH-ähnlich)-Sarkoms und deutlich seltener auch Rhabdomyosarkomen entsprechen (6). Da das gewonnene Biopsiematerial oft nicht repräsentativ ist, kommt der Synopse aus radiologischem und histologischem Befund entscheidende Bedeutung für die Diagnosestellung zu (4). Klarzellchondrosarkom Die Klarzellchondrosarkome stellen mit 2% die seltenste Entität aller CS dar. Sie werden bezüglich ihrer Malignität am ehesten den G-II-CS zugeordnet. Durch ihre bevorzugte Lokalisation an den Epiphysen des proximalen Femurs und den Altersgipfel um das 40. Lebensjahr lassen sie sich bereits anamnestisch und klinisch von den klassischen CS differenzieren. Weitere Merkmale sind die männliche Prädominanz und der unterschwellige, teilweise Jahre bestehende Schmerz. Radiologisch treten beim Klarzellchondrosarkom Verkalkungen eher selten in Erscheinung. Expansive Osteolysen mit scharfer Begrenzung und gelegentlichem Sklerosesaum finden sich dagegen regelhaft. Osteologie 3/2009 © Schattauer 2009 Downloaded from www.osteologie-journal.de on 2017-08-20 | IP: 88.99.70.242 For personal or educational use only. No other uses without permission. All rights reserved. M. Tonak; A. A. Kurth: Chondrogene Knochentumoren Wie die Terminologie bereits vermuten lässt, liegen histologisch in einem biphasischen Bild Anteile mit charakteristischen großen scharf begrenzten Zellen mit wasserhellem bis leicht eosinophilem Zytoplasma und deutlich erkennbaren rundlichen Kernen neben Arealen mit klassischer ChondrosarkomMorphologie vor (12, 13). Neugebildete Knochenbälkchen und osteoklastäre Riesenzellen zwischen den Tumorzellen lassen differenzialdiagnostisch an Osteosarkome und Chondroblastome denken, wobei Tumorlokalisation, das radiologische Erscheinungsbild und das jüngere Erkrankungsalter eine Differenzierung zum Klarzellchondrosarkom ermöglichen. Mesenchymales Chondrosarkom Mesenchymale Chondrosarkome sind sehr seltene hochmaligne Tumoren die im 2. und 3. Lebensjahrzehnt auftreten. Sie sind bevorzugt am Stammskelett an Kiefer, Rippen und Becken lokalisiert, können aber auch alle anderen Knochen befallen. In bis zu einem Drittel finden sich auch extraskelettale Manifestationen. Radiologisch weisen die Tumoren osteolytische Destruktionen auf. Histologisch stellen mesenchymale CS einen weiteren Knorpeltumor mit biphasischem Aufbau dar. Neben kleinen Arealen hyalinen Knorpels mit allenfalls geringen Atypien finden sich undifferenzierte kleine, rundliche Zellen, die teilweise an ein Ewing-Sarkome erinnern lassen (14). Neben dem jüngeren Manifestationsalter des Ewing-Sarkoms lassen sich die beiden Tumorentitäten molekularbiogisch durch eine FISH-Analyse unterscheiden. Die Prognose der Patienten mit mesenchymalen Chondrosarkomen ist schwer vorhersagbar. Einige Patienten präsentieren eine disseminierte Metastasierung und sterben früh. Andere weisen dagegen einen symptomarmen Verlauf über Jahrzehnte auf. Sekundäre Chondrosarkome Die sekundären Chondrosarkome entstehen aus einem benignen Vorläufer oder in sehr seltenen Fällen postradiogen im Rahmen der strahlentherapeutischen Behandlung einer anderen Tumorerkrankung. Solitäre Enchondrome weisen ein Entartungsrisiko von weni- Abb. 13 Endoprothetische Versorgung mit proximalem Femurersatz nach Resektion eines Chondrosarkoms ger als 1 % auf. Bei multifokalem Auftreten (Enchondromatosen, M. Ollier, Maffuci-Syndrom) liegt die Wahrscheinlichkeit einer malignen Transformation mit 10–30 % jedoch deutlich höher (3). Im Bereich der Knorpelkappe von Osteochondromen können ebenfalls bei knapp 1 % sekundäre CS auftreten. Das Erkrankungsalter liegt überwiegend in der Mitte der dritten Lebensdekade und damit deutlich unter dem Altersgipfel der konventionellen CS. Bei multiplen kartilaginären Exostosen-Erkrankungen wird ein Entartungsrisiko von 5–25 % beschrieben (15, 16). Seitens des Malignitätsgrades lassen sich die CS auf Boden eines Osteochondroms nahezu ausschließlich Grad-I-CS zuordnen, während auf Enchondromen basierende maligne Tumoren höher gradige Klassifikationen aufweisen können (17, 18). Therapiestrategien bei Chondrosarkomen Besteht bei Verdacht auf ein Chondrosarkom die Indikation zur Biopsie, sollte grundsätzlich eine offene Inzisionsbiopsie erfolgen, um großzügige Gewebeproben aus allen Anteilen des Tumors gewinnen zu können. Nur so ist eine aussagekräftige histopathologische Begutachtung zu erhalten. Entleert sich bei der Inzision des Knorpeltumors muzinöse Flüssigkeit, gilt die Diagnose eines CS als nahezu gesichert. Große Knorpeltumoren mit internen Zysten variabler Größe sprechen ebenfalls mit an Sicherheit grenzender Wahrscheinlichkeit für das Vorliegen eines CS. Eine zu zaghafte Pro- benentnahme, CT-gesteuerte Nadelbiopsien oder reine Stanzbiopsien bergen ein erhebliches Risiko, nicht alle für die histologische Beurteilung entscheidenden Areale zu treffen, wodurch es häufig zur Fehleinschätzung des Malignitätsgrads oder zu einer Verzögerung der Diagnosesicherung kommt. Insbesondere bei den sehr heterogenen dedifferenzierten CS mit ihrem Nebeneinander von großen niedrig- und eher kleinen hochmalignen Arealen kann dies zu fatalen Folgen bezüglich des Ausmaßes der chirurgischen Radikalität führen (씰Abb. 12). Der operative Zugang und die Drainageaustrittsstelle sind bei der Biopsie so zu wählen, dass sie bei der endgültigen Tumorresektion nach onkologischen Gesichtspunkten spindelförmig umschnitten und auf dem Resektat belassen werden. Zellzahl, Atypiegrad und myxoide Anteile nehmen, ebenso wie das Auftreten von spindeligen Tumorzellen und Verschwimmen der lobulären Struktur, mit steigender Malignität zu (6). Anhand dieser histopathologischen Kriterien erfolgt die Einteilung der klassischen CS in 3 Malignitätsgrade, die nach derzeitiger Datenlage entscheidend für die Prognose ist. Während Grad-1-CS praktisch nur zu Rezidiven neigen, metastasieren G2– und G3-CS in bis zu 20 % bzw. 50 %, dann häufig pulmonal (19). Leider ist die Beurteilung des Malignitätsgrads von CS wie bei fast jeder Tumorentität sehr subjektiv und schwer zu reproduzieren. Überwiegend ist das CS ein Low-grade-Tumor, dessen Problematik sich aus der hohen Rezidivrate aber nicht aus der Metastasierung ergibt (20). Da die Prädilektionsstellen entlang des Achsenskeletts liegen (씰Abb. 1), ist © Schattauer 2009 Osteologie 3/2009 Downloaded from www.osteologie-journal.de on 2017-08-20 | IP: 88.99.70.242 For personal or educational use only. No other uses without permission. All rights reserved. 197 198 M. Tonak; A. A. Kurth: Chondrogene Knochentumoren die vollständige chirurgische Entfernung oft schwierig und die Patienten können aufgrund der lokal persistierenden Tumorerkrankung versterben. Daraus ergibt sich die eigentliche Schwierigkeit bei der Behandlung von Low-gradeChondrosarkomen – die richtige Balance zwischen ausreichender Radikalität der Tumorresektion und kleinstmöglicher Zerstörung der befallenen Strukturen zum Erhalt größtmöglicher Funktionalität zu finden. In ausgewählten Fällen ist daher die intraläsionale Ausräumung oder marginale Resektion mit einem erheblichen Funktionsvorteil zu rechtfertigen. Der entstehende Knochendefekt wird dann mit Poly-methylmethacrylat (PMMA)-Zement aufgefüllt. Bei den postoperativen Kontrollen kontrastiert sich ein Rezidiv gegen den röntgendichten Knochenzement gut und kann frühzeitig erkannt werden. Im Rezidivfall ist bei langer Anamnese und geringer Ausbreitung des Tumors häufig eine erneute Kürettage oder marginale Resektion zulässig. Destruiert ein Tumorrezidiv den Knochen in großem Ausmaß kann sekundär auch bei Grad I-CS die weite Segmentresektion mit endoprothetischer Versorgung oder in Einzelfällen sogar die Amputation unausweichlich sein. Nach aktueller Studienlage nimmt die Radikalität der chirurgischen Therapie bei Lowgrade CS keinen statistisch signifikanten Einfluss auf die Metastasierungs- und Überlebensrate (21, 22). Allerdings weisen die Grenzzonenresektion und intraläsionale Ausräumung ein höheres Risiko für ein erneutes Tumorwachstum auf. In einer retrospektiven Analyse bildeten sich bei CS des Beckens nach intraläsionaler Tumorresektion in 100% der Fälle Lokalrezidive aus, während nach Tumorentfernung in weiten Grenzen bei keinem Patient ein erneutes Tumorwachstum beobachtet werden konnte. Unter diesen Gesichtspunkten gilt es für das GradI-CS des Beckens den Kompromiss zwischen Auftreten des Rezidivs und Funktionserhalt besonders kritisch zu prüfen. Hinsichtlich der hohen Lokalrezidivrate von CS sollten regelmäßige klinische und radiologische Verlaufskontrollen über einen Zeitraum von mindestens 5 Jahren erfolgen. Die Therapie der High-grade-CS (GII-IV) besteht in der Entfernung mittels Segmentresektion in weiten Grenzen. Unter extremitätenerhaltenden Gesichtspunkten erfolgt die Rekonstruktion der Knochendefekte mittels Tumorendoprothesen (씰Abb. 13). Die Wiederherstellung der Knochenkontinuität durch einen gefäßgestielten Fibula-Autograft oder Allograft kann bei diaphysärer Lage des CS erfolgen. Bei Infiltration der Gefäß-Nerven-Bündel durch die Tumorweichteil-Komponente oder exorbitanten Tumorausmaßen (씰Abb. 10) ist unter kurativem Ansatz eine weite Tumor-Resektion nur durch Amputation zu erreichen. Dabei sind teilweise stark entstellende und mit maximalen Funktionsverlusten behaftete Verfahren wie die externe Hemipelvektomie oder die interthorakoskapuläre OberarmAmputation notwendig. Eine präoperative Tumormassen-Reduktion ist auf Grund des Fehlens effektiver Therapieoptionen wie z. B. der neoadjuvanten Chemotherapie nicht möglich. Äquivalent konnte bisher in keiner Studie für die adjuvante Chemotherapie, die bei den High-grade-CS Anwendung findet, ein signifikanter Überlebensvorteil nachgewiesen werden. (23). Ausnahmen weisen die Behandlungen von dedifferenzierten CS nach dem COSS-Protokoll und mesenchymaler CS nach dem CESS-Protokoll mit niedrigsignifikanten Effekten auf, vermutlich aufgrund ihrer histologischen Parallelen zum Osteo- bzw. Ewing-Sarkom. Neue Folsäureantagonisten wie Pemetrexed werden ebenso wie die Kombination von Gemcitabin und Doctaxel bei Patienten mit CS evaluiert. So genannte small-molecular inihibitors wie Dasatinib und monoklonale Antikörper wie Apomab, ein TRAIL-Rezeptor-Agonist, sind zum Eintritt in klinische Studien startbereit. Für Perifosin, einen Modulator der Membranpermeabilität, werden aktuell die Phase-II-Ergebnisse bei chemotherapieresistenten Tumoren inklusive CS erwartet (27). In kleineren Studien konnte lediglich bei seltenen Manifestationen im Bereich der Wirbelsäule oder des Schädels durch eine Bestrahlung mit Photonen- und Schwerionen eine ausreichende Lokalkontrolle des Chondrosarkoms erzielt werden (24). Ansätze mit konventioneller γ-Strahlung können bei palliativer Intention zur Kontrolle des lokalen Tumorwachstums versucht werden, versagen jedoch bei kurativem Therapieziel (25). Neue Therapieansätze mit dem in der Osteoporose-Therapie erfolgreich angewandten Bisphosphonat Alendronat erbrachten bei In-vitro-Experimenten vielversprechende Ergebnisse (26). Ob mit Alendronat tatsächlich ein signifikanter Behandlungserfolg erzielt werden kann, muss zunächst am Tiermodell und in klinischen Studien evaluiert werden. Die Verfügbarkeit geeigneter Tiermodelle, die relativ geringe Inzidenz und der lange Krankheitsverlauf lassen eine zeitnahe Weiterentwicklung neuer Chemotherapeutika jedoch schwierig erscheinen. Bei Patienten mit fortgeschrittenem Krankheitstadium sollte daher die Integration in klinische multizentrische Studien wie Euro-BOSS in jedem Fall überlegt werden. Grundsätzlich sollten alle auffälligen chondrogenen Tumoren zu einer Beurteilung in einem spezialisierten Knochentumorzentrum vorgestellt werden. Interessenkonflikt Der korrespondierende Autor gibt an, dass kein Interessenkonflikt besteht. Literatur 1. Winkelmann W. Tumoren und tumorähnliche Erkrankungen. Stuttgart: Georg Thieme 2005. 2. Unni KK. Cartilaginous lesions of bone. Journal of Orthopaedic Science 2001; 6: 457–472. 3. Schwartz HS ZN et al. The malignant potential of enchondromatosis. J Bone Joint Surg Am 1987; 69: 269–274. 4. Freyschmidt J OH, Jundt G. Knochentumoren. 2nd ed. Berlin Heidelberg New York Tokyo: Springer 2003. 5. Rodgers WB MH. Metastatic malignant chondroblastoma. Am J Orthop 1996; 25: 845–849. 6. Unni KK IC, Bridge JA. Tumors of the bones and joints. Washington ARP and AFIP 2005. 7. Erlemann R. Benigne Knorpeltumoren. Der Radiologe 2001; 41: 548–559. 8. Bjornsson J MR et al. Primary chondrosarcoma of long bones and limb girdles. Cancer 1998; 83: 2105–2119. 9. Geirnaerdt MJA et al. Maligne Knorpeltumoren. Der Radiologe 1998; 38: 502–508. 10. Brien EW MJ, Kerr R. Benign and malignant cartilage tumors of bone and joint: their anatomic and theoretical basis with an emphasis on radiology, pathology and clinical biology. I. The intramedullary cartilage tumors. Skeletal Radiol 1997; 26: 325–353. 11. Milchgrub S HP. Dedifferentiated chondrosarcoma. In: Fletcher CDM, Unni KK, Mertens F (eds) WHO: Pathology and genetics of tumours of the soft tissue and bone. Lyon: IARC Press 2002. 12. Bjornsson J UK et al. Clear cell chondrosarcoma of bone. Observations in 47 cases. Am J Surg Pathol 1984; 8: 223–230. 13. Delling G, Jobke B, Burisch S, Werner M. Knorpelbildende Tumoren. Der Orthopäde 2005; 34: 1267–1282. Osteologie 3/2009 © Schattauer 2009 Downloaded from www.osteologie-journal.de on 2017-08-20 | IP: 88.99.70.242 For personal or educational use only. No other uses without permission. All rights reserved. M. Tonak; A. A. Kurth: Chondrogene Knochentumoren 14. Yasuaki N et al. Mesenchymal chondrosarcoma of bone and soft tissue. A review of 111 cases. Cancer 1986; 57: 2444–2453. 15. Canella P GF, Boriani S. Exostosis: development, evolution and relationship to malignant degeneration. Ital J Orthop Traumatol 1981; 7: 293–298. 16. Garrison RC UK et al. Chondrosarcoma arising in osteochondroma. Cancer 1982; 49: 1890–1897. 17. Ahmed Ar Fau et al. Secondary chondrosarcoma in osteochondroma: report of 107 patients. Clin Orthop Relat Res 2003; 411: 193–206. 18. Liu J HP, Swee RG, Unni KK. Bone sarcomas associated with Ollier’s disease. Cancer 1987; 79: 1376–1385. 19. Campanacci M. Bone and soft tissue tumors. Berlin Heidelberg New York Tokio Springer 1988. 20. Rizzo M GM, Harrelson JM, Scully SP. Chondrosarcoma of bone: analysis of 108 cases and evaluation for predictors of outcome. Clin Orthop Relat Res 2001; 391: 224–232. 21. Streitbürger A et al. Grade I chondrosarcoma of bone: the Münster experience. Journal of Cancer Research and Clinical Oncology 2009; 135: 543–550. 22. Puri A et al. Chondrosarcoma of bone: Does the size of the tumor, the presence of a pathologic fracture, or prior intervention have an impact on local control and survival? Journal of Cancer Research and Therapeutics. 2009; 5: 14–19. 23. Dickey ID RP et al. Dedifferentiated chondrosarcoma: the role of chemotherapy with updated outcomes. J Bone Joint Surg Am 2004; 86-A: 2412–2418. 24. Noel G HJ et al. Combination of photon and proton radiation therapy for chordomas and chondrosarcomas of the skull base: the Centre de Protontherapie DOrsay experience. Int J Radiat Oncol Biol Phys 2001; 51: 392–398. 25. Soderstrom M ET et al. No improvement in the overall survival of 194 patients with chondrosarcoma in Finland in 1971–1990. Acta Orthop Scand 2003; 74: 344–350. 26. Susa M et al. Alendronate Inhibits Growth of Highgrade Chondrosarcoma Cells. Anticancer Research 2009; 29: 1879–1888. 27. Verfügbar auf: http://www.clinicaltrials.gov/ct2/re sults?term=chondrosarcoma. zugänglich seit Januar 2009. © Schattauer 2009 Osteologie 3/2009 Downloaded from www.osteologie-journal.de on 2017-08-20 | IP: 88.99.70.242 For personal or educational use only. No other uses without permission. All rights reserved. 199